Method Article
人THP-1巨噬细胞通过核转高效转染
摘要
这个协议提出通过电穿孔转染人THP-1巨噬细胞中的siRNA或质粒DNA具有高转染效率,同时保持高的细胞活力和分化和极化全细胞巨噬细胞的能力的有效和可靠的方法。
摘要
巨噬细胞,如先天免疫反应的关键角色,因为研究涉及组织稳态或各种病症的焦点。转染siRNA和质粒DNA是研究其功能的有效工具,但巨噬细胞的转染是不是一件小事。虽然可用许多不同的方法对真核细胞的转染,只允许少数巨噬细胞的可靠,高效的转染,但降低细胞活力和喜欢经常观察分化或极化能力减弱严重改变细胞的行为。因此,转染的协议要求,其能够传送siRNA和质粒DNA为巨噬细胞,而不会引起严重副作用从而允许的siRNA的中的正常细胞行为的背景效果或质粒调查。这里介绍的协议提供了一种用于可靠且高效地转染人THP-1巨噬细胞和莫nocytes具有较高的细胞活力,转染效率高,而且对细胞行为的影响最小。这种方法是基于核转和协议进行了优化,以维持染后细胞活化的最大能力。该协议是适当的分离以及细胞悬浮液后的贴壁细胞,并且可用于小至中等样品编号。因此,提出的方法是在巨噬细胞分化和极化研究基因调控的影响非常有用。除了呈现结果表征巨噬细胞,根据该协议相比,替代化学法转染,细胞培养基的选择对转染细胞的行为后产生的影响进行了讨论。所呈现的数据表明验证对不同的实验设置中的选择的重要性。
引言
其中人类免疫系统的细胞成分,巨噬细胞是在先天免疫应答非常重要的。他们的任务是多种多样的;他们都参与了病原体和坏死物质的吞噬作用,它们在组织稳态的重要作用,产生和分泌大量的细胞因子,调节和协调免疫反应1。因此,巨噬细胞被整体参与许多生理过程和病理生理条件。由于其任务的多样性,巨噬细胞是一个非常庞杂的和多方面的细胞类型。这是通过不同的极化来实现;根据外界刺激的巨噬细胞可发展成不同的表型2。巨噬细胞"的变异和影响免疫反应使他们成为一个非常有趣的研究课题。为了阐明自己的复杂的代谢和监管职能,适当的巨噬细胞在体外模型REQuired的正确反映巨噬细胞的异质性和多变性。
细胞的质粒DNA载体或小干扰RNA(siRNA),以改变细胞的基因表达的转染已成为细胞生物学一种广泛使用的和强大的工具,用于研究两种基因调控和基因功能。目前有多种选择可用于真核细胞的转染不同的工具。这些工具包括病毒载体,机械方法(如基因枪等),化学方法(这依赖于聚合物或脂质可形 成配合物的核酸)的电池单元3的应用,和电穿孔。所有这些方法都有各自的优点和缺点,并选择最适合于从该宽阵列以特定的细胞类型和应用程序可以是一个困难且耗时的过程。
巨噬细胞是出了名的难转染的几乎所有成熟的transfection方法大幅减少巨噬细胞"活力或干扰他们的行为, 也就是差异化,尤其是两极分化。因此,我们在座的高效,无病毒的协议转染使用电为主Nucleofector技术,它代表了一个优化的电穿孔的方法,需要的DNA量减少人THP-1巨噬细胞。核转染是非常适用于敏感的细胞如单核细胞和巨噬细胞。该协议是此前公布的4.5版本的改编。
简言之,佛波醇12 - 肉豆蔻酸酯13 - 乙酸酯(PMA)是用来区分人THP-1单核细胞48小时进入早产的巨噬细胞在转染前用siRNA或质粒DNA。用于转染的预分化的巨噬细胞是由的Accutase I治疗酶分离。用Nucleofector 2b的装置,所述细胞的电穿孔进行转染。转染后不同entiation继续另外24至48小时的要求。最后,成熟的转染的巨噬细胞孵育不同种类的功能性研究的化合物。
这种方法允许对细胞系如人THP-1单核细胞和巨噬细胞的转染,并已在过去的6-10得到成功应用。相反,大部分的化学转染方法,我们使用过早噬改性核转过程,产生在与未损伤的细胞活力组合高转染效率,而不需要使用病毒载体或具有未知的副作用进一步增加载体化合物。此外,巨噬细胞保持它们的全部潜力分化以及偏振从而允许不受阻碍功能研究转染后11。
此外,核转之后所施加的细胞培养基强烈影响的功能性研究以下TRANsfection;特别是,在巨噬细胞的能力为极化可以根据所应用的培养基上受到影响。这里四种不同类型的细胞培养基(IMDM,X-VIVO 20,LGM3和小鼠T细胞Nucleofector介质)失活的条件下使用白细胞介素进行了测试(IL)10。使用THP-1巨噬细胞中,我们观察到细胞响应于IL10是当小鼠T细胞Nucleofector介质被用在比较上面提到的其它培养基最强。这些结果表明,所有的细胞培养条件相应的优化对于成功的转染UND其后的功能研究必不可少的,因为这些可能会显著改善实验结果。
作为巨噬细胞参与多种人类疾病,许多研究集中在阐明巨噬细胞的行为以及影响巨噬细胞或反过来由巨噬细胞控制的调控机制。因此,该协议是相关的许多不同的研究领域。
研究方案
1 Predifferentiation THP-1巨噬细胞
- 培育THP-1细胞中,在CO 2补充有10%(V / V)胎牛血清(FCS)和1%(体积/体积)青霉素/链霉素/ L-谷氨酰胺(PSG)的RPMI-1640培养基(5% )培养箱中37℃。
- 转染前,拆分单元格,并像以前一样将它们传输到新鲜RPMI培养基。培养细胞24小时。
- 种子1.0-1.5×10 7细胞成75平方厘米组织培养瓶或2.5×10 7细胞转变成一个150平方厘米的组织培养烧瓶中的RPMI-1640培养基中,并添加10%(V / V)FCS,1%(体积/ v)的PSG,1%(体积/体积),丙酮酸钠,1%(体积/体积)非必需氨基酸,10毫微克/毫升的PMA,和50μM的β-巯基乙醇的48小时。
2,准备核转的
- 放置的Accutase我和一切媒体入水浴在37℃。
- 从瓶中吸出培养基,并更换用6毫升(75平方厘米瓶)或12毫升(150平方厘米瓶)的的Accutase I和孵育30分钟,在37℃下电池完全脱离。观察的Accutase I治疗后的细胞形态,以确保电池有一个圆形的外观。如果某些细胞似乎仍然被扣押,仔细冲洗瓶用微量或轻轻拍打它来完成脱离。不要使用细胞刮刀,因为这会对细胞的活力产生负面影响。转移细胞悬液至15ml管中。
- 期间的Accutase I治疗,准备以下媒体:
- 制备转染培养基:补充细胞培养基中含有1%(体积/体积),PSG,1%(体积/体积)的非必需氨基酸,1%(体积/体积),丙酮酸钠和5%(体积/体积)人血清(用于siRNA)或20%(体积/体积)人血清(质粒DNA);制备要么为3ml /样品的最终体积为1 6孔板或4毫升/样品为2个12孔板中。
- 制备培养基:补充培养基中含有1%(体积/体积),PSG,1%(体积/体积)的非必需氨基酸,1%(体积/体积),丙酮酸钠和5%(体积/体积),胡人血清(用于siRNA)或20%(体积/体积)人血清(质粒),2.5纳克/毫升的PMA,和50μM的β-巯基乙醇;制备要么为3ml /样品的最终体积为1 6孔板或4毫升/样品为2个12孔板中。
- 离心细胞悬浮液5分钟,在300 XG在室温下。
- 吸的Accutase I和悬浮细胞在1毫升RPMI培养基预热至37℃的;计数细胞,以确定细胞数量。
请注意:当快速自动细胞计数程序时,步骤2.4和2.5可以省略,且细胞可被计数后立即脱离提供了长期暴露于的Accutase予避免。 - 对每个转染样品在含有2.0-2.5×10 6个细胞的离心管中制备等分试样。
3,核转THP-1巨噬细胞
- 离心机的所有等分试样在250 XG在室温下10分钟。
- 稀释质粒DNA或siRNA在无核酸酶水或适当的缓冲液中。保持质粒DNA或siRNA的所需体积尽可能地小。
- 准备一张Nucleofector比色皿是1微克质粒DNA的每个转染的siRNA或0.5微克。
- 在每次执行一个转染。吸出上清液细胞等分。
- 重新悬浮沉淀的细胞在Nucleofector溶液,得到的100μl的DNA / siRNA和Nucleofector溶液的总体积。保持接触的时间,以纯净Nucleofector溶液减至最少,并确保曝光时间不超过15分钟。
- 通过轻敲混合在Nucleofector反应杯重悬的细胞和DNA / siRNA的。
- 转染细胞在Nucleofector 2B设备中执行的程序的Y 001。
- 转染的细胞为使用一次性塑料巴斯德吸液管的反应瓶中。
- 立即加入500μl准备转染介质。
- 重复步骤3.4至3.9为每个转染样品。
4。后核转护理
- 制备任6孔或12孔板的转染细胞。吸管2.5毫升转染培养基到6孔板的各孔中(1以及/转染)或1.75毫升转染培养基成12孔板的每个孔(2孔/转染)。
- 充分混匀细胞悬液用微量。
- 转染细胞到准备好的孔中(无论是一个阱中在12孔板中在6孔板或两个)。
- 培养板4小时,在湿润的培养箱(5%CO 2,37℃)。
- 检查电池的复位显微镜。
注:大部分细胞要再次附着。偶尔,由1小时延长潜伏期增加的情况下复位不足的粘附细胞的数量。 - 小心吸染介质微量并更换培养基等量。吸只有一个很好的时间。
- 孵育细胞所需的时间为质粒或siRNA(24-72小时)的最大效应。如果培养时间超过48小时,48小时后更换培养基。
- 用于与效应物额外处理( 例如 ,细胞因子,激动剂,拮抗剂和抑制剂),使用无血清培养基中无PMA和β-巯基乙醇。时间带的质粒或siRNA的最大作用的时间效应的孵育期结束时,计划中,加入效应的相应的变化。不要保持无血清条件下细胞的时间超过24小时。
结果
使用这种协议的THP-1巨噬细胞中的siRNA,我们通常达到90%以上的转染率不显著降低细胞活力的转染, 图1示出了有代表性的数据24小时转染荧光标记的siRNA与一个未转染后表征所述细胞的状态控制,这些都没有治疗核转试剂和脉冲或siRNA,但收到的培养基作为转染样品的所有更改。在图1A中的细胞形态,根据流式细胞仪测量所示。显微图像示于图1B图1C和1D表示的低速率凋亡(对照:1.5%;核转:5.4%)。和坏死(对照:2.0%;核转:3.2%),指示未受影响细胞的活力。坏死和凋亡是用于转染的样品略高作为转染的THP-1巨噬细胞中有更多的难以分离比未转染的细胞中,细胞损伤从而在脱离的概率增大。最后转染效率示于图1E中 。作为整个染人口偏移相对于对照,这表明它是由荧光显微镜图像( 图2B)确认所有的细胞被转染。既流式细胞数据以及荧光显微图像表明,所有的细胞都始终如一地用siRNA转染的细胞内的细胞间,以及均匀分布。这是与许多化学转染试剂,用于比较图2A和2B示出了各自的流式细胞术数据和荧光显微图像,使用的脂质为基础的方法的化学转染试剂。这些数字表明,可以检测转染细胞的两种不同的人群。第一群是类似于转染的细胞follo翼核转。它们的特征是低的总荧光和siRNA的细胞内均匀分布。第二个群体的特点是更强烈的荧光起源于siRNA的非常明亮的细胞团块。细胞形态不受影响两种转染方法如由在图2C微分干涉对比。有效地利用质粒DNA的产量相似的结果转染中,对于实施例请参阅Robenek 等人(2009)9或解等人(2006)7。
转染后的细胞培养基的选择是有很大的相关性;因此,不同的细胞培养基进行了比较试验。所选择的媒体都适合栽培的THP-1细胞,并根据龙沙作为用于后核转栽培适用介质建议被选择, 图3表示的siRNA mediat使用针对IL10RB(白介素10受体β链)的mRNA为siRNA敲除编辑效率。对于所有测试介质IL10RB的表达显著降低到约10%至20%的对照水平( 图3)。然而,转染的细胞不同,取决于它们的潜力偏振的培养基上。将THP-1巨噬细胞转染了两种非特异性对照siRNA或IL10RB特异性siRNA培养于不同媒体转染后,用IL10治疗。对IL10-诱导的基因SOCS3(抑制细胞因子信号3)在mRNA水平上的随后的表达水平通过RT-qPCR的测量。培养介质之间的差别发生在关于SOCS3 mRNA表达的诱导的程度( 图4),该导入装置对于每个被测试的介质小鼠T细胞Nucleofector培养基,LGM3,X-VIVO 20和IMDM分别为19.5 [17.7-21.5 ],11.5 [8.5-15.7],8.0 [4.6-14.2] 7.2 [5.6-9.5]倍。该在小鼠T细胞Nucleofector介质refore应用是至关重要的。此外,在IL10RB的敲低对SOCS3表达IL10处理后的效果差异观察到的,SOCS3 mRNA的表达水平降低到9.5 [8.8-10.3]折叠在小鼠T细胞Nucleofector介质,2.1 [1.1-4.1]折在LGM3,4.8 [3.2-7.2]倍的X-VIVO 20和3.3 [2.7-3.9]倍IMDM。这些值对应于SOCS3的表达在不同的媒体减少到49%,18%,60%和45%。还原IL10RB的siRNA转染后的IL-10诱导SOCS3表达的证实IL10RB,由转染的成功下调。
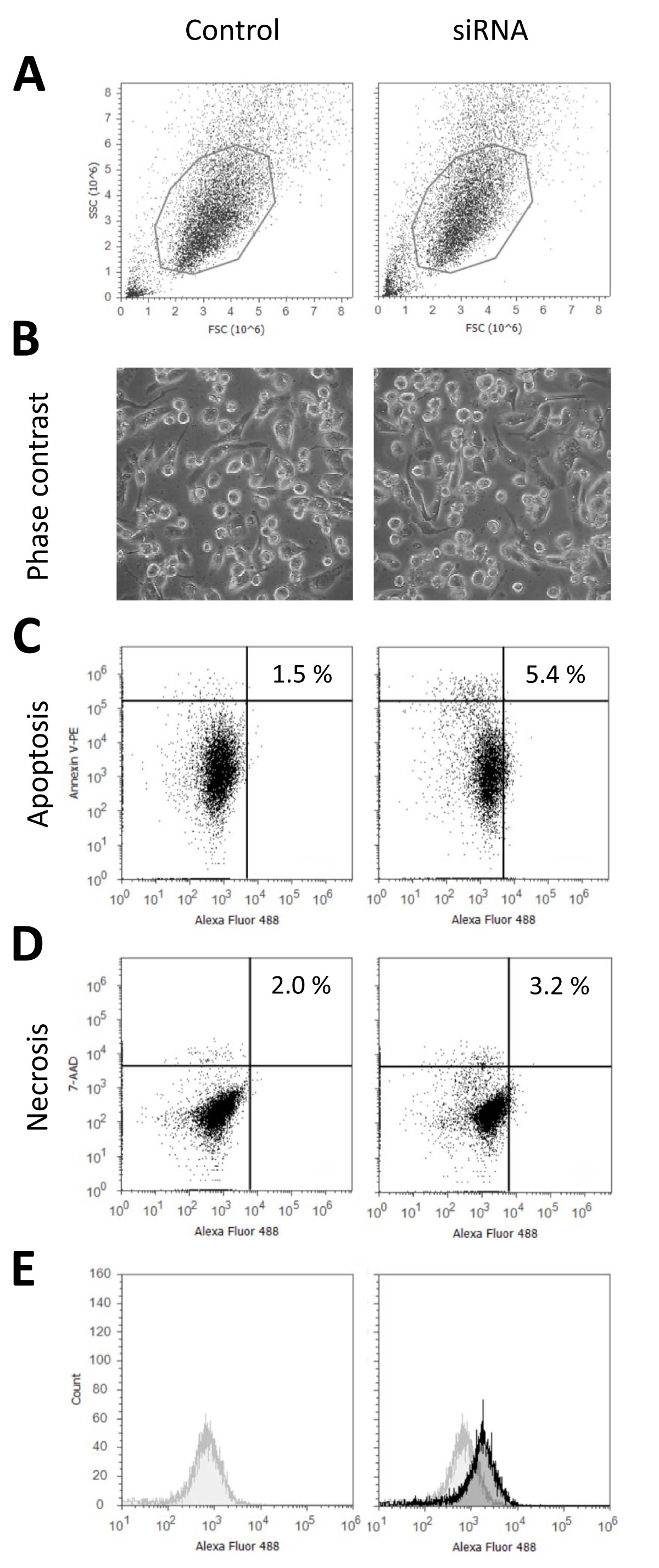
转染的THP-1巨噬细胞中的图1表征。细胞的特征的状态是未受影响的所揭示的光学显微镜和流式细胞仪的未转染的联合分析ntrol细胞与THP-1巨噬细胞中,根据所提出的协议转染。将THP-1巨噬细胞分化为10纳克/毫升的PMA 48小时和转染了荧光标记(Alexa的488)的非特异性对照siRNA。转染后24小时,或者活细胞的拍摄图像(B)中 ,或在细胞中的Accutase予治疗被分离并通过流式细胞仪(A)进行分析。使用膜联蛋白V-藻红蛋白(PE)(C)和7 -氨基放线菌素(7-AAD),(D)进行的细胞凋亡和坏死染色。转染效率(E),通过流式细胞术使用连接到所述siRNA荧光标记来确定。转染的细胞(黑色)的荧光信号显示对控制信号(灰色)。 请点击这里查看该图的放大版本。

图的siRNA核转后的细胞内分布与脂质体的2比较。THP-1细胞中,根据本协议分化48小时,然后或者通过核转或通过脂质体转染转染。所呈现的脂质体转染的结果,根据制造商的建议使用的试剂为4的siRNA电荷比使用Xtremegene siRNA的试剂盒得到的:1。转染细胞24小时后进行分离或者用的Accutase I对于流式细胞仪分析或活细胞显微镜进行评估。 (A) 的转染效率和每个细胞的siRNA的分布范围内的人口,通过流式细胞术使用连接到所述siRNA荧光标记来确定,转染siRNA的无控制以灰色显示,用siRNA转染的样品显示为黑色。 (B)的荧光显微镜图像显示荧光标记的siRNA(的Alexa Fluor 488)在细胞内的分布;比例尺条为40微米。 (C)对应于所述的荧光图像微分干涉相衬图像;比例尺代表40微米。 请点击这里查看该图的放大版本。
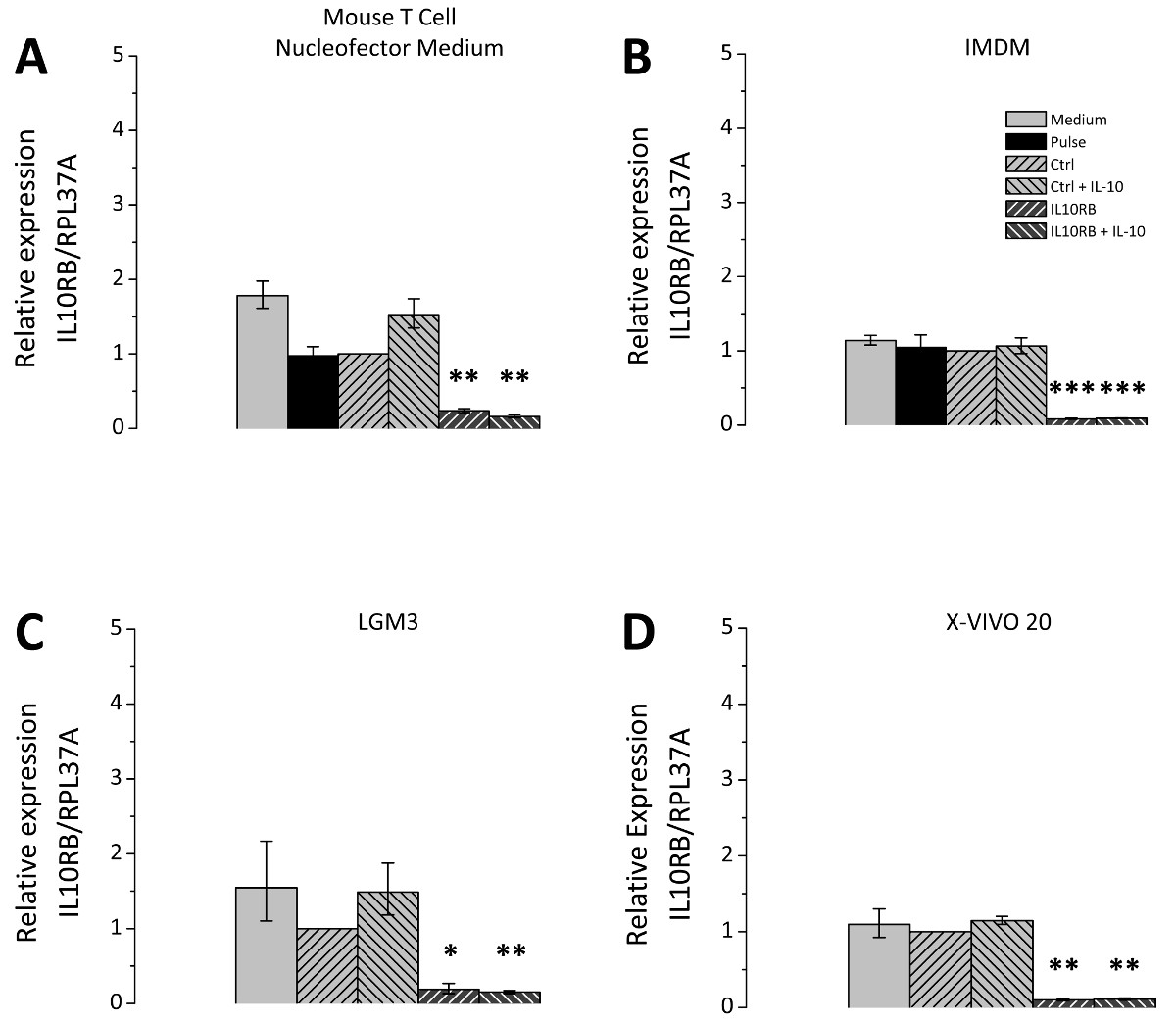
在转染的THP-1巨噬细胞中图3的siRNA介导的IL10RB击倒。THP-1巨噬细胞,根据概述的协议转染。转染后,将细胞培养于四个不同的培养基,即小鼠T细胞Nucleofector介质(A),IMDM(B)LGM3(C),和X-VIVO 20(D)中,添加作为在协议部分中描述。 çELLS要么被转染非特异性对照siRNA(CTRL)或IL10RB特异性siRNA(IL10RB)。作为额外的控制下的样品包括:脉冲控制, 即得。细胞在不存在的siRNA(脉冲),以及一个介质控制, 即进行转染。细胞接受文化传媒只将更改,但仍然以其他方式治疗。 24小时转染后的细胞在无血清培养基中具有或不具有50毫微克/毫升的IL10对另外24小时。 IL10RB表达,用RT-qPCR的检测;图显示三次独立实验的平均值,误差棒代表平均值的标准误差; * P <0.05; ** P <0.01; *** P <0.001与Ctrl键。 请点击这里查看该图的放大版本。
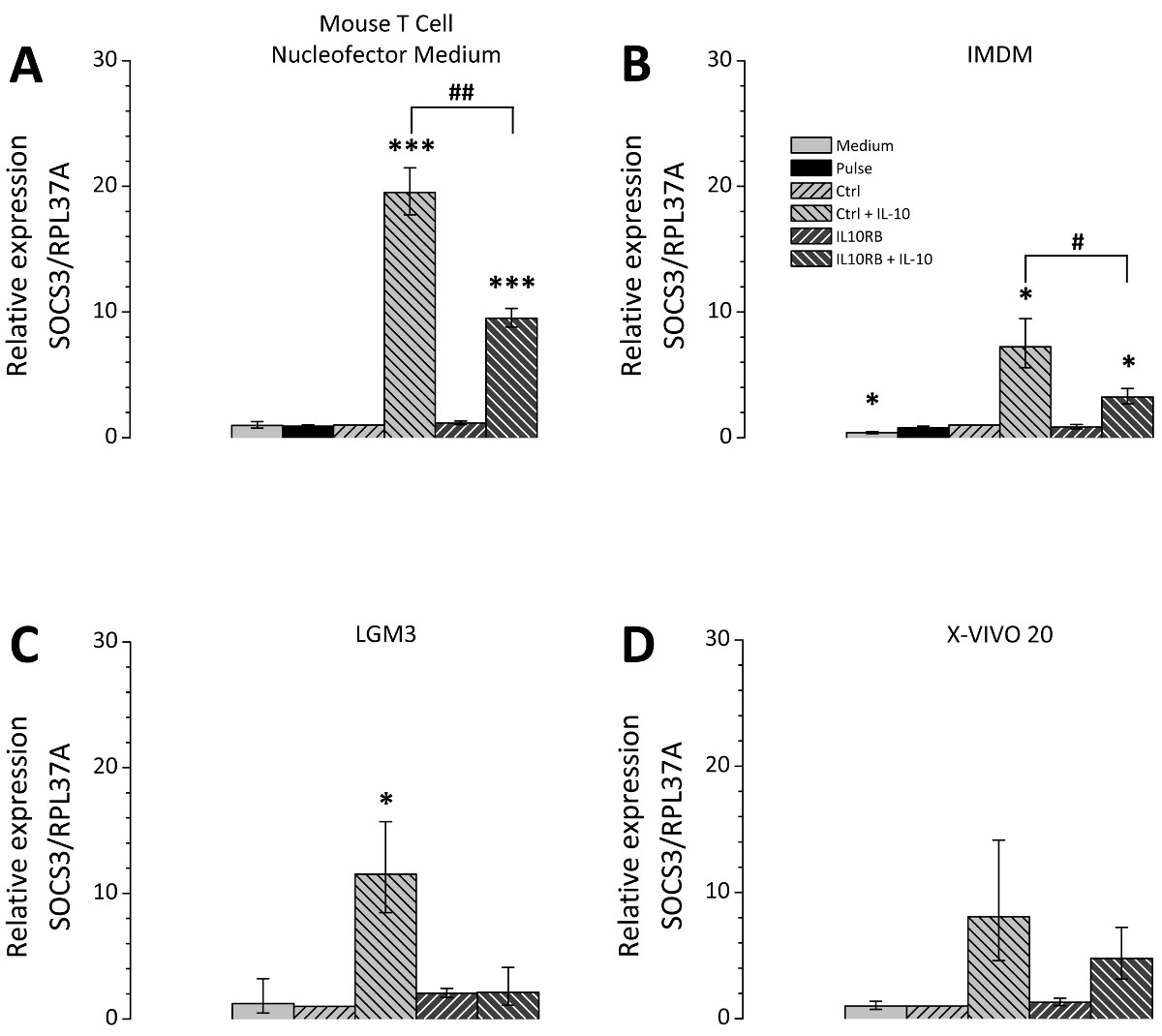
图4 IL10依赖性SOCS3调控IL10RB在转染的THP-1巨噬细胞中敲低后,THP-1巨噬细胞,根据所描述的协议转染。转染后,将细胞培养于四种不同培养基小鼠T细胞Nucleofector介质(A),IMDM(B)使用的协议部分中所述,LGM3(C)和X-VIVO 20(D)的补充。细胞,或者转染的非特异性对照siRNA(CTRL)或IL10RB特异性siRNA(IL10RB)。作为额外的控制下的样品包括:脉冲控制,这在没有siNRA(脉冲)进行转染,即细胞和培养基对照, 即得。细胞接受文化传媒只将更改,但仍然以其他方式治疗。 24小时转染后的细胞在无血清培养基中具有或不具有50毫微克/毫升的IL10对另外24小时。 SOCS3 expre裂变,通过RT-qPCR的检测;图显示三次独立实验的平均值,误差棒代表平均值的标准误差; *,#P <0.05; **,##,P <0.01; ***,### P <0.001与Ctrl键并与按Ctrl + IL-10。 请点击这里查看该图的放大版本。
讨论
这里列出的协议提供了一个可靠和有效的方式转染的THP-1巨噬细胞,大多数是比较难转染。转染可以使用的90%以上用于siRNA转染效率不显著降低细胞活力来实现。效率为质粒可能会少由于约70%的大小,但转染效率通常可以达到。的siRNA介导的敲除的效率可以依赖于所施加的siRNA达到80〜90%。此协议的一个主要优点是,它不与细胞分化干扰。转染后的细胞仍然正常响应分化剂PMA( 图1A到图1B和图4)12。在细胞因子的刺激,如IL10和LPS除了细胞极化/IFNγ不受影响12,虽然这也很大程度上取决于染后选定的栽培介质上š 如图4所示。
还有,可以以适应该协议的具体要求进行修改的过程中的几个选项。如示于图4的单元有不同的反应到相同的IL10刺激取决于染后选择的培养基上。这表示介质的组合物对细胞行为强烈的影响。如由介质施加的可能不同的各种实验的刺激的效果,这可能是最佳的介质可能会发生变化,因此,有必要以验证用于独立地不同实验的介质的适用性。然而在RPMI-1640培养基,其是用于培养的THP-1细胞中的默认介质,已经被证明为观察细胞活力显著损失是不适合用于培养转染后。此外,该协议也可以被应用到的THP-1单核细胞没有事先PMA诱导分化此,明显地消除了操作过程中需要进行细胞剥离,但所有剩余的步骤不必进行调整。如果所需的THP-1单核细胞可事后区分。
该协议的最关键要素是:第一支队,第二需要转的时间。该部队必须尽量轻柔执行,以维持高的细胞存活率。因此,我们建议在比较温和的酶支队的Accutaseí过相当积极的方法,如胰蛋白酶消化。进一步分离方法,如用利多卡因或刮处理被发现是相当不利的,不应该被使用。在该情况下的Accutase予处理30分钟不应当足以分离所有细胞正常这通常是过多的冻融循环的正确存储或过期的Accutase余溶液或指示。我们已经通过存储的Accutase I的小分装置于-20°获得好成绩C到减少冻融循环的次数。然而,当有足够的分离或者更换的Accutase我和新鲜的Accutase或增加保温时间长达1小时。除了轻轻敲击或漂洗烧瓶或板可协助脱离。对于用于转染所需的时间的单元的曝光时间,以纯净Nucleofector解决方案已经得到了对细胞存活的高冲击,因此应尽可能地短。实现这一目标的最好办法是在同一时间(步骤2.10至2.15),而不是并行的多个转染执行每转。
如果拦截效率是低的,这通常不是由低转染效率所致,但这是可以很容易地验证使用流式细胞仪或荧光显微镜和荧光标记的siRNA或GFP编码质粒。大多的原因是低效率的siRNA或质粒DNA。在这些情况下,应考虑到增加的siRNA的量(高达2-3微克)或质粒DNA(高达1-2微克)或(如果可用)来使用不同的siRNA或者表达载体。备选地,令人满意的结果也可能通过使用针对相同的靶几个不同的siRNA池实现。此外,时间过程实验,可能需要精确地确定的最大的效果,这之后在转染后24至72小时,通常达到周期。
除了转染通过电穿孔有进一步完善的技术,用于哺乳动物细胞的转染。经常应用的系统可以形成配合物的货物核酸,然后方便运输到细胞内的化学转染试剂。最常用的试剂,或者根据不同的脂质种类或可从许多阳离子聚合物3的选择。对于这两种方法多元化的选择市售。这些转染试剂提供,它们通常是优点容易使用,不需要太多的时间,并与贴壁细胞的工作,以及,因此去除的必要性脱离。不幸的是,巨噬细胞是相当困难的,这些方法转染,因为它们不体外显著增殖并具有针对外来细胞质DNA 13-15防御机制。因此,化学转染方法经常导致严重降低细胞活力。然而, 如图2有化学转染试剂,可以成功传输的siRNA为巨噬细胞,但是作为流式细胞术( 图2A)和荧光显微镜( 图2B)的分析表明它们不能达到的siRNA的细胞内的相同的均匀分布通过核转得。事实上,在流式细胞仪的数据表明,转染细胞的两种不同的人群发生,首先在具有类似的荧光作为Nucleofecti后的细胞群上检测到,其次还有更强烈的荧光人口。仍需要一定的确认,但是我们假设第一群是在荧光显微镜等同于那些细胞显示出荧光的siRNA的胞质溶胶内的均匀分布,而第二人口可能对应于该细胞具有非常明亮的附聚物。在图2A所示的流式细胞仪的数据表明,核转染的结果中每个细胞的siRNA比替代脂质体转染的方法少。然而在图3中的数据表明,即使通过核转掺入较少量的siRNA已经足以与靶基因的80至90%击倒。因此,siRNA对由化学转染后第二次人口掺入额外量很可能过剩,因而更容易引起不希望的副作用比进一步增加拦截效率。除了这形成的细胞内团块已经是不希望的本身,因为这些siRNA分子很可能无法正常运作,或至少比游离siRNA分子效率低,并且可能会导致脱靶效应。此外,这些结块的本色,目前尚不清楚。这是可能的,这些亮点代表内涵体,表明siRNA的细胞所内化,但随后释放从内涵体失败和siRNA的保持俘获,因此是无效的。可选地,点可以是其在细胞内形成凝聚体。化学转染的官能评价是未决的,因此就抑制效率没有明确的陈述可以还提出,还是两个不同群体的存在已经不利,因为这意味着,所有的结果描述了两个群体的平均值,这并因此不符合种群之一。出于这个原因核转是优越的方法。
不过也有局限性,这里列出的转染程序。由于细胞要能在悬浮液中的核转粘附细胞需要被分离时,其提供了一个额外的压力因子的细胞。此外,整个协议是相当耗时的。因为转染不能同时进行的,但必须以避免细胞损伤迅速地进行,样品的数量被限制为大约8 - 10%的实验。因此,该协议不适合于高通量筛选的项目。对于高吞吐量的应用程序不同的Nucleofector系统可供选择。首先,有4D-Nucleofector系统,提供了一个16孔条格式。对于更大的通过量,有96孔穿梭系统和384以及HT Nucleofector系统。然而,由于这些新系统的导电聚合物电极代替铝,因此电气条件, 即计划和工作。复合的Nucleofector溶液银行足球比赛,也相应地改变,它需要如果我们的协议可以被转移到那些系统来确定。
然而,尽管有这些限制的协议提出这里没有得到THP-1细胞的可靠和有效的转染,优于所有其它非病毒方法。该协议允许在改变的基因表达的THP-1细胞,在所有其他方面分化和分化正常,从而表明转染尽可能少副作用的影响进行调查。
披露声明
此视频文章出版费用由龙沙集团有限公司主办
致谢
我们非常感谢龙沙集团有限公司赞助这次出版物涵盖了出版费用。我们感谢德国Infarktforschungshilfe,威廉 - 威能,基金会,欧内斯特 - 苏威,基金会和图林根的ministerium献给教化,Wissenschaft UND Kultur的向SL的资金支持。
材料
| Name | Company | Catalog Number | Comments |
| Accutase I | Sigma-Aldrich | A6964 | |
| Amino acids, nonessential | PAA | M11-003 | |
| Centrifuge tubes (15 ml) | TPP | TPP91015 | |
| Fetal calf serum (FCS gold) | PAA | A15-151 | |
| Human Monocyte Nucleofector Kit | Lonza | VPA-1007 | Contains Nucleofector Solution, cuvettes, and Pasteur pipettes |
| Human serum off the clot | Lonza | C11-020 | |
| Isove's Modified Dulbecco's Medium (IMDM) with 25 mM HEPES and 25 mM L-glutamine | Lonza | 12-722F | |
| Lymphocyte Growth Medium 3 (LGM3) | Lonza | CC-3211 | |
| Mouse T Cell Nucleofector Medium | Lonza | VZB-1001 | |
| Nucleofector 2b | Lonza | AAD-1001 | |
| Penicillin / streptomycin / L-glutamine (100x) | Sigma-Aldrich | G1146 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685 | |
| Roswell Park Memorial Institute 1640 Medium (RPMI 1640) | PAA | E15-840 | |
| siRNA / plasmid | |||
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636 | |
| THP-1 human leukemia monocytes | CLS | 300356 | |
| Tissue culture flasks (75 cm²; 150 cm²) | TPP | TPP90076/TPP90151 | |
| Tissue culture plates (6-well; 12-well) | TPP | TPP92406/TPP92012 | |
| Tubes (1.5 ml) | StarLab | S 1615-5500 | |
| Water (nuclease-free) or appropriate siRNA/plasmid buffer | |||
| X-Vivo 20 with gentamycin | Lonza | BE04-448Q | |
| β-Mercaptoethanol | Sigma-Aldrich | M3148 |
参考文献
- Ricardo, S. D., van Goor, H., Eddy, A. A. Macrophage diversity in renal injury and repair. J Clin Invest. 118 (11), 3522-3530 (2008).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Morille, M., Passirani, C., Vonarbourg, A., Clavreul, A., Benoit, J. P. Progress in developing cationic vectors for non-viral systemic gene therapy against cancer. Biomaterials. (24-25), 3477-3496 (2008).
- Schnoor, M., et al. Efficient non-viral transfection of THP-1 cells. J Immunol Methods. 344 (2), 109-115 (2009).
- Maeß, M. B., Buers, I., Robenek, H., Lorkowski, S. Improved protocol for efficient nonviral transfection of premature THP-1 macrophages. Cold Spring Harb Protoc. 2011 (5), (2011).
- Ma, W., Liu, Y., Ellison, N., Shen, J. Induction of C-X-C chemokine receptor type 7 (CXCR7) switches stromal cell-derived factor-1 (SDF-1) signaling and phagocytic activity in macrophages linked to atherosclerosis. J Biol Chem. 288 (22), 15481-15494 (2013).
- Xie, Q., et al. Cell surface localization of ABCG1 does not require LXR activation. Arterioscler Thromb Vasc Biol. 26 (11), 143-144 (2006).
- Buers, I., Robenek, H., Lorkowski, S., Nitschke, Y., Severs, N. J., Hofnagel, O. TIP47, a lipid cargo protein involved in macrophage triglyceride metabolism. Arterioscler Thromb Vasc Biol. 29 (5), 767-773 (2009).
- Robenek, H., Buers, I., Hofnagel, O., Lorkowski, S., Severs, N. J. GFP-tagged proteins visualized by freeze-fracture immuno-electron microscopy: A new tool in cellular and molecular medicine. J Cell Mol Med. 13 (7), 1381-1390 (2009).
- Guh, J. H., et al. Development of novel adenosine monophosphate-activated protein kinase activators. J Med Chem. 53 (6), 2552-2561 (2010).
- Park, E. K., Jung, H. S., Yang, H. I., Yoo, M. C., Kim, C., Kim, K. S. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Maeß, M. B., Wittig, B., Cignarella, A., Lorkowski, S. Reduced PMA enhances the responsiveness of transfected THP-1 macrophages to polarizing stimuli. J Immunol Methods. 402 (1-2), 76-81 (2014).
- Angosto, D., et al. Evolution of inflammasome functions in vertebrates: Inflammasome and caspase-1 trigger fish macrophage cell death but are dispensable for the processing of IL-1b. Innate Immun. 18 (6), 815-824 (2012).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nat Rev Immunol. 13 (6), 397-411 (2013).
- Muruve, D. A., et al. The inflammasome recognizes cytosolic microbial and host DNA and triggers an innate immune response. Nature. 452 (7183), 103-107 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。