Method Article
Nucleofection에 의해 인간의 THP-1 대 식세포의 고효율 형질
요약
이 프로토콜은 높은 세포 활력과 분화 및 편광에 대한 완전한 식세포 용량을 유지하면서 높은 형질 전환 효율로 전기 천공에 의해 또는 siRNA의 플라스미드 DNA와 함께 인간 대 식세포 THP-1을 형질 효율적이고 신뢰할 수있는 방법을 제시한다.
초록
대식 세포는 선천성 면역 반응의 키 선수로서, 조직 항상성 또는 다양한 병리 다루는 연구의 초점에있다. siRNA의 플라스미드 DNA와 형질이 그 기능을 연구하기위한 효율적인 도구이지만, 대식 세포의 형질 전환은 사소한 문제가 아니다. 진핵 세포의 형질 전환을위한 여러 가지 방법을 사용할 수 있지만, 단지 몇 대 식세포의 안정적이고 효율적인 형질 전환하지만, 감소 된 세포의 활력과 자주 관찰된다 분화 또는 편파 저하 기능 등을 심각하게 변형 된 세포의 행동을 할 수 있습니다. 따라서 형질 감염 프로토콜 따라서 정상 셀 동작의 맥락에서의 siRNA의 효과 나 플라스미드의 조사를 허용하는 심각한 부작용을 유발하지 않고 대 식세포로의 siRNA 및 플라스미드 DNA를 전사 할 수있는 것이 요구된다. 여기에 제시된 프로토콜은 신뢰성 있고 효율적으로 THP-1 인간 대 식세포 및 MO를 형질 전환하는 방법을 제공한다높은 세포 활력, 높은 형질 전환 효율 및 셀 동작에 최소한의 효과 nocytes. 이러한 접근 방식에 기반 Nucleofection 및 프로토콜 후에 형질 세포 활성화의 최대 능력을 유지하기 위해 최적화되었다. 프로토콜은 현탁액의 박리뿐만 아니라 세포 후 부착 세포에 적합한 지, 그리고 매체 샘플 번호를 작게 사용할 수있다. 따라서, 제시된 방법은 대식 세포의 분화와 편광 동안 유전자 규제 효과를 조사하는 데 유용합니다. 이 외에 다른 화학적 방법에 비해 본 프로토콜에 따라 형질 감염 대 식세포를 특징 화 결과를 제시에서, 셀 동작에 형질 감염 후 세포 배양 배지의 선택에 미치는 영향에 대해서도 설명한다. 제시된 데이터는 다른 실험 설정에 대한 선택의 유효성을 검사의 중요성을 나타냅니다.
서문
인간의 면역 체계의 세포 성분 중, 대 식세포는 선천성 면역 반응에 대한 매우 중요합니다. 그들의 작업은 다양하다; 그들이 병원균 및 괴사 물질의 식균 작용에 관여하는, 그들은 조직 항상성에 중요한 역할을하고 조절하고 면역 반응 한 사이토 카인을 조율하는 다수의 생산 및 분비한다. 따라서 대 식세포는 일체 생리 학적 과정과 병태 생리 학적 조건에서 참여하고 있습니다. 그들의 작업의 다양성, 식세포는 매우 이질적인 다방면 세포 유형이다. 이것은 상이한 편파에 의하여 달성된다; 외부 자극의 대 식세포에 따라 서로 다른 표현형이로 발전 할 수 있습니다. 면역 반응에 대 식세포 '변화와 영향은 그들을 매우 흥미로운 연구 주제합니다. 시험 관내 모델에서 복잡한 대사 조절 기능과, 해당 식세포를 명료하게하기 위해서이다 REQuired 제대로 대식 세포의 이질성과 다양성을 반영한다.
세포 유전자 발현을 변화시키기 위해 플라스미드 DNA 벡터 또는 작은 방해 RNA들 (siRNA가)와 셀의 형질 유전자 조절 및 유전자 기능을 모두 조사하는 세포 생물학에서 널리 사용되는 강력한 도구가되었다. 현재 진핵 세포의 형질 전환에 사용할 다른 도구의 큰 선택이있다. 이러한 도구는 셀 3의 바이러스 벡터 (예 : 유전자 총)을 기계적 방법 (핵산과 복합체를 형성 할 수있는 중합체 또는 지질에 의존하는) 화학 접근 방식의 응용 프로그램 및 전기 천공 법 (electroporation)을 포함한다. 이들 접근법들은 모두 장점과 단점을 가지고 특정 세포 유형 및 애플리케이션이 광범위한부터 최적 선택은 어렵고 시간 소모적 인 프로세스 일 수있다.
대 식세포는 거의 모든 잘 확립 transfe 형질하기 어렵기로 악명이 있습니다ction의 접근 방식이 크게 식세포 '가능성을 감소 시키거나 그들의 행동, 즉 차별화 특히 양극화를 방해합니다. 따라서, 우리는 여기에 DNA의 양의 감소를 요구하는 최적화 된 전기 천공 방법을 나타내는 일렉트로 Nucleofector 기반 기술을 사용하여 THP-1 인간 대 식세포를 트랜 효율적인 비 바이러스 프로토콜을 제시한다. Nucleofection는 단핵 세포와 대 식세포와 같은 민감한 세포에 적합합니다. 이 프로토콜은 이전에 게시 된 버전 4.5의 적응이다.
요컨대, 포르 볼 12 - 미리 스테이트 13 - 아세테이트 (PMA)는 종래의 siRNA 또는 플라스미드 DNA와 형질 시기상조 식세포로 48 시간 동안 인간 단핵구 THP-1을 구별하는 데 사용된다. 형질 전환을 위해 predifferentiated 대 식세포는 Accutase I 처리에 의해 효소 분리된다. 형질 감염은 세포의 전기 천공을 위해 Nucleofector 2B의 장치를 사용하여 수행된다. 형질 전환 한 후, 다른필요에 따라 entiation 다른 24-48 시간 동안 계속된다. 마지막으로, 성숙한 형질 식세포 작용의 연구를위한 화합물의 종류와 함께 배양된다.
이 방법은 인체 THP-1 단핵구 및 대 식세포와 같은 세포주의 형질 감염이 가능하며 성공적으로 과거 6-10에 적용되었다. 대부분의 화학적 형질 전환 방법과 대조적으로, 조기 식세포를 사용하여 변형 된 Nucleofection 과정은 바이러스 벡터를 이용하거나 미지의 부작용 상기 담체 화합물을 추가 할 필요없이, 손상되지 않은 세포 생존율과 함께 높은 형질 전환 효율을 산출한다. 또한, 대 식세포, 따라서 형질 11 다음 방해받지 기능적 연구를 허용 그들의 완전한 분화에 대한 가능성뿐만 아니라 편광을 유지한다.
또한, Nucleofection 후에 적용 세포 배양 배지를 강하게 작용 연구보기 다음 트란 영향sfection; 특히, 대 식세포 편파 '용량은인가 배지에 따라 영향을받을 수있다. 세포 배양 배지의 다음 네 가지 유형 (IMDM는, X-VIVO 20 LGM3 및 마우스 T 세포 Nucleofector 매체) 인터루킨를 사용하여 비활성화 조건 하에서 시험 하였다 (IL) (10)는 THP-1 대 식세포를 사용하여, 우리는 IL10에 세포 반응성이 관찰 마우스 T 세포 Nucleofector 매체가 상술 한 다른 배지와 비교하여 사용되는 경우 강한. 이러한 결과는 이들 실험 결과를 현저하게 향상시킬 수 있으므로 모든 세포 배양 조건의 최적화는 적당한 성공적인 형질 싶게 후속 기능적 연구에 필수적임을 증명한다.
대 식세포는 다양한 인간 질병에 관여하는 바와 같이, 많은 연구가 대 식세포의 행동뿐만 아니라 대 식세포에 의해 제어 식세포 또는 차례로 영향을 미치는 규정하는 메커니즘을 해명에 초점을 맞추고 있습니다. 따라서,이 프로토콜에 관련이있다많은 다른 연구 분야.
프로토콜
THP-1 대 식세포의 1 Predifferentiation
- CO 2에서 10 % (v / v) 소 태아 혈청 (FCS), 1 % (v / v) 페니실린 / 스트렙토 마이신 / L-글루타민 (PSG)이 보충 된 RPMI-1640 배지에서 THP-1 세포를 배양 (5 % 37 ° C에서) 인큐베이터.
- 형질 전환하기 전에 세포를 분리하고 이전과 같이 신선한 RPMI 매체로 전송. 24 시간 동안 세포를 배양.
- 종자 1.0 ~ 1.5 × 10 75 cm² 조직 배양 플라스크에 넣고 7 세포 또는 2.5 × 10 7 RPMI-1640 배지에서 150 cm² 조직 배양 플라스크에 넣고 세포와 10 % (v / v)로 FCS, 1 % (V / 추가 48 시간 동안 V) PSG, 1 % (v / v)로 피루브산 나트륨, 1 % (v / v)로 비 필수 아미노산, 10 NG / ml의 PMA, 50 μM의 β-머 캅토 에탄올.
Nucleofection의 2 준비
- 37 ° C에서 물을 욕조에 Accutase I와 모든 미디어를 놓습니다.
- 술병에서 기음 문화 매체는 6 ㎖ (75 cm² 플라스크) 또는 12 ㎖ (150 cm² 플라스크)의 교체Accutase I 및 세포의 완전 분리를 위해 37 ° C에서 30 분 동안 배양한다. 세포가 둥근 모양을 가지고 있는지 확인하기 위해 Accutase I 처리 후 세포 형태를 관찰한다. 일부 세포가 여전히 연결 것으로 나타나면주의 깊게 마이크로 피펫 플라스크를 씻어 또는 부드럽게 분리를 완료하기를 누릅니다. 이 세포 활력에 부정적인 영향을 미칠 것으로, 세포 스크레이퍼를 사용하지 마십시오. 15 ML 튜브에 세포 현탁액을 전송합니다.
- Accutase I 처리하는 동안 다음 미디어를 준비 :
- 형질 감염 배지를 준비 : 보충 세포 배양 배지를 1 % (v / v) PSG로, 1 % (v / v) 비 필수 아미노산, 1 % (v / v) 피루브산 나트륨, 5 % (v / v) 인간 혈청 (플라스미드 DNA에 대한) 인간 혈청 (siRNA의 경우) 또는 20 % (v / v)로; 이 12 - 웰 플레이트에 대해 하나의 6 웰 플레이트 또는 4 ㎖ / 샘플 중 3 ㎖ / 샘플의 최종 볼륨을 준비합니다.
- 배양 배지를 준비 : 보충 배지를 1 % (v / v) PSG로, 1 % (v / v) 비 필수 아미노산, 1 % (v / v) 피루브산 나트륨, 5 % (v / v) 주석은남자 (siRNA를위한) 혈청 또는 20 % (플라스미드) (v / v)로 인간 혈청, 2.5 NG / ml의 PMA, 50 μM β-머 캅토 에탄올; 이 12 - 웰 플레이트에 대해 하나의 6 웰 플레이트 또는 4 ㎖ / 샘플 중 3 ㎖ / 샘플의 최종 볼륨을 준비합니다.
- 실온에서 300 XG에서 5 분 동안 원심 분리 세포 현탁액.
- RPMI 매체 37 ° C로 예열 1 ㎖에 기음 Accutase I 및 재현 탁 세포; 세포 수를 결정하는 세포를 카운트.
NOTE : 빠른 자동 셀 카운팅 절차를 사용하는 경우, 2.4 및 2.5 단계가 생략 될 수 있으며, 세포가 박리 Accutase I 장기간 노출되는 것을 피할 제공된 직후에 계산 될 수있다. - 각 형질 샘플의 경우 2.0 ~ 2.5 × 10 6 세포를 포함하는 원심 분리기 튜브에 분주을 준비합니다.
THP-1 대 식세포의 3 Nucleofection
- 원심 분리기 상온에서 250 XG에 10 분 동안 모든 분취.
- 클리 프리의 플라스미드 DNA 나 siRNA를 희석물이나 적절한 버퍼입니다. 가능한 한 작게 플라스미드 DNA 나 siRNA를 필요한 볼륨을 유지하십시오.
- 각 형질에 대한 플라스미드 DNA의 한 siRNA를 ㎍의 0.5 μg 중 하나의 Nucleofector의 베트를 준비합니다.
- 한 번에 하나의 형질 전환을 수행합니다. 세포 나누어에서 대기음 뜨는.
- DNA / 된 siRNA 및 Nucleofector 용액 100 ㎕의 총 부피를 수득 Nucleofector 용액 펠렛 세포를 재현 탁. 최소한으로 순수한 Nucleofector 용액에 노출되는 시간을 유지하고 15 분을 초과하지 않는 노광 시간을 보장한다.
- 부드럽게 눌러 Nucleofector 큐벳에 재현 탁 세포와 DNA / siRNA를 혼합.
- Nucleofector의 2B 장치에 프로그램을 Y-001를 수행하여 형질 세포.
- 회용 플라스틱 파스퇴르 피펫을 사용하여, 반응 바이알에 형질 감염된 세포를 옮긴다.
- 즉시 준비 형질 매체의 500 μl를 추가합니다.
- 반복 3.4 각 형질 샘플 3.9 단계를.
사보기. 포스트 Nucleofection 케어
- 형질 전환 된 세포를 6 웰 또는 12 웰 플레이트 중 하나를 준비합니다. 피펫 2.5 6 - 웰 플레이트의 각 웰에 형질 감염 배지 (1도 / 형질)의 ML 또는 12 웰 플레이트의 각 웰에 형질 감염 배지 1.75 ㎖ (2 웰 / 형질 감염).
- 마이크로 피펫으로 철저하게 세포 현탁액을 섞는다.
- 준비된 우물에 형질 세포 이동 (둘 중 하나 아니라 12 웰 플레이트에서 6 웰 플레이트 또는 두에).
- 가습 인큐베이터 (5 % CO 2, 37 ° C에서)에서 4 시간 동안 번호판을 품어.
- 현미경으로 세포의 재 부착을 확인합니다.
참고 : 세포의 대부분은 다시 부착해야한다. 때때로, 1 시간으로 잠복기를 연장하는 것은 불충분 재 부착시에 부착 세포의 수를 증가시킨다. - 조심스럽게 마이크로 피펫으로 형질 매체를 대기음 및 재배 매체의 동일한 양으로 교체합니다. 한번에 오직 하나의 잘 대기음. <리> 플라스미드 또는 siRNA를 (24 ~ 72 시간)의 최대 효과를 위해 필요한 기간 동안 세포를 품어. 배양 기간이 48 시간을 초과하는 경우, 48 시간 후 매체를 교체합니다.
- 이펙터와 추가 치료를 위해 (예를 들면., 사이토 카인, 효능 제, 길항제 및 억제제) PMA없이 혈청 배지 및 β-머 캅토 에탄올을 사용합니다. 시간 플라스미드 또는 siRNA의 효과의 최대의 시간 이펙터의 잠복기의 단부와 매체와 그에 첨가 이펙터의 변경을 계획. 이상 24 시간 동안 무 혈청 조건에서 세포를 유지하지 마십시오.
결과
우리가 일반적으로 세포 활력이 크게 감소하지 않고 90 % 이상의 형질 전환 속도를 달성 siRNA를 가진 THP-1 대식 세포의 형질이 프로토콜을 사용. 그림 1은 24 시간 untransfected 대 siRNA를 표시 형광을 가진 형질 전환 후 세포의 상태를 특징 짓는 대표적인 데이터를 표시 Nucleofection 시약으로 처리하고, 펄스 또는 siRNA를하지만 형질 샘플 등 문화 미디어의 모든 변경 사항을 수신하지 않은 제어,. 도 1a에 셀룰러 형태학 유세포 측정에 따라 도시된다. . 현미경 이미지는 그림 1b에 도시도 1C 및 1D는 낮은 세포 사멸에 대한 요금 (제어 : 1.5 %; Nucleofection : 5.4 %) 표현됩니다; 영향을받지 세포의 활력을 나타내는 괴사 (3.2 % 제어 Nucleofection 2.0 %)을. 형질 전환 된 THP-1 식세포가 더 아르으로 괴사 및 세포 사멸은 형질 전환 된 샘플에 대한 약간 높은untransfected 세포 분리가 증가하는 동안 세포 손상의 따라서 확률보다 분리하기가 어렵습니다. 마지막으로 형질 전환 효율은 그림 1E로 표시됩니다. 전체 인구가 형질 제어에 대해 이동됨에 따라, 이는 모든 세포가 형광 현미경 영상 (도 2b)에 의해 확인 된 형질 것을 나타낸다. 모두 모든 세포가 지속적으로 세포들 사이뿐만 아니라 세포 내에서의 siRNA의 균일 한 분포로 형질가되어 있다는 것을 나타내 유세포 데이터뿐만 아니라 형광 현미경 이미지를 흐른다. 이것은 비교도 2a를 들어, 많은 화학 형질 전환 시약 대조적이다 및도 2b는 지질 기반 접근법을 이용하여 화학적 형질 에이전트 각각 유세포 데이터 및 형광 현미경 이미지를 나타낸다. 이 수치는 형질 세포의 두 가지 집단이 검출 될 수 있다는 것을 보여줍니다. 첫째 인구는 FOLLO 형질 세포와 유사하다날개 Nucleofection. 이들은 낮은 전체적인 형광 및 siRNA의 세포 내에서의 균일 한 분포에 의해 특징 지어진다. 두 번째 인구는 siRNA를 매우 밝은 세포 덩어리에서 유래 더 강렬한 형광으로 표시됩니다. 그림 2C 미분 간섭 대비 같이 세포의 형태는 모두 형질 전환 방법에 대한 영향을받지 남아있다. 효율적으로 비슷한 결과를 플라스미드 DNA 수율을 사용하여 형질은 예제 Robenek 외. (2009) 9시에 참조하시기 바랍니다 외. (2006) 7.
형질 감염 후 세포 배양 배지의 선택은 큰 관련성이고; 따라서 다른 세포 배양 배지는 비교 시험 하였다. 선택한 미디어는 모든 THP-1 세포의 배양에 적합하며 포스트 Nucleofection 재배에 적용 매체와 같은 론자의 권장 사항에 따라 선택되었다. 3의 siRNA mediat을 나타내는 그림에드 IL10RB (인터루킨 10 수용체 β 체인)의 mRNA에 대한 감독의 siRNA를 사용하여 효율성을 넉다운. 테스트 된 모든 미디어 IL10RB의 발현은 유의하게 제어 레벨의 10-20 %이다 (도 3)를 감소시켰다. 그러나 형질 감염된 세포에 대한 그들의 분극 전위 배지에 따라 다르다. 불특정 제어의 siRNA 또는 IL10RB 별 하나의 siRNA로 형질 THP-1 대식 세포는 형질 전환 후 다른 미디어에서 재배 및 IL10 처리 하였다. IL10 유도 SOCS3 유전자 mRNA의 수준 (사이토 카인 시그널링의 억제 3)의 후속 발현은 RT-qPCR에 의해 측정 하였다. 배양액의 차이점은 SOCS3 발현의 유도 정도에 관하여 발생 (도 4), 테스트 용지 마우스 T 세포 Nucleofector 중간마다 입회식, LGM3, X-VIVO 20 IMDM이었다 19.5 [17.7-21.5 ], 11.5 [8.5-15.7], 8.0 [4.6-14.2] 7.2 [5.6-9.5] 각각 접습니다.마우스 T 세포 Nucleofector 매체의 refore 응용 프로그램은 매우 중요합니다. 또한, IL10 처리 후의 SOCS3 발현에 IL10RB의 넉다운의 효과의 차이가 관찰되었다, SOCS3의 mRNA 발현 수준이 9.5 [8.8-10.3] 접을 마우스 T 세포 Nucleofector 매체로 감소하고, 2.1 [1.1-4.1] 폴드 LGM3에서 4.8 [3.2-7.2] X-VIVO 20 3.3 [2.7-3.9]에서 배 IMDM에 접습니다. 이러한 값은 각각 49 %, 18 %, 60 %, 45 %로 다른 매체 SOCS3 발현의 감소에 대응한다. IL10RB의 siRNA의 형질 감염 후 IL-10 유도 SOCS3 발현의 감소에 의한 형질 IL10RB 하향 조절의 성공을 확인한다.
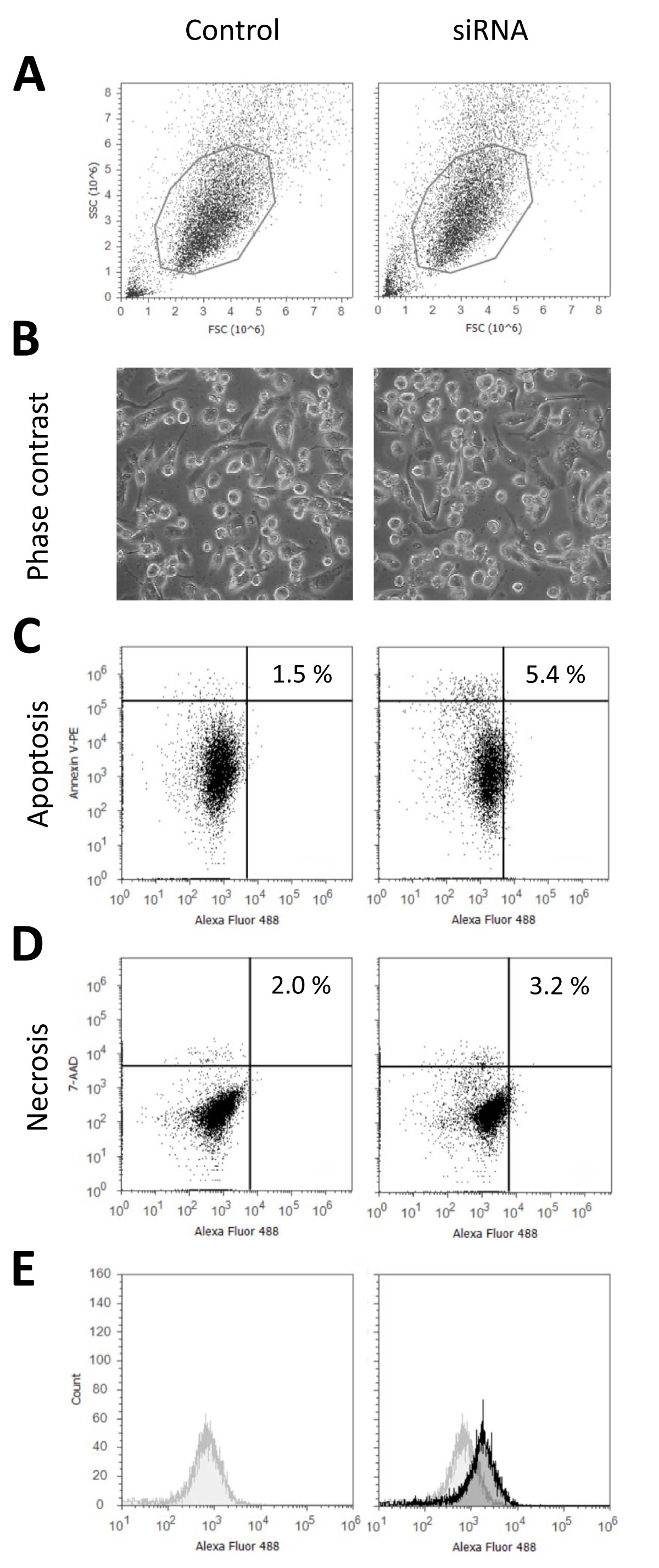
광학 현미경에 의해 밝혀 및 유세포 흐름 untransfected 공동 분석으로 형질 전환 된 THP-1 식세포의 그림 1 특성화. 세포의 특성 상태는 영향을받지 않습니다THP-1 대 식세포 ntrol 세포 제시된 프로토콜에 따라 형질 감염. THP-1 대식 세포는 48 시간 동안 10 NG / ml의 PMA와 차별화 형광 표지 (알렉사 488) 불특정 제어 된 siRNA로 형질되었다. 형질 감염 후 24 시간 중 생균의 영상 (B)을 찍은, 또는 세포 Accutase I 처리에 의해 분리 및 유동 세포 계측법 (A)에 의해 분석 하였다. 아폽토시스 및 괴사 염색 넥신 V-피코 에리 트린 (PE) (C) 및 7-aminoactinomycin (7-AAD) (D)를 사용하여 수행 하였다. 형질 전환 효율 (E)가 부착 된 siRNA 형광 라벨을 이용하여 유동 세포 계측법에 의해 결정 하였다. 형질 세포 (검은 색)의 형광 신호가 제어 신호 (회색)에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 리포 펙 대 Nucleofection 이후의 siRNA의 세포 내 분포의 비교 2. THP-1 세포는이 프로토콜에 따라 48 시간 동안 차별화 된 다음 Nucleofection 또는 리포 펙에 의해 어느 형질 전환 하였다. 리포 펙 제시된 결과는 4 행의 siRNA 시약의 투입 비율과 제조자의 권장 사항에 따라 Xtremegene siRNA의 키트를 사용하여 수득 하였다 : 1. 형질 감염 24 시간 후 세포가 어느 유세포 분석 Accutase I로 분리 또는 생균 현미경으로 평가 하였다. 집단 내 (A) 형질 효율 및 셀당의 siRNA의 분포의 siRNA에 부착 형광 라벨을 이용하여 유동 세포 계측법에 의해 결정 하였다, siRNA의없이 형질 컨트롤이 회색으로 표시되고, siRNA를 형질 샘플은 흑색으로 표시된다. (B) 형광 현미경siRNA를 (알렉사 플 루어 488) 라벨 형광의 세포 내 분포를 나타내는 이미지; 스케일 바는 40 μm의를 나타냅니다. (C)의 형광 화상에 대응하는 차동 간섭 콘트라스트 화상; 스케일 바는 40 μm의를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
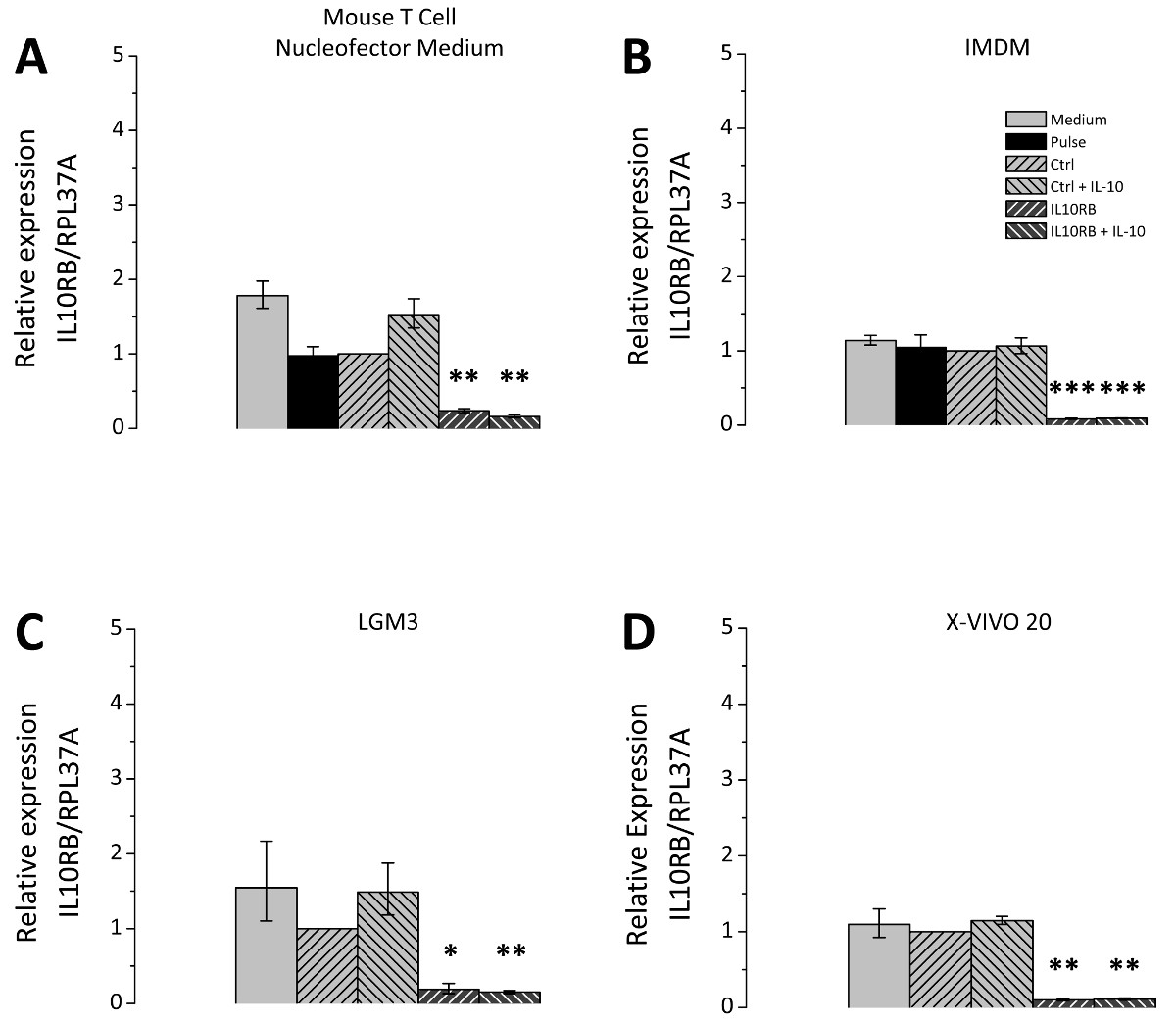
그림 3 형질 THP-1 식세포에 IL10RB의 최저 siRNA를 매개. THP-1 식세포는 설명 된 프로토콜에 따라 형질 전환 하였다. 형질 세포가 네 가지 배양 배지, 즉 마우스 T 세포 Nucleofector 매체 (A), IMDM (B)에서 배양시킨 후 프로토콜 부분에서 설명한 바와 같이, LGM3 (C), 및 X-VIVO 20 (D)는, 보충. CELL 학생은 어느 불특정 제어의 siRNA (Ctrl 키) 또는 IL10RB 고유의 siRNA (IL10RB)로 형질 하였다. 펄스 제어, 즉 다음 샘플이 포함 된 추가 컨트롤로. 즉 siRNA의 (펄스)의 부재, 및 배지 제어에 형질 감염 세포를 받았다. 문화 미디어의 변경 사항 만 받았지만, 그렇지 않으면 치료 남아 세포. 형질 감염 24 시간 후, 세포를 추가로 24 시간이나 50 NG / ㎖ IL10없이 무 혈청 배지에서 배양 하였다. IL10RB 발현은 RT-qPCR에 의해 측정 하였다; 다이어그램은 3 개의 독립적 인 실험의 평균이, 오차 막대는 평균의 표준 오차를 나타내는 표시; * p <0.05; ** P <0.01; *** Ctrl 키를 대 P <0.001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
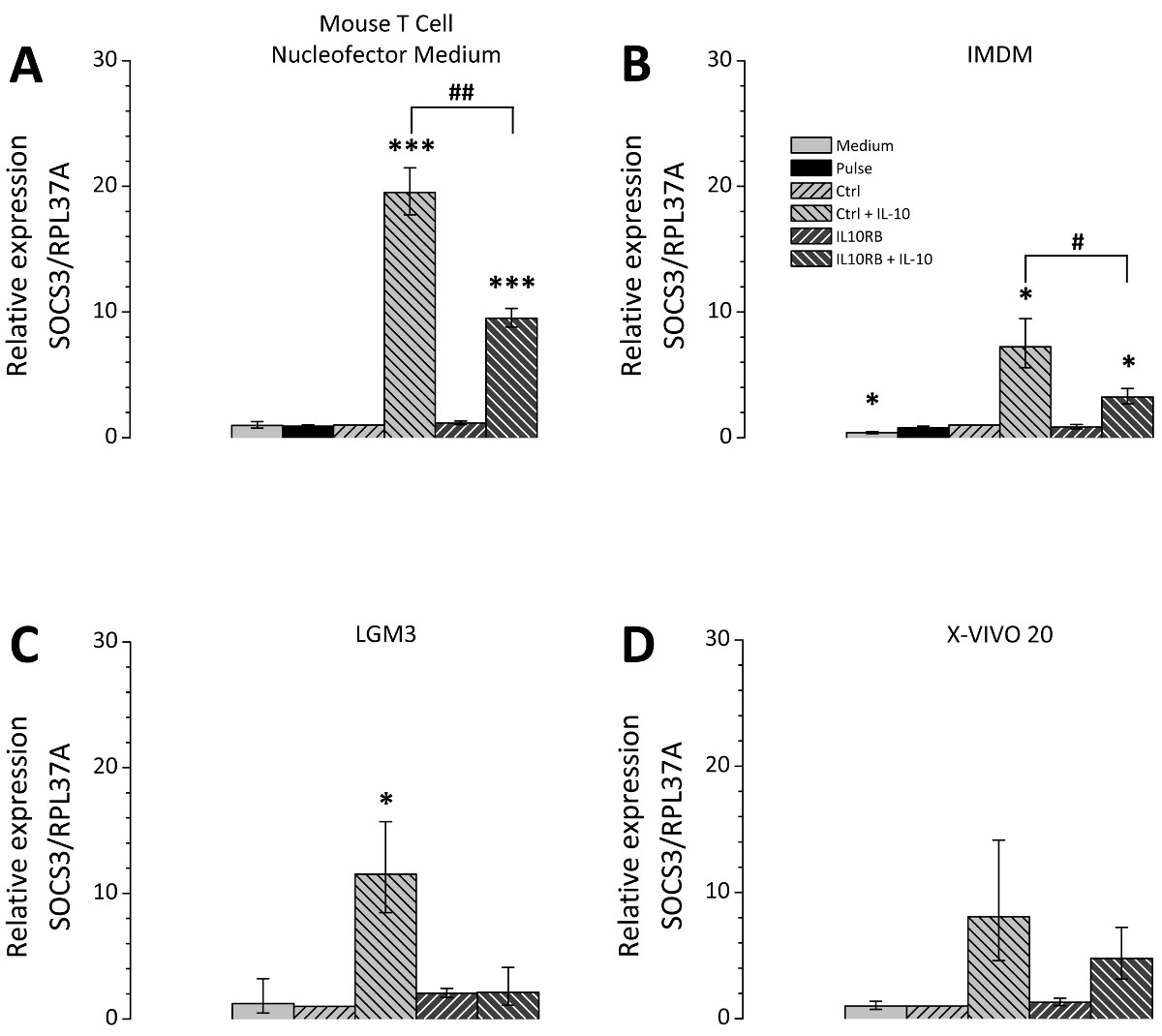
도 THP-1 형질 감염된 대 식세포에서의 최저 IL10RB 후 SOCS3의 4 IL10 의존적 규제. THP-1 식세포 기재된 프로토콜에 따라 형질 감염시켰다. 형질 세포가 네 가지 배지 마우스 T 세포 Nucleofector 매체 (A), IMDM (B)에서 배양시킨 후 프로토콜 부분에서 설명한 바와 같이, LGM3 (C) 및 X-VIVO 20 (D) 첨가. 세포 하나 불특정 제어의 siRNA (Ctrl 키) 또는 IL10RB 고유의 siRNA (IL10RB)로 형질 하였다. 즉 펄스 제어, siNRA (펄스)의 부재하에 형질을 시행 즉 세포 및 배지 제어, 자세한 다음 샘플이 포함 된 컨트롤 등. 문화 미디어의 변경 사항 만 받았지만, 그렇지 않으면 치료 남아 세포. 24 시간 후 형질 전환 세포 또는 추가 24 시간 동안 50 NG / ml의 IL10없이 무 혈청 배지에서 배양 하였다. SOCS3의 expression은 RT-qPCR에 의해 측정 하였다; 다이어그램은 3 개의 독립적 인 실험의 평균이, 오차 막대는 평균의 표준 오차를 나타내는 표시; *, # p <0.05; **, ## p <0.01; ***, ### Ctrl 키를 대 및 대 P <0.001 Ctrl 키 + IL-10, 각각. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명 된 프로토콜은 일반적으로 형질 오히려 어려운 THP-1 대식 세포를 형질은 믿을 수 있고 효율적인 방법을 제공합니다. 형질 세포 활력의 상당한 감소없이 상기 siRNA를위한 90 %의 형질 전환 효율을 달성 할 수있다. 플라스미드에 대한 효율성은 일반적으로 달성 될 수 약 70 %의 크기 그러나 형질 전환 효율 인해 적게 할 수있다. 의 siRNA-매개 된 녹다운의 효율은인가 된 siRNA에 따라 80-90% 도달 할 수있다. 이 프로토콜의 주요한 장점은 세포 분화를 방해하지 않는다는 것이다. 형질 전환 후 세포는 여전히 12 분화 에이전트 PMA (1B 그림 4 그림 1A)에 일반적으로 반응한다. 이것은 또한 형질 전환 후 재배를 위해 선택한 매체에 크게 의존하지만, 이러한 IL10 또는 LPS와 같은 사이토 카인의 자극에 의해 또한 휴대 편광 / IFNγ는 영향을받지 12그림 4 s의.
특정 요구 프로토콜에 적응하기 위해서 변형 될 수있는 절차 내에서 여러 가지 옵션이있다. 도 4에 도시 된 바와 같이 세포를 형질 감염 후 선택한 배지에 따라서 동일한 IL10 자극에 다르게 반응한다. 이 매체 조성물은 세포 행동에 강한 영향이 있음을 나타냅니다. 다양한 자극에 대한 실험 다를 수 매체에 의해 부과되는 효과로서, 최적의 매체가 변경 될 수 있으며, 따라서 서로 다른 독립적 실험 매체의 적합성을 검증 할 필요가 있다고 할 수있다. 그러나 THP-1 세포의 배양에 사용되는 기본 매체 인 RPMI-1640 배지는 세포의 활력에 상당한 손실이 관찰로 형질 전환 한 후 재배에 부적당 한 것으로 입증되었습니다. 또한 프로토콜은 또한 종래 PMA없이 분화 유도 된 THP-1 단핵 세포에 적용 할 수 있으며,이명백하게 절차 중에 세포 분리의 필요성을 제거하지만, 나머지 단계는 조정될 필요가 없다. 필요한 경우, THP-1 단핵구는 나중에 분화 될 수있다.
프로토콜의 가장 중요한 요소는 첫째로 박리 둘째 형질 전환에 필요한 시간이다. 박리는 높은 세포 생존율을 유지하기 위해서는, 가능한 한 조심스럽게 수행되어야한다. 그러므로 우리는 Accutase 나는 이상과 같은 트립신 등 매우 공격적인 방법으로 비교적 온화한 효소 분리하는 것이 좋습니다. 같은 Lidocain 또는 긁어 치료로 더 분리 방법은 오히려 해로운 것으로 밝혀졌다 및 사용할 수 없습니다. Accutase I 처리의 30 분의 모든 세포를 분리하기에 충분하지 않도록 적절히 경우 이것은 보통 잘못 저장되거나 만료 Accutase I 용액 또는 너무 많은 동결 - 해동 사이클의 표시이다. 우리는 -20 °에서 Accutase I의 작은 분량 씩 저장하여 좋은 결과를 얻은C는 동결 - 해동 사이클의 수를 감소시킨다. 불충분 한 분리가 그러나 때 신선한 Accutase와 Accutase I를 교체하거나 1 시간에 배양 시간을 증가 중. 또한 부드러운 도청에서 또는 분리를 지원할 수 플라스크 또는 플레이트의 세척. 형질 전환에 필요한 시간에 대하여 순수한 Nucleofector 용액에 세포의 노출 시간은 가능한 한 짧아야 따라서 세포 생존에 높은 효과를 얻고있다. 이것을 달성하는 가장 좋은 방법은 한 번에 병렬로 (단계 2.10-2.15)가 아닌 여러 형질 각 형질 전환을 수행하는 것입니다.
넉다운 효율이 낮은 경우, 이것은 일반적으로 낮은 형질 전환 효율로 인한 것이 아니라,이 쉽게 유동 세포 계측법 또는 형광 현미경을 이용하여 확인하고 형광 또는 GFP siRNA를 인코딩 플라스미드를 표시 할 수있다. 구름 원인은 비효율적 인 siRNA의 또는 플라스미드 DNA이다. 이러한 상황은 (2-3 μg까지)의 siRNA의 양을 증가시키기 위해 고려되어야하거나플라스미드 DNA (최대 1-2 μg) 또는 사용 가능한 경우 다른 siRNA를 또는 발현 벡터를 사용합니다. 대안 적으로, 만족스러운 결과는 동일한 대상에 대하여 지시 된 siRNA의 여러 풀을 사용함으로써 달성 될 수있다. 또한, 시간 경과 실험은 정확하게 일반적으로 형질 전환 후 24-72 시간 후에 도달 할 때 최대 효과의 기간을 결정해야 할 수도 있습니다.
별개로 형질에서 일렉트로 포유 동물 세포의 형질 전환을위한 잘 확립 기술은 더있다. 자주 적용된 시스템은화물 핵산과 복합체를 형성 한 다음 세포 내로 수송을 용이하게 할 수 화학적 형질 에이전트이다. 가장 흔히 사용되는 시약 중 다른 지질 종을 기반으로 또는 양이온 성 중합체 (3)의 수로부터 선택 될 수있다. 모두가 다양한 선택을 접근을 위해 상업적으로 사용할 수 있습니다. 선택된 형질 전환 시약은 보통 이점을 알려따라서 박리를위한 필요성을 제거하는, 많은 시간을 필요로하며, 또한 부착 세포에서 작동하지 않는 사용하기 쉬운. 불행히도, 대 식세포들은 시험 관내에서 증식 크게 외국 세포질 DNA 13-15 대항 방어 메커니즘을 갖고 있지 않는 한이 방법에 의해 형질 오히려 어렵다. 따라서, 화학 형질 전환 방법은 자주 세포 생존 능력의 심각한 감소를 초래한다. 이 성공적 식세포로의 siRNA를 전송할 수 화학적 형질 에이전트가 있지만 유세포 (도 2A) 및 형광 현미경으로 (도 2b)를 분석하여도 2에 도시 된 그러나 같이 그들이 세포와 같은 내의 siRNA와 같은 균일 한 분포를 달성하는 데 실패 지시 Nucleofection하여 얻을 수 있습니다. 사실, 유세포 데이터는 형질 세포의 두 개의 서로 다른 집단이 발생한다는 Nucleofecti 후 세포와 유사한 형광 우선 인구를 나타낸다에 검출하고, 두 번째로 더 강렬한 형광을 가진 인구가있다. 확실한 확인은 여전히 필요하지만 우리는 첫 번째 인구가 두 번째 인구는 가능성이 매우 밝은 덩어리와 세포에 해당하면서 세포질 내에서 형광의 siRNA의 균일 한 분포를 보여 그 세포와 동일 형광 현미경에 있음을 가정합니다. 도 2a에 도시 유세포 데이터 제시 그 대안 리포 펙 접근법보다 더 적은 셀당의 siRNA에 nucleofection 결과. 그러나도 3의 데이터에 의해 도입 된 siRNA Nucleofection 심지어 비교적 소량 이미 표적 유전자의 80 % 내지 90 % 최저 충분 것을 보여준다. 따라서 화학적 형질 감염 후 제 인구로 인용 된 siRNA의 첨가량은 매우 높다 잉여는 더욱 증가 넉다운 효율보다 바람직하지 않은 부작용을 야기하는 것이 더 쉽다. 그 외에도이들의 siRNA 분자는 가능성이없는 기능 또는 무료의 siRNA 분자보다 적어도 덜 효율적이며 표적 효과를 일으킬 수 있으므로 세포 응집체의 형성이 이미 그 자체로 바람직하지 않다. 또한 이러한 덩어리의 본질은 아직 명확하지 않다. 이들 밝은 반점의 siRNA는 세포에 의해 내면화하지만 엔도 좀이 실패의 siRNA 갇혀 때문에 효과가 남아에서 연속적으로 해제되었음을 나타내는 엔도 좀을 표현하는 것이 가능하다. 또는 반점은 세포 내에서 형성되어 응집 될 수 있습니다. 화학 형질의 기능 평가에 따라서 최저 효율에 결정적인 문은 여전히 별개의 두 집단의 존재는이 모든 결과는 두 집단의 평균을 설명한다는 뜻 이미 불리한 아직 수행 할 수 없습니다, 보류,이 때문에 일치하지 않습니다 어느 집단의. 이러한 이유로 Nucleofection은 뛰어난 접근 방식입니다.
그럼에도 불구하고 또한 여기에서 설명 된 형질 전환 절차에 대한 제한 사항이 있습니다. 세포 Nucleofection 부착 세포는 세포에 추가적인 스트레스 인자를 제공하는, 분리 할 필요에 대한 서스펜션에 있어야하기 때문이다. 또한 전체 프로토콜은 다소 시간이 소요됩니다. 실험 당 10 - 형질 감염을 동시에 수행하지만, 세포의 손상을 방지하기 위해 신속하게 수행 할 필요가 없기 때문에, 샘플의 수는 약 8로 제한된다. 따라서,이 프로토콜은 높은 처리량 스크리닝 프로젝트에 적합하지 않습니다. 처리량이 많은 애플리케이션의 경우 다른 Nucleofector 시스템을 사용할 수 있습니다. 먼저, 16 웰 스트립 포맷을 구비 4D-Nucleofector 시스템이있다. 더 큰 처리량의 경우, 96 웰 셔틀 시스템과 384도 HT Nucleofector 시스템이 있습니다. 이 새로운 시스템은 대신에 알루미늄의 전도성 고분자 전극 따라서 전기 조건, 즉 프로그램과 compos 작업 그러나로Nucleofector 용액 페이지에 계속는, 우리의 프로토콜이 이러한 시스템으로 전송 될 수 있는지 판정 할 필요가 그에 따라 바뀌었다.
그러나, 이러한 제한에도 불구 프로토콜은 모든 다른 비 - 바이러스 성 방법보다 우수 THP-1 세포의 안정적이고 효율적인 형질을 수득 않는 여기를 선보였다. 이 프로토콜은 모든 다른 측면에서 차별화하는 것이 정상적이며, 따라서 가능한 형질 적은 부작용을 보여 편광 THP-1 세포에서 변형 된 유전자 발현의 효과의 조사를 가능하게한다.
공개
이 비디오 기사에 대한 출판 비용은 론자 그룹 유한 회사에 의해 후원
감사의 말
우리는 출판 비용을 포함하여이 책을 후원하기위한 론자 그룹 유한 회사에 감사하고 있습니다. 우리는 SL에 대한 금융 지원을 위해 싶게 Kultur Wissenschaft 도이치 Infarktforschungshilfe, 빌헬름는 Vaillant 재단, 어니스트 - 솔베이 재단하고, 링거 Ministerium 엘리제 Bildung을, 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Accutase I | Sigma-Aldrich | A6964 | |
| Amino acids, nonessential | PAA | M11-003 | |
| Centrifuge tubes (15 ml) | TPP | TPP91015 | |
| Fetal calf serum (FCS gold) | PAA | A15-151 | |
| Human Monocyte Nucleofector Kit | Lonza | VPA-1007 | Contains Nucleofector Solution, cuvettes, and Pasteur pipettes |
| Human serum off the clot | Lonza | C11-020 | |
| Isove's Modified Dulbecco's Medium (IMDM) with 25 mM HEPES and 25 mM L-glutamine | Lonza | 12-722F | |
| Lymphocyte Growth Medium 3 (LGM3) | Lonza | CC-3211 | |
| Mouse T Cell Nucleofector Medium | Lonza | VZB-1001 | |
| Nucleofector 2b | Lonza | AAD-1001 | |
| Penicillin / streptomycin / L-glutamine (100x) | Sigma-Aldrich | G1146 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685 | |
| Roswell Park Memorial Institute 1640 Medium (RPMI 1640) | PAA | E15-840 | |
| siRNA / plasmid | |||
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636 | |
| THP-1 human leukemia monocytes | CLS | 300356 | |
| Tissue culture flasks (75 cm²; 150 cm²) | TPP | TPP90076/TPP90151 | |
| Tissue culture plates (6-well; 12-well) | TPP | TPP92406/TPP92012 | |
| Tubes (1.5 ml) | StarLab | S 1615-5500 | |
| Water (nuclease-free) or appropriate siRNA/plasmid buffer | |||
| X-Vivo 20 with gentamycin | Lonza | BE04-448Q | |
| β-Mercaptoethanol | Sigma-Aldrich | M3148 |
참고문헌
- Ricardo, S. D., van Goor, H., Eddy, A. A. Macrophage diversity in renal injury and repair. J Clin Invest. 118 (11), 3522-3530 (2008).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Morille, M., Passirani, C., Vonarbourg, A., Clavreul, A., Benoit, J. P. Progress in developing cationic vectors for non-viral systemic gene therapy against cancer. Biomaterials. (24-25), 3477-3496 (2008).
- Schnoor, M., et al. Efficient non-viral transfection of THP-1 cells. J Immunol Methods. 344 (2), 109-115 (2009).
- Maeß, M. B., Buers, I., Robenek, H., Lorkowski, S. Improved protocol for efficient nonviral transfection of premature THP-1 macrophages. Cold Spring Harb Protoc. 2011 (5), (2011).
- Ma, W., Liu, Y., Ellison, N., Shen, J. Induction of C-X-C chemokine receptor type 7 (CXCR7) switches stromal cell-derived factor-1 (SDF-1) signaling and phagocytic activity in macrophages linked to atherosclerosis. J Biol Chem. 288 (22), 15481-15494 (2013).
- Xie, Q., et al. Cell surface localization of ABCG1 does not require LXR activation. Arterioscler Thromb Vasc Biol. 26 (11), 143-144 (2006).
- Buers, I., Robenek, H., Lorkowski, S., Nitschke, Y., Severs, N. J., Hofnagel, O. TIP47, a lipid cargo protein involved in macrophage triglyceride metabolism. Arterioscler Thromb Vasc Biol. 29 (5), 767-773 (2009).
- Robenek, H., Buers, I., Hofnagel, O., Lorkowski, S., Severs, N. J. GFP-tagged proteins visualized by freeze-fracture immuno-electron microscopy: A new tool in cellular and molecular medicine. J Cell Mol Med. 13 (7), 1381-1390 (2009).
- Guh, J. H., et al. Development of novel adenosine monophosphate-activated protein kinase activators. J Med Chem. 53 (6), 2552-2561 (2010).
- Park, E. K., Jung, H. S., Yang, H. I., Yoo, M. C., Kim, C., Kim, K. S. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Maeß, M. B., Wittig, B., Cignarella, A., Lorkowski, S. Reduced PMA enhances the responsiveness of transfected THP-1 macrophages to polarizing stimuli. J Immunol Methods. 402 (1-2), 76-81 (2014).
- Angosto, D., et al. Evolution of inflammasome functions in vertebrates: Inflammasome and caspase-1 trigger fish macrophage cell death but are dispensable for the processing of IL-1b. Innate Immun. 18 (6), 815-824 (2012).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nat Rev Immunol. 13 (6), 397-411 (2013).
- Muruve, D. A., et al. The inflammasome recognizes cytosolic microbial and host DNA and triggers an innate immune response. Nature. 452 (7183), 103-107 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유