需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人淋巴管内皮细胞中的多参数荧光激活细胞分选分离
摘要
这个协议的目标是隔离淋巴管内皮细胞衬里使用荧光激活细胞分选(FACS)人淋巴管畸形囊肿状容器和包皮。随后的细胞培养和扩大这些细胞的实验允许为复杂遗传,蛋白组学,功能和细胞分化研究的一个新的水平。
摘要
淋巴系统疾病如原发性淋巴水肿,淋巴管畸形和淋巴管瘤是导致发病率显著但鲜为人知的是,他们的生物学罕见的情况。隔离患病和健康组织高纯度的人淋巴管内皮细胞(晶状体上皮细胞)将促进淋巴管内皮细胞在基因,分子和细胞水平的研究。可以预料,这些调查可能揭示目标为新的疗法可能改变这些条件的临床管理。描写人包皮淋巴管内皮细胞和淋巴管畸形淋巴管内皮细胞(LM的LEC)的隔离协议提出。以获得单细胞悬液组织切碎并用分散酶II和胶原酶II酶处理。将所得的单细胞悬浮液,然后标记抗体的分化(CD)标志物CD34,CD31,血管内皮生长因子-3(VEGFR-3)和PODOPLANIN群集。 STAI奈德的活细胞进行分选上的荧光激活细胞分选(FACS)对CD34 低 CD31 方位 VEGFR-3的方位 PODOPLANIN 方位的LM LEC人口从其他内皮细胞和非内皮细胞中分离出来。排序LM淋巴管内皮细胞培养和扩增的纤维连接蛋白包瓶中进一步的实验中使用。
引言
淋巴血管系统的一个主要功能是吸收淋巴液,含有脂质,蛋白质和细胞成分的过量的组织液,并进行到血液静脉系统。毛细淋巴管的一个网络指示淋巴在那里它筛选外源抗原,在免疫监视和部署的白血细胞中和外来抗原的重要过程的存在的淋巴结。
单向淋巴系统开始在组织中与初始毛细淋巴管,一个独特的结构,薄壁扁平的内皮细胞的一个连续单层与专门的细胞连接,允许淋巴条目1,2。这些毛细管经由锚定纤丝以防止在增加间质的压力3存在容器塌陷附连到相邻的结缔组织基质。最初的毛细淋巴管直接排入收集毛细淋巴管这凝聚成较大的淋巴管静脉或。在比较初始淋巴毛细血管,收集淋巴管具有较厚的血管壁,配对淋巴阀和由不连续的基底膜,其中几个平滑肌细胞包埋4被装入。平滑肌细胞协调开口和淋巴阀门关闭和收缩有助于流淋巴结3。在人体中,从身体的各个区域淋巴静脉连接形成淋巴中继线其合并以形成两个淋巴管:胸导管和右淋巴管。胸导管排出淋巴液从身体的左侧和从右侧胸部下方而从右侧臂的头,颈和胸部的和右侧的右淋巴管下水道淋巴。两管道在颈部5进行淋巴进入锁骨下静脉。
淋巴系统疾病,大致分为获取的第二先天性( 表1)。收购条件的例子是淋巴管炎和继发性淋巴水肿。淋巴管炎是一种淋巴管的炎症因细菌感染。受影响的淋巴管扩张并充满渗出液含有多形核细胞。在皮肤中,这些淋巴管是作为红,痛苦皮下条纹常伴相关引流淋巴结(淋巴结)6的放大可见。继发性淋巴水肿出现损坏或阻塞的淋巴管或淋巴结阻塞的后果。这导致慢性进行性肿大,由于淋巴结远端积累的损坏或阻塞。在发达国家中,继发性淋巴水肿是最常见的恶性肿瘤,其中转移性肿瘤妨碍淋巴管或区域淋巴结,或作为抗癌治疗的结果在手术切除的淋巴结,辐照后纤维化和炎症后血栓的相关bosis和疤痕7。在世界的其他地方,继发性淋巴水肿可继发于引起寄生蠕虫淋巴阻塞如班氏丝虫 6。
| 淋巴血管系统疾病 | |||
| 后天 | 先天性 | ||
| 淋巴结炎 继发性淋巴水肿 | 原发性淋巴水肿10 | 零星的淋巴管畸形13 | 淋巴管畸形伴有证13 |
| 例如: 米尔罗伊综合征 美格综合征 | 简单 : 淋巴管畸形 | 例如: 畸形骨Tranaunay综合征 公园Weber综合征 斯特奇 - 韦伯综合征 | |
| 结合 : 毛细淋巴管畸形 毛细淋巴管静脉畸形 毛细淋巴管,动静脉畸形 毛细淋巴管静脉动静脉畸形 | |||
表1概述淋巴血管系统的疾病。
淋巴系统的先天性病症包括初级(特发性)淋巴水肿被认为是由基因突变,淋巴管扩张和淋巴系统8,9的异常所引起的。初级淋巴水肿可能是零星的推测是通过从头突变引起,或继承。淋巴病症也可以是分离的或包括一个更一般化综合征10的一部分。在儿科人群中,97淋巴结%水肿是零星的,在淋巴管结构异常的影响区域淋巴结引流11。米尔罗伊疾病是由突变的VEGFR-3的基因明显在出生时或不久后12初级淋巴水肿的一个例子。虽然大多家族条件下,米尔罗伊疾病,也可在婴儿识别未经米尔罗伊疾病32的家族史。任何淋巴水肿的严重程度是依赖于淋巴生产和运输淋巴回静脉循环6能力的量。
根据临床表现和原位内皮细胞增殖,淋巴系统的异常被分类为淋巴肿瘤或淋巴管畸形13。 Kaposiform淋巴血管瘤病是一个LEC肿瘤14的一个例子。淋巴管畸形被认为是胚胎发育过程中产生和成长的比例给孩子15,16。他们很少倒退,但可以remaiñ无症状直到外伤或感染沉淀的快速增长,导致临床并发症。淋巴管网和淋巴传导的有序结构,从组织到上述静脉循环受到干扰的淋巴管畸形其中包括充满淋巴液不正常的囊性结构的局部集合。虽然没有临床或实验证据表明,这些囊状容器被连接到淋巴循环或它们包含官能淋巴阀,其淋巴同一性是通过淋巴细胞标记物如PODOPLANIN,CD31,淋巴管内皮受体1范围表达证实(LYVE-1),普洛斯彼罗同源异型盒蛋白1(PROX-1)和VEGFR-3 15,17,18。这些囊性结构可以是小的(微囊)或大(macrocystic),但大多数淋巴管畸形同时包含微囊和macrocystic组件( 图1)16。手术后,注射液ñ硬化和/或射频消融治疗的淋巴管畸形往往重演。
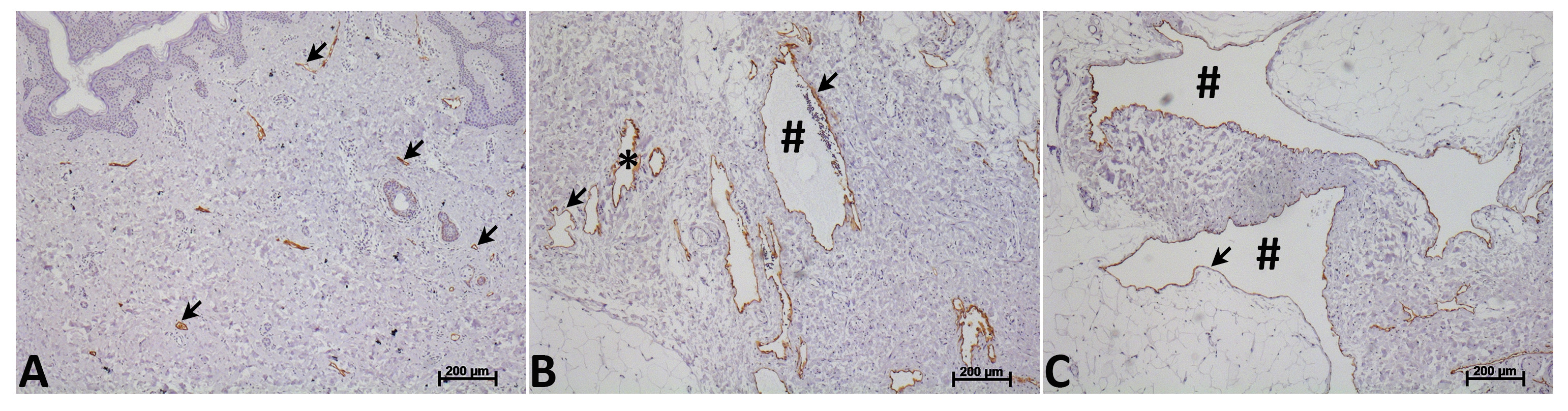
图1.形态人体淋巴血管和淋巴管畸形。正常人体淋巴(A)和淋巴管畸形血管(B和C)标记抗体PODOPLANIN(棕色标签,箭头)。人类淋巴管畸形血管的特征是显着的扩张和管腔大小相当大的变化。这些局部异常囊性结构可以是小的(微囊,*)(B)或大(macrocystic,#)(℃)。多数淋巴管畸形同时含有微囊和macrocystic组件。 请点击此处查看该图的放大版本。
一些研究者已经提出,淋巴管畸形代表淋巴脉管系统的发育障碍,其中所述淋巴管内皮细胞不具有异常生长潜力,而是未能连接到正常循环19。然而,我们已经发现,在LM淋巴管内皮细胞增殖速度更快,对细胞凋亡比包皮的LEC 15提示有在LM淋巴管内皮细胞的主缺陷更有抵抗力。当LM晶状体上皮细胞植入小鼠异种移植模型中,他们形成的结构让人想起淋巴管畸形15。这支持一个假说,即淋巴管畸形可能由胎儿发育过程中的LM淋巴管内皮细胞产生的一种或多种体细胞突变引起的。事实上,最近的报告已经确定这样的一个突变在磷酸肌醇-3-激酶(PIK3CA)基因20的p110α催化亚基。
鉴于DNA测序技术,相关的突变c中的进步乌尔德在孤立的LM晶状体上皮细胞更容易识别,引导这些条件进一步研究。可行的淋巴管内皮细胞的分离将促进试验,例如迁移,增殖,管形成能力和存活异常和正常淋巴管内皮细胞之间的比较响应于降低的养分可用性或促凋亡剂15。孤立的LEC将进一步使我们能够进行细胞特异性基因表达和蛋白质组研究中,描绘新的LEC亚群,并发现适合淋巴管畸形的临床管理新的药理学试剂。
之前我们已经发布了基于晶状体上皮细胞从新生儿包皮和淋巴管畸形15磁珠分离LEC隔离法。我们报道从基于缺乏CD34的表达的,接着进行的CD34 负片细胞级分,以正选择为CD31血管内皮细胞的分离正常和患病的淋巴管内皮细胞的一个策略。然而,这种方法受到阻碍残留非内皮细胞的存在。这是独立前的后续结缔组织消化去除表皮。这些污染物通常增殖得更快,从而最终茂密生长尽管后续尝试重复LEC隔离的内皮细胞培养物。的确,非内皮细胞低至2%至5%的初始污染足以压倒LEC群体15。这促使我们探索荧光激活细胞分选法作为一种选择,以改善LEC细胞产率和纯度。此外,我们使用了多参数排序以增强LEC群体的特异性,增加VEGFR-3和PODOPLANIN到选择标记,以确定CD34 低 CD31 方位 VEGFR-3的方位 PODOPLANIN 方位淋巴管内皮细胞。
选择这些标记的基本原理是根据报告,虽然晶状体上皮细胞和血液血管内皮CELLS有许多共同的细胞表面标志物,例如CD31,淋巴管内皮细胞表现出在它们的CD34,PODOPLANIN和VEGFR-3的细胞表面标志物的表达表型变异时相比,血液血管内皮细胞21-23。 CD31是一种130 kDa的跨膜糖蛋白也被称为血小板内皮细胞粘附分子-1(PECAM-1)。它被认为是一个泛内皮细胞标记物,因为它表达于所有类型的血液和淋巴管21,24,25。 CD34是存在于大多数造血祖110-kDa的跨膜糖蛋白和干细胞,血管内皮细胞和某些淋巴管26。
VEGFR-3,受体对血管内皮细胞生长因子C和D,是最初存在于在小鼠胚胎显影静脉,但以下淋巴规范由转录调控因子SRY相关的HMG-盒(SOX)-18 角 hicken Øvalbuminüpstrea米p romoter 牛逼ranscription˚F演员2(COUPTF-II)和PROX-1,VEGFR-3静脉表达丢失,它成为限制胚胎的LEC 25,27。 PODOPLANIN,一个38 kDa的膜粘蛋白,首先注意对小鼠胚胎发育28淋巴管在胚胎大约11天(〜E11.0),并同时强烈微血管淋巴管,PODOPLANIN表达在淋巴管畸形macrocystic淋巴管内皮细胞表达更变15。流式细胞术实验表明,至少一些的CD34 高 CD31 方位内皮细胞表达淋巴标记PODOPLANIN 29。虽然LYVE-1和PODOPLANIN染色在人淋巴管畸形系统的评估表明,两者都是在染色淋巴管畸形内皮30有效,在正常组织中,LYVE-1据报道,强烈存在于初始淋巴毛细血管内皮但降低,即使在收集淋巴管内皮31不存在。因为我们的目标是隔离两个我们已选择的初始和收集淋巴管内皮细胞不使用LYVE-1作为我们的小区选择策略的一部分。最后,聘请这些标记的决定也是基于抗体的诊断被用于为显微成像标记淋巴管的可用性,这将允许流式细胞仪及免疫研究之间相关性的特征。
本文将描述该组织消化法,细胞染色和FACS设置所需的CD34 低 CD31 波什VEGFR-3 POS PODOPLANIN 波什晶状体上皮细胞的成功分离,以及来自包皮和淋巴管畸形高 CD34 CD31 波什VEGFR-3 POS PODOPLANIN 波什内皮细胞组织。
研究方案
伦理声明:伦理学批准征收的淋巴管畸形及包皮组织从人类研究伦理委员会获得皇家儿童医院,墨尔本,澳大利亚。签名同意从患者的父母接受手术前。组织样本从确诊患者与LMS进行外科手术作为临床管理的一部分,并择期包皮环切收集。所有实验均符合国家卫生和医学研究理事会,澳大利亚的指引执行。
从包皮和淋巴管畸形组织1.准备细胞悬液
- 缓冲器和媒体准备。
- 使用市售的EGM-2中压子弹套件温热的EGM-2培养基,轻轻解冻试剂盒组分在37℃水浴中制备完整的内皮细胞的介质。在II级生物安全柜,无菌每个组件添加到EGM-2介质。一旦所有的组件添加到媒体,请参阅此媒体称为"完整的内皮细胞培养基"。使用无菌50毫升吸管混合使用前的内容。
注 :所有涉及的细胞培养步骤是在II类生物危害柜进行。所有解决方案都存储在4℃按制造商的说明,并加热至在使用前室温。完整的内皮细胞培养基,细胞培养缓冲液和酶溶液加热至37℃,使用前20分钟。 - 补充完整内皮细胞培养基用50ng / ml的VEGF-C。分装补充内皮细胞培养基到50ml无菌管中并储存于4℃直至使用。储存在4℃下,当媒体是稳定至少4周。
- 通过溶解8.752克氯化钠,1.416克的Na 2 HPO制备钙和镁的磷酸盐缓冲盐水(PBS)4 .2H 2 O和0.395克KH 2 PO 4在1,000ml水中。调节pH至7.4。使用0.22微米的过滤器,并储存在4℃过滤消毒PBS。在使用之前,添加抗生素/抗真菌溶液(在1中使用:100)。
- 为了制备人纤连蛋白,溶解在10毫升无菌水中1毫克纤维连接蛋白。商店重新溶解在100μl的等分溶液在-20℃下。上使用的当天无菌PBS加入10 mL至100μl纤连蛋白等分试样(以得到最终工作的10微克/毫升浓度)。
- 用于酶介质,制备含有0.04%分散酶II,0.25%胶原酶II和0.01%DNA酶I在无菌PBS中的溶液。首先,称量分散酶和胶原酶,放置在无菌的50ml管中,加入的PBS所需的体积和30分钟孵育振荡在37℃下使其溶解。一旦溶解,在生物安全罩过滤消毒(0.22微米过滤器)分散酶/胶原酶溶液。无菌在37℃下加入DNA酶I.商店酶溶液直到使用。
注 :抗酶是一种商业细胞培养级试剂可作为无菌冻干粉。
- 使用市售的EGM-2中压子弹套件温热的EGM-2培养基,轻轻解冻试剂盒组分在37℃水浴中制备完整的内皮细胞的介质。在II级生物安全柜,无菌每个组件添加到EGM-2介质。一旦所有的组件添加到媒体,请参阅此媒体称为"完整的内皮细胞培养基"。使用无菌50毫升吸管混合使用前的内容。
从包皮和淋巴管畸形2.准备细胞悬液
- 称量50ml管含有10毫升的DMEM / 2%抗生素 - 抗真菌溶液。该管将用于组织采集。
- 下列手术切除淋巴管畸形和包皮的组织,在无菌条件下在冰上添加组织标本到管并转移到细胞培养实验室。
- 称量装有组织的管,并计算组织重量。使用该权重来计算的消化所述组织所需的酶溶液的体积。
- 在II级生物安全柜,用无菌镊子来组织和媒体转移到100毫米组织培养皿。用无菌剪刀精细剁碎组织成约1 立方毫米件。
- 转移组织糜混合媒体我NTO 50ml管含有额外的10毫升无菌DMEM / 2%抗生素 - 抗真菌溶液。通过颠倒混合到重悬浮组织。离心样品在300×g离心5分钟。
- 去除上清。基于组织重量,加入1 ml预热(37℃)胶原酶II每100mg组织糜的/ DNA酶I /分散酶II消化溶液。通常,使用将10ml酶溶液对约1g组织糜的。
- 孵育在37℃培养箱的组织为20-90分钟,恒定200rpm振荡。在这一时期结束时,确保几乎所有的组织的被消化成细碎片。
注 :在隔离的从主组织影响细胞存活的时间曝光的细胞胶原酶和分散酶的。我们已经发现根据经验,多数新生儿包皮样品最优地需要消化20-30分钟,而纤维化淋巴管畸形样品可能需要消化60-90分钟。 LM LEC产量S被纤维化的存在量的影响,更纤维组织产生较少的细胞,这可能是由于长期暴露的有害影响,胶原酶II和分散酶II。 - 消化后,将管转移到生物安全柜,并通过一个70微米的过滤器放入一个无菌50ml管中通过消化的组织方案。使用3个毫升注射器活塞与柱塞橡胶,磨下来的剩余组织,直到细胞外基质的只有很小的痕迹观察。
- 与卷的内皮细胞培养基相当于解离酶培养基以回收细胞粘到筛和使酶失活的体积洗细胞过滤网。例如,对于2毫升解离酶介质消化的组织糜的,内皮细胞培养基中加入2毫升至使酶失活。
- 离心在300×g离心5分钟将细胞溶液和吸出上清液。 R> E-暂停在10毫升PBS的细胞。离心细胞在300 XG5分钟后,除去上清液,然后重复细胞洗涤两次。 >重悬细胞沉淀在20ml内皮细胞培养基中。使用台盼蓝然后种子计数细胞2×10> 6个细胞在150厘米> 2烧瓶中20ml的内皮细胞培养基的终体积预涂覆有纤连蛋白。培养在37℃,在5%CO> 2的湿润空气培养箱中。>
注 :预计有核细胞的75%-90%的存活组织消化估算由锥虫蓝排除。初始细胞计数反映所有有核细胞中的细胞悬浮液( 即角质形成细胞,白细胞,巨噬细胞,结缔组织细胞和血管细胞)。在5-7天的细胞计数反映已附加,存活和细胞培养过程中增殖的细胞。涂层组织培养瓶中用纤连蛋白也提高了随后的LEC和LM LEC生存。 - 过夜孵育后,在洗涤三次以P洗去未结合的细胞BS / 1%的抗生素,抗真菌的解决方案,并添加新鲜的内皮细胞培养基。进行三次洗涤,有效地除去未结合的细胞和红血细胞存在于烧瓶中。改变媒体每隔一天。细胞将是〜80%汇合后5-7天。
细胞淋巴管内皮细胞表面标志物流式细胞仪的3抗体染色
- 后的细胞达到80%汇合时,吸出介质并漂洗细胞,用PBS。
- 通过孵育细胞用7ml的细胞脱附溶液分离贴壁细胞如的Accutase每150cm 2烧瓶中5-7分钟,在37℃。
- 收获分离的细胞,通过加入3倍体积的内皮细胞培养基的灭活细胞脱离溶液和细胞悬液转移到一个新的无菌试管中。
- 离心细胞,在300×g离心5分钟。
- 吸去上清液并重新悬浮在5ml PBS中的细胞。离心细胞,在300×g离心5分钟,除去的S然后重复upernatant洗细胞。重新悬浮在5ml PBS中的细胞。
- 计数活细胞的数量。混合10微升细胞悬浮液与90微升0.4%台盼蓝。转移10微升此悬浮液至血细胞计数计数。
注 :最终细胞产率将取决于处理的样本大小。每150cm 2烧瓶范围通常的细胞产量从7×10 5〜1.2的活细胞×10 6。 - 制备用于细胞染色的抗体溶液。
注意 :下面的稀释液进行滴定染色1×10 6中的100微升的染色体积。- 稀PE偶联的小鼠抗人VEGFR-3(1:50); PE-Cy7的缀合的小鼠抗人缀合的CD34(1:200); APC缀合的小鼠抗人CD31(1:100)和Alexa 488缀合的鼠抗人PODOPLANIN(1:200)中的100微升每组织样品无菌5%FBS / PBS溶液总体积。下面的准备抗体溶液,保持在冰上直到使用。同样准备稀释的同型对照抗体的混合物,以方便流式细胞仪门的设置。
- 为了减少非特异性抗体结合,离心细胞,在300×g离心2分钟,除去上清液,然后悬浮细胞在100μl灭菌的5%FBS /每个样品PBS溶液进行染色。孵育细胞在冰上20分钟,在4℃。
- 离心细胞在300 XG 5分钟,弃上清然后重新暂停细胞中的共轭抗体的鸡尾酒。还染色在100μl同种型对照抗体混合物的细胞(1×10 5)的更小的等分试样。孵育细胞在冰上进行20分钟。
- 以除去未结合的抗体,加入2毫升的2%FBS / PBS溶液和离心机将细胞在300×g离心5分钟。吸出上清液,重复清洗。
- 重悬细胞沉淀于同种型对照和抗体染色样品中加入300微升的0.5毫克/毫升丙锭io的要排序啶/ 2%FBS / PBS溶液。放在冰管,直到排序。
4.细胞分选
- 使用以下材料来设置仪器;对准珠如市售的荧光颗粒,磷酸盐缓冲的基于盐水鞘流体和下降延迟珠,如Accudrop荧光珠。
- 隔离在一个多参数荧光激活细胞分选仪纯化的人淋巴管内皮细胞。设置仪器和对齐根据制造商的建议。此外,运行单染补偿控制与每个排序以生成补偿矩阵,并通过荧光的发射,以从而消除实质泄放如PE进入PE-CY通道。
注 :FACS分选的细胞比例较高生存的隔离,如果一个100微米的喷嘴被使用,细胞分类成内皮细胞培养基中。
5.细胞培养后FACS排序ING
- 以下排序,离心细胞,在300×g离心5分钟。吸出上清液并将细胞重新悬浮在5-10毫升的培养基(取决于所使用的种子的细胞在烧瓶)。如果低于50,000元分类中,细胞是在纤连蛋白涂覆为25cm 2烧瓶中培养。
- 否则培养在5%的CO 2,空气增湿培养箱将细胞在75cm 2的纤连蛋白涂覆的烧瓶在37℃。术后第2天更换介质。
注 :细胞培养基改变每隔一天,因为延长介质变化的时间似乎有利于非内皮细胞的存活。 PROX-1,VEGFR-3,Podoplanin,CD34和CD31,当细胞是第一分割为进一步扩大15:我们使用免疫组织化学标记的检测验证的淋巴管内皮细胞的表型。
结果
以下初始组织消化,在24小时中未分离的样品培养之后,不同的内皮细胞集落可以观察到( 图2A)一起成纤维细胞样细胞和平滑肌细胞。以下排序和24小时细胞培养物后,将CD34 低 CD31 方位 VEGFR-3的方位 Podoplanin 方位细胞附着并显示典型鹅卵石形态( 图2B和C)。使用上述流式细胞仪的方法,我们能够从CD34 高 CD31 方?...
讨论
淋巴管内皮细胞在维持流体稳态,对外来抗原的吸收和某些营养素转运免疫应答中起重要作用。 LEC动态平衡可受疾病过程,如细菌感染和肿瘤转移,但淋巴管内皮细胞还可以开发导致形成的不正常的淋巴管和显著发病为受影响的患者的体细胞突变。要通过植入体内和体外实验获得的淋巴管畸形的病因更多的理解,并发现新的治疗选择,我们首先开发了LEC分离方法的基础上使用CD34 CD31...
披露声明
The authors have nothing to disclose.
致谢
作者要感谢贝克基金会和皇家儿童少年基金会"女科学家奖学金"支持Zerina Lokmic的。安德鲁G. Elefanty和爱德华G.士丹利NHMRC资深研究员的研究。在他们的实验室工作是由NHMRC和干细胞澳大利亚支持。
材料
| Name | Company | Catalog Number | Comments |
| DMEM | Life Technologies (Gibco) | 11965-092 | Used to collect tissue samples from the operating theatre. |
| EGM-2 MV Bullet Kit | Lonza | CC-3202 | EGM-2 MV Bullet Kit contains 500 ml of EBM-2 media and human EGF, hydrocortisone, gentamycin (GA-1000), fetal bovine serum (FBS), VEGF, human FGF-b, R3-IGF-1 and ascorbic acid. |
| VEGF-C | R&D Systems | 2179-VC-025 | Complete endothelial cell media is supplemented with 50 ng/ml VEGF-C |
| Antibiotic-antimycotic solution (100x) | Life Technologies (Gibco) | 15240-062 | This solution contains 10,000 U/ml of penicillin, 10,000 mg/ml of streptomycin and 25 mg/ml of Fungizone antimycotic. Use at 1:100 dilution. |
| Fibronectin from human plasma | Sigma-Aldrich | F2006 | Used at 10 mg/ml concentrations. It can be re-used for up to 1 month if kept at 4 °C and maintained sterile. Use 7 ml to coat 150 cm2 flask. |
| StemPro Accutase Cell dissociation reagent | Life Technologies (Gibco) | A11105-01 | StemPro®Accutase® is used at 0.05 ml per cm2 to cover the entire surface area of the flask. Using lesser volumes may result in incomplete cell detachment. |
| 0.4% Trypan Blue dye | Life Technologies (Gibco) | 15250-061 | Used as a viability stain. |
| Dispase II | Roche Applied Biosciences | 4942078001 | Used at 0.04% |
| Collagenase II | Worthington Lab | 4176 | Used at 0.25% |
| DNase I | Roche Applied Biosciences | 11284932001 | Used at 0.01% |
| 70 mm nylon cell strainers | BD Falcon | 352350 | |
| [header] | |||
| PE-conjugated VEGFR-3 clone 9D9F9, clone WM59 | BioLegend | 356204 | Used at 1:50 dilution |
| PE-Cy7-conjugated CD34, clone 581 | BioLegend | 343516 | Used at 1:200 dilution |
| APC-conjugated mouse anti human CD31, clone WM59 | BioLegend | 303116, | Used at 1:100 dilution |
| Alexa 488-conjugated rat anti human Podoplanin, clone NC-80. | BioLegend | 337006 | Used at 1:200 dilution |
| PE-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400112 | Used at 1:50 dilution |
| PE-Cy7-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400126 | Used at 1:200 dilution |
| APC-conjugated mouse IgG1, k isotype, clone MOPC-21 | BioLegend | 400120 | Used at 1:100 dilution |
| Alexa 488-conjugated mouse IgG2a, k isotype, clone RATK2758 | BioLegend | 400525 | Used at 1:200 dilution |
参考文献
- Baluk, P., et al. Functionally specialized junctions between endothelial cells of lymphatic vessels. J Exp Med. 204 (10), 2349-2362 (2007).
- Yao, L. C., Baluk, P., Srinivasan, R. S., Oliver, G., McDonald, D. M. Plasticity of button-like junctions in the endothelium of airway lymphatics in development and inflammation. Am J Pathol. 180 (6), 2561-2575 (2012).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Witte, M. H., et al. Structure function relationships in the lymphatic system and implications for cancer biology. Cancer Metastasis Rev. 25 (2), 159-184 (2006).
- Andrade, M., Jacomo, A. Anatomy of the human lymphatic system. Cancer Treat Res. 135, 55-77 (2007).
- Kumar, V., Abbas, A. K., Aster, J. C., Ch Fausto, N. . Cotran Pathologic Basis of Disease. 43-78. 2, (2009).
- Shayan, R., Achen, M. G., Stacker, S. A. Lymphatic vessels in cancer metastasis: bridging the gaps. Carcinogenesis. 27 (9), 1729-1738 (2006).
- . . Mulliken & Young's Vascular Anomalies Hemangiomas and. , 1059-1076 (2013).
- . . Mulliken & Young's Vascular Anomalies Hemangiomas. 14, 562-594 (2013).
- Bellini, C., Hennekam, R. C. Clinical disorders of primary malfunctioning of the lymphatic system. Adv Anat Embryol Cell Biol. 214, 187-204 (2014).
- Schook, C. C., et al. Primary lymphedema: clinical features and management in 138 pediatric patients. Plast Reconstr Surg. 127 (6), 2419-2431 (2011).
- Brouillard, P., Boon, L., Vikkula, M. Genetics of lymphatic anomalies. J Clin Invest. 124 (3), 898-904 (2014).
- . for the Study of Vascular Anomalies (ISSVA) classification. Available from: http://www.issva.org/classification.com. , (2014).
- Croteau, S. E., et al. Kaposiform lymphangiomatosis: a distinct aggressive lymphatic anomaly. J Pediatr. 164 (2), 383-388 (2014).
- Lokmic, Z., et al. Isolation of human lymphatic malformation endothelial cells, their in vitro characterization and in vivo survival in a mouse xenograft model. Angiogenesis. 17 (1), 1-15 (2014).
- Smith, R. J. Lymphatic malformations. Lymphat Res Biol. 2 (1), 25-31 (2004).
- Chen, E. Y., et al. Similar histologic features and immunohistochemical staining in microcystic and macrocystic lymphatic malformations. Lymphat Res Biol. 7 (2), 75-80 (2009).
- Norgall, S., et al. Elevated expression of VEGFR-3 in lymphatic endothelial cells from lymphangiomas. BMC cancer. 7 (2), 75-80 (2007).
- Garzon, M. C., Huang, J. T., Enjolras, O., Frieden, I. J. Vascular malformations. Part I. J Am Acad Dermatol. 56 (3), 353-370 (2007).
- Osborn, A., Dickie, P., Adams, D., Dickie, B. . 20th International workshop on Vascular Anomalies. ISSVA. , (2014).
- Baluk, P., McDonald, D. M. Markers for microscopic imaging of lymphangiogenesis and angiogenesis. Ann N Y Acad Sci. 1131, 1-12 (2008).
- Lokmic, Z., Mitchell, G. M. Engineering the microcirculation. Tissue engineering. Part B, Reviews. 14 (1), 87-103 (2008).
- Lokmic, Z., Mitchell, G. M. Visualisation and stereological assessment of blood and lymphatic vessels. Histol Histopathol. 26 (6), 781-796 (2011).
- Hagerling, R., et al. A novel multistep mechanism for initial lymphangiogenesis in mouse embryos based on ultramicroscopy. EMBO J. 32 (5), 629-644 (2013).
- Pollmann, C., Hagerling, R., Kiefer, F. Visualization of lymphatic vessel development, growth, and function. Adv Anat Embryol Cell Biol. 214, 167-186 (2014).
- Breiteneder-Geleff, S., et al. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 154 (2), 385-394 (1999).
- Kaipainen, A., et al. Expression of the fms-like tyrosine kinase 4 gene becomes restricted to lymphatic endothelium during development. Proc Natl Acad Sci U S A. 92 (8), 3566-3570 (1995).
- Schacht, V., et al. T1alpha/podoplanin deficiency disrupts normal lymphatic vasculature formation and causes lymphedema. EMBO J. 22 (14), 3546-3556 (2003).
- Kriehuber, E., et al. Isolation and characterization of dermal lymphatic and blood endothelial cells reveal stable and functionally specialized cell lineages. J Exp Med. 194 (6), 797-808 (2001).
- Florez-Vargas, A., et al. Comparative analysis of D2-40 and LYVE-1 immunostaiing in lymphatic malformations. Lymphology. 41 (3), 103-110 (2008).
- Makinen, T., et al. PDZ interaction site in ephrinB2 is required for the remodeling of lymphatic vasculature. Genes Dev. 19 (3), 397-410 (2005).
- Connell, F. C., et al. Analysis of coding regions of VEGFR3 and VEGFRC in Milroy disese and other primary lymphoedemas. Hum Genet. 124 (6), 625-631 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。