Method Article
生物膜制作的溶剂辅助脂质双分子层(SALB)方法
摘要
我们提出了一个试验性协议,形成对固体基质支持的脂质双层不使用脂质囊。我们展示了一个一步法,以形成具有各种生物应用胆固醇富集域上的二氧化硅和金脂质双层以及支持膜。
摘要
为了模仿细胞膜,所支持的脂质双层(SLB)是一个有吸引力的平台使在膜相关过程的体外调查而赋予的生物相容性和生物功能,以固体基质。磷脂小泡的自发吸附和破裂是最常用的方法来形成的SLBs。然而,在生理条件下,囊泡融合(VF)被限制在脂质组合物和固体载体的一个子集。这里,我们描述为了形成SLBs的,它不需要囊泡一个称为溶剂辅助脂质双层(SALB)的形成方法的一个步骤的一般方法。所述SALB方法以触发SLB形成包括脂质分子上的沉积,在水混溶的有机溶剂(例如,异丙醇)中,用缓冲水溶液后续溶剂交换的存在下的固体表面。连续的溶剂交换步骤使应用程序的方法在适合于监视双层形成和使用范围广泛的表面敏感的生物传感器进一步修改的流通配置。所述SALB方法可被用于制造SLBs的就广泛亲水固体表面,包括那些棘手到囊泡融合的。此外,它使SLBs的脂质组合物的构成不能使用的囊泡融合方法制备的制造。在此,我们比较有两个说明性的亲水性的表面,二氧化硅和黄金SALB和常规囊泡融合方法得到的结果。为了优化实验条件用于制备经由SALB方法制备高品质双层,各种参数,包括有机溶剂在沉积步骤的类型,溶剂交换的速率,和脂质浓度的效果连同故障排除提示讨论。含胆固醇高的分数支持膜的形成也是魔鬼trated与SALB方法,突出SALB技术的技术能力,适用范围广的膜配置。
引言
固体支持的脂质双层1(SLB)是一种多功能的平台,其保留生物膜的基本特性,如双层厚度,二维脂质扩散率,和主机膜相关的生物分子的能力。由于天然细胞膜的复杂性,这个简单的平台已经显示用作用于体外研究膜相关的处理的诸如筏形成2,蛋白质的高效平台结合3,病毒和病毒样颗粒的结合4,5-和细胞信号6。形成在靠近固体支持物,所述SLB平台是与一系列的表面敏感的测量技术相容如全内反射显微镜(TIRF),石英晶体微天平耗散(QCM-D)和阻抗谱。
几种方法已经被开发,以生产不同类型的SLBs的,包括气泡崩7和蘸笔纳米光刻8为亚微米尺寸的脂质斑点,旋涂为双层堆叠和LB膜(LB)10和囊泡融合(VF)11,用于全跨越,单脂质双层涂层9。在VF方法包括小单层囊泡吸附到固体支持物和随后的自发破裂和熔化,形成连续的脂质双层。然而,在生理条件下,自发囊泡破裂主要限于硅系材料,如二氧化硅,玻璃,和云母。此外,泡囊破裂不会发生自发为复合脂质组合物的囊泡,例如含有胆甾醇或带负电荷的脂质的高级分。根据不同的系统,囊泡破裂可通过进一步剪裁实验条件,如温度12,溶液的pH值13,和盐度14,渗透压休克15被诱导或压力16,或添加二价离子如钙离子的17,另外,在膜的活性AH肽可以破坏的层吸附囊泡被引入,导致小泡破裂和双层形成在一系列表面18-22。
此外,成功的双层形成需要制备的小单层囊泡,可以是耗时且难以实现的某些膜的组合物良好控制的人口。因此,尽管其高效率的最佳情况下(例如,后囊23的广泛冻融预处理),囊泡融合的一般应用由合适的底物和膜组合物的范围的限制。
的溶剂辅助脂质双层(SALB)方法24-28是一种替代的制造技术,它不需要的脂质囊泡。该方法是基于沉积Ô˚F脂质分子上在与水混溶的有机溶剂后用此溶剂与以触发SLB形成缓冲水溶液逐渐交换的存在下的固体表面。在溶剂交换步骤,脂质,有机溶剂的三元混合物,和水进行一系列相变而增加水部分,这导致层状相的结构在本体溶液的形成和SLB固体基材上。重要的是,该自组装的路线绕过需要囊泡破裂,这通常是用于吸附囊泡转变成一个SLB限制步骤。该协议是适用于多种表面,包括二氧化硅,氧化铝,铬,铟锡氧化物,和金的。在本文和在所附的视频,脂质沉积由SALB和囊泡融合方法进行了比较,提出。特别是,实验参数的影响,包括脂浓度,流量,和水混溶性有机溶剂的选择,由所述SALB法形成的双层的质量进行了讨论。所制造的SLBs的分析表征由QCM-D,荧光显微镜,荧光漂白恢复(FRAP)技术之后进行。 QCM-D监测是,由于由Keller和Kasemo 29进行的开创性工作,已被广泛用于定量研究双层形成一个表面感光质量测量的技术。荧光显微镜允许膜均一性的检查以及膜结构域的可视化。的FRAP技术是一个标准的工具,以确定在SLB,这是流体膜的一个重要性质脂质分子的横向流动。
该研究的第一部分涉及SALB应用到试图对二氧化硅和金双层形成的QCM-D分析和囊泡融合的方法。在第二部分中,的制备方法和含有一个范围胆固醇浓度与SALB方法的支持膜表征演示了,结果与那些由囊泡融合方法获得了比较。
研究方案
在亲水性固体支持1组的支持的脂质双层
- 制备10毫克/毫升1,2- dioleoyl- SN -glycero -3-磷酸胆碱脂质储备溶液(DOPC)和1毫克/毫升1,2- dioleoyl- SN -glycero -3- phosphoethanolamine- -N - (丽丝胺若丹明乙磺酰基)(铑-PE)通过将相应的脂质粉末(适当地预先用分析质量平衡)的异丙醇溶液称重。
- 稀释和混合储备溶液在异丙醇中,以在最终浓度制备所需的脂质混合物。为荧光显微镜和FRAP的实验中,0.5重量%的Rh-PE的应包括在脂质混合物。
- 注入在异丙醇脂质混合物到微流体通道中,直到它被充满。
- 孵育在玻璃表面上的脂质混合物约10分钟。
- 使用蠕动泵以非常低的流速逐渐取代与水或缓冲溶液的脂质溶液(10-50微升/分钟)。可替代地,代替通过反复移液脂质混合物。
- 用过量的缓冲液彻底冲洗通道以去除残留的异丙醇。
2,形成的胆固醇富集支持膜
注:固体表面(SiO 2)的支持囊泡融合,但膜组成(高胆固醇)抑制囊泡融合,因为胆固醇富集的囊泡具有较高的抗弯刚度30。
- 制备含有10毫克/毫升DOPC脂质,10毫克/毫升胆固醇,和1毫克/毫升的Rh-PE通过首先将各粉末的异丙醇母液。
- 使用步骤2.1准备的储液重复步骤1.2-1.6。
3.膜流动性分析
- 沉浸在十二烷基硫酸钠(SDS)溶液(1%)10分钟的载玻片上。
- 使用去离子水彻底冲洗的幻灯片和冲洗机智^ h乙醇。
- 吹干使用温和氮气流幻灯片。
- 露出滑动到氧等离子体进行30秒,在氧等离子体室最大射频功率。
- 取出使用镊子保护膜涂层的深不见底的商业微流控室( 图1A)和载玻片附着在室( 图1B)的粘性面。
- 组装连接器和管导入腔室的入口和出口的位置,并放置在显微镜台(图1C)的微流体通道。
- 形成在微流体通道中的荧光标记的支持的脂质双层[使用所需的脂类组合物重复步骤1(例如,0.5毫克/毫升DOPC),其包括0.5重量%的Rh-PE的在有机溶剂中。
- 定位,以捕捉图像与60X油浸物镜(NA 1.49)的双层飞机。
- 取两个预漂白图像,然后光漂白301;米宽圆光点。一个532纳米,100毫瓦的激光束。漂白前,热身激光,直到其强度趋于稳定。立即漂白后,为了遵循荧光强度的恢复在漂白点捕获的一系列图像的每1秒2分钟。
4.胆固醇定量分析
- 露出二氧化硅被覆石英晶体传感器芯片以氧等离子体进行30秒,在氧等离子体室最大射频功率。除去从室的芯片和立即装入在测量室中的芯片。
- 实验前,先获得在空气中的传感器芯片的频率和耗散,以便确保正确安装。
- 对于商用Q-检测E1或E4 QCM-D仪器,运行Q-Soft软件程序,并单击"获取",然后选择"设置测量"。
- 在出现的新窗口中,检查3,5,7,9,11和13的泛音,然后点击查找,并以检查共振光谱运行。设定在24的温度下 C。如果一个或多个谐振频率不与预期值一致,检查芯片安装和直到达成协议重新执行此步骤。
- 启动蠕动泵和流动缓冲溶液(10mM的Tris,150mM的氯化钠,pH值7.5)导入测量室以100微升/分钟的流速。
- 在软件程序中,点击"捕获",并以记录的谐振频率和耗能信号选择"重新启动测量"。直到一个稳定的基线的频率和功耗的变化得到重复此步骤。注意:对于步骤以后,将有可被记录为时间的函数的其他频率和损耗变化。
- 注入异丙醇(无脂)10分钟。
- 注入DOPC脂质/胆固醇的混合物在期望的摩尔比为0.5毫克/毫升的异丙醇进行10分钟的总脂质浓度。
- 注入缓冲器20分钟以100微升/分钟的流速。
- 注入1mM的在缓冲液(流速100微升/分钟),直到频率信号达到稳定的值制备甲基β环糊精(MβCD)中的溶液。
- 测量即引起所述MβCD处理步骤的相对正的频率偏移和通过利用索尔布雷方程[ΔM=转换ΔF 町和ΔFDOPC值质量值计算的胆固醇和DOPC脂质的质量- (C / N)× ΔF,其中C = 17.7毫微克/厘米2,N:泛音。
- 计算中的胆固醇的SLB的摩尔分数,考虑到DOPC脂质(786.1克/摩尔)和胆固醇(三百八十六点六克/摩尔)的分子量。
结果
制造亲水性基材支持脂质双层。
的音频和SALB形成方法进行了尝试对二氧化硅和金并在实时的QCM-D测量技术监测的形成过程。在大规模的吸附的振荡压电石英晶体到晶体的表面的QCM-D测量仪器中的共振频率(ΔF)的变化。此外,QCM-D仪器测量以表征所述吸附层的粘弹性(刚性和柔软性)的振荡能量的消耗。泡融合实验如前所述31进行。简要地说,一个基线最初成立于水性缓冲液〔10毫摩尔Tris,150mM的氯化钠,pH值7.5的频率和耗散信号; (图2A 和B)。接着,在相同的缓冲液小单层DOPC脂质囊泡分别在投影在 t = 10分钟(箭头1)到二氧化硅( 图2A)和金(图2B)。有关二氧化硅囊泡融合,两步吸附动力学,观察在-26(±1)赫兹频率和能量耗散和0.3最终改变(±0.2)×10 - ,6分别。这些值是用支持的脂质双层29的形成是一致的。
如图2B所示,除了囊泡溶液到金表面的导致了同时减少和增加Δf和ΔD信号 ,分别直到它们的值达到-150(±10)Hz和(7.5±2) ×10 - 6。这些值对应于被吸附的囊泡层的形成。因此,正如所料,一个SLB没有通过囊泡融合法形成黄金。
QC对于双层形成于二氧化硅和金由SALB方法的MD分析示于图2C和 D。上二氧化硅,的-25.6(±0.55)最终Δf和Δð移位赫兹和0.4(±0.27)×10 - 6,分别实现,并且这些值表示形成一个SLB的。 Δf和 Δ 的D类似范围(Δ˚F 金 :-27.3±2.7赫兹,Δð 金 :0.48(±0.26)×10 - 6),观察其对黄金。这些结果支持了SALB方法能够在其上防止囊泡破裂面形成支持的脂质双层。
溶剂交换流量对支持的脂质双层的质量。
为了确定最佳条件为高品质的支持脂双层六制造一个所述SALB方法,脂质浓度,溶剂交换速率和有机溶剂的选择的影响进行了研究。
图3显示了在SALB协议的最后步骤中的QCM-D频率的变化,如在两个不同的流速(100和600微升/分钟)和两种不同的脂质浓度(0.125和0.5mg / ml)的执行上二氧化硅。
当0.5毫克/毫升DOPC脂质,使用(图3A),双层形式并不受流动速率和大约-26赫兹在两个流速得到最终ΔF移位。
相反,当一个低脂质浓度使用,吸附脂质后完成溶剂交换的量显著受流动速率( 图3B)。以100微升/分钟的平均流动速率,双层形成完成(约-26赫兹ΔF)。然而,在6倍较高流速(600微升/分钟),一个完整的双层不形成(大约-17赫兹ΔF)。这些结果提供了指导选择合适的实验条件,使用方法SALB用异丙醇作为首选的有机溶剂成功的双层形成。
从各种醇溶液不同血脂浓度形成支持的脂质双分子层的表征。
脂浓度是影响SLBs中的通过使用SALB方法获得的质量的另一参数。荧光显微镜显示,在0.05毫克/毫升脂质浓度,只有分离的,亚微观脂质结构形成(图4A)。而增大SALB过程中所使用的脂质浓度,脂质结构的荧光强度变得更加均匀。以0.1mg / ml的脂质浓度,有微观脂质斑块虽然结构没有跨越整个F跨越的视图ield(图4B)。然而,当为0.25mg / ml的脂质浓度为所使用的,均匀的脂质双层形成(图4C)。因此,存在以形成一个完整的,跨越SLB所需的最小的脂质浓度。
在SALB实验的最后结果的脂质浓度的影响也检查在更宽的脂质浓度范围(0.01至5mg / ml)和在不同的有机溶剂(异丙醇,乙醇和正丙醇)。的Δf和对应于SALB过程中的最后一步ΔD取值 示于图5。
我们定义双层形成基于-25和-30赫兹和小于0.5×10 -6,分别之间最终的变化频率和能量耗散。根据这些标准,最佳脂质浓度范围,以形成一个支持的脂质双层被确定为在0.1和0.5mg/毫升很大程度上独立的有机溶剂的类型。在所获取的Δf和ΔD中的偏差偏移的上述范围以外是由于附加质量(例如,双层叠层),的非双层形貌的发生(例如,水疱,蠕虫状胶束)的存在,和零散双层岛与整个基板不完整的形态存在。
而SALB过程来得到支持的脂双层是比较稳健的,高品质的双层形成的最佳脂质浓度可能需要调谐取决于具体的实验配置。基本上,存在不仅是一个最小的脂质浓度,但也需要经由SALB方法最佳双层形成一个最大的脂质浓度。最佳浓度范围取决于流速和可能也受基板和脂质组合物。根据经验,在许多情况下,我们有found即0.5毫克/毫升和100微升的流速的脂质浓度/ min是用于均质支持的脂质双层的形成条件的最佳集合。然而,根据不同的脂类组合物和流动池几何后者影响期间脂质浓度的溶剂交换进一步优化流动轮廓可能是必要的。因此,我们建议您使用0.5毫克/毫升脂浓度和评价使用QCM-D或荧光显微镜技术的双层质量进行试点SALB实验。如果双层出现不完整的,则所述脂质浓度应在10%的递增增加,直到满意的成果得以实现。如果该双层似乎具有附加脂质结构共存,则脂质浓度应在10%的递增下降,直至满意的疗效得以实现。
支持的脂质双层与各种脂质组合物以及d的制造ifferent胆固醇分数。
接着,SALB和VF方法被采用,以形成胆固醇-富集的SLBs;图6示出了包含胆固醇编写的SALB方法支持膜的代表性荧光图像(100×100微米)。这种膜由通过特征的统一的荧光亮度的连续相包围的圆形染料排除在外域。暗域面积的增加而增加胆固醇分数前体脂质混合物。接着,FRAP测量为了检查脂质双层膜的流动性被执行。该FRAP测量显示在周围阶段几乎完全荧光恢复,说明脂质的横向流动,从而形成一个单一的脂质双层的。由于的Rh-PE隔板优先进入流体相,暗域最有可能由密集的胆固醇丰富的结构。
为了比较,使用VF方法DOPC /胆固醇双层膜的制造还尝试。 DOPC泡囊随着胆固醇部分(10 - 40摩尔%),制备囊泡挤出方法。的Rh-PE脂质(0.5重量%)用作荧光标记进行成像。 图7示出在玻璃基板与含有胆固醇的囊泡的孵化产生结构的代表性荧光图像(100×100微米)。 FRAP分析表明使用含有20摩尔%澈或更少囊泡的流体脂质双层的形成。然而,样品制备用囊泡具有更高胆固醇馏分并没有表现出恢复,这表明吸附的但是未破裂囊泡的存在。
胆固醇将其最终掺入支持脂质双层的馏分量化为胆固醇馏分已被包括在该前体唇的函数的id混合物在SALB方法或在音频方法水溶液囊泡有机溶剂。使用QCM-D技术,双层形式进行了监测,然后MβCD加入以专门从支持的脂质双层32提取澈。质量损失由于除去胆固醇导致了频移的绝对值减少与SLB关联(| |&Delta F)。所造成的MβCD处理步骤的相对正频移示于图8A。胆固醇的摩尔分数基础上的频移进行了计算,如在图8B呈现。
掺入编写的SALB方法支持的脂质双层中的胆固醇百分率为几乎线性正比于前体的脂质混合物中的胆固醇含量。有趣的是,编写的VF方法在双层的胆固醇部分(小泡含至多20摩尔%澈)比包含在前体囊泡低得多。事实上,胆固醇通过VF方法得到的最高分数仅约为10摩尔%。
条纹上层建筑中胆固醇的磷脂的β两相共存区域观察支持的脂质双层。
SALB实验使用的脂质混合物与胆固醇的一个更高的级分进一步进行。当4:使用DOPC和胆固醇的混合物6,均匀的液相逐渐分层成两个共存相形象化为在黑暗(染料不含)背景明亮的条形结构域观察到(图9)。经确定的Rh-PE被排除富含胆固醇的结构域33,并因此而出现作为背景的主导暗域是胆固醇富集区域。微米大小的亮域在一个黑暗的背景,在形成喜GH胆固醇级分(> 50摩尔%)是具有在胆固醇/磷脂的混合物34,35单层相图的β区一致。此外,条纹的域,从弱线张力而出现的形成,表明混合物接近混溶性临界点。

图1.微流控室SALB形成一个合适的配置荧光显微镜。(一)商业微流控室,(B)附着于室的粘合面玻璃盖玻片,(C)完成安装与管显微镜支架连接成腔室的入口和出口, 和 (D)蠕动泵用于控制溶剂交换的速率。脂质溶解在异丙醇注入测量chamb呃与蠕动泵的帮助。 请点击此处查看该图的放大版本。
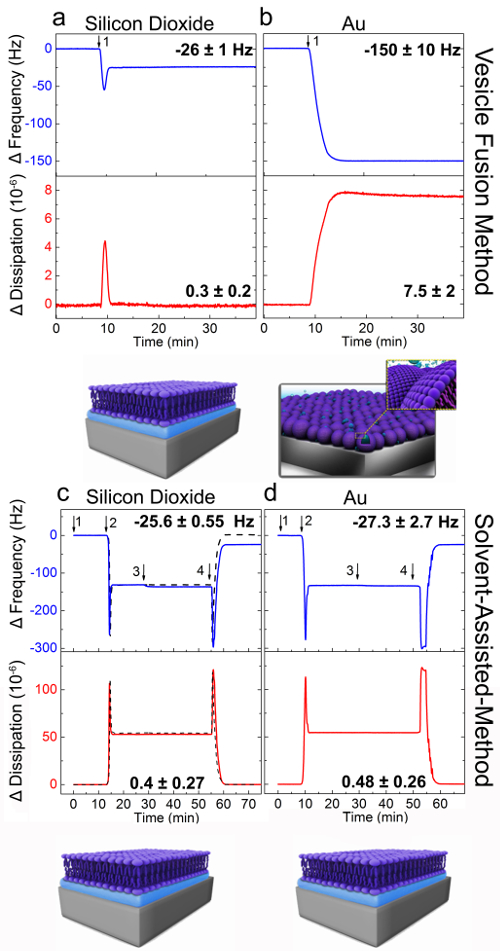
的囊泡融合和SALB实验上的二氧化硅和金基板图2的QCM-D分析。QCM-D频率(ΔF,蓝色)和耗散用于第三谐波(ΔD,红色)反应(N = 3)记录为一个时间在脂质吸附(A和C)二氧化硅,(B和D),黄金的功能。板a和b给出的囊泡融合方法。 DOPC脂质囊泡在 t = 10分钟注射(箭头1)。板c和d对应SALB形成方法。箭头指示在注射缓冲液(1),异丙醇(2),脂质混合物[0.5毫克/毫升DOPC在异丙醇脂质; (3)]和浅黄色呃交易所(4)。在面板B中的虚线曲线对应于一个控制实验,其中脂质不注入。指定ΔF与△D的每个表面的最终值。这些原理图给出建议组装脂质结构从最终的频率和功耗的变化推断。从参考24改编,并与美国化学协会的许可使用。 请点击此处查看该图的放大版本。
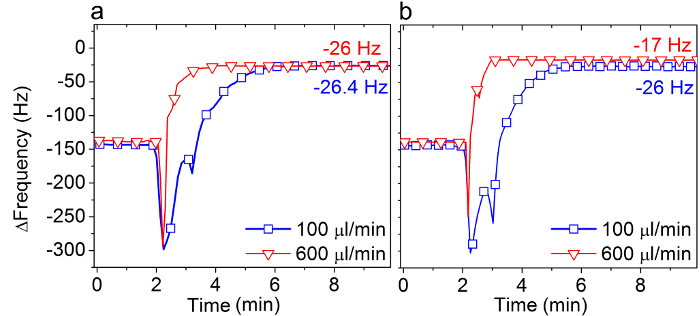
图上的SALB形成过程中的溶剂汇率3.影响 。 QCM-D的频率偏移(ΔF)对应于最终的步骤(见箭头4在图2C)在SALB法以两种不同的汇率,100和600微升/分钟,U上测量二氧化硅唱(A)中为0.5mg / ml和异丙醇(B)的 0.125毫克/毫升DOPC脂质。最终ΔF值也指定相比,在水性缓冲溶液中的测量基准。从参考24改编,并与美国化学协会的许可使用。 请点击此处查看该图的放大版本。
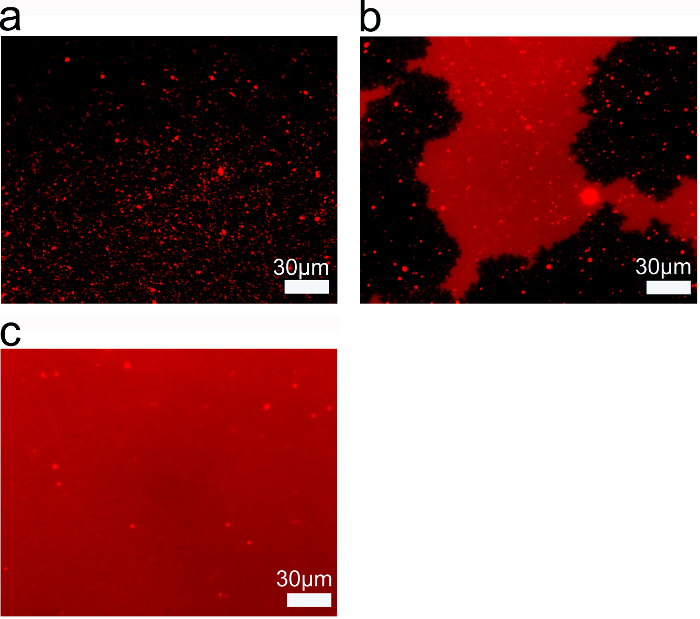
图4.阈值脂浓度的完整的二级行政边界形成的使用(A)0.05毫克/毫升制备SALB二氧化硅脂质层荧光显微镜。 (B)的0.1毫克/毫升; 和 (C)0.25毫克/毫升脂质浓度。从参考26适于和与美国化学学会的授权使用。/files/ftp_upload/53073/53073fig4large.jpg"目标="_空白">点击此处查看该图的放大版本。
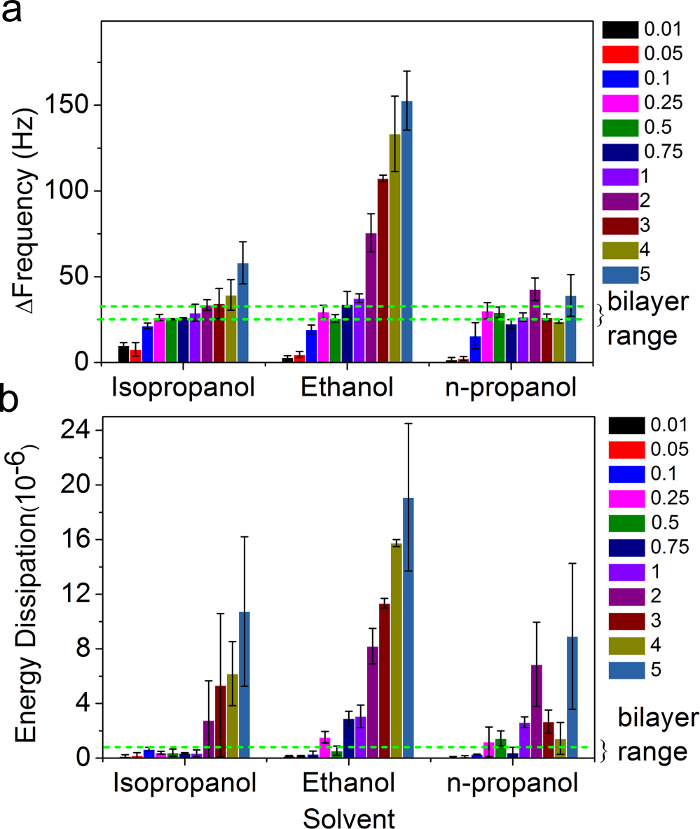
由SALB方法图5.影响脂质浓度和上支持的脂质双层形成的有机溶剂。在QCM-D中的最后的变化(A)的频率和 (B)消能使用各种有机溶剂SALB实验,作为脂质的函数浓度。虚线绿线对应于预期的频率和耗散移的完整双层(-30赫兹<ΔF<-25赫兹和ΔD<1×10 -6)。从参考26改编,并与美国化学协会的许可使用。 请点击此处查看该网络的放大版本古尔。

漂白支持的脂质双层的分析具有不同胆固醇制备在玻璃基板上的方法SALB馏分之后,图6的荧光恢复 。双层的(AE)荧光显微照片使用各种胆固醇馏分中前体混合物制备。图像进行漂白后立即(上)和1分钟(中)记录下来。在图像中心的暗斑对应于光漂白区域。该比例尺为20微米。每个样品中的单独的染料排除结构域的表面积直方图还提出(底部)。从参考36改编,并与美国化学协会的许可使用。 请点击此处查看该图的放大版本。
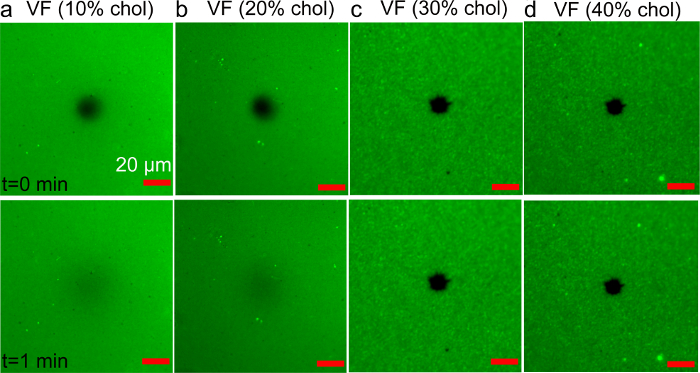
图含胆固醇编写的囊泡融合方法支持双层7. FRAP分析 。双层的(AD)的荧光显微照片使用各种胆固醇部分(10〜40摩尔%)中制备,在该前体囊泡。图像进行漂白后立即(上)和1分钟(底部)记录。在图像中心的暗斑对应于光漂白区域。该比例尺为20微米。从参考36改编,并与美国化学协会的许可使用。 请点击此处查看该图的放大版本。
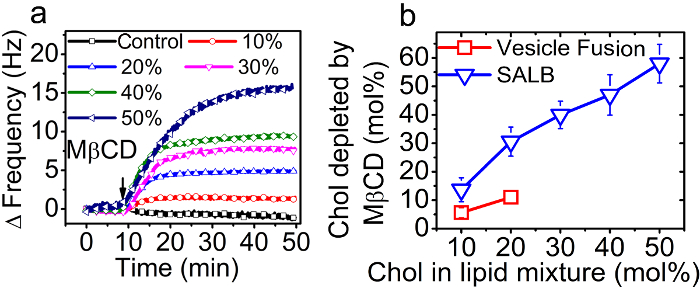
图8.曲胆固醇部分的支持脂双层antification。 (A)中的阳性QCM-D频移注射后的1毫MβCD到所支持的脂质双层具有不同的胆固醇的摩尔分数中的前体混合物(在0和50摩尔%)。 (B)的胆固醇从编写的SALB和囊泡融合方法作为前体的混合物或囊泡的胆固醇分数的函数的双层耗尽的摩尔%。从参考36改编,并与美国化学协会的许可使用。 请点击此处查看该图的放大版本。

6摩尔比CONTA:荧光显微结构的DOPC /胆固醇(4支持双层图9.时间依赖演变进不去0.5%罗丹明-PE)编写的SALB方法。均匀相逐渐相分离成在完整的溶剂交换的液-液共存区域。从参考37改编,并与美国化学协会的许可使用。 请点击此处查看该图的放大版本。
讨论
在这项工作中,溶剂交换协议被提出,其中脂类在醇(异丙醇,乙醇或正丙醇)温育与固体载体上,然后将醇逐渐取代用含水缓冲溶液中,以驱动一系列相变的最终生产层状相脂质双层24。它表明,该方法使得能够支持的脂质双层的制造在表面上,例如金,它是顽固性的囊泡融合方法。
最佳的脂质浓度范围(0.1 - 0.5毫克/毫升)已被确定为完整双层形成在标准实验格式测试迄今。在低于0.1毫克/毫升,离散的,微观双层的补丁血脂浓度而形成的。另一方面,在浓度高于0.1毫克/毫升和低于0.5毫克/毫升,一个完整而均匀的双层形成。在高于该范围血脂浓度,流体双层仍形成为的核查通过FRAP分析编,但是,荧光显微镜揭示的额外脂质结构上该双层的顶部的存在。引人注目的是,这些附加的脂质结构的形态,如由QCM-D分析确定,取决于在其上在培养步骤中使用的醇。在乙醇的情况下,相对高的Δf和Δð移类似于用于吸附囊泡层得到的QCM-D签名。当异丙醇或正丙醇代替所使用的,Δτf为比预期的双层(-30至-40赫兹最终ΔF)的值略高,而ΔD为相当高的。这样的QCM-D响应将预期用于扩展脂质结构(例如,蠕虫状胶束)从膜表面向外突出(如通过在某些情况下,荧光显微镜可见)。
溶剂交换的速率可以是临界的另一个重要参数,ESPECially当低血脂浓度( 例如,0.1毫克/毫升)使用。在低浓度的脂质快速溶剂交换可导致不完全的双层的形成。在用于本文的QCM-D测量(Q-感E4测量室),约100微升/分钟的流速的标准测量室,均适宜高度可重复的完整双层形成。对于流细胞与其他的几何形状和体积,最佳流速可以变化,并且基于本文提出的步骤必须根据经验确定。
除了形成支持的脂质双层上的表面是难治到囊泡融合,所述SALB可以被用来规避需要脂质囊泡可破裂,从而打开门支持膜具有复杂的组合物的制造。作为说明性实例组合物,与胆甾醇的高分数的脂质的混合物进行了研究。胆固醇是mamm的重要组成部分阿莲细胞膜,它的分数可能接近45-50%(摩尔)的膜脂组成(如红细胞)。因此,脂质双层的代表人体细胞膜即使一个简单的模型应该包括胆固醇。
而小泡的融合可以用于制造仅含有10-15%的胆固醇的流体脂质双层,该SALB方法能够形成含胆固醇的高分数的流体脂质双层(高达57%(摩尔),作为量化的QCM-D测量)36。但是,当胆甾醇的水平进一步升高(最多63摩尔%),条纹形状结构域观察到37。共存的结构域是液体,使人联想起在空气 - 水界面中的β区观察到胆固醇/磷脂单层的相图。
总体而言,SALB方法证明是一种简单而有效的方法,以形成支持的脂质双层,尤其是我n个个案超出常规的囊泡融合方法的范围。迄今为止,QCM-D技术和荧光显微镜主要用来表征由SALB方法形成的支持的脂质双层。展望未来,范围广泛的表面敏感分析测量技术,包括表面等离子共振(SPR)38,原子力显微镜(AFM)39,40,傅立叶变换红外光谱41,X射线42和中子反射率43,可以可用于进一步表征和研究简单和复杂的双层结构准备由SALB方法。这些新兴的功能,打开大门,更多的科学家谁可以采取一个简单而强大的实验方案的优势,探索人工细胞膜。
披露声明
The authors have no competing financial interests to disclose.
致谢
作者们希望从国家研究基金会(NRF -NRFF2011-01和NRF2015NRF-POC0001-19),国家医学研究理事会(NMRC / CBRG / 0005/2012),和南洋理工大学NJC感谢支持
材料
| Name | Company | Catalog Number | Comments |
| QCM-D silicon dioxide-coated substrates | QSense AB, Sweden | ||
| QCM-D gold-coated substrates | QSense AB, Sweden | ||
| Q-Sense E4 module | QSense AB, Sweden | ||
| Plasma Cleaner, PDC-32G | Harrick Plasma, Ithaca, NY | PDC-001 (115V) | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375P | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (ammonium salt) (Rh-PE) | Avanti Polar Lipids | 810150P | |
| cholesterol | Avanti Polar Lipids | 700000P | |
| Methyl-β-cyclodextrin | Sigma | C4555 | |
| Isopropanol | Sigma | 673773 | |
| Ethanol | Sigma | 459844 | |
| n-propanol | Sigma | 279544 | |
| Sticky-Slide I 0.1 Luer | IBIDI | 81128 | |
| Male elbow 1/8” | Cole-Parmer | 30505-70 | |
| Silicon tubing 1.6 mm ID | IBIDI | 10842 | |
| Glass coverslip No. 1.5H, 25 mm x 75 mm | IBIDI | 10812 | |
| Reglo Digital M2-2/12 Peristaltic Pump | Ismatec | ||
| Sodium dodecyl sulfate | Sigma | 71725 |
参考文献
- Sackmann, E. Supported membranes: Scientific and practical applications. Science. 271, 43-48 (1996).
- Kraft, M. L., Weber, P. K., Longo, M. L., Hutcheon, I. D., Boxer, S. G. Phase separation of lipid membranes analyzed with high-resolution secondary ion mass spectrometry. Science. 313, 1948-1951 (2006).
- Kalb, E., Engel, J., Tamm, L. K. Binding of proteins to specific target sites in membranes measured by total internal reflection fluorescence microscopy. Biochemistry. 29, 1607-1613 (1990).
- Bally, M., et al. Norovirus GII. 4 Virus-like Particles Recognize Galactosylceramides in Domains of Planar Supported Lipid Bilayers. Angewandte Chemie International Edition. 51, 12020-12024 (2012).
- Bally, M., Graule, M., Parra, F., Larson, G., Höök, F. A virus biosensor with single virus-particle sensitivity based on fluorescent vesicle labels and equilibrium fluctuation analysis. Biointerphases. 8, 10-1186 (2013).
- Groves, J. T., Dustin, M. L. Supported planar bilayers in studies on immune cell adhesion and communication. Journal of Immunological Methods. 278, 10-1016 .
- Mager, M. D., Melosh, N. A. Lipid Bilayer Deposition and Patterning via Air Bubble Collapse. Langmuir. 23, 9369-9377 (2007).
- Lenhert, S., Sun, P., Wang, Y., Fuchs, H., Mirkin, C. A. Massively Parallel Dip-Pen Nanolithography of Heterogeneous Supported Phospholipid Multilayer Patterns. Small. 3, 71-75 (2007).
- Mennicke, U., Salditt, T. Preparation of solid-supported lipid bilayers by spin-coating. Langmuir. 18, 8172-8177 (2002).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophysical Journal. 47, 105-113 (1985).
- Kalb, E., Frey, S., Tamm, L. K. Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers. Biochim Biophys Acta. 1103, 307-316 (1992).
- Reimhult, E., Höök, F., Kasemo, B. Intact vesicle adsorption and supported biomembrane formation from vesicles in solution: influence of surface chemistry, vesicle size, temperature, and osmotic pressure. Langmuir. 19, 1681-1691 (2003).
- Cho, N. -. J., Jackman, J. A., Liu, M., Frank, C. W. pH-Driven assembly of various supported lipid platforms: A comparative study on silicon oxide and titanium oxide. Langmuir. 27, 3739-3748 (2011).
- Boudard, S., Seantier, B., Breffa, C., Decher, G., Felix, O. Controlling the pathway of formation of supported lipid bilayers of DMPC by varying the sodium chloride concentration. Thin Solid Films. , 495-4246 (2006).
- Stanglmaier, S., et al. Asymmetric distribution of anionic phospholipids in supported lipid bilayers. Langmuir. 28, 10818-10821 (2012).
- Jackman, J. A., Choi, J. -. H., Zhdanov, V. P., Cho, N. -. J. Influence of osmotic pressure on adhesion of lipid vesicles to solid supports. Langmuir. 29, 11375-11384 (2013).
- Rossetti, F. F., Bally, M., Michel, R., Textor, M., Reviakine, I. Interactions between titanium dioxide and phosphatidyl serine-containing liposomes: formation and patterning of supported phospholipid bilayers on the surface of a medically relevant material. Langmuir. 21, 6443-6450 (1021).
- Cho, N. -. J., Cho, S. -. J., Cheong, K. H., Glenn, J. S., Frank, C. W. Employing an amphipathic viral peptide to create a lipid bilayer on Au and TiO2. Journal of the American Chemical Society. 129, 10050-10051 (2007).
- Hardy, G. J., et al. Biomimetic supported lipid bilayers with high cholesterol content formed by [small alpha]-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22, 19506-19513 (2012).
- Wallin, M., Choi, J. -. H., Kim, S. O., Cho, N. -. J., Andersson, M. Peptide-induced formation of a tethered lipid bilayer membrane on mesoporous silica. European Biophysics Journal. , 1-10 (2014).
- Coutable, A., et al. Preparation of tethered-lipid bilayers on gold surfaces for the incorporation of integral membrane proteins synthesized by cell-free expression. Langmuir. 30, 3132-3141 (2014).
- Zan, G. H., Jackman, J. A., Cho, N. -. J. AH peptide-mediated formation of charged planar lipid bilayers. The Journal of Physical Chemistry B. 118, 3616-3621 (2014).
- Jackman, J. A., Zhao, Z., Zhdanov, V. P., Frank, C. W., Cho, N. -. J. Vesicle adhesion and rupture on silicon oxide: Influence of freeze–thaw pretreatment. Langmuir. 30, 2152-2160 (2014).
- Tabaei, S. R., Choi, J. -. H., Haw Zan, ., Zhdanov, G., P, V., Cho, N. -. J. Solvent-Assisted Lipid Bilayer Formation on Silicon Dioxide and Gold. Langmuir. 30, 10363-10373 (2014).
- Hohner, A., David, M., Rädlera, J. Controlled solvent-exchange deposition of phospholipid membranes onto solid surfaces. Biointerphases. 5, 1-8 (2010).
- Tabaei, S. R., Jackman, J. A., Kim, S. -. O., Zhdanov, V. P., Cho, N. -. J. Solvent-Assisted Lipid Self-Assembly at Hydrophilic Surfaces: Factors Influencing the Formation of Supported Membranes. Langmuir. 31, 3125-3134 (2015).
- Tabaei, S. R., Vafaei, S., Cho, N. -. J. Fabrication of Charged Membranes by the Solvent-Assisted Lipid Bilayer (SALB) Formation. Method on SiO2 and Al2O3. Physical Chemistry Chemical Physics., doi:10.1039/C5CP01428J. , (2015).
- Jackman, J. A., Tabaei, S. R., Zhao, Z., Yorulmaz, S., Cho, N. -. J. Self-Assembly Formation of Lipid Bilayer. Coatings on Bare Aluminum Oxide: Overcoming the Force of Interfacial Water. ACS Applied Materials & Interfaces. 7, 959-968 (2015).
- Keller, C., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Sundh, M., Svedhem, S., Sutherland, D. S. Influence of phase separating lipids on supported lipid bilayer formation at SiO2 surfaces. Physical Chemistry Chemical Physics. 12, 453-460 (2010).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature Protocols. 5, 1096-1106 (2010).
- Beseničar, M. P., Bavdek, A., Kladnik, A., Maček, P., Anderluh, G. Kinetics of cholesterol extraction from lipid membranes by methyl-β-cyclodextrin—A surface plasmon resonance approach. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1778, 175-184 (2008).
- Pedersen, S., Jørgensen, K., Baekmark, T. R., Mouritsen, O. G. Indirect evidence for lipid-domain formation in the transition region of phospholipid bilayers by two-probe fluorescence energy transfer. Biophysical journal. 71, 554-560 (1996).
- Okonogi, T., McConnell, H. Contrast inversion in the epifluorescence of cholesterol-phospholipid monolayers. Biophysical Journal. 86, 880-890 (2004).
- McConnell, H. M., Radhakrishnan, A. Condensed complexes of cholesterol and phospholipids. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1610, 159-173 (2003).
- Tabaei, S. R., et al. Formation of Cholesterol-Rich Supported Membranes Using Solvent-Assisted Lipid Self-Assembly. Langmuir. 30, 13345-13352 (2014).
- Tabaei, S. R., Jackman, J. A., Liedberg, B., Parikh, A. N., Cho, N. -. J. Observation of Stripe Superstructure in the β-Two-Phase Coexistence Region of Cholesterol–Phospholipid Mixtures in Supported Membranes. Journal of the American Chemical Society. 136, 16962-16965 (2014).
- Salamon, Z., Wang, Y., Tollin, G., Macleod, H. A. Assembly and molecular organization of self-assembled lipid bilayers on solid substrates monitored by surface plasmon resonance spectroscopy. Biochimica et Biophysica Acta (BBA)-Biomembranes. , 1195-11267 (1994).
- Yuan, C., Johnston, L. Phase evolution in cholesterol/DPPC monolayers: atomic force microscopy and near field scanning optical microscopy studies. Journal of microscopy. 205, 136-146 (2002).
- Schneider, J., Dufrêne, Y. F., Barger, W. R., Lee, G. U. Atomic force microscope image contrast mechanisms on supported lipid bilayers. Biophysical Journal. 79, 1107-1118 (2000).
- Tamm, L. K., Tatulian, S. A. Infrared spectroscopy of proteins and peptides in lipid bilayers. Quarterly reviews of biophysics. 30, 365-429 (1997).
- Miller, C. E., Majewski, J., Gog, T., Kuhl, T. L. Characterization of biological thin films at the solid-liquid interface by X-ray reflectivity. Physical Review Letters. 94, 238104 (2005).
- Koenig, B. W., et al. Neutron reflectivity and atomic force microscopy studies of a lipid bilayer in water adsorbed to the surface of a silicon single crystal. Langmuir. 12, 1343-1350 (1996).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。