Method Article
溶剤アシスト脂質二重(SALB)法による生体膜の作製
要約
私たちは、脂質小胞を使用せずに、固体基板上にサポートされている脂質二重層を形成するための実験プロトコルを提示します。我々は、様々な生物学的用途のためのコレステロールに富むドメインと脂質二酸化ケイ素と金の二重層と同様に支持された膜を形成するために、一段階法を示しています。
要約
細胞膜を模倣するためには、サポートされている脂質二重層(SLB)は、固体基材に生体適合性および生物機能性を付与しながら、膜関連プロセスの in vitroでの調査に有効に魅力的なプラットフォームです。リン脂質小胞の自発的な吸着と破裂はのSLBを形成するための最も一般的に使用される方法です。しかし、生理的条件下で、小胞融合(VF)は、脂質組成物および固体支持体のサブセットのみに限定されます。ここでは、小胞を必要としないのSLBを形成するために、溶剤支援脂質二重層(SALB)の形成法と呼ばれるワンステップの一般的な手順を説明します。 SALB方法は、水混和性有機溶媒 (例えば、イソプロパノール)とSLBの形成を誘発するために、水性緩衝液とのその後の溶媒交換の存在下で固体表面上に脂質分子の堆積を伴います。連続溶媒交換ステップはのアプリケーションを可能にします表面感受性バイオセンサーの広い範囲を使用して、二重層の形成とその後の変化を監視するのに適したフロースルー構成の方法。 SALB方法は、小胞融合に難治性であるものを含む疎水性固体表面の広い範囲でのSLBを製造するために使用することができます。また、ベシクル融合法を用いて調製することができない脂質組成物からなるのSLBの製造を可能にします。ここで、我々は2つの例示的な親水性表面、二酸化ケイ素と金のSALBと従来のベシクル融合法を用いて得られた結果を比較します。 SALB方法により調製高品質の二重層を調製するための実験条件を最適化するために、成膜工程における有機溶媒の種類などの様々なパラメータの効果は、溶媒交換の速度、および脂質濃度は、トラブルシューティングのヒントと一緒に説明されています。コレステロールの高い画分を含む支持された膜の形成も悪魔です膜構成の広い範囲のためのSALB技術の技術的能力を強調し、SALB方法でtrated。
概要
固体サポート脂質二重層1(SLB)は、二層の厚さ、二次元脂質拡散率、および膜関連生体分子をホストする機能として、生体膜の基本的な特性を保持する汎用性の高いプラットフォームです。 、天然の細胞膜の複雑さのために、この単純なプラットフォームは、ラフト形成2、4,5結合タンパク質結合3、ウイルスおよびウイルス様粒子のような膜関連プロセスの in vitro研究のための効率的なプラットフォームとして機能することが示されています、およびセル6シグナリング 。固体支持体に近接して形成され、SLBプラットフォームは、内部全反射顕微鏡(TIRF)、水晶振動子マイクロ散逸(QCM-D)、及びインピーダンス分光法のような表面に敏感な測定技術の範囲と互換性があります。
いくつかの方法は、気泡を含む、のSLBの異なるタイプを生成するために開発されていますサブミクロンサイズの脂質スポットのための崩壊7およびディップペンナノリソグラフィー8、スピンコーティング二重層スタックとラングミュア-ブロジェット(LB)10とフルスパン、単一の脂質二重層コーティングのための小胞融合(VF)11のために9。 VFの方法は、連続的な脂質二重層を形成するために、固体支持体とその後の自発的破裂および融合に小型単層小胞の吸着で構成されています。しかし、生理的条件下で、自発的な小胞の破壊は、主として二酸化ケイ素、ガラス、マイカなどのシリコン系材料に限定されています。また、小胞の破裂は、コレステロールまたは負に帯電した脂質の高い画分を含むもののような複雑な脂質組成物の小胞のために自然に発生しません。システムに応じて、小胞の破裂は、さらに、温度12、溶液pH 13、及び塩分14、浸透圧ショック15の実験条件を調整することによって誘導することができます16、または例えばCa 2+などの二価イオンの添加アップ>または17あるいは、膜活性AHペプチドはの範囲に小胞の破裂および二重層の形成につながる、吸着された小胞の膜を不安定化するために導入することができます表面18-22。
また、成功した二層の形成は、時間がかかり、特定の膜組成物を達成するのは困難であることができる、小さな単層小胞のよく制御集団の調製を必要とします。したがって、最適なケースでは、その高い効率にもかかわらず(例えば、小胞23の大規模な凍結融解の前処理後)、小胞の融合の一般的なアプリケーションは、適切な基板と膜の組成物の範囲によって制限されます。
溶剤補助脂質二重層(SALB)メソッド24-28脂質小胞を必要としない代替製造技術です。この方法は、堆積Oに基づいていますSLBの形成を誘発するために、水性緩衝溶液と、この溶媒の段階的な交換に続いて水混和性有機溶媒の存在下で固体表面へのF脂質分子。溶媒交換工程中に、脂質、有機溶媒、及び水の三成分混合物は、固体基板上にバルク溶液とSLBにおけるラメラ相構造の形成をもたらす増大水画分と直列の相転移を受けます。重要なことは、この自己組織化ルートは通常のSLBに吸着された小胞の形質転換のための律速段階である小胞の破裂、の必要性を回避します。プロトコルは、二酸化ケイ素、酸化アルミニウム、クロム、インジウムスズ酸化物、金を含む多種多様な表面に適用可能です。本稿でおよび添付のビデオで、SALBとベシクル融合法による脂質沈着の比較が示されています。特に、実験パラメータの影響を含む脂質濃度、流速、及びSALB法により形成された二層の品質に水混和性有機溶媒の選択は、説明されています。作製のSLBの分析的特徴付けは、(FRAP)技術を光退色後QCM-D、蛍光顕微鏡、蛍光回復することによって行われます。 QCM-Dの監視はケラーとKasemo 29によって行わ先駆的研究以来、広く定量的二重層の形成を研究するために使用されている、表面に敏感な質量測定法です。蛍光顕微鏡は、膜の均一性の検査だけでなく、膜ドメインの可視化を可能にします。 FRAP技術は、流体膜の本質的な特性であるSLB、中の脂質分子の横方向の移動性を決定するための標準的なツールです。
この研究の最初の部分は、二酸化ケイ素と金に二重層形成を試みるように適用SALBとベシクル融合法のQCM-Dの分析を含みます。第二部では、SALB方法でコレステロール濃度の範囲を含むサポートされている膜の調製および特性が示されており、その結果は、小胞融合法によって得られたものと比較します。
プロトコル
親水性固体支持体上に支持された脂質二重層の形成1。
- 10 mg / mlの1,2- dioleoyl- SN -glycero -3-ホスホコリンの脂質ストック溶液を準備します(DOPC)および1 mg / mlの1,2- dioleoyl- SN -glycero-3-phosphoethanolamine- N - (リサミンローダミンBそれぞれの脂質粉末を溶解することによりスルホニル)ロジウム(Rh-PE)は、(適切にイソプロパノール溶液中の分析物質収支)を事前に秤量しました。
- 希釈し、最終濃度で、所望の脂質混合物を調製するために、イソプロパノール中ストック溶液を混合します。蛍光顕微鏡およびFRAP実験のために、0.5重量%のRh-PE脂質混合物中に含まれるべきです。
- それが満たされるまで、マイクロ流体チャネル内に、イソプロパノール中の脂質混合物を注入します。
- 約10分間、ガラス表面上の脂質混合物をインキュベートします。
- 徐々に非常に低い流量で、蠕動ポンプを用いて水または緩衝溶液と脂質溶液を交換(10〜50μL/分)。また、ピペッティングを繰り返すことにより、脂質混合物を交換してください。
- 残留イソプロパノールを除去するために過剰の緩衝液で徹底的にチャンネルを洗い流します。
コレステロールに富む支持された膜の形成2。
注:固体表面(SiO 2)が小胞の融合をサポートしていますが、コレステロールに富む小胞は、高剛性30を曲げているため、膜組成物(高コレステロール)は、小胞融合を阻害します。
- まずイソプロパノールで各粉末を溶解させて10 mg / mlのDOPCの脂質、10 mg / mlのコレステロール、および1mg / mlでのRh-PEを含むストック溶液を調製します。
- 繰り返しは、ステップ2.1で調製したストック溶液を使用して、1.2から1.6を繰り返します。
3.膜流動性アッセイ
- 10分間のドデシル硫酸ナトリウム(SDS)溶液(1%)でガラススライドを浸します。
- 脱イオン水で十分にスライドを洗浄し、ウィットをすすぎますHエタノール。
- ブロー乾燥窒素の穏やかな流れを使用してスライドを。
- 酸素プラズマチャンバ内で最大の高周波電力で30秒間酸素プラズマにスライドを露出させます。
- ピンセットを使用して、底なしの商用マイクロ流体チャンバー( 図1A)の保護フィルムコーティングを外し、チャンバー( 図1B)の粘着面上にスライドガラスを取り付けます。
- チャンバーの入口と出口の位置にコネクタとチューブを組み立て、顕微鏡ステージ( 図1C)にマイクロ流体チャネルを配置します。
- 蛍光標識されたフォームは、マイクロ流体チャネルの[希望する脂質組成物の有機溶媒中に0.5重量%のRh-PEを含む( 例えば 、0.5 mg / mlのDOPC)を使用して、手順1を繰り返し]を脂質二重層を支持しました。
- 画像をキャプチャするために、60X油浸対物レンズ(NA 1.49)との二層面の位置を確認します。
- 2つの事前漂白画像を撮影し、フォトブリーチ301; 532 nmで、100 mWのレーザービームで広い円形スポットをメートル。その強度が安定するまで退色する前に、レーザーを温めます。すぐに退色した後、漂白スポットの蛍光強度の回復を追跡するために、2分毎に1秒の一連の画像をキャプチャします。
4.コレステロール定量アッセイ
- 酸素プラズマチャンバ内で最大の高周波電力で30秒間酸素プラズマに二酸化ケイ素でコーティングされた水晶センサーチップを露出します。チャンバーからチップを取り出し、すぐに測定室にチップをマウントします。
- 実験の前に、第一の適切な取り付けを確実にするために、空気中のセンサチップの周波数と損失を取得します。
- 商業Q-センスE1またはE4 QCM-Dの機器については、Q-ソフトのソフトウェアプログラムを実行し、「取得」をクリックして、「セットアップ測定」を選択します。
- 表示される新しいウィンドウでは、3、5、7をご確認ください、9、11、13倍音[検索]をクリックしますと、共鳴スペクトルをチェックするために実行します。 24で温度を設定します °C。一つ以上の共振周波数が期待値と一致していない場合は、チップ実装を確認し、合意に達するまで、この手順を再度実行します。
- 蠕動ポンプを起動し、100μL/分の流速で測定室に(10mMのトリス、150mMのNaCl、pH7.5)に緩衝液を流します。
- ソフトウェアプログラムでは、「取得」をクリックして、共振周波数とエネルギー散逸信号を記録するために、「再起動測定」を選択します。安定したベースラインが周波数と消費のシフトのために取得されるまで、この手順を繰り返します。注:以下の手順については、時間の関数として記録することができ、追加の周波数と消費のシフトが存在することになります。
- 10分間(脂質なし)イソプロパノールを注入します。
- でDOPC脂質/コレステロールとの混合物を注入します10分間イソプロパノール中0.5 mg / mlの総脂質濃度が所望のモル比。
- 100μL/分の流速で20分間のバッファを注入します。
- 周波数信号が安定した値に達するまで緩衝液(流速100μL/分)で調製した1mMのメチルβシクロデキストリン溶液(MβCD)を注入します。
- MβCD処理工程によって引き起こされる相対的な正の周波数シフトを測定し、[量Δm=のSauerbrey式を用いて質量値にΔfのCHOおよび ΔfのDOPCの値を変換することにより、コレステロールおよびDOPCの脂質の質量を計算- (C / N)× Δfを、C = 17.7 NG / cm 2であり、nは:倍音]。
- アカウントにDOPC脂質(786.1グラム/モル)及びコレステロール(386.6グラム/モル)の分子量を取って、SLB中のコレステロールのモル分率を計算します。
結果
親水性基板上にサポートされている脂質二重層の作製。
VFとSALB形成方法は、二酸化ケイ素および金で試行され、形成プロセスは、QCM-D測定技術によりリアルタイムでモニターしました。 QCM-D機器は、結晶の表面上に大量の吸着時の振動圧電水晶の共振周波数の変化(ΔF)を測定します 。また、QCM-D機器は、吸着層の粘弾性特性(剛性、柔軟性)を特徴付けるために振動エネルギーの散逸を測定します。先に説明したように31ベシクル融合実験を行いました。簡単に説明すると、ベースラインは、第一の水性緩衝液[10mMのトリス、150mMのNaCl、pH7.5の周波数と消費電力の信号のために設立されました。 ( 図2AおよびB)〕。次に、同じ緩衝液中の小さな単層DOPC脂質小胞はしていました二酸化ケイ素( 図2A)および金( 図2B)に(矢印1)= 10分トンでjected。二酸化ケイ素の小胞の融合のために、2段階の吸着速度は、-26(±1)Hzから0.3(±0.2)の周波数とエネルギー消費が最終的な変更で観察した10× -それぞれ、6。これらの値は、サポートされている脂質二重層29の形成と一致しています。
図2Bに示すように、それらの値は-150(±10)Hzから(7.5±2)に達するまで、金表面への小胞の溶液の添加は、それぞれ、Δf及びΔDシグナルの同時減少と増加しましたそれぞれ、6から10を×。これらの値は、吸着ベシクル層の形成に対応します。このように、予想されたように、SLBは、ベシクル融合法によって金上に形成されていませんでした。
QCSALB法による二酸化ケイ素および金で二重層を形成するためのMD分析は、 図2CおよびDに示されています。二酸化ケイ素、最終Δfと(0.27±)-25.6(0.55±)Hzから0.4のΔDシフトが 10×で-それぞれ6を達成し、これらの値は、SLBの形成を示しました。 ΔfおよびΔDの同様の範囲(ΔF 金 :-27.3±2.7 Hzで、ΔD 金 :0.48(0.26±)×10から6)は金で観察されました。これらの結果は、SALB法は小胞の破裂を防止する表面上に支持された脂質二重層の形成を可能にすることを支持します。
サポートされている脂質二重層の品質に溶媒交換流量の効果。
高品質のサポート脂質二重層VIの製造のための最適な条件を決定するために、A SALB法、脂質濃度、溶媒の交換レートと有機溶媒の選択の影響を調べました。
二つの異なる流量(100および600μL/分)および2つの異なる脂質濃度(0.125および0.5 mg / mlで)に二酸化ケイ素で実行される図3は 、SALBプロトコルの最後のステップの間QCM-Dの周波数の変化を示しています。
0.5 mg / mlのDOPCの脂質は、( 図3A)を用いた場合、二重層の形成には、流量との両方の流量で得られた約-26ヘルツの最終量Δfずれによる影響を受けませんでした。
対照的に、低い脂質濃度を用いた場合、完全に溶媒交換後の吸着脂質の量が著しく流量( 図3B)によって影響されました。 100μL/分の平均流量で、二層の形成が(-26 Hzの周りΔfの)完了しました。しかし、6倍高い流量で(600μL/分)は、完全な二重層は-17 Hzの周り(Δfの)形成されませんでした。これらの結果は、選択した有機溶媒としてイソプロパノールでSALBメソッドを使用して成功した二層形成のための右の実験条件を選択するための指針を提供しています。
様々なアルコール溶液中の異なる脂質濃度から形成されたサポートされている脂質二重層の特性。
脂質濃度はSALB法を用いて得られるのSLBの品質に影響を与える別のパラメータです。蛍光顕微鏡は、0.05 mg / mlの脂質濃度でのみ単離され、サブ微視的脂質構造は、( 図4A)を形成したことを明らかにしました。 SALB手順において使用される脂質濃度の上昇に伴って、脂質構造の蛍光強度がより均一になります。構造は全体Fをまたがることはありませんでしたが、0.1 mg / mlの脂質濃度では、微細な脂質パッチがありましたビューのield( 図4B)。 0.25 mg / mlの脂質濃度を用いた場合しかし、均質な脂質二重層(図4C)を形成しました。したがって、完全な、完全にまたがるSLBを形成するのに必要な最低限の脂質濃度で存在します。
SALB実験の最終結果に脂質濃度の影響も広い脂質濃度範囲(0.01から5mg / ml)の上に、異なる有機溶媒(イソプロパノール、エタノール、n-プロパノール)で調べました。 ΔfとSALB手順の最後のステップに対応するΔD値は 、図5に示されています。
私たちは、それぞれ-25および-30ヘルツ未満0.5×10 -6との間の周波数とエネルギー消費が最終的な変更に基づいて、二重層形成を定義しました。これらの基準に基づいて、サポートされている脂質二重層を形成する脂質の最適な濃度範囲は、Mg 0.1〜0.5であると決定されました/ mlの有機溶媒の種類に大きく依存。取得ΔfとΔDの偏差が上記範囲外のシフト付加質量(例えば、二層スタック)、非二重層形態の発生(例えば、小胞、ワームのようなミセル)の存在によるもので、基板全体不完全な形態を有する断片化し、二重層の島の存在。
得られた担持脂質二重層にSALB手順は比較的堅牢ですが、高品質の二層形成のための最適な脂質濃度は、具体的な実験構成に応じて調整が必要になる場合があります。基本的には、最小脂質濃度もSALB法による最適な二層の形成に必要な最大の脂質濃度だけでなく、そこにあります。最適な濃度範囲は、流量に依存し、また、基板と脂質組成によって影響されてもよいです。経験的に、多くの場合、我々は、Fを有していますound 0.5 mg / mlとし、100μlの流量の脂質濃度こと/分で均質なサポート脂質二重層の形成のための条件の最適なセットです。しかし、脂質組成物およびフローセルに応じて脂質濃度の溶媒交換、さらに最適化の際に流れプロファイルに影響を与えるのジオメトリ後者が必要になる場合があります。したがって、我々は、0.5 mg / mlの脂質濃度を用いてパイロットSALB実験を行い、QCM-Dまたは蛍光顕微鏡検査法を用いて二層の品質を評価するお勧めします。二重層が不完全表示された場合、良好な結果が達成されるまで、脂質濃度は10%ずつ増やす必要があります。二重層は、追加の脂質構造と共存するために表示された場合、良好な結果が達成されるまで、脂質濃度は10%ずつ減少させるべきです。
様々な脂質組成物およびdのサポート脂質二重層の作製ifferentコレステロール画分。
次に、SALB及びVF方法は、コレステロールに富むのSLBを形成するために使用した。 図6は、SALB方法により調製コレステロール含有担持膜の代表的な蛍光画像(100×100ミクロン)を示す図 。膜は、均一な蛍光輝度によって特徴づけられる連続相に囲まれた円形の色素除外ドメインからなります。暗い領域は、前駆体脂質混合物中のコレステロールの画分の増加と共に地域で増加しました。次に、FRAP測定は、脂質二重層膜の流動性を調べるために行きました。 FRAP測定は、横方向の脂質の移動度および単一脂質二重層の形成を示し、従って、周囲の段階でほぼ完全な蛍光回復を明らかにしました。優先的に液相へのRh-PEパーティションので、暗い領域は最も可能性の高い高密度のコレステロールに富む構造で構成されています。
比較のために、VFの方法を使用してDOPC / Cholの二重層の製造も試みられました。ベシクル押出法により調製された - (40モル%10)、DOPC、コレステロール画分の増加と共に小胞。 Rh-PE脂質(0.5重量%)をイメージングするための蛍光標識として使用した。 図7コレステロール含有小胞とガラス基板のインキュベーション時に作成された構造の代表的な蛍光画像(100×100μm)を示しています。 FRAP分析は、20モル%のChol以下を含んだ小胞を用いて、流体脂質二重層の形成を示しました。しかし、より高いコレステロール画分で小胞を用いて調製されたサンプルは、吸着が、未破裂小胞の存在を示す、回復を示さありませんでした。
最終的にはサポートされている脂質二重層に組み込まれたコレステロールの割合は、前駆体唇に含まれていたコレステロール画分の関数として定量化しましたSALB法やVFの方法で水溶液中のベシクル中の有機溶媒のid混合物。 QCM-D法を用いて、二重層の形成をモニターし、次いで、MβCDは、具体的にサポートされている脂質二重層32からのCholを抽出するために添加しました。 SLBに関連した(| |ΔのF)によるコレステロールの除去に質量損失は、周波数シフトの絶対値の減少につながりました。 MβCD処理工程に起因する相対的な正の周波数シフトは、 図8Aに示されている。図8Bに示されるようコレステロールのモル分率は、周波数シフトに基づいて計算しました。
SALB方法によって作成された支持脂質二重層に組み込まれコレステロール画分は、前駆体脂質混合物中のコレステロール含有量にほぼ直線的に比例しました。興味深いことに、VFの方法により調製二重層におけるコレステロール画分は(小胞まで含みます20モル%のChol)は、前駆体小胞に含まれるよりも実質的に低かったです。実際には、VFの方法により得られたコレステロールの最も高い画分は約10モル%でした。
コレステロールリン脂質のβ二相共存領域でのストライプ上部構造の観察は、脂質二重層を支持しました。
SALB実験はさらに、コレステロールのさらに高い画分と脂質混合物を用いて行きました。 4時:DOPCおよびコレステロールの6混合物を使用した、2共存する相への均一な液相の段階的な脱混合が暗い(色素を除く)背景に明るいストライプ状ドメインとして視覚化した (図9)を観察しました。これは、Rhの-PEはコレステロールリッチドメイン33、ひいては背景として登場優勢な暗いのドメインからコレステロールに富む領域で除外されていることが確立されています。ハイテクで暗い背景上のミクロンサイズの明るいドメインの形成GHコレステロール画分(> 50モル%)、コレステロール/リン脂質の混合物34,35の単層相図におけるβ領域と一致しています。また、弱い線張力に起因するストライプドメインの形成は、混合物が混和性の臨界点付近であることを示唆しています。

落射蛍光顕微鏡に適した構成でSALB形成のために、図1のマイクロ流体室。(A)商業マイクロ流体チャンバー、(B)室の接着面に付着カバーガラス、(C)に接続されたチューブと、顕微鏡ホルダーの完全なセットアップチャンバーの入口および出口ポート、および(D)蠕動ポンプが溶媒交換の速度を制御するために使用されます。イソプロパノールに溶解した脂質は、測定CHAMBに注入されますER蠕動ポンプの助けを借りて。 この図の拡大版をご覧になるにはこちらをクリックしてください。
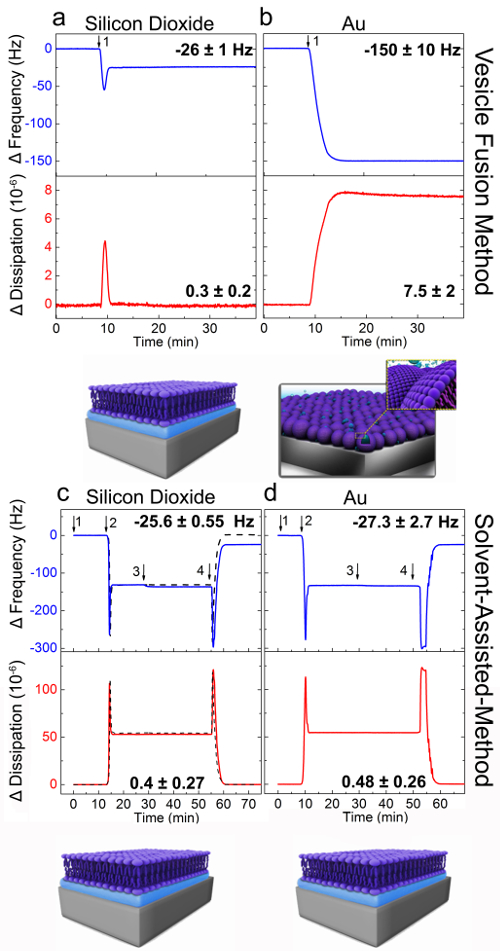
二酸化ケイ素と金基板上の小胞融合とSALB実験の図2 QCM-D分析。QCM-Dの周波数(Δfを、青)と散逸3次オーバートーン用(ΔD、赤)応答(n = 3)をとして記録しました脂質への吸着(A及びC)二酸化ケイ素、(B及びD)金中の時間の関数。パネルAおよびBは、小胞融合法を提示します。 DOPC脂質小胞は、(矢印1)T = 10分で注入しました。パネルCおよびDはSALB形成方法に対応します。矢印(1)、イソプロパノール(2)、脂質混合物[イソプロパノール中0.5 mg / mlのDOPCの脂質バッファーの注入を示します。 (3)]とバフER交換(4)。パネルBにおける破線の曲線は、脂質を注射しなかった対照実験に相当します。各面のためにΔfのとΔDの最終的な値が指定されています。最終的な周波数と消費シフトから推定される回路図は、提案された組み立てられた脂質構造を示しています。参照24から適応し、米国化学会の許可を得て使用していました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
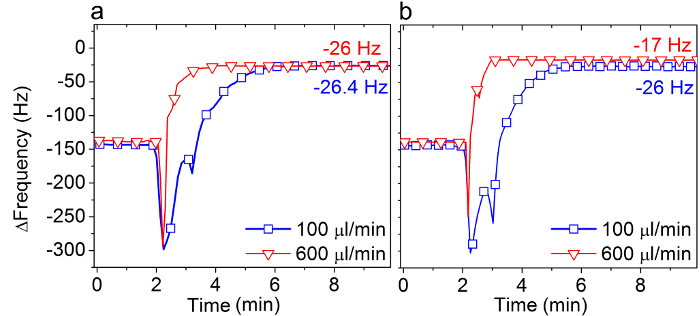
SALB形成プロセスの溶剤為替レートの影響3.図 。 SALB方法でQCM-Dの周波数シフト(Δfの)最後のステップに対応する( 図2Cに矢印4を参照)は、二つの異なる為替レート、100および600μL/ minで、Uで二酸化ケイ素で測定しましたイソプロパノール中の (A)は0.5mg / mlであり、(B)0.125 mg / mlのDOPC脂質を歌います。最終Δfの値は、水性緩衝液中の測定基準値と比較して、指定されています。参照24から適応し、米国化学会の許可を得て使用していました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
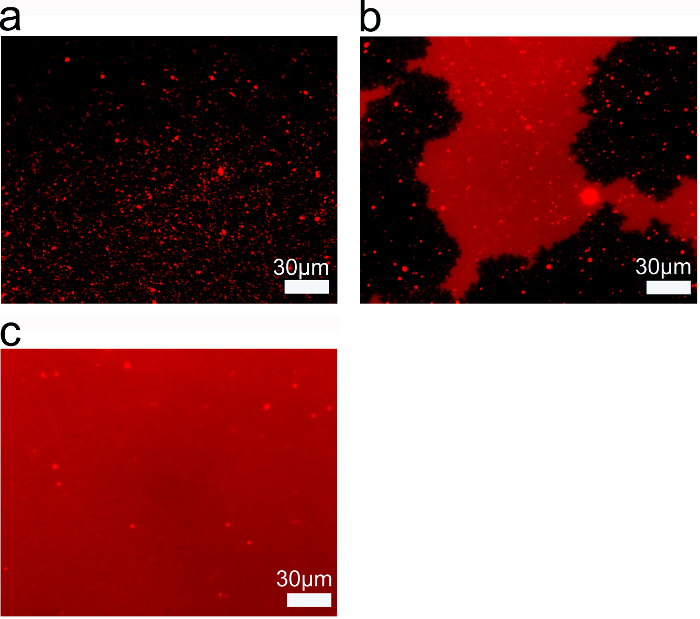
完全SALBの形成のための脂質濃度の図4.しきい値(A)0.05 mg / mlのを使用してSALBにより製造された二酸化ケイ素上の脂質層の落射蛍光顕微鏡。 (B)0.1 mg / mlの、および(C)0.25 mg / mlの脂質濃度。参照26から適応し、米国化学会の許可を得て使用。/files/ftp_upload/53073/53073fig4large.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
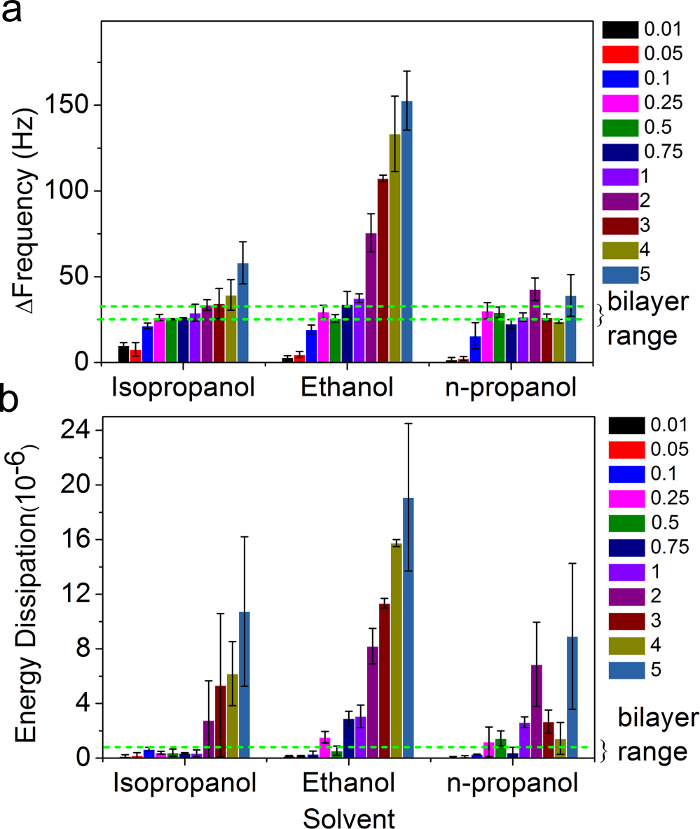
SALB法によってサポートされている脂質二重層形成に脂質濃度と有機溶媒の図5影響。QCM-D(A)は、周波数および種々の有機溶媒を用いてSALB実験用(B)エネルギー散逸の最終変化、脂質の関数として濃度。破線の緑の線は完全な二重層(-30ヘルツ<Δfを<-25 HzからΔD<1×10 -6)に期待される周波数と消費のシフトに対応しています。参照26から適応し、米国化学会の許可を得て使用。 このFiのの拡大版を表示するには、こちらをクリックしてくださいグレ。

ガラス基板上にSALB方法によって調製コレステロールの画分を変化させることで支持脂質二重層の解析を光退色後の図6の蛍光回復 。二重層の(AE)の蛍光顕微鏡写真は、前駆体混合物中の種々のコレステロール分画を用いて調製。画像は、光退色の直後(上)および1分間(中間)を記録しました。画像中心にあるダークスポットは退色領域に相当します。スケールバーは20μmです。各サンプル内の個々の染料除外領域の面積のヒストグラムは、(底部)を提示します。参照36から適応し、米国化学会の許可を得て使用していました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
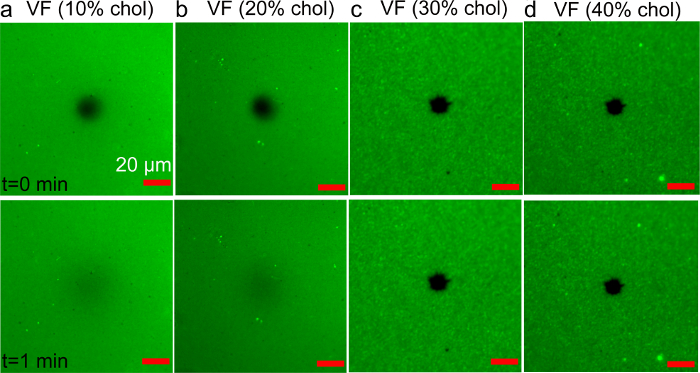
ベシクル融合法により調製したコレステロール含有担持二重層の図7 FRAP分析 。二重層の(AD)の蛍光顕微鏡写真は、前駆体小胞において、様々なコレステロール画分(10〜40モル%)を用いて調製。画像は、光退色の直後(上)および1分間(下)を記録しました。画像中心にあるダークスポットは退色領域に相当します。スケールバーは20μmです。参照36から適応し、米国化学会の許可を得て使用していました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
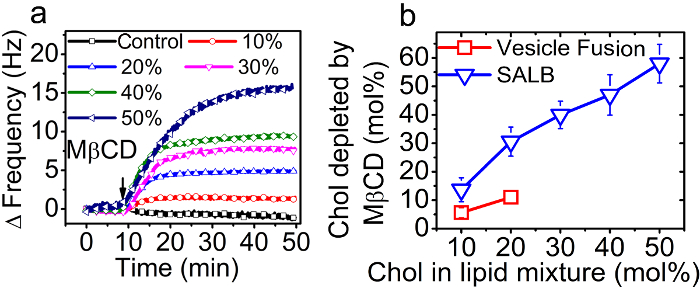
図8.屈原サポートされている脂質二重層中のコレステロール画分のantification。 (A)1ミリモルの注入の際に正のQCM-Dの周波数シフト(0〜50モル%との間の)前駆体混合物中のコレステロールのモル分率を変化させることで支持脂質二重層にMβCD。 (B)の前駆体混合物または小胞中のコレステロール画分の関数としてSALBおよびベシクル融合法によって調製二重層からのコレステロール枯渇のモルパーセント。参照36から適応し、米国化学会の許可を得て使用していました。 この図の拡大版をご覧になるにはこちらをクリックしてください。

6モル比のコンタ:DOPC / Cholを(4のサポート二重層における蛍光微細構造の図9の時間依存進化SALB方法によって調製0.5%ローダミンPE)ining。均一相を徐々に位相が完全に溶媒交換の際に、液-液共存領域に分離します。参照37から適応し、米国化学会の許可を得て使用していました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
この作業では、溶媒交換手順は、アルコール中の脂質(イソプロパノール、エタノール、又はn-プロパノール)は、固体支持体と共にインキュベートし、次いでアルコールを直列に駆動するために、水性緩衝液に徐々に置換された提示され相転移の最終的ラメラ相の脂質二重層24を生成します 。この方法は、このような小胞融合法に難治性である金、などの表面上に支持された脂質二分子層の製造を可能にすることが示されています。
最適な脂質濃度範囲(0.1 - 0.5 mg / mlの)は、これまで試験された標準的な実験形式で完全な二層形成のための決定されました。二重層の0.1 mg / mlの、個別の、微小パッチ以下の脂質濃度で形成されました。一方、0.1 mg / mlのより高い濃度およびより低いで0.5 mg / mlの、完全かつ均一な二重層が形成されます。この範囲より上の脂質濃度で、流体二重層は依然としてverifiとして形成しましたFRAP解析により編、しかし、蛍光顕微鏡は、二層の上に追加の脂質構造の存在を明らかにする。驚くべきことに、これらの追加の脂質構造の形態は、QCM-D分析によって決定されるように、インキュベーション工程の間に使用したアルコールに依存しました。エタノールの場合には、比較的高ΔFおよびΔDシフトが吸着小胞の層に対して得られたQCM-Dの署名に似ています。イソプロパノール又はn-プロパノールの代わりに使用した場合ΔDがかなり高かった、Δfは、二重層(-40ヘルツまでの間-30 F最終Δ)が期待値よりもわずかに高かったです。このようなQCM-D応答は、(場合によっては蛍光顕微鏡によって可視など)膜表面から外側に突出する延長脂質構造(例えば、蠕虫状ミセル)のために予想されます。
溶媒交換の速度は、エスペック重要であり得る別の重要なパラメータであります低い脂質濃度(例えば、0.1 mg / mlで)を使用しているときially。低脂質濃度で迅速な溶媒交換は、不完全な二重層の形成につながることができます。本論文では、QCM-D測定(Q-センスE4測定室)、約100マイクロリットル/分の流量のために使用される標準的な測定室では、再現性の高い完全な二重層形成に適していました。他の形状及び容積を有するフローセルの場合、最適な流量が変化してもよく、経験的に、本明細書に推奨される手順に基づいて決定されなければなりません。
小胞の融合に難治性である表面上に支持された脂質二重層を形成することに加えて、SALBにより複雑な組成を有する支持された膜の製造にドアを開け、破裂することができる脂質小胞の必要性を回避するために使用することができます。例示的な実施例の組成物として、コレステロールの高い割合を有する脂質混合物を調べました。コレステロールはmammの重要な構成要素でありますalian細胞膜、およびその画分は、(赤血球中など )、膜脂質組成の45〜50モル%に近づけることができます。このように、人間の細胞膜を代表する脂質二重層であっても単純なモデルは、コレステロールを含むべきです。
小胞の融合のみ10-15%のコレステロールを含有する流体の脂質二重層を製造するために使用することができるが(QCM-Dの測定によって定量し、最大57モル%)、SALB方法は、コレステロールの高い画分を含む流体の脂質二重層を形成することができる36。コレステロールのレベルはさらに(63モル%まで)上昇したときしかし、ストライプ状の領域37を観察しました。共同既存のドメインは、空気 - 水界面におけるコレステロール/リン脂質単層の相図にβ地域で観察されたものを連想させる液体でした。
全体として、SALB方法は私は特に、サポートされている脂質二重層を形成するためのシンプルかつ効率的なアプローチであることが示されています従来のベシクル融合法の範囲を超えて、n個のケース。これまで、QCM-D法と蛍光顕微鏡検査は、主にSALB法により形成されたサポートされている脂質二重層を特徴付けるために使用されました。 、39,40、フーリエ変換赤外分光法41、X線42と中性子反射率43ができる表面プラズモン共鳴(SPR)38を含む技術は、前方表面感受性分析測定の広い範囲を見ると、原子間力顕微鏡(AFM)さらに特徴付け、単純および複雑な二層構成はSALB方法により調製研究するために使用されます。これらの新興の機能はシンプルで堅牢な実験プロトコルを利用することにより、人工細胞膜を探索することができます科学者のより多くの扉を開きます。
開示事項
The authors have no competing financial interests to disclose.
謝辞
著者はNJCに国立研究財団(NRF -NRFF2011-01とNRF2015NRF-POC0001-19)、国立医学研究審議会(/ 0005/2012 NMRC / CBRG)、およびナンヤン工科大学からのサポートを認めることを望みます
資料
| Name | Company | Catalog Number | Comments |
| QCM-D silicon dioxide-coated substrates | QSense AB, Sweden | ||
| QCM-D gold-coated substrates | QSense AB, Sweden | ||
| Q-Sense E4 module | QSense AB, Sweden | ||
| Plasma Cleaner, PDC-32G | Harrick Plasma, Ithaca, NY | PDC-001 (115V) | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375P | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (ammonium salt) (Rh-PE) | Avanti Polar Lipids | 810150P | |
| cholesterol | Avanti Polar Lipids | 700000P | |
| Methyl-β-cyclodextrin | Sigma | C4555 | |
| Isopropanol | Sigma | 673773 | |
| Ethanol | Sigma | 459844 | |
| n-propanol | Sigma | 279544 | |
| Sticky-Slide I 0.1 Luer | IBIDI | 81128 | |
| Male elbow 1/8” | Cole-Parmer | 30505-70 | |
| Silicon tubing 1.6 mm ID | IBIDI | 10842 | |
| Glass coverslip No. 1.5H, 25 mm x 75 mm | IBIDI | 10812 | |
| Reglo Digital M2-2/12 Peristaltic Pump | Ismatec | ||
| Sodium dodecyl sulfate | Sigma | 71725 |
参考文献
- Sackmann, E. Supported membranes: Scientific and practical applications. Science. 271, 43-48 (1996).
- Kraft, M. L., Weber, P. K., Longo, M. L., Hutcheon, I. D., Boxer, S. G. Phase separation of lipid membranes analyzed with high-resolution secondary ion mass spectrometry. Science. 313, 1948-1951 (2006).
- Kalb, E., Engel, J., Tamm, L. K. Binding of proteins to specific target sites in membranes measured by total internal reflection fluorescence microscopy. Biochemistry. 29, 1607-1613 (1990).
- Bally, M., et al. Norovirus GII. 4 Virus-like Particles Recognize Galactosylceramides in Domains of Planar Supported Lipid Bilayers. Angewandte Chemie International Edition. 51, 12020-12024 (2012).
- Bally, M., Graule, M., Parra, F., Larson, G., Höök, F. A virus biosensor with single virus-particle sensitivity based on fluorescent vesicle labels and equilibrium fluctuation analysis. Biointerphases. 8, 10-1186 (2013).
- Groves, J. T., Dustin, M. L. Supported planar bilayers in studies on immune cell adhesion and communication. Journal of Immunological Methods. 278, 10-1016 .
- Mager, M. D., Melosh, N. A. Lipid Bilayer Deposition and Patterning via Air Bubble Collapse. Langmuir. 23, 9369-9377 (2007).
- Lenhert, S., Sun, P., Wang, Y., Fuchs, H., Mirkin, C. A. Massively Parallel Dip-Pen Nanolithography of Heterogeneous Supported Phospholipid Multilayer Patterns. Small. 3, 71-75 (2007).
- Mennicke, U., Salditt, T. Preparation of solid-supported lipid bilayers by spin-coating. Langmuir. 18, 8172-8177 (2002).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophysical Journal. 47, 105-113 (1985).
- Kalb, E., Frey, S., Tamm, L. K. Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers. Biochim Biophys Acta. 1103, 307-316 (1992).
- Reimhult, E., Höök, F., Kasemo, B. Intact vesicle adsorption and supported biomembrane formation from vesicles in solution: influence of surface chemistry, vesicle size, temperature, and osmotic pressure. Langmuir. 19, 1681-1691 (2003).
- Cho, N. -. J., Jackman, J. A., Liu, M., Frank, C. W. pH-Driven assembly of various supported lipid platforms: A comparative study on silicon oxide and titanium oxide. Langmuir. 27, 3739-3748 (2011).
- Boudard, S., Seantier, B., Breffa, C., Decher, G., Felix, O. Controlling the pathway of formation of supported lipid bilayers of DMPC by varying the sodium chloride concentration. Thin Solid Films. , 495-4246 (2006).
- Stanglmaier, S., et al. Asymmetric distribution of anionic phospholipids in supported lipid bilayers. Langmuir. 28, 10818-10821 (2012).
- Jackman, J. A., Choi, J. -. H., Zhdanov, V. P., Cho, N. -. J. Influence of osmotic pressure on adhesion of lipid vesicles to solid supports. Langmuir. 29, 11375-11384 (2013).
- Rossetti, F. F., Bally, M., Michel, R., Textor, M., Reviakine, I. Interactions between titanium dioxide and phosphatidyl serine-containing liposomes: formation and patterning of supported phospholipid bilayers on the surface of a medically relevant material. Langmuir. 21, 6443-6450 (1021).
- Cho, N. -. J., Cho, S. -. J., Cheong, K. H., Glenn, J. S., Frank, C. W. Employing an amphipathic viral peptide to create a lipid bilayer on Au and TiO2. Journal of the American Chemical Society. 129, 10050-10051 (2007).
- Hardy, G. J., et al. Biomimetic supported lipid bilayers with high cholesterol content formed by [small alpha]-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22, 19506-19513 (2012).
- Wallin, M., Choi, J. -. H., Kim, S. O., Cho, N. -. J., Andersson, M. Peptide-induced formation of a tethered lipid bilayer membrane on mesoporous silica. European Biophysics Journal. , 1-10 (2014).
- Coutable, A., et al. Preparation of tethered-lipid bilayers on gold surfaces for the incorporation of integral membrane proteins synthesized by cell-free expression. Langmuir. 30, 3132-3141 (2014).
- Zan, G. H., Jackman, J. A., Cho, N. -. J. AH peptide-mediated formation of charged planar lipid bilayers. The Journal of Physical Chemistry B. 118, 3616-3621 (2014).
- Jackman, J. A., Zhao, Z., Zhdanov, V. P., Frank, C. W., Cho, N. -. J. Vesicle adhesion and rupture on silicon oxide: Influence of freeze–thaw pretreatment. Langmuir. 30, 2152-2160 (2014).
- Tabaei, S. R., Choi, J. -. H., Haw Zan, ., Zhdanov, G., P, V., Cho, N. -. J. Solvent-Assisted Lipid Bilayer Formation on Silicon Dioxide and Gold. Langmuir. 30, 10363-10373 (2014).
- Hohner, A., David, M., Rädlera, J. Controlled solvent-exchange deposition of phospholipid membranes onto solid surfaces. Biointerphases. 5, 1-8 (2010).
- Tabaei, S. R., Jackman, J. A., Kim, S. -. O., Zhdanov, V. P., Cho, N. -. J. Solvent-Assisted Lipid Self-Assembly at Hydrophilic Surfaces: Factors Influencing the Formation of Supported Membranes. Langmuir. 31, 3125-3134 (2015).
- Tabaei, S. R., Vafaei, S., Cho, N. -. J. Fabrication of Charged Membranes by the Solvent-Assisted Lipid Bilayer (SALB) Formation. Method on SiO2 and Al2O3. Physical Chemistry Chemical Physics., doi:10.1039/C5CP01428J. , (2015).
- Jackman, J. A., Tabaei, S. R., Zhao, Z., Yorulmaz, S., Cho, N. -. J. Self-Assembly Formation of Lipid Bilayer. Coatings on Bare Aluminum Oxide: Overcoming the Force of Interfacial Water. ACS Applied Materials & Interfaces. 7, 959-968 (2015).
- Keller, C., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Sundh, M., Svedhem, S., Sutherland, D. S. Influence of phase separating lipids on supported lipid bilayer formation at SiO2 surfaces. Physical Chemistry Chemical Physics. 12, 453-460 (2010).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature Protocols. 5, 1096-1106 (2010).
- Beseničar, M. P., Bavdek, A., Kladnik, A., Maček, P., Anderluh, G. Kinetics of cholesterol extraction from lipid membranes by methyl-β-cyclodextrin—A surface plasmon resonance approach. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1778, 175-184 (2008).
- Pedersen, S., Jørgensen, K., Baekmark, T. R., Mouritsen, O. G. Indirect evidence for lipid-domain formation in the transition region of phospholipid bilayers by two-probe fluorescence energy transfer. Biophysical journal. 71, 554-560 (1996).
- Okonogi, T., McConnell, H. Contrast inversion in the epifluorescence of cholesterol-phospholipid monolayers. Biophysical Journal. 86, 880-890 (2004).
- McConnell, H. M., Radhakrishnan, A. Condensed complexes of cholesterol and phospholipids. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1610, 159-173 (2003).
- Tabaei, S. R., et al. Formation of Cholesterol-Rich Supported Membranes Using Solvent-Assisted Lipid Self-Assembly. Langmuir. 30, 13345-13352 (2014).
- Tabaei, S. R., Jackman, J. A., Liedberg, B., Parikh, A. N., Cho, N. -. J. Observation of Stripe Superstructure in the β-Two-Phase Coexistence Region of Cholesterol–Phospholipid Mixtures in Supported Membranes. Journal of the American Chemical Society. 136, 16962-16965 (2014).
- Salamon, Z., Wang, Y., Tollin, G., Macleod, H. A. Assembly and molecular organization of self-assembled lipid bilayers on solid substrates monitored by surface plasmon resonance spectroscopy. Biochimica et Biophysica Acta (BBA)-Biomembranes. , 1195-11267 (1994).
- Yuan, C., Johnston, L. Phase evolution in cholesterol/DPPC monolayers: atomic force microscopy and near field scanning optical microscopy studies. Journal of microscopy. 205, 136-146 (2002).
- Schneider, J., Dufrêne, Y. F., Barger, W. R., Lee, G. U. Atomic force microscope image contrast mechanisms on supported lipid bilayers. Biophysical Journal. 79, 1107-1118 (2000).
- Tamm, L. K., Tatulian, S. A. Infrared spectroscopy of proteins and peptides in lipid bilayers. Quarterly reviews of biophysics. 30, 365-429 (1997).
- Miller, C. E., Majewski, J., Gog, T., Kuhl, T. L. Characterization of biological thin films at the solid-liquid interface by X-ray reflectivity. Physical Review Letters. 94, 238104 (2005).
- Koenig, B. W., et al. Neutron reflectivity and atomic force microscopy studies of a lipid bilayer in water adsorbed to the surface of a silicon single crystal. Langmuir. 12, 1343-1350 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved