Method Article
可溶和不可溶α-突触核蛋白从帕金森脑连续提取
摘要
Here, we present a protocol for the isolation of increasingly insoluble/aggregated alpha-synuclein (α-syn) from post-mortem human brain tissue. Through the utilization of buffers with increasing detergent strength and high-speed ultracentrifugation techniques, the variable properties of α-syn aggregation in diseased and non-diseased tissue can be examined.
摘要
α-突触核蛋白(α-顺)蛋白质大量表达主要的神经元内,并且存在于若干不同的形式 - 单体,四聚体,低聚物和细纤维。在疾病,α-顺经历构象变化,以形成倾向于使蛋白质更不溶性低聚物和高分子量聚集体。异常聚集的α-顺是帕金森氏病(PD),路易体痴呆(DLB)和多系统萎缩症(MSA)的神经病理学特征。生化特征和不溶性α-顺使用缓冲器,提高洗涤剂的强度和高速超速离心的分析提供了一个功能强大的工具,以确定与疾病进展相关的α-SYN病理学的发展。本协议描述越来越不溶性/聚集的α-SYN从验尸人脑组织分离。这种方法可以与修改来适应正常和异常的α研究-syn生物学在转基因动物模型携带不同α-顺突变以及在该功能相关的它们各自的病症的蛋白质的异常纤维状沉积物其它神经变性疾病。
引言
一个常见的几种之间神经退行性疾病的主要病理特征是发生在蛋白质/疾病的具体方式1形成的异常蛋白聚集体。因此,存在在阿尔茨海默氏病(AD)的神经元内的特性extraneuronalβ-淀粉样蛋白斑和聚集的tau蛋白的存款;聚集的α-顺矿床Lewy小体(磅),其突触夹杂物,也称为内路易神经突(逻辑节点)中的PD,PD痴呆和路易体痴呆(DLBs)2-4营养不良的神经元突起。异常α-顺沉积物中也见到MSA 5胶质细胞胞浆内的标志病变。在亨廷顿氏病,也有特征聚-Q存款和异常焦油DNA结合蛋白43和稠合于肉瘤蛋白(FUS)被沉积在额颞痴呆。重要的是为PD,α - 顺式基因突变已发现CAUSE常染色体显性遗传PD 6-11。此外,α-SYN基因三重12和重复13也导致家族性PD从而增加联系起来α-SYN表达PD的病理机制。值得注意的是,无论是散发性和家族的PD例怀有α-顺病理学14的异常沉积。帕金森病目前可用的治疗方法只是治标不治本,而且对阻止或延缓必然疾病进展没有任何影响。
α-顺大量表达在人的大脑和大约占总量的1%脑蛋白的。它是本更具体的神经元内,但可以存在尽管在神经胶质细胞中较低量。一个有争议的一点是α-SYN的天然结构,可以存在一个随机单体15或折叠四聚体16。在疾病,α-顺改变其构象,允许它得到错误折叠而这一过程被认为是疾病pathoge的原因NESIS。尽管几年来调查α-SYN和疾病的病理生理方面,对疾病机制的确切原因仍然难以实现14。
使用帕金森脑事后分析研究迄今已提供了有关的α-SYN无论是在零星的PD和PD也与在LRRK2基因突变17-22相关的正常和异常的生物学重要的线索。这里,一个生化提取协议(参见方案示于图1),用于从人类验尸PD脑组织日益不溶α-顺存款窝藏α -顺聚集体在不同程度上已经描述。这种技术也可以适于与在缓冲液中组合物的修改来研究从其它神经变性疾病23,24聚合蛋白质和还从转基因动物的脑组织25-27。主要考虑为适应在solubi的差异lity总金额的相应部分的蛋白质,其中的主要是核电,并可能需要高盐缓冲剂的最佳提取如图所示为FUS 28。
研究方案
验尸脑组织捐赠给皇后广场脑库神经系统疾病,伦敦大学学院神经学研究所用合乎伦理的协议下由人体组织机构颁发的许可证存储的研究(HTA)英国(编号12198)。看到用于此协议(表1)的情况下的清单。
1.准备缓冲区
- 制备1X TBS(Tris-缓冲盐水)缓冲液:
- 制备10X TBS作为储备溶液用500mM的Tris-HCl pH 7.4的和1500毫米氯化钠。
- 称取60.5克三Cl pH 7.6的87.6克氯化钠在800ml的高纯度水。调节pH用1M HCl,并进行最后的蓄积量至1L
- 通过在蒸馏水稀释储备10倍制备1X TBS的最终浓度。
- 加入蛋白酶抑制剂(PI),(每50 ml的缓冲液1片)和PHOS停止磷酸酶抑制剂片剂(1片每10 ml缓冲液),以废除的蛋白酶和磷酸酶的非特异性酶促动作的效果。
注意:在这里,我们使用的酶抑制剂来自Roche片剂但同样其它市售抑制剂可根据制造商的说明使用。
- 制备10X TBS作为储备溶液用500mM的Tris-HCl pH 7.4的和1500毫米氯化钠。
- 制备的TBS-SDS缓冲加入5%w / v的十二烷基硫酸钠(SDS)至1X TBS(pH为7.4)缓冲液。加热使用磁力搅拌器以溶解的SDS溶液到60℃并不断搅拌。
- 制备的TBS-SDS-尿素缓冲通过添加尿素至8M的w / v到1X TBS-SDS缓冲液(pH7.4)的最终浓度。加热在磁力搅拌器上的溶液到60℃并不断搅拌以溶解尿素。
2.样本同质化和差异超速离心
注意:以下工作部分包括人脑组织的根据HTA英国的规则处理。地方标准作业程序遵循所有TIMES。脑样品从匀浆在保持在负压microcabinet冷冻脑块和组织材料解剖。一次性手术服手套,口罩,过鞋保护器和护目镜磨损整个过程。在121℃高压灭菌20分钟进行安全处置后,自人组织废物被丢弃。尖锐件(手术刀片)布置在密封及安全处置适当尖锐物容器。
- (从基底节区的约0.5克的重量)取冷冻的人组织的组块,并迅速剁碎成小片段(约1毫米2)在冰上使用小培养皿和无菌解剖刀刀片。使用一个单独的培养皿和手术刀刀片每个样品。收集组织糜在15ml管中,加入10倍体积的冰冷的缓冲1XTBS到管。
- 均质化,使用机械均化器将样品以20,000rpm离心10秒。冷却在冰上2分钟。重复此步骤三次秒。
注:这是这样做的样品不加热均化。 - 通过离心澄清,在1000×g离心5分钟,在4℃。丢弃的非均质材料颗粒。
- 取上清液(粗匀浆),加入到聚碳酸酯离心管(管的大小取决于转子尺寸),并仔细权衡。离心机以100,000×g离心1小时,在4℃。
- 保留上清液,因为这是TBS可溶部分。
- 洗涤在五个体积的1X TBS缓冲液和每次离心沉淀两次以100,000×g离心15分钟,在4℃。弃去上清液。
- 在大约5卷1X TBS-SDS在室温超声颗粒,持续10秒,在20千赫重悬最终的沉淀。
注意:在另外的SDS的缓冲液样品应提请在10℃,以避免SDS沉淀。 - 超离心机以100,000×g离心30分钟,在25℃下。
- 在大约5卷1X TBS-SDS在室温超声颗粒,持续10秒,在20千赫重悬最终的沉淀。
- 保留上清液,因为这是第ËSDS可溶部分。
- 洗涤沉淀两次在5倍体积的1X TBS-SDS缓冲液在室温。离心机以100,000×g离心15分钟,每次在25℃。
- 溶解在50μl的使用超声波仪设定为20千赫,10秒以获得完全溶解的1X TBS-SDS-尿素缓冲液中最终的沉淀;这被称为尿素可溶部分。
- 测定每个级分使用根据制造商的协议市售蛋白质测定试剂盒的总蛋白质含量。稀的TBS-SDS-尿素样品1:1与1X TBS缓冲,以允许与蛋白质测定试剂的相容性。在小等分试样(20微升)在-80℃冷冻的样品,以减少冻融循环。
注意:添加10%甘油以样品被推荐用于长期储存在-80℃。
3.免疫印迹样品和分析结果
- 从TBS,TBS-SDS和TBS-SDS-尿素提取物对10孔4-12%的Bis-Tris聚丙烯酰胺凝胶电泳样本具有MOPS作为使用标准技术运行缓冲液。见Gallagher和Chakravarti(2008)29进行了详细的免疫印迹协议。
- 负载10微克来自各样品的蛋白质到每个泳道随着分子量标记为TBS和SDS和尿素的级分。
- 运行凝胶在200V 1小时,或直到从装载缓冲液的蓝染料到达凝胶的底部。
- 转移从凝胶电泳的蛋白质上的尼龙膜28,预润湿先在100%甲醇中,然后进入含有20%甲醇的转移缓冲液。提供在印迹上的识别标记,以确定该蛋白侧和的分子量大小标记的取向。
- 夹着与沿着湿滤纸膜中的凝胶。膜的正确位置是与凝胶和阳极之间的膜是至关重要的。 40五,执行转移2小时
- 弥补1X PBS - 吐温(1X PBS-T)缓冲液:溶在200ml 1片剂的PBS水,得到0.01M磷酸盐缓冲液,0.0027氯化钾和0.137氯化钠,pH 7.4。
- 阻断膜中的5%BSA溶液在1X PBS-T进行30分钟振荡以70rpm。这防止非特异性的第一抗体的结合到膜上。
- 探测蛋白质印迹用6mlα-顺初级抗体顺-1(BD Biosciences公司;小鼠单克隆抗体)在1:750稀释液(O / N,4℃),接着是一系列的洗涤用1X PBS-T的( 3×5分钟,每次)28。
- 孵育适当的HRP缀合的二级抗体的印迹以1:2000稀释30分钟。执行一系列的洗涤(每次3×5分钟),用1X PBS-T。
- 沉浸在一个黑暗的房间,持续15秒增强化学发光的解决方案印迹。封面印迹用保鲜膜和地点放射自显影胶片对杂交蛋白质方在一个不透光的纸盒捕捉到相应的信号(适当大小带)。
- 开发以自动显影剂放射自显影膜。
注意:将印迹还可以使用的显影液和定影液从在壳体自动化显影剂机不可用一个商业来源手动开发的。
- 孵育印迹用6ml印迹剥离缓冲器10分钟以恒定摇动剥离α-顺抗体信号的印迹。按照步骤3.43至3.6.2使用β-肌动蛋白一抗(鼠单克隆)在1:8000稀释。
- 扫描和转换的最终图像转换成使用NIH ImageJ的用于定量目的(免费下载软件)TIFF图像和测量密度。
注意:软件允许读感兴趣相对面积(适当大小带)的密度和数据可以表示为α-顺密度/β肌动蛋白(一个管家基因),为任意单位或上的一个比它自己的时看家基因无效(如尿素可溶样品的情况下)。
结果
TBS,SDS和从基底节以下如图 1所示的协议中提取尿素可溶性蛋白被运行在凝胶和免疫印迹带有SYN-1的小鼠单克隆α-顺初级抗体。的TBS可溶性部分显示的单体α -顺(〜14 KDa的物种)中检查的PD和控制的情况下(图2A)的存在。将SDS可溶性级 分也显示有大量的单体α -顺式中所显示的低曝光印迹(图2C)研究案件的所有三个亚型。对PD例还表明所看到在高曝光量印迹较高分子量(MW)α-顺物种,其中很可能是低聚物(图2C)。从PD例尿素可溶性部分表明升高的量α - 顺式单体,低聚物和相比,控制的情况下聚集的物种。新皮层的特发性PD的情况下表现出较高数额aggreg的 atedα-顺品种,而边缘的情况下表现出不溶性的α-SYN的中间水平。无论从特发性PD情况下,SDS和尿素分数证明截断α-SYN的产品不同水平的12 kDa的和所描述的20 kDa的6。与此相反,在对照病例没有显示出任何不溶性的或聚集的α-顺(图2E)。半定量密度的措施反映了LB的负载量为categoriesd使用α-SYN免疫证明聚集α-SYN的不溶性的性质( 图2B,2D,2F)在新皮层和边缘PD案件。
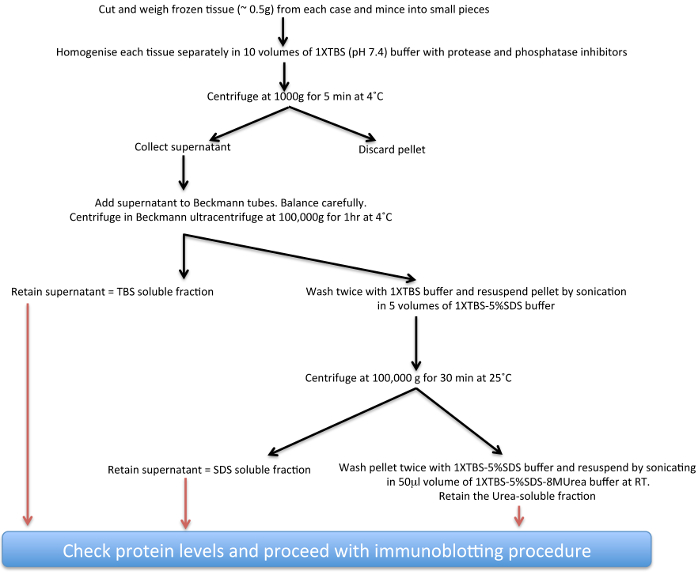
图1的不溶性 α-syn提取过程 示意图 。rget ="_空白">点击此处查看该图的放大版本。
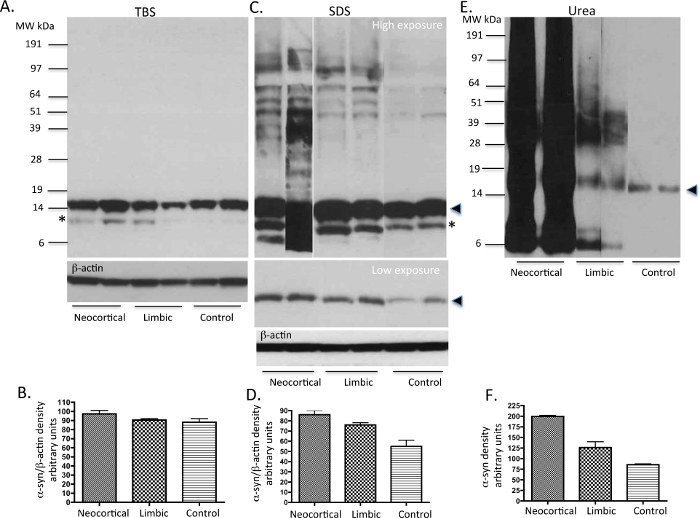
α-syn 级别图 2. PD 代表免疫印迹 和控制人体组织,TBS,SDS和尿素可溶部分的基底神经节特发性PD病例和神经功能正常(对照)(即港口α-SYN病理PD情况下的区域)大脑的α-SYN的使用免疫印迹的存在进行了分析。 10微克蛋白的上样到每个泳道。在TBS中组分 (A),主要是α-顺单体的存在于所有情况。在SDS的级分(C)中,α -顺式的一些低聚物连同单体主要在PD组织观察。在尿素的级分(C)中,单体,低聚物和聚合α -顺式被可变地表示在对PD箱子reflectin摹各自LB负载。的神经学上正常的对照样品显示出只有少量的单体α-顺的存在。请注意α - 顺式的被视为在一些情况下,以高的LB负荷可能降解产物。实线箭头头表示α-SYN的单体形式。在*可能代表了α-SYN的如前所述20,26的C末端截短形式。 请点击此处查看该图的放大版本。
| 外壳 | 性别 | 死亡年龄岁 | 验尸延迟(小时) | pH值组织 |
| 新皮层1 | 中号 | 82 | 40 | 6.3 |
| 新皮层2 | F | 75 | 35.3 | 6.4 |
| 边缘1 | 中号 | 81 | 28.5 | 6.2 |
| 边缘2 | F | 79 | 36.5 | 6.2 |
| 控制1 | 中号 | 80 | 38 | 6.1 |
| 控制2 | F | 83 | 32.5 | 6.3 |
的情况下,表1中使用有限的人口统计
讨论
本文介绍了一种生化协议提取和检查单体,低聚物的溶解度差异性,并使用变性凝胶运行条件患病的大脑聚集α-SYN。这是一个公认的技术来研究聚集α-顺17,18,20,21的蛋白质通常是可溶的天然形式,但获得淀粉样变或增加的聚集性质与疾病进展或与遗传突变。尽管如此,一些团体已经使用在SDS浓度的轻微变化在它们的缓冲区(8%或10%,而不是5%)21,22,30的SDS是阴离子洗涤剂和solubilisesα -顺式的低聚物,其可以包括膜结合形式α -顺,而尿素,离液试剂变性α-顺20的不溶性聚集和原纤维或淀粉样变的形式。在这方面Paleologou等31进行系统研究考察的稳定性α-顺低聚物和细纤维具有不同浓度的尿素的(6.5 - 8 M)或SDS(0.25-2%),并报告说,低聚物在SDS的浓度稳定,但不与高浓度的尿素。其FILA-1抗体,特异于α-顺寡聚体和原纤检测更高浓度原纤维在非变性条件下6.5尿素浓度。在这个协议中使用的缓冲液浓度密切反映什么在Culvenor 等人被描述。 (1999年)32。
解剖大脑区域的不溶性α-SYN的生物化学提取应慎重选择,这应该反映了α-顺LB和LN负载取决于疾病进展33,34。这里使用的情况下,从PD的新皮层和边缘亚型反映根据麦克凯斯PD进展的后期和中间阶段基底节样品ctriteria 34。在皇后广场脑库,有一半的大脑是常规福尔马林固定为组织化学分析,而另一半被小心解剖成不同的解剖区域和快速冷冻并储存在-80℃下冷冻用于进一步的生化和DNA / RNA分析研究。继大脑和解剖通过neuropathologists的福尔马林固定,采用免疫组化α-SYN抗体和结果存档来执行。也作为常规方法,将脑组织的pH到达作为脑组织濒死状态的量度时测量。这构成了组织保存质量的生化分析了坚实的基础。
这里我们的数据表明,有更多的SDS在与对照相比的PD例可溶性α - 顺单体;特别是新皮层PD例具有更高的α-顺负荷相比,边缘的PD品种。新皮层的情况下,代表在新皮层区域的PDα-SYN病理更大的进展,如额叶和顶叶COR践33,34。边缘PD例具有更高的LB分数在基底前脑中/边缘区的区域如杏仁核,transentorhinal和扣带地区。对于有意义的数据和统计分析,必须运行至少4个案件的每个队列。同样,我们没有试图这里给出的印迹数据进行统计分析。
还必须注意的是,不同的抗体可以识别不同形式/高阶α-顺低聚物组合物,每个可以具有它自己的相对灵敏度和偏好。这是从童等人 29的结果所表明,他们表明,4种不同的α-顺抗体(顺式1,SS ONCO和LB509)给至少多变结果α-顺低聚物/聚集体。 α-顺单体认识到相似程度由所有4抗体虽然这些可以有变化取决于是否α-顺抗体表位或位于N末端或C末端29。同样,对于磷酸-α特异性抗体突触核蛋白确定不同的高分子量α突触核蛋白物种20,21。在这里描述的方案中,高度表征抗体顺-1已经被使用19-21。
但是,重要的是考虑通过抗体预吸附实验验证在蛋白质印迹的任何新的抗体,也过表达的蛋白质和敲除细胞中是很重要的。
考虑已经由研究人员采用其它变型,以确定α-顺和或不稳定四聚α - 顺式形式更小的片段是很重要的。这可以包括轻微的定影膜用0.4%PFA的PBS保留α-顺35或处理样品匀浆与交联剂的截短形式,以稳定四聚体36。
通过验尸TI蛋白质的准确生化评价ssue需要最小化的酶蛋白质降解和修改。因此,建议使用组织用最短的验尸延误和/或选择相匹配的样本的情况下队列中。使用标准的抗体α-SYN免疫组化免疫前应启动分离方案进行。 α-顺病理的程度是高度可变的,并且可以根据选择的区域而变化。这是明智的选择地区丰富的病理为阳性对照,与每一个运行的最佳产量。使用蛋白酶抑制剂,如有必要,磷酸酶抑制剂,以防止不希望的酶降解期间细胞裂解发生,并且保持样品在4℃下的细胞内的蛋白酶或磷酸酶的释放之后是至关重要的。
重要的是,所有的批实验中的样品被处理均匀和一致,以避免内用户的变动;多FRE结 - 解冻循环应该避免,因为这可能潜在地缩回的翻译后修饰,如磷酸化。一个关键点到牢记当检查大量样品的是,从免疫印迹数据应该是标准化为一个样品,其中应并行运行在凝胶上的所有其他样品,并参照该样本的所有数据。这样做是为了确保多个印迹之间的免疫印迹数据正常化。这是我们最近的研究22采用的方法。
应当指出,为了保持背景ECL低,印迹不应允许的免疫印迹协议期间变干随时。此外,很长时间曝光(> 10分钟)的放射自显影胶片应该避免,因为这会导致ECL信号的饱和度,并会导致不准确的定量。
此上述方案是使用普通实验室试剂和在一个相对简单的技术struments,并且可用于调查α-顺蛋白的病理生理学中的PD研究的宝贵工具。这种方法不仅可以扩展通过适当的修改,以在α-顺转基因动物α-顺生物学研究,也对其他的神经变性疾病具有聚集的蛋白质如AD,MSA,DLB,HD和frontotemporaldementias的异常沉积。然而这里所描述的免疫印迹数据也使用利用抗α-顺31的具体形式酶联免疫测定法来验证。
披露声明
作者有没有透露。
致谢
I thank Dr Adamantios Mamais for extracting α-synuclein from human tissue and running of blots. This work was supported in part by a MRC Grant (MR/L010933/1) and in part by the Wellcome Trust/MRC Joint Call in Neurodegeneration award (WT089698) to the UK Parkinson's Disease Consortium (UKPDC) whose members are from the UCL Institute of Neurology, the University of Sheffield and the MRC Protein Phosphorylation Unit at the University of Dundee. RB received funding from MJFox foundation for this work and is also funded by the Reta Lila Weston Trust.
材料
| Name | Company | Catalog Number | Comments |
| Tris-HCL | Sigma | T5912 | |
| sodium chloride | VWR | 27800.291 | |
| SDS | Fluka | 71727 | |
| Urea | Sigma | U5378 | |
| Protease inhibitor tablets | Roche | 04 693 116001 | |
| Phosphatase inhibitor tablets | Roche | 04 906 837001 | |
| Phosphate buffered saline tablets | Sigma | P4417 | |
| Tween-20 | Sigma | P9416 | |
| NuPAGE MOPS SDS running buffer | Invitrogen | NP0001 | |
| NuPAGE transfer buffer | Invitrogen | NP0006-1 | |
| Hybond-P membrane | GE Healthcare | RPN303F | |
| Whatman 3MM filter paper | Sigma | WHA30306185 | |
| Bis-tris gels 4-12% | Invitrogen | NP0322BOX | |
| Supersignal West Pico Chemiluminescent substrate | Pierce | 34080 | |
| Bio-RAD DC protein assay kit | Bio-Rad | 500-0112 | |
| Thickwall Beckman Polycarbonate tubes | Beckman | 355630 | |
| Western blot stripping buffer | Thermo scientific | 46430 | |
| Syn-1 primary antibody (mouse monoclonal) | BD Biosciences | 610786 | |
| beta-actin primary antibody (mouse monoclonal | Sigma | A5441 | |
| HRP cojugated goat anti-mouse secondary antibody | Santa Cruz | sc-2031 | |
| Bovine serum albumin | Sigma | A7030 | |
| Instrument | Company | Rotor/ model no | |
| Benchtop Ultracentrifuge Optima Max | Beckman | MLA-80 | |
| Sonicator | Heat Systems | XL20-20 | |
| Homogeniser | Jenke and Kunkel | TP18/10 |
参考文献
- Forman, M. S., Trojanowski, J. Q., Lee, V. M. Neurodegenerative disease a decade od discoveries paves the way for therapeutic breakthroughs. Nat Med. 10, 1055-1063 (2004).
- Spillantini, M. G., Schmidt, M. L., Lee, V. M., Trojanowski, J. Q., Jakes, R., Goedert, . M. A-synuclein in Lewy bodies. Nature. 388, 839-840 (1997).
- Spillantini, M. G., Crowther, R. A., Jakes, R., Hasegawa, M., Goedert, M. Alpha-synuclein in filamentous inclusions of Lewy bodies from Parkinson's disease and dementia with Lewy bodies. Proc Natl Acad Sci. 95, 6469-6473 (1998).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. Am J Pathol. 152, 879-884 (1998).
- Ahmed, Z., et al. The neuropathology, pathophysiology and genetics of multiple system atrophy. Neuroptahol Appl Neurobiol. 38 (1), 4-24 (2012).
- Ploymeropoulos, M. H., et al. Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. Science. 276, 2045-2047 (1997).
- Kruger, R., et al. Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson's disease. Nat Genet. 18, 106-108 (1998).
- Zarranz, J. J., et al. The new mutation, E46K, of alpha-synuclein causes Parkinson and Lewy Body dementia. Ann. Neurol. 55, 164-173 (2004).
- Proukakis, C., et al. A novel alpha-synuclein missense mutation in Parkinson disease. Neurology. 80 (11), 1062-1064 (2013).
- Kiely, A., et al. Synucleinopathy associated with G51D SNCA mutation: a link between Parkinson's disease and Multiple System atrophy?. Acta Neuropathol. 125 (5), 753-769 (2013).
- Lesage, S., et al. G51D alpha-synuclein mutation causes a novel Parkinson-pyramidal syndrome. Ann Neurol. 73 (4), 459-471 (2013).
- Singleton, A. B., et al. Alpha-synuclein locus triplication causes Parkinson's disease. Science. 302, 841 (2003).
- Chartier-Harlin, M. C., et al. Alpha-synuclein locus duplication as a cause of familial Parkinson's disease. Lancet. 364, 1167-1169 (2004).
- Cookson, M. R., Hardy, J., Lewis, P. A. Genetic neuropathology of PD. Int J Clin Exp Pathol. 1 (3), 217-231 (2008).
- Fauvet, B., et al. α-synuclein in central nervous system and from erythrocytes, mammalian cells, and. Escherichia coli exists predominantly as disordered monomer. J Biol Chem. 287, 15345-15364 (2012).
- Bartels, T., et al. α-synuclein occurs physiologically as a helically folded tetramer that resists aggregation. Nature. 477, 107-110 (2011).
- Campbell, B. C., et al. Accumulation of insoluble alpha-synuclein in dementia with Lewy bodies. Neurobiol of Dis. 7 (3), 192-200 (2000).
- Campbell, B. C., et al. The solubility of alpha-synuclein in multiple system atrophy differs from that of dementia with Lewy bodies and Parkinson's disease. J Neurochem. 76, 87-96 (2001).
- Miller, D. W., et al. Alpha-synuclein in blood and brain from familial Parkinson's disease with SNCA locus triplication. Neurology. 62, 1835-1838 (2004).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Zhou, J., et al. Changes in the solubility and phosphorylation of alpha-synuclein over the course of Parkinson's disease. Acta Neuropathol. 121, 695-704 (2013).
- Mamais, A., et al. Divergent solubility and aggregation properties in G2019S LRRK2 Parkinson's disease brains with Lewy Body pathology compared to idiopathic cases. Neurobiol of Dis. 58, 183-190 (2013).
- Lashley, T., et al. A comparative clinical, pathological, biochemical and genetic study of fused in sarcoma proteinopathies. Brain. 134 (pt9), 2548-2564 (2011).
- Brelstaff, J., et al. Transportin-1: a marker of FTLD-FUS. Acta Neuropathol. 122 (5), 591-600 (2011).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO reports. 3 (6), 583-588 (2002).
- Nuber, S., et al. A progressive dopaminergic phenotype associated with neurotoxic conversion of α-synuclein in BAC-transgenic rats. Brain. 136, 412-432 (2013).
- Tofaris, G. K., et al. Pathological changes in dopaminergic nerve cells odf the substantia nigra and olfactory bulb in mice transgenic for truncated human a-synuclein (1-120): implications for Lewy Body disorders. J Neurosci. 26 (15), 3942-3950 (2006).
- Neumann, M., et al. FET proteins TAF15 and EWS are selective markers that distinguish FTLD with FUS pathology from amyotrophic lateral sclerosis with FUS mutations. Brain. 134 (9), 2595-2609 (2011).
- Gallagher, S., Chakravarti, D. Immunoblot analysis . J Vis. Exp. (16), e759 (2008).
- Tong, J., et al. Brain alpha-synuclein accumulation in multiple system atrophy, Parkinson's disease and progressive supranuclear palsy: a comparative investigation. Brain. 133, 172-188 (2010).
- Paleologou, K. E., et al. Detection of elevated levels of soluble α-synuclein oligomers in post-mortem brain extracts from patients with dementia with Lewy bodies. Brain. 132, 1093-1101 (2009).
- Culvenor, J. G., et al. Non-Aβ component of Alzheimer s disease Amyloid (NAC) revisited. American Journal of Pathology. 155 (4), 1173-1181 (1999).
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiol Aging. 24, 197-211 (2003).
- McKeith, I. G., et al. Diagnosis and management of dementia with Lewy bodies: third report of the DLB consortium. Neurology. 65, 1863-1872 (2005).
- Lee, B. R., Kamitani, T. Improved immunodetection of endogenous α-synuclein. PLoS ONE. 6, e23939 (2011).
- Newman, A. J., et al. A new method for quantitative immunoblotting of endogenous α-synuclein. PLoS ONE. 8 (11), e81314 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。