Method Article
Sequentielle Extraktion von löslichen und unlöslichen Alpha-Synuclein von Parkinson-Brains
In diesem Artikel
Zusammenfassung
Here, we present a protocol for the isolation of increasingly insoluble/aggregated alpha-synuclein (α-syn) from post-mortem human brain tissue. Through the utilization of buffers with increasing detergent strength and high-speed ultracentrifugation techniques, the variable properties of α-syn aggregation in diseased and non-diseased tissue can be examined.
Zusammenfassung
Alpha-Synuclein (α-syn) Protein ist reichlich hauptsächlich in Neuronen exprimiert wird, und kommt in einer Reihe von verschiedenen Formen - Monomere, Tetramere, Oligomeren und Fibrillen. Während der Krankheit, α-syn erfährt Konformationsänderungen zu Oligomeren und Aggregaten mit hohem Molekulargewicht, die das Protein mehr unlöslich zu machen sind in der Regel zu bilden. Ungewöhnlich aggregierten α-syn ist ein neuropathologischen Merkmal der Parkinson-Krankheit (PD), Demenz mit Lewy-Körperchen (DLB) und Multisystematrophie (MSA). Biochemischen Charakterisierung und Analyse von unlöslichen α-syn unter Verwendung von Puffern mit zunehmender Waschmittelfestigkeit und Hochgeschwindigkeits-Ultrazentrifugation stellt ein leistungsfähiges Werkzeug, um die Entwicklung von α-syn Pathologie, die mit Fortschreiten der Krankheit assoziiert zu bestimmen. Dieses Protokoll beschreibt die Isolierung von immer unlösliche / aggregierten α-syn aus post-mortem menschlichem Gehirngewebe. Diese Methode kann mit Modifikationen Untersuchungen normaler und abnormaler α angepasst werden-syn Biologie in transgenen Tiermodellen Beherbergen verschiedener α-syn-Mutationen sowie in anderen neurodegenerativen Krankheiten, die aberrant fibrillären Ablagerungen von Proteinen, um ihre jeweiligen Pathologien ähnliche Funktion.
Einleitung
Eine der wichtigsten pathologischen gemeinsam unter mehreren neurodegenerativen Erkrankungen Merkmale ist die Bildung von abnormen Proteinaggregaten, die in einem Protein / krankheitsspezifische Weise 1 auftritt. Somit gibt es die charakteristischen extran Amyloid-beta-Plaques und aggregierte hyperphosphoryliertem tau Ablagerungen in Neuronen bei Alzheimer-Krankheit (AD); die aggregierten α-syn Ablagerungen in Lewy-Körperchen (innen), die intraneuronalen Einschlüsse sind, und auch innerhalb dystrophischen neuronale Prozesse namens Lewy Neuriten (LK) in PD, PD Demenz und Demenz mit Lewy-Körperchen (DLBS) 2-4. Abnormal α-syn Kautionen werden auch im Markenzeichen Läsionen der Glia-zytoplasmatische Einschlüsse in MSA 5 zu sehen. Huntington-Krankheit, gibt es die charakteristischen Poly-Q Ablagerungen und abnorme Tar DNA-Bindungsprotein-43 und in Sarkom Proteine (FUS) fusioniert sind in frontotemporalen Demenzen abgeschieden. Wichtig für PD haben α-syn-Gen-Mutationen zu cau gefundense autosomal dominant PD 6-11. Zusätzlich α-syn-Gen Verdreifachung 12 und Vervielfältigung 13 verursacht auch familiären PD was eine Verknüpfung erhöhte α-syn-Expression auf die Pathomechanismen der PD. Bemerkenswert ist, bergen sowohl sporadischen und familiären PD Fällen anomale Vorkommen von α-syn Pathologie 14. Aktuell verfügbare Behandlungen für PD sind nur palliative und haben keine Auswirkungen auf die Eindämmung oder Verzögerung des unaufhaltsamen Fortschreiten der Krankheit.
α-syn ist reichlich im Gehirn exprimiert und macht etwa 1% des Gesamthirnprotein. Es ist gegenwärtig insbesondere in den Neuronen, kann aber, wenn auch in geringeren Mengen in Gliazellen existieren. Ein strittiger Punkt ist die native Struktur des α-syn, die als Zufalls Monomers 15 oder als gefaltete Tetramer 16 existieren kann. Bei Erkrankung, Änderung α-syn seine Konformation, die es fehlgefaltetem erhalten können, und dieses Verfahren wird angenommen, dass die Ursache der Krankheit sein pathogeNesis. Trotz mehrjähriger Untersuchungen der pathophysiologische Aspekte der α-syn und Krankheit sind die genauen Ursachen der Krankheitsmechanismen schwer fassbaren 14 geblieben.
Studien unter Verwendung von Post-mortem-Analyse der Parkinson-Gehirn bisher vorgesehen wichtige Hinweise in Bezug auf normale und abnormale Biologie der α-syn sowohl bei sporadischen PD und PD Mutationen im LRRK2-Gen 17-22 verbunden. Hier wird eine biochemische Extraktionsprotokoll (siehe Schema in Abbildung 1 dargestellt) für die immer unlösliche α-syn Ablagerungen aus menschlichem post-mortem Gehirngewebe PD, die α-syn-Aggregate in unterschiedlichem Ausmaß beherbergen beschrieben worden. Diese Technik kann auch mit Modifikationen in Pufferzusammensetzungen zu aggregierten Proteine von anderen neurodegenerativen Erkrankungen 23,24 untersuchen und auch von transgenen Tierhirngewebe 25-27 angepasst werden. Das wichtigste Kriterium für den Anpassungen sind die Unterschiede in solubikeit und die Gesamtmengen der jeweiligen Proteine, von denen einige vor allem Kernenergie und kann Hochsalzpuffer muss für eine optimale Extraktion wie für FUS 28 dargestellt.
Protokoll
Post-mortem-Gehirngewebe wurde für neurologische Erkrankungen zu Queen Square Hirnbank gespendet, University College London, Institut für Neurologie mit ethisch anerkannten Protokolle und für die Forschung unter einer Lizenz von der menschlichen Gewebe Behörde gespeichert (HTA) UK (Nr. 12198). Siehe Liste der Fälle, für dieses Protokoll (Tabelle 1) verwendet.
1. Herstellung der Puffer
- Bereiten 1X TBS (Tris-gepufferte Kochsalzlösung) Puffer:
- Vorbereitung 10X TBS als Stammlösung mit 500 mM Tris-HCl pH 7,4 und 1500 mM NaCl.
- Man wiegt 60,5 g Tris-Cl pH 7,6 und 87,6 g NaCl in 800 ml hochreinem Wasser. Der pH-Wert mit 1 M HCl und die endgültige Aktienvolumen um 1 L.
- Bereiten Sie die Endkonzentration von 1X TBS durch Verdünnen der Stamm 10-mal in destilliertem Wasser.
- Add-Protease-Inhibitoren (PI), (1 Tablette pro 50 ml Puffer) und Phos-stop Phosphataseinhibitor Tabletten (1 Tablette pro 10 ml Puffer), umhebt die Auswirkungen der nicht-spezifischen enzymatischen Wirkungen von Proteasen und Phosphatasen.
Anmerkung: Hier haben wir den Enzyminhibitor Tabletten aus Roche aber ebenso andere kommerziell verfügbare Inhibitoren können gemäß den Anweisungen des Herstellers verwendet werden, eingesetzt.
- Vorbereitung 10X TBS als Stammlösung mit 500 mM Tris-HCl pH 7,4 und 1500 mM NaCl.
- Vorbereitung TBS-SDS-Puffer durch Zugabe von 5% w / v Natriumdodecylsulfat (SDS) auf 1X TBS (pH 7,4) Puffer. Die Lösung auf 60 ° C unter ständigem Rühren mit einem Magnetrührer wurden einer SDS löslich.
- Vorbereitung TBS-SDS-Harnstoff-Puffer durch Zugabe von Harnstoff bis zu einer Endkonzentration von 8 M w / v bis 1X TBS-SDS-Puffer (pH 7,4). Die Lösung auf 60 ° C unter ständigem Rühren auf einem Magnetrührer zu Harnstoff aufzulösen.
2. Proben Homogenisierung und Differential Ultrazentrifugation
Hinweis: Der folgende Teil der Arbeit beinhaltet Umgang mit menschlichem Gehirngewebe nach den Regeln des HTA UK. Lokale Standardarbeitsanweisungen sind an allen ti gefolgtmes. Gehirnproben werden aus gefrorenen Gehirn blockiert und Gewebematerial in einem microcabinet bei Unterdruck gehalten homogenisiert seziert. Einwegkittel Handschuhe, Gesichtsmasken, Überschuh-Protektoren und Schutzbrille sind während des gesamten Verfahrens tragen. Menschliches Gewebe Abfall wird nach dem Autoklavieren bei 121 ° C für 20 min für eine sichere Entsorgung verworfen. Sharps (Skalpellklingen) werden in einem geeigneten Behälter für scharfe Gegenstände für Rückhaltung und sichere Entsorgung angeordnet ist.
- Nehmen Sie ein Stück gefrorenes menschliches Gewebe (ca. 0,5 g Gewicht aus der Basalganglien-Region) und schnell in kleine Fragmente (ca. 1 mm 2) auf Eis mit einem kleinen Petrischale und ein steriles Skalpell Blatt vor den Mund. Verwenden Sie eine separate Petrischale und Skalpellklinge für jede Probe. Sammeln Sie das zerkleinerte Gewebe in einem 15-ml-Röhrchen und fügen Sie 10 Volumen eiskaltem 1xTBS Puffer in das Röhrchen.
- Homogenisierung der Proben unter Verwendung eines mechanischen Homogenisators bei 20.000 Upm für 10 sec. Abkühlen auf Eis für 2 min. Wiederholen Sie diesen Schritt drei Zeits.
Anmerkung: Dies ist so, dass die Proben nicht unter Homogenisieren erhitzt. - Klärung durch Zentrifugation bei 1.000 xg für 5 Minuten bei 4 ° C. Entsorgen Pellets von nicht-homogenisierte Material.
- Nehmen Stand (Rohhomogenat), in den Zentrifugenröhrchen (Größe des Rohres hängt von Rotorgröße) Polycarbonat und Waage vorsichtig. Zentrifuge bei 100.000 × g für 1 h bei 4 ° C.
- Behalten Stand als dies der TBS-löslichen Fraktion.
- Waschen Sie das Pellet zweimal in fünf Volumen 1X TBS Puffer und Zentrifuge jedesmal bei 100.000 xg für 15 min bei 4 ° C. Die Überstände verwerfen.
- Resuspendieren endgültige Pellet durch Beschallung des Pellets für 10 Sekunden bei 20 kHz in etwa 5 Volumen 1X TBS-SDS bei RT.
Anmerkung: Vor der Zugabe des SDS enthaltenden Puffer Proben bei 10 ° C gebracht werden, um eine Ausfällung zu vermeiden SDS. - Ultrazentrifuge bei 100,000 × g für 30 min bei 25 ° C.
- Resuspendieren endgültige Pellet durch Beschallung des Pellets für 10 Sekunden bei 20 kHz in etwa 5 Volumen 1X TBS-SDS bei RT.
- Bewahren Überstand, wie das ist the SDB-löslichen Fraktion.
- Waschen Sie das Pellet zweimal in 5 Volumina 1X TBS-SDS-Puffer bei RT. Zentrifuge jedesmal bei 100.000 xg für 15 min bei 25 ° C.
- Solubilisierung des letzte Pellet in 50 ul 1X TBS-SDS-Harnstoff-Puffer unter Verwendung eines Ultraschallgeräts in 20 KHz für 10 Sekunden eingestellt, um eine vollständige Auflösung zu erreichen; dies wird den Harnstoff lösliche Fraktion bezeichnet.
- Assay jede Fraktion auf den Gesamtproteingehalt unter Verwendung eines kommerziellen Protein-Assay-Kit nach Herstellerprotokoll. Verdünnter TBS-SDS-Harnstoff-Proben 1: 1 mit 1X TBS-Puffer, um die Kompatibilität mit der Protein-Assay-Reagenzien zu ermöglichen. Freeze-Proben in kleinen Aliquots (20 ul) bei -80 ° C, um Einfrieren und Auftauen zu reduzieren.
Anmerkung: Zusatz von 10% Glycerin, um Proben für die langfristige Lagerung empfohlen bei -80 ° C.
3. Immunoblotting von Proben und analysieren Ergebnisse
- Führen Sie Proben von TBS, TBS-SDS und TBS-SDS-Urea-Extrakte auf 10-Well-4-12% Bis-Tris-Polyacrylamidgelmit MOPS als Laufpuffer Verwendung von Standardtechniken. Siehe Gallagher und Chakravarti (2008) 29 für eine detaillierte Western-Blot-Protokoll.
- Last 10 ug Protein aus jeder Probe auf jeder Spur zusammen mit einem Molekulargewichtsmarker für TBS und SDS und Harnstoff-Fraktionen.
- Laufen Gel bei 200 V für 1 Stunde oder bis die blaue Farbe von Ladepuffer den Boden des Gels erreicht hat.
- Transferproteine aus Gelen elektrophoretisch auf Nylonmembranen 28, zuerst in 100% Methanol und dann vorbenetzt in Transferpuffer, der 20% Methanol. Geben Sie ein Kennzeichen auf dem Blot, um das Protein Seite und die Orientierung der Molekulare Größenmarker zu bestimmen.
- Sandwich des Gels mit der Membran neben feuchtem Filterpapier. Korrekte Platzierung der Membran entscheidend ist mit der Membran zwischen dem Gel und der Anode. Führen Sie den Transfer für 2 h bei 40 V.
- Make up 1X PBS-Tween (1X PBS-T) Puffer: Man löst 1 Tablette PBS in 200 mlWasser unter Bildung von 0,01 M Phosphatpuffer, 0,0027 M Kaliumchlorid und 0,137 M Natriumchlorid, pH 7,4.
- Blockieren die Membran in 5% BSA-Lösung in 1X PBS-T für 30 min mit 70 UpM schüttelnd. Dies verhindert, dass nicht-spezifische Bindung des primären Antikörpers an die Membran.
- Sonde, die das Protein-Blot mit 6 ml α-syn Primärantikörper Syn-1 (BD Biosciences, monoklonaler Maus-Antikörper) bei 1: 750 Verdünnung (O / N bei 4 ° C), gefolgt durch eine Reihe von Waschungen mit 1X PBS-T ( 3 x je 5 min) 28.
- Inkubieren des Blots mit dem geeigneten HRP konjugierten sekundären Antikörper bei einer 1: 2.000-Verdünnung für 30 min. Durchführen einer Reihe von Waschvorgängen (3 x je 5 min) mit 1 × PBS-T.
- Tauchen Blots in verstärkten Chemilumineszenz-Lösung für 15 Sekunden in einem dunklen Raum. Abdeckung Blots mit einer Klarsichtfolie und Ort Autoradiographie-Filme gegen den Blot mit Proteinseite nach oben in einer lichtdichten Kassette die entsprechenden Signale (angemessene Größe Bänder) zu erfassen.
- Entwickeln Autoradiographie Filme in einem automatischen Entwickler.
Hinweis: Flecken kann auch manuell unter Verwendung der Entwickler und Fixierer aus einer kommerziellen Quelle, falls ein automatisiertes Entwicklersystem nicht verfügbar ist entwickelt werden.
- Inkubieren Sie die Western-Blot mit 6 ml Western-Blot-Stripping-Puffer für 10 Minuten unter konstantem Schütteln, um die Blot von α-syn-Antikörper Signalstreifen. Führen Sie die Schritte durch, um 3.43 3.6.2 Verwendung von beta-Actin primären Antikörpers (monoklonaler Maus) bei 1: 8.000-Verdünnung.
- Scannen und konvertieren Sie das endgültige Bild in ein TIFF-Bild und messen Dichten mit NIH ImageJ zur Quantifizierung Zwecke (eine kostenlose Software zum Download).
Hinweis: Die Software ermöglicht das Lesen der Dichten der relativen Fläche von Interesse (die entsprechende Größe Bänder) und die Daten können ausgedrückt werden entweder als ein Verhältnis der α-syn Dichte / β-Actin (a house-keeping Gen) als willkürliche Einheiten oder eine eigene, wenn ein Housekeeping-Gen nicht gültig ist (wie im Falle von Harnstoff-lösliche Proben).
Ergebnisse
TBS, SDS und Harnstoff lösliche Proteine aus Basalganglien nach dem in Figur 1 dargestellten Protokolls extrahiert wurden auf Gelen laufen gelassen und mit dem Syn-1 monoklonalen Maus-α-syn primären Antikörper immungeblottet. Die TBS löslichen Fraktionen zeigten die Anwesenheit von monomeren α-syn (~ 14 kDa-Spezies) im PD und Kontrollfällen untersucht (Abbildung 2A). Die SDS löslichen Fraktionen zeigten auch reichlich monomeren α-syn in allen drei Subtypen von Fällen untersucht, wie in der geringen Exposition Blot (2C) angezeigt. Die PD Fällen zeigte auch höheres Molekulargewicht (MW) α-syn-Spezies auf der hohen Belichtungs Blot gesehen, die wahrscheinlich Oligomere (2C) sind. Der Harnstoff lösliche Fraktionen von PD Fälle zeigten erhöhte Mengen an α-syn-Monomere, Oligomere und im Vergleich zu Fällen zu steuern aggregierten Spezies. Die neokortikalen idiopathischer PD Fälle zeigen höhere Mengen an AGGREG ATED α-syn-Spezies, während die limbischen Fälle zeigen Zwischenstufen von unlöslichen α-syn. Sowohl die SDS und Harnstoff-Fraktionen aus idiopathischer PD Fälle zeigen variable Ebenen der abgeschnittenen α-syn-Produkte bei 12 kDa und 6 kDa wie beschrieben 20. Im Gegensatz dazu die Steuer Fällen keine unlöslichen oder aggregierten α-syn (2E) zu zeigen. Semi-quantitative Dichte Maßnahmen spiegeln die Menge der LB Last categoriesd mit α-syn Immunhistochemie was die unlösliche Natur der aggregierten α-syn (2B, 2D, 2F) im Neokortex und limbischen PD Fällen.
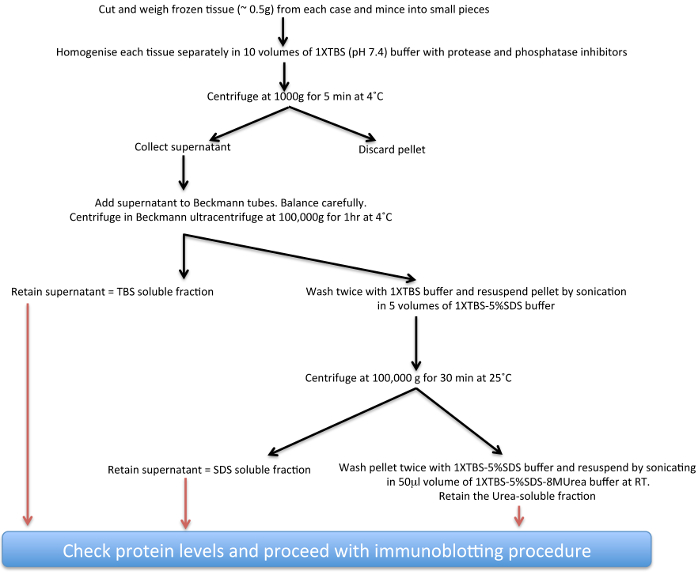
Abbildung 1. Schematische Darstellung der unlöslichen α-syn-Extraktionsverfahren.rget = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
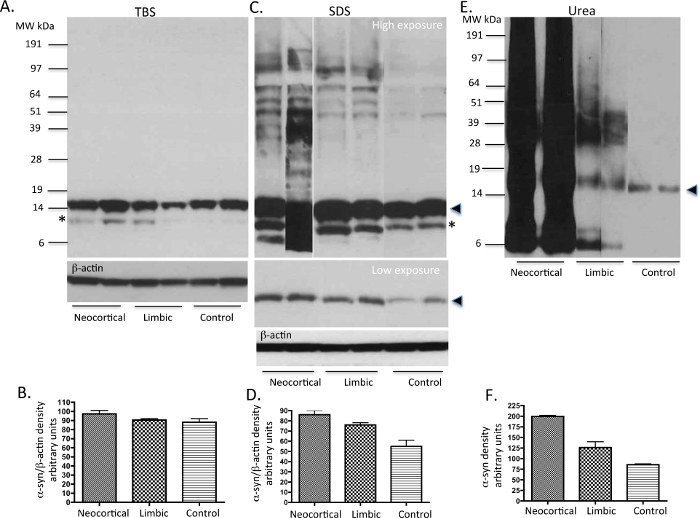
Abbildung 2. Repräsentative Immunoblots von α-syn Stufen von PD und menschlichem Gewebe zu steuern. TBS, SDS und Harnstoff löslichen Fraktionen von Basalganglien (einer Region, die α-syn Pathologie birgt in PD Fälle) der idiopathischen PD Fälle und neurologisch normalen (Kontroll-) Gehirne wurden auf die Anwesenheit von α-syn mit Western Immunoblot analysiert. 10 ug Protein wurde auf jede Spur geladen. In TBS, die Anteile (A), hauptsächlich α-syn-Monomere sind in allen Fällen vorhanden. In SDS-Fraktionen (C), werden einige Oligomere von α-syn zusammen mit Monomeren, die hauptsächlich in der PD Gewebe gesehen. In Harnstoff-Fraktionen (C), Monomere, Oligomere und aggregierte α-syn variabel in der PD Fällen reflectin exprimiertg jeweiligen LB Last. Die neurologisch normalen Kontrollproben zeigen die Gegenwart von nur geringen Mengen an monomeren α-syn. Bitte beachten Sie mögliche Abbauprodukte von α-syn sind in einem Teil der Fälle mit hoher LB Last gesehen. Der feste Pfeilspitze stellt den monomeren Form des α-syn. Der * möglicherweise eine C-terminal verkürzte Form von α-syn, wie zuvor beschrieben 20,26. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Fall | Sex | alter Jahre | Post-mortem-Verzögerung (Stunden) | pH-Wert des Gewebes |
| Neokortikalen 1 | M | 82 | 40 | 6.3 |
| Neokortikalen 2 | F | 75 | 35,3 | 6.4 |
| Limbic 1 | M | 81 | 28,5 | 6.2 |
| Limbic 2 | F | 79 | 36,5 | 6.2 |
| Control 1 | M | 80 | 38 | 6.1 |
| Control 2 | F | 83 | 32,5 | 6.3 |
Tabelle 1 Begrenzte Demographie der Fälle verwendet
Diskussion
Dieser Artikel beschreibt eine biochemische Protokoll für die Extraktion und Untersuchung der unterschiedlichen Löslichkeit Eigenschaften der monomeren, oligomeren und aggregiert α-syn von erkrankten Gehirnen mit Denaturierungsgel Laufbedingungen. Dies ist eine gut etablierte Technik zum Studium aggregierten α-syn 17, 18, 20, 21 ein Protein, das normalerweise in seiner nativen Form löslich ist, jedoch gewinnen amyloidogenen oder erhöhte Aggregationseigenschaften mit Fortschreiten der Erkrankung oder mit genetischen Mutationen. Dennoch haben einige Gruppen leichte Variationen in SDS-Konzentrationen in ihrem Puffer verwendet (8% oder 10% statt 5%) 21,22, 30. Der SDS ist ein anionisches Detergens und solubilisiert α-syn-Oligomere, die Membran-gebundene Formen umfassen kann α-syn, während Harnstoff denaturiert ein chaotropes Reagenz der unlöslichen aggregiert und fibrillären oder amyloidogenen Formen von α-syn 20. In diesem Zusammenhang eine systematische Untersuchung von Paleologou et al 31 untersucht die Stabilitätvon α-syn-Oligomeren und Fibrillen mit unterschiedlichen Konzentrationen an Harnstoff (6,5-8 M) oder SDS (0,25-2%) und berichtet, daß Oligomere in SDS-Konzentrationen stabil, aber nicht mit hohen Konzentrationen an Harnstoff. Ihre Fila-1-Antikörper, der spezifisch für α-syn-Oligomeren und Fibrillen detektiert höheren Konzentrationen von Fibrillen mit 6,5 M Harnstoffkonzentrationen unter nicht-denaturierenden Bedingungen. Die Pufferkonzentrationen in diesem Protokoll verwendet genau widerspiegelt, was in Culvenor et al. (1999) 32.
Die anatomischen Hirnregionen für biochemische Extraktion der unlöslichen α-syn sollten sorgfältig ausgewählt werden und dies sollte α-syn LB und LN Belastung widerspiegeln, je nach Fortschreiten der Krankheit 33,34. Die hier verwendeten Fälle sind Basalganglien Proben aus den Neokortex und limbischen Subtypen von PD spät und Zwischenstufen der PD Progression nach McKeith reflektierenden ctriteria 34. Am Queen Square Hirnbank, die eine Hälfte des Gehirnsroutinemßig in Formalin für die histochemische Analyse fixiert und die andere Hälfte wird vorsichtig in verschiedenen anatomischen Bereichen seziert und schockgefroren und bei -80 o C Gefrierschränke für weitere biochemische und DNA / RNA-Analyse Untersuchungen gelagert. Nach Formalinfixierung der Gehirne und Dissektion von Neuropathologen, wird Immunhistochemie unter Verwendung α-syn-Antikörper und Ergebnisse archiviert. Auch als Routineverfahren wird der pH-Wert der Hirngewebe bei der Ankunft als Maß agonal Stand der Hirngewebe gemessen. Dies bildet eine solide Grundlage für die Qualität der Gewebekonservierung für die biochemische Analyse.
Unsere Daten zeigen, dass hier gibt es mehr SDS lösliche α-syn-Monomer in PD Fällen im Vergleich zu Kontrollen; insbesondere die neokortikalen PD Fällen hat im Vergleich zum limbischen PD Vielzahl höheren α-syn Last. Die neokortikalen Fälle stellen größere Progression von PD α-syn Pathologie in den Neokortex Regionen wie den frontalen und parietalen corTices 33,34. Das limbische PD Fällen haben höhere LB Ticker im basalen Vorderhirn / limbischen Regionen Bereichen wie der Amygdala, transentorhinal und cinguli Regionen. Für aussagekräftige Daten und statistische Analysen, muss man mindestens 4 Fällen von jeder Kohorte laufen. Ebenso haben wir eine statistische Analyse der Blot hier vorgestellten Daten nicht versucht.
Es muss auch darauf hingewiesen, dass verschiedene Antikörper können verschiedene Formen / Zusammensetzung der höheren Ordnung α-syn Oligomere erkennen und jedes kann seine eigene relative Sensitivität und Präferenz haben werden. Dies ist aus den Ergebnissen von 29 Tong et al., Wo sie zeigen, dass die 4 verschiedenen α-syn-Antikörpern (Syn-1, SS, Onco und LB509) erhalten veränd Ergebnisse zumindest für α-syn-Oligomere / Aggregate. Die α-syn-Monomere wurden in ähnlichem Ausmaß von allen 4 Antikörpern erkannt obwohl diese Abweichung abhängig davon, ob die α-syn Antikörperepitop befindet sich entweder in der N-terminalen oder C haben-terminalen 29. Ähnlich spezifische Antikörper für phospho-alpha-Synuclein bestimmen verschiedene hochmolekulare α-Synuclein Spezies 20,21. In dem hier beschriebenen Protokoll, das hoch gekennzeichnet Antikörper Syn-1 verwendet wurde, 19-21.
Jedoch ist es wichtig zu berücksichtigen, die Validierung jedes neue Antikörper auf Western-Blots durch Antikörper Präabsorption Versuchen sowie Überexpression und Zuschlags des Proteins in den Zellen.
Es ist wichtig, andere Variationen, die von den Forschern angewendet wurden betrachten, um kleinere Fragmente α-syn und tetrameren oder instabilen α-syn Formen zu bestimmen. Dies könnte mild-Fixierung von Membranen mit 0,4% PFA in PBS auf verkürzte Formen von α-syn 35 oder Behandlung von Proben Homogenate mit Vernetzer behalten zu stabilisieren Tetramere 36 gehören.
Genaue biochemischen Auswertung von Proteinen unter Verwendung von Post-mortem-tiUSGABE erfordert die Minimierung der enzymatischen Proteinabbau und Veränderung. Es ist daher ratsam, um Gewebe mit den kürzesten post-mortem Verzögerungen innerhalb der Fallkohorten zu verwenden und / oder wählen Sie abgestimmte Proben. Immunhistochemie unter Verwendung von Standardantikörper für α-syn Immunhistochemie sollte vor Beginn der Isolierungsprotokoll durchgeführt werden. Das Ausmaß der α-syn-Pathologie ist sehr variabel und können entsprechend ausgewählten Regionen variieren. Es ist ratsam, Regionen mit reichlich Pathologie als eine positive Kontrolle für eine optimale Ausbeute bei jedem Durchlauf auszuwählen. Die Verwendung von Protease-Inhibitoren und ggf. Phosphataseinhibitoren unerwünschten enzymatischen Abbau zu verhindern, nach der Freigabe von intrazellulären Proteasen oder Phosphatasen während Zelllyse vorkommende und Aufrechterhalten der Proben bei 4 & deg; C ist entscheidend.
Wichtig ist, daß alle Proben innerhalb der Charge von Experimenten sind gleichmäßig und einheitlich behandelt werden, um intra-Benutzer Variationen zu vermeiden; Mehrfach freEZE-Auftau-Zyklen zu vermeiden, da diese potenziell posttranslationale Modifikationen wie Phosphorylierung zurückzuziehen. Ein kritischer Punkt zu bedenken, bei der Prüfung einer großen Anzahl von Proben ist, dass die Daten von Immunoblots sollten normalisiert werden, um eine Probe, die parallel zu allen anderen Proben auf den Gelen, und alle zu dieser Probe referenzierten Daten ausgeführt werden soll. Dies geschieht, um eine Normalisierung der Immunoblot Daten zwischen mehreren Blots gewährleisten. Dies ist die in unserer aktuellen Studie 22 angewandte Methode.
Es sei darauf hingewiesen, dass, um die Hintergrund ECL gering zu halten, werden die Blots nicht zu jeder Zeit während der Western-Blot-Protokoll austrocknen werden. Darüber hinaus sollte sehr lange Belichtungszeiten (> 10 min) auf Autoradiographie Filmen vermieden werden, da dies zu einer Sättigung des ECL-Signals führen und zu ungenauen Quantifizierung führen.
Das obige Protokoll ist eine relativ einfache Technik mit gemeinsamen Laborreagenzien und inInstrumente und können ein wertvolles Werkzeug für die Untersuchung der Pathophysiologie der α-syn-Protein in PD Forschung sein. Diese Methode kann nicht nur mit entsprechenden Änderungen in der Untersuchung der α-syn Biologie in α-syn transgenen Tieren, sondern auch für andere neurodegenerative Erkrankungen mit abnormalen Ablagerungen von aggregierten Proteinen, wie AD, MSA, DLB, HD und frontotemporaldementias verlängert. Jedoch sind die hier beschriebenen Western-Blot-Daten könnten auch unter Verwendung von Enzym-Immuntests unter Verwendung von Antikörpern für spezifische Formen von α-syn-31 geprüft.
Offenlegungen
Der Autor hat nichts zu offenbaren.
Danksagungen
I thank Dr Adamantios Mamais for extracting α-synuclein from human tissue and running of blots. This work was supported in part by a MRC Grant (MR/L010933/1) and in part by the Wellcome Trust/MRC Joint Call in Neurodegeneration award (WT089698) to the UK Parkinson's Disease Consortium (UKPDC) whose members are from the UCL Institute of Neurology, the University of Sheffield and the MRC Protein Phosphorylation Unit at the University of Dundee. RB received funding from MJFox foundation for this work and is also funded by the Reta Lila Weston Trust.
Materialien
| Name | Company | Catalog Number | Comments |
| Tris-HCL | Sigma | T5912 | |
| sodium chloride | VWR | 27800.291 | |
| SDS | Fluka | 71727 | |
| Urea | Sigma | U5378 | |
| Protease inhibitor tablets | Roche | 04 693 116001 | |
| Phosphatase inhibitor tablets | Roche | 04 906 837001 | |
| Phosphate buffered saline tablets | Sigma | P4417 | |
| Tween-20 | Sigma | P9416 | |
| NuPAGE MOPS SDS running buffer | Invitrogen | NP0001 | |
| NuPAGE transfer buffer | Invitrogen | NP0006-1 | |
| Hybond-P membrane | GE Healthcare | RPN303F | |
| Whatman 3MM filter paper | Sigma | WHA30306185 | |
| Bis-tris gels 4-12% | Invitrogen | NP0322BOX | |
| Supersignal West Pico Chemiluminescent substrate | Pierce | 34080 | |
| Bio-RAD DC protein assay kit | Bio-Rad | 500-0112 | |
| Thickwall Beckman Polycarbonate tubes | Beckman | 355630 | |
| Western blot stripping buffer | Thermo scientific | 46430 | |
| Syn-1 primary antibody (mouse monoclonal) | BD Biosciences | 610786 | |
| beta-actin primary antibody (mouse monoclonal | Sigma | A5441 | |
| HRP cojugated goat anti-mouse secondary antibody | Santa Cruz | sc-2031 | |
| Bovine serum albumin | Sigma | A7030 | |
| Instrument | Company | Rotor/ model no | |
| Benchtop Ultracentrifuge Optima Max | Beckman | MLA-80 | |
| Sonicator | Heat Systems | XL20-20 | |
| Homogeniser | Jenke and Kunkel | TP18/10 |
Referenzen
- Forman, M. S., Trojanowski, J. Q., Lee, V. M. Neurodegenerative disease a decade od discoveries paves the way for therapeutic breakthroughs. Nat Med. 10, 1055-1063 (2004).
- Spillantini, M. G., Schmidt, M. L., Lee, V. M., Trojanowski, J. Q., Jakes, R., Goedert, . M. A-synuclein in Lewy bodies. Nature. 388, 839-840 (1997).
- Spillantini, M. G., Crowther, R. A., Jakes, R., Hasegawa, M., Goedert, M. Alpha-synuclein in filamentous inclusions of Lewy bodies from Parkinson's disease and dementia with Lewy bodies. Proc Natl Acad Sci. 95, 6469-6473 (1998).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. Am J Pathol. 152, 879-884 (1998).
- Ahmed, Z., et al. The neuropathology, pathophysiology and genetics of multiple system atrophy. Neuroptahol Appl Neurobiol. 38 (1), 4-24 (2012).
- Ploymeropoulos, M. H., et al. Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. Science. 276, 2045-2047 (1997).
- Kruger, R., et al. Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson's disease. Nat Genet. 18, 106-108 (1998).
- Zarranz, J. J., et al. The new mutation, E46K, of alpha-synuclein causes Parkinson and Lewy Body dementia. Ann. Neurol. 55, 164-173 (2004).
- Proukakis, C., et al. A novel alpha-synuclein missense mutation in Parkinson disease. Neurology. 80 (11), 1062-1064 (2013).
- Kiely, A., et al. Synucleinopathy associated with G51D SNCA mutation: a link between Parkinson's disease and Multiple System atrophy?. Acta Neuropathol. 125 (5), 753-769 (2013).
- Lesage, S., et al. G51D alpha-synuclein mutation causes a novel Parkinson-pyramidal syndrome. Ann Neurol. 73 (4), 459-471 (2013).
- Singleton, A. B., et al. Alpha-synuclein locus triplication causes Parkinson's disease. Science. 302, 841 (2003).
- Chartier-Harlin, M. C., et al. Alpha-synuclein locus duplication as a cause of familial Parkinson's disease. Lancet. 364, 1167-1169 (2004).
- Cookson, M. R., Hardy, J., Lewis, P. A. Genetic neuropathology of PD. Int J Clin Exp Pathol. 1 (3), 217-231 (2008).
- Fauvet, B., et al. α-synuclein in central nervous system and from erythrocytes, mammalian cells, and. Escherichia coli exists predominantly as disordered monomer. J Biol Chem. 287, 15345-15364 (2012).
- Bartels, T., et al. α-synuclein occurs physiologically as a helically folded tetramer that resists aggregation. Nature. 477, 107-110 (2011).
- Campbell, B. C., et al. Accumulation of insoluble alpha-synuclein in dementia with Lewy bodies. Neurobiol of Dis. 7 (3), 192-200 (2000).
- Campbell, B. C., et al. The solubility of alpha-synuclein in multiple system atrophy differs from that of dementia with Lewy bodies and Parkinson's disease. J Neurochem. 76, 87-96 (2001).
- Miller, D. W., et al. Alpha-synuclein in blood and brain from familial Parkinson's disease with SNCA locus triplication. Neurology. 62, 1835-1838 (2004).
- Anderson, J. P., et al. Phosphorylation of Ser-129 is the dominant pathological modification of alpha-synuclein in familial and sporadic Lewy body disease. J Biol Chem. 281, 29739-29752 (2006).
- Zhou, J., et al. Changes in the solubility and phosphorylation of alpha-synuclein over the course of Parkinson's disease. Acta Neuropathol. 121, 695-704 (2013).
- Mamais, A., et al. Divergent solubility and aggregation properties in G2019S LRRK2 Parkinson's disease brains with Lewy Body pathology compared to idiopathic cases. Neurobiol of Dis. 58, 183-190 (2013).
- Lashley, T., et al. A comparative clinical, pathological, biochemical and genetic study of fused in sarcoma proteinopathies. Brain. 134 (pt9), 2548-2564 (2011).
- Brelstaff, J., et al. Transportin-1: a marker of FTLD-FUS. Acta Neuropathol. 122 (5), 591-600 (2011).
- Kahle, P. J., et al. Hyperphosphorylation and insolubility of alpha-synuclein in transgenic mouse oligodendrocytes. EMBO reports. 3 (6), 583-588 (2002).
- Nuber, S., et al. A progressive dopaminergic phenotype associated with neurotoxic conversion of α-synuclein in BAC-transgenic rats. Brain. 136, 412-432 (2013).
- Tofaris, G. K., et al. Pathological changes in dopaminergic nerve cells odf the substantia nigra and olfactory bulb in mice transgenic for truncated human a-synuclein (1-120): implications for Lewy Body disorders. J Neurosci. 26 (15), 3942-3950 (2006).
- Neumann, M., et al. FET proteins TAF15 and EWS are selective markers that distinguish FTLD with FUS pathology from amyotrophic lateral sclerosis with FUS mutations. Brain. 134 (9), 2595-2609 (2011).
- Gallagher, S., Chakravarti, D. Immunoblot analysis . J Vis. Exp. (16), e759 (2008).
- Tong, J., et al. Brain alpha-synuclein accumulation in multiple system atrophy, Parkinson's disease and progressive supranuclear palsy: a comparative investigation. Brain. 133, 172-188 (2010).
- Paleologou, K. E., et al. Detection of elevated levels of soluble α-synuclein oligomers in post-mortem brain extracts from patients with dementia with Lewy bodies. Brain. 132, 1093-1101 (2009).
- Culvenor, J. G., et al. Non-Aβ component of Alzheimer s disease Amyloid (NAC) revisited. American Journal of Pathology. 155 (4), 1173-1181 (1999).
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiol Aging. 24, 197-211 (2003).
- McKeith, I. G., et al. Diagnosis and management of dementia with Lewy bodies: third report of the DLB consortium. Neurology. 65, 1863-1872 (2005).
- Lee, B. R., Kamitani, T. Improved immunodetection of endogenous α-synuclein. PLoS ONE. 6, e23939 (2011).
- Newman, A. J., et al. A new method for quantitative immunoblotting of endogenous α-synuclein. PLoS ONE. 8 (11), e81314 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten