Method Article
光驱动脱羧酶
摘要
我们描述用于光催化生成过氧化氢的一个协议 - 对于氧化转化的辅因子。
摘要
氧化还原酶属于施加大多数工业酶。然而,他们需要外部的电子,其供应往往是昂贵的,具有挑战性的。的电子给体的NADH或NADPH的回收需要使用的其他酶和牺牲衬底。有趣的是,几个氧化还原酶接受过氧化氢作为电子供体。而价格便宜,这种试剂通常会减少酶的稳定性。一种解决这个问题是在原位产生的辅因子。在低浓度的辅助因子的连续供应驱动而不损害酶的稳定性进行反应。本文展示了一种方法的光催化在原位生成过氧化氢 与血红素依赖性脂肪酸脱羧酶OLET 乙脑的例子。脂肪酸脱羧酶OLET JE是由于发现了其独特的生产脂肪酸,一个名不见经传的酶长链1-烯烃能力反应。 1-烯烃被广泛使用的添加剂为增塑剂和润滑剂。 OLET JE已经显示,以接受来自过氧化氢 的电子的氧化脱羧。而加入过氧化氢 损失的酶,并在低的产率的结果, 在原位生成辅因子的规避这个问题。该photobiocatalytic系统显示关于酶活性和产率,从而导致对脂肪酸脱羧一个简单而有效的系统明显的优势。
引言
气候变化和可再生资源的消耗可预见的对我们的社会构成严重威胁。在这种情况下,酶催化表示的可持续发展和"绿色"化学1仍然没有完全利用的潜力。氧化还原酶有催化温和反应条件下的引入和官能团的修饰和属于最重要的生物催化剂2的能力。大多数的氧化还原转换需要的外部辅因子的供给,如NAD(P)H。对辅因子再生的方法在工业规模得到了应用。然而,他们仍然导致高工艺成本,这主要是限制了其应用到高价值产品。有趣的是,几个过氧化物3,4-和P450单加氧酶5经由所谓的过氧化物分流接受来自过氧化氢 的电子。而H 2 O 2是一种廉价共试剂,它是据报道harmfUL许多酶。一个稳定的原位形成 的低浓度的过氧化氢的是驱动反应而不损害酶的操作稳定性的可行方法。
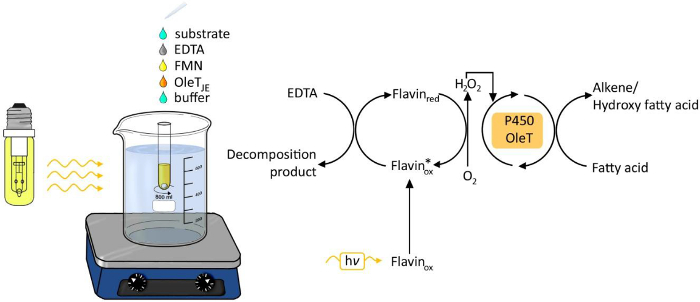
图由OLET JE脂肪酸的photobiocatalytic脱羧1.实验装置。 请点击此处查看该图的放大版本。
利用光作为化学和生物过程的能源已收到在过去的6年越来越多的关注。光驱动生成过氧化氢 的已成为一种简单和可靠的方法来提供用于氧化还原转换( 图1)的过氧化氢 。一种光催化剂,如黄素腺嘌呤星期一onucleotide核苷酸(FMN)允许分子氧与过氧化氢,然后被用作辅因子的酶oxyfunctionalization反应的减少。可能的电子供体是乙二胺四乙酸(EDTA),抗坏血酸或廉价的甲酸盐。该方法是普遍适用的 H 2 O 2的依赖性酶,包括过氧化物3,4-和P450单加氧酶5。
最近我们已经调查了一种新的细菌脱羧酶7的应用为天然脂肪的转化为烯烃8。这将是中广泛使用的平台化学品从基于生物源合成一个持续路由。从革兰氏阳性菌Jeotgalicoccus藻脱羧酶OLET JE。催化脂肪酸氧化脱羧并且形成1-烯烃作为产品。 OLET 乙脑是密切相关的细菌细胞色素P450单加氧酶和需要的电子˚FROM的过氧化氢的反应。
不幸的是,加入的 H 2 O 2与底物和酶的溶液中导致低转化率和结果的重复性差,大概是由于过氧化氢 对OLET 乙脑的稳定性产生有害影响。与NADPH还原酶RhFred的融合蛋白的产生做出了NADPH依赖性脱羧可能。9尽管如此,价格高NADPH的和具有成本效益的再生电流限制的可能性促使我们研究更便宜的电子供体。通过OLET JE的相似性P450单加氧酶的启发,我们使用的光催化生成H 2 O 2。我们高兴使用无细胞提取物或纯化的酶溶液,以获得高的转化率(高达> 95%)。
随着脂肪酸脱羧的例子中,我们提出了光驱动enzym一般协议使用FMN作为光催化剂和过氧化氢作为辅助因子ATIC氧化还原转换。所提出的方法包括在大肠杆菌中的重组细胞生产所述酶的大肠杆菌 ,酶的纯化,用于1-烯烃的合成和反应产物的分析中的应用。
研究方案
注意:使用前请咨询所有相关的材料安全数据表(MSDS)。几个在这些合成中使用的化学品是剧毒和致癌性。所有涉及有害有机溶剂中,反应产物的特别的提取和脂肪酸衍生的步骤必须在通风橱下使用个人防护设备(安全眼镜,手套,实验室外套,全长裤,封闭趾鞋来进行)。所有涉及这项工作转基因生物操作要求被批准用于处理安全水平S1的转基因生物的安装。
1.重组脱羧酶OLET JE在大肠杆菌中表达大肠杆菌
- 生产菌株的制备
- 从Jeotgalicoccus制备OLET 乙脑的合成基因,并克隆到表达载体如所述PASK-IBA37plus 8
注意:要通过酶避免了细菌的代谢, 大肠杆菌脂肪酸降解使用的是来自庆应义塾收集与脂肪酸降解途径失调大肠杆菌菌株JW5020。
- 从Jeotgalicoccus制备OLET 乙脑的合成基因,并克隆到表达载体如所述PASK-IBA37plus 8
- 培育和酶的诱导表达
- 接种大肠杆菌制备预培养从的LB板中在试管2个3毫升的LB培养基(含100μg毫升-1氨苄青霉素) 大肠杆菌 JW5020 OLET突变体。从原液成用于选择的介质吸管氨苄青霉素(100微克毫升-1),以180rpm孵育在37℃下15小时在振荡孵化器。
- 将2ml的预培养物添加到两份各为200ml的LB培养基,含有氨苄青霉素(100微克毫升-1)时 ,在1升摇瓶中。孵育进行在37℃和180转。
- 监测OD 600nm的变化 后接种。当OD 600达到0.6之间的值。ð0.8通过添加四环素(0.2微克毫升-1)诱导的表达。孵育培养物在20℃下15小时和180的转速。
注意:由于OLET JE含有血红素辅因子,需要另外δ氨基乙酰丙酸(0.5毫摩尔)之前,感应的,以提供培养用为辅助因子合成的前体。
- 细胞裂解
- 进行冰上以下步骤。倾析或移液枪转移到培养离心管中,并使用规模,以确保公平分配。离心20分钟培养在4℃下12000 xg离心。
- 小心弃去上清液,并通过移液重悬颗粒在50ml缓冲液(Tris 50mM的,氯化钠的200mM,pH7.5)中,并在离心管转移悬浮液中。
- 在4℃离心在4000 xg离心15分钟后弃上清,通过移液重悬每个粒料在3毫升缓冲液。
- 通过这样进行细胞裂解nicating留在周期之间有1分钟的停顿在冰上溶液(三次循环×30秒)。离心机在4℃以15,000 xg离心20分钟的解决方案,以除去细胞碎片,将上清液转移到一个锥形离心管不通过移液干扰颗粒。弃沉淀。
注:小分子被除去后一溶剂部分将直接用于生物催化。第二级分将被用于His-标记OLET 乙脑纯化。
- 细胞提取物的小分子的去除
- 使用在生物催化的粗提取物除去可能通过在4℃吹打3毫升无细胞提取物的与10 kDa的膜和离心机离心过滤单元以4000 xg离心与过氧化氢的形成或电子转移干扰小分子之前。重悬在3ml Tris-盐酸缓冲液中剩余的蛋白质。
- OLET纯化
- 应用将3ml第二小区提取物与他的飘的Ni-NTA旋转柱,并已用平衡缓冲液(Tris 20mM的,氯化钠的300mM,咪唑的10mM)之前平衡。
- 封与底塞和上部螺旋帽的列和轻轻摇动它们,直到树脂与无细胞提取物均匀分布。孵育在4℃的塔顶摇床进行30分钟的加载列。
- 通过在700 xg离心离心2分钟用1ml洗涤缓冲液(的Tris 20mM的,氯化钠的300mM,咪唑的20mM,pH 7.4)中洗柱。重复此步骤两次。
- 放置的列到一个新的圆锥形离心管中,加入1ml洗脱缓冲液(的Tris 20mM的,氯化钠的300mM,咪唑250mM的,pH值7.4)OLET JE。离心机700 XG 2分钟,重复此步骤两次。
注:咪唑将绑定到镍,因此从列中删除OLET JE。 - 洗脱转移到离心过滤单元(10 kDa的纪念品brane),并在4000 xg离心离心机,在4℃以除去咪唑。
- 通过SDS-PAGE(15%)。9混合3微升用SDS缓冲液(终浓度1×)洗脱的检查酶的纯度和孵育在95℃的溶液中5分钟变性。接着应用上的SDS-PAGE的总量。运行使用商业标准蛋白在35毫安凝胶。检测该蛋白质在50 kDa的。
- 为了确定蛋白浓度使用市售的BSA-套件。吸移管将50μl稀释的蛋白质样品(1:100 1:200 1:500)和BSA标准品(0,20,30,40,50,60,80,100毫克毫升-1)在一个96孔板。加入200μlBradford试剂的,测量之后,用荧光15分钟在595nm处的吸光度,并使用该标准曲线计算浓度。
2.光催化的生物转化
- 没有过氧化氢 加成生物催化反应
- 通过加入10%(V / V)TERGITOL和0.0284克硬脂酸蒸馏水制备的10毫硬脂酸(Mr 为 284.5克摩尔-1)10ml的储备溶液。在加热腔室中的溶液加热至60℃,直至脂肪酸完全溶解。
- 生物催化和取样
- 制备含有50mM EDTA,0.01毫FMN,0.5的Tris-HCl缓冲液毫硬脂酸两张2毫升反应混合物。添加足够的氧气供应磁性搅拌棒,并放置在水浴中的玻璃管,加热至25℃。
- 200微克毫升-1纯化的酶或10%(体积/体积)无细胞提取液添加到各反应混合物中,用在反应管15厘米的距离一个透明玻璃灯泡(120瓦)照射它们。
- 取200μl的样品,在特定的时间点(0,10,30,60和120分钟和过夜)停止与20微升37%的HCl的反应。添加5微升的肉豆蔻酸(10mM储备所以lution)作为内标。
- 反应产物的分析
- 为萃取加入500μl乙酸乙酯样品两次,反转管和离心以13,000×g的1分钟。
- 取下400微升上清液,让溶剂完全蒸发。
- (三甲硅烷基)三氟乙酰胺(MSTFA) -加入200微升N-甲基-N-衍生的羧酸成trimethylsilylcarboxylic酸。孵育在60℃下30分钟的溶液,以转换羟基到三甲基甲硅烷醚。
- 通过GC / FID转换判定
注:使用GC / FID测定1-十七碳烯(RT:8.34分钟)的形成,α-和β羟基硬脂酸(RT:12.05和12.1分钟)和减小基板(11.15分钟RT)。- 设置为低于设置在注射温度描述〜340℃的温度分布。保持初始炉温为在90℃3.5分钟,随后用45℃分钟-1增加。在220℃,保持2分钟的温度。 45℃分钟-1的反复上升后,保持在280℃的温度下进行2分钟,然后用60℃分钟-1增加。
注:330℃最高温度保持1.44分钟。 - 注入4微升样品,用5分流比,以获得快速挥发并均匀混合与载气氦气。
注:在上增加的温度依存性的底物和产品将进入气相。该物质是由GC / FID检测器在特定的保留时间通过柱后检测到,并显示在屏幕上的峰。观察监视器上峰的形成。 - 由以下公式计算形成产物的浓度:
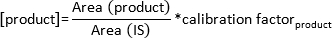
注:校正因子已被用于该列的每个底物和产物通过从已知量衍生的物质和它们的相应的峰面积的计算标准曲线具体确定。
- 设置为低于设置在注射温度描述〜340℃的温度分布。保持初始炉温为在90℃3.5分钟,随后用45℃分钟-1增加。在220℃,保持2分钟的温度。 45℃分钟-1的反复上升后,保持在280℃的温度下进行2分钟,然后用60℃分钟-1增加。
- 通过GC / MS识别烯烃和β羟基酸的峰。
- 通过GC / MS识别烯烃和β羟基酸的峰。置的温度分布。设置注射温度至250℃。保持在100℃的烘箱温度下5分钟,随后用20℃分钟-1增加。
注:最高温度保持7.5分钟。 - 设置质谱仪检测器的温度至250℃,并在电子冲击模式50至500米/ Z扫描。
注意:电子碰撞电离除去造成其将被传递向前用于质量分析的自由基阳离子的形成一个电子。由于内部的高能量intramolar共价键分子突破创造更低的M / Z的片段。这些片段形成特定的物质的指纹。 - 将1μL样品。由相应的指纹( 图2)11.4分钟的保留时间后检测1-十七烯。
- 通过GC / MS识别烯烃和β羟基酸的峰。置的温度分布。设置注射温度至250℃。保持在100℃的烘箱温度下5分钟,随后用20℃分钟-1增加。
结果
而添加过氧化氢 在反应混合物的结果在低到中等的转化(<10%), 在原位产生过氧化氢 的增加的转化率达到80%的转化率。分析的GC / MS显示了从脂肪酸烯烃的形成( 图2)。
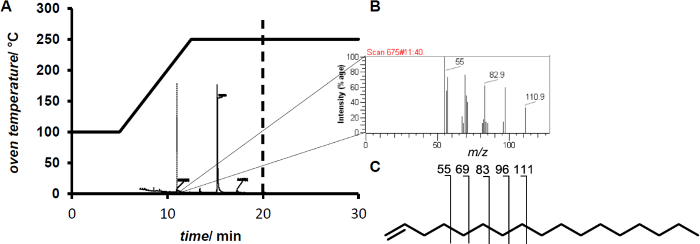
图2.(A)温度GC / MS测量轮廓。 (B)的后11.4分钟1-十七烯洗脱的指纹。 (C)1 -十七烯显示终端烯烃示范性的特点二次为 C n ^ h 2N-1碎片离子。 请点击此处查看该图的放大版本。
光催化反应实现高转化率与大肠杆菌的无细胞提取物大肠杆菌 。精制酶液用于显示酶浓度和转化之间的明显的相关性。的捕光分子FMN铅的浓度提高到更高的转换。然而,增加上述10mM的浓度并没有进一步加速反应,表明过氧化氢的量足够可用且不再是限制因素。
除了 脂肪酸脱羧,OLET JE还催化在β位羟基化。在硬脂酸的转化,脱羧比羟基化快约三倍。在使用0.5毫米硬脂酸的溶液和10μMFMN典型的实验中,基片的99%转化为1-十七烯和2-羟基硬脂酸的混合物与比3.3:1( 图3)8。光驱动的生物催化的衬底频谱的调查表明,脂肪酸具有更长酰基链,OLET JE优先催化脱羧,而在产品混合物羟基脂肪酸的相对量具有较短链长的增加。脂肪酸比肉豆蔻酸(C14)短没有进行脱羧。
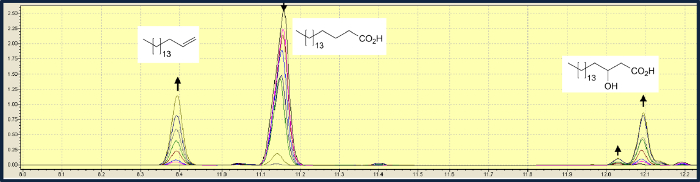
图3.气体OLET 乙脑色谱分析介导的硬脂酸(11.15分钟)的脱羧成1-十七烯(8.4分),α羟基硬脂酸(12.04分钟)β羟基硬脂酸(12.1分钟)。显示取自超过2小时的时间进程样品的峰面积的变化。 请点击此处争夺WA更大的版本这个数字。
出人意料的是,不饱和酸油酸(C18:1D9 顺 )和亚油酸(C18:2d9d12)没有被接受作为底物,这表明顺式双键的扭曲配置不能被容纳在酶的生产性结合模式。油酸(10%)的加成也防止了硬脂酸的转化率。有趣的是,硬脂酸(C18:1D9 反式 )通过OLET JE转换,但具有稍微较低活性然后硬脂酸。
讨论
光驱动的生成过氧化氢 的可应用在各种氧化还原转换,包括peroxygenases 3,chloroperoxidases 10和P450单加氧酶5。这是一个简单可行的方法。从长远来看,利用可见光开辟了利用太阳光进行化学转化,这是能源丰富的反应的可持续替代的观点。
该方法可应用于与纯化的酶或与无细胞提取物。而后者需要成本和工作少,应当注意的是,在粗提取物的小分子可以与光催化转换干扰。可操作的方法是(在离心过滤单元或透析例如 ,通过离心)用微膜,除去这些小部件。捕光分子的FMN的浓度决定了的过氧化氢的浓度。取决于AFFINI氧化还原酶的TY,该浓度是决定性的酶的酶活性。另一个重要因素是在牺牲电子给体的EDTA的浓度。最重要的参数,但是,是酶的操作稳定性和活性。
脂肪酸的olefinization是生物基的脂肪酸转化优雅的反应到属于化工行业主要商品烯烃。光驱动的生物催化脱羧可在室温下,并在中性pH值,从而在持续性方面提供了明显的优点的情况下进行。
我们的研究结果表明, 在原位生成过氧化氢 的是不损害酶稳定性供给辅因子,导致了高的转化率的策略。对辅因子再生本发明的方法用农产品或基于汽油的化学物质。光驱动的反应正在成为可再生替代。未来研究将专门方法牺牲试剂的EDTA由便宜分子的取代,并降低捕光分子的FMN的量。
披露声明
The authors declare that they have no competing financial interests.
致谢
R.K. and F.H. are grateful for the EU-commision for financial support within the Marie-Sklodowska ITN Biocascades (Nr. 634200).
材料
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Ampicillin | Sigma Aldrich | 69-52-3 | |
| Bradford reagent | Roth | K015.1 | |
| BSA | Sigma Aldrich | 90604-29-8 | |
| DMSO | Sigma Aldrich | 67-68-5 | |
| Ethyl acetate | Fisher Chemical | 141-78-6 | |
| Ethylenediaminetetraacetic acid (EDTA) | Roth | 8043.1 | |
| Riboflavin 5-monophosphate sodium salt hydrate | Sigma Aldrich | 130-40-5 | |
| Hydrochlorid acid 37% | Sigma Aldrich | 7647-01-0 | |
| Hydrogen peroxide 30% | Sigma Aldrich | 7722-84-1 | |
| δ-Amino levulinic acid | Sigma Aldrich | 5451-09-2 | |
| N-Methyl-N-(Trimethylsilyl)trifluoro acetamide (MSTFA) | Sigma Aldrich | 24589-78-4 | |
| Myristic acid >99% | Sigma Aldrich | 208-875-2 | |
| Imidazole | Sigma Aldrich | 288-32-4 | |
| Sodium chloride | Fisher Chemical | 7647-14-5 | |
| Stearic acid >99% | Sigma Aldrich | 57-11-4 | |
| Tetracycline | Sigma Aldrich | 60-54-8 | |
| Tergitol | Sigma Aldrich | MFCD01779855 | |
| Tris(hydroxymethyl)-aminomethan | Sigma Aldrich | 77-86-1 | |
| Device | |||
| Incubator shaker | G-25CK | New Brunswick Scientific | |
| Ecotron | Infors HT | ||
| Centrifugation | Labofuge 400R | Heraeus | |
| RC 5B Plus | Sorvall | ||
| Fresco 17 | Thermo Scientific | ||
| Centrifugation rotors | SS34 | Sorvall | |
| SLA | Sorvall | ||
| Clean bench | Envirco | Ceag Schirp Reinraum technik | |
| Column GC-FID | CP-Sil 5CB (30 m x 0.25 mm x 0.25 µm) | Agilent Technologies | |
| Column GC-MS | FactorFour Capillary Coloumn (VF-5 ms + 5 m EZ Guard) | Varian | |
| GC-FID | GC-2010 plus | Shimadzu | |
| GC-MS | IST-40 | Varian | |
| Magnetic stirrer | RCT classic | IKA | |
| pH meter | SevenEasy | Mettler toledo | |
| Sonicator | Branson Sonifier 250 | Branson | |
| Spectral photometer | FLUOstar Omega | BMG Labtech | |
| Equipment | |||
| Affinity chromatography column | His Pur Ni-NTA spin column | Thermo Scientific | |
| Centricon | Vivaspin turbo 15 | VWR International | |
| Microtiter plates | 96 Well Multiply®PCR Plates | Sarstedt |
参考文献
- Kourist, R., Domìnguez de Marìa, P., Miyamoto, K. Biocatalytic strategies for the asymmetric synthesis of profens - recent trends and developments. Green Chem. , 2607-2618 (2011).
- Holtmann, D., Fraaije, M. W., Arends, I. W., Opperman, D. J., Hollmann, F. The taming of oxygen: biocatalytic oxyfunctionalisations. Chemical Comm. 50, 13180-13200 (2014).
- Churakova, E., et al. Specific photobiocatalytic oxyfunctionalization reactions. Ang. Chem. In. Ed. 123, 10904-10907 (2011).
- Hollmann, F., Arends, I., Buehler, K. Biocatalytic Redox Reactions for Organic Synthesis: Nonconventional Regeneration Methods. ChemCatChem. 2, 762-782 (2010).
- Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva, V. V., Urlacher, V. B. Light-driven biocatalysis with cytochrome P450 peroxygenases. Biotechnol. Appl. Biochem. 60, 111-118 (2013).
- Bartsch, M., et al. Photosynthetic production of enantioselective biocatalysts. Microb. Cell. Fact. 14, 53 (2015).
- Rude, M. A., et al. Terminal olefin (1-alkene) biosynthesis by a novel P450 fatty acid decarboxylase from Jeotgalicoccus species. Appl. Environ. Microbiol. 77, 1718-1727 (2011).
- Zachos, I., et al. Photobiocatalytic decarboxylation for olefin synthesis. Chem. Comm. 51, 1918-1921 (2015).
- Liu, Y., et al. Hydrogen peroxide-independent production of α-alkenes by OleTJE P450 fatty acid decarboxylase. Biotechnol. Biofuels. 7, 28 (2014).
- Perez, D. I., Grau, M. M., Arends, I. W., Hollmann, F. Visible light-driven and chloroperoxidase-catalyzed oxygenation reactions. Chem. Comm. 40 (44), 6848-6850 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。