Method Article
光駆動酵素的脱炭酸
要約
我々は、過酸化水素の光触媒生成のためのプロトコルを記述 - 酸化的変換のための補因子です。
要約
酸化還元酵素は、ほとんどの適用産業用酵素に属します。それにもかかわらず、彼らは、その供給、多くの場合、コストがかかり、困難である外部の電子を必要とします。電子供与体のNADHまたはNADPHのリサイクルは、追加の酵素および犠牲基板の使用を必要とします。興味深いことに、いくつかの酸化還元酵素は、電子供与体として過酸化水素を受け入れます。安価でありながら、この試薬は、多くの場合、酵素の安定性を低下させます。この問題を解決するには、補因子の中でその場で生成されます。低濃度の補因子の継続的な供給は、酵素の安定性を損なうことなく、反応を駆動します。本論文では、ヘム依存脂肪酸脱炭酸酵素OLET JEの例で光触媒による過酸化水素のその場世代のための方法を示しています。脂肪酸デカルボキシラーゼOLET JEは、脂肪酸、これまで未知の酵素からの長鎖1-アルケンを生成する独自の能力のために発見されました反応。 1-アルケンは、可塑剤および潤滑剤のため広く使用されている添加剤です。 OLET JEは、酸化的脱炭酸のための過酸化水素から電子を受容することが示されています。過酸化水素損傷補因子のその場生成酵素と低収率をもたらし、添加は、この問題を回避します。 photobiocatalyticシステムは、脂肪酸脱炭酸のための簡単で効率的なシステムでは、その結果、酵素活性及び収率に関する明らかな利点を示しています。
概要
気候変動と再生可能な資源の予測可能な枯渇は、私たちの社会に深刻な脅威をもたらします。この文脈において、酵素触媒は、持続可能で「環境に優しい」化学1の開発のため、まだ十分に活用されない可能性を表しています。酸化還元酵素は、穏やかな反応条件下で官能基を導入し、修飾を触媒し、最も重要な生体触媒2に所属する能力を有します。ほとんどの酸化還元変換は、NAD(P)Hのような補因子の外部の電源を必要とします。補因子再生のための方法は、工業規模で適用されています。しかし、彼らはまだほとんど価値の高い製品への適用を制限する、高い処理コストをもたらします。興味深いことに、いくつかのペルオキシダーゼ3,4およびP450モノオキシゲナーゼ5は 、いわゆる過酸化物のシャントを介して過酸化水素から電子を受け入れます。 H 2 O 2が安い共試薬であるが、それは伝えharmfあります多くの酵素のためのul。 その場の形成が着実に 過酸化水素の低濃度の酵素の安定動作を損なうことなく、反応を駆動するための実行可能なアプローチです。
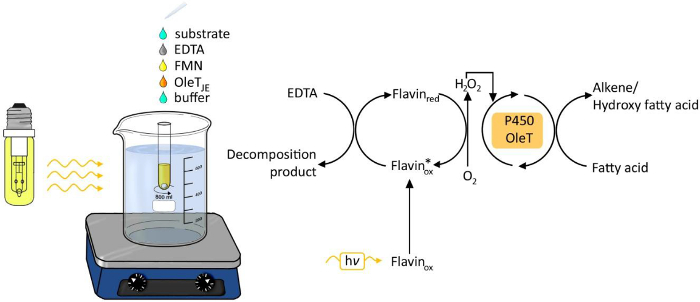
OLET JEによって脂肪酸のphotobiocatalytic脱炭酸の図1.実験のセットアップ。 この図の拡大版をご覧になるにはこちらをクリックしてください。
化学的および生物学的プロセスのためのエネルギー源として光を使用することは、最後の年6に増加注目されています。過酸化水素の光駆動世代レドックス変換( 図1)のために過酸化水素を供給することが容易かつ強固な方法として登場しました。このようなフラビンアデニン月として光触媒onucleotide(FMN)を酵素oxyfunctionalization反応の補因子として使用される過酸化水素に分子酸素の還元を可能にします。可能な電子供与体は、エチレンジアミン四酢酸(EDTA)、アスコルビン酸又は安価なギ酸です。この方法は、ペルオキシダーゼ3,4およびP450モノオキシゲナーゼ5を含むH 2 O 2依存性酵素のための一般的に適用可能です。
我々は最近、オレフィン8への天然脂肪の転換のための新規の細菌カルボキシラーゼ7の適用を検討しました。これは、バイオベースのソースから広く使用されているプラットフォームの化学物質の合成のための持続可能な経路であろう。グラム陽性菌Jeotgalicoccus SPからカルボキシラーゼOLET JE。脂肪酸の酸化的脱炭酸を触媒し、製品としての1-アルケンを形成します。 OLET JEは、細菌P450モノオキシゲナーゼに密接に関係していると、電子fは必要反応のためのロム過酸化水素。
残念ながら、基質と酵素の溶液にH 2 O 2の添加は、おそらくOLET JEの安定性に対する過酸化水素の有害な影響に、低い転化率及び結果の乏しい再現性をもたらしました。 NADPH還元RhFredとの融合タンパク質の生成が可能なNADPH依存性脱炭酸を行った。 図9は、それにもかかわらず、NADPHおよび費用効率的な再生のための現在の限られた可能性の高い価格が安く電子供与体を調査するために私たちを促しました。 P450モノオキシゲナーゼとOLET JEの類似性に触発され、我々は、H 2 O 2の光触媒による世代を使用していました。私たちは、無細胞抽出物または精製された酵素液を使用して(> 95%まで)、高い転化率を得るために喜んでいました。
脂肪酸脱炭酸の例では、我々は光駆動enzymのための一般的なプロトコルを提示します補因子として、光触媒と過酸化水素としてFMNを使用して、ATICレドックス変換。提示される方法は、Eの組換え細胞における酵素の産生を含みますコリ酵素の精製、1-アルケンの合成および反応生成物の分析のためのアプリケーション。
プロトコル
注意:使用する前に、関連するすべての物質安全データシート(MSDS)を参照してください。これらの合成に使用される化学物質のいくつかは、急性毒性及び発がん性があります。有害な有機溶剤、特に反応生成物の抽出および脂肪酸の誘導体化を含むすべてのステップは、個人用保護具(安全眼鏡、手袋、白衣、フルレングスパンツ、閉じたつま先の靴を使用して、ヒュームフードの下で行わなければなりません)。この作業では遺伝子組み換え生物を含むすべての操作は、安全レベルS1の遺伝子組換え生物の取扱いのために承認されたインストールが必要です。
大腸菌における組換えデカルボキシラーゼOLET JEの1式大腸菌
- 生産菌株の作製
- JeotgalicoccusからOLET JEの合成遺伝子を調製し、発現ベクターPASK-IBA37plus記載されているようにクローニングした。8
注:細菌代謝の酵素によって脂肪酸の分解を回避するために、E。脂肪酸分解のための機能不全の経路と慶應義塾コレクションからコリ株JW5020を使用しました。
- JeotgalicoccusからOLET JEの合成遺伝子を調製し、発現ベクターPASK-IBA37plus記載されているようにクローニングした。8
- 栽培と酵素発現の誘導
- E.を接種することにより前培養を準備試験管内の2つの3ミリリットルのLB培地(100μgのml -1のアンピシリンを含む)LB-plateから大腸菌 JW5020 OLET変異体。選択用培地にストック溶液からピペットアンピシリン(100μgのミリリットル-1)、180 rpmで振盪インキュベーター中で15時間37℃でインキュベートします。
- 1 Lの振とうフラスコに、アンピシリン(100μgのmlに-1)を含む、2 200ミリリットルのLB培地に前培養の2ミリリットルを追加します。インキュベーションは、37℃、180rpmで進行します。
- OD 600nmでの変化を監視します 接種後。 OD 600が 0.6の値に達したときD 0.8(0.2μgのミリリットル-1)テトラサイクリンを添加し、発現を誘導します。 20°Cおよび180 rpmで15時間、培養液をインキュベートします。
注:OLET JEは、ヘム補因子を含んでいるので、δアミノレブリン酸(0.5 mM)の誘導前への添加は補因子の合成のための前駆体と文化を提供するために必要とされます。
- 細胞溶解
- 氷の上で次の手順を実行します。遠心管にデカントまたはピペッティングによって培養液を移し、平等な分配を確保するために、スケールを使用しています。 4℃で12,000×gで20分間培養液を遠心。
- 注意深く上清を破棄し、ピペッティングにより50ミリリットルバッファ(50mMトリス、NaClを200 mMの、pHは7.5)にペレットを再懸濁し、コニカル遠心チューブ中の懸濁液を移します。
- 4℃で4000×gで15分間の遠心分離後、上清を捨てピペッティングにより3ミリリットルバッファ内の各ペレットを再懸濁します。
- そうすることにより細胞溶解を行いますサイクルの間に1分間の休止を残して氷の上でソリューション(×30秒3回)を通。遠心分離を4℃で15,000×gで20分間、溶液をピペッティングすることによってペレットを乱すことなく、細胞破片を除去し、コニカル遠心チューブに上清を移します。ペレットを捨てます。
注:小分子が除去された後、一つの溶媒画分を生体触媒に直接使用されます。第二の画分は、HisタグOLET JEの精製に使用されます。
- 細胞抽出物の小分子の除去
- 生体触媒で粗抽出物を使用する前に4℃で4000×gで10 kDaの膜と遠心分離機で遠心分離フィルターユニットに無細胞抽出液の3ミリリットルをピペットで過酸化水素形成または電子移動を妨害する可能性がある小分子を除去します。 3ミリリットルのTris-HCl緩衝液の残りのタンパク質を再懸濁します。
- OLETの精製
- 平衡緩衝液(20mMトリス、NaClを300mMのイミダゾールを10mM)で前平衡化された彼のピュールのNi-NTAスピンカラムに第二の細胞抽出物の3ミリリットルを適用します。
- 下部プラグと上部のスクリューキャップでカラムを密封し、樹脂を、無細胞抽出物で均等に分配されるまで軽くそれらを振ります。 4℃でオーバーヘッドシェーカーで30分間ロード列をインキュベートします。
- 2分間700×gで遠心分離することにより、洗浄用緩衝液1ml(20mMトリス、NaClを300mMのイミダゾールを20mM、pH7.4)でカラムを洗浄します。二回、この手順を繰り返します。
- 新鮮な円錐形の遠心チューブにカラムを配置し、溶出緩衝液の1ミリリットル(20mMトリス、NaClを300mMのイミダゾール250mMの、pH7.4)にOLET JEを追加します。 2分間700×gで遠心分離し、この手順を2回繰り返します。
注:イミダゾールは、ニッケルに結合し、したがって、列からOLET JEを削除します。 - 遠心分離フィルターユニットに溶出を転送する(10 kDaのMEMブレーン)と4℃で4000×gで遠心分離器は、イミダゾールを除去しました。
- SDS緩衝液(最終濃度1×)で9ミックス溶出を3μl。SDS-PAGE(15%)により、酵素の純度を確認し、変性のために95℃で5分間のソリューションをインキュベートします。その後、SDS-PAGE上の合計金額を適用します。市販のタンパク質標準を使用して、35ミリアンペアでゲルを実行します。 50kDaのでタンパク質を検出します。
- タンパク質濃度を決定するために市販のBSA-キットを使用します。ピペット希釈したタンパク質試料50μlの(1:100、1:200、1:500)およびBSA標準(0、20、30、40,50、60、80、100mgのミリリットル-1)を、96ウェルプレート中。 、Bradford試薬の200μlを添加し、蛍光光度計を用いて15分後に595nmで吸光度を測定し、標準曲線を用いて濃度を計算。
2.光触媒による生体内変化
- 過酸化水素を添加しない生体触媒反応
- 蒸留水に10%(v / v)のTERGITOLおよび0.0284 gでステアリン酸を添加することによって、10mMのステアリン酸(M rを284.5グラムモル-1)10mlのストック溶液を調製します。脂肪酸が完全に溶解するまで60℃に加熱チャンバ内の溶液を加熱します。
- 生体触媒とサンプリング
- 50 mMのEDTA、0.01 mMのFMN、トリス塩酸緩衝液中で0.5 mMのステアリン酸を含有する2 2ミリリットルの反応混合物を準備します。十分な酸素供給のための磁気撹拌棒を加え、水浴中でガラス管を配置し、25℃に加熱しました。
- 反応混合物のそれぞれに精製された酵素を200μgml -1の10%(v / v)の無細胞抽出液を追加し、反応管を15cmの距離で透明ガラス電球(120 W)でそれらを照らします。
- 20μlの37%HClで反応停止させ、特定の時点(0、10、30、60および120分および一晩)に200μlのサンプルを取ります。 5μlのミリスチン酸を加える(10 mMストックので、内部標準としてリューション)。
- 反応生成物の分析
- 抽出のために、二回のサンプルに500μlの酢酸エチルを追加13,000×gで1分間のチューブと遠心分離機を反転。
- 上清の400μLを脱ぎ、溶媒を完全に蒸発させます。
- 200μLを加えることによって、trimethylsilylcarboxylic酸にカルボン酸を誘導体化N -メチル- N - (トリメチルシリル)トリフルオロアセトアミド(MSTFA)。エーテルトリメチルシリルヒドロキシル基に変換するために、30分間、60℃で溶液をインキュベートします。
- GC / FIDによる変換の決意
注:GC / FIDを使用して、α-およびβヒドロキシステアリン酸(RT:12.05および12.1分)と基板(11.15分RT)の減少:1ヘプタデセン(8.34分RT)の形成を決定します。- 340℃に設定の下に注入温度を説明した温度プロファイルを設定します。ホールド初期オーブン温度は3.5分間、90℃であり、その後、分-1、45℃で増加します。 220℃では、2分間温度を保持します。 45℃分-1の繰り返し増加した後、2分間280℃の温度を保持し、次に分-1、60℃で増加します。
注:330°Cの最高温度は1.44分間保持されます。 - キャリアガスヘリウムで急速に揮発し、均質な混合を得るために5の分割比で、サンプルの4μLを注入します。
注:温度の上昇に依存して基板および製品は、ガス相に入ります。物質は、特定の保持時間でカラムを通過した後、GC / FID検出器によって検出され、画面上のピークとして表示されます。モニター上のピークの形成を観察します。 - 次式によって形成される生成物の濃度を計算します。
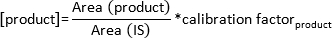
注:キャリブレーション係数は、誘導体化物質とそれに対応するピーク面積の既知量から標準曲線を計算することにより、各基板および製品については、このコラムのために特別に決定されています。
- 340℃に設定の下に注入温度を説明した温度プロファイルを設定します。ホールド初期オーブン温度は3.5分間、90℃であり、その後、分-1、45℃で増加します。 220℃では、2分間温度を保持します。 45℃分-1の繰り返し増加した後、2分間280℃の温度を保持し、次に分-1、60℃で増加します。
- GC / MSによってオレフィンとβヒドロキシ酸のピークを特定します。
- GC / MSによってオレフィンとβヒドロキシ酸のピークを特定します。温度プロファイルを設定します。 250℃に射出温度を設定します。 5分間100℃のオーブン温度を保持し、その後20℃の分-1で増加。
注:最大温度は7.5分間保持されます。 - 250°Cに質量分析計検出器温度を設定し、電子衝撃モードで50〜500のm / zで走査します。
注:電子衝撃イオン化質量分析のために前方に渡されるラジカルカチオンの形成をもたらす単一電子を除去します。原因内の高intramolarエネルギー共有結合へ下のm / zのフラグメントを作成する分子ブレーク。これらの断片は、物質の特定のフィンガープリントを形成します。 - サンプルの1μLを注入します。対応するフィンガープリント( 図2)により、11.4分の保持時間後に1ヘプタデセンを検出します。
- GC / MSによってオレフィンとβヒドロキシ酸のピークを特定します。温度プロファイルを設定します。 250℃に射出温度を設定します。 5分間100℃のオーブン温度を保持し、その後20℃の分-1で増加。
結果
反応混合物に過酸化水素の添加は、変換(<10%)を緩和する低もたらしながら、過酸化水素のその場生成を 80%の転化率までの変換を増加させました。 GC / MSによる分析は、脂肪酸のオレフィンの形成( 図2)を示しています。
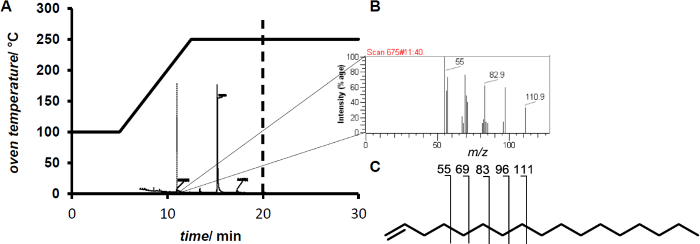
GC / MS測定のため、図2(A)温度プロファイル。 (B)11.4分後に1ヘプタデセン溶出の指紋。 (C)1-ヘプタデセンについて示した末端オレフィンの典型的なの特性二の C n H 2nの-1フラグメントイオン。 この図の拡大版をご覧になるにはこちらをクリックしてください。
光触媒反応は、Eの無細胞抽出液と高い変換を達成しました大腸菌 。精製された酵素溶液は、酵素濃度と変換の間に明確な相関を示しました。より高い転化率に光捕集分子のFMNリードの濃度を増加させます。しかし、さらに過酸化水素の量が十分に利用できない、もはや制限因子であることを示す、反応を促進しなかった10 mMの上記の濃度を増加させます。
脂肪酸の脱カルボキシル化に加えて、OLET JEも β位にヒドロキシル化を触媒します。ステアリン酸の変換では、脱炭酸は、ヒドロキシル化よりも約3倍高速です。 0.5 mMのステアリン酸および10μMFMNの溶液を使用する典型的な実験では、基質の99%の割合で1ヘプタデセンおよび2-ヒドロキシステアリン酸の混合物に変換しました3.3:1( 図3)8。生成物混合物中のヒドロキシル脂肪酸の相対量は、より短い鎖長の増加した光駆動生体触媒の基質スペクトルの調査は、より長いアシル鎖を有する脂肪酸のため、OLET JEが優先的脱炭酸を触媒することが示されました。ミリスチン酸(C14)より短い脂肪酸は脱炭酸を受けませんでした。
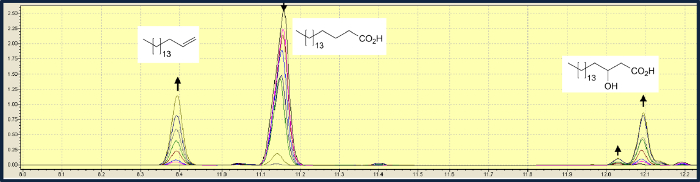
OLET JEの図3.ガスクロマトグラフィー分析は、1ヘプタデセン(8.4分)、αヒドロキシステアリン酸(12.04分)βヒドロキシステアリン酸(12.1分)にステアリン酸(11.15分)の脱炭酸を媒介しました。 2時間の時間経過にわたって採取されたサンプルからのピーク面積の変化が示されている。 争うにはこちらをクリックしてください。この図のWA拡大版。
驚くべきことに、不飽和酸(C18:1D9 シス )オレイン酸とリノール酸(C18は:2d9d12) シス二重結合のねじれ構成を酵素で生産的な結合様式に収容することができないことを示す、基質として受け入れられませんでした。オレイン酸(10%)の添加はまた、ステアリン酸の転化を防ぎます。興味深いことに、ステアリン酸(C18:1D9 トランス)は OLET JEで変換され、まだわずかに低い活性その後、ステアリン酸としました。
ディスカッション
過酸化水素の光駆動世代peroxygenases 3を含む範囲の酸化還元変換のために適用することができ、10及びP450モノオキシゲナーゼ5 chloroperoxidases。これは、簡単かつ実用的なアプローチです。長期的には、可視光の使用は、高エネルギー反応のための持続可能な代替手段である、化学変換のための太陽光を活用する視点を開きます。
この方法は、精製された酵素を伴うまたは無細胞抽出液でも適用可能です。後者は、低コストと作業が必要ですが、粗抽出物中の小分子は、光触媒変換を妨害し得ることに留意すべきです。実用的なアプローチは、マイクロメンブレン( すなわち 、遠心分離による遠心フィルターユニット内または透析による)で、これらの小さなコンポーネントを削除することです。光捕集分子FMNの濃度は、過酸化水素の濃度を測定します。 affiniに応じて、酸化還元酵素のtyが、この濃度は、酵素活性のために決定的に重要です。もう一つの重要な要因は、犠牲電子供与体EDTAの濃度です。最も重要なパラメータは、しかしながら、酵素の安定動作および活動です。
脂肪酸のオレフィン化は、化学工業の主要な商品に属するオレフィンにバイオベースの脂肪酸の変換のための優雅な反応です。光駆動生体触媒脱炭酸を室温でと持続可能性の点で明らかな利点を提供しています中性pH、で行うことができます。
我々の結果は、過酸化水素のその場生成に高い変換をもたらす、酵素の安定性を損なうことなく、補因子を供給するための戦略であることを示しています。補因子再生のための現在の方法は、農産物や石油ベースの化学物質を使用しています。光駆動反応は、再生可能な代替案として浮上しています。未来研究は安価な分子によって犠牲試薬EDTAの置換のための方法に専念され、光捕集分子FMNの量を削減します。
開示事項
The authors declare that they have no competing financial interests.
謝辞
R.K. and F.H. are grateful for the EU-commision for financial support within the Marie-Sklodowska ITN Biocascades (Nr. 634200).
資料
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Ampicillin | Sigma Aldrich | 69-52-3 | |
| Bradford reagent | Roth | K015.1 | |
| BSA | Sigma Aldrich | 90604-29-8 | |
| DMSO | Sigma Aldrich | 67-68-5 | |
| Ethyl acetate | Fisher Chemical | 141-78-6 | |
| Ethylenediaminetetraacetic acid (EDTA) | Roth | 8043.1 | |
| Riboflavin 5-monophosphate sodium salt hydrate | Sigma Aldrich | 130-40-5 | |
| Hydrochlorid acid 37% | Sigma Aldrich | 7647-01-0 | |
| Hydrogen peroxide 30% | Sigma Aldrich | 7722-84-1 | |
| δ-Amino levulinic acid | Sigma Aldrich | 5451-09-2 | |
| N-Methyl-N-(Trimethylsilyl)trifluoro acetamide (MSTFA) | Sigma Aldrich | 24589-78-4 | |
| Myristic acid >99% | Sigma Aldrich | 208-875-2 | |
| Imidazole | Sigma Aldrich | 288-32-4 | |
| Sodium chloride | Fisher Chemical | 7647-14-5 | |
| Stearic acid >99% | Sigma Aldrich | 57-11-4 | |
| Tetracycline | Sigma Aldrich | 60-54-8 | |
| Tergitol | Sigma Aldrich | MFCD01779855 | |
| Tris(hydroxymethyl)-aminomethan | Sigma Aldrich | 77-86-1 | |
| Device | |||
| Incubator shaker | G-25CK | New Brunswick Scientific | |
| Ecotron | Infors HT | ||
| Centrifugation | Labofuge 400R | Heraeus | |
| RC 5B Plus | Sorvall | ||
| Fresco 17 | Thermo Scientific | ||
| Centrifugation rotors | SS34 | Sorvall | |
| SLA | Sorvall | ||
| Clean bench | Envirco | Ceag Schirp Reinraum technik | |
| Column GC-FID | CP-Sil 5CB (30 m x 0.25 mm x 0.25 µm) | Agilent Technologies | |
| Column GC-MS | FactorFour Capillary Coloumn (VF-5 ms + 5 m EZ Guard) | Varian | |
| GC-FID | GC-2010 plus | Shimadzu | |
| GC-MS | IST-40 | Varian | |
| Magnetic stirrer | RCT classic | IKA | |
| pH meter | SevenEasy | Mettler toledo | |
| Sonicator | Branson Sonifier 250 | Branson | |
| Spectral photometer | FLUOstar Omega | BMG Labtech | |
| Equipment | |||
| Affinity chromatography column | His Pur Ni-NTA spin column | Thermo Scientific | |
| Centricon | Vivaspin turbo 15 | VWR International | |
| Microtiter plates | 96 Well Multiply®PCR Plates | Sarstedt |
参考文献
- Kourist, R., Domìnguez de Marìa, P., Miyamoto, K. Biocatalytic strategies for the asymmetric synthesis of profens - recent trends and developments. Green Chem. , 2607-2618 (2011).
- Holtmann, D., Fraaije, M. W., Arends, I. W., Opperman, D. J., Hollmann, F. The taming of oxygen: biocatalytic oxyfunctionalisations. Chemical Comm. 50, 13180-13200 (2014).
- Churakova, E., et al. Specific photobiocatalytic oxyfunctionalization reactions. Ang. Chem. In. Ed. 123, 10904-10907 (2011).
- Hollmann, F., Arends, I., Buehler, K. Biocatalytic Redox Reactions for Organic Synthesis: Nonconventional Regeneration Methods. ChemCatChem. 2, 762-782 (2010).
- Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva, V. V., Urlacher, V. B. Light-driven biocatalysis with cytochrome P450 peroxygenases. Biotechnol. Appl. Biochem. 60, 111-118 (2013).
- Bartsch, M., et al. Photosynthetic production of enantioselective biocatalysts. Microb. Cell. Fact. 14, 53 (2015).
- Rude, M. A., et al. Terminal olefin (1-alkene) biosynthesis by a novel P450 fatty acid decarboxylase from Jeotgalicoccus species. Appl. Environ. Microbiol. 77, 1718-1727 (2011).
- Zachos, I., et al. Photobiocatalytic decarboxylation for olefin synthesis. Chem. Comm. 51, 1918-1921 (2015).
- Liu, Y., et al. Hydrogen peroxide-independent production of α-alkenes by OleTJE P450 fatty acid decarboxylase. Biotechnol. Biofuels. 7, 28 (2014).
- Perez, D. I., Grau, M. M., Arends, I. W., Hollmann, F. Visible light-driven and chloroperoxidase-catalyzed oxygenation reactions. Chem. Comm. 40 (44), 6848-6850 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved