Method Article
移植到小鼠卵巢脂肪垫
摘要
我们描述适用于女性生殖道的正常和转化上皮研究卵巢脂肪垫移植测定。鼠标脂肪垫允许大型组织碎片移植,是手术和成像方便,并为苗勒起源组织最有利的本地环境。
摘要
Orthotopic transplantation assays in mice are invaluable for studies of cell regeneration and neoplastic transformation. Common approaches for orthotopic transplantation of ovarian surface and tubal epithelia include intraperitoneal and intrabursal administration of cells. The respective limitations of these methods include poorly defined location of injected cells and limited space volume. Furthermore, they are poorly suited for long-term structural preservation of transplanted organs. To address these challenges, we have developed an alternative approach, which is based on the introduction of cells and tissue fragments into the mouse fat pad. The mouse ovarian fat pad is located in the immediate vicinity of the ovary and uterine tube (aka oviduct, fallopian tube), and provides a familiar microenvironment for cells and tissues of these organs. In our approach fluorescence-labeled mouse and human cells, and fragments of the uterine tube are engrafted by using minimally traumatic dorsal incision surgery. Transplanted cells and their outgrowths are easily located in the ovarian fat pad for over 40 days. Long-term transplantation of the entire uterine tube allows correct preservation of all principle tissue components, and does not result in adverse side effects, such as fibrosis and inflammation. Our approach should be uniquely applicable for answering important biological questions such as differentiation, regenerative and neoplastic potential of specific cell populations. Furthermore, it should be suitable for studies of microenvironmental factors in normal development and cancer.
引言
移植实验,其中涉及引入细胞和组织到小鼠体内的特定网站,代表了组织再生和癌变研究的重要方法。细胞的原位移植,即其放置到一个本地环境,是成体干细胞的表征中是特别重要的。乳腺干细胞的存在首先由上皮乳腺片段移植到小鼠1的自由腺乳腺脂肪垫建议。植入试验以人源化小鼠的脂肪垫2被用来概括人原发性乳腺上皮细胞的再生潜能和正常发展。此外,表型不同的细胞类型成清零乳腺脂肪垫的串行和有限稀释移植是测试乳腺干细胞3-5的自我更新能力和多向分化至关重要。在combinat移植实验离子与遗传谱系追踪提供起源细胞的证据在乳腺肿瘤发生5。肾囊移植通常用于测试推定的前列腺干细胞6的性质。正常和肿瘤小鼠和人类胰腺组织体原位移植揭示了癌症的发展改变了7基因和途径。天然环境的重要性也已经由不同的再生的示范支承engraftments汗腺后到不同的位置,如乳腺脂肪垫,肩脂肪垫和背部皮肤8。
腹膜腔和卵巢囊通常用作女性生殖道9-12的上皮细胞的原位移植的地方。这两种方法都具有一定的限制。细胞的腹膜内注射导致其植入在腹膜腔中的不同区域,从而玉米plicating监测细胞生长。此外,在微环境的变化,如血管,神经支配和免疫细胞的代表性的程度,可以是在腹膜腔的不同区域相当显著。卵巢囊具有非常有限的体积,使不超过10微升液体的注入。这显著限制了可以施用细胞的量。此外,注射入卵巢囊可以相当技术上具有挑战性并且过程需要的时间显著量。
为了解决这些限制,我们已经采取了卵巢脂肪垫性能优势。鼠标卵巢脂肪垫具有大的尺寸,相邻的卵巢和子宫管,并且是由手术很方便。据报道,马滋养层可以移植到小鼠卵巢脂肪垫13。然而没有描述该方法的细节。也有人没有,如果这我报道的ThOD可以应用于成人细胞和组织。在这里,我们描述了小鼠和雌性生殖道的人类细胞的移植的可靠方法,并表明,该方法也适用于长期器官移植。
研究方案
所描述的所有体内的工作是由美国康奈尔大学机构动物护理和使用委员会的批准。
1.样品制备卵巢脂肪垫化验
- 分离和小学文化输卵管上皮(TE)细胞
- 用CO安乐死施主6-8周龄处女β肌动蛋白增强绿色荧光蛋白(EFGP)或β肌动蛋白香菇红色荧光蛋白(DsRed的)小鼠2施用颈椎脱位。用脚趾捏验证成功安乐死。
- 放置在吸收性悬垂性,腹侧的个体小鼠,然后擦拭用70%乙醇的腹部。通过在主体中线作出侧向切口并用指尖拉扯皮肤上方并朝向鼠标的头部和尾部切口下方打开皮肤。
- 使用钝钳抓住腹膜,并用细剪刀剪开体腔削减。轻轻推肠癌的线圈Ë一边,找到生殖器官。
- 用细镊子接起来一听子宫角切0.5厘米其中子宫角分开点以上。按住子宫角,解剖走附着于子宫角结缔组织,输卵管,卵巢和卵巢脂肪垫。放置解剖生殖道中以6毫升无菌磷酸盐缓冲盐水(PBS)中一个盘。与第二生殖道继续。
- 转移菜生物安全柜,洗组织3次6毫升无菌PBS。继续位于生物安全柜解剖显微镜下工作。抓住用细镊子子宫角,并通过在子宫 - 输卵管连接切断断开输卵管子宫角。剪出通过将25g针头周围的卵巢卵巢囊。
注意:卵巢囊已被删除后,解剖完成且个体子宫管保持在PBS溶液。 - 转接SINGL在PBS的50微升下降到3.5 cm的天线Ë输卵管和剁碎成用28号针头0.1毫米件。转移到200微升的消化缓冲液1(Dulbecco改进的Eagle培养基(DMEM)F12(补充有300单位毫升-1胶原酶和100单位毫升-1透明质酸酶火腿的)培养基),并在5%CO孵育1小时,在37℃ 2孵化器。
- 保温后,加入1ml 0.25%胰蛋白酶乙二胺四乙酸(EDTA)和暂停与1毫升枪头(又名蓝色尖)20次3分钟的帮助下的解决方案。添加5毫升+ 4℃的DMEM / F12含有2%胎牛血清(咸的)培养基。
- 通过离心(600 RCF,5分钟,室温(RT)),收集组织和加入1毫升消化缓冲液2(DMEM F12(补充有7毫克毫升-1分散酶II和10微克毫升-1脱氧核糖核酸酶I含的)培养基( DNA酶I))。暂停组织粒料20次用1毫升吸管缇帮助页。
- 加入5毫升血清自由完整的鼠标输卵管上皮生长培养基(M-TE-GM,表1)。
- 收集通过离心细胞(600 RCF,5分钟,RT)。加入1 ml M-TE-GM,暂停和血球计数细胞。种子1×10 5细胞以每孔1毫升24孔低安装板并孵育以M-TE-GM,在37℃在一个5%CO 2培养箱中培养4天。
- 每天改变介质。
- 从β肌动蛋白-EGFP或β肌动蛋白DsRed的小鼠制备原代培养悬浮液的TE细胞的单细胞悬浮液。
- 从24孔低附着板收集TE悬浮培养。离心(600 RCF,5分钟,RT),并暂停细胞沉淀用1毫升0.25%的胰蛋白酶-EDTA。在一个5%CO 2培养箱孵育10分钟,在37℃。
- 通过加入5ml的DMEM / F12含有5%胎牛血清(火腿的)培养基停止胰蛋白酶活性。通过离心(600 RCF,5分钟,RT),收集细胞沉淀。
- 洗涤细胞沉淀两次用4ml冷的PBS(4℃),加1ml的PBS每细胞沉淀,并暂停。计数细胞血球和转移到1.7毫升离心管。在冰上工作,1×10 5个细胞添加到10微升的PBS,然后加10微升基底膜基质。中止,并在冰上输送到动物房。
注:在无菌条件下进行的生物安全柜的所有解剖和组织培养工作。
- 永生化人细胞的制备
- 分别生长慢病毒EGFP和-mCherry标记的人永生化卵巢表面上皮细胞lineHIO118直到80 -在5%CO 2培养箱10 cm的培养皿90%汇合,在37℃。
- 用10ml PBS洗涤碗碟两次,加入1ml 0.25%胰蛋白酶-EDTA每个培养皿,并在5%CO 2培养箱中于37℃孵育10分钟。通过加入10ml的DMEM / F12含有5%胎牛血清(火腿的)培养基终止反应。搜集通过离心细胞沉淀(600 RCF,5分钟,RT)。
- 洗涤细胞沉淀两次用10ml冷PBS(4℃),加1ml的PBS每细胞沉淀,并暂停。计数细胞血球和转移到1.7毫升离心管。
- 冰工作,加入1.0×10 6伦蒂- mCherry标记的细胞+ 1.0×10 6伦蒂-EGFP标记的细胞至10微升PBS。添加10微升基底膜基质。中止,并在冰上输送到动物房。
- 对输卵管的制备
- 解剖如步骤1.1.1-1.1.5个别输卵管从6-至在PBS 8周龄处女β肌动蛋白DsRed的小鼠。转移单输卵管进入PBS的解剖显微镜下200微升下降。通过除去输卵管系膜,它支持子宫管的部分的宽韧带的一部分轻轻解开用镊子和28号针的帮助下输卵管。将单一的开卷输卵管中的2下降00微升冰冷的PBS直到收件人的卵巢脂肪垫被暴露并准备接收的移植。
2.卵巢脂肪垫移植
注意:每次消毒手术动物之间的仪器。准备和安排所有设备提前。背移植到右侧卵巢脂肪垫是优惠的,因为这避免了脾脏。但是,收件人可能有两个卵巢脂肪垫移植。
- 使用同基因小鼠或重症联合免疫缺陷(SCID / NCR)小鼠原代细胞的接受者。对于人细胞,如HIO118细胞,使用NOD / SCID /伽马(NSG)小鼠或SCID小鼠。
- 麻醉受体小鼠与2,2,2-三溴乙醇的单个腹膜内注射以0.15毫升/ 10g体重的剂量。将动物在加热垫,在动物引擎盖,然后按确认踏板反射(趾捏)的损失适当麻醉。对眼睛应用兽医药膏,以防止干燥而动物处于麻醉状态。注入与镇痛酮洛芬动物皮下注射4毫克/克体重的剂量来治疗为手术后疼痛。
注意:作为一个替代方案,使用异氟烷麻醉。放置在感应室中的动物,并调整氧气流量计0.8-1.5升/分和异氟烷蒸发器,以2-3%。从腔室中取出麻醉动物,让它从掩模呼吸异氟烷和氧气流量计设定为0.4-0.8升/分钟和异氟烷蒸发器,以1.5%,然后启动手术。 - 剃须用40号快船手术区;从一个区域除去毛发2倍手术区,准备用碘伏三种防腐剂磨砂,接着用70%乙醇的剃光皮肤上,并用无菌披盖覆盖。
- 移动至动物位于生物安全柜中的解剖显微镜下。在直接卵巢脂肪垫上面的背内侧位置的切口暴露生殖道。
注:暴击iCal的一步:准确的皮肤切口有利于伤口愈合,用手术刀在步骤2.4建议。 - 使用钝细镊子拔卵巢脂肪垫通过仔细朝中线切口,尽量减少对神经和大血管的损伤。
关键的一步:如果发生出血,停止手术,并考虑移植到不同的宿主动物。 - 以下的28号斜口针的帮助下解剖显微镜的控制使2-4毫米深的切口进入卵巢脂肪垫,3-4毫米卵巢以上。
关键的步骤:确保切口只有经过脂肪垫的一半;通过向底侧穿刺一路导致泄漏。迅速而没有进行这一步后延迟。 - 对于细胞移植,填充注射器(30号针头),用10-20微升细胞基底膜基质混合物和注入脂肪垫切口。对于输卵管移植,拿起输卵管机智^ h细镊子和10的地方 - 20微升基底膜基质保持在冰上。使用0.1〜10/20微升XL毕业的过滤嘴(3毫米缩短)拿起组织和基底膜基质悬挂和释放入脂肪垫切口。
- 等待5分钟,基底膜基质固化并放置生殖道回腹膜。手术缝合2拆线并用两个小伤口剪辑或手术缝合皮肤紧密的肌肉。
- 重复步骤2.4-2.8到PBS-基底膜基质混合物移植到动物将作为对照的对侧脂肪垫。
关键步骤:手术后放置在一个加热垫的动物,因为热损失是在麻醉小鼠迅速。 - 让动物在天然笼上的加热垫恢复并观察动物直到从麻醉完全清醒。不要离开无人看管的动物,直到它已经恢复了足够的意识,以保持胸骨升靠着。不要返回已动过手术,以公司的其他动物,直到完全康复的动物。
- 将预湿的食物颗粒极少数在笼子里面除了干上手术后的笼子食品。如果需要在未来几天申请手术后止痛药和日常检查伤口。根据批准的动物协议,如果发生伤口感染应用抗生素。手术后伤口取出夹子10天的时间伤口已经完全关闭。
3.组织学和图像采集
- 嫁接收集和保存
- 通过混合26毫升DDH 2 O的用4ml PBS 10倍和10毫升16%多聚甲醛溶液制备4%多聚甲醛溶液。
- 解剖一个块,所栽种的卵巢脂肪垫,卵巢,输卵管,如步骤1.1.1-1.1.40.5厘米子宫。立即将2毫升4%多聚甲醛和修复2小时,在室温。从相同的动物,解剖非嫁接用PBS基底膜基质混合物作为控制对侧移植卵巢脂肪垫系统(见步骤2.9)。固定并以同样的方式处理。
- 固定后洗净组织中,用PBS 3次5分钟,并在4℃在PBS中孵育过夜。
- 对于卵巢脂肪垫的整个安装成像继续执行步骤3.2.1。
注:图像采集组织可冻结后(3.3.1)或加工的石蜡包埋(3.3.2)。在PBS中30%蔗糖过夜孵育在4℃提高冷冻组织的质量。
- 图像采集
- 地点整个安装在PBS充满菜肴和使用倒置显微镜图像配有落射荧光附件和高清晰度彩色摄像机,卵巢脂肪垫系统,有4个,10倍的目标,并配有荧光附件,彩色摄像机和规划立体显微镜阿波1xWD70,ED计划1.5xWD45目标。
- 组织学
- 以下全安装图像采集(3.2.1)的地方在2×1厘米长的实验室薄膜和使用镊子冰冻组织标本包埋剂的200-500微升下降,组织转移到下降。拿起膜在一个边缘和传送组织培养基降低到了1.8毫升低温小瓶中。关闭小瓶陷入液氮。在-80℃保存冷冻组织。
- 另外,继续与标准石蜡包埋。使用20-40体积组织体积的每个步骤。
- 浸入组织在65%的乙醇一次30分钟,在RT轻轻晃动。
- 浸入组织在70%乙醇一次30分钟,在RT轻轻晃动。在此阶段的样品可以储存在RT个月。
- 浸入组织在90%乙醇一次30分钟,在RT轻轻晃动。
- 浸入组织在95%乙醇一次30分钟,在RT轻轻晃动。
- 30分钟浸泡组织在无水乙醇(200标准强度)的两倍,在RT轻轻晃动。
- 沉浸组织两次氯仿30分钟,在室温下轻轻晃动。
- 在石蜡浸入组织一次30分钟,在58℃,轻轻摇动。
- 在石蜡浸入组织一次12小时,在58℃,轻轻摇动。
- 在石蜡浸入组织一次3小时,在58℃。
- 将金属模具的组织学和组织填充58℃的石蜡模具。添加的石蜡顶部的塑料盒的组织学和石蜡冷却到+4℃。在提取RT石蜡组织块和存储。
注:石蜡温度不应该适用于免疫组化染色组织的最佳保存超过58℃。
- 此外,准备的石蜡包埋标本用凝胶处理。
- 吸出PBS并整体安装的组织转移到70%的乙醇。在室温下孵育2小时。在水浴中,预热检体处理凝胶至60℃。
- PipettË200微升样本处理凝胶到实验室薄膜内衬培养皿。用细解剖钳整个贴装组织系统传送到检体处理凝胶滴。
- 允许样本处理凝胶塞在室温下固化,或在4℃下固化10分钟的插头。
- 放置在夹在活检泡沫垫之间组织学组织盒的检体处理凝胶包埋的组织。在石蜡中嵌入如步骤3.3.2-3.3.2.10。
注:样品处理凝胶嵌入防止损失,并允许小脆弱的组织样本保存。
注:冻结或石蜡包埋组织保存适合免疫组化染色14,15。
结果
实验的细胞和组织可以精确地移植到解剖显微镜( 图1)下的卵巢脂肪垫。的实例包括由鼠遍在表达EGFP( 图2A)或红色荧光蛋白( 图2B)和人永生卵巢表面上皮细胞标记mCherry与EGFP慢病毒HIO118 16,17细胞( 图2C - F)的来源的原小鼠输卵管上皮细胞。该方法也适用于器官,如鼠标子宫管( 图3)的长期的移植。根据免疫组化染色,既纤毛(FOXJ1正14)和分泌(PAX8阳性15)细胞移植组织( 图3D和E)的输卵管上皮被保留。

图1:卵巢脂肪垫移植 (A)裸露移植(箭头)的区域。 (B)的一个切口通过一个28克针(箭头)制成。通过移液管尖(箭头)(C)的UT /基底膜基质混合物植入。 (D)UT嫁接(箭头,呈鲜红色,β肌动蛋白红色荧光蛋白的小鼠UT)。 FP,脂肪垫; OV,卵巢; UT,输卵管。比例尺= 2毫米。 请点击此处查看该图的放大版本。
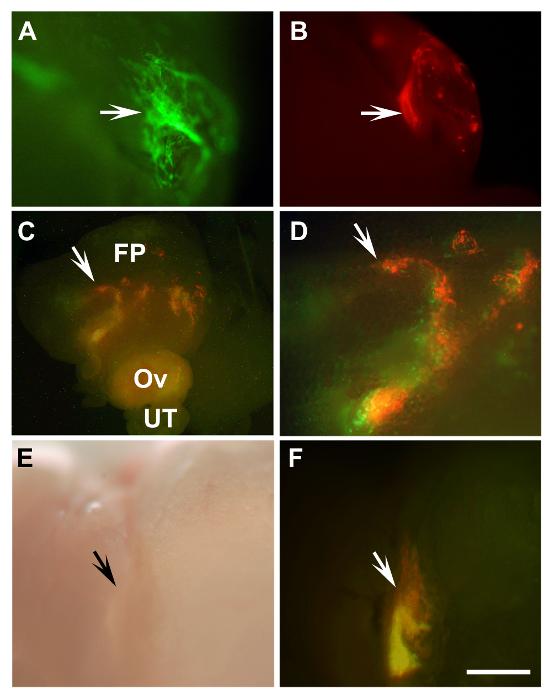
图 2: 移植小鼠原输卵管上皮细胞和人类的永生化检测卵巢表面上皮细胞 (A,B)输出初级小鼠输卵管上皮细胞β肌动蛋白-EGFP小鼠(A,绿色)和β肌动蛋白DsRed的 (B,红色)移植到同系小鼠后8天(箭头)的生长。 (C,D)Engraftments标有两种伦蒂-EGFP(绿色)或伦蒂- mCherry(红色)混合HIO118细胞(箭头)移植入小鼠NSG后10天的。 (D)从(C,箭头)放大区。 (E,F)接枝开发相同细胞移植在C 43天后,D到SCID小鼠(箭头)。 AD,女,荧光; E,亮场,FP,脂肪垫; OV,卵巢; UT,输卵管。 (A,B,DF)比例尺= 500微米; (C)比例尺= 1600微米。 请点击此处查看该图的放大版本。
广告/ 54444 / 54444fig3.jpg"/>
图3: 输卵管移植的表征。 (A)β-actin的,红色荧光蛋白小鼠移植到卵巢脂肪垫后6天的完整子宫管(箭头)(箭头,呈鲜红色)。 (B)与(A)所示移植脂肪垫的荧光冰冻切片。红色,红色荧光蛋白;蓝,4',6-二脒基-2-苯基吲哚(DAPI)复染核。 ( 三 )子宫管移植(箭头)移植入NSG受体小鼠(箭头)后40天。石蜡切片。注意:所有的原则输卵管组件的正确保存,以及缺乏移植相关性纤维变性和炎症。苏木和伊红染色。 (D,E)检测输卵管上皮细胞标记配对-box基因8(PAX8)和叉头框J1的(FOXJ1;棕色核色,箭头)中所示的移植物(箭头)的细胞( C)。免疫过氧化物酶系统。用甲基绿复染。 FP,脂肪垫; OV,卵巢; UT,输卵管。 (A)比例尺= 1000微米; (B)比例尺= 200微米; (CE)比例尺= 100微米。 请点击此处查看该图的放大版本。
| 零件 | 1X DMEM F12(含的)中 |
| L-谷氨酰胺 | 2毫米 |
| pruvate钠 | 1毫米 |
| 表皮生长因子 | 10毫微克毫升-1 |
| 碱性成纤维细胞生长因子-2 | 10毫微克毫升-1 |
| 氢化可的松 | 500纳克毫升-1 |
| 胰岛素 | 5微克毫升-1 |
| 茶nsferrin | 5微克毫升-1 |
| 亚硒酸钠 | 5纳克毫升-1 |
| 牛血清白蛋白 | 0.10% |
| 青霉素/链霉素 | 100毫升单位1/100微克毫升-1 |
| 极限必需培养基Eagle(MEM)非必需氨基酸 | 0.1毫米 |
| β-巯基乙醇 | 10 -4 M |
表1:鼠标输卵管Epithelim生长培养基(M-TE-GM)组件在左边的列中溶解在1X DMEM F12指定浓度(含的)中,右列。最终的培养基成分是无血清。
讨论
我们已经建立了卵巢脂肪垫移植法,允许上皮细胞和组织的准确传递和检测。卵巢脂肪垫测定移植过程比囊内注射10-12更少技术上具有挑战性并允许更均匀的和相比腹腔注射9为移植的细胞的精确位置。它也非常适用于整个器官,长期移植如子宫管。
重要的是,卵巢脂肪垫提供了用于女性生殖系统的上皮一个熟悉的微环境。应该特别适用于再生和恶性转化过程中人类和小鼠的卵巢和输卵管上皮细胞的分子和细胞性质的研究。相对于其他器官,很少有研究在阴r的上皮集中于鉴定和干细胞的表征eproductive道18,19。这种研究是特别重要的,因为许多癌症被认为从成体干细胞20发起。然而,细胞上皮性卵巢癌的起源仍然是极具争议的18。上皮卵巢癌占多数卵巢癌,是在美国的21名妇女的所有癌症相关死亡中第5位。它具有以下优点这样发展的原位测定在现有技术移植应9-12大大促进这方面的研究。
由于卵巢脂肪垫的位置表浅,小动物成像系统可用于跟进engraftments具有较强的荧光或生物发光标记记者。它也应该能够建立微创高分辨率实时成像测定法,诸如非线性显微镜22。卵巢脂肪垫也可以被保持在器官培养,从而允许密切扼要重述细胞的组织和细胞外基质的条件下,ING正常和肿瘤上皮细胞的三维培养。未来的研究应该解决这些有前途的可能性。
有几个关键步骤必须考虑。提供一个加热垫和在手术过程中保持啮齿类温暖大大提高了存活率。仪器搬运脂肪垫无菌保证植入系统保持无菌。根据我们的经验,显著出血导致移植生长发育迟缓。重要的是,脂肪垫切口应作出正是因为撕裂脂肪垫或通过原因出血刺穿。混凝剂应该用于止血是必要的。如果engraftments不发展,注射的细胞的更高浓度应予以考虑。第一次成功的副产物可以观察到作为移植后早一周,并最engraftments应一个可见手术后一个月。用于移植的,具有较大直径(23-25 G)的针可用于防止大细胞剪切(直径超过10微米)。然而,这样的针可能更创伤到脂肪垫和它们的使用应提前进行测试。对于我们的实验中,我们已经使用6-8周龄供体和受体的小鼠。对于这两个目的可以使用年轻或年长的小鼠。然而,注射的细胞的数量可能需要调整。在年轻供卵巢脂肪垫的尺寸小也需要考虑。
正如任何方法,也有在小鼠卵巢脂肪垫移植试验的一些限制。虽然同系免疫能干小鼠可用于鼠原代细胞/组织中,我们的技术需要NSG或用于人体材料的移植SCID小鼠。它很可能可以人源化脂肪垫支持人类上皮细胞的生长。但是,我们还没有测试这种方法呢。年轻的FE使用男性可能会导致降低养殖成本;然而,成熟处女雌性小鼠(年龄8-10周)有较大的脂肪垫,由此允许更大的试样的移植。最后,实验室人员应在动物手术进行培训,以确保程序的及时和成功执行。
披露声明
The authors have nothing to disclose.
致谢
我们要感谢安德鲁K.戈德温博士,堪萨斯大学医学中心,提供人体细胞HIO118。 (; T028095 NYSTEM)和儿童健康与人类发展(P50HD076210)到AFN的健康/研究所的国家机构,并通过从NYSTEM(C028125,C024174和资助这些研究是由纽约干细胞项目的资金支持T028095),健康/美国国家癌症研究所(CA182413)和卵巢癌研究基金(327516),以艾因国家机构。
材料
| Name | Company | Catalog Number | Comments |
| 25 gauge needle | BD Becton Dickinson | 305122 | |
| 28 gauge needle (hypodermic syringe with attached needle) | Kendall | 30339 | Part Number: 8881500014 |
| basic fibroblast growth factor-2 | Sigma-Aldrich | F9786 | |
| basement membrane matrix (Geltrex) | Invitrogen | A1413202 | |
| β-actin-DsRed mice | The Jackson Laboratory | 6051 | B6.Cg-Tg(CAG-DsRed*MST)1Nagy/J |
| β-actin-EGFP mice | The Jackson Laboratory | 3291 | C57BL/6-Tg(CAG-eGFP)1Osb/J |
| β-mercaptoethanol | Sigma-Aldrich | M7522 | |
| bovine albumin | Sigma-Aldrich | A3311 | |
| chloroform | VWR | EM-CX1058-1 | |
| collagenase/hyaluronidase | Stem Cell Technologies | 7912 | |
| cryogenic vials | Thermo Scientific Nunc | 377267 | |
| dispase II | Worthington | NPRO2 | |
| DMEM F12 (HAM's) | Corning | 10-092-CV | |
| DNaseI (Deoxyribonuclease I) | Stem Cell Technologies | 7900 | |
| embedding medium for frozen tissue specimens (O. C. T.) | Sakura Finetek | 4583 | |
| epidermal growth factor | Sigma-Aldrich | E4127 | |
| ethanol 200 proof | Koptec | V1001 | to prepare 70% |
| fetal bovine serum | Sigma | F4135 | |
| filter tip 0.1-10/20 µl XL | USA Scientific | 1120-3810 | |
| FOXJ1 antibody | eBioscience | E10109-1632 | used at concentration 1:1,000 (no unmasking) |
| hydrocortisone | Sigma | H0135 | |
| Ketoprofen | Zoetis | 4396H | |
| laboratory film (Parafilm M) | American National Can | PM-999 | |
| L-Glutamine | Corning | 25-005-Cl | |
| insulin-transferin-sodium selenite | Sigma-Aldrich | I884 | |
| isoflurane, 250 ml | Santa Cruz Animal Health | sc-363629Rx | |
| low attachment plate 24-well | Costar | 3473 | |
| MEM non-essential amino acids | Corning | 25-025-Cl | |
| metal histology molds | Electron Microscopy Sciences | 62527-22 | |
| microscope, inverted | Nikon | Eclipse TS 100 | |
| microscope, stereo | Nikon | SMZ800 | |
| Nod/SCID/gamma (NSG) mice | The Jackson Laboratory | 05557 | NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ |
| paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| paraffin (Paraplast, X-TRA) | Fisher Thermo Scientific | 23-021-401 | |
| PAX8 antibody | Proteintech | 10336-1-AP | used at concentration 1:1,000 (no unmasking) |
| PBS (Phosphate-Buffered Saline) | Corning | 21-030-CV | |
| penicillin streptomycin | Corning | 30-002-Cl | |
| severe combined immunodeficiency (SCID/NCr) mice, BALB/C background) | NCI-Frederick Animal Production Program | 01S11 | |
| sodium pyruvate | Corning | 25-000-Cl | |
| specimen processing gel (HISTOGEL) | Richard-Allan Scientific | HG-4000-012 | |
| sucrose | Sigma-Aldrich | S0389 | |
| Trypsin-EDTA, 25% | Corning | 25-053-Cl |
参考文献
- Deome, K. B., Faulkin, L. J., Bern, H. A., Blair, P. B. Development of mammary tumors from hyperplastic alveolar nodules transplanted into gland-free mammary fat pads of female C3H mice. Cancer Res. 19, 515-520 (1959).
- Proia, D. A., Kuperwasser, C. Reconstruction of human mammary tissues in a mouse model. Nature protocols. 1, 206-214 (2006).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439, 84-88 (2006).
- Stingl, J., Caldas, C. Molecular heterogeneity of breast carcinomas and the cancer stem cell hypothesis. Nat Rev Cancer. 7, 791-799 (2007).
- Koren, S., et al. PIK3CA(H1047R) induces multipotency and multi-lineage mammary tumours. Nature. 525, 114-118 (2015).
- Nikitin, A. Y., Nafus, M. G., Zhou, Z., Liao, C. -. P., Roy-Burman, P., Bagley, R. G., Teicher, B. A. Prostate stem cells and cancer in animals. Stem Cells and Cancer. , 199-216 (2009).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160, 324-338 (2015).
- Lu, C. P., et al. Identification of stem cell populations in sweat glands and ducts reveals roles in homeostasis and wound repair. Cell. 150, 136-150 (2012).
- Flesken-Nikitin, A., et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495, 241-245 (2013).
- Orsulic, S., et al. Induction of ovarian cancer by defined multiple genetic changes in a mouse model system. Cancer Cell. 1, 53-62 (2002).
- Dawes, J., Liu, B., Mars, W., Michalopoulos, G., Khillan, J. S. Multiple ovarian transplants to rescue a transgenic line of mice. Lab Anim (NY). 39, 191-193 (2010).
- Cordero, A. B., Kwon, Y., Hua, X., Godwin, A. K. In vivo imaging and therapeutic treatments in an orthotopic mouse model of ovarian cancer. Journal of visualized experiments : JoVE. , (2010).
- Albihn, A., et al. Production of capsular material by equine trophoblast transplanted into immunodeficient mice. Reproduction. 125, 855-863 (2003).
- Muthusamy, N., Vijayakumar, A., Cheng, G., Ghashghaei, H. T. A knock-in Foxj1(CreERT2::GFP) mouse for recombination in epithelial cells with motile cilia. Genesis. 52, 350-358 (2014).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24, 751-765 (2013).
- Capo-Chichi, C. D., et al. Dynamic alterations of the extracellular environment of ovarian surface epithelial cells in premalignant transformation, tumorigenicity, and metastasis. Cancer. 95, 1802-1815 (2002).
- Roland, I. H., et al. Loss of surface and cyst epithelial basement membranes and preneoplastic morphologic changes in prophylactic oophorectomies. Cancer. 98, 2607-2623 (2003).
- Flesken-Nikitin, A., Odai-Afotey, A. A., Nikitin, A. Y. Role of the stem cell niche in the pathogenesis of epithelial ovarian cancers. Mol Cell Oncol. 1, 963435 (2014).
- Ng, A., Barker, N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol. 16, 625-638 (2015).
- Visvader, J. E. Cells of origin in cancer. Nature. 469, 314-322 (2011).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65, 5-29 (2015).
- Williams, R. M., et al. Strategies for high-resolution imaging of epithelial ovarian cancer by laparoscopic nonlinear microscopy. Transl Oncol. 3, 181-194 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。