Method Article
Трансплантация в коврик для мыши Овариальное Fat
В этой статье
Резюме
Мы описываем овариальный трансплантации анализа конек площадку, пригодную для изучения нормальных и трансформированных эпителии женского репродуктивного тракта. Мыши жировой ткани позволяет трансплантация больших фрагментов ткани, легко доступны для хирургии и обработки изображений, а также обеспечивает наиболее благоприятные условия для родной тканей мюллеровой происхождения.
Аннотация
Orthotopic transplantation assays in mice are invaluable for studies of cell regeneration and neoplastic transformation. Common approaches for orthotopic transplantation of ovarian surface and tubal epithelia include intraperitoneal and intrabursal administration of cells. The respective limitations of these methods include poorly defined location of injected cells and limited space volume. Furthermore, they are poorly suited for long-term structural preservation of transplanted organs. To address these challenges, we have developed an alternative approach, which is based on the introduction of cells and tissue fragments into the mouse fat pad. The mouse ovarian fat pad is located in the immediate vicinity of the ovary and uterine tube (aka oviduct, fallopian tube), and provides a familiar microenvironment for cells and tissues of these organs. In our approach fluorescence-labeled mouse and human cells, and fragments of the uterine tube are engrafted by using minimally traumatic dorsal incision surgery. Transplanted cells and their outgrowths are easily located in the ovarian fat pad for over 40 days. Long-term transplantation of the entire uterine tube allows correct preservation of all principle tissue components, and does not result in adverse side effects, such as fibrosis and inflammation. Our approach should be uniquely applicable for answering important biological questions such as differentiation, regenerative and neoplastic potential of specific cell populations. Furthermore, it should be suitable for studies of microenvironmental factors in normal development and cancer.
Введение
Трансплантация анализы, которые включают введение клеток и тканей в определенных участках тела у мышей, представляют существенный подход к изучению регенерации тканей и канцерогенеза. Ортотопической трансплантацией клеток, то есть, их размещение в родной среде, особенно важны для характеристики стволовых клеток взрослого организма. Существование стволовых клеток молочной железы была впервые предложена трансплантация эпителиальных молочной железы фрагментов в сальниковых свободных молочных жировым мышей 1. Приживления анализы на гуманизированное мыши жировое 2 были использованы резюмировать регенеративного потенциала и нормальное развитие первичного рака молочной эпителиальных клеток человека. Кроме того, последовательные и предельного разбавления трансплантаций фенотипически различных типов клеток в очищенной молочной жировой ткани имеют решающее значение для того чтобы испытать способность самообновления и мультилинейной дифференцировки стволовых клеток молочной железы 3-5. Трансплантация анализы в комбинатион с генетической линии трассировка представили доказательства клетки происхождения в канцерогенез молочных желез 5. Почечная капсула трансплантаций обычно используются для проверки свойств мнимый простаты стволовых клеток 6. Ортотопическая трансплантация нормальной и опухолевой мыши и панкреатических органоидов человека выявили гены и пути , измененными в прогрессии рака 7. Важность родной среды также была поддержана демонстрацией разнообразной регенерации после engraftments потовых желез в разных местах, таких как жировым молочных желез, плечевых жировым и обратно кожи 8.
Брюшную полость и бурса овариальный, как правило , используются в качестве мест для ортотопической трансплантации клеток эпителия женских половых путей 9-12. Оба этих метода имеют ряд ограничений. Внутрибрюшинное введение клеток приводит к их имплантаций в различных областях брюшной полости, тем самым комусложняю- мониторинг клеточного роста. Кроме того, вариации в микросреде, таких как степень васкуляризации, иннервацией и представления иммунных клеток, может быть весьма существенным в различных областях брюшной полости. Бурса яичников имеет очень ограниченный объем, что позволяет инъекции не более 10 мкл жидкости. Это значительно ограничивает количество клеток, которые могут быть введены. Кроме того, инъекции в бурсу яичника может быть весьма сложной технически и процедура требует значительного количества времени.
Для устранения этих ограничений, мы воспользовались овариальных свойств жировой ткани. Мышь яичников жировой ткани имеет большой размер, находится рядом с яичником и маточной трубы, и легко доступны с помощью хирургического вмешательства. Сообщалось , что лошадиный трофобласта могут быть пересажены в мышь овариальный жировое 13. Однако детали этого метода не были описаны. Было также не сообщается, если это мнеThOD могут быть применены к взрослым клеткам и тканям. Здесь мы описываем надежный подход для трансплантации мышиных и человеческих клеток женских половых путей и показывают, что этот метод также применим к долгосрочной трансплантации органов.
протокол
Вся работа в естественных условиях описано одобрено Институциональным уходу и использованию животных комитетом Корнельского университета по.
1. Примеры Подготовка к Овариальных жировое Assays
- Выделение и культуры первичных Трубное эпителием (TE) Клетки
- Эвтаназии донора от 6 до 8-недельного девственник β-актин-усиленный зеленый флуоресцентный белок (EFGP) или бета-актин-Discosoma красный флуоресцентный белок (DsRed) у мышей с помощью СО 2 введение с последующей цервикальной дислокацией. Проверка успешной эвтаназию с помощью пальца щепоткой.
- Поместите индивидуальную мышь на фильтровальную драпировки, вентральной стороной вверх, а затем протрите живот с 70% этанола. Откройте кожу, делая боковой разрез по срединной линии тела и кончики пальцев подтягивает кожу выше и ниже разреза в направлении головы и хвоста мыши.
- Удерживая брюшины с помощью тупых пинцетом и сделать разрез с тонкими ножницами, чтобы открыть полость тела. Аккуратно надавите на катушку intestinе в сторону и найти репродуктивных органов.
- С тонким пинцетом подобрать один рог матки и разрезают на 0,5 см выше точки, где рога матки разделиться. Удерживая рог матки, отсечь соединительную ткань, прикрепленную к роге матки, маточной трубы, яичника и жировой ткани яичников. Поместите расчлененный ИРТ в чашке с 6 мл стерильного фосфатно-солевом буферном (PBS). Продолжайте второй репродуктивный тракт.
- Передача блюдо в шкафу биологической безопасности и мыть тканей 3 раза в 6 мл стерильной PBS. Продолжить работу под рассечение микроскопом, расположенный в шкафу биологической безопасности. Захватите рога матки с мелкими пинцетом и отсоедините рога матки от маточной трубы путем разъединять на маточно-трубное перехода. Вырежьте бурсу яичника, окружающий завязь с помощью иглы 25 G.
Примечание: После того, как бурса овариальный был удален, рассечение завершена и индивидуальная маточной трубы остается в растворе PBS. - Передача оде маточной трубы в капле 50 мкл PBS до 3,5 см чашку и фарша в 0,1 мм с использованием 28 штук калибра иглы. Передача 200 мкл сбраживания буфера 1 (модифицированной среде Игла (DMEM) F12 орла Дульбекко () среда Хэма , дополненной 300 единиц мл -1 коллагеназы и 100 единиц мл -1 гиалуронидазы) и инкубируют в течение 1 ч при 37 ° С в 5% СО в 2 инкубатора.
- После инкубации добавляют 1 мл 0,25% трипсина-этилендиаминтетрауксусной кислоты (ЭДТА) и приостановить решение с помощью кончика пипетки 1 мл (он же синий TIP) в 20 раз в течение 3 минут. Добавляют 5 мл + 4 ° C DMEM / F12 (Хэма), содержащей 2% фетальной бычьей сыворотки.
- Сбор тканей путем центрифугирования (600 RCF, 5 мин, при комнатной температуре (RT)), и добавляют 1 мл пищеварении буфера 2 (DMEM F12 () среда Хэма с добавлением 7 мг мл -1 диспаза II и 10 мкг мл -1 дизоксирибонуклеаза I ( ДНКазы I)). Приостановка ткани на пеллетах 20 раз с помощью пипетки 1 мл тип.
- Добавьте 5 мл сыворотки бесплатно полную среду для роста мыши маточных эпителий (M-TE-GM, таблица 1).
- Сбор клеток путем центрифугирования (600 RCF, 5 мин, RT). Добавляют 1 мл M-TE-GM, приостанавливать и подсчет клеток с помощью гемоцитометра. Семенной 1 х 10 5 клеток в 1 мл на лунку в плите 24-луночного низким крепежного и инкубировать в М-TE-GM при 37 ° С в атмосфере 5% СО 2 инкубаторе в течение 4 дней.
- Изменение среды каждый день.
- Подготовка одноклеточных суспензий культивируемых первичных суспензионных TE клеток из бета-актина-EGFP или β-актин-DsRed мышей.
- Собирают TE суспензионных культур из 24-луночного низких пластин крепления. Центрифуга (600 RCF, 5 минут, комнатная температура), и подвесить гранулы кювета с 1 мл 0,25% трипсин-ЭДТА. Инкубировать в течение 10 мин при 37 ° С в атмосфере 5% СО 2 инкубаторе.
- Прекратить активность трипсина путем добавления 5 мл DMEM / F12 (Хэма), содержащей 5% сыворотки плода коровы. Сбор Клеточный осадок центрифугированием (600 RCF, 5 минут, комнатная температура).
- Промыть Клеточные осадки дважды с 4 мл холодного PBS (4 ° С), добавляют 1 мл PBS в осадок клеток, и приостанавливать. Граф клеток с помощью гемоцитометра и переносят 1,7 мл центрифужные пробирки. Работая на льду, добавляют 1 × 10 5 клеток в 10 мкл PBS, затем добавляют 10 мкл базальной мембраны матрицу. Приостановка и транспортировать на льду к животному комнате.
Примечание: Выполните все рассечение и тканевой культуры работы в кабинете биологической безопасности в стерильных условиях.
- Получение увековечена линия клеток человека
- Отдельно растут лентивирусов-EGFP и -mCherry маркированы человек увековечен поверхность яичника эпителий клеток lineHIO118 до 80 - 90% сплошности на 10 см чашки при температуре 37 ° С в 5% CO 2 инкубаторе.
- Мыть посуду в два раза с 10 мл PBS, добавляют 1 мл 0,25% трипсин-ЭДТА на чашку и инкубировать в течение 10 мин при 37 ° С в атмосфере 5% СО 2 инкубаторе. Остановить реакцию добавлением 10 мл DMEM / F12 (Хэма), содержащей 5% сыворотки плода коровы. собиратьКлеточный осадок центрифугированием (600 RCF, 5 минут, комнатная температура).
- Промыть Клеточные осадки дважды 10 мл холодного PBS (4 ° С), добавляют 1 мл PBS в осадок клеток, и приостанавливать. Граф клеток с помощью гемоцитометра и переносят 1,7 мл центрифужные пробирки.
- Работая на льду, добавить 1,0 х 10 6 Ленти-mCherry меченые клетки + 1,0 × 10 6 Ленти-EGFP меченых клеток до 10 мкл PBS. Добавьте 10 мкл базальной мембраны матрицы. Приостановка и транспортировать на льду к животному комнате.
- Приготовление маточной трубы
- Проанализируйте отдельные маточные трубы от 6 до 8-недельных мышей целинных β-актин-DsRed в PBS, как описано в пунктах 1.1.1-1.1.5. Передача отдельных трубок матки в каплю 200 мкл PBS под микроскопом рассечение. Осторожно размотать маточные трубы с помощью пинцета и 28 калибровочных игл путем удаления mesosalpinx, часть широкой связки, которая поддерживает сегменты маточной трубы. Поместите одиночные развернутого трубы матки в капле 200 мкл не ледяным PBS до овариальный жировой ткани реципиента подвергается и готова получить пересадку.
2. Овариальное Fat Pad Трансплантация
Примечание: Лечить инструменты между каждой операцией животных. Подготовить и организовать все оборудование заранее. Спинные трансплантаций к правой яичников жировой ткани являются льготное, так как это позволяет избежать селезенку. Однако получатели могут иметь трансплантаты в обоих яичниках жировым.
- Используйте сингенных мышей или тяжелым комбинированным иммунодефицитом (SCID / NCr) мышей в качестве получателей первичных клеток. Для человеческих клеток, таких как клетки HIO118, использование Nod / SCID / гамма мышей (NSG) или SCID мышей.
- Обезболить мышь адресата одной внутрибрюшинной инъекции 2,2,2-Tribromoethanol в дозе 0,15 мл / 10 г массы тела. Место животное на грелку, в животном капюшоном и подтвердить надлежащее обезболивание потерей педали рефлекса (носок щепотку). Нанесите мазь ветеринара на глаза, чтобы предотвратить сухость в то время какживотное находится под анестезией. Вводят животным подкожно обезболивающего Кетопрофен в дозе 4 мг / г массы тела для лечения для послеоперационной боли.
Примечание: В качестве альтернативы, использовать изофлуран для анестезии. Место животное в индукционной камере и регулировать расходомер кислорода в 0,8-1,5 л / мин и изофлурановым испарителем до 2-3%. Удалите наркозом животного из камеры, пусть дышат изофлуран от маски и установите расходомер кислорода в 0,4-0,8 л / мин и изофлурановым испарителем до 1,5%, а затем начать операцию. - Бритье хирургическую область с # 40 машинки для стрижки; удалить волосы из зоны 2 раза хирургической области, подготовить бритую кожу с тремя антисептических скрабы повидон-йодом, а затем на 70% этанола, и накрыть стерильной драпировки.
- Переместить животное под микроскопом рассечение, расположенного в шкафу биологической безопасности. Выставляют репродуктивного тракта с помощью разреза в дорсомедиальной положении непосредственно над яичников жировой ткани.
Примечание: Critскую шаг: Точная Разрез кожи облегчает заживление ран, использование скальпелем рекомендуется на этапе 2.4. - Тупыми тонким пинцетом вытащить овариальный жировой ткани тщательно через разрез по направлению к средней линии, сводя к минимуму повреждения нервов и крупных кровеносных сосудов.
Важнейший шаг: Если происходит кровотечение, остановить операцию и рассмотреть вопрос пересадки на другой животного-хозяина. - Под контролем рассечение микроскопом с помощью 28 калибра скошенной иглой сделать 2-4 мм глубокий надрез в жировой ткани яичников, 3-4 мм над яичником.
Критический шаг: Убедитесь в том, что разрез проходит только через половину жировой ткани; прокалывание весь путь до конца к нижней стороне вызывает утечку. Будь скор и без промедления приступить после этого шага. - Для клеточных трансплантаций, заполнить шприц (30 калибр иглы) с 10-20 мкл клеток базальной мембраны матрицы-смеси и вводят в жировой разрез площадки. Для пересадки маточной трубы, подобрать остроумие маточной трубыч тонким пинцетом и место в 10 - 20 мкл матрицы базальной мембраны держали на льду. Использование 0.1-10 / 20 мкл XL закончил кончик фильтра (укороченный на 3 мм) подобрать ткани и базальной мембраны матрицы суспензии и выпустить в разрез жировой ткани.
- Подождите 5 минут мембраны матрица фундамента затвердеть и место репродуктивного тракта обратно в брюшину. Закройте мышцы с 2 stiches хирургического шовного материала и кожи с двумя маленькими раневых скрепками или хирургического шовного материала.
- Повторите шаги 2.4-2.8 трансплантировать PBS-базальной мембраны матрица-смесь в контра-латеральной жировое животного, который будет служить в качестве контроля.
Критический шаг: После операции поместить животное на грелку, потому что потеря тепла происходит быстро под наркозом мышей. - Пусть животное восстановиться на грелку в родной клетке и не наблюдать за животное, пока полностью проснулся от наркоза. Не оставляйте животное без присмотра, пока он не пришел в сознание достаточное для поддержания Sternaл отдохновение. Не возвращать животное, которое перенес операцию на компании других животных, пока полностью не выздоровел.
- Поместите несколько предварительно влажных пищевых гранул внутри клетки в дополнение к сухой пищи на клетке после операции. Применяют послеоперационные анальгетиков, если это необходимо в течение следующих нескольких дней и осмотреть рану ежедневно. Применяют антибиотики в соответствии с утвержденным протоколом животных в случае возникновения раневой инфекции. Удалить рану клипы через 10 дней после операции, когда рана полностью закрыта.
3. гистологии и Image Acquisition
- Привитые Сбор и сохранение
- Готовят 4% раствор параформальдегида путем смешивания 26 мл DDH 2 O 4 мл 10х PBS и 10 мл 16% -ного раствора параформальдегида.
- Рассеките в одном блоке, насаждаемое овариальный жировой ткани, яичника, маточной трубы, 0,5 см матки, как описано в шагах 1.1.1-1.1.4. Сразу же место в 2 мл 4% параформальдегида и зафиксировать в течение 2 часов, при комнатной температуре. Из того же животного, рассекают не-приживлениеконтралатеральной яичника система жировой ткани трансплантировали PBS-базальной мембраны матричной смеси в качестве контроля (см шаг 2.9). Закрепить и процесс таким же образом.
- После фиксации стирке тканей три раза PBS в течение 5 мин и инкубировать в течение ночи в PBS при 4 ° С.
- Для всего монтажа визуализации яичников жировой ткани переходите к шагу 3.2.1.
Примечание: После того, как ткани захвата изображений могут быть заморожены (3.3.1) или обработанные для парафин (3.3.2). Инкубацию в течение ночи в 30% сахарозы в PBS при 4 ° С улучшает качество замороженных тканей.
- Image Acquisition
- Бесплатно разместить весь монтажа яичниковые системы жировое в PBS заполненных блюд и изображения с помощью инвертированного микроскопа, оборудованного с приложением эпи-флюоресценции и цветной камерой высокой четкости, с 4-мя, 10x целями и стереомикроскопа оснащены насадкой флюоресценции, цветной камерой и плана Апо 1xWD70, цели ED план 1.5xWD45.
- гистология
- Следующийполучение изображений в целом монтажа (3.2.1) поместите каплю 200-500 мкл вложение среды для образцов замороженной ткани на 2 х 1 см кусок лабораторной пленкой и с помощью пинцета, перенести ткань капли. Возьмите фильм на одном краю и передачи ткани среднего каплю к криогенной мл флакон 1,8. Закройте флакон и погрузить в жидкий азот. Хранить замороженные ткани при -80 ° С.
- В качестве альтернативы, действуйте со стандартным парафин. Используйте 20-40 объемы объема ткани для каждого шага.
- Погружают ткань один раз в 65% этаноле в течение 30 мин, встряхивая осторожно при комнатной температуре.
- Погружают ткань один раз в 70% этаноле в течение 30 мин, встряхивая осторожно при комнатной температуре. На этом этапе образцы могут храниться в течение нескольких месяцев при комнатной температуре.
- Погружают ткань один раз в 90% этаноле в течение 30 мин, встряхивая осторожно при комнатной температуре.
- Погружают ткань один раз в 95% этаноле в течение 30 мин, встряхивая осторожно при комнатной температуре.
- Погружают ткань в два раза в абсолютном этаноле (200 доказательства) в течение 30 мин, встряхивая осторожно при комнатной температуре. <литий> погружают ткани дважды в хлороформе в течение 30 мин, встряхивая осторожно при комнатной температуре.
- Погружают ткань один раз в парафин в течение 30 мин, встряхивая осторожно при 58 ° C.
- Погрузитесь ткани один раз в парафин в течение 12 часов, встряхивая осторожно при 58 ° C.
- Погружают ткань один раз в парафин в течение 3 ч, при 58 ° C.
- Поместите ткани в гистологических форм металлических и заполнить формы с 58 ° C парафин. Добавить пластиковую гистологии кассеты поверх парафина и остывать парафина до + 4 ° С. Извлечь блок парафином ткани и хранить при комнатной температуре.
Примечание: температура Парафин не должна превышать 58 ° C для оптимального сохранения ткани, пригодной для иммуногистохимического окрашивания.
- В качестве альтернативы, Подготовка к парафин с образцами обработки геля.
- Аспирируйте PBS и передавать все-монтирование ткани до 70% этанола. Инкубируют при комнатной температуре в течение 2 часов. В водяной бане нагрейте образец обработки геля до 60 ° С.
- Pipettе 200 мкл геля для обработки образца на лабораторном пленочной подкладке Петри. Использование тонких щипцов рассечение передать всю систему для монтажа в ткани до капли геля обработки образца.
- Дайте образец гель обработки вилка для отверждения при комнатной температуре, или затвердевать пробку в течение 10 мин при температуре 4 ° С.
- Поместите гель обработки образца встроенной ткани в кассетах ткани гистологии, зажатых между пенопластовых биопсии подушечками. Вставить в парафин, как на этапах 3.3.2-3.3.2.10.
Примечание: Образец обработки геля вложение предотвращает потерю и позволяет сохранение небольших образцов хрупких тканей.
Примечание: Тканей сохраняются при замораживании или парафин подходят для иммуногистохимического окрашивания 14,15.
Результаты
Экспериментальные клетки и ткани могут быть точно пересажены в овариальной площадку жира под микроскопом рассечение (рисунок 1). Примеры включают первичные мыши маточных эпителиальные клетки , полученные от мышей Повсеместно , выражающих EGFP (рис 2А) или DsRed (рис 2B) и клетки эпителия поверхности яичников человека увековечено HIO118 16,17 клетки , меченные mCherry и EGFP лентивирусах (рис 2C - F). Этот подход также применим для длительной трансплантации органов, таких , как мышь маточной трубы (рисунок 3). Согласно иммуногистохимического окрашивания, как мерцательного (FOXJ1 положительный 14) и секреторные (Pax8 положительный 15) клетки сохраняются в маточных эпителии пересаженных тканей (рис 3D и Е).

Рисунок 1:. Овариальное Fat Pad Трансплантация (A) Видимая область трансплантации (стрелка). (В) надрезают с помощью 28 G иглы (стрелки). (С) УТ / базальной мембраны матрица смесь приживление с помощью пипетки (стрелка). (D) UT привиты (стрелка, ярко - красный, UT из бета-актина-DsRed мышей). FP, жировой ткани; Оу, яичник; UT, маточной трубы. Шкала бар = 2 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
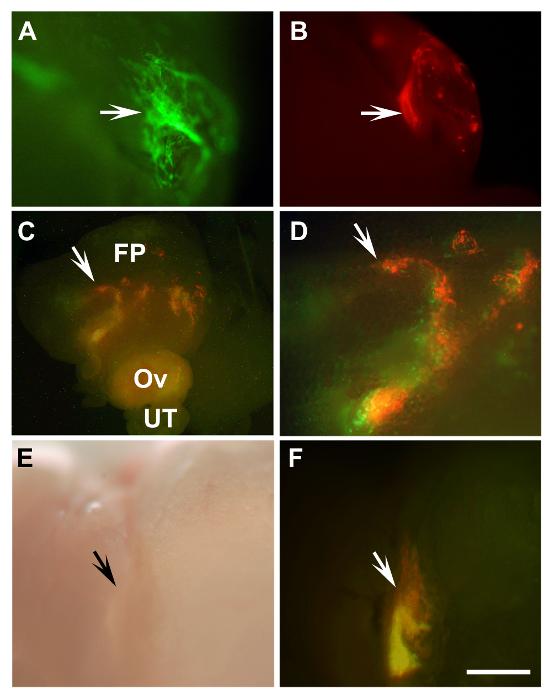
Рисунок 2:. Обнаружение трансплантировали мыши Первичные Трубное эпителиальных клеток человека и Увековеченный яичников поверхностных эпителиальных клеток (A, B) Нет разрастания первичной мыши маточных клеток эпителия (стрелки) из β-актин-EGFP мышей (A, зеленый) и бета-актина-DsRed (B, красный) через 8 дней после трансплантации в сингенных мышей. (C, D) Engraftments смешанных клеток HIO118 (стрелки) обозначалась либо с Ленти-EGFP (зеленый) или Ленти-mCherry (красный) через 10 дней после трансплантации мышам NSG. (D) Увеличенная область из (С, стрелка). (E, F) Прививка разработана 43 дней после трансплантации одних и тех же клеток, что и в C, D к SCID мыши (стрелки). AD, F, флуоресценция; E, светлое поле, FP, жировой ткани; Оу, яичник; UT, маточной трубы. (A, B, DF) Шкала бар = 500 мкм; (C) Шкала бар = 1600 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Объявление / 54444 / 54444fig3.jpg "/>
Рисунок 3: Характеристика маточной трубы трансплантологии. (A) Полная маточной трубы (стрелка) β-актина-DsRed мыши 6 дней после трансплантации в жировой ткани яичников (стрелка, ярко - красный). (Б) Флуоресцентные замороженный участок жировой ткани с трансплантацией , показанной в позиции (А). Красный, DsRed; Синий, 4 ', 6-диамидино-2-фенилиндола (DAPI) ядерный counterstaining. (C) маточной трубы трансплантата (стрелка) через 40 дней после пересадки в NSG мыши получателя (стрелка). Парафин раздел. Обратите внимание, правильное сохранение всех компонентов принципа маточной трубы, а также отсутствие трансплантационной ассоциированного фиброза и воспаления. Гематоксилином и эозином. (D, E) Обнаружение гена трубные маркеров эпителий Соединенный ящика 8 (Pax8) и Forkhead коробки J1 (FOXJ1; коричневого цвета ядерного, Arrowheads) в клетках трансплантата (стрелки) , показанных в ( C). Иммунопероксидазной система. Counterstaining с метиловым зеленым. FP, жировой ткани; Оу, яичник; UT, маточной трубы. (A) Шкала бар = 1000 мкм; (B) Шкала бар = 200 мкм; (CE) Шкала бар = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Компонент | 1x DMEM F12 среду (Хама) |
| L-Глютамин | 2 мМ |
| pruvate натрия | 1 мМ |
| фактор эпидермального роста | 10 нг мл -1 |
| Базовый фактор-2 роста фибробластов | 10 нг мл -1 |
| гидрокортизон | 500 нг мл -1 |
| инсулином | 5 мкг мл -1 |
| Траnsferrin | 5 мкг мл -1 |
| селенита натрия | 5 нг мл -1 |
| бычий альбумин | 0,10% |
| Пенициллин / стрептомицин | 100 единиц мл -1 / 100 мкг мл -1 |
| Minimum Essential Medium Eagle (MEM) несущественные аминокислоты | 0,1 мМ |
| Бета-меркаптоэтанол | 10 -4 М |
Таблица 1:. Мышь Трубное Epithelim Рост среднего (М-ТЭ-ГМ) компонентов , перечисленных в левой колонке , растворяют в 1x DMEM среде F12 (Хэма) в указанных концентрациях, правой колонке. Окончательный состав среды является не содержащей сыворотки.
Обсуждение
Мы установили овариальный жировое анализа трансплантации, которая позволяет для точной доставки и обнаружения эпителиальных клеток и тканей. Жировой ткани яичников Процедура трансплантации анализ является технически менее сложным , чем интрасиновиальных инъекции 10-12 и позволяет более равномерного и точного расположения пересаженных клеток по сравнению с внутрибрюшинного введения 9. Он также хорошо подходит для длительной трансплантации целого органа, таких как маточной трубы.
Важно отметить, что овариальный жировой ткани обеспечивает знакомый микросреду для эпителии женской репродуктивной системы. Это должно быть особенно хорошо подходит для изучения молекулярных и клеточных свойств человека и мыши яичников и маточных клеток эпителия в процессе регенерации и злокачественной трансформации. В отличие от других органов, несколько исследований были сосредоточены на выявлении и характеристике стволовых клеток в эпителии женского гeproductive тракта 18,19. Такие исследования имеют особое значение , так как многие виды рака , как полагают, происходят из стволовых клеток взрослого организма 20. Все же клеточные происхождение эпителиального рака яичников остаются весьма спорными 18. Эпителиального рака яичников составляют большинство случаев рака яичников и в 5 - е место среди всех связанных с раком смертей женщин в США 21. Таким образом , развитие ортотопической анализа с несколькими преимуществами по сравнению с существующими методами трансплантации должна 9-12 значительно облегчит исследования в этой области.
Учитывая поверхностное расположение жировой ткани яичников, небольшие системы обработки изображений животных могут быть использованы для наблюдения на engraftments маркированы с сильным флуоресцентным или биолюминесценции репортеров. Она также должна быть возможность установить минимально инвазивных анализов с высокой разрешающей способностью живого изображения, такие как нелинейной микроскопии 22. Яичников жировой ткани также могут быть сохранены в органных культурах, таким образом, позволяютИнг трехмерную культуру нормальной и опухолевой эпителий в условиях тесно Резюмируя организацию клеток и внеклеточного матрикса. Будущие исследования должны решать эти перспективные возможности.
Несколько важных шагов должны быть рассмотрены. Обеспечение грелку и держать грызунов теплой во время операции значительно улучшает выживаемость. Стерильность инструментов обработки жировой ткани гарантирует, что насаждаемое системы поддерживаются стерильными. По нашему опыту, значительные результаты кровотечения в замедление роста трансплантатов. Важно отметить, что накладка Разрез жир должен быть сделан именно потому, что разрывают жировой ткани или прокалывания его через вызывает кровотечение. Коагулянты следует использовать для остановки кровотечения по мере необходимости. Если engraftments не развиваются, более высокая концентрация инжектированных клеток следует рассматривать. Первые успешные наросты можно наблюдать уже через одну неделю после пересадки и наиболее engraftments должен быть виден одинмесяц после процедуры. Для пересадки, иглы с большим диаметром (23-25 G) может быть использован для предотвращения настригу крупных клеток (более 10 мкм в диаметре). Тем не менее, такие иглы могут быть более травмирующим жировой слой, и их использование должно быть проверено заранее. Для наших экспериментов мы использовали 6 до 8-недельного возраста донора и реципиента мышей. Для обеих целей могут быть использованы моложе или старше мышей. Тем не менее, число инжектированных клеток может потребоваться скорректировать. Чем меньше размер овариальных жировым у молодых доноров также должны быть рассмотрены.
Как и в случае каких-либо методов, существуют некоторые ограничения мыши яичников жира трансплантации колодки анализа. Несмотря на то, сингенных иммунокомпетентных мыши могут быть использованы для мышиных первичных клеток / тканей, наша техника требует NSG или SCID мышей для трансплантации человеческого материала. Вполне вероятно, можно гуманизировать жировой ткани для поддержания роста эпителиальных клеток человека. Тем не менее, мы не проверяли этот подход пока. Использование младшего Feсамцы могут привести к снижению затрат размножения; Тем не менее, зрелые девственных самок мышей (в возрасте от 8 до 10 недель) имеют больший жировой ткани, тем самым позволяя трансплантация больших образцов. Наконец, персонал лаборатории должен быть обучен в хирургии животных, чтобы обеспечить своевременное и успешное выполнение процедуры.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы хотели бы поблагодарить д-ра Эндрю К. Годвин, Университет Канзаса медицинский центр, для обеспечения человеческих клеток HIO118. Эти исследования были поддержаны грантами от стволовых клеток программы Нью-Йорк (NYSTEM; T028095) и Национальные институты здравоохранения / Национального института здоровья ребенка и развития человека (P50HD076210) к AFN и грантами от NYSTEM (C028125, C024174 и T028095), Национальные институты здравоохранения / Национального института рака (CA182413) и яичников фондом исследований рака (327516) в Айн.
Материалы
| Name | Company | Catalog Number | Comments |
| 25 gauge needle | BD Becton Dickinson | 305122 | |
| 28 gauge needle (hypodermic syringe with attached needle) | Kendall | 30339 | Part Number: 8881500014 |
| basic fibroblast growth factor-2 | Sigma-Aldrich | F9786 | |
| basement membrane matrix (Geltrex) | Invitrogen | A1413202 | |
| β-actin-DsRed mice | The Jackson Laboratory | 6051 | B6.Cg-Tg(CAG-DsRed*MST)1Nagy/J |
| β-actin-EGFP mice | The Jackson Laboratory | 3291 | C57BL/6-Tg(CAG-eGFP)1Osb/J |
| β-mercaptoethanol | Sigma-Aldrich | M7522 | |
| bovine albumin | Sigma-Aldrich | A3311 | |
| chloroform | VWR | EM-CX1058-1 | |
| collagenase/hyaluronidase | Stem Cell Technologies | 7912 | |
| cryogenic vials | Thermo Scientific Nunc | 377267 | |
| dispase II | Worthington | NPRO2 | |
| DMEM F12 (HAM's) | Corning | 10-092-CV | |
| DNaseI (Deoxyribonuclease I) | Stem Cell Technologies | 7900 | |
| embedding medium for frozen tissue specimens (O. C. T.) | Sakura Finetek | 4583 | |
| epidermal growth factor | Sigma-Aldrich | E4127 | |
| ethanol 200 proof | Koptec | V1001 | to prepare 70% |
| fetal bovine serum | Sigma | F4135 | |
| filter tip 0.1-10/20 µl XL | USA Scientific | 1120-3810 | |
| FOXJ1 antibody | eBioscience | E10109-1632 | used at concentration 1:1,000 (no unmasking) |
| hydrocortisone | Sigma | H0135 | |
| Ketoprofen | Zoetis | 4396H | |
| laboratory film (Parafilm M) | American National Can | PM-999 | |
| L-Glutamine | Corning | 25-005-Cl | |
| insulin-transferin-sodium selenite | Sigma-Aldrich | I884 | |
| isoflurane, 250 ml | Santa Cruz Animal Health | sc-363629Rx | |
| low attachment plate 24-well | Costar | 3473 | |
| MEM non-essential amino acids | Corning | 25-025-Cl | |
| metal histology molds | Electron Microscopy Sciences | 62527-22 | |
| microscope, inverted | Nikon | Eclipse TS 100 | |
| microscope, stereo | Nikon | SMZ800 | |
| Nod/SCID/gamma (NSG) mice | The Jackson Laboratory | 05557 | NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ |
| paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| paraffin (Paraplast, X-TRA) | Fisher Thermo Scientific | 23-021-401 | |
| PAX8 antibody | Proteintech | 10336-1-AP | used at concentration 1:1,000 (no unmasking) |
| PBS (Phosphate-Buffered Saline) | Corning | 21-030-CV | |
| penicillin streptomycin | Corning | 30-002-Cl | |
| severe combined immunodeficiency (SCID/NCr) mice, BALB/C background) | NCI-Frederick Animal Production Program | 01S11 | |
| sodium pyruvate | Corning | 25-000-Cl | |
| specimen processing gel (HISTOGEL) | Richard-Allan Scientific | HG-4000-012 | |
| sucrose | Sigma-Aldrich | S0389 | |
| Trypsin-EDTA, 25% | Corning | 25-053-Cl |
Ссылки
- Deome, K. B., Faulkin, L. J., Bern, H. A., Blair, P. B. Development of mammary tumors from hyperplastic alveolar nodules transplanted into gland-free mammary fat pads of female C3H mice. Cancer Res. 19, 515-520 (1959).
- Proia, D. A., Kuperwasser, C. Reconstruction of human mammary tissues in a mouse model. Nature protocols. 1, 206-214 (2006).
- Shackleton, M., et al. Generation of a functional mammary gland from a single stem cell. Nature. 439, 84-88 (2006).
- Stingl, J., Caldas, C. Molecular heterogeneity of breast carcinomas and the cancer stem cell hypothesis. Nat Rev Cancer. 7, 791-799 (2007).
- Koren, S., et al. PIK3CA(H1047R) induces multipotency and multi-lineage mammary tumours. Nature. 525, 114-118 (2015).
- Nikitin, A. Y., Nafus, M. G., Zhou, Z., Liao, C. -. P., Roy-Burman, P., Bagley, R. G., Teicher, B. A. Prostate stem cells and cancer in animals. Stem Cells and Cancer. , 199-216 (2009).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160, 324-338 (2015).
- Lu, C. P., et al. Identification of stem cell populations in sweat glands and ducts reveals roles in homeostasis and wound repair. Cell. 150, 136-150 (2012).
- Flesken-Nikitin, A., et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495, 241-245 (2013).
- Orsulic, S., et al. Induction of ovarian cancer by defined multiple genetic changes in a mouse model system. Cancer Cell. 1, 53-62 (2002).
- Dawes, J., Liu, B., Mars, W., Michalopoulos, G., Khillan, J. S. Multiple ovarian transplants to rescue a transgenic line of mice. Lab Anim (NY). 39, 191-193 (2010).
- Cordero, A. B., Kwon, Y., Hua, X., Godwin, A. K. In vivo imaging and therapeutic treatments in an orthotopic mouse model of ovarian cancer. Journal of visualized experiments : JoVE. , (2010).
- Albihn, A., et al. Production of capsular material by equine trophoblast transplanted into immunodeficient mice. Reproduction. 125, 855-863 (2003).
- Muthusamy, N., Vijayakumar, A., Cheng, G., Ghashghaei, H. T. A knock-in Foxj1(CreERT2::GFP) mouse for recombination in epithelial cells with motile cilia. Genesis. 52, 350-358 (2014).
- Perets, R., et al. Transformation of the fallopian tube secretory epithelium leads to high-grade serous ovarian cancer in Brca;Tp53;Pten models. Cancer Cell. 24, 751-765 (2013).
- Capo-Chichi, C. D., et al. Dynamic alterations of the extracellular environment of ovarian surface epithelial cells in premalignant transformation, tumorigenicity, and metastasis. Cancer. 95, 1802-1815 (2002).
- Roland, I. H., et al. Loss of surface and cyst epithelial basement membranes and preneoplastic morphologic changes in prophylactic oophorectomies. Cancer. 98, 2607-2623 (2003).
- Flesken-Nikitin, A., Odai-Afotey, A. A., Nikitin, A. Y. Role of the stem cell niche in the pathogenesis of epithelial ovarian cancers. Mol Cell Oncol. 1, 963435 (2014).
- Ng, A., Barker, N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol. 16, 625-638 (2015).
- Visvader, J. E. Cells of origin in cancer. Nature. 469, 314-322 (2011).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65, 5-29 (2015).
- Williams, R. M., et al. Strategies for high-resolution imaging of epithelial ovarian cancer by laparoscopic nonlinear microscopy. Transl Oncol. 3, 181-194 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены