Method Article
长期共焦成像根和下胚轴发育的简单室
摘要
这里介绍的是使用高数值孔径目标和全氟萘烷作为浸渍介质,用于高达3天的根和下胚轴发育的高分辨率共焦延时成像的简单技术。
摘要
植物发育的几个方面,如侧根形态发生,发生在几天的时间跨度。为了研究潜在的细胞和亚细胞过程,需要保持生理条件的高分辨率延时显微术策略。植物组织必须具有足够的营养和水供应持续的气体交换,但是当浸没并固定在盖玻片下时,它们特别易于缺氧。已经成功应用的一个策略是使用灌注系统来维持氧和营养物质的不断供应。然而,这种布置可能是复杂的,麻烦的,并且需要专门的设备。这里介绍的是一种使用全氟萘烷作为浸渍介质的简单成像系统的替代策略。该系统易于安装,需要最少的设备,并且易于安装在显微镜平台上,允许建立几个成像室并以标准形式成像等位基因。在该系统中,前两天,侧根生长速率与标准条件下的琼脂平板生长速率无差异,侧根生长以降低的速率持续至少另一天。植物组织通过琼脂板供应营养物质,其可用于施用一系列药理化合物。该系统被建立以监测侧根发育,但是容易适应于其他植物器官如下胚轴和主根的成像。
引言
为研究植物发育基础的细胞和亚细胞过程,对高分辨率长期延时成像策略的需求不断增加。这种成像实验中的一个关键挑战是维持生理条件,包括充分的气体交换加水和营养物1,2,3 。为了利用具有高数值孔径的目标以获得最佳的光学分辨率,样本应位于紧密接近并且平行于盖玻片定向。在成像过程中,x,y和z方向的移动理想情况下最小。
虽然幼苗通常安装在水或水溶液中用于短期成像,但水具有低的溶解CO 2和O 2的能力(1.54mg / mL和0.04mg / mL,分别在20℃,0.1MPa) 4 ,这使得它不适合延长的延时实验。保持恒定水平的氧气和营养物质的灌注系统是解决这个问题的一种解决方案,并且已经开发用于共聚焦激光扫描显微镜(CLSM) 1,2,3和光敏显微镜(LSM) 5 。像RootChip 2和RootArray 3这样的系统专门设计用于发育根的时间推移成像,并且涉及在定制多标本装置中发芽种子。这些布置确保最小的机械扰动,并且被设计用于多个幼苗的并行分析,但是未被优化用于亚细胞结构的成像。 Calder及其同事设计了一种更复杂的基于灌注的成像腔室,其优化用于通过网状物将样品保持在适当位置的亚细胞结构成像允许使用高倍率浸没镜头1 。
这里提出的另一个简单的解决方案不是基于灌注系统,而是利用全氟碳酸盐(PFD),全氟碳化合物最近作为拟南芥成像6,7,8的成熟载体普及 。在这种应用中,用于溶解CO 2和O 2的PFD的高容量(PFD中的O 2为1.9g / mL,而在水中为0.04mg / mL) 9允许浸入的组织进行气体交换。此外,PFD是非荧光的,其折射率(1.313)与水(1.333)相当,并且比空气(1.000) 6更接近细胞质(〜1.4)。据报道,全氟化碳对各种植物和植物t具有最小的生理作用问题6 ,当浸泡在PFD中时,萝卜种子容易发芽,并在供水时呈现正常生长发育至少两整天。对拟南芥种子萌发进行了类似的观察。基于受激拉曼散射直接成像渗透后拟南芥叶组织中PFD的分布 ,Littlejohn及其同事得出结论,PFD可能不被活细胞吸收8 。 PFD以前主要用于成像空中组织,其中它显着地增加成像深度,因为它由于其低表面张力而容易地渗入空气空间6 。在这里,PFD被用于发展侧根的长期共焦成像。在该构造中,将一个或多个幼苗置于用琼脂固化并浸在PFD中的生长培养基板上。 PFD允许g在成像室内进行交换,防止缺氧。 PFD具有高挥发性,因此其也具有高气体渗透性的聚(二甲基硅氧烷)胶的垫圈(CO 2为1.5×10 -12 pmol m -1 s -1 Pa -1 ) 11保留。营养物和水由用琼脂固化的培养基板供应。同时,该琼脂板轻轻地将根部压在盖玻片上,从而将其相对位置固定在成像室中并允许使用高分辨率的水浸透镜。此外,琼脂板可用于施用一系列药理学治疗,包括地塞米松,谷维素和异恶草酮。成像室可以使用最少的设备从标准显微镜载玻片大量组装。成像室被开发和表征以研究侧根发育,但适用于成像其他幼苗器官,如主要根尖和下胚轴。
研究方案
创建分庭
- 使用玻璃切割机,从1mm厚的显微镜载玻片的末端切下3mm宽的条带。使用氰基丙烯酸酯超级胶或双面胶带,将这些玻璃条胶带沿第二显微镜载玻片的宽度大约45毫米分开( 图1A )。需要每个房间一个幻灯片,再加上额外的幻灯片,倒入琼脂平板(一个幻灯片将产生2-3个琼脂平板)。幻灯片可以重复使用。
- 在玻璃条之间,从气体渗透性聚(二甲基硅氧烷)胶中形成相同高度的垫圈。将聚(二甲基硅氧烷)胶球放在载玻片上( 图1B ),用少量100%绝对乙醇湿下第二片,并用第二片平片化聚(二甲基硅氧烷)胶珠,直至达到高度的玻璃条( 图1C )。
- 如有必要,修剪多余的聚(一分钱硫代硅氧烷)口香糖和重复变平。
- 使用在无水乙醇中润湿的合适的切割刀或剃须刀片,去除聚(二甲基硅氧烷)胶的内部部分以形成稍后保持幼苗和琼脂板的空腔( 图1D )。
- 用剃刀刀片小心地修剪凝胶,形成最终壁厚约2mm的垫片( 图1E )。通过聚(二甲基硅烷)阻挡层的气体的渗透性与50μm以上的厚度无关11 。
2.生成琼脂凝固的生长培养基板
- 在带有两个玻璃条的显微镜载玻片上,放置一块盖玻片(22 mm x 50 mm),使其放在两个玻璃条上。
- 移液器将含有1%w / v蔗糖和1.5%w / v琼脂(1/2 MS)的半强度Murashige和Skoog生长培养基移入所得空间在盖玻片下面,直到后者完全充满(约1mL总体积),并留下直到琼脂(约5分钟)。
注意:药理化合物可以在浇注板之前,通过在液体介质中加入适当的浓度,通过琼脂板进行施用。已经成功地测试了地塞米松12 ,异恶草酮,2,6-二氯苄腈(DCB),谷维素和latrunculin B.
3 。完成会议室设置
- 空气通过在管7中摇动小体积的PFD平衡PFD。将少量(约200μL)空气平衡的PFD添加到凝胶垫片的孔中,但不要完全填充室。这种PFD将有助于避免在琼脂平板放置在室内时吸附气泡。
- 从琼脂板上取下盖玻片(在上面的步骤2.2),并使用剃须刀切断一部分de粗大的尺寸和形状。然后将其放入凝胶垫圈的孔中( 图1F )。与周围的垫圈应该有2-4毫米的间隙。
- 用空气平衡的PFD填充室。
- 将一个或多个拟南芥幼苗(最多3个幼苗用于2-3天的成像)放置在琼脂板上,子叶和下胚轴悬挂在边缘上,漂浮在PFD中( 图1G )。
- 为了获得幼苗,用70%乙醇灭菌种子,在补充有1%蔗糖和0.8%琼脂的1/2 MS培养基上种植,在4℃下分层2-4天,并在22℃的垂直取向板上生长16 h光/ 8小时黑暗的制度。为了成像侧根,在转移到成像室之前,种植植物7-10天。
- 要关闭室,应用与物镜光学元件相匹配的盖玻片,用玻璃显微镜载玻片的边缘轻轻地将其压下,直到盖玻片搁置在两个玻璃条上( 图1H )。
- 如果需要,将盖玻片固定在每个端部半长度上切割的1.25厘米宽的微孔外科手术带的条带( 图1I )。使成像前让样品沉淀约30分钟。这样可以使成像期间的样品运动最小化。
- 用立式显微镜进行成像,以保持受控的生长基质。使用20X / 0.7NA或63X / 1.2NA CS2目标。
结果
侧根生长在成像室的生理速率。
以每小时间隔测量成像室中植物的侧根长度( 图2A ,左图,电影1,n = 23),并将生长速率与在含有相同琼脂凝固培养基的标准培养皿上生长的侧根比较( 图2A ,right,Movie 2,n = 23)。由于越来越长的生长和增殖区域,增长率可能在侧根之间变化很大,根长度是一个决定因素。因此,在成像室和琼脂板中选择侧根组以表示不同初始长度(范围从50μm到1150μm)的根。实验开始时的平均侧根长度在每组中分别是相似的(成像室和板分别为439和442μm)。在27小时的分析时间间隔内,成像室和板上的侧根生长近似线性,板上平均生长速率为52μm/ h(R 2 = 0.997),成像室为51μm/ h R 2 = 0.993)( 图2B )。单个侧根的生长速率在板上和成像室( 图2C )中高度变化,成像室中的17μm/ h至82μm/ h,板上的13μm/ h至87μm/ h。虽然生长速度通常随着根长度的增加而增长,但是在相似长度的根之间的生长速率仍然存在显着变化,但在成像室和板上的差异相似。
侧根在成像室中增殖,并且可以使用hi成像数值孔径目标。
共表达质膜标记NPSN12-YFP14的侧根和微管标记UBQ1 :: mRFP-TUBULIN BETA6(RFP-TUB6) 15以1小时间隔通过CLSM 10成像,以记录成像室中细胞增殖过程中的微管行为( 图2D ,电影3)。在这些室中,侧根在x,y和z轴上的位置高度稳定,允许在几个小时内获得连续的延时共聚焦堆叠。分生细胞连续增殖,从前相变带( 图2D ,绿色箭头)的形成,有丝分裂主轴( 图2D ,白色箭头)和鳞片状体( 图2D ,蓝色箭头)的形成可以看出。与Petri板上的幼苗一样,成像室中完全细长的根细胞引发根毛( 图2A , 图2D ,箭头),进一步指示如成像室中预期的发展。为了提供广泛的视野, 图2D中的图像是用20x / 0.7NA目标获得的。也可以使用高数值孔径63x / 1.2NA浸水物镜获得侧根的高分辨率图像( 图2E )。
成像室持续长达三天的侧根生长。
为了探索成像室在生理速率下可以支持多长时间的根部生长,在0 h,24 h,48 h和72 h定量成像室(n = 27)和平板(n = 33)的侧根长度。根根在0小时,sen小于200μm,成像室中的平均侧根长度为117μm,板上为121μm。由于较短的根部平均生长得更慢( 图2C ),它们不经常在琼脂板的边缘生长,并且更容易成像。在前48小时内,与Petri平板相比,成像室中所有侧根的平均生长没有显着差异( 图3A )。然而,平均生长在48 h和72 h之间显着降低( 图3A )。虽然48小时后成像室的生长速度似乎通常会下降,但是个体之间的生长速率保持高度变化( 图3B , 3C ),这意味着侧根的实质子集以相当的速度在板和室内生长在整个72小时的增长期。 33个侧根中有23个生长在板上(69.7%)在72小时(927和3,163μm之间)达到平均长度的一个标准偏差内的长度, 图3B ,红色)。成像室中的27个(37.0%)侧根中的10个达到该间隔内的长度( 图3B ,红色)。
成像室可以轻松适应较老的侧根,一次根和下胚轴 。
原始成像室设计的一个限制是,刚性琼脂板提供了一些机械阻力,重力生长的根最终渗透到琼脂板上,导致图像质量的损失( 图4B )和超出高NA的工作距离的生长透镜,甚至相对较长的工作距离(0.3 mm)63X / 1.3 NA CS2目标。年轻的侧根缺乏含有statolith的因此,它们最初在成像室中平行于盖玻片生长( 图2E )。当它们长得更长,形成columella和statoliths时,侧根表现出增加的正向引力,而初生根表现出从发芽开始的强烈的引力响应。这限制了几个小时可以成像初级根的时期,严重限制了可以连续成像48小时以上的侧根的起始长度。为了克服这个限制,室被修改,使得通过在琼脂板的表面上作为渗透阻挡层的纤维素玻璃纸膜保持平行于盖玻片的生长( 图4A )。使用1.5%琼脂板的初步尝试在前24小时内引起根部生长减少,这可能是由于机械应力。对平板中较低的琼脂浓度进行了测试发现在含有0.8%琼脂和纤维素膜的板的室内,初始48小时的常规室中的年轻侧根生长速率与生长速率没有显着差异。 0-24小时,纤维素腔和常规腔室的平均根生长分别为242μm和262μm(p = 0.78 Student t检验),24-48h分别为330μm和355μm1(p = 0.67) T检验); n = 12,n = 11。这种布置有效地防止侧根从盖玻片生长进入琼脂,并且还允许主根成像长达48小时( 图4C )。
为了检验成像室是否可适应除根以外的器官,选择拟南芥下胚轴。下胚轴基本上比根更厚,因此在常规成像室中,最上面的c椭圆形被挤压在盖玻片上,导致变形。因此,使用在其中心包含椭圆形凹陷的腔玻片来开发替代设计( 图4D )。在该构造中,将1mm厚的琼脂板(如上述2.2制备)定位成一端突出几毫米进入滑动腔( 图4D )。下胚轴位于载玻片上的空腔上方,同时根部位于水平部分上方。这确保了幼苗在根部固定在空间中,但下胚轴没有被挤压。虽然室内与板的生长速率没有系统地量化,但成像室中的下胚轴显示出沿着下胚轴向上移动的良好的纵向生长波( 图4E , 4F ) 16 。

图1 :组装成像室。所有细节在文中描述。 请点击此处查看此图的较大版本。
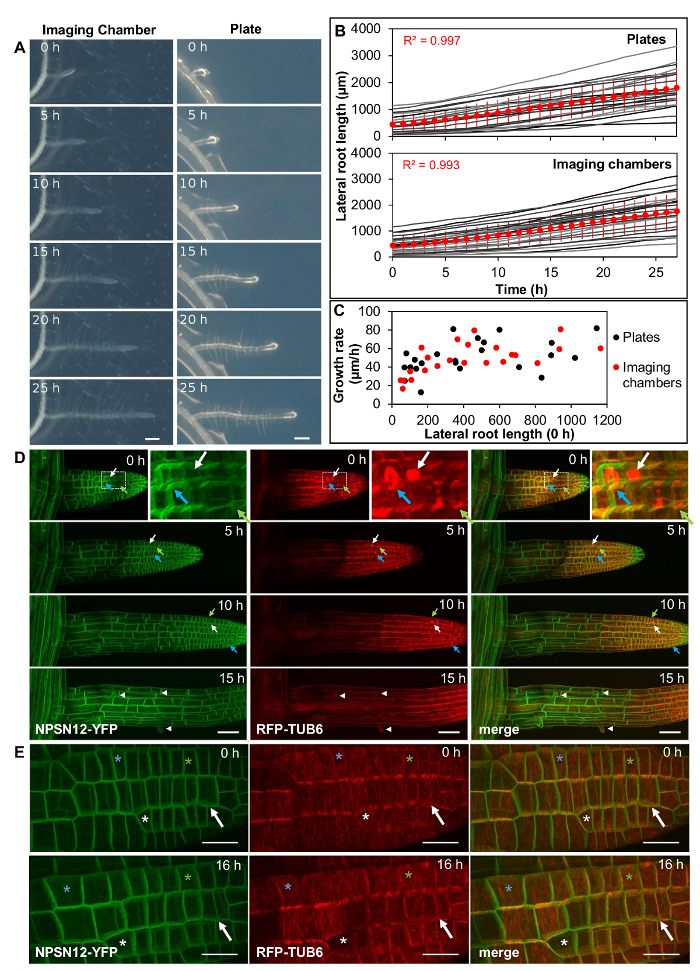
图2 :侧根在成像室的生理条件下生长。 ( A )在成像室(左)和平板(右)超过25小时(恒定光照,水平孵育,同时成像)中的拟南芥侧根发育。刻度棒=200μm。 ( B )如( A )所示,显示侧根长度超过27小时(以1小时间隔测量),侧根的图。 Individ根部绘制为灰色(平板和成像室为n = 23),平均长度为红色圆圈。误差棒= 1 SD。红线通过平均长度线性拟合。 ( C )显示( B )相对于其初始长度的所有侧根的平均生长速率的图。 ( D )在连续时间点从表达NPSN12-YFP和RFP-TUB6的侧根获得的3D共聚焦堆的最大强度投影。插入:盒装区域放大。绿色箭头:前相变带;白色箭头:有丝分裂主轴;蓝色箭头:箭头:根毛。 ( E )使用63X / 1.2NA物镜和奈奎斯特采样(像素尺寸77nm×77nm)在0小时和16点从( D )所示的转基因品系的年轻侧根获得的高分辨率图像的最大强度投影H;星号在每个时间点定位相同的单元格;箭头表示在0h和16h之间划分的单元格。刻度棒=50μm(AC); 20μm(E)。 请点击此处查看此图的较大版本。

图3 :成像室的长期侧根发育。 ( A )与平板相比,成像室中连续24小时间隔内平均绝对根生长曲线图。 ns表示p> 0.05; ***表示p <0.001(学生t检验)。 n = 33(平板),n = 27(成像室)。 ( B )在(A)中使用的所有根的连续时间点显示侧根长度的图。红色:所有侧根,其最终长度在板上生长的所有侧根的平均值的1 SD内(927和3163μm之间)。 ( C )最大在72h的连续时间点获得的侧根中质膜 - 膜标记NPSN12-YFP的代表性3D共聚焦点的张力投影。刻度棒=100μm。 请点击此处查看此图的较大版本。

图4 :成像室可适用于其他植物器官。 ( A - C )成像室适应主根。 ( A )成像室设计原理图。除了两个修改之外,这与标准设计( 图1 )相同:MS中间板含有0.8%琼脂而不是1.5%琼脂,并且在琼脂和植物之间放置纤维素膜(红色)以防止生长进入琼脂( B )在常规成像中在0小时和48小时成像的7天龄幼苗的主要根中的质膜 - 膜标记物NPSN12-YFP的代表性3D共焦点堆叠的XY(顶部)和XZ(底部)最大强度投影室。注意,由于其引力响应,根部生长到琼脂中。 ( C )在成像中0h和48h成像的7天龄幼苗的主要根中的质膜 - 膜标记物NPSN12-YFP的代表性3D共焦点堆叠的XY(顶部)和XZ(底部)最大强度投影室与纤维素膜。施用前,将纤维素薄膜在80%乙醇中灭菌,并在液体½MS培养基中浸泡。请注意,防止根部向琼脂的引力生长。 ( D - F )成像室适应下胚轴。 ( D )显示下胚轴成像室设计的示意图。聚(二甲基硅氧烷)胶垫(灰色)是制造商红色在两个玻璃条(黄色)之间的空腔上滑动。平板厚度为1.5%的平板(米色)的板坯放置在滑块上,部分地进入空腔。室内充满了PFD(蓝色)。将幼苗放置在琼脂板上,使得下胚轴占据琼脂板在腔中的向下倾斜的区域,同时根部位于琼脂的水平部分。房间用盖玻片封闭。 ( E )连续时间点在48小时内成像的两天龄幼苗的下胚轴中的质膜 - 膜标记物NPSN12-YFP的代表性3D共聚焦点的最大强度投影。 ( F )沿( E )所示的下胚轴的基底至根尖轴(沿着E轴所示的轴0小时的相对位置)的单个细胞的两个连续时间间隔的纵向生长。注意前面描述的生长波移动下胚轴16 。比例尺= 100μ米请点击此处查看此图的较大版本。

电影1: 请点击这里下载这部电影。
电影2: 请点击这里下载这部电影。
电影3: 请c舔这里下载这部电影。
讨论
这里介绍的方法是一个简单的策略,用于高分辨率共焦成像的发展侧根,长达三天。对于长达48小时的时期,没有观察到成像系统对侧根发育的不利影响。 48小时后,平均侧根生长开始减慢,尽管大部分根(37%)继续以与平板根平均生长相当的速率生长。因此,通过成像足够大量的根,48小时后其生长减缓的根可被排除。成像室的系统测试在长于72小时的时间内不进行,但如果需要延长成像周期,建议使用替代策略。如果提供适当的环境条件,或者将其移除到生长设备并定期返回到显微镜,成像室可以连续留在显微镜台上。这允许多个室被平行成像/ P>
这里所述的腔室的一个优点是侧根固定在它们的位置,并且可以使用高分辨率水浸透镜成像。空间稳定性主要取决于支撑琼脂板中使用的琼脂浓度。最初测试了从0.8%琼脂到2%琼脂的一系列不同浓度的浓度,表明该范围内的高浓度稳定地固定在空间中的根,但是根生长速度更慢,一些根表现出机械应力的迹象,包括减少的细胞伸长。相比之下,在成像期间,低琼脂浓度没有提供所需的支持物和根部漂移在x,y和z中。最佳1.5%琼脂板固定样品的位置,无不良机械效应。在这些条件下,经过30分钟左右的时间,根在数小时内稳定,允许数据采集过夜。在采集4D数据期间,z堆叠范围通常为b另外还有5-10微米,但这主要是为了适应侧根的平面外生长而不是z漂移或摆动。尽管标准琼脂浓度提供了一些抗渗透性,但根深蒂固的根将最终渗入琼脂。然而,通过成像室的微小修改,根部生长可以保持平行于盖玻片,从而使较老的侧根和主根成像。此外,可以容易地为基底成像室定制下胚轴。下胚轴在该系统中更自由地浮动,使得用于图像采集的z轴支架通常增加到约20μm。在这项研究中,整个使用直立式显微镜,这使得可以控制基底特性。成像室可以适用于倒置显微镜配置,但是需要评估刚性盖玻片对截肢器官的时间依赖性影响。
Littlejohn及其同事指出,PFD本身不易溶解生物分子,这意味着它不能直接用于药物化合物的递送7 。通过将这些化合物通过琼脂板搁在其上的凝固生长培养基的板块来克服这个问题。虽然灌注系统仍然是洗出实验的首选方法,但是成像室已经成功地用于施用地塞米松12和其他化合物。一个注意事项,虽然这篇文章正在准备von Wagenheim及其同事18描述了使用光照片显微镜成像侧根发育的室。
披露声明
作者没有什么可以披露的。
致谢
我们感谢不列颠哥伦比亚大学Geoffrey Wasteneys教授的种子表达RFP-TUB6,还有一位匿名评审员进行了有用的修正。我们感谢Hugh Dickinson教授提醒我们使用纤维素膜作为机械支持,并向John Baker摄影。这项工作得到BBSRC研究资助BB / G013993 / 1和BB / D004055 / 1对IM的支持,BBSRC博士生培训奖和Clarendon奖学金
材料
| Name | Company | Catalog Number | Comments |
| Perfluorodecalin | F2 Chemicals, F2 Chemicals Ltd., Lea Town, Lancashire, UK | FLUTEC PP6 | |
| Poly(dimethylsiloxane) gum | Carolina Biological Supply; Burlington, NC, USA | Item # 132700 | Carolina Observation Gel |
| Cavity Microscope Slides | VWR International Ltd, Lutterworth, UK | 10118-600 | Cavity is 13 mm diameter and 0.2-0.4 mm in depth. Any cavity slide will probably suffice |
| Cyanoacrylate glue | Loctite | 604753 | Any 'super-glue' suitable for glass will probably suffice |
| Cellulosic cellophane membrane | AA Packaging Limited, Preston, UK | 325P cellulose film; 80 mm disc |
参考文献
- Calder, G., Hindle, C., Chan, J., Shaw, P. An optical imaging chamber for viewing living plant cells and tissues at high resolution for extended periods. Plant Meth. 11, 22 (2015).
- Grossmann, G., et al. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23, 4234-4240 (2011).
- Busch, W., et al. A microfluidic device and computational platform for high throughput live imaging of gene expression. Nat Meth. 9, 1101-1106 (2012).
- Baranenko, V., et al. Solubility of oxygen and carbon dioxide in water. Atomic Energy. 68, 342-346 (1990).
- Sena, G., Frentz, Z., Birnbaum, K. D., Leibler, S. Quantitation of Cellular Dynamics in Growing Arabidopsis Roots with Light Sheet Microscopy. Plos One. 6, (2011).
- Littlejohn, G. R., Gouveia, J. D., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186, 1018-1025 (2010).
- Littlejohn, G. R., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. , (2012).
- Littlejohn, G. R., et al. An update: improvements in imaging perfluorocarbon-mounted plant leaves with implications for studies of plant pathology, physiology, development and cell biology. Front Plant Sci. 5, 140 (2014).
- Dias, A., Freire, M., Coutinho, J. A., Marrucho, I. Solubility of oxygen in liquid perfluorocarbons. Fluid Phase Equilibria. 222, 325-330 (2004).
- Sukumaran, N. P., Quamme, H., Weiser, C. J. Use of Fluid Fluorocarbons to Study Freezing in Plant Tissues. Plant Physiol. 50, 632-634 (1972).
- Firpo, G., Angeli, E., Repetto, L., Valbusa, U. Permeability thickness dependence of polydimethylsiloxane (PDMS) membranes. J Membrane Sci. 481, 1-8 (2015).
- Kirchhelle, C., et al. The Specification of Geometric Edges by a Plant Rab GTPase Is an Essential Cell-Patterning Principle During Organogenesis in Arabidopsis. Dev Cell. 36, 386-400 (2016).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Geldner, N., et al. Rapid, combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59, 169-178 (2009).
- Ambrose, C., Allard, J. F., Cytrynbaum, E. N., Wasteneys, G. O. A CLASP-modulated cell edge barrier mechanism drives cell-wide cortical microtubule organization in Arabidopsis. Nat Commun. 2, 430 (2011).
- Kiss, J. Z., Miller, K. M., Ogden, L. A., Roth, K. K. Phototropism and Gravitropism in Lateral Roots of Arabidopsis. Plant Cell Physiol. 43, 35-43 (2002).
- Gendreau, E., et al. Cellular basis of hypocotyl growth in Arabidopsis thaliana. Plant Physiol. 114, 295-305 (1997).
- von Wangenheim, D., Hauschild, R., Friml, J. Light Sheet Fluorescence Microscopy of Plant Roots Growing on the Surface of a Gel. J. Vis. Exp. (119), e55044 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。