Method Article
根および胚軸発達の長期共焦点イメージングのための単純なチャンバー
要約
ここに提示されているのは、高開口数の対物レンズと浸漬媒体としてのパーフルオロデカリンを使用して、最長3日間の根および胚軸発達の高解像度共焦点経時撮影イメージングのための簡単な技術である。
要約
側根の形態形成などの植物発達のいくつかの局面は、数日の時間間隔で起こる。基礎となる細胞および細胞下の過程を研究するためには、生理学的状態を保存する高分解能経時顕微鏡法が必要である。植物組織は、持続的な気体交換を伴う適切な栄養および水供給を有しなければならないが、カバーガラスの下に沈め固定されると、特に無酸素状態になりやすい。成功裡に採用された1つの戦略は、酸素および栄養分の一定した供給を維持するための灌流システムの使用である。しかしながら、このような構成は、複雑で煩雑であり、特殊な装置を必要とする。浸漬媒体としてペルフルオロデカリンを使用する簡単なイメージングシステムの代替戦略がここに提示されている。このシステムはセットアップが簡単で、最小限の設備を必要とし、顕微鏡ステージに簡単に取り付けることができ、いくつかのイメージングチャンバをセットアップして同等対立遺伝子。このシステムでは、最初の2日間の寒天平板上での標準条件下での側根伸長率と成長率との差異はなく、少なくとももう1日は側根伸長率が低下する。植物組織には、寒天スラブを介して栄養素が供給され、これを用いて一連の薬理学的化合物を投与することもできる。この系は、側根の発達をモニターするために確立されたが、胚軸および一次根のような他の植物器官を画像化するために容易に適応可能である。
概要
植物発達の基礎となる細胞および細胞下の過程を研究するために、高分解能の長期間経過イメージング戦略に対する需要が高まっている。このようなイメージング実験における重要な課題は、十分な気体交換と水および栄養剤の供給を含む生理学的条件の維持である 1,2,3 。最適な光学分解能のために高い開口数を有する対物レンズを利用するためには、試料をカバースリップに近接して平行に配置する必要がある。 x、y、およびz方向の動きは、理想的には、イメージング中に最小でなければならない。
苗はしばしば短期間のイメージングのために水または水溶液中に設置されるが、水はCO 2およびO 2 (20℃、0.1MPaでそれぞれ1.54mg / mLおよび0.04mg / mL)それは長期間の実験には適していません。一定レベルの酸素および栄養素を維持する灌流システムは、この問題の1つの解決策であり、共焦点レーザー走査顕微鏡(CLSM) 1,2,3および光シート顕微鏡(LSM) 5の両方で開発されている。 RootChip 2やRootArray 3のようなシステムは、発達する根の時間経過イメージングのために特別に設計されており、カスタムビルドマルチ検体装置に種子を発芽させることが含まれています。これらの配置は、最小の機械的摂動を保証し、複数の苗の平行分析のために設計されているが、細胞内構造のイメージングには最適化されていない。 Calderらは、検体がメッシュによって所定の位置に保持される細胞下構造の画像化に最適化された、より複雑な灌流ベースの画像化チャンバを設計した高倍率の液浸レンズ1の使用を可能にする。
ここに提示されているのは、灌流システムに基づいていないが、 シロイヌナズナイメージングのためのマウント媒体として最近普及しているペルフルオロカーボンであるペルフルオロデカリン(PFD)を利用する、この問題に対する代替の簡単な解決法である。そのような用途では、CO 2およびO 2 (PFD中のO 2については、水中で0.04mg / mLと比較して1.9g / mL) 9を溶解するためのPFDの高い容量は、浸漬した組織によるガス交換を可能にする。さらに、PFDは非蛍光性であり、その屈折率(1.313)は水(1.333)のそれに匹敵し、空気(1.000)よりもサイトゾルの屈折率(〜1.4)に近い。ペルフルオロカーボンは、様々な植物および植物に最小の生理学的効果を有することが報告されているPFDに沈めたときに容易に発芽し、水を供給したときに少なくとも2日間通常の成長と発育を示す大根種子が6である。 Arabidopsis種子の発芽についても同様の観察がなされている6 。 Littlejohnらは、浸潤後のシロイヌナズナ葉組織におけるPFDの分布を直接的にイメージ化する誘導ラマン散乱に基づいて、PFDが生きた細胞によって取り込まれない可能性が高いと結論している[ 8] 。 PFDは以前は空中組織を画像化するために主に使用されていましたが、表面張力が低いために空中に容易に浸透するため、イメージング深度が大幅に増加します。ここで、PFDは、発生する側方の根の長期共焦点画像化に採用される。この構成では、寒天で固められ、PFDに浸された成長培地のスラブ上に1つ以上の実生を置く。 PFDは、gイメージングチャンバー内での無菌交換、無酸素状態の防止。 PFDは非常に揮発性であるため、高いガス透過性(CO 2に対して1.5×10 -12 pmol m -1 s -1 Pa -1 )も有するポリ(ジメチルシロキサン)ガムのガスケットによって保持される。栄養素と水は、寒天で固めた培地のスラブによって供給される。同時に、この寒天スラブは、カバーグラスに対して根元を静かに押しつけ、イメージングチャンバー内の相対位置を固定し、高解像度水浸レンズを使用することを可能にする。さらに、寒天スラブは、デキサメタゾン、オリザリン、およびイソキサベンを含む、ある範囲の薬理学的処置を施すために使用することができる。イメージングチャンバは、最小限の装置を使用して標準的な顕微鏡スライドから大量に組み立てることができる。イメージングチャンバーは、側方根の発達を研究するために開発され、特徴付けられたが、他の実生の器官、例えば根の先端および胚軸。
プロトコル
1.チャンバーの作成
- ガラスカッターを使用して、厚さ1 mmの顕微鏡スライドの端から3 mm幅のストリップを切断します。シアノアクリレート超接着剤または両面テープを使用して、これらのガラスストリップを第2の顕微鏡スライド( 図1A )の幅にわたって約45mm離して接着します。 1つのチャンバーに1つのスライドが必要です。さらに、寒天スラブを入れるための追加のスライドも必要です(スライド1枚で2〜3寒天スラブが得られます)。スライドを再利用できます。
- ガラスストリップの間に、ガス透過性のポリ(ジメチルシロキサン)ガムから同じ高さのガスケットを成形する。スライド( 図1B )にポリ(ジメチルシロキサン)ガムのボールを置き、少量の100%無水エタノールで第2のスライドを湿らせ、第2のスライドでポリ(ジメチルシロキサン)ガムボールを平らにして高さに達するまでのガラスストリップ( 図1C )。
- 必要ならば、余分なポリ(ダイム剃刀の刃で平らにすることを含む。
- 無水エタノールで湿らせた適切なカッターまたはカミソリの刃を使用して、ポリ(ジメチルシロキサン)ガムの内部を除去し、後で苗木および寒天スラブを保持する空洞を形成する( 図1D )。
- カミソリの刃で丁寧にトリミングして、最終的な肉厚が約2 mmのガスケットを作ります( 図1E )。ポリ(ジメチルシラキサン)障壁を通るガスの透過性は、50μm以上の厚さとは無関係です。
成長培地の寒天凝固スラブの作製
- 2つのガラスストリップを有する顕微鏡スライドガラス上に、ガラスストリップ上に載るようにカバーガラス(22mm×50mm)を配置する。
- ピペットは、1%w / vのスクロースおよび1.5%w / v寒天(1 / 2MS)を含む半強度の半透明のMurashigeおよびSkoog増殖培地を、得られた空間に溶解した後者が完全に満たされるまで(約1mLの全容量)カバースリップの下に置き、寒天がセットされるまで(約5分間)放置する。
注:薬理化合物は、スラブを注ぐ前に液体培地に適切な濃度を加えることによって、寒天スラブを介して投与することができる。これは、デキサメタゾン12 、イソキサベン、2,6-ジクロロベンゾニトリル(DCB)、オリザリン、およびラトランクリンBについて首尾よく試験された。
3 。チャンバーセットアップの終了
- 空気は、少量のPFDをチューブ7内で振盪することによってPFDを平衡させる。少量(約200μL)の空気平衡PFDをゲルパイプのウェルに加えますが、チャンバーを完全に満たさないようにしてください。このPFDは、寒天スラブがチャンバー内に置かれるとき、寒天スラブ下の気泡の捕捉を回避するのに役立つ。
- 寒天スラブからカバースリップを取り除き(上記のステップ2.2)、カミソリの刃を使ってdeの一部を切り取る欲しいサイズと形状。次に、ゲルパイプの井戸に入れます( 図1F )。ガスケットには2〜4 mmの隙間があります。
- 空気平衡PFDでチャンバーを完全に満たしてください。
- PFDに浮遊する子葉と胚軸が吊り下げられた寒天スラブ上に、1つ以上のA. thaliana苗(2〜3日以上の作像には最大3苗)を置く( 図1G )。
- 実生を得るために、種子を70%エタノールで滅菌し、1%スクロースおよび0.8%寒天を補充した1 / 2MS培地上に植え、4℃で2〜4日間層別化し、垂直配向プレート上で22℃、16℃ h光/ 8時間の暗視野。側方の根を画像化するために、画像化チャンバに移す前に植物を7〜10日間増殖させる。
- チャンバーを閉じるには、目的の光学系に合ったカバースリップをガラス顕微鏡スライドガラスの端に軽く押してカバースリップ両方のガラスストリップ上に置かれる( 図1H )。
- 必要に応じて、両端に半分の長さに切断した幅1.25cmの細孔手術用テープのストリップでカバーガラスを固定する( 図1I )。撮像前に試料を約30分間沈降させる。これにより、イメージング中の標本の移動が最小限に抑えられます。
- 成長のために制御された基質を維持するために直立顕微鏡で画像化を行う。 20X / 0.7NAまたは63X / 1.2NA CS2の目標を使用してください。
結果
側根はイメージングチャンバー内で生理的速度で成長する。
( 図2A 、左、ムービー1、n = 23)、成長速度を、同じ寒天固化培地を含有する標準ペトリプレート上で生育させた側根のものと比較した( 図2 2A 、右、映画2、n = 23)。成長率は、根の長さが成長と増殖の領域がますます長くなるために決定要因の1つである、側方の根の間でかなり変化する可能性がある13 。したがって、横方向の根のセットは、画像化チャンバおよび寒天プレートの両方において、異なる初期長さ(50μm〜1150μmの範囲)の根を表すように選択された。実験開始時の平均横根の長さ各セット(439および442μmのイメージングチャンバおよびプレートそれぞれ)において同様であった。分析された27時間の時間間隔で、横方向の根の成長は、イメージングチャンバーおよびプレートの両方において、プレート上で52μm/ h(R 2 = 0.997)およびイメージングチャンバーで51μm/ hの平均成長速度R 2 = 0.993)( 図2B )。プレートとイメージングチャンバー( 図2C )の両方で高度に変動する個々の側根の成長速度は、イメージングチャンバーでは17μm/ hから82μm/ h、プレートでは13μm/ hから87μm/ hの範囲である。成長速度は根の長さと共に一般に増加したが、成長速度は同様の長さの根の間で実質的に変化したが、変動はイメージングチャンバおよびプレートにおいて同様であった。
側根はイメージングチャンバー内で増殖し、hiを用いて画像化することができるgh開口数の目標。
血漿膜マーカーNPSN12-YFP14および微小管マーカーUBQ1 :: mRFP-TUBULIN BETA6(RFP-TUB6) 15を同時発現する側方の根をCLSM10によって1時間間隔で画像化して、画像化チャンバー中の細胞増殖中の微小管挙動を記録した( 図2D 、映画3)。これらのチャンバーでは、外側の根は、x、y、z軸上の位置が非常に安定しており、数時間にわたって連続的な時間経過共焦点スタックを得ることができました。プレプロバースバンド( 図2D 、緑矢印)、有糸分裂スピンドル( 図2D 、白矢印)、および線条体( 図2D 、青矢印)の形成から明らかなように、分裂細胞は連続的に増殖した。ペトリ皿の実生と同様に、イメージングチャンバー内の完全に伸長した根細胞は根毛を開始した( 図2A 、 図2D 、矢頭)。広い視野を提供するために、 図2Dの画像は20x / 0.7NAの対物レンズで得られた。高開口数の63x / 1.2NA水浸対物レンズ( 図2E )を使用して側根の高解像度画像を得ることも可能であった。
側根の成長は、画像化チャンバ内で3日間まで持続する。
イメージングチャンバーが生理的速度で横方向の根の成長をどれくらいの期間サポートできるかを調べるために、イメージングチャンバー(n = 27)およびプレート(n = 33)における側根の長さを0時間、24時間、48時間および72時間で定量した。ルーツ・チョウsenは、0時間で200μmより短く、平均横方向の長さは画像化チャンバで117μm、プレート上では121μmであった。より短い根は平均してよりゆっくりと成長するので( 図2C )、それらは寒天平板の縁部であまり成長せず、画像化が容易であった。最初の48時間で、すべての側根の平均成長は、ペトリプレートと比較して、イメージングチャンバーで有意に異ならなかった( 図3A )。しかし、平均成長は48時間と72時間との間で有意に低下した( 図3A )。成長速度は、48時間後のイメージングチャンバでは一般的に減速すると思われるが、個体間の成長速度は非常に変化し易い( 図3B 、 3C )。これは、プレートおよびチャンバー上で同等の速度で成長する側根の実質的なサブセットが存在することを意味する完全な72時間の成長期間にわたって。成長した33個の側根のうち23個(69.7%)は、72時間(927〜3,163μmの間、 図3B 、赤色)の平均長さの1標準偏差以内の長さに達する。イメージングチャンバー内の横方向の根は、この間隔内の長さに達する( 図3B 、赤色)27のうちの10/27(37.0%)。
イメージングチャンバーは、より古い側方の根、主な根および胚軸に容易に適合させることができる 。
元のイメージングチャンバー設計の限界の1つは、硬い寒天スラブがいくらかの機械的耐性を提供する一方で、重力によって成長する根は最終的に寒天スラブに浸透し、画質の損失をもたらし( 図4B )、高NA比較的長い作動距離(0.3mm)の63X / 1.3 NA CS2対物レンズでさえも、若い側方の根は、それらは最初にイメージングチャンバー( 図2E )でカバースリップと平行に成長した。それらがより長く成長し、コルミラおよび顎石が形成されるにつれて、側根は増加する陽性重力作用を示し、一方、一次根は発芽後に強い重力応答を示す。これは、一次根を画像化することができる期間を数時間に制限し、48時間以上連続して画像化できる側根の開始長さを厳しく制限する。この制限を克服するために、寒天スラブの表面上の浸透障壁として作用するセルロースセロファン膜によって、カバースリップと平行に成長が維持されるように、チャンバーを改変した( 図4A )。 1.5%寒天スラブを用いた最初の試みは、おそらく機械的ストレスのために最初の24時間以内に根の成長を減少させた。スラブ中のより低い寒天濃度を試験した。0.8%の寒天およびセルロースフィルムを含むスラブを有するチャンバーでは、若い側根成長速度は、最初の48時間の従来のチャンバーにおける成長速度と有意に異ならないことが分かった。 0-24時間の間、セルロースチャンバーおよび従来のチャンバーにおける平均根の成長はそれぞれ242μmおよび262μmであり(p = 0.78スチューデントt検定)、24-48時間は330μmおよび355μmであった(p = 0.67スチューデントズt検定); n = 12、n = 11である。この配置は、効果的にカバーグラスから寒天へと横方向の根が成長するのを防ぎ、さらに48時間まで一次根のイメージングを可能にした( 図4C )。
画像化チャンバーが根以外の臓器に適合できるかどうかを試験するために、 シロイヌナズナ胚軸を選択した。胚軸は実質的に根よりも厚いので、従来のイメージングチャンバでは、最上部のcellsはカバースリップに押し付けられ、変形を引き起こした。したがって、中央に楕円形のくぼみを含む空洞スライドを使用して、別の設計が開発された( 図4D )。この構成では、厚さ1mmの寒天スラブ(前記2.2と同様に調製)をスライドキャビティ内に数mm突出した一端に配置した( 図4D )。スライド中の窩の上に胚軸を配置し、根元を水平部分の上に配置した。これにより、苗が根で宇宙に固定されていたが、胚軸は押しつぶされなかった。プレートと比較して、チャンバー内の成長速度は系統的に定量化されなかったが、イメージングチャンバー内の胚軸は、胚軸( 図4E 、 4F ) 16の上方に移動する、十分に記述された縦方向成長の波を示した。

図1 :イメージングチャンバの組み立て。すべての詳細は本文に記載されています。 この図の拡大版を見るには、ここをクリックしてください。
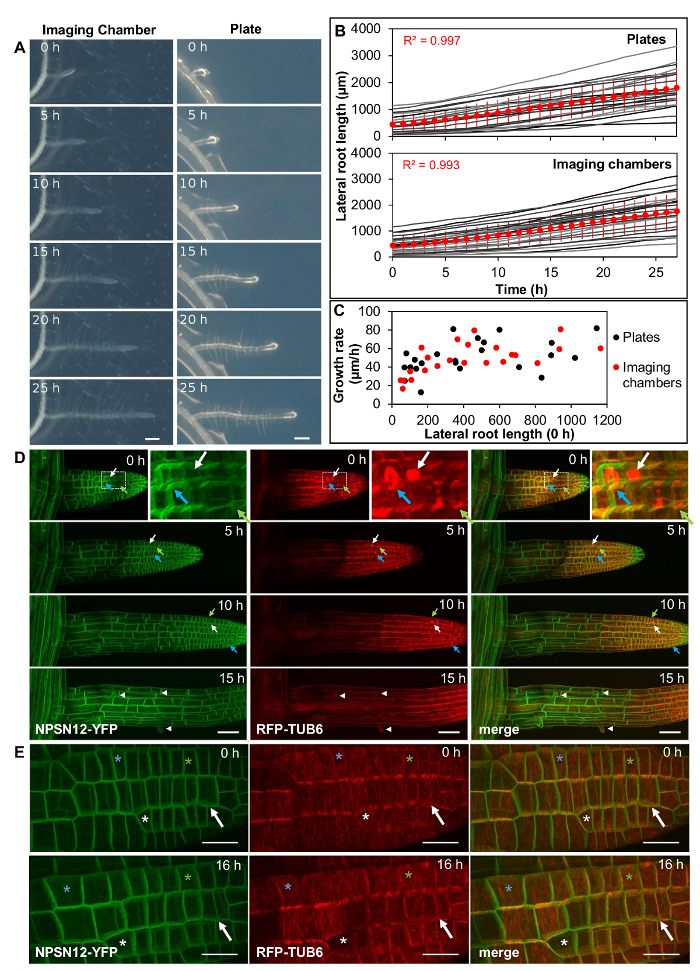
図2 :イメージングチャンバー内の生理的条件下で側根が成長する。 ( A )イメージングチャンバー(左)およびプレート(右)上の25時間にわたるアラビドプシス側根発達(一定光、水平インキュベーション、同時イメージング)。スケールバー=200μm。 ( B )( A )に示すように、側根の長さを27時間(1時間間隔で測定)以上に示すプロット。個別灰色にプロットされた根(プレートおよびイメージングチャンバーについてはn = 23)、赤色の円としての平均長さ。エラーバー= 1SD。赤い線は平均的な長さに線形にフィットします。 ( C )初期長さに対する( B )に示されるすべての側根に対する平均成長率を示すプロット。 ( D )連続する時点でNPSN12-YFPおよびRFP-TUB6を発現する側方の根から得られた3D共焦点スタックの最大強度予測。 Inset:ボックス領域の拡大。緑色の矢印:プレプロファーゼバンド;白い矢印:紡錘体。青い矢印:phragmoplasts; arrowheads:根毛。 ( E )0時間および16時間における63X / 1.2NA対物レンズおよびナイキストサンプリング(ピクセル寸法77nm×77nm)を用いて、( D )に示すトランスジェニックラインの若い側根から得た高解像度画像の最大強度投影。 h;アスタリスクは、各時点で同一の細胞を突き止める。矢印は、0hと16hとの間で分割するセルを示す。スケールバー=50μm(AC)。 20μm(E)。 この図の拡大版を見るには、ここをクリックしてください。

図3 :イメージングチャンバーにおける長期的な側方根の発達。 ( A )プレートと比較して、撮像チャンバー内で3つの連続した24時間間隔で平均絶対根の成長を示すプロット。 nsはp> 0.05を示す。 ***はp <0.001(スチューデントt検定)を示す。 n = 33(プレート)およびn = 27(イメージングチャンバ)。 ( B )(A)で使用したすべての根の連続した時点での側根の長さを示すプロット。赤:プレート上に生育したすべての側根の平均の1SD内の最終長さを有するすべての側根(927〜3163μmの間)。 ( C )最大値72時間を超える連続した時点で取得された側方の根における血漿 - 膜マーカーNPSN12-YFPの代表的な3D共焦点スタックの高密度投影。スケールバー=100μm。 この図の拡大版を見るには、ここをクリックしてください。

図4 :イメージングチャンバーは、他の植物器官に適応させることができます。 ( A - C )主な根のためのイメージングチャンバー適応。 ( A )イメージング・チャンバ設計の概略図。これは、MS培地スラブが1.5%寒天の代わりに0.8%寒天を含有し、寒天と植物の間にセルロースフィルム(赤色)を入れて増殖を防止するという2つの変更点を除いて、標準的なデザイン( 図1 )寒天に加える。 ( B )従来のイメージングにおいて0時間および48時間で撮像された7日齢実生の一次根における血漿膜マーカーNPSN12-YFPの代表的な3D共焦点スタックのXY(上)およびXZ(下)最大強度投影図チャンバー。その根は、その重力応答のために寒天に成長することに注意してください。 ( C )画像化において0時間および48時間で画像化された7日齢実生の一次根における血漿膜マーカーNPSN12-YFPの代表的な3D共焦点スタックのXY(上)およびXZ(下)最大強度投影図セルロースフィルムを有するチャンバー。適用前に、セルロースフィルムを80%エタノール中で滅菌し、液体の1 / 2MS培地に浸漬した。寒天への根の重力による成長が防止されることに留意されたい。 ( D - F )イメージングチャンバーの胚軸への適応。 ( D )胚軸イメージングチャンバー設計を示す概略図。ポリ(ジメチルシロキサン)ガムガスケット(灰色)は、2つのガラスストリップ(黄色)間の空洞スライド上の赤色。 1.5%の寒天平板(ベージュ)をスライド上に置き、部分的に空洞に到達させる。チャンバはPFD(青色)で満たされている。胚軸が寒天の水平部分に置かれている間に、胚軸が空洞内の寒天スラブの下向きの傾斜領域を占めるように、苗を寒天スラブ上に置く。チャンバーをカバースリップで閉じます。 ( E )2日苗の胚軸における、血漿 - 膜マーカーNPSN12-YFPの代表的な3D共焦点スタックの最大強度予測は、連続時間点で48時間以上撮像した。 ( F )(E)に示す胚軸の根底から頂端軸(Eに示す軸に沿って0時間の相対位置)に沿った個々の細胞の2つの連続する時間間隔における縦方向の成長。胚軸16の上に移動する前述の成長波に注意してください。スケールバー=100μm。 この図の拡大版を見るには、ここをクリックしてください。

映画1: この映画をダウンロードするにはここをクリックしてください。
映画2: この映画をダウンロードするにはここをクリックしてください。
映画3:し てくださいこの映画をダウンロードするにはここを舐めてください。
ディスカッション
ここに提示されている方法は、2〜3日間の側方根の発達の高解像度共焦点画像化のための簡単な戦略である。 48時間までの期間、側根発達に対するイメージングシステムの悪影響は観察されなかった。 48時間後、根の実質的なサブセット(37%)はプレート上の平均根の成長に匹敵する速度で成長し続けたが、平均側方根の成長は遅くなった。したがって、十分に多数の根を画像化することにより、48時間後に増殖が遅くなる根を排除することができる。撮像チャンバの体系的検査は、72時間よりも長い時間実施されなかったが、延長された撮像期間が望ましい場合には、代替戦略が推奨される。画像化チャンバは、適切な環境条件が提供された場合、顕微鏡ステージ上に連続的に残されてもよく、または成長施設に移され、定期的に顕微鏡に戻されてもよい。これにより、多数のチャンバが平行に結像されることが可能になる。/ p>
ここに記載されたチャンバの1つの利点は、側方の根がそれらの位置に固定され、高解像度水浸レンズを使用して画像化できることである。空間的安定性は、支持寒天スラブにおいて使用される寒天濃度に決定的に依存する。当初、0.8%寒天から2%寒天の種々の濃度の範囲で試験したところ、この範囲の高濃度は安定して根に固定されていたが、根の成長はより速く減速し、いくつかの根は細胞伸長の減少を含む機械的ストレスの徴候を示した。対照的に、低寒天濃度は、画像化中にx、y、およびzに漂流する必要な支持および根を提供しなかった。最適な1.5%寒天スラブは、有害な機械的影響なしに試験片の位置を固定する。これらの条件下では、最初の30分程度で安定した後、根は数時間にわたって安定し、一晩のデータ取得が可能になる。 4Dデータの取得中、zスタック範囲は典型的にはb追加の5〜10μmの厚さであったが、これは主に、zドリフトまたは揺動ではなく、横方向の根の面外成長に対応するためであった。標準的な寒天濃度は浸透に対する耐性を提供するが、重力によって成長する根は最終的に寒天に浸透する。しかしながら、画像化チャンバーのわずかな変更によって、根の成長はカバースリップと平行に維持され、より古い側方の根および主な根を画像化することが可能になる。さらに、基本イメージングチャンバは、胚軸用に容易にカスタマイズすることができる。このシステムでは胚軸はより自由に浮遊しているので、画像取得のためのz軸ブラケットは通常約20μmに増加した。この研究では、基板の特性を制御することを可能にした直立型顕微鏡を使用した。イメージングチャンバは、倒立型顕微鏡構成に適応可能であってもよいが、断熱臓器に対する硬質カバースリップの時間依存性の影響を評価する必要がある。
Littlejohnらは、PFD自体が生物学的分子を容易に溶解しないことを指摘しており、これは薬理学的化合物の送達のために直接使用することができないことを意味する7 。この問題は、そのような化合物を寒天スラブが載っている固化した増殖培地のスラブを通して供給することによって克服された。灌流システムは、ウォッシュアウト実験のための選択の方法のままであるが、イメージングチャンバは、デキサメタゾン12および他の化合物の投与に首尾よく使用されている。一方、この記事はWagenheimの準備中であり、同僚らは、薄いシート顕微鏡法を用いて側根発達を画像化するためのチャンバーを記載している。
開示事項
著者は何も開示することはない。
謝辞
ブリティッシュ・コロンビア大学のGeoffrey Wasteneys教授に、シードを表現するRFP-TUB6と匿名の校閲者の助けに感謝します。ヒュー・ディキンソン教授には、機械的なサポートとしてのセルロースフィルムの使用と、写真撮影のためのジョン・ベイカーの使用について警告してくれたことに感謝します。この研究は、BBSRCの研究助成金BB / G013993 / 1とBB / D004055 / 1のIM、およびBBSRC博士号訓練賞とClarendon Scholarship of CK
資料
| Name | Company | Catalog Number | Comments |
| Perfluorodecalin | F2 Chemicals, F2 Chemicals Ltd., Lea Town, Lancashire, UK | FLUTEC PP6 | |
| Poly(dimethylsiloxane) gum | Carolina Biological Supply; Burlington, NC, USA | Item # 132700 | Carolina Observation Gel |
| Cavity Microscope Slides | VWR International Ltd, Lutterworth, UK | 10118-600 | Cavity is 13 mm diameter and 0.2-0.4 mm in depth. Any cavity slide will probably suffice |
| Cyanoacrylate glue | Loctite | 604753 | Any 'super-glue' suitable for glass will probably suffice |
| Cellulosic cellophane membrane | AA Packaging Limited, Preston, UK | 325P cellulose film; 80 mm disc |
参考文献
- Calder, G., Hindle, C., Chan, J., Shaw, P. An optical imaging chamber for viewing living plant cells and tissues at high resolution for extended periods. Plant Meth. 11, 22 (2015).
- Grossmann, G., et al. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23, 4234-4240 (2011).
- Busch, W., et al. A microfluidic device and computational platform for high throughput live imaging of gene expression. Nat Meth. 9, 1101-1106 (2012).
- Baranenko, V., et al. Solubility of oxygen and carbon dioxide in water. Atomic Energy. 68, 342-346 (1990).
- Sena, G., Frentz, Z., Birnbaum, K. D., Leibler, S. Quantitation of Cellular Dynamics in Growing Arabidopsis Roots with Light Sheet Microscopy. Plos One. 6, (2011).
- Littlejohn, G. R., Gouveia, J. D., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186, 1018-1025 (2010).
- Littlejohn, G. R., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. , (2012).
- Littlejohn, G. R., et al. An update: improvements in imaging perfluorocarbon-mounted plant leaves with implications for studies of plant pathology, physiology, development and cell biology. Front Plant Sci. 5, 140 (2014).
- Dias, A., Freire, M., Coutinho, J. A., Marrucho, I. Solubility of oxygen in liquid perfluorocarbons. Fluid Phase Equilibria. 222, 325-330 (2004).
- Sukumaran, N. P., Quamme, H., Weiser, C. J. Use of Fluid Fluorocarbons to Study Freezing in Plant Tissues. Plant Physiol. 50, 632-634 (1972).
- Firpo, G., Angeli, E., Repetto, L., Valbusa, U. Permeability thickness dependence of polydimethylsiloxane (PDMS) membranes. J Membrane Sci. 481, 1-8 (2015).
- Kirchhelle, C., et al. The Specification of Geometric Edges by a Plant Rab GTPase Is an Essential Cell-Patterning Principle During Organogenesis in Arabidopsis. Dev Cell. 36, 386-400 (2016).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Geldner, N., et al. Rapid, combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59, 169-178 (2009).
- Ambrose, C., Allard, J. F., Cytrynbaum, E. N., Wasteneys, G. O. A CLASP-modulated cell edge barrier mechanism drives cell-wide cortical microtubule organization in Arabidopsis. Nat Commun. 2, 430 (2011).
- Kiss, J. Z., Miller, K. M., Ogden, L. A., Roth, K. K. Phototropism and Gravitropism in Lateral Roots of Arabidopsis. Plant Cell Physiol. 43, 35-43 (2002).
- Gendreau, E., et al. Cellular basis of hypocotyl growth in Arabidopsis thaliana. Plant Physiol. 114, 295-305 (1997).
- von Wangenheim, D., Hauschild, R., Friml, J. Light Sheet Fluorescence Microscopy of Plant Roots Growing on the Surface of a Gel. J. Vis. Exp. (119), e55044 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved