Method Article
使用体外活体细胞成像技术研究脂纳米粒子化疗
摘要
活细胞成像是可视化动态过程的有力工具。对固定细胞的检查只提供静态的图片, 这可能导致对过程的误解和混淆。本文介绍了一种在活细胞中研究脂质体纳米粒子的吸收、释放和细胞内定位的方法。
摘要
传统的成像技术可以提供有关细胞过程的详细信息。然而, 这些信息是基于静态图像在一个动态系统, 和连续阶段很容易被忽视或误解。活体细胞成像和延时显微镜, 活细胞可以被跟踪几个小时甚至几天, 在一个或多或少连续的时尚, 因此是非常翔实的。本文所述的协议允许对在活细胞中交付阿霉素 (dox) 后化疗纳米微粒的命运进行调查。Dox 是一种插剂, 必须从其 nanocarrier 中释放, 以成为生物活性。尽管其临床注册已有二十多年, 但其摄取、分解和药物释放仍未完全了解。本文探讨的假说, 脂纳米颗粒是由肿瘤细胞, 并逐渐退化。释放的 dox 然后移位到原子核。为了防止固定伪影, 可以应用在实验过程中描述的活细胞成像和延时显微镜。
引言
在生命细胞和组织中, 遵循生物过程的能力, 如细胞间相互作用、和细胞内转运、细胞毒复合吸收和蛋白质-蛋白质相互作用, 在过去十年, 因为它提供了额外的维度 "实时"。本文介绍了一种跟踪游离 dox 和 dox 在纳米颗粒 (dox-NP) 中的胞内命运的方法。
几十年来, 纳米粒子被用于治疗某些癌症。Dox-NP 已经批准治疗艾滋病相关的卡波西肉瘤, 晚期卵巢癌和乳腺癌, 多发性骨髓瘤1。它是第一个在临床环境中开发和引入的脂质体纳米颗粒之一。自由形式, dox, 是从血液循环中大大清除, 限制其能力, 以足够的数量到达肿瘤网站。此外, 治疗伴随着严重的和剂量限制的副作用, 如口腔炎和心力衰竭。当封装成乙二醇脂质体纳米颗粒的循环时间从分钟增加到几天2。这种类型的胆固醇脂质体是相当稳定, 这种稳定性决定了药代动力学的封装药物。
然而, 这种刚性有一个缺点。一个化合物对肿瘤细胞的细胞毒能力首先被评估在体外, 它已经表明, dox 是更有效的比 dox NP 在细胞毒化验3,4。假设载体的稳定性阻止了药物的释放和细胞的摄取, 值得进一步研究这种现象。固有的脂质体属性, 建立到最后的侵略性元素的血液流和达到完整的肿瘤部位, 导致损害生物利用度的细胞毒性成分 (即, dox) 在目标站点 (即,肿瘤细胞核)。虽然 Dox-NP hardily 改善了响应与自由形式相比, 它仍然是临床价值, 因为封装显著减少了心脏效果5。在随后的几年中, 其他化合物被封装在纳米载体中6。另外, 修改载体导致了触发药物释放 (即,在肿瘤部位), 但维持血液循环的稳定性7,8。尽管多年的调查和临床使用, 纳米的肿瘤的命运, 如 Dox NP 仍然不完全清楚。在最近的一份出版物中, 人们发现纳米粒子被作为一个整体被占了, 而 dox 仍然被困在溶酶体9中。
细胞摄取纳米微粒和药物释放是动态过程, 可以最好地使用活细胞成像监测。此外, 传统的组织学, 其中细胞孵育, 然后固定, 可以给假结果, 如果固定破坏脂质体载体和引进文物。对活细胞成像的主要要求是可视化, 最好是通过荧光, 所需的过程。某些化合物, 如 dox, 有一个固有的红色荧光。此外, 荧光标记可以引入到载体, 和细胞器可以可视化使用活细胞标记。这样, 就可以对载体的摄取、药物释放和细胞定位等一系列参数进行成像和分析。在这一方法中, dox 和 dox 在几个肿瘤细胞中的细胞间的命运在 real-time。此外, 这种方法可以很容易地适应创造理想的条件为目标 (例如,带电纳米粒子10) 和触发 (如,热疗7) 药物释放。
研究方案
1. 准备
- 组装成像室, 由两部分组成.
- 将 25 mm 盖玻璃 ( 图 1A -1) 置于会议厅底部 ( 图 1A -2), 并将顶部螺钉插入底部部分 ( 图 1A -3)。不要绷得太紧, 因为玻璃会折断。高压釜整个会议厅 ( 图 1A -4).
- 在不育条件下, 通过补充 Dulbecco 和 #39、s 修饰的鹰和 #39 培养基 (DMEM)、无酚红、10% 热灭活胎小牛血清 (FCS) 和1毫米 l-谷氨酰胺制备细胞培养基。存储在4和 #176; c 和温暖到37和 #176; c 之前使用.
- 使用标准细胞培养技术在培养烧瓶中维护细胞培养基.
注: 在这里, 两个鼠标细胞线, 黑色素瘤 B16BL6 11 和刘易斯肺癌 (LLC), 和两个人类黑色素癌, 土地管理局和 1F6 12 , 使用. - 在37和 #176 的磷酸盐缓冲盐水 (PBS) 中, 通过称量和溶解明胶来制作0.1% 明胶, 过夜。通过过滤 0.22 #181; m 过滤器, 并将其存储在4和 #176; C.
2。平板电池
- 从层流柜中的灭菌袋中取出成像室, 仔细地拧紧腔, 并将其放入培养皿中.
注意: 为了避免污染, 将成像室保持在培养皿中, 直到将腔置于显微镜下. - 用1毫升0.1% 无菌明胶在成像室的玻璃上涂上20分钟37和 #176; C 和 5% CO 2 .
注意: 这将允许更好的单元格连接. - 从细胞培养烧瓶中取出培养基 (见步骤1.2 和 1.3), 用 1x PBS 冲洗一次, 然后用0.25% 胰蛋白酶分离细胞。通过添加细胞培养基, 收集细胞, 在 1100 x g 处旋转5分钟, 并在5毫升的细胞培养基中重颗粒, 使胰蛋白酶钝化.
- 稀释20和 #181; 20 和 #181 的细胞悬液 l; 台盼蓝 (将被死细胞所占用)。使用例计算活细胞和死体细胞的数量;死细胞的数量不应超过 10%.
- 吸出明胶并将细胞稀释, 使其在24小时内达到70% 的最大覆盖率。例如, 在 10 mL 中使用 5 x 10 4 或 10 x 4 1 单元格的稀释。允许单元格在 5% CO 2 和37和 #176 上粘附; C 为 24 h.
3。时间推移显微镜 ( 图 2 )
注意: 在这里, 使用了一个 custom-made 阶段持有人共焦显微镜, 虽然大多数制造商提供了一系列的活体细胞成像的孵化器是也适用于调查 nanoparticulated 药物的传递.
- 对显微镜下的细胞进行70-100、细胞形态学和污染的评估。将会议厅放回 CO 2 孵化器中.
注: 70-100 不应超过70%。如果细胞形态学不一致 ( 即, 细胞不粘附) 或污染被检测到, 丢弃成像室. - 在共焦显微镜上切换 ( 图 1E -1)、荧光灯 ( 图 1E -2) 和计算机 ( 图 1E -3).
- 将镜头加热器连接到目标并将其设置为35和 #176; C ( 图 1E -4 + 插入)
- 准备孵化单元, 如下所示 图 1B .
注意: 本单元由一个加热阶段 ( 图 1B -1) 组成, 一个流阶段具有 co 2 管 ( 图 1B -2) 和 co 2 探测器 ( 图1B-3) 和一个红色的结束补丁 ( 图 1B -4)。此修补程序用于临时关闭设备, 直到成像室被放置. - 将孵化单元置于显微镜阶段并连接 in-and 出 CO 2 管 ( 图 1E -5)。打开主 co 2 阀 ( 图 1E -6), 并在 co 2 控制器 ( 图 1E -7) 上切换。检查控制器是否设置为 5% CO 2 .
注意: 对于湿度, CO 2 经过一个加湿器 ( 图 1E -8)。对于低氧实验, 设置中包括一个单独的 O 2 稳压器 ( 图 1E -9)。 - 将舞台温度设置为37和 #176; C ( 图 1E -10)。对于热疗实验, 将温度设置为42和 #176; c. 允许孵化单元达到选定的温度和 CO 2 百分比.
- 从主 CO 的成像室 2 孵化器, 并将培养皿中的腔室传送到显微镜室.
- 将成像室 ( 图 1A -4) 置于 custom-made、35毫米直径的舞台托架 ( 图 1A -5) 中, 并将 custom-made 密封盖 (图 1A -6).
注: 盖子允许 CO 2 通过和防止蒸发和污染。- 打开孵化单元, 用成像室替换红色补丁, 然后关闭设备 ( 图 1C )。尽可能快地做到这一点, 以防止冷却的细胞。确保没有电缆停留在舞台和显微镜之间.
- 将设备保持为适应30分钟.
- 打开软件并在激光器上切换.
注: 在这里, 488 nm 氩, 543 nm 氦氖, 和 633 nm 氦氖激光器使用. - 通过单击和 #34 建立新的数据库; 新建和 #34; 在 "文件" 选项卡下命名并保存数据库.
- 在 "获取" 选项卡下, 单击 "#34; 配置和 #34; 选择和 #34; 通道模式和 #34; 和 #34; 单声道和 #34; 评估单个荧光或 #34; 多轨 #34; 多个荧光。选择与荧光匹配的适当带通滤波器 ( 例如, 560 到 615 nm 带通滤波器, 用于 dox 和 dox-NP; 请参见代表结果以了解更多示例)。在其中一个轨道中选择亮场通道.
- 通过单击和 #34 来设置扫描控件; 扫描和 #34; 在 "获取" 选项卡下. 通过单击和 #34 设置帧大小 (1024 x 1024)、扫描速度 (最佳)、扫描方向 (8 位、单) 和扫描平均值 (4); 模式 #34; 设置针孔 (200 和 #181; m), 增益和偏移 ( 例如, 580、700和 835;请参见 图 3 ) 和激光电源 (488 = 10%, 543 = 100%, 633 = 100%), 通过单击和 #34; 通道. #34;
- 通过单击 "#34; Config 和 #34; 在" 配置 "选项卡中保存这些设置, 并将它们保存在配置数据库中.
- 在 "宏" 选项卡中, 通过单击和 #34 设置延时; 多时间 X 和 #34; ( 图 1D ). 单击并 #34; 单位置和 #34;.
- 若要使单元格处于焦点, 请单击并 #34, 在宏中选择自动焦点; 自动对焦. #34;
注: 自动对焦是用633纳米激光器的反射玻璃作为参考点来实现的. - 通过单击和 #34 来应用保存的配置; 单轨道和 #34; 或 #34; 多轨, #34; 滚动到配置数据库中所需的配置, 设置时间间隔 ( 例如 , 15 分钟), 扫描次数 (, 例如 , 97) 和单击并 #34; 加载配置. 和 #34;
注意: 使用这些设置, 将进行 97 x 15 min = 24 h 的时间序列. - 在 #34 中命名延时; 基本文件名和 #34; 并通过单击和 #34 来选择数据库 (在步骤3.11 中进行); 图像数据基和 #34; 以节省延时。通过单击 "#34; Tmp 图像文件夹. #34;
注意: 如果由于某种原因系统停止或崩溃, 则图像位于该文件夹中. - 打开孵化单元, 提起成像环, 向目标添加一滴浸入式油, 并尽可能快地关闭单位。聚焦并在成像室中选择一个位置.
注意: 这个位置包含单层细胞, 至少有 70% 70-100, 允许对单个细胞进行成像. - 检查背景的配置设置并在必要时进行更正.
注意: 可以通过减少增益或激光功率来纠正背景。配置中的任何更改都需要保存 (请参见步骤 3.17) 并在宏中再次加载 (请参见步骤 3.18). - 在层流柜中, 在浓度为5和 #181 时稀释游离药物或纳米颗粒; g/毫升药物或0.05 和 #181; 细胞培养基中的脂类。通过 0.22-#181; m 注射器过滤如果药物/纳米颗粒不是无菌.
- 打开孵化室, 提起密封盖, 从细胞中取出培养基, 加入1毫升稀释药物/纳米颗粒, 并尽可能快地关闭该单位.
- 将焦点放在单元格上, 然后通过单击和 #34 启动延时; 开始时间和 #34; 在多时间 X 宏中.
- 定期检查以查看单元格是否仍处于焦点或使用自动对焦 (请参见步骤 3.16)。该程序自动保存在数据库中的延时;在程序运行时不要关闭数据库.
4。数据分析
- 根据原始研究问题, 使用软件程序 (如 ImageJ 进行数据分析) (请参见 结果 部分).
结果
标记脂质体载体与不同的标记以前被描述了9。带有远红 dioctadecyl tetramethylindotricarbocyanine 高氯酸盐的载体 (没有;Ex = 644 nm;Em = 665 nm) 或绿色 12-油-sn-磷脂-3-乙醇-n-(羧基) (CF PE;Ex = 490 nm;Em = 515 nm) 是在这份手稿中提出。为了显示细胞间的相似性和不同的脂质体吸收, 释放和细胞内定位, 研究了几种肿瘤类型。这些包括两个鼠标线, B16BL6 黑色素瘤11和刘易斯肺癌 (LLC), 和两个人黑色素癌, 高度转移 (土地管理局) 和转移 (1F6) 黑色素瘤12,13。所有的实验都是用活细胞进行的。在所有的实验中, 5 µg/毫升 dox, 5 µg/毫升 dox-NP, 或0.05 µmol 纳米颗粒的浓度为3或 24 h. 测量和分析 dox (在自由, 释放, 封装, 螯合, 或夹层形式) 被称为 DXR。40X (数值孔径: 1.3) 使用了油物镜, 成像采用 488 nm 氩激光 (10%/0.2 兆瓦功率) 和505至 550 nm 带通滤波器进行 CF PE 和溶酶体标记 (LM)-绿色。543 nm 氦氖激光器 (100%/0.2 兆瓦功率) 和560到 615 nm 带通滤波器用于 dox, dox NP, 和溶酶体标记红。633 nm 氦氖激光器 (100%/0.5 兆瓦功率) 和 640 nm long-pass 过滤器用于做。
由于其封装,体外dox 的细胞毒性、生物利用度和药代动力学显著改变了3、9、14。在图 3中演示了以自由和封装形式管理药物的生物利用度的差异。Dox 是一种插剂, 必须进入细胞核才能成为细胞毒。图 3和相关的电影1和2显示了在相同条件下用 dox 或 dox NP 处理的一个 3 h 时移。在 dox 曝光的几分钟内, 可以观察到核 DXR (图 3A, 电影 1), 并使用较低的增益 (插入), 可以看到插在原子核。相比之下, 当暴露在 Dox-NP, 细胞内 DXR 是很难看到在此时限 (图 3B, 电影 2)。只有增加光电倍增管的增益, 才能观察到细胞质中的 DXR (插入)。利用 ImageJ, 分析了细胞质和核 DXR 的像素密度。当细胞在时间推移评估中运动时, 把荧光与明亮的图像结合起来是很重要的。这提出了在 ImageJ 中使用特定插件跟踪单个细胞和稳定 XY 漂移的可能性。在图 3中提供的分析中, 使用明亮场图像绘制了细胞质 (实线) 和核 (虚线) 周围的感兴趣区域 (ROI)。ImageJ 中的 roi 管理器可以在菜单项分析和 #62 中找到; 工具和 #62; roi 管理器。这些 roi 用于荧光图像中, 通过使用菜单项分析和 #62 来分析像素密度; 测量。dox 或 dox NP 处理后的细胞核 (图 3C) 和细胞质 (图 3D) 中的像素密度之间的差异证实了图像中所看到的内容。此外, 细胞孵育 24 h 与 dox 或 dox NP, 在此之后, 该化合物被取代的介质和立即成像增加灵敏度的光电倍增管增益 (图 4)。其他设置 (如激光电源、偏移、针孔和图像显示) 是相同的。Dox-NP 处理的低 DXR 信号与 Dox 处理后的细胞相比是惊人的。使用增益为 700, DXR 在 Dox-NP 处理细胞变得可见, 而 Dox 的图像已经过度曝光。这个简单的体外实验表明, 自由与封装药物的生物利用度有显著差异。
当单元格连续暴露于 24 h Dox NP 时, DXR 会随着时间的推移而累积, 如图 5A和电影3和4所示。信号在细胞质中增加, 后来, DXR 也在细胞核中被发现。这些观测得到了像素密度图 (图 5B) 的确认。与1F6 细胞相比, 由于细胞内分布的不同, 其细胞质中的像素密度相对较低。而在1F6 细胞中的 DXR 分布在整个细胞中, DXR 细胞更集中于靠近细胞核的器官 (图 5C)。
因此, 对药物和载体在不同细胞系中的定位 (图 6) 进行了研究。细胞孵育 24 h 与 Dox-NP/做和成像。利用光场图像, 在三种不同细胞系的荧光图像中绘制了细胞膜 (实线) 和核 (虚线) 的叠加。它在这里被证明, 被标记的载体, 跟随与 DXR 一样的细胞质模式: 集中在一个细胞器官接近细胞核在土地管理局, 在整个核在 LLC, 并且随机地分散在细胞质中在 B16BL6。在原子核中, 只有 DXR 和 no 能被看到, 表明释放 dox。通过减少光电倍增管的增益, 可以看到含有 DXR 和载体的单个细胞泡, 加上标签, 以及 CF PE (图 6B和6C)。
胞质 DXR 固在小泡中, 细胞以绿或红的活细胞溶酶体标记标记。这些溶酶体的运动可以在细胞中被跟随 (电影 5)。细胞质 DXR 和 nanocarrier colocalize 在这些结构中, 以及 DXR 模式中的胞间差异, 如图 6所示, 在这里解释。溶酶体是随机分布在整个细胞质中的 B16BL6 和位于旁边的细胞核在土地管理局细胞 (图 7A)。使用 ImageJ, 计算了溶中 DXR 和载波之间的定位 (图 7B)。彩色图像被制成二进制 (过程和 #62; 二进制和 #62; 二进制), 并使用定位插件 (分析和 #62; 定位), 定位的图像是由 DXR 做的。这将创建一个绿色-红色-白色的彩色图像, 白色像素表示两个图像的 colocalized 像素。通过菜单项过程和 #62; 二进制和 #62; 使二进制, 白像素将被分离和转换成黑色像素, 从它的像素密度测量 (分析和 #62; 测量)。此后, 在该 DXR 图像与溶酶体标记 (LM) 的二值图像和测量的像素密度之间进行了定位图像。定位数据是 DXR 和 DXR/溶酶体标记 (图 7C) 的像素百分比。以 CF PE 标记的载体和所做的一样, 位于溶中, 也显示在图 7D中。

图 1: 仪器和设备设置.A) 成像室 + 必需品。25毫米 #1 盖子玻璃 (1), 房间的底部 (2), 顶部部分的房间 (地方d 倒置) 和 O 形环 (3), 舞台保持器 (4), 密封盖 (5)。标尺: 2 厘米 B) 孵化单位。加热显微镜阶段 (1), 流动阶段与 in-and 出为 co2 (2)、co2探针 (3) 和闭合的补丁 (4)。刻度条: 2 厘米 C) 在孵化室中的成像腔, 如显微镜下所示。D) 多时间序列宏。E) 成像设备。倒置显微镜 (1), 萤光灯 (2), 电脑 (3), 环形加热器 (4、插入) 和控制器 (4、主图 )、co2流管 (5)、co2阀 (6)、co 2 控制器 (7)、co 2 加湿器 (8)、O 2 阀和控制器 (9) 和舞台温度控制器 (10)。请单击此处查看此图的较大版本.
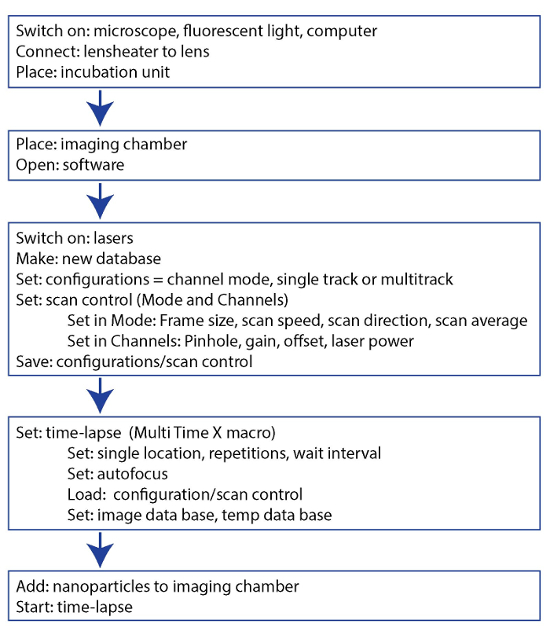
图 2:协议3节详细说明的显微镜参数示意图.请单击此处查看此图的较大版本.
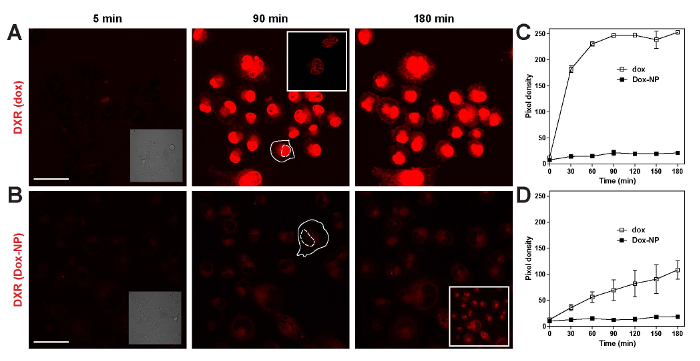
图 3: 调查 dox 和 dox 的短期摄取量。 在3小时内, dox 或 dox 连续暴露于细胞中, 并采取了延时。(A) 仍然是 dox 的细胞的延时的图片。(B) 仍然是 Dox 的细胞的延时的图片。缩放条 = 50 µm. (C) dox 和 dox-NP 处理细胞中核 DXR 的像素密度增加。(D) dox 和 dox-NP 处理细胞中细胞质 DXR 的像素密度增加。数据代表每场3细胞的平均± SD。请单击此处查看此图的较大版本.
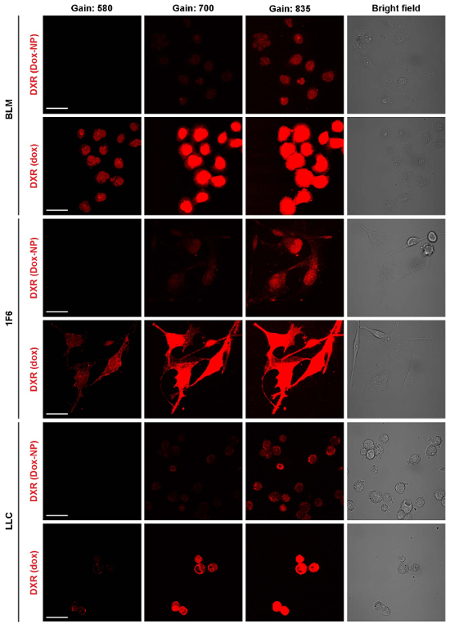
图 4: 调查 dox 和 dox 在不同细胞系中的长期摄取情况.细胞被暴露在 dox 或 dox NP, 并成像24小时后。在药物清除后立即采取了图像, 有3种不同的收获。缩放栏 = 50 µm.请单击此处查看此图的较大版本.
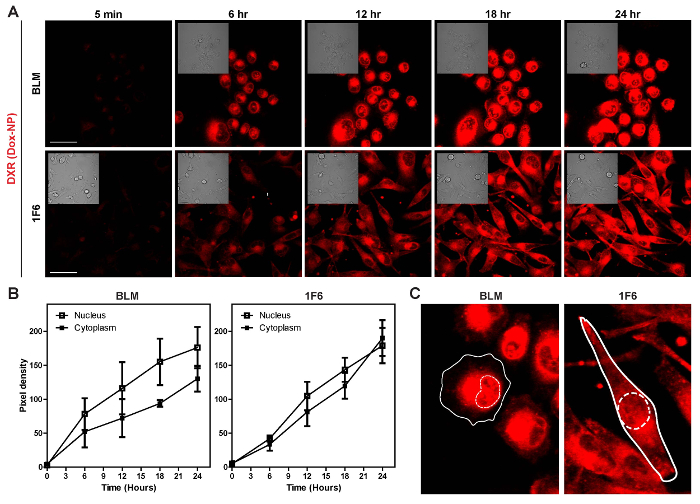
图 5: 研究脂质体剂的细胞摄取和释放.细胞连续暴露于 Dox-NP 24 小时, 并进行了延时。(A) 仍然是延时的图片。缩放条 = 50 µm (B) 像素密度在细胞核和细胞质中增加 DXR。数据代表每场3细胞的平均± SD。(C) 图像, 演示 DXR 在单元格内的本地化。实心线: 细胞膜, 虚线: 核。请单击此处查看此图的较大版本.
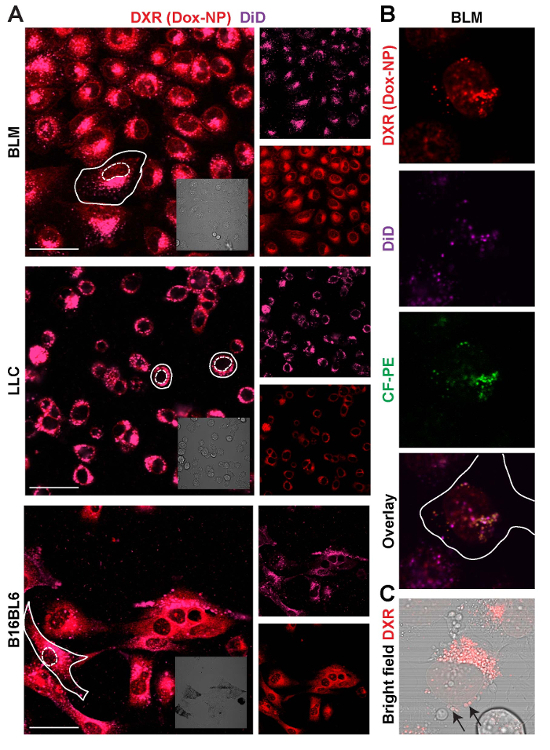
图 6: 调查药物和载体在不同细胞系中的定位.(A) 细胞暴露于 Dox-NP/24 小时, 并成像。缩放条 = 50 µm. (B) 细胞暴露在 Dox-NP/做/CF PE 24 小时, 并以较低的强度增益, 以区分个别小泡。(C) 亮场和 DXR 叠加, 显示 DXR 胞浆囊泡 (箭头)。请单击此处查看此图的较大版本.
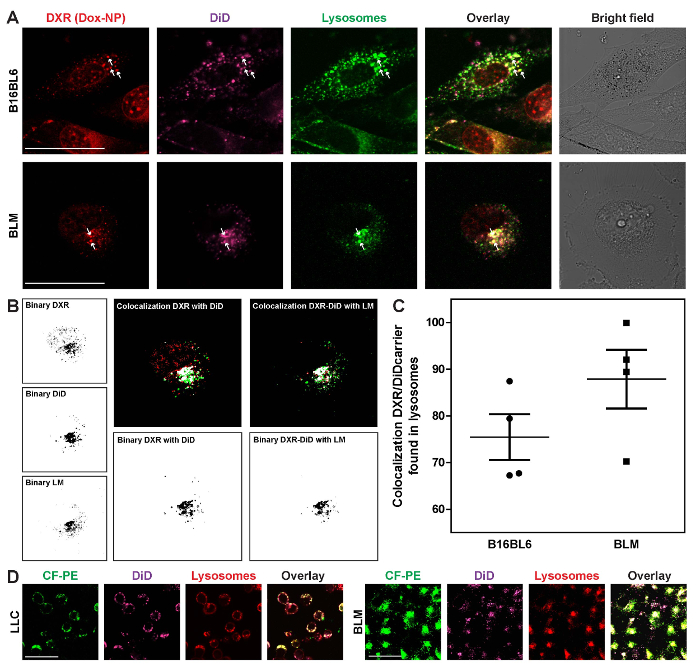
图 7: 调查药物和载体的细胞内定位.细胞暴露在 Dox-NP/做或 CF PE/做了24小时, 和溶酶体是可视化使用活细胞溶酶体标记 (LM) 在绿色或红色。(A) DXR 和载体的细胞内定位。箭头代表了 3 DXR 的例子, 并在溶中进行了本地化。缩放条 = 50 µm. (B) 使用 ImageJ 的溶酶体 (LM) 中 DXR 和载体的 Co 定位分析。(C) 共存的 DXR 和载体在溶酶体中的百分比。这些数据代表了3个个体实验的平均± SEM。(D) 用两种不同的标记来可视化载体的溶酶体的封存。缩放栏 = 50 µm.请单击此处查看此图的较大版本.
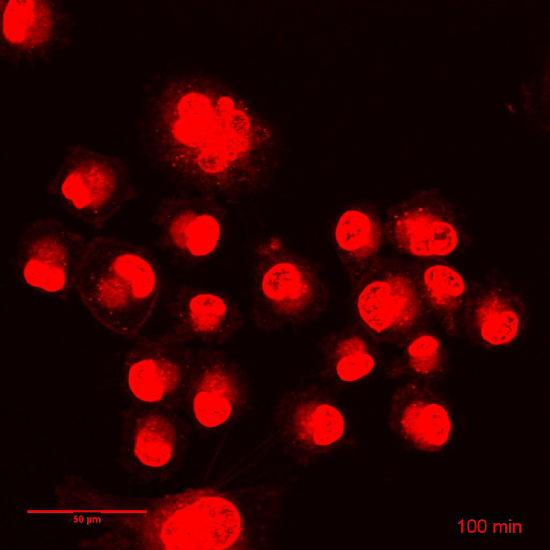
影片 1: 相关图 3:dox 细胞孵育3小时.延时:19 图像, 间隔10分钟帧速率: 3 fps。缩放栏 = 50 µm.请单击此处查看此视频。(右键单击可下载.
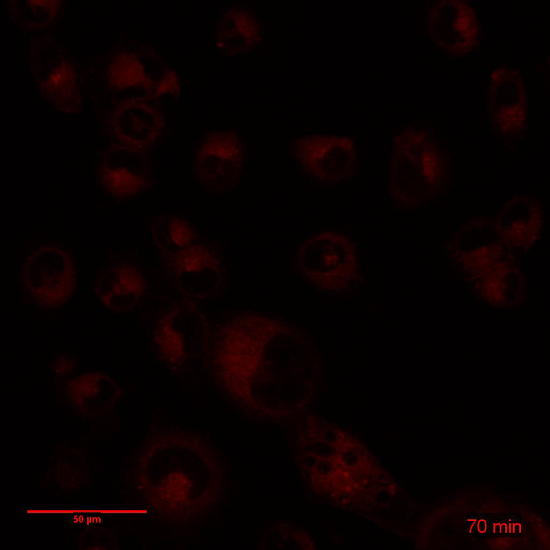
影片 2: 相关图 3:Dox 细胞培养 3 h.延时:19 图像, 间隔10分钟帧速率: 3 fps。缩放栏 = 50 µm.请单击此处查看此视频。(右键单击可下载.
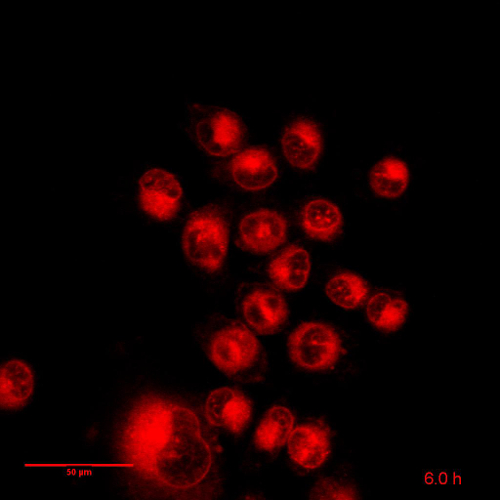
影片 3: 相关图 5:Dox 细胞培养 24 h.延时:96 图像, 间隔15分钟帧速率: 8 fps。缩放条 = 50 µm。> 请点击这里查看此视频。(右键单击可下载。
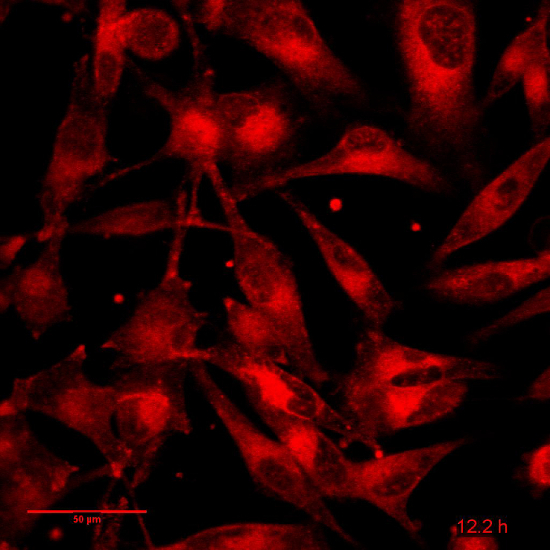
影片 4: 相关图 5: 1F6 细胞 Dox 24 h.延时:96 图像, 间隔15分钟帧速率: 8 fps。缩放栏 = 50 µm.请单击此处查看此视频。(右键单击可下载.
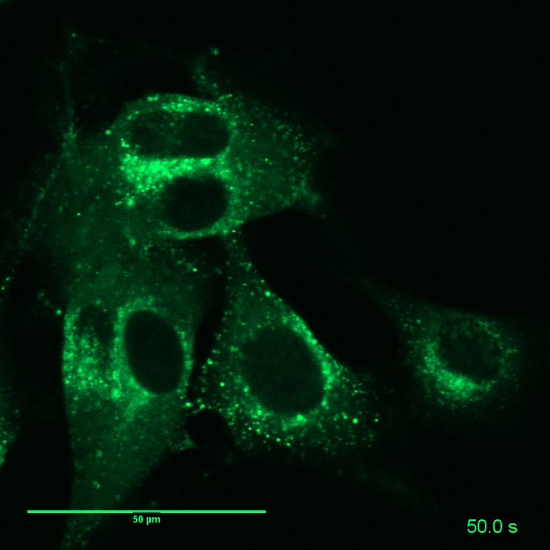
影片 5: 相关图 7:B16BL6 细胞的溶酶体用活细胞标记染色.时间流逝:10 图像, 间隔十年代. 帧率: 3fps。缩放栏 = 50 µm.请单击此处查看此视频。(右键单击可下载.
讨论
正如以往观察到的, 固定可以破坏脂质体纳米几乎立即和 DXR 释放形式这些被破坏的脂类还有时间进入细胞核, 使解释数据非常困难, 甚至误导。通过一些细微的调整, 可以对活细胞和组织中的化疗命运进行例行调查, 以确认或推翻组织学观察。最近的一篇论文显示了 DXR 的摄取, 释放和定位的细胞在自由和封装 dox 使用活细胞延时成像9。这项工作更详细地描述了实验设置。使用这个模型, 可以直观地将 dox 的直接传输到细胞核, 在那里它不断累积直到细胞最终死亡。相反, 当使用 Dox 时, 只有少量的释放的 Dox 在原子核中被发现。虽然连续的曝光结果在连续的 DXR 积累, 荧光信号是低得多的 Dox-NP-与 Dox 处理的细胞, 表明在细胞浓度和随后细胞毒性的差异。此外, 通过使用活细胞标记, 它表明, 当暴露细胞到 Dox-NP, DXR 和 nanocarrier 位于溶。这表明, 完整的脂质体是由细胞, 并表明参与的吞通路在吸收这些纳米颗粒。原子核中的 DXR 显然是从 dox 释放出来的。然而, 使用这种方法, 无论是 DXR 和载体 co-localize, 似乎是在溶酶体, 它仍然是不确定是否封装或释放 dox。纳米粒子的内在稳定性可能在溶的局部化时防止 dox 释放。
在这个协议中, 活细胞成像是使用一个具体的显微镜设置, 与一个 custom-made 阶段持有人 (规格可以根据要求提供)。然而, 大多数共焦显微镜制造提供了一系列的孵化器, 执行活细胞成像。保留细胞培养条件 (即,温度, CO2, pH 值, 湿度和不育) 是这些孵化器的主要标准, 需要进行一些初步测试以确定适当的条件, 这是进一步的解释。自动化的数据采集程序也可以由相同的制造商提供。"多位置" 选项使在同一腔室中有多个位置的图像成为可能, 从而细化统计分析。但是, 这个在这个手稿中提到的宏的选择需要固定的 XYZ 位置, 其中的可能性, 纠正 Z 漂移丢失。扫描 Z 维度可以包含在此宏中, 并使用焦点平面进行分析。然而, 这需要额外的扫描, 增加了光和漂白的可能性。
与所有的荧光测量一样, 过度曝光是一个问题, 特别是当比较两个化合物与不同的细胞摄取量。荧光强度不仅依赖于化合物的固有信号, 而且还取决于吸收率、浓度和药物暴露时间。如图3所示, dox 处理过的细胞的核 DXR 含量已经可见, 而在 dox-NP 处理的细胞中没有发现信号。只有增加增益才能使 Dox-NP 处理细胞的 DXR 可视化, 导致 Dox 处理细胞过度暴露。此外, 即使细胞, Dox-NP 异分布, 这可能导致不可避免的或过度曝光。特别是在研究细胞 DXR 诱捕时, 增益明显降低, 以区分个体化器 (图 5B和5C)。因此, 以像素密度表示的测量必须伴随有代表性的图像, 以便正确解释结果。
光、漂白和低信噪比也是荧光显微镜中的重要问题, 必须建立图像质量与图像采集之间的折衷关系。然而, 即使在显微镜设置是最佳的, 图像质量也很大程度上取决于质量的细胞和增加的化合物。DXR 提供了一个强烈的信号, 并采取适当的预防措施, 漂白是没有观察到, 即使在较长的时期 (高达72小时)。然而, 荧光信号的减少也可能是外排的结果。外排是一个重要的现象, 在耐药性15和发生时, 细胞泵出药物从细胞内的行动场所。因此, 随着时间的推移, 荧光信号的减少也可能是 dox 射流9的结果。将实验结束时的 non-scanned 位置的荧光信号与延时序列中的最后一个图像进行比较, 将显示漂白 (即,信号在 non-scanned 位置更高) 或流出 (即信号将是相同的)。一些矫正选项 (例如,背景, 漂移, 漂白,等) 可在 ImageJ16等程序中使用。此外, 随着时间的推移, 荧光强度的增加, 配置设置可以 pre-evaluated 在一个试点试验, 以尽量减少过度暴露在结束时的延时 (步骤 3.21)。另外, 一个成像室与细胞已经暴露在药物为所需的期限可以用来初始化设置。最后, 对于这种类型的分析, 有毒药物浓度 (步骤 3.22) 应避免和预先设定使用传统的生物化验。
细胞在不含酚红的培养基中连续培养和维持。酚红荧光在红色部分的频谱, 可以观察到细胞器, 最有可能的溶酶体, 呈现假阳性信息 (步骤 1.2)。为了允许对单个细胞进行监测, 细胞融合不应超过 70% (步骤 3.1)。CO2流速 (步骤 3.5) 需要在设备购买或维修后的验证试验中进行调整。当速度太高时, 介质会蒸发。当速度过低时, 培养基的 pH 值会增加, 这会影响细胞的生长。由于培养基是没有酚红色 ph 值指标的变化不能被观察到, 因此很容易被忽视。在验证 CO2流后, 这些设置可用于所有未来的实验。
使用这里描述的方法, 纳米粒子的命运可以很容易地用活细胞成像和延时显微镜来研究。在这个过程中, 使用了商业上可用的纳米粒子。然而, 热敏性的命运17, 阳离子脂质体10;脂质体富含链 shingolipids18;和纳米粒子封装其他药物8,19也以这种方式在肿瘤和正常细胞中进行了调查。
披露声明
作者没有什么可透露的。
致谢
使用的显微镜设施是伊兹斯光学成像中心的一部分, 我们要感谢伊斯兰会议组织工作人员的服务。
材料
| Name | Company | Catalog Number | Comments |
| DMEM (no phenol-red) | Sigma | D1145 | Supplemented with 1 mM L-glutamine and 10 % FCS |
| Trypsin-versene (EDTA) | Lonza | BE17-161E | |
| Fetal calf serum | Sigma | F7524 | Heat inactivate for 30 min at 55 ºC |
| L-Glutamin | Lonza | BE17-605E | |
| Gelatin from bovine skin | Sigma | G9391 | Make a 0,1% solution in PBS, sterile |
| Phosphate buffered saline (PBS) | Sigma | D8537 | |
| Stericup 0,22 µm filter - 500 ml | Millipore | SCGPU05RE | |
| Trypan-blue | Sigma | T8154 | |
| Cells: Lewis lung carcimoma | ATCC | CRL-1642 | |
| Cells: B16BL6 | Dr. P. Brouckaert, Ghent University | donated | Ref.10 |
| Cells: BLM and 1F6 | Dr. van Muijen, University of Nijmegen | donated | Ref.11 |
| Petri dish | Greiner | 664160 | |
| Doxorubicin | Actavis | mentioned as dox in the manuscript | |
| Doxil/Caelyx | Janssen-Cilag | mentioned as Dox-NP in the manuscript | |
| Syringe filter 0.2 µm | VWR international | 10462200 | |
| Lysotracker-green DND-26 | Invitrogen | L7526 | mentioned as lyosomal marker (LM)-green in manuscript |
| Lysotracker-red DND-99 | Invitrogen | L7528 | mentioned as lyosomal marker (LM)-red in manuscript |
| Attofluor cell ring | Invitrogen | A7816 | |
| Cover glass 25 mm #1 | Thermo scientific | CB00250RA1 | |
| Stage holder + sealing lid | Custom made | ||
| ZEISS LSM 510 microscope | Zeiss | ||
| Software LSM 510 version 3.2 SP2 | Zeiss | ||
| Image J | NIH | https://imagej.nih.gov/ij/index.html |
参考文献
- Duggan, S. T., Keating, G. M. Pegylated liposomal doxorubicin: a review of its use in metastatic breast cancer, ovarian cancer, multiple myeloma and AIDS-related Kaposi's sarcoma. Drugs. 71 (18), 2531-2558 (2011).
- Gabizon, A., et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res. 54 (4), 987-992 (1994).
- Ten Hagen, T. L., et al. Low-dose tumor necrosis factor-alpha augments antitumor activity of stealth liposomal doxorubicin (DOXIL) in soft tissue sarcoma-bearing rats. Int J Cancer. 87, 829-837 (2000).
- Hoving, S., Seynhaeve, A. L., van Tiel, S. T., Eggermont, A. M., Ten Hagen, T. L. Addition of low-dose tumor necrosis factor-alpha to systemic treatment with STEALTH liposomal doxorubicin (Doxil) improved anti-tumor activity in osteosarcoma-bearing rats. Anticancer Drugs. 16 (6), 667-674 (2005).
- Gabizon, A. A., Lyass, O., Berry, G. J., Wildgust, M. Cardiac safety of pegylated liposomal doxorubicin (Doxil/Caelyx) demonstrated by endomyocardial biopsy in patients with advanced malignancies. Cancer Invest. 22 (5), 663-669 (2004).
- Muggia, F. M. Liposomal encapsulated anthracyclines: new therapeutic horizons. Curr Oncol Rep. 3 (2), 156-162 (2001).
- Li, L., et al. Triggered content release from optimized stealth thermosensitive liposomes using mild hyperthermia. J Control Release. 143 (2), 274-279 (2010).
- Lu, T., Lokerse, W. J., Seynhaeve, A. L., Koning, G. A., ten Hagen, T. L. Formulation and optimization of idarubicin thermosensitive liposomes provides ultrafast triggered release at mild hyperthermia and improves tumor response. J Control Release. 220, 425-437 (2015).
- Seynhaeve, A. L., Dicheva, B. M., Hoving, S., Koning, G. A., Ten Hagen, T. L. Intact Doxil is taken up intracellularly and released doxorubicin sequesters in the lysosome: Evaluated by in vitro/in vivo live cell imaging. J Control Release. 172 (1), 330-340 (2013).
- Dicheva, B. M., et al. Cationic Thermosensitive Liposomes: A Novel Dual Targeted Heat-Triggered Drug Delivery Approach for Endothelial and Tumor Cells. Nano Lett. 13 (6), 2324-2331 (2012).
- Brouckaert, P. G., Leroux-Roels, G. G., Guisez, Y., Tavernier, J., Fiers, W. In vivo anti-tumour activity of recombinant human and murine TNF, alone and in combination with murine IFN-gamma, on a syngeneic murine melanoma. Int J Cancer. 38 (5), 763-769 (1986).
- Van Muijen, G. N., et al. Antigen expression of metastasizing and non-metastasizing human melanoma cells xenografted into nude mice. Clin Exp Metastasis. 9 (3), 259-272 (1991).
- Das, A. M., et al. Differential TIMP3 expression affects tumor progression and angiogenesis in melanomas through regulation of directionally persistent endothelial cell migration. Angiogenesis. 17 (1), 163-177 (2013).
- Brouckaert, P., et al. Tumor necrosis factor-alpha augmented tumor response in B16BL6 melanoma-bearing mice treated with stealth liposomal doxorubicin (Doxil) correlates with altered Doxil pharmacokinetics. Int J Cancer. 109 (3), 442-448 (2004).
- Chen, V. Y., Posada, M. M., Zhao, L., Rosania, G. R. Rapid doxorubicin efflux from the nucleus of drug-resistant cancer cells following extracellular drug clearance. Pharm Res. 24 (11), 2156-2167 (2007).
- Parslow, A., Cardona, A., Bryson-Richardson, R. J. Sample drift correction following 4D confocal time-lapse imaging. J Vis Exp. (86), (2014).
- Li, L., et al. Mild hyperthermia triggered doxorubicin release from optimized stealth thermosensitive liposomes improves intratumoral drug delivery and efficacy. J Control Release. 168 (2), 142-150 (2013).
- Pedrosa, L. R., et al. Improving intracellular Doxorubicin delivery through nanoliposomes equipped with selective tumor cell membrane permeabilizing short-chain sphingolipids. Pharm Res. 30 (7), 1883-1895 (2013).
- Pedrosa, L. R., et al. Short-chain glycoceramides promote intracellular mitoxantrone delivery from novel nanoliposomes into breast cancer cells. Pharm Res. 32 (4), 1354-1367 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。