Method Article
体外配信生細胞イメージング化学療法を探求する脂質ナノ粒子によってを使用してください。
要約
住セルイメージ投射はダイナミックなプロセスを可視化する強力なツールです。固定セルの検討プロセスについての混乱と誤解につながることができます、静的画像のみを提供します。この作業は、吸収、薬物放出と細胞内リポソーム型ナノ粒子の細胞内局在性を調査する手法を示します。
要約
従来の画像処理技術は、細胞プロセスに関する詳細情報を提供できます。しかし、この情報は、そうでなければ動的システムで静的なイメージに基づいています、連続したフェーズが簡単に見落とされるか誤解。住セルイメージ投射と微速度顕微鏡観察で生きているセルに対して実行できます数時間あるいは数日もっとまたはより少なく連続的なファッションではありませんそのため非常に有益。ここで説明したプロトコルでは、ドキソルビシン (dox) 生きている細胞の出産後化学療法ナノ粒子の運命の調査ができます。Dox は、生物学的にアクティブになる、ナノキャリアから解放する必要がありますデュアルインターカレーションのエージェントです。二十年以上臨床登録、にもかかわらずその吸収、破壊し、薬物放出まだ完全に理解しました。この資料では、脂質を基盤とした腫瘍細胞によってとられ、徐々 に分解があるという仮説を探ります。リリースされた dox は、核に転流します。固定アーティファクトを防ぐために、住セルイメージ投射と微速度顕微鏡観察、この実験の手順の説明を適用できます。
概要
細胞間相互作用などの生物学的プロセスに従う能力間-細胞内輸送、細胞毒性化合物の吸収と細胞や組織、単一の分子の蛋白質蛋白質の相互作用過去大きな関心を得ています10 年間、「リアルタイム」の余分な次元を提供するので本稿では、無料 dox とナノ粒子 (Dox NP) に組み込まれている dox の細胞の運命に従う方法は、説明します。
ナノ粒子はある特定の癌を治療するために何十年も使用されています。エイズ関連カポジ肉腫の治療高度な卵巣と乳がん、多発性骨髄腫1と Dox NP が承認されました。最初リポソーム型ナノ粒子を開発し、臨床導入の一つだった。フリー フォーム、dox が大幅に十分な量で腫瘍部位に到達する能力を制限する血液の循環からクリアされます。さらに、治療は重度と用量制限副作用、口内炎、心臓障害などを伴います。ペグ化リポソーム ナノ粒子循環時間は日2分から増加します。このタイプのコレステロール含有リポソームは非常に安定して、この安定性は、カプセル化された薬剤の薬物動態を決定します。
しかし、この剛性を下げてをいます。腫瘍細胞に対する化合物の細胞毒性の能力は最初評価の in vitro、それは、dox は Dox-NP の細胞毒性の試金の3,4よりも強力示されています。キャリアの安定リリースと薬物の細胞内取り込みを防止し、この現象を精査する価値がある仮説。血流に積極的な要素を最後に、そのまま、腫瘍部位に到達するために建てられた、リポソームの組み込みプロパティは、ターゲット ・ サイト (すなわち腫瘍の細胞毒性成分 (すなわちdox) の障害のバイオアベイラビリティ細胞核)。Dox NP は、フリー フォームと比較して応答を改善するかはたくましくまだの臨床的価値としてカプセル化大幅減少心毒性効果5だったします。次の年では、他の化合物をナノ キャリア6のカプセル化。また、キャリアを変更するトリガーされた薬物の放出 (すなわち、腫瘍部位で) の結果しますが、血液循環7,8で安定性を維持します。長年の調査と臨床使用、Dox NP のようなナノキャリアの腫瘍内運命を完全クリアはまだはありません。最近の出版物のナノ粒子とられること、全体として、dox のリソソーム9に閉じ込められたままことが示されました。
薬剤の放出をナノ粒子の細胞内取り込みは、住セルイメージ投射を使用して最高監視できます動的プロセスです。また、セルの古典的な組織に孵化、固定化リポソームのキャリアを破壊するアーティファクトを導入、偽の結果を与えることができるその後固定します。住セルイメージ投射のための主な要件、蛍光によって好ましく、目的のプロセスの視覚化であります。Dox のような特定の化合物がある本質的な赤い蛍光性。また、キャリアに蛍光マーカーが生じるし、細胞小器官は、生きている細胞のマーカーを使用して視覚化できます。この方法では、キャリア、薬物放出とキャリアや薬物などの細胞局在の取り込みなどのパラメーターの配列をイメージを作成および分析できます。ここでは、メソッドを説明し、dox といくつかの腫瘍細胞の Dox NP の細胞の運命はリアルタイムでその後します。また、このメソッドは、ターゲット (例えば、ナノ粒子10) とトリガーのための理想的な条件を作成する簡単に合わせることができる (例えば、温熱療法7) 薬物放出。
プロトコル
1 準備
- イメージングの商工会議所、2 つの部分から成っている組み立て。。
- 場所商工会議所 ( 図 1 a-2) の下の部分と下の部分 ( 図 1 a-3) にネジ上部に 25 mm カバー ガラス ( 図 1 a-1)。ガラスを破ることができるとはあまりにもハードに締めてないです。オートクレーブ全体の部屋 ( 図 1 a-4).
- ダルベッコを補うことで細胞培養培地を準備 ' s 修正イーグル ' s 媒体 (DMEM) フェノール レッド 10% 熱不活化牛胎児血清 (FCS) と 1 ミリメートル L グルタミン無菌条件下でなし。4 ° C で使用する前に 37 ° c の暖かい店 。
- は、標準的な細胞培養の技術を用いたフラスコ培養で細胞培養培地で細胞を維持します
。 注: ここでは、2 つのマウス細胞株、メラノーマ B16BL6 11 ルイス肺癌 (LLC)、および 2 つのひと黒色腫、BLM 1F6 12、使用されたします 。
- 、計量し、リン酸緩衝生理食塩水 (PBS) 37 ° C でにゼラチンを溶解する 0.1% ゼラチンは一晩します。0.22 μ m のフィルターを通してフィルタ リング ソリューションを殺菌し、4 で保存 ° C
2。細胞をプレート
- キャビネット流で滅菌袋からイメージング室を削除慎重にチャンバーを強化し、ペトリ皿に配置します
。 : 汚染を防止する注意イメージング室ペトリ皿で顕微鏡下でチャンバーを配置ことができますまで 。
- コート 1 ml 0.1 %37 ° C、5% CO 2 で 20 分間滅菌ゼラチンのイメージング室のガラスします
。 注: これは良い細胞接着になります 。
(1.2 と 1.3 の手順を参照してください) 細胞培養フラスコからメディアを取り外し、1x PBS で 1 回洗浄 0.25% トリプシンを使用してセルを外し、 - 。細胞培養液を追加してトリプシンを不活化、細胞を収集、5 分 1,100 x g でそれらをスピンダウンおよび細胞培養液 5 mL にペレットを再懸濁します 。 トリパン ブルー (これは死んだ細胞に取り込まれるが) の 20 細胞懸濁液の希釈 20 μ
- μ L。診断; 生活と死んでいるセルの数をカウントします。死んだ細胞の数は 10% を超えないようにしてください。 。
- は、ゼラチンを吸引し、24 h 以内 70% のカバレッジの最大希釈で細胞をプレートします。たとえば、5 x 10 の 4 または 1 mL の 10 x 10 の 4 セルの希薄を使用します。5% CO 2 と 24 時間の 37 ° C で接着細胞を許可
3。微速度顕微鏡観察 ( 図 2)
注: ここでは、オーダーメイド ステージ ホルダーと共焦点顕微鏡、生細胞イメージングのためのインキュベーターの範囲を提供するほとんど製造していますが使用されました。nanoparticulated ドラッグデリバリーを調べるにも適しています
。- 密度、細胞形態、汚染に顕微鏡下で細胞を評価します。CO 2 インキュベーターにチャンバーを配置します
。 注: 密度が 70% を超えない。細胞の形態は、一貫性のない (すなわち 細胞が付着しない) かどうか、または汚染が検出されると、イメージングの商工会議所を破棄します 。
- 蛍光灯 ( 図 1E-2) とコンピューター ( 図 1E-3) 共焦点顕微鏡 ( 図 1E-1) を切り替えます 。
- レンズ ヒーターを目的に接続し、35 ° C ( 図 1E-4 + 挿入物) に設定します 。 図 1 b に示すように、
- はインキュベーション ユニットを準備します
。 注: このユニットで構成されています加熱ステージ ( 図 1 b-1) 流期 CO 2 管 ( 図 1 b-2) コネクタと CO 2 のプローブ ( 図 1 b-3)、および赤い終了パッチ ( 図 1B-4)。一時的に部屋が配置されるまでユニットを閉じるにこの修正プログラムを使用します 。
- は、顕微鏡ステージ上にインキュベーション ユニットを配置で- とアウト-flow CO 2 管 ( 図 1E-5) を接続します。主な CO 2 バルブ ( 図 1E-6) を開き、CO 2 コント ローラー ( 図 1E-7) に切り替えます。コント ローラーが 5% CO 2 に設定されていることを確認します
。 注: 湿度、CO 2 は加湿器 ( 図 1E-8) を通過します。低酸素症実験別 O 2 レギュレータ ( 図 1E-9) セットアップに含まれています 。
- は、ステージ温度を 37 ° C ( 図 1E-10) に設定します。温熱実験設定温度 42 ° c. 許可する選択した温度と CO 2 の割合に到達するインキュベーション ユニット 。
- 2 インキュベーターの主な CO からイメージング室を取り出して、顕微鏡の部屋にシャーレに商工会議所を輸送します 。
- カスタムメイドにイメージング室 ( 図 1 a-4) を配置して、35 mm 直径 ( 1 a を図-5) ホルダーをステージし特注シールふた付け室を閉じる (図 1A-6).
注: ふたを CO 2 を渡すことができ、蒸発や汚染を防ぎます。- インキュベーション ユニット、赤のパッチを置き換えるイメージング室開閉ユニット ( 図 1)。セルの冷却を防ぐためにできるだけ早くこれを行います。ステージと顕微鏡の間立ち往生しているケーブルがないことを確認します 。
- 30 分慣らすユニットを残す
- ソフトウェアを開き、レーザーに切り替える
。 注: ここでは、488 nm のアルゴン、543 nm ヘリウム-ネオン、633 nm ヘリウム-ネオン レーザーを用いています 。
- をクリックして新しいデータベースを作成 " 新しい " ファイル タブの名前の下で、データベース保存します 。
- をクリックして構成の設定 " 設定 " 取得タブの選択の下で " ・ チャネル ・ モード " と " 単線 " 一分子蛍光を評価するまたは " マルチ トラック " fluorophores が付いていくつかの。蛍光体 (dox と Dox NP など 560 に 615 nm バンドパス フィルター; 参照例について代表結果) と一致する適切な帯域通過フィルターを選択します。トラックの 1 つで明るいフィールド チャンネルを選択します 。 スキャン設定をクリックして
- " スキャン " 取得タブ セット フレーム サイズ (1,024 × 1,024)、スキャン速度 (最適) の下でスキャン方向 (8 ビット、シングル)、およびクリックして平均 (4) をスキャン " モード " ピンホール (200 μ m) を設定、ゲインおよびオフセット (例えば 580、700、および 835; 図 3 を参照) とレーザーの力 (488 = 10 543 = 100% 633% = 100%) をクリックして " チャンネル "
- をクリックしてこれらの設定を保存 " 設定 " タブ構成で、構成データベースに保存。 。
- をクリックして、時間経過を設定 " マルチ時間 X " ( 図 1) [マクロ] タブをクリックして " の場所をシングル ". フォーカスの細胞を維持する
- マクロでクリックして自動フォーカスを選択する " 自動フォーカス "
。 注: オート フォーカス633 nm レーザーを基準点として、ガラスの反射を使用して実現します 。
- をクリックして保存した構成を適用 " 単線 " または " マルチ トラック " スキャン (例えば 97) の数 (例えば、15 分)、時間の間隔を設定、構成データベースで必要な構成するスクロールとクリックすると " 負荷設定します "
注: これらの設定を使用して、97 × 15 分 = 24 h の時間シリーズが行われる。 。
- 名前でコマ撮り、" ベース ファイル名 " (ステップ 3.11 製) データベースをクリックして選択、" イメージ データ ベース " コマ撮りを保存します。クリックして一時フォルダーを設定 " フォルダー Tmp イメージ "
注: 画像がこのフォルダーにある場合は、システムが停止または何らかの理由でクラッシュ、。 。
- インキュベーターのユニット、イメージングのリングを持ち上げて、客観的にイマージョン オイルのドロップを追加開閉ユニットに、できるだけ早く。集中し、イメージングの商工会議所で位置を選択します
。 注: この位置には 70% の confluency、個々 の細胞のイメージングを可能にする最小の単分子膜の細胞が含まれています 。
- 背景の設定を確認し、必要に応じて修正します
。 注: バック グラウンドは、利得やレーザーの力を減らすことによって修正できます。構成の変更 (手順 3.17 参照) を保存する必要があり、(手順 3.18 参照) 読み込まれたマクロで再度です 。
- キャビネット流で無料医薬品または濃度 5 μ G/ml 薬物を細胞培養液中の脂質 0.05 µmol ナノ粒子を希釈します。薬/ナノ粒子が滅菌されない場合 0.22 μ m シリンジ フィルターをフィルター処理します 。
- インキュベーターのチャンバーを開き、シール蓋を持ち上げて、セルからメディアを取り出して、希釈薬/ナノ粒子の 1 つの mL を追加し、できるだけ早くユニットを閉じる 。
- をクリックしてセルとスタート、時間経過に焦点を当てる " 開始時刻 " マルチ時間 X マクロで 。
- セルをフォーカスはまだ、またはオート フォーカス (3.16 の手順を参照してください) を使用してかどうかを定期的に確認します。プログラムが自動的にデータベースにコマ撮り保存します。プログラムの実行中は、データベースを閉じないで 。
4。データ分析
- 元の研究の質問に応じてデータ分析の ImageJ などのソフトウェア プログラムを使用して、(例の 結果 を参照してください).
結果
別のマーカーとリポソーム キャリアの分類は上記9をされています。キャリア付けられて遠 dioctadecyl tetramethylindotricarbocyanine 過塩素酸塩 (でした。Ex = 644 nm;Em = 665 nm) または緑 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(carboxyfluorescein) (CF PE;Ex = 490 nm;Em = 515 nm) この原稿で示されます。細胞間の類似点とリポソーム取り込み、リリース、および細胞内局在の違いを表示するには、複数の腫瘍のタイプを調べた。マウスの 2 つの行、B16BL6 悪性黒色腫11とルイス肺癌 (LLC) と 2 つのひと黒色腫、転移性の高い (BLM)、非転移性 (1F6) 悪性黒色腫12,13が含まれます。生きた細胞を用いるすべての実験を行った。すべての実験で 3 24 の h. 測定や分析 dox (無料、リリースされた、カプセル化、隔離、または介在の形態) で呼ばれた DXR の 5 μ g/mL dox、5 μ G/ml、Dox NP または 0.05 µmol ナノ粒子の濃度が投与されました。40 X (開口数: 1.3) 油対物レンズが使用され、CF PE とライソゾーム マーカー (LM) のイメージングを行った 488 nm アルゴン レーザー (10%/0.2 mw) と 505 に 550 nm バンドパス フィルター-緑。543 nm ヘリウム ネオン レーザー (100%/0.2 mw) 560 に 615 nm のバンドパス フィルターを用いて dox、Dox NP とライソゾーム マーカー赤と。633 nm ヘリウム ネオン レーザー (100%/0.5 mw)、640 nm ロングパス ・ フィルターを用いていた。
そのカプセル化のため生体外の細胞毒性、バイオアベイラビリティ、dox の薬物動態は、大幅に変更された3,9,14をだった。無料でカプセル化された形で投与したときの薬物のバイオアベイラビリティの差は、図 3に示されています。Dox はデュアルインターカレーション エージェントを細胞に細胞核を入力する必要があります。図 3と関連映画の 1 と 2 は、3 h を同一条件下で dox と Dox NP BLM 細胞の時間経過の表示に。Dox 露出の数分以内核 DXR (図 3 a映画 1) を観察することができ、下を使用して (挿入) を得るため、核の間をインターカ レートを見ることができます。一方、Dox NP にさらされると、細胞内 DXR は、(図 3 b映画 2) この時間枠の内でほとんど見えないです。光電子増倍管の利得を増やすだけで細胞質に DXR を観察できる (挿入)。ImageJ を用いた、細胞質と核の DXR のピクセル密度を行った。細胞は、運動、時間経過の評価中に、蛍光を明視野画像を組み合わせることが重要です。これは、個々 のセルを追跡し、ImageJ で特定のプラグインを使用して XY ドリフトを安定化の可能性を示します。図3 における、明視野イメージは利益 (率 ROI) (実線) の細胞質と核 (点線) の周りの領域を描画に使用されました。ImageJ で ROI マネージャーは、メニュー項目分析で見つけることができます > ツール > ROI マネージャー。これらの Roi はメニュー項目分析を使用してピクセル密度を分析する蛍光画像で使用される > メジャー。核 (図 3) のピクセル密度と dox または Dox-NP-処理細胞の細胞質 (図 3 D) の違いは、画像で見ているものを確認します。また、セル dox または後化合物は媒体に置き換え、光電子増倍管の利得 (図 4) の高められた感度ですぐに結像される Dox NP で 24 時間培養。レーザー出力、オフセット、ピンホール、画像表示などの他の設定は同一であった。Dox NP 処理 dox 治療に比べて細胞で DXR 信号が印象的です。700 のゲインを使用、Dox NP 処理細胞で DXR が dox のイメージは既に露出オーバーに対し、表示されます。この単純な生体外実験では、カプセル化された薬剤と無料のバイオアベイラビリティの差を可視化します。
細胞が 24 h の Dox NP に継続的にさらされる、DXR 造り上げる、図 5 aと映画 3 と 4 で示すように。信号が細胞質の増加し、DXR 発見が遅くまた核に挟在します。これらの観察は、ピクセル密度グラフ (図 5 b) で確認しています。測定された細胞質ピクセル密度は BLM 1F6 細胞に比べて細胞内分布の違いのために低いです。DXR 1F6 セルでは、セル全体に分散され、一方 BLM セルの DXR はより核 (図 5) に近い細胞小器官に集中してください。
そのため、薬と異なる細胞 (図 6) のキャリアの局在を調べた。Dox NP/したとイメージで 24 時間培養し, 細胞。明視野イメージを使用して細胞膜 (実線) と核 (点線) のオーバーレイは、3 つの異なる細胞の蛍光像で描かれました。ここで付いた、キャリア、DXR と同じ細胞質パターンに従うこと示されて: LLC は、全体の核の周り, BLM の原子核に近い細胞小器官に集中し、ランダムに B16BL6 細胞の細胞質に散在します。核でのみ DXR として見ることができる、dox を解放を示します。光電子増倍管の利得を減らして、DXR と付けられてキャリアを含む個々 の細胞小胞でしたと同様、CF-PE (図 6 b ・ 6 C) と見ることができます。
小さい小胞の細胞質 DXR sequesters し、セルは緑または赤で生きている細胞のライソゾーム マーカーで付けられました。これらのリソソームの動きは、セル (映画 5) で続くことができます。細胞質 DXR と、ナノキャリアはこれらの構造の内で colocalize し、DXR パターンで細胞間差図 6に見られるように、ここで説明します。リソソームは、B16BL6 細胞質全体にランダムに分散し、BLM 細胞 (図 7 a) の核に位置しています。ImageJ を用いた、DXR とリソソーム内のキャリアの間の共存を求めた (図 7 b)。カラー画像はバイナリで行われた (プロセス > バイナリ > バイナリを作る)、プラグインの共存を使用して (分析 > の共存)、共存イメージと DXR の作られたでした。これは両方の画像のコードして, ピクセルを表す白いピクセル グリーン赤白カラーの画像を作成します。メニュー項目のプロセス > バイナリ > バイナリを作る、白いピクセルを分離し、ピクセル密度の測定元となる黒のピクセルに変換する (分析 > 測定)。この DXR 間共存イメージがしましたその後、-イメージしたし、ライソゾーム マーカー (LM) とピクセル密度のバイナリ イメージを測定します。共存に関する研究データは DXR の肯定的なピクセルの割合-でしたと DXR でした/ライソゾーム マーカー (図 7)。CF PE で標識されたキャリアと同様は、リソソームの位置も、図 7に表示されます。

図 1: 楽器と機器のセットアップ。A) イメージング室 + 必需品。25 mm #1 カバーガラス (1) 商工会議所 (2) の下の部分 (場所の部屋の上部します。下逆さま d)、o リング (3)、ステージ ホルダー (4)、シール蓋 (5)。スケール バー: 2 cm。 B) インキュベーション ユニット。加熱顕微鏡ステージ (1) フローとで- とアウト-flow CO2 (2)、(3) CO2プローブおよび終了パッチ (4)。スケール バー: 2 cm。 C) 顕微鏡の下で見られるようにインキュベーター ユニットでチャンバーをイメージングします。D) マルチ時間シリーズ マクロ。E) イメージング装置です。逆顕微鏡 (1)、蛍光灯 (2)、コンピューター (3)、リング ヒーター (4、挿入) とコント ローラー (4、主要な図)、CO2流管 (5)、CO2バルブ (6)、CO2コント ローラー (7), CO2加湿器 (8) O2バルブとコント ローラー (9) とステージ温度コント ローラー (10)。この図の拡大版を表示するのにはここをクリックしてください。
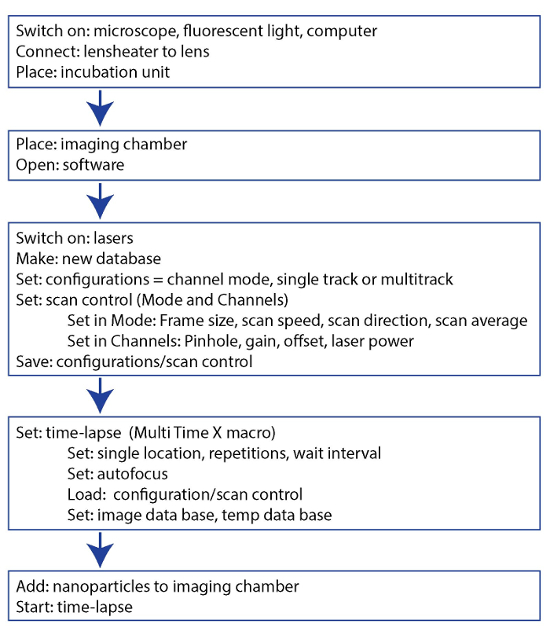
図 2:プロトコル セクション 3 で細かいパラメーターを顕微鏡の概略図。この図の拡大版を表示するのにはここをクリックしてください。
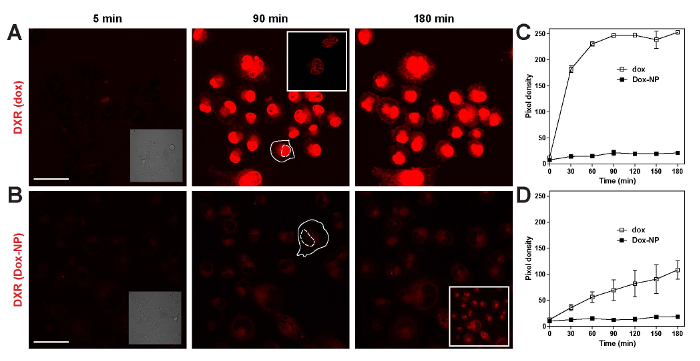
図 3: dox と Dox NP の短期的な摂取量を調査します。 BLM 細胞が 3 h、dox または Dox NP にさらさ継続的に、経過時間をとった。(A) dox と培養細胞のコマの静止画像。(B) 細胞のコマの静止画像は、Dox NP と孵化させます。スケールバー = 50 μ m (C) ピクセル密度増加額 dox と Dox-NP-処理細胞で核の DXR の。(D) dox と Dox-NP-処理細胞の細胞質の DXR のピクセル密度増加。データは、フィールドごとの 3 セルの平均 ± SD を表します。この図の拡大版を表示するのにはここをクリックしてください。
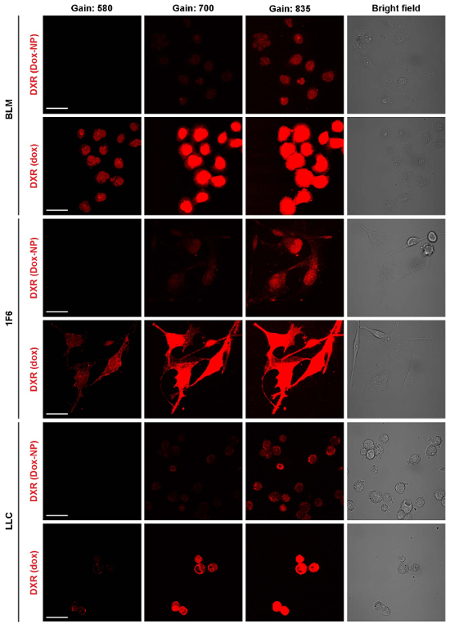
図 4: 細胞 dox と Dox NP の長期的な摂取量を調査しています。細胞は dox または Dox NP にさらされ、後で 24 h をイメージします。3 異なる利益と、薬を除去した後すぐに撮影を行った。スケールバー = 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。
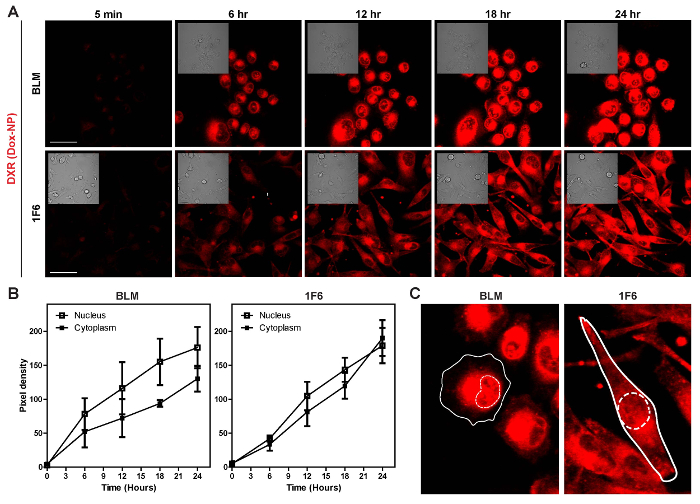
図 5: 細胞内取り込みとリポソームのエージェントのリリースを調べるします。細胞は、24 時間、Dox NP に継続的にさらされ、コマ撮りしました。(A) コマ撮りの静止画。スケール バー 50 μ m (B) ピクセル密度の増加額 DXR の核と細胞質を =。データは、フィールドごとの 3 セルの平均 ± SD を表します。(C) 画像をセル内で DXR の局在を示します。実線: 細胞膜、点線: 核。この図の拡大版を表示するのにはここをクリックしてください。
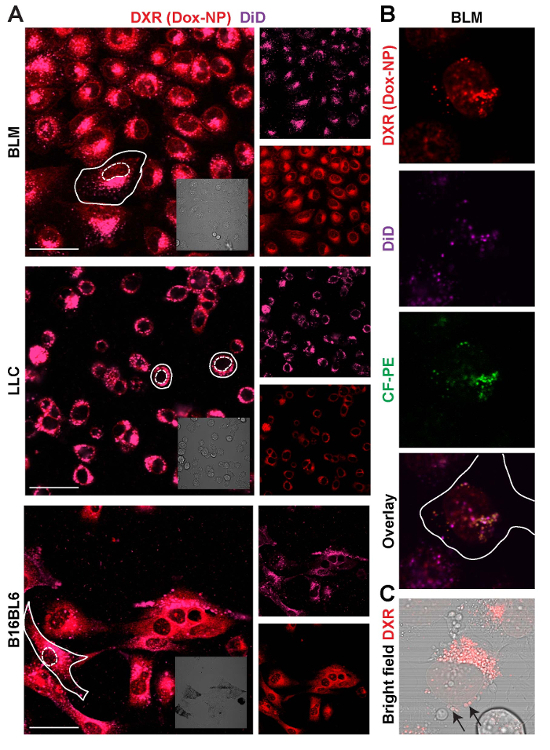
図 6: 薬と異なる細胞株におけるキャリアのローカライズを調査します。(A) 細胞が Dox NP/ー 24 時間にさらされているし、イメージします。スケールバー = 50 μ m。 (B) 細胞 24 h の Dox-NP/か/CF-PE にさらされる, 個々 の小胞を区別するために低強度の利得を持つイメージを作成します。(C) ブライト フィールド、DXR の細胞質小胞 (矢印) で DXR を示すオーバーレイします。この図の拡大版を表示するのにはここをクリックしてください。
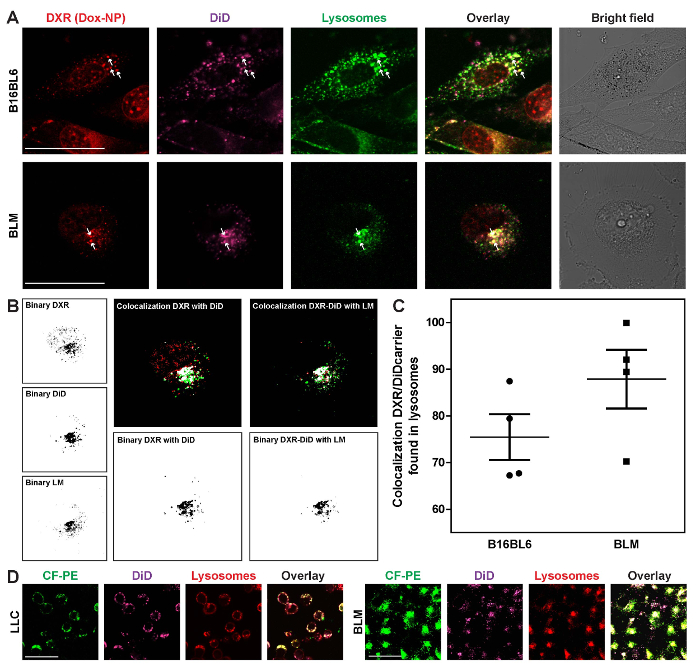
図 7: 薬物とキャリアの細胞内局在化の調査。セルは、Dox NP/でしたか CF-PE/24 時間にさらされ、リソソームが緑または赤の生きている細胞のライソゾーム マーカー (LM) を用いて可視化します。DXR と (した) キャリアの細胞内分布 (A)。矢印は、DXR の 3 例を表し、リソソームでローカライズされたでした。スケールバー = 50 μ m (B) の共局在解析において, dxr と ImageJ を用いたリソソーム (LM) にキャリア (でした)。DXR の共局在およびリソソームにキャリアの (C) の割合。データは、3 の個々 の実験の平均 ± SEM を表します。2 つのマーカーを用いて可視化するキャリアの (D) ライソゾーム隔離。スケールバー = 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。
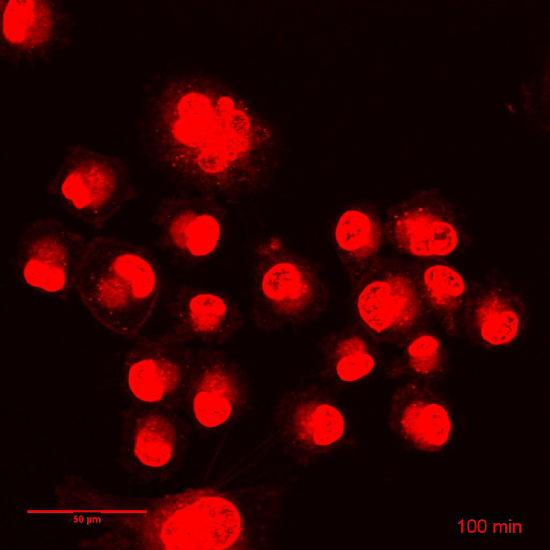
映画 1: 関連図 3:3 h の dox と BLM 細胞培養コマ撮り: フレーム レートを 10 分の間隔で、19 画像: 3 fps。スケールバー = 50 μ m.してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
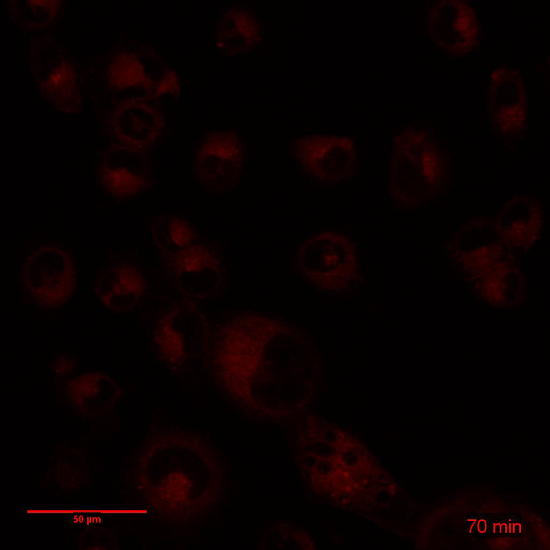
映画 2: 関連図 3:3 h の Dox NP の BLM 細胞培養コマ撮り: フレーム レートを 10 分の間隔で、19 画像: 3 fps。スケールバー = 50 μ m.してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
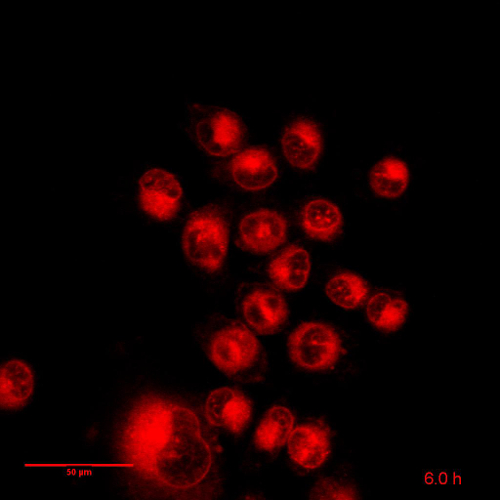
映画 3: 関連する図 5:24 時間の Dox NP の BLM 細胞培養時間経過は: フレーム レートを 15 分間隔で 96 画像: 8 fps。スケールバー = 50 μ m。 このビデオを表示するのにはここをクリックしてください。(右クリックしてダウンロード)。
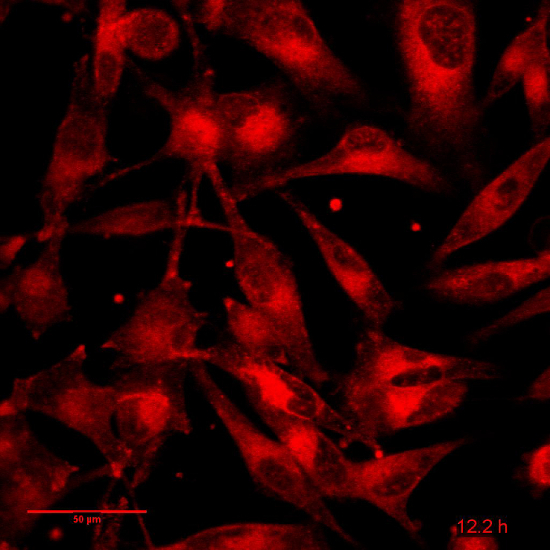
映画 4: 関連図 5: 1F6 細胞 Dox NP で培養し, 24 時間時間経過は: フレーム レートを 15 分間隔で 96 画像: 8 fps。スケールバー = 50 μ m.してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
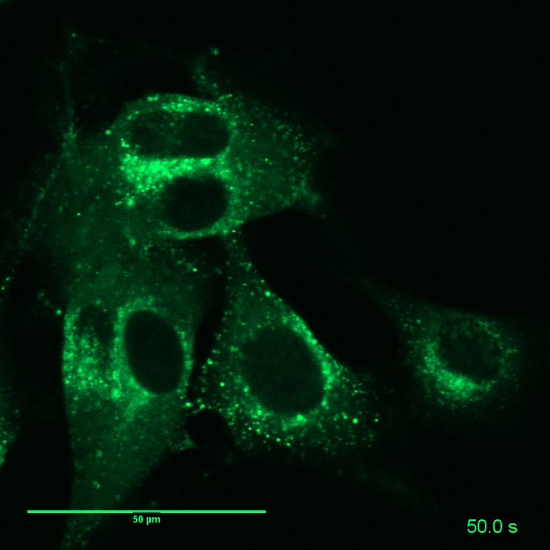
の映画 5: 関連図 7:リソソーム B16BL6 細胞の生細胞マーカーが染まった。時間経過は: 10 の間隔で 10 の画像 s のフレーム レート: 3 fps。スケールバー = 50 μ m.してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
過去に観測された固定ほとんどすぐにリポソーム ナノキャリアを破壊することが、DXR リリース フォームこれらの破壊されたリポソームはまだ核を入力する時間を持っていた非常に難しいとも誤解を招くデータの解釈を行います。日常的にいくつかの顕微鏡の調整と生きた細胞や組織に化学療法の運命を確認または組織学的観察を打倒する調べることができます。最近の論文は、細胞生細胞タイムラプス イメージング9を使用して無料でカプセル化された dox で取り込み、リリース、および DXR の局在を示した。この作品より詳細に実験のセットアップについて説明します。このモデルを使用して、それは核に dox の即時の輸送を可視化することが可能、それは継続的にセルが最終的に死ぬまで蓄積します。対照的に、Dox NP を使用すると、リリースされた dox の少量は核にあります。DXR が次々 に連続暴露、蛍光シグナルは Dox ではるかに低い-NP-dox 扱われる細胞対細胞濃度とそれに続く細胞毒性の違いを示します。さらに、生きている細胞のマーカーを使用することにより、Dox NP に細胞を公開することには、DXR、ナノキャリアにあるとリソソームが示されました。これは、完全なリポソーム細胞によってとられる、これらのナノ粒子の取り込み中にエンドサイトーシス経路の関与を示しますを示します。核の DXR は明らかにリリースされた dox からです。ただし、DXR とキャリアの両方共をローカライズし、リソソームにはめられるよう、このメソッドを使用して、じゃまだ決定的かどうかこれはカプセル化または dox をリリースします。ナノ粒子の本質的な安定性が dox リリース リソソームでローカライズされている場合を防止することが可能です。
このプロトコルでは、住セルイメージ投射は (要求の仕様を与えることができる) カスタムメイド ステージ ホルダーと特定の顕微鏡のセットアップを使用して示されています。ただし、共焦点顕微鏡製造最も住セルイメージ投射を行うインキュベーターの範囲を提供しています。培養条件 (すなわち温度、CO2pH、湿度、および不妊症) を維持するこれらのインキュベーターの主な基準、適切な条件を決定するいくつかの予備テストが必要でさらに説明しています。自動データ取得プログラムは、同じメーカーでも配信できます。「マルチ ロケーション」オプションは、同じ室で複数ポジションを画像統計解析を精製すること可能になります。ただし、このオプションは本稿に記載されているマクロで Z ドリフトを修正する可能性が失われる、固定の XYZ の位置が必要です。Z 寸法をスキャンは、このマクロの分析の焦点平面を使用して含めることができます。ただし、これは余分なスキャン、光毒性の可能性を増加させる、漂白する必要があります。
細胞吸収性の異なる 2 つの化合物を比較するときに特に、すべての蛍光測定と同様は、露出オーバーは、問題です。蛍光の強度は、化合物の内因性信号にも取り込み、濃度、および薬剤の露出時間の速度に依存。図 3 に示すように、Dox NP 処理細胞の信号は見られないに対し dox 処理細胞の核の DXR コンテンツが表示されて既に。ゲインを増やすことによってのみ Dox NP 処理細胞で DXR 視覚化できます、dox 処理細胞では露出オーバーに 。さらに、細胞内でも、Dox NP は不均一分散、下でやむを得ないが発生- または露出オーバー。細胞の DXR エントラップメントを調査したときに特に、ゲインは個々 の細胞器官 (図 5 bと5 C) を区別するために激減しました。したがって、ピクセル密度で表される測定は結果の適切な解釈のための代表的なイメージで同伴します。
光毒性、漂白、低信号対雑音比も重要な問題で蛍光顕微鏡、画像の品質と画像の取得間の妥協を確立する必要があります。ただし、顕微鏡のセットアップが最適のときでも画質はセルと付加化合物の品質によって決まりますも大きく。DXR 強いシグナルを与えるし、適切な予防措置と漂白を確認できなかった (最大 72 時間) より長い期間後でさえも。ただし、蛍光信号の低減には流出の結果することができます。流出薬物抵抗15で重要な現象であり細胞細胞内作用部位から薬剤をポンプでくむときに発生します。時間をかけて蛍光シグナルの低下はできるためまた dox 流出9の結果になります。コマ撮りシリーズの最後の画像で実験の終わりに非スキャン位置の蛍光信号を比較するデモンストレーションを漂白 (すなわち、信号より高い場所にある、非スキャン) または (すなわち、両方の流出信号同じになります)。いくつかの矯正オプション (例えば背景、ドリフト、漂白など) が ImageJ16のようなプログラムで使用できます。また、蛍光強度が時間の経過につれて、構成設定は時間経過 (ステップ 3.21) の終わりに露出オーバーを最小限に抑えるためのパイロット実験における事前評価することができます。また、すでに希望期間の薬剤にさらされる細胞イメージング商工会議所は、設定を初期化する使用できます。最後に、このタイプの分析では、有毒な薬物濃度 (ステップ 3.22) は避けるべきであるし、確立済みの従来のバイオ試金を使用しています。
細胞は継続的に培養、フェノールレッドなし中維持されます。フェノールレッドはスペクトルの赤い部分に蛍光を発するし、細胞細胞器官、最も可能性の高いリソソーム、誤情報 (ステップ 1.2) を提示で観察することができます。個々 のセルの監視できるように、セルの合流は 70% (手順 3.1) を超えない。CO2流-速度 (ステップ 3.5) はメンテナンス以降検証実験機器を購入したときに規制する必要があります。速度が高すぎると、中に蒸発します。速度が低すぎる、培地の pH が増加細胞の成長に影響することができます。媒体が無い ph フェノールレッド pH インジケーターの変化は観察できない、そのため見落とされがちです。CO2の流れを検証すると、これらの設定は、すべて将来の実験で使用できます。
ここで説明した方法を使用して、ナノ粒子の運命簡単に調査できる住セルイメージ投射と微速度顕微鏡観察を使用しています。この手順では、市販のナノ粒子が使用されました。ただし、感温17、カチオン性リポソーム10の運命リポソーム濃縮短鎖 shingolipids18;ナノ粒子は、8、19腫瘍と正常細胞にこの方法で調べた他の薬をカプセル化します。
開示事項
著者が明らかに何もありません。
謝辞
エラスムス光イメージング センターの一部である使用される顕微鏡施設とそのサービスの OIC のスタッフに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| DMEM (no phenol-red) | Sigma | D1145 | Supplemented with 1 mM L-glutamine and 10 % FCS |
| Trypsin-versene (EDTA) | Lonza | BE17-161E | |
| Fetal calf serum | Sigma | F7524 | Heat inactivate for 30 min at 55 ºC |
| L-Glutamin | Lonza | BE17-605E | |
| Gelatin from bovine skin | Sigma | G9391 | Make a 0,1% solution in PBS, sterile |
| Phosphate buffered saline (PBS) | Sigma | D8537 | |
| Stericup 0,22 µm filter - 500 ml | Millipore | SCGPU05RE | |
| Trypan-blue | Sigma | T8154 | |
| Cells: Lewis lung carcimoma | ATCC | CRL-1642 | |
| Cells: B16BL6 | Dr. P. Brouckaert, Ghent University | donated | Ref.10 |
| Cells: BLM and 1F6 | Dr. van Muijen, University of Nijmegen | donated | Ref.11 |
| Petri dish | Greiner | 664160 | |
| Doxorubicin | Actavis | mentioned as dox in the manuscript | |
| Doxil/Caelyx | Janssen-Cilag | mentioned as Dox-NP in the manuscript | |
| Syringe filter 0.2 µm | VWR international | 10462200 | |
| Lysotracker-green DND-26 | Invitrogen | L7526 | mentioned as lyosomal marker (LM)-green in manuscript |
| Lysotracker-red DND-99 | Invitrogen | L7528 | mentioned as lyosomal marker (LM)-red in manuscript |
| Attofluor cell ring | Invitrogen | A7816 | |
| Cover glass 25 mm #1 | Thermo scientific | CB00250RA1 | |
| Stage holder + sealing lid | Custom made | ||
| ZEISS LSM 510 microscope | Zeiss | ||
| Software LSM 510 version 3.2 SP2 | Zeiss | ||
| Image J | NIH | https://imagej.nih.gov/ij/index.html |
参考文献
- Duggan, S. T., Keating, G. M. Pegylated liposomal doxorubicin: a review of its use in metastatic breast cancer, ovarian cancer, multiple myeloma and AIDS-related Kaposi's sarcoma. Drugs. 71 (18), 2531-2558 (2011).
- Gabizon, A., et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res. 54 (4), 987-992 (1994).
- Ten Hagen, T. L., et al. Low-dose tumor necrosis factor-alpha augments antitumor activity of stealth liposomal doxorubicin (DOXIL) in soft tissue sarcoma-bearing rats. Int J Cancer. 87, 829-837 (2000).
- Hoving, S., Seynhaeve, A. L., van Tiel, S. T., Eggermont, A. M., Ten Hagen, T. L. Addition of low-dose tumor necrosis factor-alpha to systemic treatment with STEALTH liposomal doxorubicin (Doxil) improved anti-tumor activity in osteosarcoma-bearing rats. Anticancer Drugs. 16 (6), 667-674 (2005).
- Gabizon, A. A., Lyass, O., Berry, G. J., Wildgust, M. Cardiac safety of pegylated liposomal doxorubicin (Doxil/Caelyx) demonstrated by endomyocardial biopsy in patients with advanced malignancies. Cancer Invest. 22 (5), 663-669 (2004).
- Muggia, F. M. Liposomal encapsulated anthracyclines: new therapeutic horizons. Curr Oncol Rep. 3 (2), 156-162 (2001).
- Li, L., et al. Triggered content release from optimized stealth thermosensitive liposomes using mild hyperthermia. J Control Release. 143 (2), 274-279 (2010).
- Lu, T., Lokerse, W. J., Seynhaeve, A. L., Koning, G. A., ten Hagen, T. L. Formulation and optimization of idarubicin thermosensitive liposomes provides ultrafast triggered release at mild hyperthermia and improves tumor response. J Control Release. 220, 425-437 (2015).
- Seynhaeve, A. L., Dicheva, B. M., Hoving, S., Koning, G. A., Ten Hagen, T. L. Intact Doxil is taken up intracellularly and released doxorubicin sequesters in the lysosome: Evaluated by in vitro/in vivo live cell imaging. J Control Release. 172 (1), 330-340 (2013).
- Dicheva, B. M., et al. Cationic Thermosensitive Liposomes: A Novel Dual Targeted Heat-Triggered Drug Delivery Approach for Endothelial and Tumor Cells. Nano Lett. 13 (6), 2324-2331 (2012).
- Brouckaert, P. G., Leroux-Roels, G. G., Guisez, Y., Tavernier, J., Fiers, W. In vivo anti-tumour activity of recombinant human and murine TNF, alone and in combination with murine IFN-gamma, on a syngeneic murine melanoma. Int J Cancer. 38 (5), 763-769 (1986).
- Van Muijen, G. N., et al. Antigen expression of metastasizing and non-metastasizing human melanoma cells xenografted into nude mice. Clin Exp Metastasis. 9 (3), 259-272 (1991).
- Das, A. M., et al. Differential TIMP3 expression affects tumor progression and angiogenesis in melanomas through regulation of directionally persistent endothelial cell migration. Angiogenesis. 17 (1), 163-177 (2013).
- Brouckaert, P., et al. Tumor necrosis factor-alpha augmented tumor response in B16BL6 melanoma-bearing mice treated with stealth liposomal doxorubicin (Doxil) correlates with altered Doxil pharmacokinetics. Int J Cancer. 109 (3), 442-448 (2004).
- Chen, V. Y., Posada, M. M., Zhao, L., Rosania, G. R. Rapid doxorubicin efflux from the nucleus of drug-resistant cancer cells following extracellular drug clearance. Pharm Res. 24 (11), 2156-2167 (2007).
- Parslow, A., Cardona, A., Bryson-Richardson, R. J. Sample drift correction following 4D confocal time-lapse imaging. J Vis Exp. (86), (2014).
- Li, L., et al. Mild hyperthermia triggered doxorubicin release from optimized stealth thermosensitive liposomes improves intratumoral drug delivery and efficacy. J Control Release. 168 (2), 142-150 (2013).
- Pedrosa, L. R., et al. Improving intracellular Doxorubicin delivery through nanoliposomes equipped with selective tumor cell membrane permeabilizing short-chain sphingolipids. Pharm Res. 30 (7), 1883-1895 (2013).
- Pedrosa, L. R., et al. Short-chain glycoceramides promote intracellular mitoxantrone delivery from novel nanoliposomes into breast cancer cells. Pharm Res. 32 (4), 1354-1367 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved