Method Article
染色质免疫沉淀(ChIP)在小鼠T细胞系
摘要
这项工作描述了使用成熟小鼠T细胞系的染色质免疫沉淀(ChIP)的方案。该方案适用于研究特定启动子位点或全基因组特异性组蛋白标记的分布。
摘要
信号途径通过调节不同水平的染色质结构来调节基因表达程序,例如通过组蛋白尾的翻译后修饰(PTM),组蛋白变体的规范组蛋白的交换和核小体驱逐。这种调节需要在定义为增强子的调节元件上招募染色质修饰酶的信号敏感转录因子(TF)的结合。了解信号级联如何调节增强子活性需要对TFs,染色质修饰酶的结合以及特定组蛋白标记和组蛋白变体的占据进行综合分析。染色质免疫沉淀(ChIP)测定利用高度特异性的抗体免疫沉淀特异性蛋白质/ DNA复合物。纯化的DNA的随后分析允许鉴定由抗体识别的蛋白质占据的区域。这个工作描述了一个有效率的协议组蛋白在成熟小鼠T细胞系中的ChIP ChIP。所提出的方案允许在合理的时间范围内以高重现性进行ChIP测定。
引言
发育,分化和体内平衡取决于通过调节染色质结构的信号事件建立的特定基因表达程序,从而确定特定基因是否以细胞和时间特异性方式被激活或抑制。在T细胞发育期间,必须建立特异性基因表达程序,以正确地确定T细胞前体从双负(DN)到单阳性(SP)状态的成熟,通过几个中间阶段1 。几个实验室2,3,4,5,6在前几年广泛研究了T细胞发育过程中基因表达程序的动态调控。
通过组蛋白的翻译后修饰(PTM),交换具有组蛋白变体,核小体迁移和DNA甲基化的规范组蛋白调节基因的ON / OFF转换。几组已经研究了PTM和组蛋白变体的全基因组分布,以确定在近端和远端调节区7,8,9,10处与不同染色质状态相关的标记。信号级联通过在特异性增强子元件交换正染色质修饰酶(也称为染色质修饰剂)来编排动态染色质调节。这些染色质调节剂通过例如动态组蛋白甲基化和乙酰化来调节染色质结构,从而调节转录产物。 Notch信号通路11,12,13 ,14。
动态组蛋白PTMs;与组蛋白变体交换;并且可以通过染色质免疫沉淀(ChIP)测定来研究组蛋白,转录因子和辅因子的动态占据。使用高度特异性的抗体来纯化特定的DNA-蛋白复合物,通过定量PCR(qPCR)分析纯化的DNA。深度测序(ChIP-Seq);或者现在不太频繁地与微阵列杂交(ChIP-ChIP)。
由于细胞的裂解,染色质的剪切和/或抗体的低特异性的并发症,ChIP测定有时是有挑战性的。已经采用了几种策略来改进协议,就像NEXSON 15一样 。使用冷却水浴超声波器避免样品加热,这可能会损害正在研究的蛋白质上存在的表位,但剪切样品所需的能量分散在水中。随着防止能量分散的聚焦超声波装置的发展,进一步改进。因此,聚焦超声波设备允许改善细胞裂解和染色质剪切,消除操作者诱导的变异并显着增加再现性。
该工作描述了一种协议( 图1中的示意图 ),用于有效地在称为E2-10HA 16,17的成熟小鼠T细胞系中执行组蛋白的ChIP。 T细胞通常难以溶解,染色质的剪切已被揭示为低效率。在使用冷却聚焦超声波器的该方案中,针对E2-10HA小鼠T细胞系优化了细胞数量,裂解缓冲液和剪切设置。该协议允许人们在合理的时间内以高重现性执行ChIP。事实上,它需要大约两天剪切染色质并评估剪切的质量,三天进行免疫沉淀,逆转交联并纯化DNA。
研究方案
注意: 表1中列出了本协议中使用的所有缓冲区和介质。
第1天和第2天
交换单元格
- 将小鼠T细胞从6孔板转移到50mL管中,并在4℃和〜271×g离心5分钟。将细胞沉淀重悬于30mL的IMDM细胞培养基中,并使用Neubauer室计数细胞。
- 将20×10 6个细胞的等分试样收集到新的50mL管中。
- 将甲醛(FMA)直接加入到细胞培养基中1%终浓度,并在室温下孵育10分钟。
注意:如果吸入,FMA有毒,因此在通风橱下工作并佩戴适当的保护设备。另外,请按照主办机构的规定处理FMA废物。 - 加入1/8体积的1M甘氨酸,pH7.0,并在室温下孵育5分钟。
- 通过离心沉淀5次细胞分钟在4℃和〜271×g,并用10mL磷酸盐缓冲盐水(PBS)洗涤。
- 用1 mL PBS洗涤细胞沉淀,并转移至1.5 mL管。
细胞裂解和染色质剪切
- 将细胞沉淀重悬于1mL SDS裂解缓冲液中,并在冰上孵育10分钟。
- 将每个样品转移到超声处理管中,并使用聚焦超声波仪根据表2所示的设置进行剪切。
- 剪切后,将样品转移至1.5 mL试管,并在4°C和约18,000 x g离心10 min。
- 将上清液转移到新管中。
- 收集50μL,根据步骤3确定剪切效率,并在液氮中快速冷冻剪切的裂解物。将溶胞产物在-80℃下储存在一次性等分试样中。
3.剪切效率的测定
- 加入50μL洗脱缓冲液至50#181; L每个剪切裂解物,并在65℃下孵育过夜,摇动。
- 加入100μLTE缓冲液和4μL10 mg / mL RNA酶A(0.2μg/μL终浓度)。混合并在37℃下振荡孵育2小时。
- 加入2μL20mg / mL蛋白酶K(0.2μg/μL终浓度)至每个样品,并在55℃下摇动孵育2小时。
- 将每个样品转移到适用于苯酚/氯仿/异戊醇萃取的凝胶管中;按照制造商的说明处理。
- 加入200μL苯酚/氯仿/异戊醇(25:24:1),摇匀管。在24℃和约16,000xg离心5分钟,并将上层转移到新管中。
注意事项:苯酚,氯仿,异戊醇吸入有腐蚀性;在通风橱下工作,并穿戴适当的个人防护装备。另外,处理苯酚,氯仿,异戊醇等遵守主办机构的规定。- 重复一次
- 根据制造商的说明,使用纯化柱纯化DNA,并进行以下修改:
- 洗膜两次。最后一次洗涤后,将管在室温下放置2分钟以蒸发剩余的乙醇。
- 为了洗脱,加入50μLH 2 O,室温孵育1 min,旋转管1秒,以适当地浸湿膜,并在室温下孵育1分钟,然后通过离心1分钟洗脱DNA 24°C和〜17,900 x g。
- 使用高灵敏度试剂盒根据制造商的说明书在荧光计上定量纯化的DNA。
- 使用高灵敏度试剂盒,在1.8%琼脂糖凝胶上分析约500ng纯化的DNA,并在电泳系统上分析约1ng。
注意:预期的DNA片段的e为200〜500bp。
第3天和第4天
4.免疫沉淀
- 稀释1体积的剪切裂解物与5体积的稀释缓冲液。
- 与30μL/ mL蛋白A预先准确的琼脂糖珠(根据附录A制备)在冷室中旋转30分钟。
- 在约750 x g下,4℃离心5分钟。
- 收集10%的输入并将其存储在4°C。
- 将所需量的裂解液分成新的管( 详见表3 )。向每个管中加入所需的抗体( 详见表3 ),并在4°C下旋转过夜。
- 加入40μL蛋白A珠,并在4℃下旋转孵育1小时。
- 用1mL低盐缓冲液,高盐缓冲液,LiCl缓冲液和TE缓冲液洗涤珠子(每次洗涤,在4℃下孵育5分钟,同时旋转和离心在4℃和约950×g下3分钟)。 详见表3 。
- 加入110μL洗脱缓冲液,室温孵育15分钟,每2分钟涡旋。
- 在4℃和约950×g离心3分钟,并将100μL上清转移到新的1.5-mL管中。
- 用100μL洗脱缓冲液重复步骤4.7-4.8,并结合洗脱液。加入高达200μL的洗脱缓冲液输入样品。
- 将所有样品在65℃下振荡孵育过夜。
第5天
5. DNA纯化
- 向每个洗脱液中加入200μLTE缓冲液,加入8μL10 mg / mL RNA酶A(最终浓度为0.2μg/μL)。混合并在37℃下振荡孵育2小时。
- 向每个洗脱液中加入4μL20 mg / mL蛋白酶K(0.2μg/μL终浓度),并在55°C振荡孵育2 h。
- 将每个样品转移到凝胶管适用于苯酚/氯仿/异戊醇提取;按照制造商的说明处理。
- 加入400μL苯酚/氯仿/异戊醇(25:24:1),摇匀管。在24°C离心5 min,约16,000 x g。将上层转移到新管。
注意事项:苯酚,氯仿,异戊醇吸入有腐蚀性;在通风橱下工作,并穿戴适当的个人防护装备。另外,按照主办机构的规定处理苯酚,氯仿,异戊醇等废物。- 重复一次
- 根据制造商的说明,使用纯化柱纯化DNA,并进行以下修改:
- 洗膜两次。最后一次洗涤后,将管在室温下放置2分钟以蒸发剩余的乙醇。
- 为了洗脱,加入50μL的H 2 O,在室温下孵育重复1分钟,旋转管1秒以适当地润湿膜,并在室温下孵育1分钟,然后在24℃下离心1分钟至约17,900×g。
结果
对成熟的小鼠T细胞进行ChIP分析,研究赖氨酸4组蛋白3(H3K4me1)的组蛋白标记单甲基化,赖氨酸4在组蛋白3(H3K4me3)上的三甲基化)和赖氨酸27乙酰化的富集组蛋白3(H3K27ac)以及核小体占有率,如panH3 ChIP所揭示的。通过1.8%琼脂糖凝胶( 图2A )和电泳系统( 图2B )的分析来评估剪切质量。 H3K4me1和H3K4me3通常用于分别鉴别增强子位点和启动子( 图3A )。事实上,H3K4me3在启动子5,8,14中是突出的,但不完全是富集的。活性增强剂的特征是H3K4me1和H3K27ac高度富集,H3K4me3(<强力类="xfig">图3A,上图),而无活性的增强子呈现低水平的H3K4me3和H3K27ac但高水平的H3K4me1( 图3A ,下图)。 如图3B所示 , 甘油醛-3-磷酸脱氢酶 ( Gapdh )基因是活性基因启动子 (Gapdh 启动子 )的分析的代表。实际上H3K4me3和H3K27ac水平较高,H3K4me1水平较低。在图3B中 , Deltex1 ( Dtx1 )代表无活性增强子 ( Dtx1增强子 ),因为它对H3K4me1是高度富集的,并且H3K4me3和H3K27ac的富集性差。 基因沙漠是缺乏编码基因的区域的代表,通常被称为活性染色质标记的阴性对照。观察到H3K4me1是一个被广泛接受的增强子标记4,5 , 7,14,18,在基因沙漠不富集,表明该地区缺乏增强剂。
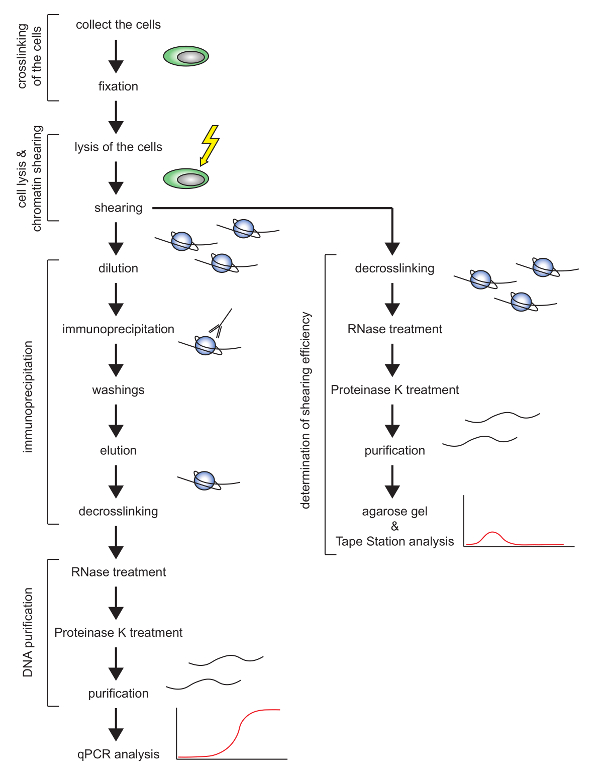
图1:提出的ChIP协议示意图。 请点击此处查看此图的较大版本。
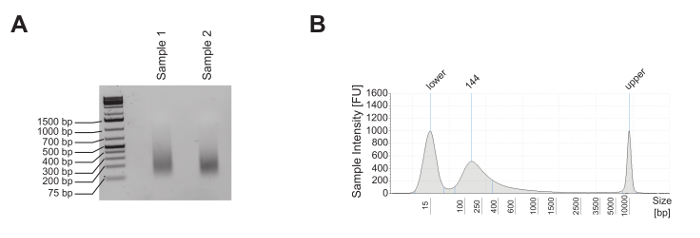
图2:成熟小鼠T细胞系的剪切质量控制。 ( A )剪切成熟小鼠T细胞系E2-10HA的两个不同等分试样,在1.8%琼脂糖凝胶上分析大约500ng纯化的DNA,以评价其剪切质量。 ( B )通过电泳分析1ng来自样品2的纯化DNA以评价其剪切质量。 请点击此处查看此图的较大版本。
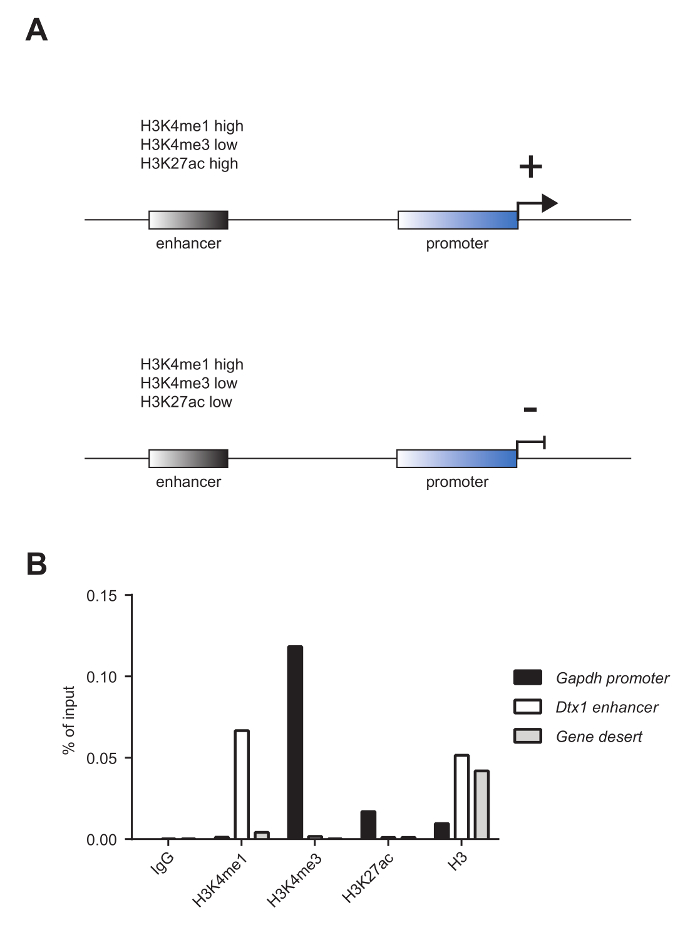
图3:表征增强子和启动子的染色质标记。 ( A )活性增强剂(上图)的特征在于高H3K4me1,低H3K4me3和高H3K27ac,而无活性增强子(下图)具有高H3K4me1,低H3K4me3和低H3K27ac的特征。 ( B ) 如图2A所示的样品汇集在一起,用于ChIP分析与组蛋白标记H3K4me1,H3K4me3和H3K27ac以及组蛋白占用,如PanH3 ChIP所示。这个分析显示,持家基因的e启动子甘油醛-3-磷酸脱氢酶 ( Gapdh 启动子 )对H3K4me3和H3K27ac高度富集,并且H3K4me1低富集。另一方面,无活性基因Deltex1 ( Dtx1增强子 )的增强子对H3K4me1高度富集,但对于H3K4me3和H3K27ac不富集。使用panH3抗体的ChIP来研究核小体占有率。 基因沙漠被用作阴性对照。显示了一个代表性的实验。 请点击此处查看此图的较大版本。
| 缓冲区名称 | 试剂 | 最终集中 |
| 稀释缓冲液 | 十二烷基钠硫酸基(SDS) | 0.01%(w / v) |
| Triton X-100 | 1.1%(v / v) | |
| 乙二胺四乙酸(EDTA)pH 8.0 | 1.2mM | |
| Tris-HCl pH 8.1 | 16.7mM | |
| 氯化钠(NaCl) | 167mM | |
| DMA解决方案 | 己二酸二甲酯(DMA) | 10 mM |
| 磷酸盐缓冲盐水(PBS) | 1X | |
| 洗脱缓冲液 | 十二烷基硫酸钠(SDS) | 1%(w / v) |
| 乙二胺四乙酸(EDTA)pH 8.0 | 10 mM | |
| Tris-HCl pH 8.0 | 50 mM | |
| 高盐缓冲液 | 十二烷基硫酸钠(SDS) | 0.1%(w / v) |
| Triton X-100 | 1%(v / v) | |
| Ethylenediami净四乙酸(EDTA)pH 8.0 | 2mM | |
| Tris-HCl pH 8.1 | 20 mM | |
| 氯化钠(NaCl) | 500 mM | |
| IMDM介质 | Iscove修改后的Dulbecco介质(IMDM) | 1X |
| 胎牛血清(FBS) | 2%(v / v) | |
| 青霉素/链霉素 | 1X | |
| 蛋白胨primatone | 0.3 mg / mL | |
| 胰岛素溶液人 | 4.8 mg / mL | |
| 最低必需培养基非必需氨基酸(MEM NEAA) | 1X | |
| LiCl盐缓冲液 | 氯化锂(LiCl) | 0.25 M |
| IGEPAL-CA630 | 1%(v / v) | |
| 乙二胺四乙酸(EDTA)pH 8.0 | 1mM | |
| Tris-HCl pH 8。1 | 10 mM | |
| 低盐缓冲液 | 十二烷基硫酸钠(SDS) | 0.1%(w / v) |
| Triton X-100 | 1%(v / v) | |
| 乙二胺四乙酸(EDTA)pH 8.0 | 2mM | |
| Tris-HCl pH 8.1 | 20 mM | |
| 氯化钠(NaCl) | 150 mM | |
| 蛋白A琼脂糖珠洗涤缓冲液 | Tris-HCl pH 8.0 | 20 mM |
| 氯化钠(NaCl) | 500 mM | |
| 乙二胺四乙酸(EDTA)pH 8.0 | 2mM | |
| 十二烷基硫酸钠(SDS) | 0.1%(w / v) | |
| IGEPAL-CA630 | 1%(v / v) | |
| SDS裂解缓冲液 | 十二烷基硫酸钠(SDS) | 1%(w / v) |
| 乙二胺胺四乙酸(EDTA)pH 8.0 | 10 mM | |
| Tris-HCl pH 8.1 | 50 mM | |
| TE缓冲区 | Tris-HCl pH 8.0 | 10 mM |
| 乙二胺四乙酸(EDTA)pH 8.0 | 1mM |
表1:本协议中使用的缓冲区和介质的列表。
| 上 | 关闭 | |
| 峰值功率 | 150.0 | 2.5 |
| 职责因素 | 15.0 | 15.0 |
| 循环/爆裂 | 500 | 500 |
| 循环次数 | 28 | |
表2:本协议中使用的剪切设置。这些条件已针对成熟的小鼠T细胞系进行了优化。
| 抗体 | 供应商 | 抗体量/免疫沉淀 | 细胞数/免疫沉淀 | 洗涤条件 |
| H3 | 阿布卡姆(ab1791) | 2.5毫克 | 5 x 10 6 | 一次在低盐缓冲液中,两次在高盐缓冲液中,两次在LiCl盐缓冲液中,三次在TE缓冲液中 |
| H3K4me1 | 阿布卡姆(ab8895) | 2.5毫克 | 5 x 10 6 | 一次在低盐缓冲液中,两次在高盐缓冲液中,两次在LiCl盐缓冲液中,三次在TE缓冲液中 |
| H3K4me3的 | Diagenode(pAb-003-050) | 2.5毫克 | 5 x 10 6 | 一次在低盐缓冲液中,两次在高盐缓冲液中,两次在LiCl盐缓冲液中,三次在TE缓冲液中 |
| H3K27ac | Diagenode(pAb-174-050) | 2.5毫克 | 5 x 10 6 | Oce在低盐缓冲液中,两次在高盐缓冲液中,两次在LiCl盐缓冲液中,三次在TE缓冲液中 |
| IgG抗体 | Diagenode(C15410206) | 变量* | 变量* | 变量* |
| *在IgG对照的情况下,抗体和细胞以及洗涤步骤的量必须反映其他免疫沉淀的条件。 | ||||
表3:本研究中使用的抗体和洗涤条件。
| 基因 | 正向引物 | 反向引物 | 探测 |
| Gapdh启动子 ( 0kb ) | 5'-GGG TTC CTA TAA ATA CGG ACT GC-3' | 5'-CTG GCA CTG CAC AAG AAG A-3' | 68 |
| Dtx1增强子 (+ 26kb ) | 5'-CTC TGG GTT GTA GGG GAC AG-3' | 5'-GCA TGG GAA CTG TGT TAC AGA A-3' | 27 |
| 基因沙漠 | 5'-CAA TGC ATG GGT CCA GAT TT-3' | 5'-ATT GGC ACG GAA GTA GTG CT-3' | 94 |
表4:本研究中用于qPCR的引物和探针。
| 问题 | 原因 | 解 |
| 染色质处于剪切状态,碎片太大。 | 已经使用了太多的细胞。 | 减少细胞数量。 |
| 剪切太低。 | 增加剪切循环次数。 | |
| 增加剪切峰值功率,占空因数和/或周期/突发。 | ||
| 染色质过度剪切,碎片太小。 | 已经使用的细胞太少了。 | 增加细胞数量。 |
| 剪切太高了。 | 减少剪切循环次数。 | |
| 降低剪切峰值功率,占空因数和/或周期/脉冲串。 | ||
| 我的回收率太低了gG控制和/或阴性对照(高背景)。 | 用于实验的染色质不足。 | 增加染色质量。 |
| 抗体量太低。 | 增加抗体的量。 | |
| 抗体量过高。 | 减少抗体的量。 | |
| 该抗体的特异性低。 | 改变抗体。 | |
| 洗涤条件太严格。 | 减少洗涤次数 | |
| 降低洗涤缓冲液的严格性。 | ||
| 洗涤条件不够严格。 | 增加洗涤次数 | |
| 增加洗涤缓冲液的严格性。 | ||
| 在qPCR中吸取太多的DNA。 | 减少qPCR中吸移的DNA量。 | |
| qPCR条件不是最优的。 | 优化qPCR条件。 | |
| 减少循环次数。 | ||
| 没有产品或产品在输入样品的qPCR反应中太低。 | 在qPCR中没有足够的DNA被吸移。 | 增加qPCR中DNA吸移量。 |
| qPCR条件不是最优的。 | 优化qPCR条件。 | |
| 增加循环次数。 | ||
| 用于实验的染色质不足。 | 增加染色质量。 | |
| 在阳性对照和/或panH3 ChIP中无信号。 | 用于实验的染色质不足。 | 增加染色质量。 |
| 抗体量太低。 | 增加抗体的量。 | |
| 反身体特异性低。 | 改变抗体。 | |
| 洗脱是次优的。 | 一定要频繁地旋转样品,以保持珠粒溶解。 |
表5:故障排除。
讨论
ChIP是一种有效的技术,用于调查蛋白质或其PTM是否在特定基因组区域富集。由于生物或技术原因,ChIP测定结果通常具有挑战性。生物学原因有很多,包括蛋白质与DNA的弱或间接结合。还存在技术限制,例如有限的抗体特异性和低效细胞裂解或染色质剪切。故障排除指南( 表5 )可帮助读者解决ChIP测定可能遇到的问题。
该协议利用冷却聚焦超声波装置,可以有效地剪切成熟的小鼠T细胞系的染色质。协议的主要关键步骤由染色质的剪切表示,染色质必须始终针对每种细胞类型进行优化。建议改变细胞数量和超声处理循环次数。而且,她样品中SDS沉淀物的存在会对培养效率产生负面影响,SDS沉淀缓冲液可能在冰上裂解细胞时形成。在这种情况下,最好在室温下裂解后样品孵育数分钟以减少SDS沉淀物的存在。建议优化方案以获得200至500 bp之间的剪切片段,并在进行免疫沉淀前始终评估样品的剪切质量。此外,必须针对每种抗体优化注射时间,抗体和/或细胞的量以及洗涤条件。
使ChIP程序成功的另一个关键步骤是抗体的选择,因为低特异性抗体显着降低免疫沉淀的效率。以前,统一的质量检测程序允许评估市场上可获得的几种抗体的特异性 ss ="xref"> 19。筛选管道基于斑点印迹,Western印迹和ChIP,提供了适用于ChIP 19的高品质试剂列表。最近,使用高密度组蛋白肽微阵列平台评估了几种市售抗体的特异性,允许建立抗体特异性数据库20 。读者可以使用这个有用的工具来识别可用于ChIP实验的最具体的抗体。
该协议尚未对原始T细胞进行测试,在这种情况下,读者应参考在主要T细胞3,4,21上成功执行ChIP的其他已发布协议。值得注意的是,该方案已经成功地用于在小鼠祖细胞T细胞系以及小鼠内皮细胞系上进行ChIP。
ove_content"> 5×10 6个细胞应用于每次免疫沉淀用于组蛋白标记的分析,因为该方案也可以合适,通过一些优化,在TF或辅因子上进行ChIP,最好增加细胞数量用于这些情况下的免疫沉淀。为了达到每个实验所需数量的细胞,在稀释稀释缓冲液中的染色质稀释之前,可以将更多等分的剪切裂解物合并在一起。也可以修改该方案以对不直接与DNA结合的内源蛋白进行ChIP。在这种情况下,可能需要预先固定蛋白质 - 蛋白质交联剂( 例如,二甲基己二亚胺酯,DMA)(有关更多信息,请参阅附录B )。先前通过过表达与生物素标签融合的蛋白质来实现ChIP对辅因子的成功表现。在这种情况下,用链霉抗生物素蛋白 - 缀合物纯化蛋白质22进行了预先固定的DMA。
披露声明
作者没有竞争的经济利益。
致谢
我们非常感谢P.Käse和T. Schmidt-Wöll的优秀技术援助。这项工作得到了德国研究基金会(DFG)(德国研究基金会),马克斯·普朗克社会和弗莱堡的EXC 294的合作研究资助TRR81和海森堡计划(BO 1639 / 5-1)以及心肺系统(ECCPS)在吉森至TB
材料
| Name | Company | Catalog Number | Comments |
| Agilent High Sensitivity D5000 Reagents | Agilent Technologies | 5067-5593 | |
| Agilent High Sensitivity D5000 ScreenTape | Agilent Technologies | 5067-5592 | |
| Agilent Tapestation 4200 | Agilent Technologies | G2991AA | |
| Covaris S220 AFA System | Covaris | 500217 | |
| dimethyl adipimidate (DMA) | Thermo Fisher Scientific | 20660 | |
| Fetal bovine serum (FBS) | Pan-Biotech | 1502-P121301 | |
| Formaldehyde (FMA) | Sigma-Aldrich | F8775 | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Iscove's modified Dulbecco's medium (IMDM) | Gibco | 21980-032 | |
| Minimum essential medium non-essential amino acids (MEM NEAA) | Gibco | 11140-035 | |
| nProtein A Sepharose 4 Fast Flow | GE Healthcare | 17-5280-02 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Peptone primatone | Sigma-Aldrich | P4963-100G | |
| Phase Lock Gel Heavy 2 mL | 5 Prime | 2302830 | |
| Phenol/chloroform/isoamyl alcohol (25:24:1) | Roth | A156.2 | |
| Phosphate-buffered saline (PBS) | GIBCO | 14190-094 | |
| Proteinase K Solution (20 mg/mL), RNA grade | Thermo Fisher Scientific | 25530049 | |
| QIAquick PCR Purification Kit (250) | Qiagen | 28106 | |
| Qubit 3.0 Fluorometer | Thermo Fisher Scientific | Q33216 | |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32854 | |
| RNase A, DNase and protease-free (10 mg/mL) | Thermo Fisher Scientific | EN0531 | |
| Tube AFA Fiber & Cap | Covaris | 520081 |
参考文献
- Rothenberg, E. V. The chromatin landscape and transcription factors in T cell programming. Trends Immunol. 35 (5), 195-204 (2014).
- Zhang, J. A., Mortazavi, A., Williams, B. A., Wold, B. J., Rothenberg, E. V. Dynamic transformations of genome-wide epigenetic marking and transcriptional control establish T cell identity. Cell. 149 (2), 467-482 (2012).
- Cauchy, P., et al. Dynamic recruitment of Ets1 to both nucleosome-occupied and -depleted enhancer regions mediates a transcriptional program switch during early T-cell differentiation. Nucl Acids Res. 44 (8), 3567-3585 (2016).
- Koch, F., et al. Transcription initiation platforms and GTF recruitment at tissue-specific enhancers and promoters. Nat Struct Mol Biol. 18 (8), 956-963 (2011).
- Pekowska, A., et al. H3K4 tri-methylation provides an epigenetic signature of active enhancers. EMBO J. 30 (20), 4198-4210 (2011).
- Vanhille, L., et al. High-throughput and quantitative assessment of enhancer activity in mammals by CapStarr-seq. Nat Commun. 6, 6905(2015).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Heintzman, N. D., et al. Histone modifications at human enhancers reflect global cell-type-specific gene expression. Nature. 459 (7243), 108-112 (2009).
- Ernst, J., et al. Mapping and analysis of chromatin state dynamics in nine human cell types. Nature. 473 (7345), 43-49 (2011).
- Ostuni, R., et al. Latent enhancers activated by stimulation in differentiated cells. Cell. 152 (1-2), 157-171 (2013).
- Giaimo, B. D., Oswald, F., Borggrefe, T. Dynamic chromatin regulation at Notch target genes. Transcription. 8 (1), 61-66 (2017).
- Liefke, R., et al. Histone demethylase KDM5A is an integral part of the core Notch-RBP-J repressor complex. Genes Dev. 24 (6), 590-601 (2010).
- Jung, C., Mittler, G., Oswald, F., Borggrefe, T. RNA helicase Ddx5 and the noncoding RNA SRA act as coactivators in the Notch signaling pathway. Biochim Biophys Acta. 1833 (5), 1180-1189 (2013).
- Oswald, F., et al. A phospho-dependent mechanism involving NCoR and KMT2D controls a permissive chromatin state at Notch target genes. Nucl Acids Res. 44 (10), 4703-4720 (2016).
- Arrigoni, L., et al. Standardizing chromatin research: a simple and universal method for ChIP-seq. Nucl Acids Res. 44 (7), e67(2016).
- Essen, D., Dullforce, P., Brocker, T., Gray, D. Cellular interactions involved in Th cell memory. J Immunol. 165 (7), 3640-3646 (2000).
- White, J., et al. Two better cell lines for making hybridomas expressing specific T cell receptors. J Immunol. 143 (6), 1822-1825 (1989).
- Ghisletti, S., et al. Identification and characterization of enhancers controlling the inflammatory gene expression program in macrophages. Immunity. 32 (3), 317-328 (2010).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat Struct Mol Biol. 18 (1), 91-93 (2011).
- Rothbart, S. B., et al. An Interactive Database for the Assessment of Histone Antibody Specificity. Mol Cell. 59 (3), 502-511 (2015).
- Fenouil, R., et al. CpG islands and GC content dictate nucleosome depletion in a transcription-independent manner at mammalian promoters. Genome Res. 22 (12), 2399-2408 (2012).
- Hein, K., et al. Site-specific methylation of Notch1 controls the amplitude and duration of the Notch1 response. Sci Signal. 8 (369), ra30(2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。