Method Article
マウスT細胞株におけるクロマチン免疫沈降(ChIP)
要約
この研究は、成熟マウスT細胞株を用いたクロマチン免疫沈降(ChIP)のためのプロトコールを記載している。このプロトコルは、特定のプロモーター部位またはゲノムワイドにおける特定のヒストンマークの分布を調べるのに適しています。
要約
シグナル伝達経路は、ヒストン尾部の翻訳後修飾(PTM)、ヒストン変異体との標準的ヒストンの交換、およびヌクレオソーム退化など、異なるレベルでのクロマチン構造の調節を介して遺伝子発現プログラムを調節する。そのような調節は、エンハンサーとして規定された調節エレメントでクロマチン修飾酵素を補充するシグナル感受性転写因子(TF)の結合を必要とする。シグナリングカスケードがエンハンサー活性を調節する方法を理解するには、TF、クロマチン修飾酵素の結合、および特定のヒストンマークとヒストン変異体の占有の包括的な分析が必要です。クロマチン免疫沈降(ChIP)アッセイは、特異的タンパク質/ DNA複合体を免疫沈降させるために高度に特異的な抗体を利用する。精製DNAのその後の分析は、抗体によって認識されるタンパク質が占める領域を同定することを可能にする。この作業では、効率的にperform成熟マウスT細胞株におけるヒストンタンパク質のChIP。提示されたプロトコールは、妥当な時間枠内で高い再現性でChIPアッセイの実施を可能にする。
概要
発達、分化およびホメオスタシスは、クロマチン構造を調節し、したがって特定の遺伝子が細胞および時間特異的に活性化されるか、または抑制されるかを決定するシグナル伝達事象によって確立される特定の遺伝子発現プログラムに依存する。 T細胞発達中に、いくつかの中間段階1を経て、二重陰性(DN)から単一陽性(SP)状態へのT細胞前駆体の成熟を適切に決定するために、特定の遺伝子発現プログラムを確立しなければならない。遺伝子発現プログラムがT細胞発達中にどのように動的に調節されるかは、過去数年にいくつかの研究室によって幅広く研究されてきた2、3、4、5、6。
ヒストンの翻訳後修飾(PTM)により、ヒストン変異体を有する標準的なヒストン、ヌクレオソーム退縮、およびDNAメチル化は、遺伝子のON / OFFスイッチを調節する。いくつかのグループが、PTMおよびヒストン変異体のゲノムワイド分布を調査して、近位および遠位の調節領域7,8,9,10の異なるクロマチン状態に関連する痕跡を決定した。シグナリングカスケードは、特定のエンハンサー要素での陽性および陰性のクロマチン修飾酵素(クロマチン修飾因子としても知られている)の交換を介して、動的クロマチン制御を調整する。これらのクロマチン修飾因子は、例えばダイナミックヒストンのメチル化およびアセチル化によるクロマチン構造および従って転写産物を調節する。これは、Notchシグナル伝達経路11,12,13 、14。
動的ヒストンPTM;ヒストン変異体との交換;ヒストン、転写因子、および補因子の動的占有率は、クロマチン免疫沈降(ChIP)アッセイによって調べることができる。高度に特異的な抗体を用いて特定のDNA-タンパク質複合体を精製し、精製されたDNAを定量PCR(qPCR)によって分析する。ディープシーケンシング(ChIP-Seq);今日では、マイクロアレイへのハイブリダイゼーション(ChIP-ChIP)の頻度は低い。
ChIPアッセイは、細胞の溶解、クロマチンの剪断および/または抗体の低特異性による合併症のために時々困難である。 NEXSON 15の場合のように、プロトコルを改善するためのいくつかの戦略が採用されています。冷却水浴ソニケーターの使用は、調査中のタンパク質上に存在するエピトープに損傷を与える試料加熱を回避するが、試料のせん断に必要なエネルギーは水中に分散する。エネルギーの分散を防止する集束超音波装置の開発により、別の改良がなされた。したがって、集束超音波装置は、細胞溶解およびクロマチン剪断の改善を可能にし、オペレーター誘発変異を排除し、再現性を有意に増加させる。
この研究は、E2-10HA 16,17と呼ばれる成熟マウスT細胞系においてヒストンタンパク質のChIPを効率的に行うためのプロトコール( 図1の概略図 )を説明している。 T細胞は通常溶解するのが困難であり、そのクロマチンのせん断は非効率的であることが明らかにされている。冷却された集束超音波装置を使用するこのプロトコールでは、細胞数、溶解緩衝液、およびせん断設定が、E2-10HAマウスT細胞株について最適化された。このプロトコルは、高い再現性と妥当な時間でChIPを実行することを可能にする。実際には、それはrequirクロマチンを剪断して剪断の質を評価するおよそ2日間、免疫沈降を行い、架橋を逆転させ、DNAを精製するために3日間。
プロトコル
注:このプロトコルで使用されるすべてのバッファーと培地は、 表1にリストされています。
1日目と2日目
1.細胞の架橋
- マウスT細胞を6ウェルプレートから50 mLチューブに移し、4℃および271 x gで5分間遠心分離します。細胞ペレットを30mLのIMDM細胞培養培地に再懸濁し、Neubauerチャンバーを用いて細胞を計数する。
- 新しい50mLチューブに20×10 6細胞のアリコートを集める。
- ホルムアルデヒド(FMA)を最終濃度1%に細胞培養培地に直接添加し、室温で10分間インキュベートする。
注意:FMAは吸入すると有毒ですので、フュームフードの下で作業し、適切な保護具を着用してください。また、ホスト機関の規則に従ってFMA廃棄物を処理してください。 - 1/8容量の1Mグリシン(pH7.0)を加え、室温で5分間インキュベートする。
- 5分間遠心分離して細胞をペレット化する。4℃および〜271×gで10分間インキュベートし、10mLのリン酸緩衝生理食塩水(PBS)で洗浄する。
- 1mLのPBSで細胞ペレットを洗浄し、1.5mLチューブに移す。
2.細胞溶解およびクロマチンのせん断
- 細胞ペレットを1mLのSDS溶解バッファーに再懸濁し、氷上で10分間インキュベートする。
- 各サンプルを超音波処理チューブに移し、集束超音波装置を用いて表2に示す設定に従ってせん断を行う。
- せん断後、サンプルを1.5 mLのチューブに移し、4℃および約18,000 x gで10分間遠心分離します。
- 上清を新しいチューブに移す。
- ステップ3に従って剪断効率を決定するために50μLを集め、剪断された溶解物を液体窒素中でスナップ凍結する。ライセートを一度に使用するアリコートに-80℃で保存する。
3.せん断効率の決定
- 溶出バッファー50μLを50&各剪断された溶解物の181μLを加え、振盪しながら65℃で一晩インキュベートする。
- 100μLのTE緩衝液と4μLの10mg / mL RNase A(最終濃度0.2μg/μL)を添加する。混合し、37℃で2時間、振とうしながらインキュベートする。
- 2μLの20mg / mLプロテイナーゼK(0.2μg/μL最終濃度)を各サンプルに添加し、振盪しながら55℃で2時間インキュベートする。
- 各サンプルをフェノール/クロロホルム/イソアミルアルコール抽出に適したゲルチューブに移す。製造者の指示に従って取り扱ってください。
- フェノール/クロロホルム/イソアミルアルコール(25:24:1)200μLを加え、チューブを振とうする。 24℃、〜16,000×gで5分間遠心分離し、上相を新しいチューブに移す。
注意:フェノール、クロロホルム、イソアミルアルコールは吸入すると有毒で腐食性があります。ヒュームフードの下で作業し、適切な個人用保護具を着用する。また、フェノール、クロロホルム、イソアミルアルコール廃棄物処理ホスト機関の規則に従う。- 一度繰り返します。
- 以下の変更を加えて、製造者の指示に従って精製カラムを使用してDNAを精製する:
- メンブレンを2回洗浄する。最後の洗浄の後、チューブを室温で2分間開いたままにして、残留エタノールを蒸発させる。
- 溶出のために、50μLのH 2 Oを添加し、室温で1分間インキュベートし、膜を適切に濡らすためにチューブを1分間回転させ、室温で1分間インキュベートした後、1分間遠心分離によってDNAを溶出する。 24℃〜17,900×g。
- 高感度キットを使用して、製造業者の指示に従って、精製したDNAを蛍光光度計で定量する。
- 1.8%アガロースゲル上で約500ngの精製DNAを分析し、高感度キットを用いて電気泳動システムで約1ngを分析する。
注:予想されるsizeは200〜500bpである。
3日目と4日目
免疫沈降
- 剪断された溶解物の1容量を5倍量の希釈バッファーで希釈する。
- 30μL/ mLのプロテインAアガロースビーズ( 付録Aに従って調製)を30分間冷蔵室で回転させながら予め洗浄する。
- 〜750 x gで5分間4℃で遠心分離する。
- 入力の10%を収集し、4℃で保存する。
- 新しいチューブに所望量のライセートを分注する(詳細は表3を参照)。各チューブに目的の抗体を加え(詳細は表3を参照)、4℃で一晩回転させます。
- 40μLのプロテインAビーズを添加し、回転させながら4℃で1時間インキュベートする。
- ビーズを低塩緩衝液、高塩緩衝液、LiCl緩衝液、およびTE緩衝液(各洗浄のために、4℃で5分間、回転および遠心分離しながらインキュベートする)で洗浄する。4℃で3分間、〜950×g)。詳細は表3を参照してください。
- 110μLの溶出緩衝液を添加し、室温で15分間インキュベートし、2分ごとにボルテックスする。
- 4℃、〜950×gで3分間遠心分離し、100μLの上清を新しい1.5mLチューブに移す。
- 溶出バッファー100μLでステップ4.7-4.8を繰り返し、溶出液を合わせます。サンプルを入力するために200μLまでの溶出バッファーを添加する。
- すべてのサンプルを振盪しながら65℃で一晩インキュベートする。
5日目
DNA精製
- 各溶出液にTEバッファー200μLと10 mg / mL RNase A(最終濃度0.2μg/μL)8μLを加えます。混合し、37℃で2時間、振とうしながらインキュベートする。
- 各溶出液に20 mg / mLプロテイナーゼK(0.2μg/μL最終濃度)4μLを添加し、振とうしながら55°Cで2時間インキュベートする。
- 各サンプルをゲルに移すフェノール/クロロホルム/イソアミルアルコール抽出に適したチューブ;製造者の指示に従って取り扱ってください。
- 400μLのフェノール/クロロホルム/イソアミルアルコール(25:24:1)を加え、チューブを振とうする。 24℃および〜16,000×gで5分間遠心分離する。上層を新しいチューブに移す。
注意:フェノール、クロロホルム、イソアミルアルコールは吸入すると有毒で腐食性があります。ヒュームフードの下で作業し、適切な個人用保護具を着用する。また、ホスト機関の規則に従って、フェノール、クロロホルム、イソアミルアルコールの廃棄物を処理してください。- 一度繰り返します。
- 以下の変更を加えて、製造者の指示に従って精製カラムを用いてDNAを精製する:
- メンブレンを2回洗浄する。最後の洗浄後、室温で2分間チューブを開いたままにして、残留エタノールを蒸発させる。
- 溶出のために、50μLのH 2 Oを加え、室温でインキュベートする1分間インキュベートし、膜を適切に濡らすためにチューブを1分間回転させ、室温で1分間インキュベートした後、24℃で1分間遠心分離してDNAを溶出させ、約17,900×gで溶出する。
結果
成熟マウスT細胞をChIP分析に供し、ヒストン3(H3K4me1)上のリジン4モノメチル化、ヒストン3上のリジン4のトリメチル化(H3K4me3)、およびリジン27のアセチル化ヒストン3(H3K27ac)、ならびにpanH3 ChIPによって明らかにされるように、ヌクレオソーム占有率。せん断品質は、1.8%アガロースゲル( 図2A )および電気泳動システム( 図2B )の分析によって評価した。 H3K4me1およびH3K4me3は、それぞれ、エンハンサー部位およびプロモーターを同定するために一般的に使用される( 図3A )。実際に、H3K4me3は、プロモーター5,8,14において顕著であるが、排他的ではない。活性エンハンサーの特徴は、H3K4me1およびH3K27acに対して高度に富化され、H3K4me3(<一方、不活性エンハンサーは、H3K4me3およびH3K27acの低レベルであるが、高レベルのH3K4me1を示す( 図3A 、下のパネル)。 図3Bに示すように、 グリセルアルデヒド3-リン酸デヒドロゲナーゼ ( Gapdh )遺伝子は、活性遺伝子プロモーター ( Gapdhプロモーター )の分析の代表である。実際、それはH3K4me3およびH3K27acの高レベルおよびH3K4me1の低レベルを示す。 図3Bにおいて、 Deltex1 ( Dtx1 )は、H3K4me1が高度に富化され、H3K4me3およびH3K27acがほとんど濃縮されていないので、不活性エンハンサー( Dtx1エンハンサー )の代表である。 遺伝子砂漠は、コード遺伝子を欠いている領域の代表であり、通常、活性クロマチンマークの陰性対照として提出されている。 H3K4me1、よく受け入れられているエンハンサーマーカーである4,5 、 7,14,18は、 遺伝子の砂漠では豊かではないが、この地域にはエンハンサーがないことが示唆されている。
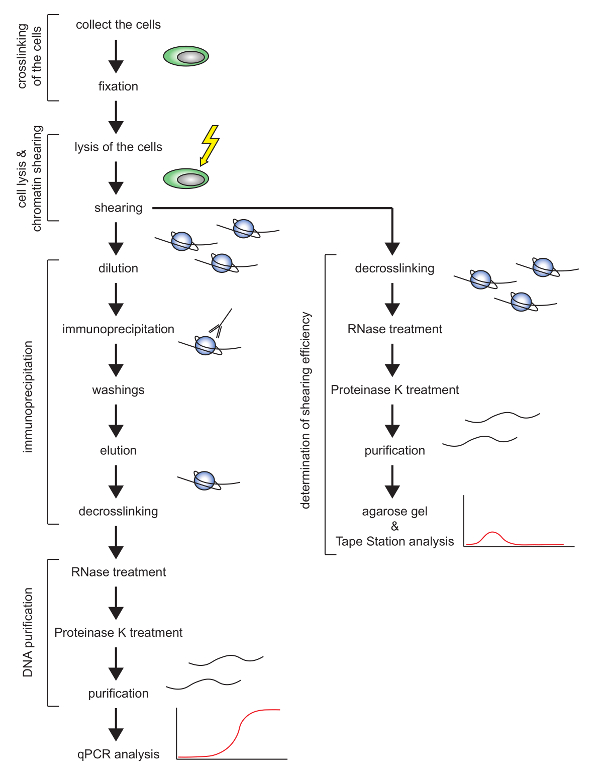
図1:提示されたChIPプロトコルの概略図。 この図の拡大版を見るには、ここをクリックしてください。
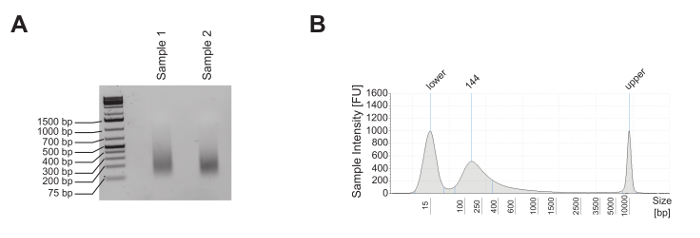
図2:成熟マウスT細胞株のシャーリング品質管理。 ( A )成熟マウスT細胞株E2-10HAの2つの異なるアリコートをせん断し、約500ngの精製DNAを1.8%アガロースゲルで分析して、それらのせん断を評価した品質。 ( B )試料2の精製DNA1ngを電気泳動で分析し、その剪断品質を評価した。 この図の拡大版を見るには、ここをクリックしてください。
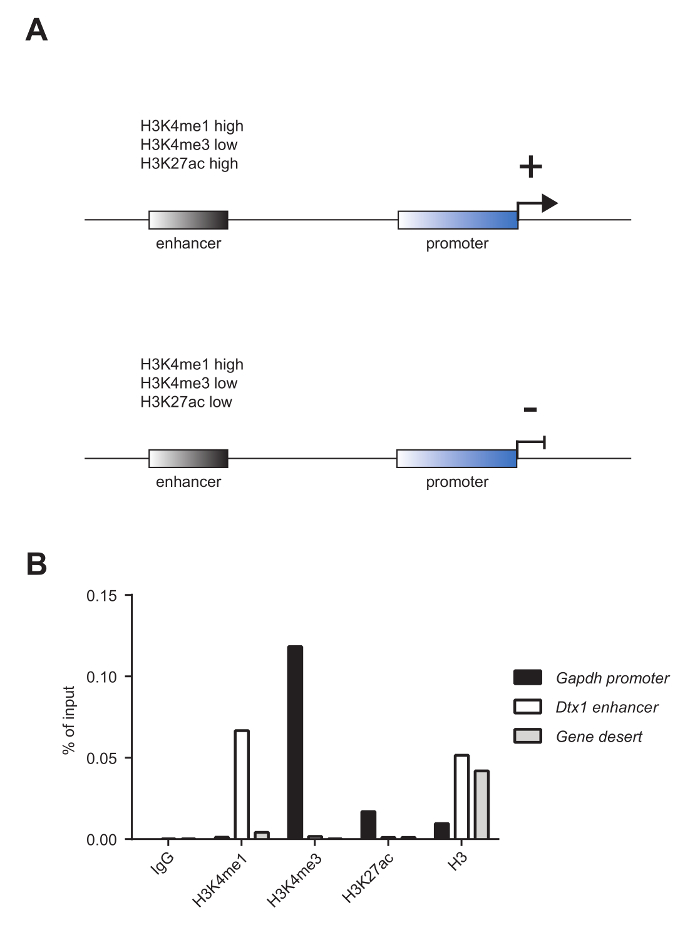
図3:エンハンサーおよびプロモーターを特徴付けるクロマチンマーク。 ( A )活性型エンハンサー(上パネル)は、高H3K4me1、低H3K4me3、および高H3K27acを特徴とするが、不活性エンハンサー(下パネル)は高H3K4me1、低H3K4me3および低H3K27acを示す。 ( B ) 図2Aに提示されたサンプルを一緒にプールし、panH3 ChIPによって明らかにされるように、ChIP分析対ヒストンマークH3K4me1、H3K4me3、およびH3K27acおよびヒストン占有に使用した。この分析は、( Gapdhプロモーター )は、H3K4me3およびH3K27acに対して高度に富化され、H3K4me1に対しては低濃度に濃縮される。一方、不活性遺伝子Deltex1 ( Dtx1エンハンサー )のエンハンサーは、 H3K4me1に対して高度に濃縮されているが、H3K4me3およびH3K27acにはほとんど濃縮されていない。 panH3抗体を用いたChIPを用いてヌクレオソーム占有率を調べた。 遺伝子砂漠を陰性対照として用いた。 1つの代表的な実験が示されている。 この図の拡大版を見るには、ここをクリックしてください。
| バッファの名前 | 試薬 | 最終濃度 |
| 希釈緩衝液 | ナトリウムドデック(SDS) | 0.01%(w / v) |
| トリトンX-100 | 1.1%(v / v) | |
| エチレンジアミン四酢酸(EDTA)pH8.0 | 1.2mM | |
| トリス-HCl pH 8.1 | 16.7mM | |
| 塩化ナトリウム(NaCl) | 167mM | |
| DMA溶液 | ジメチルアジピミデート(DMA) | 10mM |
| リン酸緩衝食塩水(PBS) | 1倍 | |
| 溶出バッファー | ドデシル硫酸ナトリウム(SDS) | 1%(w / v) |
| エチレンジアミン四酢酸(EDTA)pH8.0 | 10mM | |
| トリス-HCl pH 8.0 | 50mM | |
| 高塩濃度緩衝液 | ドデシル硫酸ナトリウム(SDS) | 0.1%(w / v) |
| トリトンX-100 | 1%(v / v) | |
| エチレンジアミネトラテトラ酢酸(EDTA)pH8.0 | 2mM | |
| トリス-HCl pH 8.1 | 20mM | |
| 塩化ナトリウム(NaCl) | 500mM | |
| IMDM媒体 | イスコフ改変ダルベッコ培地(IMDM) | 1倍 |
| ウシ胎児血清(FBS) | 2%(v / v) | |
| ペニシリン/ストレプトマイシン | 1倍 | |
| ペプトンプリマトン | 0.3mg / mL | |
| ヒトインスリン溶液 | 4.8mg / mL | |
| 最小必須培地非必須アミノ酸(MEM NEAA) | 1倍 | |
| LiCl塩緩衝液 | 塩化リチウム(LiCl) | 0.25M |
| IGEPAL-CA630 | 1%(v / v) | |
| エチレンジアミン四酢酸(EDTA)pH8.0 | 1mM | |
| トリス-HCl pH8。1 | 10mM | |
| 低塩分緩衝液 | ドデシル硫酸ナトリウム(SDS) | 0.1%(w / v) |
| トリトンX-100 | 1%(v / v) | |
| エチレンジアミン四酢酸(EDTA)pH8.0 | 2mM | |
| トリス-HCl pH 8.1 | 20mM | |
| 塩化ナトリウム(NaCl) | 150mM | |
| プロテインAセファロースビーズ洗浄バッファー | トリス-HCl pH 8.0 | 20mM |
| 塩化ナトリウム(NaCl) | 500mM | |
| エチレンジアミン四酢酸(EDTA)pH8.0 | 2mM | |
| ドデシル硫酸ナトリウム(SDS) | 0.1%(w / v) | |
| IGEPAL-CA630 | 1%(v / v) | |
| SDS溶解緩衝液 | ドデシル硫酸ナトリウム(SDS) | 1%(w / v) |
| エチレンジアミンアミノテトラ酢酸(EDTA)pH8.0 | 10mM | |
| トリス-HCl pH 8.1 | 50mM | |
| TE緩衝液 | トリス-HCl pH 8.0 | 10mM |
| エチレンジアミン四酢酸(EDTA)pH8.0 | 1mM |
表1:このプロトコルで使用されるバッファおよび媒体のリスト。
| に | オフ | |
| 最大電力 | 150.0。 | 2.5 |
| デューティファクタ | 15.0 | 15.0 |
| サイクル/バースト | 500 | 500 |
| サイクル数 | 28 | |
表2:このプロトコルで使用されるシャーリング設定。これらの条件は、成熟マウスT細胞株に対して最適化されている。
| 抗体 | サプライヤー | 抗体/免疫沈降の量 | 細胞量/免疫沈降 | 洗濯条件 |
| H3 | アブカム(ab1791) | 2.5 mg | 5×10 6 | いったん低塩緩衝液に入れ、高塩緩衝液で2回、LiCl塩緩衝液で2回、TE緩衝液で3回 |
| H3K4me1 | アブカム(ab8895) | 2.5 mg | 5×10 6 | いったん低塩緩衝液に入れ、高塩緩衝液で2回、LiCl塩緩衝液で2回、TE緩衝液で3回 |
| H3K4me3 | ジアゲノド(pAb-003-050) | 2.5 mg | 5×10 6 | いったん低塩緩衝液に入れ、高塩緩衝液で2回、LiCl塩緩衝液で2回、TE緩衝液で3回 |
| H3K27ac | ジアゲノイド(pAb-174-050) | 2.5 mg | 5×10 6 | 低塩緩衝液中のOce、高塩濃度緩衝液中で2回、LiCl塩緩衝液中で2回およびTE緩衝液中で3回 |
| IgG | ジアゲノド(C15410206) | 変数* | 変数* | 変数* |
| IgGコントロールの場合、抗体および細胞の両方の量、ならびに洗浄工程は、他の免疫沈降の条件を反映しなければならない。 | ||||
表3:本研究で用いた抗体および洗浄条件。
| 遺伝子 | フォワードプライマー | リバースプライマー | プローブ |
| Gapdhプロモーター (0kb) | 5'-GGG TTC CTA TAA ATA CGG ACT GC-3 ' | 5'-CTG GCA CTG CAC AAG AAG A-3 ' | 68 |
| Dtx1エンハンサー (+ 26kb ) | 5'-CTC TGG GTT GTA GGG GAC AG-3 ' | 5'-GCA TGG GAA CTG TGT TAC AGA A-3 ' | 27 |
| 遺伝子砂漠 | 5'-CAA TGCATGGGTCCAGATTT-3 ' | 5'-ATT GGC ACG GAA GTA GTG CT-3 ' | 94 |
表4:この研究におけるqPCRに使用されるプライマーおよびプローブ。
| 問題 | 原因 | 溶液 |
| クロマチンは剪断されており、断片は大きすぎます。 | あまりにも多くの細胞が使用されている。 | 細胞の数を減らす。 |
| せん断が低すぎます。 | せん断サイクル数を増やす。 | |
| せん断ピーク電力、デューティファクタおよび/またはサイクル/バーストを増加させる。 | ||
| クロマチンが剪断され、断片が小さすぎます。 | 使用された細胞が少なすぎます。 | 細胞の数を増やす。 |
| せん断が高すぎます。 | せん断サイクル数を減らす。 | |
| せん断ピーク電力、デューティファクタおよび/またはサイクル/バーストを低減する。 | ||
| 私よりも回復が低すぎるgGコントロールおよび/またはネガティブコントロール(高いバックグラウンド)。 | 実験に使用されるクロマチンが足りません。 | クロマチンの量を増やす。 |
| 抗体の量が少なすぎます。 | 抗体の量を増やしてください。 | |
| 抗体の量が多すぎます。 | 抗体の量を減らす。 | |
| この抗体は特異性が低い。 | 抗体を交換する。 | |
| 洗濯条件が厳しすぎる。 | 洗濯回数を減らす。 | |
| 洗浄バッファーのストリンジェンシーを下げてください。 | ||
| 洗濯条件は厳格ではありません。 | 洗濯回数を増やしてください。 | |
| 洗浄バッファーのストリンジェンシーを増加させます。 | ||
| qPCRには多量のDNAをピペットで分注した。 | qPCRでピペッティングされたDNAの量を減らす。 | |
| qPCR条件は最適ではない。 | qPCR条件を最適化する。 | |
| サイクル数を減らしてください。 | ||
| 入力サンプルのqPCR反応が低すぎる製品も製品もありません。 | 十分なDNAがqPCRにピペッティングされていません。 | qPCRでピペッティングされたDNAの量を増やします。 |
| qPCR条件は最適ではない。 | qPCR条件を最適化する。 | |
| サイクル数を増やしてください。 | ||
| 実験に使用されるクロマチンが足りません。 | クロマチンの量を増やす。 | |
| 陽性対照および/またはpanH3 ChIPにシグナルがない。 | 実験に使用されるクロマチンが足りません。 | クロマチンの量を増やす。 |
| 抗体の量が少なすぎます。 | 抗体の量を増やしてください。 | |
| アンチ体は特異性が低い。 | 抗体を交換する。 | |
| 溶出は最適ではない。 | 溶液中でビーズを維持するために、サンプルを頻繁にボルテックスしてください。 |
表5:トラブルシューティング
ディスカッション
ChIPは、タンパク質またはそのPTMが特定のゲノム領域で富化されているかどうかを調べる有効な技術である。 ChIPアッセイの結果は、生物学的または技術的理由により解釈するのが困難なことが多い。生物学的理由は多種多様であり、タンパク質のDNAへの弱いまたは間接的な結合を含む。限られた抗体特異性および非効率的な細胞溶解またはクロマチン剪断などの技術的限界もある。トラブルシューティングガイド( 表5 )は、ChIPアッセイで遭遇する可能性のある問題を解決するのに役立ちます。
このプロトコルは、冷却された集束超音波装置を利用して、成熟マウスT細胞株のクロマチンを効率的に剪断することを可能にする。プロトコルの主な重要なステップは、各細胞タイプに対して常に最適化されなければならないクロマチンのせん断によって表される。細胞の数および超音波処理サイクルの数を変えることが示唆されている。さらに、彼女は効率は、SDS溶解バッファーを用いて氷上で細胞を溶解する間に形成される試料中のSDS沈殿物の存在によって悪影響を受ける。この場合、SDS沈殿物の存在を減少させるために、室温で数分間、溶解後に試料をインキュベートすることが最善である。 200〜500 bpのせん断断片を得るためにプロトコールを最適化し、免疫沈降を続ける前に試料のせん断品質を常に評価することが推奨される。さらに、固定時間、抗体および/または細胞の量、および洗浄条件は、各抗体について最適化されなければならない。
低特異性抗体が免疫沈降の効率を著しく低下させるので、ChIP手順を成功させるためのもう1つの重要なステップは、抗体の選択である。以前は、統一された品質試験手順により、市販されているいくつかの抗体の特異性を評価することができました ss = "xref"> 19。スクリーニングパイプラインは、ドットブロット、ウエスタンブロット、およびChIPに基づいており、ChIP 19に適した高品質の試薬のリストを提供しています。より最近、いくつかの市販の抗体の特異性を、高密度ヒストンペプチドマイクロアレイプラットフォームを用いて評価し、抗体特異性に関するデータベースの確立を可能にした20 。読者は、この有用なツールを用いて、ChIP実験に使用できる最も特異的な抗体を同定することができる。
このプロトコールは一次T細胞については試験されておらず、この場合、読者は一次T細胞上でChIPを首尾よく行う他の公表されたプロトコール3,4,21を参照すべきである。特に、このプロトコルは、マウス前駆細胞T細胞系およびマウス内皮細胞系でChIPを行うのに首尾よく使用されている。
このプロトコールは、いくつかの最適化を伴って、TFまたは補因子についてChIPを実施するのにも適しているので、細胞の数を増やすことが最も好ましい各実験に必要な細胞数に達するために、剪断された溶解物のより多くのアリコートを、希釈緩衝液中でクロマチンを希釈する前に一緒にプールすることができる。このプロトコールは、DNAに直接結合しない内在性タンパク質に対してChIPを行うように改変することもできる。この場合、タンパク質 - タンパク質架橋剤( 例えば、ジメチルアジピミデート、DMA)による前固定が必要となり得る(詳細については付録Bを参照)。補因子に対するChIPの成功した性能は、以前にビオチンタグに融合したタンパク質を過剰発現させることによって行われていた。この場合、タンパク質をストレプトアビジンコンジュゲート磁気ビーズを塗布し、DMAによる前固定を行った22 。
開示事項
著者には競合する金銭的利益はない。
謝辞
優れた技術支援をしてくださったP.Käse氏とT. Schmidt-Wöll氏に感謝します。この研究は、DFG(ドイツ研究財団)、フライブルクのマックスプランク学会とEXC 294の共同研究助成金TRR81とハイゼンベルグプログラム(BO 1639 / 5-1)と、心肺システムのエクセレンスクラスターGiessenからTBまで
資料
| Name | Company | Catalog Number | Comments |
| Agilent High Sensitivity D5000 Reagents | Agilent Technologies | 5067-5593 | |
| Agilent High Sensitivity D5000 ScreenTape | Agilent Technologies | 5067-5592 | |
| Agilent Tapestation 4200 | Agilent Technologies | G2991AA | |
| Covaris S220 AFA System | Covaris | 500217 | |
| dimethyl adipimidate (DMA) | Thermo Fisher Scientific | 20660 | |
| Fetal bovine serum (FBS) | Pan-Biotech | 1502-P121301 | |
| Formaldehyde (FMA) | Sigma-Aldrich | F8775 | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Iscove's modified Dulbecco's medium (IMDM) | Gibco | 21980-032 | |
| Minimum essential medium non-essential amino acids (MEM NEAA) | Gibco | 11140-035 | |
| nProtein A Sepharose 4 Fast Flow | GE Healthcare | 17-5280-02 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Peptone primatone | Sigma-Aldrich | P4963-100G | |
| Phase Lock Gel Heavy 2 mL | 5 Prime | 2302830 | |
| Phenol/chloroform/isoamyl alcohol (25:24:1) | Roth | A156.2 | |
| Phosphate-buffered saline (PBS) | GIBCO | 14190-094 | |
| Proteinase K Solution (20 mg/mL), RNA grade | Thermo Fisher Scientific | 25530049 | |
| QIAquick PCR Purification Kit (250) | Qiagen | 28106 | |
| Qubit 3.0 Fluorometer | Thermo Fisher Scientific | Q33216 | |
| Qubit assay tubes | Thermo Fisher Scientific | Q32856 | |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32854 | |
| RNase A, DNase and protease-free (10 mg/mL) | Thermo Fisher Scientific | EN0531 | |
| Tube AFA Fiber & Cap | Covaris | 520081 |
参考文献
- Rothenberg, E. V. The chromatin landscape and transcription factors in T cell programming. Trends Immunol. 35 (5), 195-204 (2014).
- Zhang, J. A., Mortazavi, A., Williams, B. A., Wold, B. J., Rothenberg, E. V. Dynamic transformations of genome-wide epigenetic marking and transcriptional control establish T cell identity. Cell. 149 (2), 467-482 (2012).
- Cauchy, P., et al. Dynamic recruitment of Ets1 to both nucleosome-occupied and -depleted enhancer regions mediates a transcriptional program switch during early T-cell differentiation. Nucl Acids Res. 44 (8), 3567-3585 (2016).
- Koch, F., et al. Transcription initiation platforms and GTF recruitment at tissue-specific enhancers and promoters. Nat Struct Mol Biol. 18 (8), 956-963 (2011).
- Pekowska, A., et al. H3K4 tri-methylation provides an epigenetic signature of active enhancers. EMBO J. 30 (20), 4198-4210 (2011).
- Vanhille, L., et al. High-throughput and quantitative assessment of enhancer activity in mammals by CapStarr-seq. Nat Commun. 6, 6905(2015).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Heintzman, N. D., et al. Histone modifications at human enhancers reflect global cell-type-specific gene expression. Nature. 459 (7243), 108-112 (2009).
- Ernst, J., et al. Mapping and analysis of chromatin state dynamics in nine human cell types. Nature. 473 (7345), 43-49 (2011).
- Ostuni, R., et al. Latent enhancers activated by stimulation in differentiated cells. Cell. 152 (1-2), 157-171 (2013).
- Giaimo, B. D., Oswald, F., Borggrefe, T. Dynamic chromatin regulation at Notch target genes. Transcription. 8 (1), 61-66 (2017).
- Liefke, R., et al. Histone demethylase KDM5A is an integral part of the core Notch-RBP-J repressor complex. Genes Dev. 24 (6), 590-601 (2010).
- Jung, C., Mittler, G., Oswald, F., Borggrefe, T. RNA helicase Ddx5 and the noncoding RNA SRA act as coactivators in the Notch signaling pathway. Biochim Biophys Acta. 1833 (5), 1180-1189 (2013).
- Oswald, F., et al. A phospho-dependent mechanism involving NCoR and KMT2D controls a permissive chromatin state at Notch target genes. Nucl Acids Res. 44 (10), 4703-4720 (2016).
- Arrigoni, L., et al. Standardizing chromatin research: a simple and universal method for ChIP-seq. Nucl Acids Res. 44 (7), e67(2016).
- Essen, D., Dullforce, P., Brocker, T., Gray, D. Cellular interactions involved in Th cell memory. J Immunol. 165 (7), 3640-3646 (2000).
- White, J., et al. Two better cell lines for making hybridomas expressing specific T cell receptors. J Immunol. 143 (6), 1822-1825 (1989).
- Ghisletti, S., et al. Identification and characterization of enhancers controlling the inflammatory gene expression program in macrophages. Immunity. 32 (3), 317-328 (2010).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat Struct Mol Biol. 18 (1), 91-93 (2011).
- Rothbart, S. B., et al. An Interactive Database for the Assessment of Histone Antibody Specificity. Mol Cell. 59 (3), 502-511 (2015).
- Fenouil, R., et al. CpG islands and GC content dictate nucleosome depletion in a transcription-independent manner at mammalian promoters. Genome Res. 22 (12), 2399-2408 (2012).
- Hein, K., et al. Site-specific methylation of Notch1 controls the amplitude and duration of the Notch1 response. Sci Signal. 8 (369), ra30(2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved