Method Article
多井板膜插入系统中3D 组织模型渗透扩散的测定与模拟方法
摘要
提出了一种用于多井板和在硅片中的膜插入系统中渗透率的测定方法, 并利用仿真对扩散系数进行了优化计算。
摘要
体外培养的皮肤模型已经越来越多地与药物和化妆品的应用相关, 也被用于药品开发和物质检测。这些模型主要培养在膜-插入系统, 它们的渗透性对不同的物质是一个重要的因素。通常, 用于确定这些参数的应用方法通常需要较大的样本大小 (例如、Franz 扩散单元) 或费力的设备 (例如, 漂白后的荧光恢复 (酶))。本研究提出了在4.26 毫米和12.2 毫米 (栽培面积) 直径大小的膜插入系统中直接测定渗透系数的方法。用琼脂糖和胶原凝胶以及代表皮肤模型的胶原细胞模型对该方法进行了验证。准确地描述了不同分子尺寸和通过不同细胞模型 (由胶原凝胶、成纤维细胞和 HaCaT) 渗透的物质的渗透过程。
此外, 为了支持上述实验方法, 建立了仿真模型。模拟实验数据很好地适合于小分子量的物质, 多达 14 x 10-10 m 斯托克斯半径 (4000 兆瓦), 因此是描述该系统的一个有希望的工具。此外, 模拟可以大大减少实验工作, 并且足够健壮, 可以扩展或适应更复杂的设置。
引言
有机典型的3D 文化已成为药物开发和物质测试的有力工具1。在这方面, 人类皮肤模型是特殊的兴趣, 由于监管要求, 如在化妆品行业。随后, 它们导致了许多3D 皮肤模型的发展, 用于在多井板上使用自己作为单器官培养, 或在多器官芯片中结合附加的器官模型,例如, 肝脏2。
关于皮肤当量的培养, 空气液界面 (阿里) 是正确的表皮分化的一个重要因素3。细胞培养插入物组成的容器, 在底部的液体渗透膜通常用于建立阿里。ALIs 广泛应用于商业可用的皮肤模型, 如表皮4, Phenion5和 Episkin6, 为皮肤模型的文化, 大小从 96-井 (4.26 毫米直径), 由 12-井 (12.2 毫米直径) 板。此处描述的方法决定了膜插入系统中物质的渗透。
渗透系数是评价任何培养皮肤模型的质量的一个重要参数, 与本机皮肤相比5, 用于评估活性物质在皮肤中的快速迁移。特别是如果药物或化妆品产品需要应用到皮肤, 这个参数是必要的, 以了解确切的是什么时候有效的药物通过它。模拟可以进一步帮助预测系统的行为, 并随后减少必要的耗时的实验努力, 特别是当涉及到大量的物质。
Franz 扩散细胞是最先进的渗透实验与皮肤和皮肤模型5,6,7,8,9。该装置由两个车厢组成, 其中有一个固定样品 (扩散屏障)。要测试的物质直接应用于样品的顶端 (供料室), 并且在相对 (受体) 隔间可以检测到渗透化合物的浓度。在接受方方面, 通过温度室和磁力搅拌器保证恒温和均匀的物质浓度。样品可以取自 Franz 细胞受体侧的取样臂。与高度范围在 19 cm 和 179 cm 之间, 这个系统是相对地大10,11。酶了另一种测定凝胶状物质和组织中扩散系数的方法。该技术采用漂白荧光标记颗粒在凝胶中的原理, 然后确定漂白面积的恢复时间, 计算扩散系数12,13,14。
此外, 傅里叶变换红外 (FTIR) 光谱可用于检测红外光吸收粒子运动, 以确定皮肤中物质的渗透过程15,16。然而, 这些或其他成像方法 (例如, 双光子荧光相关光谱学17) 需要耗费大量的仪器。
本文提出了一种在膜插入系统中直接测量屏障渗透性的方法, 该模型可以培养出一种皮肤模式。这种方法使渗透实验可以运行与大量的小样本 (以及大小高达4.26 毫米) 在紧凑的系统。这与 Franz 扩散单元形成对比, 每个探头需要一个单独的装置, 必须安装在设备上, 并且很难实现小样本 (尺寸为4.26 毫米)。此外, 由于该方法不需要主要的仪器 (例如, 共焦或光子显微镜), 因此缩短了时间和成本。
所有的实验都是在微孔膜插入系统中进行的, 其样本 (屏障) 由琼脂糖凝胶或膜上建立的胶原细胞模型组成。将不同分子量的荧光物质 (施主) 应用于样品的顶端, 并使用荧光板读取器在底部 (受体) 检测到渗透物质的浓度 (参见图 1)。为了验证该方法的正确性, 并对该模拟结果进行测试, 制备了琼脂糖凝胶, 并作了屏障。水凝胶一般用于研究生物科学中多孔介质中的扩散和渗透过程13。该方法随后在一个细胞种子系统中进行测试, 它由原发成纤维细胞的胶原基质和成人低钙高温角质细胞 (HaCaT) 单元 (细胞基质模型) 组成, 它是一种简化的皮肤模型18,19.
此外, 通过计算流体力学的流动模拟, 对渗透过程进行了模拟。结果表明, 通过参数优化, 可以从实验数据中计算出扩散系数。一般情况下, 该仿真提供了不同的应用;例如, 有可能预测一个基于短实验的渗透过程, 模拟可以显著减少实验次数。
实验方法和仿真设计用于在一个芯片系统1,20,21, 特别是2器官芯片 (2-OC) 开发商业1,22, 23,24,25。在原理上, 可以用这种方法描述任何基于膜插入系统的器官模型的渗透过程。
研究方案
1. 制备渗透率研究样品
注: 为了验证渗透测量和模拟, 采用了基于皮肤模型培养的琼脂糖凝胶或细胞基质模型组成的样品。
- 琼脂糖凝胶
- 在10毫升的 H2O (双蒸馏水) 中溶解0.2 克琼脂糖高分辨率粉末。
- 混合溶液, 加热到80摄氏度。保持8分钟的温度。
- 在96井膜插入系统 (直径4.26 毫米) 的膜上应用28.6 µL 琼脂糖凝胶, 或使用226µL 用于12井膜插入系统 (直径12毫米) (例如、Transwell 系统)。
- 等10分钟, 直到凝胶凝固。
- 胶原凝胶
注意: 所有步骤都是在无菌条件下进行的, 并且在冰上保存溶液以延缓胶原凝胶的聚合。- 混合125µL 的汉克斯平衡盐溶液 (HBSS) 与1毫升0.4% 胶原 R 溶液 (鼠尾胶原蛋白)。
- 用1米氢氧化钠 (氢氧化钠) (~ 6 µL) 滴定溶液, 直到酚红色的颜色由黄色变为红色。
- 添加125µL Dulbecco 的改良鹰培养基 (DMEM) + 10% 胎小牛血清 (FCS) 的胶原凝胶, 并仔细混合与吸管提示。
- 将28.6 µL 胶原凝胶应用于96井膜插入系统的膜或12井膜插入系统的226µL。
- 将凝胶放在孵化器中 (37 °c, 5% CO2), 用于30分钟。
- 成纤维细胞的胶原蛋白模型
注: 所有步骤均在无菌条件下执行。- 实验前5-7 天准备原发成纤维细胞。在细胞培养瓶 (75 厘米2) 中培养 DMEM + 10% FCS 的成纤维细胞, 并每2-3 天改变培养基。
注意: 根据实验设置, 可以使用更大数量的单元格。 - 从细胞培养瓶 (80% 汇合) 中取出培养基, 并用10毫升 (培养瓶75厘米2) 冲洗磷酸盐缓冲盐水 (PBS)。添加3毫升0.05% 胰蛋白酶/乙二胺二乙酸 (EDTA) 和孵化3分钟在37摄氏度。
- 轻轻敲击培养瓶, 从表面分离出细胞。通过添加3毫升的 DMEM + 10% 的 FCS 来阻止反应。将溶液转移到离心管中。
- 离心细胞悬浮在 120 x g, 去除上清, 并且并用重悬细胞与0.5 毫升 DMEM + 10% FCS。
- 计数单元格并调整为 0.5 x 106单元格/mL 的浓度。
注: 在冰上执行以下步骤, 以延缓胶原凝胶的聚合。 - 混合125µL HBSS 1 毫升0.4% 胶原 R 溶液。
- 滴定溶液与1米氢氧化钠 (~ 6 µL), 直到酚红色的颜色由黄色变成红色。
- 添加125µL 细胞悬浮 (DMEM + 10% FCS + 0.5 x 106细胞/毫升) 进入胶原凝胶, 并小心地与吸管混合。
- 应用28.6 µL 胶原凝胶在96井膜插入系统的膜上或226µL 的12井膜插入系统。
- 将凝胶放在孵化器中 (37 °c, 5% CO2), 用于30分钟。
- 应用75µL 的 DMEM + 10% FCS 的凝胶表面和300µL 到接收板的96井膜插入系统。对于12井膜插入系统, 使用590µL 的体积为表面和1846µL 的接收板。
- 从细胞基质模型 (气举) 表面取出介质, 再将细胞基质模型孵化7天。使用 100 ul 介质在底部和改变的媒介每天。
- 实验前5-7 天准备原发成纤维细胞。在细胞培养瓶 (75 厘米2) 中培养 DMEM + 10% FCS 的成纤维细胞, 并每2-3 天改变培养基。
- HaCaT 胶原细胞模型的建立
注: 所有步骤均在无菌条件下执行。- 在以下步骤前5-7 天准备 HaCaT。在细胞培养瓶 (75 毫米2) 培养 HaCaT 与 DMEM + 5% FCS, 并改变培养基每2-3 天。
注意: 根据实验设置, 可以使用更大数量的单元格。 - 从烧瓶中取出培养基, 并用 PBS 10 毫升 (培养瓶75厘米2) 清洗两次。添加3毫升0.05% 胰蛋白酶/EDTA 和孵化10分钟在37摄氏度。停止反应与3毫升的 DMEM + 10% FCS。将溶液转移到离心管中。
- 离心细胞悬浮在 120 x g, 去除上清和并用重悬细胞与0.5 毫升 DMEM + 10% FCS。
- 计数单元格并调整为 0.5 x 106单元格/mL 的浓度。
注: 在冰上执行以下步骤, 以延缓胶原凝胶的聚合。 - 混合125µL HBSS 1 毫升0.4% 胶原 R 溶液。
- 滴定溶液与1米氢氧化钠 (~ 6 µL), 直到酚红色的颜色由黄色变成红色。
- 添加125µL 的 DMEM + 10% FCS 的胶原凝胶, 并与吸管仔细混合。
- 将28.6 µL 的细胞悬浮在96井膜插入系统的膜上, 或在12井膜插入系统中使用226µL。
- 将凝胶放在孵化器中 (37 °c, 5% CO2), 用于30分钟。
- 将75µL 细胞悬浮液应用于凝胶表面, 并将300µL 的 DMEM + 10% 接触器添加到96井膜插入系统的接收板上。对于12井膜插入系统, 使用590µL 细胞悬浮液的表面和1846µL 的 DMEM + 10% FCS 的接收机板。
- 孵化细胞基质模型3天;2天后交换培养基。
- 从细胞基质模型的表面取出培养基, 再孵化细胞基质模型7天。在底部使用100µl 培养基, 每天改变培养基。
- 在以下步骤前5-7 天准备 HaCaT。在细胞培养瓶 (75 毫米2) 培养 HaCaT 与 DMEM + 5% FCS, 并改变培养基每2-3 天。
- 胶原细胞模型与成纤维细胞和 HaCaT
注意: 所有步骤都是在无菌条件下执行的, 以减缓胶原凝胶的聚合。准备步骤1.3 中描述的成纤维细胞, 直到步骤 1.3.5, 并准备一天后 HaCaT, 如步骤1.4 所述, 直到步骤1.4.4。- 混合125µL HBSS 1 毫升0.4% 胶原 R 溶液。
- 用1米氢氧化钠 (~ 6 µL) 中和溶液, 直到酚红色的颜色由黄色变为红色紫罗兰。
- 添加125µL 的原发纤维细胞悬浮液, 由 DMEM + 10% FCS + 0.5 x 106细胞/毫升胶原凝胶, 并仔细混合。
- 将28.6 µL 细胞悬浮液应用于96井膜插入系统的膜或12井膜插入系统的226µL。
- 将凝胶放在孵化器中 (37 °c, 5% CO2), 用于30分钟。
- 接下来, 将75µL DMEM + 10% FCS 在凝胶表面和300µL 上应用于96井膜插入系统的接收板上。对于12井膜插入系统, 590 µL 的体积用于表面和1846µL 的接收板。
- 孵育1天在37°c 和 5% CO2。
- 从表面移除介质, 并添加一个 HaCaT 细胞悬架, 0.5 x 106细胞/毫升。卷与在步骤1.5.6 之前描述的相同。
- 孵化细胞基质模型3天;2天后交换培养基。
- 从细胞基质模型的表面取出培养基, 再孵化细胞基质模型7天。在底部使用100µl 培养基, 每天改变培养基。
注: 本研究为12井膜插入系统制备了3凝胶/细胞模型样品。对于96井膜插入系统, 我们使用了6样品的凝胶/细胞模型。对于统计方法, 3 样本是常见的。但对于96井膜插入系统的胶原基质模型的实验, 我们预期细胞培养的失败和偏差。因此, 我们选择了更大量的样本。
2. 膜插入系统的渗透性研究
-
捐助者物质
注: 两种荧光素钠盐 (NaFl) 产生。- 在 H2O 中溶解 NaFl, 浓度为0.1 毫克/毫升, 0.01 毫克/毫升。不同的荧光素异硫氰酸酯-dextranes (FD) 与分子量的 4000, 1万, 2万和4万克/摩尔被溶化在 H2O 在浓度为2毫克/毫升。将这些解决方案用作渗透试验的供体物质 (参见图 1) 与琼脂糖凝胶。
- 对于与胶原细胞模型的设置, 准备所有的解决方案与 DMEM + 10% FCS, 而不是水。
注: 准备供体物质的库存溶液 (10x 高浓度)。供体浓度的小变化会影响渗透试验的结果。
-
实验方法
注: 渗透试验执行于37摄氏度和湿度 > 90%。此参数可确保单元格的生存能力。温度对扩散过程有影响, 用琼脂糖凝胶、胶原凝胶、胶原细胞模型等参数进行实验。支架中的容积信息是指12井膜插入系统。- 用琼脂糖凝胶 (见1.1 号协议) 或细胞模型 (见协议 1.2-1.5) 和荧光捐献物质的屏障, 制备 96 (或 12) 的膜插入系统。
- 准备稀释1:10、1:20、1:40、1:80、1:160 和1:320 的供体物质, 用于建立标准曲线。吸管300µL (1846 µL) 的每稀释在三井的接收板。对于12井膜插入系统使用一个单独的接收板。串行稀释用于将被测量的荧光 [RFU] 转换为等效浓度 [mg/毫升]。
- 添加75µL (590 µL) 的捐赠物质在样品 (琼脂糖凝胶或细胞模型) 和300µL (1846 µL) 的受体物质 (H2O 或 DMEM + 10% FCS) 在接收器板 (见图 1)。
注: 确保膜插入系统中的液体表面和接收板中的液面具有相同的水平, 以避免静水压压力。 - 将整个系统转移到孵化器中的振动筛上。调整震动以实现均匀混合 (总行程轨道为1.5 毫米, 速度调整在3.5 级, 这与旋转的 ~ 480 1/分钟) 有关, 以避免浓度梯度, 影响扩散过程。
- 每小时定期测定荧光。测量荧光, 将膜插入系统转换为空板, 用平板阅读器测量接收器中的荧光。使用 485 nm 的激发波长和 535 nm 的发射荧光素。
- 运行实验5小时。
注: 在实验过程中, 液体从整个系统蒸发。蒸发改变了供体和受体的浓度, 影响了结果。这种效果在运行时间为5小时时被忽略, 但对于较长的运行时, 应该考虑。
-
渗透系数的计算
- 建立标准曲线, 绘制序列稀释与浓度的荧光, 对数据进行线性回归。
- 利用线性回归的斜率将渗透实验的荧光数据转化为浓度。为了模拟, 将单位转换为摩尔/m3。
- 随着时间的推移绘制浓度作为函数, 并建立数据的线性段 (请参见图 2)。
- 确定此线性零件的斜率, 并根据以下公式计算渗透系数 (请参见图 2中的示例):
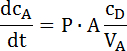
其中 dcA/dt 是物质浓度的变化在接受方期间 (斜率);CD是捐助方的浓度;P 为渗透系数;a 是渗透面, VA是接受体的体积。这个等式是从菲克的第一定律推导出来的, 只能在 cD » cA622时应用。 - 注意: 捐献者的浓度必须比受体中检测到的浓度高得多。在实验设置中验证了这一点。
3. 模拟
注: 模拟是用 COMSOL Multiphysics 5.1 进行的。这方面的基本知识是假定的。对于扩散模拟, 提出以下假设: (a) 与凝胶相比, H2O 中物质的扩散系数要高得多。为了弥补这种差异, 模拟使用的值为 1 x 10-9 m2/秒, 它比 NaFl 通过10琼脂糖凝胶的扩散系数更高, 其系数为100到2%。(b) 在实验中, 物质通过屏障扩散, 然后通过膜插入系统。与实验装置相比, 虚拟琼脂糖凝胶或细胞基质和膜被认为是一个均匀相。(c) 墙面的边界效应设置为 "无滑移", 对膜插入系统的壁 (不在液体和凝胶或液体和细胞模型之间) 的所有滑动效应都被忽略, 对扩散过程没有意义。
- 扩散模拟的建立
注: 这些步骤演示了渗透试验模拟的设置。分别建立了96和12井膜插入系统的仿真结果。"化学物种运输" 模块使用基于菲克第二定律的方程: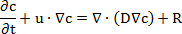
其中 c 是物质的浓度, t 是时间, u 是速度, D 是扩散系数, R 是反应速率。反应速率被忽略, 因为在扩散过程中没有发生化学反应。- 打开程序并启动一个新模型。选择了 "模型向导", 选择了3D 模型, 在下拉菜单中添加 "稀释物种迁移" 到物理界面, 点击 "学习", 选择 "时间依赖" 研究, 点击 "完成"。
- 转到 "全局定义" 并添加 "参数", 右键单击。在网格中输入几何和物理参数 (请参见表 1、表 2和图 3e)。
注:96 井膜插入系统中琼脂糖凝胶的凹面与浸泡球近似。 - 从实验中建立了膜插入系统的几何形状。在步骤3.2 中, 举例说明如何构建96井膜插入系统的几何形状。长度单位设置为米。
注意: 不要生成整个几何图形以节省计算时间。相反, 可以使用几何图形的一个季度的中心线来减少几何图形 (请参见图 3a和图 3b)。 - 在 "定义" 中添加两个 "域探头" (右键单击 "定义", 然后定位 "探测器"), 然后选择一个探针作为接受方域, 另一种作为施主域。选择两种类型的 "平均值" 和表示 "c" 的单位 "摩尔/m3"。
注: 此步骤是可选的, 并显示在模拟过程中接受方和捐赠者的浓度。 - 将 "稀释物种运输" 中的 "运输属性 1" 中的扩散系数 (Dc) 设置为 "Dif_w"。
注: "传输属性 1" 用于接受方和捐赠者域。在下一步中, 将覆盖屏障域。 - 添加第二个 "传输属性 2", 右键单击 "稀释物种的运输", 然后选择 "域选择" 中的屏障 (2)。根据模拟的目的, 扩散系数可以设置为屏障的值或作为一个虚变量 "D"。对于第一个测试运行, 设置值为 2E-10 m2/秒。
注: "D" 将在后面的步骤3.3 中声明。 - 在 "稀释的种类的运输" 为 "最初的价值 1" 定义了集中作为零。
注: "初始值 1" 用于屏障和受体域。在下一步骤中, 将覆盖捐助方域。 - 添加第二个 "初始值 2", 右键单击 "稀释物种的运输", 然后选择供方 (3) 作为域。将浓度设置为供体物质的初始浓度 (例如, 表2中的 C_fl)。
- 添加 "对称 1" 与右键单击 "稀释的物种的运输", 添加并选择 "边界选择" 的所有曲面, 镜像整个几何图形 (对于步骤3.2 中的几何示例, 它是边界号1、2、4、5、7、8)。
注意: 如果设置了整个几何图形, 则可以忽略这一点。 - 用右键点击 "网格" 添加两个 "自由四面体"。选择屏障 (2) 作为域 (将几何实体级别更改为 "域")。添加 "大小" 与右击 "自由四面体 1" 和预定义网格 "更好" 的12井膜插入系统或 "额外罚款" 的96井膜插入系统。
- 在第二个 "自由四面体" 选择承兑人和捐赠者作为领域和预定义网格 "正常" 为一个12井膜插入系统或 "更好" 为96井膜插入系统 (参见图 3c和图 3d)。
注意: 还可以选择一个粗糙的网格来节省计算时间。这可能会降低结果的准确性。点击 "建立所有" 在 "网格设置", 以网格的几何。 - 开始模拟与 "计算" 在 "研究 1"。
- 几何图形的示例设置
注: 这里给出了如何设置96井膜插入系统 (带凹屏障) 几何的例子。所有步骤都在程序的几何模块中执行。长度单位设置为米。- 生成一个圆筒 1 (右击 "几何 1") 与半径的 d_w/2 和高度的 h_sp + h_b + h_a。
- 生成具有 d_tran/2 半径、h_b + h_a 高度和 h_sp z 位置的圆柱2。
- 使用 "差异" 选项 (右键单击 "几何 1", 定位 "布尔和分区"), 从气缸1中减去圆柱2。在 "要添加的对象" 中选择 "cyl1", 激活 "对象减去", 然后选择 "cyl2"。新卷是承兑人的几何形状。
- 生成一个圆柱 3, 半径为 d_a/2, 高度为 h_b, z 位置为 h_sp。
- 生成球面 1, 半径 r 和 z 位置 r_z。
- 使用 "差分" 选项从气缸 3 (cyl3) 中减去球形 1 (sph1)。新卷称为差异2。
- 生成一个圆柱 4, 半径为 d_a/2, 高度为 h_b + h_a, 位置 z 为 h_sp。
- 使用 "差分" 选项减去 4 (cyl4) 从差2。新卷是承兑人的几何形状。
- 重复步骤 3.2. 4-3. 2.6 建立屏障 (琼脂糖凝胶或细胞模型在实验中)。
- 使一个联合1的所有几何元素 (右键单击 "几何 1", 找到 "布尔和分区")。
- 生成一个1块, 所有边都设置为 d_tran*2 的长度, 位置 x d_tran 和 y d_tran*2。
- 生成 d_tran*2 的所有边缘长度的块 2, 位置 x d_tran*2 和 y d_tran。
- 使用 "差分" 选项从1块和2块中减去联合1。
- 将参数优化添加到仿真中
注: 在参数优化的帮助下, 扩散系数可拟合到先前生成的实验数据中。以下说明如何将优化部分集成到扩散模拟中。在开始这些步骤之前, 请确保扩散模拟工作正常。- 添加物理模块 "优化" 使用 "添加物理" (优化可以发现在 "数学" 的类别 "优化和灵敏度") 的模拟。单击 "添加到组件"。
- 在 "定义" 下右击添加 "变量" (在组件中为本地), 然后在表 3中键入变量。
注意: 参数优化使用实数,即, 必须分别定义扩散系数的因子 1-10 。 - 添加 "平均 1" 与右键单击 "组件耦合" 部分中的 "定义", 并键入操作员名称 "承兑人"。
- 生成包含实验数据的单独文本文档。
注: 分号分隔列;行符分隔行。时间声明以秒为单位, 集中在摩尔/m3中。移除滞后阶段中的第一个和第二个数据点 (请参见图 2), 以避免可能的拟合错误。下面是一个示例, 说明文本文档的外观:
3540; 0.00216
7140; 0.00724
12240; 0.01707
15180; 0.02230
18660; 0.02697
21540; 0.02931
此示例可用于测试模拟。 - 添加 "全局最小二乘目标" 右键单击 "优化", 将文本文档从步骤3.3.4 附加到 "实验数据", 并将第一列定义为 "时间栏 1", 右键单击 "全局最小二乘目标", 第二列作为"价值专栏 1" 以右击 "全球最小二乘法目标"。在 "值列" 的 "表达式" 中, 键入变量 "C"。
- 添加 "全局控制变量 1", 右键单击 "优化", 并将 "D_search" 声明为具有初始值 "1"、下限 "0" 和上界 "1000" 的变量。
- 添加 "优化" 与右键点击 "学习 1", 并选择 "SNOPT" 作为优化求解方法。将最优性公差设置为 1 e-9。
注: 如果模拟没有收敛, 增加最优性公差。请记住, 如果优化公差太大, 模拟将是不准确的。 - 在 "研究" 中以 "计算" 开始参数优化。不要忘记将屏障上的扩散系数设置为 "D"。
结果
以2% 琼脂糖凝胶为屏障的96井膜插入系统进行了透气性实验, 以评价模拟的准确性。荧光素钠盐 (NaFl) 和荧光素异硫氰酸酯 dextranes (FD) 用于验证扩散物质的分子量从 5 x 10-10 m 到 45 x 10-10 m 斯托克斯半径 (376.27-40,000 摩尔) 的影响。采用仿真的本机参数优化方法拟合实验数据。
为此, 将模拟渗透率的线性部分的斜率与实验结果进行了比较。对于小分子尺寸, 模拟和实验数据与99.2% 用于 NaFl 和80.2% 的 FD 4000 (参见图 4a和图 4b) 的协议很好。较大的分子量产生更高的偏差, 显示50.5% 的相关性为 fd 1万, 79.7% 为 fd 2万, 53.6% 为 fd 4万。在模拟过程中的曲线级数显示了在开始时的延迟和图的进一步进程中的更强的上升 (请参见图 4c-4e)。
渗透系数和模拟扩散系数显示在表4中.随着分子量的增加, 渗透系数减小。标准偏差介于 0.08 x 10-8米/秒和 0.47 x 10-8 m/秒 (N = 7) 之间, 对应于4.18% 和46.15% 之间的绝对错误。实验用更大的分子显示一个更大的绝对错误。模拟扩散系数与实验渗透系数的表现非常相似。大于斯托克斯半径的物质显示扩散系数减小, 绝对误差在9.09% 和18.46% 之间 (N = 3) 不等。
在另外的渗透实验中, 四种不同的胶原细胞模型被用作12井膜插入系统的屏障。这些模型包括无细胞模型和细胞模型在胶原凝胶和 HaCaT 表面的不同的主要成纤维细胞组合。使用了以下组合: 胶原蛋白 (HaCaT) 为无细胞模型, 胶原 + 成纤维细胞 (西 + f), 胶原 + (H.), 胶原 + 成纤维细胞 + HaCaT (+ F. + h.)。荧光素钠盐与 DMEM + 10% FCS 被用作供体物质。对胶原细胞模型进行图像分析, 采用苏木精和伊红 (he) 染色。此染色是使用制造商的协议进行的。在图 5中, 显示了一个具有代表性的 c++ 模型的着色。他轻微地玷污了胶原基质的组织结构。成纤维细胞位于基质中, 成纤维细胞和 HaCaT 的细胞核在暗紫色中染色。在胶原基质的顶端, 有一个包含许多原子核的层, 这应该是 HaCaTs 的原子核, 在模型的顶端建立一个封闭层。
在表 5中, 列出了实验渗透系数和模拟扩散系数。HaCaT 的大多数模型都可以看到这种趋势, 与没有 HaCaT 的模型相比, 它们的渗透/扩散系数较低。渗透系数的绝对误差为 10.9-24.4%, 扩散系数为 5.2%-12.9%。
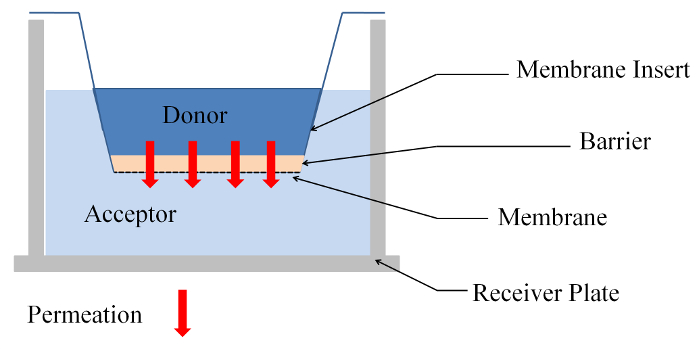
图 1: 膜插入系统中渗透实验的侧面视图.请单击此处查看此图的较大版本.
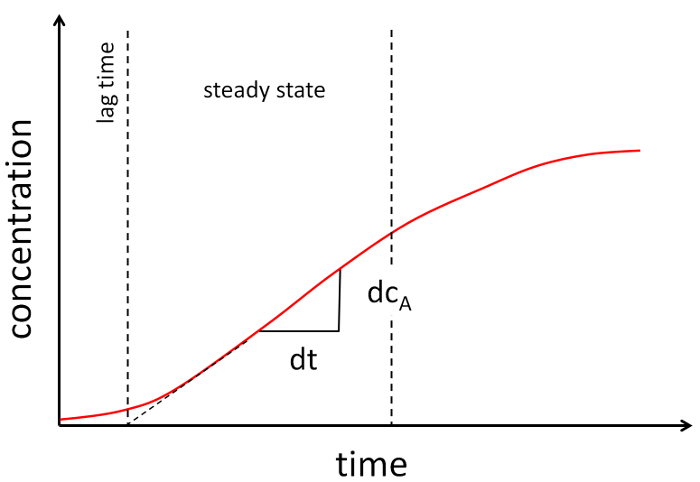
图 2: 渗透性实验的典范图.随着时间的推移, 受体的浓度被绘制出来。两条虚线将图形的近线性部分括起来。用线性部分的斜率来确定渗透系数。请单击此处查看此图的较大版本.
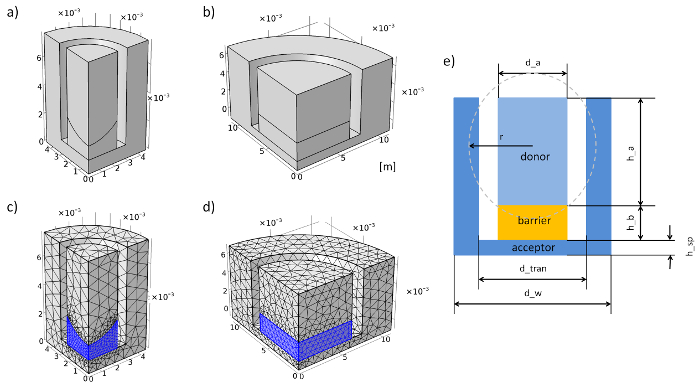
图 3: 模拟中的膜插入系统的几何和网格.(a) 96 井膜插入系统的几何形状。(b) 12 井膜插入系统的几何形状。(c) 96 井膜插入系统的网格。(d) 12 井膜插入系统的网格。(e) 膜插入系统的剖面和参数。请单击此处查看此图的较大版本.
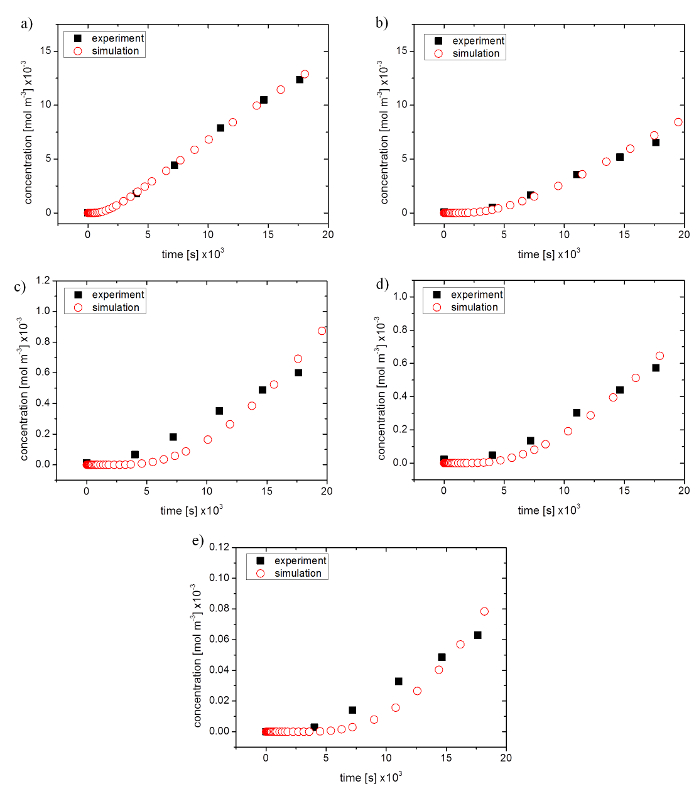
图 4: 从渗透实验数据到优化模拟的比较.(a) 荧光素钠盐, (b) 荧光素异硫氰酸酯-葡聚糖4000摩尔, (c) 1万摩尔, (d) 2万摩尔, 和 (e) 4万摩尔.请单击此处查看此图的较大版本.
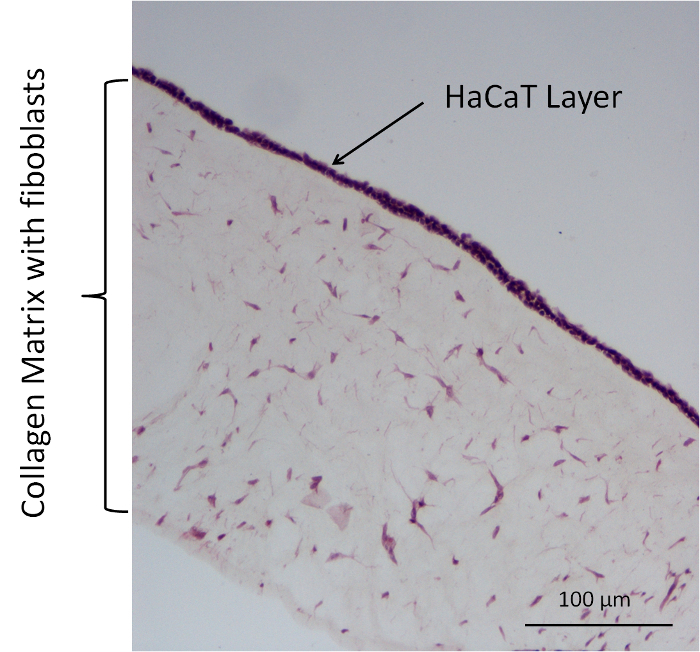
图 5: 代表他染色胶原细胞模型 (胶原 + 成纤维细胞 + HaCaT).请单击此处查看此图的较大版本.
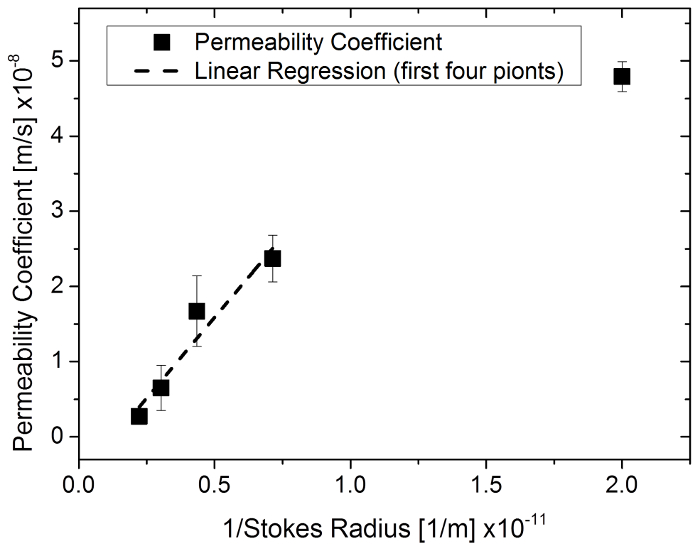
图 6: 在96井膜插入系统中, 用荧光素钠盐和异硫氰酸荧光素-葡聚糖作为 1/斯托克斯半径函数的渗透系数.请单击此处查看此图的较大版本.
| 名称 | Experession 为96井系统在毫米 | 表达12井系统的 mm | 描述 |
| d_tran | 5.65 [mm] | 14.7 [mm] | 井径 |
| d_a | 4.26 [mm] | 12.1 [mm] | 膜直径 |
| d_w | 8.79 [mm] | 21.97 [mm] | 受体直径 |
| h_b | 2 [mm] | 2 [mm] | 高度障碍 |
| h_sp | 1 [mm] | 1 [mm] | 井底距离 |
| h_a | 4.73 [mm] | 5.24 [mm] | 高的承兑 |
| b | h_b/2 | - | 浸入深度 |
| 研发 | ((d_a) ^ 2 + 4 * b ^ 2)/(8 * b) | - | 浸入球半径+ |
| r_z | r + h_b | - | 浸入式球的 z 位置+ |
表 1: "化学物种运输" 模拟的几何参数.+仅用于96井膜插入系统中琼脂糖凝胶的模拟。
| 名称 | 表达 | 值 | 描述 |
| C_fl | 0.1 [镁/毫升]/376.28 [克/摩尔] | 0.26576 摩尔/m2 | 浓度的 Fl。 |
| C_4 | 2 [镁/毫升]/4000 [克/摩尔] | 0.5 mol/m2 | FD 浓度4.000 |
| C_10 | 2 [镁/毫升]/10000 [克/摩尔] | 0.2 mol/m2 | FD 浓度10.000 |
| C_20 | 2 [镁/毫升]/20000 [克/摩尔] | 0.1 mol/m2 | FD 浓度20.000 |
| C_40 | 2 [镁/毫升]/40000 [克/摩尔] | 0.05 mol/m2 | FD 浓度40.000 |
| Dif_w | 1e-9 [m^2/s] | 1 e-9 m2/秒 | 混合水扩散系数 |
表 2: "化学物种运输" 模拟的物理参数。
| 名称 | 表达 | 描述 |
| c | 承兑 (c) | 受体浓度的定义 |
| d | D_search*1e-10 | D 的因子变化 |
表 3: "优化" 模拟的参数。
| 渗透 | 渗透系数 (m/秒) x10-8 | 扩散系数 (m/秒2) x10-10 | 渗透 (m) x10 的斯托克斯半径-10 |
| 佛罗里达州。 | 4.79 @ 0.20 | 1.94 @ 0.34 | 5 |
| FD 4000 | 2.37 @ 0.31 | 0.65 @ 0.12 | 14 |
| FD10,000 | 1.67 @ 0.47 | 0.22 @ 0.02 | 23 |
| FD 2万 | 0.65 @ 0.30 | 0.29 @ 0.04 | 33 |
| FD 4万 | 0.27 @ 0.08 | 0.14 @ 0.02 | 45 |
表 4: 在96井膜插入系统中, 通过2% 琼脂糖凝胶 + 膜的不同斯托克斯半径物质的渗透性和扩散系数.(荧光素钠盐 = Fl, fitc 葡聚糖 = FD)。
| 模型 | 渗透系数 (m/秒) x10-8 | 扩散系数 (m/秒2) x10-10 |
| 卡扎菲. | 2.18 @ 0.29 | 1.22 @ 0.06 |
| 加 F。 | 1.77 @ 0.38 | 0.93 @ 0.12 |
| H。 | 1.64 @ 0.40 | 0.96 @ 0.05 |
| + H。 | 1.65 @ 0.18 | 0.88 @ 0.11 |
表 5: 荧光素钠盐的渗透性和扩散系数通过一个胶原细胞模型在 12-井膜插入系统 (= 胶原蛋白, F. = HaCaT)
讨论
本研究记录了一种通过在膜上工程组织结构来量化渗透的方法。首先通过琼脂糖凝胶对不同分子量的物质进行了渗透试验, 验证了该方法的有效性, 并进行了相应的仿真研究。众所周知, 小分子通过基质网的渗透速度更快 (除了渗透色谱法在凝胶过滤中的作用除外)。通过巩膜26、人表皮膜27、人皮肤17和大鼠皮肤28等物质的大小排斥实验进行了类似的观察。渗透系数与相应的斯托克斯半径之间的反相关 (一个硬球体的半径与所描述的分子的扩散速率相同, 通常小于分子的有效半径) 已显示26,28, 在实验中观察到不同分子大小物质的相似关系。通过绘制 1/斯托克斯半径的渗透系数, 发现了四组具有最小分子尺寸的线性相关性 (R2 = 0.93) (图 6)。这表明, 模拟渗透系数的方法建议是在一个现实的范围。
在实验中, 46.15% 的误差比用 Franz 扩散单元系统10的渗透性实验报告的略大。一个可能的解释可能是荧光素-异硫氰酸酯-葡聚糖的大小分布, 稍后讨论。
所述方法与使用 Franz 扩散细胞系统的方法相比具有重要的优越性。首先, 设置更加紧凑;实验直接在膜插入系统中执行, 它具有商业井板 (∼13厘米 x 8.5 厘米) 的刻度。这样可以同时运行多个示例, 而每个示例都需要一个单独的 Franz 扩散单元。其次, 皮肤模型的渗透性可以直接测量在膜插入物, 在那里耕种发生。使用 Franz 扩散细胞, 样品必须取出并安装在系统上, 这对小样本来说更繁琐, 也更费时。
经胶原细胞基质渗透实验表明, 该方法可成功应用于细胞种子系统。本模型对皮肤模型进行了验证;然而, 该方法可应用于其他类型的有机细胞培养, 如肾脏或肝脏,如。
在本研究中, 采用胶原细胞模型, HaCaT 细胞完全覆盖模型表面 (参见图 5)。这导致了渗透系数的降低, 表明该方法灵敏度足以区分胶原细胞模型与无 HaCaT 层之间的渗透系数。理想的情况下, 皮肤模型应该建立一个屏障, 接近皮肤的真正皮肤29, 因此, 重要的是要验证的质量 (例如, 建立真皮, 表皮), 在实际使用之前。皮肤模型的发展可以可视化染色技术和量化的检测皮肤蛋白和胶原蛋白30,31,32。渗透系数也可能是评估皮肤模型发展的一个重要因素, 但需要进一步的实验来证实这一点。如前所述, 此方法允许并行运行多个示例。在培养过程中, 也可以采集样本来测量渗透性, 从而观察皮肤模型的这个参数的发展。
应注意的是, 渗透率通过凝胶/胶原细胞模型和膜同时测量。检测到的渗透系数是系统特有的, 因此不同皮肤模型的结果只能在使用相同的膜插入时进行比较。此外, 皮肤模型需要覆盖整个种植区, 以确保测试物质只渗透通过模型, 而不是相邻的, 这将诱发错误的渗透率测量。在未来的实验中应该考虑的另一个方面是皮肤周围的自然环境。通常情况下, 皮肤表面的温度与内区比较较低, 这会影响渗透条件。
为了使实验室实验与计算机模拟相结合, 提出了一种应用仿真的参数优化方法。实验结果表明, 与小分子尺寸的物质吻合良好。然而, 对于具有较大分子量的物质, 模拟结果与实验数据之间存在偏差。大的多糖分子可以增加摩擦和减缓扩散过程中的凝胶。此效果导致异常扩散, 这是实验和模拟值之间偏差的可能原因33,34。另一种解释可能是荧光素-异硫氰酸酯-葡聚糖中较小或更大颗粒的存在。制造商指定物质的分子量作为平均大小以一个指定的范围, 允许更小和更大的微粒存在。还不清楚这些物质是如何分散的, 因为较小的粒子通过凝胶和流体通道渗透得更快。可以扩展模拟来考虑这些扩散和摩擦效应。
研制了 2-OC 的渗透率试验和模拟实验。在仿真的帮助下, 该实验方法可以直接转移到较为复杂的实验装置中。例如, 膜插入系统模拟可以很容易地转移到 2 OC 或其他系统的几何类似的设置。这种调制模拟的选择可以用来支持未来实验的设计。此外, 蒸发、异常扩散、膜效应等副作用可以结合起来进行模拟, 从而提高精度。仿真程序给出了改变或增强模拟方程的机会, 以及集成其他物理模块, 以研究皮肤模型开发的其他方面。一个例子是模拟葡萄糖消耗量和乳酸生产在胶原细胞模型。
在医疗物质的测试中, 一个特别有趣的方面是这些物质是如何分布在一个芯片系统上的。模拟和渗透参数我的帮助回答的问题, 如如何快速的物质渗透到系统中, 以及哪些浓度将可用于其他组织在多器官芯片。该方法能够支持和加强对此类机构芯片系统的开发和测试。
披露声明
马克思是首席执行官和股东, 林德纳是 TissUse 有限公司的股东, 是一家公司制造和商业化的商务部技术。其他作者在本论文的发表声明没有利益冲突。
致谢
这项工作是在德国 Forschungsgemeinschaft (DFG) 的资助下创建的。PO413/12-1 和 LA 1028/7-1。
材料
| Name | Company | Catalog Number | Comments |
| Agarose | Carl Roth | K297.2 | High Resolution Powder |
| Collagen | Serva | 47256.01 | Collagen R solution 0.4 % |
| DMEM | Lonza (Biozym Scientific GmbH) | 880010-12 | High Glucose with L-Glutamine |
| FCS | Biochrom GmbH | S0615 0114F | Fetal Calf Serum |
| Fluorescein Sodium Salt | Sigma-Aldrich | 46960-25G-F | |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | 46944-500MG | 4000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD10S-250MG | 10 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD20S-250MG | 20 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD40S-250MG | 40 000 g/mol |
| HBSS | ThermoFisher Scientific | 14170120 | no calcium, no magnesium , with phenol red |
| NaOH | Merck | 1.06467.9010 | granulated |
| PBS | Gibco | 18912-014 | tablets |
| Transwell Cell Culture Inserts | Corning | 3391 | 96 well, 0.4 µm pore size |
| Transwell Cell Culture Inserts | Corning (VWR) | 734-1563 | 12 well, 0.4 µm pore size |
| Trypsin | Biochrom GmbH | L2143 | with EDTA |
参考文献
- Marx, U., et al. Human-on-a-chip developments: a translational cutting-edge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man? ATLA. 40 (5), 235-257 (2012).
- Maschmeyer, I., et al. Chip-based human liver-intestine and liver-skin co-cultures - A first step toward systemic repeated dose substance testing in vitro. Eur J Pharm Biopharm. 95, 77-87 (2015).
- Prunieras, M., Regnier, M., Woodley, D. Methods for Cultivation of Keratinocytes with an Air-Liquid Interface. J Invest Dermatol. 81 (1), 28-33 (1983).
- Cannon, C. L., et al. New epidermal model for dermal irritancy testing. Toxicol In Vitro. 8 (4), 889-891 (1994).
- Ackermann, K., et al. The Phenion Full-Thickness Skin Model for Percutaneous Absorption Testing. Skin Pharmacol Physiol. 23 (2), 105-112 (2010).
- Netzlaff, F., et al. Permeability of the reconstructed human epidermis model Episkin in comparison to various human skin preparations. Eur J Pharm Biopharm. 66 (1), 127-134 (2007).
- Bran, B., et al. A New Discriminative Criterion for the Development of Franz Diffusion Tests for Transdermal Pharmaceuticals. J Pharm Sci. 13 (2), 218-230 (2010).
- Pineau, A., et al. In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz diffusion cell. J Inorg Biochem. 110, 21-26 (2012).
- Filon, F. L., et al. In vitro percutaneous absorption of cobalt. Int Arch Occup Environ Health. 77 (2), 85-89 (2004).
- Ng, S. -F., et al. Validation of a Static Franz Diffusion Cell System for In Vitro Permeation Studies. AAPS PharmSciTech. 11 (3), 1432-1441 (2010).
- Bonferoni, M. C., et al. A Modified Franz Diffusion Cell for Simultaneous Assessment of Drug Release and Washability of Mucoadhesive Gels. Pharm Dev Tecnol. 4 (1), 45-53 (1999).
- Seiffer, S., Oppermann, W. Systematic evaluation of FRAP experiments performed in a confocal laser scanning microscope. J Microsc. 220 (1), 20-30 (2005).
- Pluen, A., et al. Diffusion of Macromolecules in Agarose Gels: Comparison of Linear and Globular Configurations. Biophys J. 77, 542-552 (1999).
- Cornelissen, L. H., et al. Diffusion measurements in epidermal tissues with fluorescent recovery after photobleaching. Skin Res Technol. 14 (4), 462-467 (2008).
- Pirot, F., et al. Characterization of the permeability barrier of human skin in vivo. PNAS. 94 (4), 1562-1567 (1997).
- Tetteh, J., et al. Local examination of skin diffusion using FTIR spectroscopic imaging and multivariate target factor analysis. Anal Chim Acta. 642 (1-2), 246-256 (2009).
- Guldbrand, S., et al. Two-photon fluorescence correlation spectroscopy as a tool for measuring molecular diffusion within human skin. Eur J Pharm Biopharm. 84 (2), 430-436 (2013).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Rech. 291 (11), 600-605 (1999).
- Veronike, M., et al. Epidermal Organization and Differentiation of HaCaT Keratinocytes in Organotypic Coculture with Human Dermal Fibroblasts. J Invest Dermatol. 112 (3), 343-353 (1999).
- Moraes, C., et al. Organs-on-a-chip: a focus on compartmentalized microdevices. Ann Biomed Eng. 40 (6), 1211-1227 (2012).
- Huh, D., et al. From Three-Dimensional Cell Culture to Organs-on-Chips. Trends Cell Biol. 21 (12), 745-754 (2011).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab Chip. 13 (18), 3588(2013).
- Materne, E. -M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), (2015).
- Materne, E. -M., et al. A multi-organ chip co-culture of neurospheres and liver equivalents for long-term substance testing. J Biotechnology. 205, 36-46 (2015).
- Materne, E. -M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing - organotypicalness versus cost-efficient high throughput. Lab Chip. 13 (18), 3481(2013).
- Jayakrishna, A., et al. Diffusion of High Molecular Weight Compounds through Sclera. IOVS. 41 (5), 1181-1185 (2000).
- Peck, K., et al. Hindered Diffusion of Polar Molecules Through and Effective Pore Radii Estimate of Intact and Ethanol. Pharm Res. 11 (9), 1309-1314 (1994).
- Ogiso, T., et al. Mechanism of the Enhancement Effect of n-Octyl-β-D-thioglucoside on the Transdermal Penetration of Fluorescein Isothiocyanate-Labeled Dextrans and the Molecular Weight Dependence of Water-Soluble Penetrants through Stripped Skin. J Pharm Sci. 83 (12), 1676-1681 (1994).
- Hadgraft, J. Skin, the final frontier. Int J Pharm. 224 (1-2), 1-18 (2001).
- Asselineau, D., et al. Human Epidermis Reconstructed by Culture: Is It "Normal"? J Invest Dermatol. 86 (2), 181-186 (1986).
- Casasco, A., et al. Cell proliferation and differentiation in a model of human skin equivalent. Anat Rec. 264 (3), 261-272 (2001).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Res. 291 (11), 600-605 (1999).
- Laurent, T. C., et al. Diffusion of Dextran in Concentrated Solutions. Eur J Biochem. 68, 95-102 (1976).
- Metzler, R., Klafter, J. The random walk's guide to anomalous diffusion: A fractional dynamics approach. Phys Rep. 339 (1), 1-77 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。