Method Article
生成毛因诱导多能干细胞衍生的肿瘤抗原特异性胸腺移民的三维胸腺培养系统
* 这些作者具有相同的贡献
摘要
本文介绍了一种通过三维(3D)胸腺培养系统生成肿瘤抗原特异性诱导多能干细胞衍生胸腺(iTE)的新方法。iTE 是 T 细胞的同质子集,与天真的 T 细胞密切相关,具有增殖、记忆形成和肿瘤抑制的能力。
摘要
预先排列的T细胞受体(TTC)的遗传及其表观遗传再生使诱导多能干细胞(iPSC)衍生的T细胞成为采用T细胞治疗(ACT)的有希望的来源。然而,从iPSC产生再生T细胞的经典体外方法导致先天或最终分化的T细胞,这些细胞在表象和功能上不同于天真的T细胞。最近,开发了一种新型的三维(3D)胸腺培养系统,以产生一个同质的CD8++-抗原特异性T细胞的子集,具有天真的T细胞样功能表型,包括增殖能力、记忆形成和体内的肿瘤抑制。该协议避免了异常发育命运,允许生成临床相关的iPSC衍生的T细胞,被指定为iPSC衍生胸腺移民(iTE),同时提供一个强有力的工具,以阐明后续功能必要的用于胸腺选择后的T细胞成熟。
引言
采用T细胞疗法(ACT)可以有效治疗一些晚期癌症患者。不幸的是,许多患者没有经历肿瘤回归,转移的细胞在输液后无法持续。这可能是由于注入的T细胞的质量。ACT小鼠模型显示,与天真或分化较少的中央记忆T细胞相比,由于体内持久性1的较差,最终分化效应细胞的疗效能力较差,临床数据2也支持这一观察。 3.
为了提高当前ACT的疗效,T细胞衍生的诱导多能干细胞(T-iPSC)进行了广泛的研究4,5。当T细胞被重新编程成T-iPSC并重新分化成T细胞时,TCR基因的重新排列配置由T-iPSC继承,随后再分化T细胞。因此,T-iPSC 进行无限体外扩张的能力允许携带新抗原特异性 T 细胞受体 (TCR) 的未成熟 T 细胞的有效繁殖,当这些细胞由肿瘤抗原特异性 T 细胞 6 进行工程时 ,7.然而,将T-iPSC分化为成熟T细胞的精确方法仍有待阐明,该方法将允许产生具有较少分化表型和更好抗肿瘤效力的癌症抗原特异性T细胞。
T-iPSC分化采用OP9鼠位细胞的共同培养,过度表达人类Notch配体DLL1是一种在体外6、7产生T细胞的成熟方法。在小鼠和人类中,这种共培养系统可以持续区分iPSC,从而重述从胚泡阶段到未成熟的T细胞系6、7的发育事件。尽管这些生物技术的进步,CD4+CD8+双阳性(DP)阶段后的生理分化仍然难以实现。原因之一是体内CD4+CD8-和CD4-CD8+单阳性(SP)T细胞在胸腺中产生,胸腺是负责具有外来抗原特异性的T细胞的成熟和选择的器官,但不是自动反应8。这些选择性过程分别定义为正选择和负选择。然而,胸腺中成熟T细胞所需的大多数分子机制仍未完全理解,因此很难在体外重建这一过程。为了克服这一生理障碍,几个组使用抗CD3抗体或激动剂肽刺激TCR复合物。这些体外技术产生细胞产物,表达关键T细胞标记,如CD3,CD8+,TCR+和CD62L,同时仍然保留肿瘤抗原特异性。不幸的是,这些外在方法产生的T细胞构成一个广泛的异质细胞群,其特征是不完全的正选择、先天状特征、TCR非特异性杀伤、无法记忆形成,以及在体内8、9、10、11的非持续性抗肿瘤作用。这些异常引起了人们的担忧,即如果用于治疗应用12、13、14,这些细胞可能会引发各种副作用,包括淋巴瘤以及皮肤和骨骼异常。.
为了重现当前体外分化系统中缺失的生理信号,使用收获的胸腺对肿瘤抗原特异性T-iPSC进行分化。经典胎儿胸腺器官培养(FTOC)系统,旨在研究T细胞的胸膜内发育,通过使用3D培养系统,成功地产生了T细胞,完成了胸腺教育。这些后胸肌T细胞,被指定为iPSC衍生的胸腺移民(iTE),表现出天真般的属性15。iTE显示增殖,记忆形成,和足够的抗肿瘤效果在小鼠模型对既定的B16黑色素瘤肿瘤。本文详细介绍了使用3D培养系统的新型FTOC系统的协议(图1)。
研究方案
所有动物实验均获得国家癌症研究所(NCI)机构动物护理和使用委员会的批准,并按照NIH指南进行。
1. 制备OP9/DLL1细胞,用于iPSC共培养
- 在 OP9 培养基培养性 OP9/DLL1 细胞 (β-最小必需介质 [+-MEM] = 20% 非热灭活胎儿牛血清 [FBS] = 1x 青霉素-链霉素 + 抗坏血酸 [50 纳克/mL] 和单硫甘醇 [100 nM]) 在 37 °C)。当OP9/DLL1细胞达到80~95%的汇合性时,用1倍镁、钙和酚红不含磷酸缓冲盐水(以下简称PBS)洗涤一次。
- 加入4 mL 0.05%胰蛋白酶,在37°C下孵育5分钟。然后加入4 mL的OP9介质,通过移液分离细胞层,使单个细胞悬浮。
- 通过100μm细胞过滤器将细胞悬浮液转移到50 mL锥形管中。在300 x g下在4°C下离心5分钟,吸出上清液,并在OP9介质的12 mL中重新悬浮。
- 将 OP9/DLL1 细胞悬浮液的 2 mL 板放在新的 10 厘米细胞培养培养皿上,并添加额外的 8 mL OP9 介质。每 2~3 天重复一次。
注:FBS 的质量和培养条件对于保持 OP9/DLL1 细胞的扩张而不失去支持 iPSC 分化的能力至关重要。因此,建议在80%的汇合度下对FBS和通道进行预先评估,以防止细胞分化和衰老。制造足够的OP9/DLL1细胞冷冻库存,每4~6周解冻一次新库存也很重要。
2. iPSC在体外分化为不成熟T细胞
-
第 0 天,开始 OP9/DLL1 汇盘中的 iPSC 共同培养。
- 通过胰蛋白酶化(在37°C下5分钟在0.05%胰蛋白酶),收集iPSC作为单细胞悬浮液,收集细胞,并在300 x g下在4°C下离心5分钟。
- 以 OP9 介质每 10 mL 的 1.0 x 105 iPSC 吸气和重新悬浮细胞。将 1.0 x 105 iPSC 盘盘放在可汇 OP9/DLL1 10 厘米盘上。
注:OP9/DLL1 10 cm 的菜肴在达到 90–100% 汇合时用于 iPSC 分化。汇合性的差异会影响 iPSC 分化的效率。
- 第 3 天,吸出旧介质,并更换 10 mL 的新鲜 OP9 介质。
-
第6天,通道细胞。
- 用 10 mL 的 PBS 清洗每个 10 厘米的汇联 OP9 盘。每道菜加入3 mL 0.05%的胰蛋白酶,在室温(RT)下孵育3~5分钟。
- 加入4 mL的OP9介质,通过温和的移液收集细胞。在4°C下,将细胞通过100μm细胞滤网,在300 x g下离心5分钟。丢弃上清液。
- 将细胞重新悬浮在10 mL的分化介质中(OP9介质与5 ng/mL鼠标Flt3配体 [FLT3L] 和 5 ng/mL 小鼠 IL-7)和板细胞悬浮液悬浮到新的 10 cm OP9/DLL1 汇盘中。
- 第 9 天,吸出旧介质,并更换 10 mL 的新鲜分化介质。
-
第11天,在iPSC菌落中观察到心肌细胞,通过移液机械分离非粘附细胞,并通过100μm细胞滤网过滤。在 4°C 下以 300 x g旋转 5 分钟。
- 吸出上清液,并在24 mL的分化介质中重新悬浮。将 iPSC 板盘放入汇入 OP9/DLL1 6 孔板(4 mL/孔)。
-
第15天,收集所有非粘附细胞,并通过40μm细胞滤网过滤。
- 在 4°C 下以 300 x g旋转 5 分钟。
- 通过重复步骤 2.5.1,每 3⁄4 天继续传递非粘附细胞。
3. 3D 胸腺培养,以生成 iTE
- 收获小鼠胎儿胸腺瓣和部署内源性淋巴细胞通过脱氧腺素(dGUO)治疗如前所述16。
- 在 dGUO 治疗的第 7 天,服用四个新的 10 厘米的菜肴,每个盘子都填充 20 mL 的完整介质(罗斯韦尔公园纪念研究所媒体 1640 [RPMI 1640] = 10% FBS = 1x L-阿兰尼-L-谷氨酰胺 + 1x 丙酸钠 = 1x 最小必需介质,含有非必需氨基酸(MEM-NEAA) = 1x 青霉素-链霉素 = [1:1000] 2-梅尔卡托乙醇。
- 将所有带胸腺瓣的硝基纤维素膜转移到一个10厘米的盘中。用钳子将单个叶从膜上分离,使其浸入介质中。丢弃膜。在 RT 孵育 1 小时。
- 将胸腺瓣转移到带有完整介质的 10 厘米新盘,并在 RT 孵育 1 小时。
- 使用钳子,将胸腺瓣固定在盘子上(一次一个),另一只手在中心进行100~200μm深切口,并延伸叶瓣直径的一半,以方便T细胞祖进体迁移到叶中。
- 将胸腺瓣转移到一个新的10厘米的培养皿中,里面装满了完整的分化介质(完整的介质 = 5 纳克/mL 鼠标 IL-7 = 5 ng/mL 鼠标 FLT3L = 5 纳克/mL SCF)。
- 或者,如果使用具有较低和上层网格的 3D 培养板,请用无菌 PBS 填充两个网格,以防止悬挂液的蒸发和干燥。
- 将包含一个 dGuo 处理胸腺瓣的完整介质的 30 μL 从步骤 3.6 转移到 3D 培养板的每个孔中。
- 从 OP9/DLL1 共培养(第 16-21 天)收集非粘附 T 系系细胞(iPSC 衍生未成熟 T 细胞),并在每 20 μL 介质中以 2⁄5 x 103 T系骨细胞重新悬浮。
- 在 3D 培养板中的每个胸腺瓣中加入 20 μL 的 T 系系细胞悬浮液。在37°C下孵育过夜,CO2为5%。
- 将 P200 移液器设置为 30 μL,并在从每个井中移液几次后吸出介质,以去除胸腺瓣周围的所有细胞。丢弃介质并添加 30 μL 的完整介质。重复此过程 5~7 次,取出任何未迁移到叶的超脱 T 细胞。之后每天更换 25-30 μL 的介质。
- 通过光显微镜,确认从第 4-5 天开始,在叶周围形成 iPSC 衍生胸腺移民 (iTE) 的光环。
- 每天通过移液介质收集 iTE,而不会造成叶瓣中断。每天更换介质,并继续收集约 12 天。
- 收获的iTE可用于分子分析(图2,图3,图4,图5)或体内移植实验。
4. 抗原呈现细胞的制备(APC)
- 牺牲一个C57BL/6鼠标通过宫颈错位,并放置在实验室浸泡垫上,如上所述。
- 取出脾脏,并将其放在100μm细胞过滤器上。使用 12 mL 注射器柱塞将脾脏压缩到滤网上,使单个细胞悬浮。
- 通过无菌的40μm细胞过滤器转移细胞悬浮液。在300 x g下将悬浮液在4°C下离心5分钟,以颗粒细胞。
- 吸出上清液,在2 mL氯化铵-钾(ACK)赖沙缓冲液中重新悬浮细胞颗粒,以排除红血球(RBC)。在 RT 孵育 5 分钟。
- 通过添加 10 mL 的 PBS 来淬火 ACK 解液缓冲液。在4°C下,在300 x g下通过离心将细胞进行5分钟的离心。
- 吸出上清液,将细胞颗粒重新悬浮在10 mL的完整培养基中,并转移到10厘米无菌培养皿中。
- 使用辐照装置(β-辐射)用3500 rad照射孢子,以防止细胞增殖。
- 立即将辐照细胞返回到37°C培养箱,并在一夜之间培养。
- 使用辐照细胞作为APC或冻结在细胞银行家。
5. 用抗原脉冲APC
- 使用 Neubauer 细胞测定仪和锥蓝色染料计数活辐照 APC。在37°C下用肽(hgp100)或核蛋白孵育APC30分钟。
- 用10 mL的PBS清洗APC两次,以去除任何额外的肽。
- 在 100 IU IL-2 和 5 ng/mL IL-7 的完整介质中,以 1:1 的比例计算 iTE 并与 APC 混合。将100μL的细胞混合物(总浓度:1 x 106细胞/mL)放入超低附件U底部96孔板的每口孔中,并在37°C下培养48小时。
- 48小时后,使用多通道移液器将细胞转移到新板,此后每2~3天通过一次。
-
在第3天,通过用细胞内抗体染色来分析细胞因子分泌物,并通过流动细胞学进行分析(图3)。
- 加入0.67μL/mL的蛋白质运输抑制剂(例如GolgiStop),在37°C孵育6小时,以增强细胞因子的细胞内积累。用 10 mL 的 PBS 清洗。
- 在3 mL的冷(4°C)PBS中重新悬浮细胞,并缓慢加入1 mL的4%甲醛(PFA)溶液。
- 10分钟后,在300 x g下旋转细胞5分钟,在4°C下,丢弃上清液,用10mL的PBS清洗。
- 在 1 mL PBS + 1% FBS = 0.1% 非离子表面活性剂中重新悬浮细胞,并在 4°C 中放置 10-15 分钟。
- 添加抗体,保护样品免受光线照射,并在4°C中放置30分钟。
- 在300 x g下旋转细胞5分钟,在4°C下,丢弃上清液,用10mL的PBS清洗。
- 在300 x g下在4°C下将细胞旋转5分钟,并在1mL的PBS中重新悬浮细胞。细胞已准备好在流动细胞仪中进行分析。
结果
共培养的胎儿胸腺被分割,以分析iPSC衍生的T系细胞是否可以迁移到胸腺瓣。非种子控制叶具有组织结构,其特征是星形细胞状胸腺皮网17,部署内源性CD3+细胞。另一方面,用iPSC衍生的未成熟T细胞播种的胸腺瓣被重新填充CD3+单核细胞,表明iPSC衍生的未成熟T细胞迁移到叶中(图2A)。
在胸腺微环境中迁移和成熟的T细胞随后以iTE离开。为了测试其表型表征,对C57BL6胸腺细胞、Pmel iPSC衍生的不成熟T细胞(外胸细胞)和从胸腺瓣(iTE)流出的细胞进行了流式细胞分析。OP9/DLL1 上的超分体 T 细胞显示 CD4+CD8+ (DP) T 细胞和 CD8+SP T 细胞,没有表达正选择标记 MHC-I,而 iTE 具有 CD8_SP MHC-I+ T 细胞表型的明确总体,表明其在从胸腺叶出口之前,通过正选择成功通过。iTE始终表示MHC-I和CD62L,这是与高增殖能力,细胞因子生产,外周生存,淋巴类类结18,19,20相关的标记。这种表型与M2 SP胸腺细胞一致,这是胸腺20中单阳性T细胞的最成熟群体,这表明iTE已经通过正常的胸腺发育程序过渡(图3)。为了监测iTE生成的效率,分离了从单个胸腺瓣分离出的细胞。在第7天,胸腺瓣平均产生1 x 103活CD8SP CD45.1+ CD3+ iTE每天(图3B)。从 3D 胸腺共培养第 6 天到第 12 天观察到类似的 iTE 生产速率。
分析了细胞因子的抗原依赖性活化和分泌,以观察胸腺教育iPSC衍生的未成熟T细胞的功能特性。在存在不相关的肽(核蛋白)的情况下,Pmel-iTE没有释放大量TNF-α、IL-2或IFN-α。当用Pmel T细胞(hgp100)的干酪肽刺激时,Pmel-iTE释放出强量的TNF-α和IL-2,同时产生低量的IFN-α(图4),表明受胸病教育的iTE可以识别其共性肽和分泌效应细胞因子,其轮廓类似于自然近期胸腺移民(RTE)。
为了检查在OP9/DLL1上分化的iPSC衍生T系细胞之间的转录差异,无论是否进行胸腺教育(即iTE与外胸T细胞),对这两个群体进行了RNA-seq分析并进行了比较使用OP9/DLL1(DP)和初级幼稚CD8+Pmel T细胞分化的DP T系系细胞。分析了102个基因的表达,这些基因在T细胞对体细胞、胸腺细胞活化和记忆形成中起着至关重要的作用,分析为15、20、21、22。对这四个研究群体的主要成分分析表明,超量生成的DP和CD8SP T细胞聚集在一起,而iTE聚类更接近天真的T细胞(图5)。总体而言,这些数据表明,iTE的表型更接近天真的T细胞,而不是由外显化方法生成的T系状细胞。
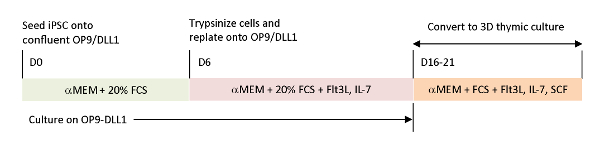
图 1:使用 OP9/DLL1 和 3D 胸腺培养的 iPSC 与 iTE 差异化的原理概述。该协议涉及三个独立的区分步骤;(左)从iPSC细胞到OP9/DLL1(第0至6天)的造血代相细胞,从造血酶体细胞到OP9/DLL1的未成熟T细胞(第6至16-21天),以及(右)从未成熟的T细胞(第16-21天)到iTE 使用 3D 胸腺培养系统。请点击此处查看此图的较大版本。
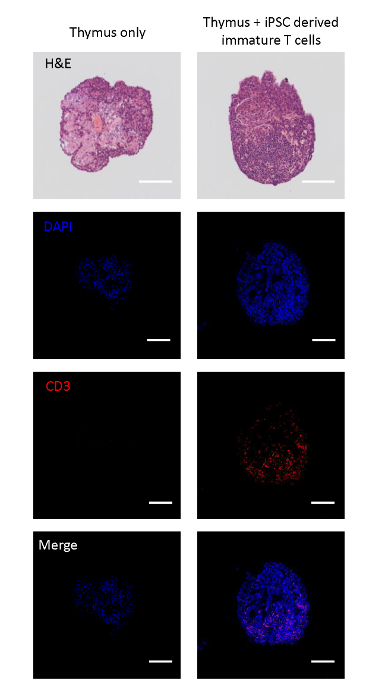
图 2: 用iPSC衍生的不成熟T细胞播种的胸腺瓣的免疫组织化学。顶部:带和未播种iPSC衍生未成熟T细胞的胸腺瓣的H&E染色。从第二从上到下:与DAPI(细胞核)、CD3(T细胞)染色的截面叶的共聚焦图像,并合并。比例尺 = 100 μm。请点击此处查看此图的较大版本。
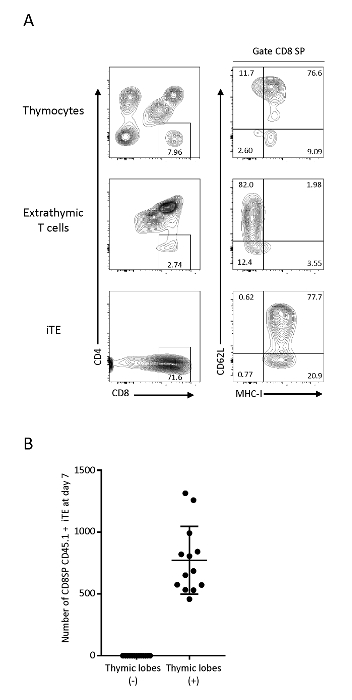
图 3:iTE 显示后胸科 T 细胞表型。(A) FACS 对胸腺细胞、胸外 T 细胞(OP9/DLL1 共培养系统)和 Pmel-iTE 的分析。活细胞被封闭在共性CD45=。CD8 SP人群进一步分析了CD62L和MHC-I表达。(B) 预播种后7天每叶一夜之间产生的CD8SP CD45.1 iTE的平均数量。从12个独立实验中收集数据。请点击此处查看此图的较大版本。
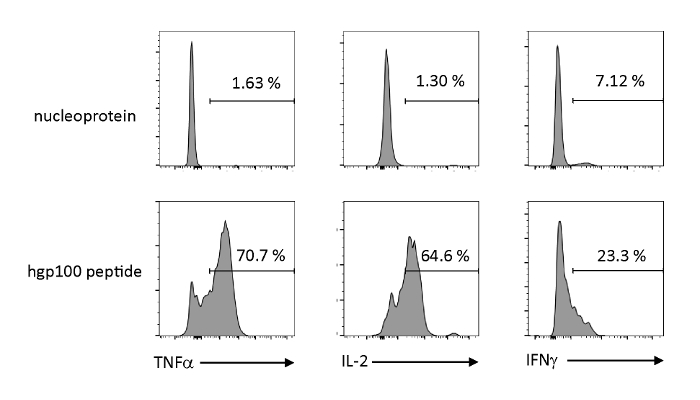
图 4: iTE通过抗原特异性刺激产生各种细胞因子。FACS分析iTE细胞因子细胞因子的细胞内生产。iTE 与预加载的 APC 共同培养,预加载不相关(核蛋白)或共和(hgp100)肽三天。右上象限中显示的数字表示 iTE 产生细胞因子的百分比。请点击此处查看此图的较大版本。
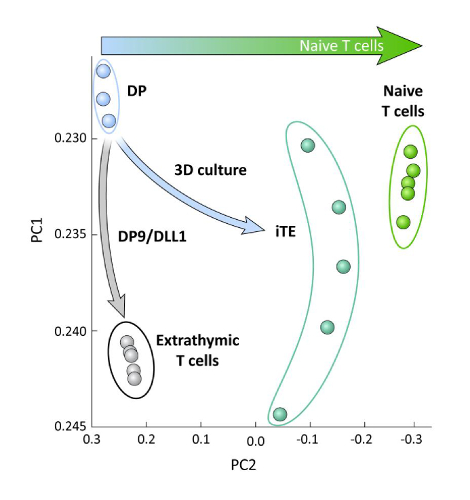
图 5:全转录组分析显示iTE基因表达向天真CD8的转变+T 细胞程序。来自DP、外音CD8SP、iTE和天真T细胞的RNA-seq数据的主要成分分析(PCA)。(使用公共数据库GSE105110分析102个与胸腺分化相关的基因)15.请点击此处查看此图的较大版本。
讨论
使用T-iPSC再生肿瘤抗原特异性T细胞,通过产生具有改善持久性的年轻细胞,可以克服ACT目前的许多障碍。虽然已经报告使用OP9/DLL1共培养系统的几种方法产生CD8 SP细胞6,7,10,13,表达CD8分子和肿瘤抗原特异性TDR,全球基因表达模式和功能分析表明,这些超音再生的CD8 SP细胞不同于天真的T细胞(图4)。在这里,我们描述了一个3D胸腺培养系统,可以产生iPSC衍生的胸腺移民(iTE),高保真度和同质性从鼠T-iPSC。iTE类似于天真的T细胞,在全球基因表达模式和功能,如记忆形成和体内抗肿瘤作用对既定的肿瘤15。
经典的FTOC系统是一种在体外重述胸腺选择的方法。它已用于研究胸腺内发育的胸腺细胞23,并有几个报告FTOC用于生成RTE24。但是,FTOC 系统有几个限制。为了应对人工器官培养中的缺氧问题,一些小组要么使用半干膜培养基23,要么使用高氧浸没培养系统25。然而,目前没有一种方法能够持续产生同质的后胸T细胞群。为了克服传统FTOC系统的局限性,我们设计了一个3D胸腺培养系统,与传统方法相比提供技术改进15。例如,使用我们的 3D 胸腺培养方法,最大氧交换和表面叶机械应力的缺乏使胸腺瓣保持在一个更生理的环境中。此外,长期培养允许成熟的T细胞从胸腺瓣自然离开。最后,实时观察和微操作使媒体交换和iTE的不断收集而不会在物理上干扰胸腺瓣。因此,3D 胸腺培养方法提供了显著的技术改进,并为研究胸腺选择的以前从未提供的天真 T 细胞提供了途径。
使用这个 3D 胸腺培养系统成功生成 iTE 有几个关键点。FBS 的质量和培养条件对于保持 OP9/DLL1 细胞的扩张而不失去支持 iPSC 分化的能力至关重要。因此,我们建议对FBS批次进行预先评估,并在80%的汇合度下持续通过,以防止细胞分化和衰老。此外,在体外分化iPSC到不成熟的T细胞中需要一种融合OP9/DLL1培养物,因为汇合性的差异会影响其效率。最后,胸腺瓣的胚胎年龄对iTE的产生至关重要。我们建议使用 E14.5 - 15.5 胸腺瓣。
与任何新协议一样,此方法有局限性,需要改进。这里介绍的文化技术每天产生大约1000 iTE,每次胸腺瓣,为期两周。通过进一步的修改(包括优化氧气浓度、介质体积和 3D 培养板类型),可能会增加 iTE 生成。细胞因子的添加或去除,以及细胞因子浓度的变化,也可能有助于提高iTE产量。
由于这里介绍的3D胸腺培养系统可以在完全外生系统中产生胸腺迁移,该技术可应用于各种免疫学和收养性细胞转移研究项目,包括但不限于T细胞分化、后胸T细胞成熟,以及从造血原或干细胞生成抗原特异性T细胞。虽然这种方法不直接适用于人体样本,但iTE和3D胸腺培养系统具有巨大的潜力,可以阐明正正选择的分子机制,并可能促进培养系统的创建,使为ACT生成临床相关的肿瘤抗原特异性天真的T细胞。
披露声明
作者劳尔·维兹卡尔多、尼古拉斯·克莱门和尼古拉斯·雷斯蒂夫是正在申请国际专利申请PCT/US2017/65986的发明者,于2017年12月13日提交,题目是"制备分离或纯化的细胞群的方法"和使用相同的治疗方法。
致谢
我们感谢川本弘和木田孝子,他们亲切地提供OP9/DLL1细胞系。我们感谢艾伦·胡弗林和埃里娜·Z。他寻求图形援助。这项研究得到了美国国家癌症研究所(ZIA BC010763)的内学研究计划(ZIA BC010763)和NIHNCI细胞治疗中心的癌症月射项目的支持。这项工作还得到了米尔斯坦家庭基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| Chemicals, Peptides and Recombinant Proteins | |||
| 2-deoxyguanosine | Sigma-Aldrich | 312693-72-4 | |
| 2-Mercaptoethanol (1,000x) | Thermo Fisher Scientific | 21985-023 | |
| ACK Lysing Buffer | Gibco | A1049201 | |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| Blasticidin | Thermo Fisher Scientific | R21001 | |
| FBS | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| GlutaMAX (100x) | Thermo Fisher Scientific | 35050-061 | |
| hgp100 | Genscript | 282077-1, KVPRNQDWL | |
| Interleukin-2 | R&D Systems | 402-ML | |
| Interleukin-7 | R&D Systems | 407-ML | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| MEM powder | Gibco | 61100061 | |
| Monothioglycerol | Sigma-Aldrich | M-6145 | |
| Nucleoprotein | Global Peptides | ASNENMETM | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Puromycin | Thermo Fisher Scientific | A1113803 | |
| RPMI 1640 | Gibco | 11875093 | |
| Sodium Pyruvate | Thermo Fisher Scientific | 11360-070 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| Stemfactor LIF, Mouse Recombinant | STEMGENT | 03-0011-100 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Cell Culture Vessels and others | |||
| 10 cm dish | Corning, Inc. | 353003 | |
| 12 mL Syringe | Covidien Monoject | 22-652-090 | |
| 6 well plate | Corning/Coster | 3516 | |
| Cell strainer 100 μm | Fisher Scientific | 22-363-549 | |
| Cell strainer 40 μm | Fisher Scientific | 22-363-547 | |
| Forceps | DUMONT | 0108-5PO | |
| Lab soaker mat | Versi-Dry | Cat. EF2175CX 74018-00 | |
| Membrane filters ( 0.8 μm, 47diam) | Whatman | WHA7408004 ALDRICH | |
| Perfecta3D Hanging Drop Plate | Sigma-Aldrich | HDP1096 | |
| U Bottom 96 well plate | Corning/Coster | 3799 | |
| Experimental Cell lines | |||
| CD3-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| MEF-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Mouse Embryonic Fibroblasts (MEF) | ATCC | SCRC-1040; RRID:MGI:5007926 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | |
| Pmel-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Experimental mouse models | |||
| B6.SJL-PtprcaPepcb/BoyCrCrl | Charles River | Strain Code 564; RRID:IMSR_CRL:564 | |
| C57BL/6N | NCI/Charles River | N/A | |
| Pmel-1 mice | Overwijk et al. | J Exp Med 198(4):569-80 | |
| Antibodies | |||
| Anti-aTCR | Biolegend | 109202; RRID:AB_313425 | |
| Anti-CD3 | abcam | ab11089; RRID:AB_369097 | |
| Anti-CD4 | BD Biosciences | 553730; RRID:AB_395014 | |
| Anti-CD44 | BD Biosciences | 559250; RRID:AB_398661 | |
| Anti-CD45.1 | BD Biosciences | 553775; RRID:AB_395043 | |
| Anti-CD45.2 | BD Biosciences | 553772; RRID:AB_395041 | |
| Anti-CD62L | BD Biosciences | 560516; RRID:AB_1645257 | |
| Anti-CD69 | BD Biosciences | 552879; RRID:AB_394508 | |
| Anti-CD8a | BD Biosciences | 557959; RRID:AB_396959 | |
| Anti-CD8b | BD Biosciences | 550798; RRID:AB_393887 | |
| Anti-H-2Kb | BD Biosciences | 553570; RRID:AB_394928 | |
| Anti-IFN-g | BD Biosciences | 557998; RRID:AB_396979 | |
| Anti-IL-2 | BD Biosciences | 554428; RRID:AB_395386 | |
| Anti-TCRb | Thermo Fisher Scientific | 35-5961-81; RRID:AB_469741 | |
| Anti-TCRVb13 | BD Biosciences | 553204; RRID:AB_394706 | |
| Anti-TNFa | BD Biosciences | 557644; RRID:AB_396761 |
参考文献
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Singh, N., Perazzelli, J., Grupp, S. A., Barrett, D. M. Early memory phenotypes drive T cell proliferation in patients with pediatric malignancies. Science Translational Medicine. 8 (320), 320-323 (2016).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends of Immunology. 35 (4), 178-185 (2014).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Yamagata, T., Mathis, D., Benoist, C. Self-reactivity in thymic double-positive cells commits cells to a CD8 alpha alpha lineage with characteristics of innate immune cells. Nature Immunology. 5 (6), 597-605 (2004).
- Themeli, M., et al. Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nature Biotechnology. 31 (10), 928-933 (2013).
- Serwold, T., Hochedlinger, K., Inlay, M. A., Jaenisch, R., Weissman, I. L. Early TCR expression and aberrant T cell development in mice with endogenous prerearranged T cell receptor genes. Journal of Immunology. 179 (2), 928-938 (2007).
- Lei, F., et al. In vivo programming of tumor antigen-specific T lymphocytes from pluripotent stem cells to promote cancer immunosurveillance. Cancer Research. 71 (14), 4742-4747 (2011).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Serwold, T., et al. T-cell receptor-driven lymphomagenesis in mice derived from a reprogrammed T cell. Proceedings of the National Academy of Sciences of the United States of America. 107 (44), 18939-18943 (2010).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- Jenkinson, W., Jenkinson, E., Anderson, G. Preparation of 2-dGuo-treated thymus organ cultures. Journal of Visualized Experiments. (18), (2008).
- Hamazaki, Y., Sekai, M., Minato, N. Medullary thymic epithelial stem cells: role in thymic epithelial cell maintenance and thymic involution. Immunological Reviews. 271 (1), 38-55 (2016).
- Vivier, E., et al. Innate or adaptive immunity? The example of natural killer cells. Science. 331 (6013), 44-49 (2011).
- Rosen, S. D. Ligands for L-selectin: homing, inflammation, and beyond. Annual Review of Immunology. 22, 129-156 (2004).
- Hogquist, K. A., Xing, Y., Hsu, F. C., Shapiro, V. S. T Cell Adolescence: Maturation Events Beyond Positive Selection. Journal of Immunology. 195 (4), 1351-1357 (2015).
- Best, J. A., et al. Transcriptional insights into the CD8(+) T cell response to infection and memory T cell formation. Nature Immunology. 14 (4), 404-412 (2013).
- Schmitz, I., Clayton, L. K., Reinherz, E. L. Gene expression analysis of thymocyte selection in vivo. International Immunology. 15 (10), 1237-1248 (2003).
- Nitta, T., Ohigashi, I., Takahama, Y. The development of T lymphocytes in fetal thymus organ culture. Methods in Molecular Biology. 946, 85-102 (2013).
- Ueno, T., et al. Role for CCR7 ligands in the emigration of newly generated T lymphocytes from the neonatal thymus. Immunity. 16 (2), 205-218 (2002).
- Watanabe, Y., Katsura, Y. Development of T cell receptor alpha beta-bearing T cells in the submersion organ culture of murine fetal thymus at high oxygen concentration. European Journal of Immunology. 23 (1), 200-205 (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。