Method Article
뮤린 유도 만능 줄기 세포 유래 종양 항원 특이적 흉선 유이주자를 생성하는 3차원 흉선 배양 시스템
* 이 저자들은 동등하게 기여했습니다
요약
본 문서에서는 3차원(3D) 흉선 배양 시스템에 의해 종양 항원 특이적 유도 만능 줄기 세포 유래 흉선 이주자(iTE)를 생성하는 새로운 방법을 설명한다. iTE는 증식, 기억 형성 및 종양 억제 능력을 가진 순진한 T 세포와 밀접하게 관련된 T 세포의 균질한 서브세트이다.
초록
사전 재배열 된 T 세포 수용체 (TKR) 및 그들의 후생 유전학 회춘의 상속은 유도 만능 줄기 세포 (iPSC)-파생 된 T 세포를 입양 T 세포 치료 (ACT)에 대한 유망한 공급원입니다. 그러나, iPSC로부터 재생성 된 T 세포를 생산하기위한 고전적인 시험관 내 방법은 선천적 또는 말단 분화 T 세포 중 하나를 초래하며, 이는 현상유형및 기능적으로 순진한 T 세포와 구별된다. 최근, 새로운 3차원(3D) 흉선 배양 시스템은 CD8αβ+ 항원 특이적 T 세포의 균질한 서브세트를 생성하기 위해 개발되었으며, 이는 증식, 기억 형성을 위한 용량을 포함하는 순진한 T 세포와 같은 기능적 표현형을 갖는다. , 및 생체 내 종양 억제. 이 프로토콜은 iPSC 유래 흉선 이주자(iTE)로 지정된 임상적으로 관련된 iPSC 유래 T 세포의 생성을 허용하는 비정상적인 발달 운명을 방지하는 동시에 필요한 후속 기능을 해명할 수 있는 강력한 도구를 제공합니다. 흉선 선택 후 T 세포 성숙을 위해.
서문
입양 T 세포 치료 (ACT)는 진행된 암을 가진 몇몇 환자를 위한 효과적인 처리일 수 있습니다. 불행히도 많은 환자는 종양 회귀를 경험하지 않으며 주입 후 전이 된 세포가 지속되지 못합니다. 이는 주입된 T 세포의 품질 때문일 수 있다. ACT 마우스 모델은 순진하거나 덜 분화된 중앙 기억 T 세포에 비해, 말단 분화 이펙터 세포가생체 내 지속성 불량으로 인해 덜 강력하다는 것을 보여주었으며, 임상 데이터 2에 의해 지원되는 관찰도있다. 3.
현재 ACT의 효능을 향상시키기 위한 노력의 일환으로, T 세포 유래 유도 만능 줄기세포(T-iPSC)는4,5. T 세포가 T-iPSC로 다시 프로그래밍되고 T 세포로 재분화될 때, TCR 유전자의 재배열된 구성은 T-iPSC에 의해 승계되고, 이어서 다시 분화된 T 세포. 따라서, T-iPSC의 용량은 무한한 시험관 내 팽창을 거치며 이러한 세포가 종양 항원 특이적 T 세포로부터 설계될 때 신항원 특이적 T 세포 수용체(TCR)를 운반하는 미성숙 T 세포의 효율적인 재생을 허용한다6 ,7. 그러나, T-iPSC를 성숙한 T 세포로 분화하기 위한 정확한 방법은, 덜 분화된 표현형 및 더 나은 항종양 효능을 가진 암 항원 특이적 T 세포의 생산을 허용할 것이고, 해명될 수 있다.
T-iPSC 분화는 OP9 뮤린 기질 세포의 공동 배양을 이용한 인간 노치 리간드 DLL1을 과도하게 발현하는시험관내 T 세포를 생산하는 잘 확립된 방법이다 6,7. 마우스 및 인간에서, 이러한 공동 배양 시스템은 iPSC를 일관되게 분화할 수 있고, 이에 따라 blastocyst 단계로부터 미성숙한 T 세포 계질 단계6,7까지의 발달 이벤트를 되풀이할 수 있다. 이러한 생명공학적 진보에도 불구하고, CD4+CD8+ 이중 양성(DP) 단계 후의 생리학적 분화는 여전히 달성하기 어렵다. 그 이유 중 하나는 생체 내 CD4+CD8- 및 CD4-CD8+ 단일 양성 (SP) T 세포가 흉선에서 생성되며, 외래 항원 특이성을 가진 T 세포의 성숙 및 선택을 담당하는 기관이지만 자동 반응하지 않음8. 이러한 선택적 프로세스는 각각 양수 및 음수 선택으로 정의됩니다. 그러나, 흉선에 있는 성숙한 T 세포에 필요한 분자 기계장치의 대부분은 아직도 완전히 이해되지 않습니다, 시험관에서 이 프로세스를 재구성하는 것을 어렵게 만들기. 이러한 생리적 장애물을 극복하기 위한 시도에서, 몇몇 그룹은 항 CD3 항체 또는 작용제 펩티드를 사용하여 TCR 복합체를 자극했다. 이러한 시험관 내 기술은 여전히 종양 항원 특이성을 유지하면서 CD3, CD8αβ, TCRαβ 및 CD62L과 같은 주요 T 세포 마커를 발현하는 세포 제품을 생성합니다. 불행하게도, 이러한 엑스트라티즘 방법에 의해 생성된 T 세포는 불완전한 양성 선택, 선천적 특징, TCR 비특이적 살인, 기억 형성을 위한 무능력, 및 생체 내 비 지속적 항종양 효과 8, 9,10,11. 이러한 이상은 이러한 세포가 림프종과 피부 및 뼈 이상을 포함한 다양한 부작용을 유발할 수 있다는 우려를 제기하고 있다, 치료 응용 프로그램에 사용되는 경우12,13,14 .
현재 시험관 내 분화 시스템에서 누락된 생리학적 신호를 재현하기 위해, 종양 항원 특이적 T-iPSC는 수확된 흉선을 사용하여 분화되었다. T 세포의 흉선 내 발달을 연구하도록 설계된 고전적인 태아 흉선 장기 배양 (FTOC) 시스템은 흉선 교육을 완료한 T 세포를 성공적으로 생산하는 3D 배양 시스템을 사용하여 개선되었습니다. 이들 포스트-흉선 T 세포는 iPSC 유래 흉선 이주자(iTE)로 지정되었고, 순진한 유사 성질을 나타내었다15. iTE는 확립된 B16 흑색종 종양에 대하여 마우스 모형에 있는 증식, 기억 형성 및 적당한 항종양 효력을 보여주었습니다. 이 문서에서는 3D 문화 시스템을 사용하는 이 새로운 FTOC시스템의 프로토콜에 대해 자세히 설명합니다(그림 1).
프로토콜
모든 동물 실험은 국립 암 연구소 (NCI)의 기관 동물 관리 및 사용 위원회에 의해 승인되고 NIH 지침에 따라 수행되었습니다.
1. iPSC와 공동 배양용 OP9/DLL1 셀 준비
- OP9 배지에서배양 OP9/DLL1 세포(α-최소 필수 배지 [α-MEM] + 20% 비열불열태아소 혈청 [FBS] + 1x 페니실린-스트렙토마이신 + 아스코르브산 [50 ng/mL] 및 모노티오글리세 [100 nM]). OP9/DLL1 세포가 80-95% 합원에 도달하면 마그네슘, 칼슘 및 페놀 레드 프리 인산염 완충식염수린(이하 PBS라고 함)으로 한 번 씻으세요.
- 0.05% 트립신의 4 mL를 추가하고 37 °C에서 5 분 동안 배양하십시오. 그런 다음 OP9 매질 4 mL을 추가하고, 단일 셀 현탁액을 만들기 위해 파이펫팅하여 세포 층을 해리합니다.
- 100 μm 세포 스트레이너를 통해 50 mL 원점 튜브로 세포 현탁액을 전송합니다. 300 x g에서 4°C에서 5분 동안 원심분리기를 흡인하고, OP9 매체의 12 mL에서 재중단한다.
- 새로운 10cm 세포 배양 페트리 접시에 OP9/DLL1 세포 현탁액의 플레이트 2 mL을 추가하고 OP9 배지의 8 mL을 추가합니다. 2-3일마다 반복합니다.
참고: FBS 및 배양 조건의 품질은 iPSC 분화를 지원하는 능력을 잃지 않고 OP9/DLL1 세포의 확장을 유지하는 데 매우 중요합니다. 따라서, 세포 분화 및 노화를 방지하기 위해 80% 수렴에서 FBS 및 통로의 많은 것을 일관되게 미리 평가하는 것이 좋습니다. 또한 OP9/DLL1 셀의 충분한 냉동 재고를 만들고 4-6주마다 새로운 재고를 해동하는 것이 중요합니다.
2. 미성숙 T 세포로 iPSC의 시험관 내 분화
-
0일째에 OP9/DLL1 동시 요리에서 iPSC 공동 문화를 시작합니다.
- iPSC를 트립시화(37°C에서 0.05% 트립신에서 5분) 단일 세포 현탁액으로 수확하고, 세포를 수집하고, 300 x g에서 300 x g에서 4°C에서 5분 동안 원심분리기를 수집하였다.
- OP9 매체의 10 mL 당 1.0 x 105 iPSC에서 상판 및 재중단 세포를 흡인한다. 접시 1.0 x 105 iPSC를 콘립OP9/DLL1 10cm 접시에 놓습니다.
참고: OP9/DLL1 10cm 요리는 90-100% 동률에 도달하면 iPSC 분화에 사용됩니다. 합류의 차이는 iPSC 분화의 효율성에 영향을 미칠 수 있습니다.
- 3일째에는 오래된 미디어를 흡인하고 10mL의 신선한 OP9 미디어로 교체합니다.
-
6 일째에, 통로 세포.
- 각 10cm 의 PS 10 mL로 OP9 접시를 씻으소서. 접시 당 0.05 % 트립신의 3 mL를 추가하고 실온 (RT)에서 3-5 분 동안 배양하십시오.
- OP9 용지 4mL를 추가하고 부드러운 파이펫팅으로 셀을 수집합니다. 4°C에서 5분 동안 300 x g에서 100 μm 세포 스트레이너 및 원심분리기를 통과시다. 상급을 버리십시오.
- 분화 매체의 10 mL에서 세포를 다시 일시 중단 (5 ng/mL 마우스 Flt3 리간드 [FLT3L] 및 5 ng/mL 마우스 IL-7와 OP9 매체) 및 플레이트 셀 현탁액을 새로운 10 cm OP9/DLL1 동시 접시에.
- 9일째에는 오래된 매체를 흡인하고 10 mL의 신선한 분화 매체로 교체합니다.
-
11일째에 iPSC 콜로니에서 심근세포가 관찰되면, 100 μm 세포 스트레이너를 통해 파이펫팅및 필터에 의해 비부착 세포를 기계적으로 분리한다. 4 °C에서 5 분 동안 300 x g에서 회전하십시오.
- 상급을 흡인하고 분화 매체의 24 mL에서 다시 중단합니다. 콘립OP9/DLL1 6웰 플레이트(4mL/well)에 iPSC 플레이트를 넣습니다.
-
15일째에 모든 비부착 세포를 수집하고 40 μm 세포 스트레이너를 통해 여과합니다.
- 4 °C에서 5 분 동안 300 x g에서 회전하십시오.
- 2.5.1단계를 반복하여 3-4일마다 비부착 세포를 계속 통과시다.
3. iTE를 생성하는 3D 흉선 기관 문화
- 수확 마우스 태아 흉엽은 앞서설명한 바와같이 내인성 림프구를 deoxyguanosine(dGUO) 처리에 의해 전개한다.
- dGUO 치료의 7 일에, 네 개의 새로운 10cm 접시를 가지고 완전한 미디어의 20 mL로 각각 채우기 (로스 웰 파크 기념 연구소 미디어 1640 [RPMI 1640] + 10 % FBS + 1x L 알라닐 - L-글루타민 + 1x 나트륨 피루바테 + 비 필수 아미노산1x 최소 필수 매체 (MEM-NEAA) + 1회 페니실린-스트렙토마이신 + [1:1000] 2-메르카페토 에탄올).
- 모든 니트로셀룰로오스 멤브레인을 흉엽으로 10cm 접시에 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김을 넣습니다. 멤브레인에서 개별 로브를 집게로 분리하여 미디어에 잠기도록 합니다. 멤브레인을 버리십시오. RT에서 1 시간 동안 배양하십시오.
- 완전한 매체를 가진 새로운 10cm 접시에 흉엽을 옮기고 RT에서 1 시간 동안 배양하십시오.
- 집게를 사용하여, 접시에 흉엽을 고정 (한 번에 하나씩), 다른 한편으로는 중앙에 100-200 μm 깊은 절개를하고 로브의 절반 직경을 확장하여 T 세포 전구가 로브로 이동을 용이하게합니다.
- 완전한 분화 매체로 채워진 새로운 10cm 접시에 흉엽을 옮니다 (완전한 매체 + 5 ng/mL 마우스 IL-7 + 5 ng/mL 마우스 FLT3L + 5 ng/mL SCF).
- 선택적으로, 하부 및 상부 그리드가 있는 3D 배양 플레이트를 사용하는 경우, 매달려 있는 방울의 증발과 건조를 방지하기 위해 두 그리드를 멸균 PBS로 채웁니다.
- 3.6단계에서 1개의 dGuo 처리된 흉엽을 포함하는 완전 배지의 30 μL을 각 웰 내로 3D 배양 플레이트로 이송한다.
- OP9/DLL1 공동 배양(16-21일)으로부터 비부착 T 계보 세포(iPSC 유래 미성숙 T 세포)를 수집하고(20 μL 배지 당 2-5 x 103 T 계보 세포에서 재중단)
- 3D 배양 플레이트의 각 흉엽에 T 계보 세포 현탁액 20 μL을 추가합니다. 37°C에서 5% CO2로 밤새 배양합니다.
- P200 파이펫을 30 μL로 설정하고 각 우물에서 여러 번 피펫을 피펫한 후 매질에 흡인하여 흉엽을 둘러싼 모든 세포를 제거합니다. 용지를 버리고 30 μL의 완전한 용지를 추가합니다. 이 절차를 5-7 번 반복하여 로브로 이동하지 않는 여분의 미성숙 T 세포를 제거하십시오. 그 후 매일 미디어의 25-30 μL을 변경합니다.
- 가벼운 현미경 검사법에 의해 4-5일째부터 로브 주변에 iPSC 유래 흉선 이주자(iTE)의 후광 형성을 확인합니다.
- 로브 중단 없이 미디어를 파이펫팅하여 매일 iTE를 수집합니다. 매일 미디어를 변경하고 약 12 일까지 수집을 계속합니다.
- 수확된 iTE는 분자 분석(도2, 도3, 도 4및 도5) 또는 생체 내 이식 실험에 사용할 준비가 되어 있다.
4. 항원 제시 세포의 준비 (APC)
- 자궁 경부 탈구에 의해 C57BL / 6 마우스를 희생하고 위에서 설명한 대로 실험실 담가 매트에 놓습니다.
- 비장을 제거하고 100 μm 세포 여과기에 놓습니다. 12 mL 주사기 플런저를 사용하여 스트레이너에 비장을 압축하여 단일 셀 현탁액을 만듭니다.
- 멸균 된 40 μm 세포 스트레이너를 통해 세포 현탁액을 옮니다. 300 x g에서 300 x g에서 4°C에서 5분 동안 현탁액을 펠렛세포에.
- 상월체를 흡인하고 적혈구를 배제하기 위해 암모늄 염화물 칼륨 (ACK) 용해 완충액의 2 mL에서 세포 펠릿을 재중단 (RBC). RT에서 5 분 동안 배양하십시오.
- PBS의 10 mL를 추가하여 ACK 라시스 버퍼를 담금질합니다. 4°C에서 5분 동안 300 x g에서 원심분리에 의해 세포를 펠렛.
- 상월체를 흡인하고 10 mL의 완전한 매체로 세포 펠릿을 재중단하고 10 cm 멸균 페트리 접시로 옮김.
- 세포 증식을 방지하기 위해 조사 장치 (γ-방사선)를 사용하여 3500 rad로 비장 세포를 조사합니다.
- 조사된 세포를 즉시 37°C 인큐베이터및 배양하여 하룻밤 동안 되돌려 한다.
- 조사된 세포를 APC로 사용하거나 세포 뱅커에서 동결하십시오.
5. 항원으로 맥동 APC
- Neubauer 혈세포계 및 트라이판 블루 염료를 사용하여 조사 된 APC를 실시간으로 계산합니다. 37°C에서 30분 동안 펩티드(hgp100) 또는 뉴클레오프로테인으로 APC를 배양한다.
- 여분의 펩티드를 제거하기 위해 PBS 10 mL로 APC를 두 번 씻으하십시오.
- iTE를 계산하고 100 IU IL-2 및 5 ng/mL IL-7로 완전한 미디어에서 1:1 비율로 APC와 혼합합니다. Aliquot 100 μL의 세포의 혼합물(총 농도: 1 x 106 세포/mL)을 37°C에서 48시간 동안 초저 부착 U 하부 96 웰 플레이트 및 배양물의 각 웰내로 하였다.
- 48시간 후, 세포를 다채널 파이펫을 사용하여 새로운 플레이트로 옮기고 그 후 2-3일마다 통과한다.
-
3일째에 세포내 항체로 세포를 염색하여 사이토카인 분비 프로파일을 분석하고 유세포분석으로 분석한다(그림 3).
- 단백질 수송 억제제 (예를 들어, GolgiStop)의 0.67 μL / mL을 추가하고 사이토 카인의 세포 내 축적을 향상시키기 위해 37 °C에서 6 시간 동안 배양하십시오. PBS 10 mL로 씻으시다.
- 3 mL의 콜드(4°C) PBS에서 세포를 재중단하고 1 mL의 차가운 4% 파라포름알데히드(PFA) 용액을 천천히 첨가합니다.
- 10 분 후, 4 °C에서 5 분 동안 300 x g에서 세포를 스핀 다운하고 상류제를 버리고 10 mL의 PBS로 씻으십시오.
- 1 mL PBS + 1% FBS + 0.1% 난오계면활성제에서 세포를 재중단하고, 10-15분 동안 4°C에 놓습니다.
- 항체를 추가하고, 빛으로부터 시료를 보호하고 30 분 동안 4 °C에 놓습니다.
- 4 °C에서 5 분 동안 300 x g에서 세포를 스핀 다운하고 상류제를 버리고 10 mL의 PBS로 씻으십시오.
- 4 °C에서 5 분 동안 300 x g에서 세포를 스핀 다운하고 PBS의 1 mL에서 세포를 다시 일시 중단하십시오. 세포는 유세포계에서 분석할 준비가 되어 있습니다.
결과
공동 배양된 태아 흉선들은 iPSC 유래 T 혈통 세포가 흉선 로브내로 이동할 수 있는지 여부를 분석하기 위해 단면화되었다. 씨없는 대조군 로브는 내인성 CD3+ 세포의 전개된 성상세포 유사 흉선 상피 웹(17)을 특징으로 하는 조직 구조를 가졌다. 한편, iPSC 유래 미성숙 T 세포로 시드된 흉엽은 CD3+ 단핵 세포로 재채우었으며, iPSC 유래 미성숙 T 세포의 이동을 나타내는 로브 내로의 이동을 나타낸다(도2A).
백성 미세 환경 내에서 이동되고 성숙된 T 세포는 이후에 iTE로서 퇴각하였다. 그들의 현상형 특성을 시험하기 위해, C57BL6 흉선 세포의 유동 세포 분석, Pmel iPSC 유래 미성숙 T 세포(extrathymic), 및 흉엽(iTE)으로부터 배출된 세포를 수행하였다. OP9/DLL1에 엑스트라티믹 T 세포는 양성 선택 마커 MHC-I의 발현 없이 CD4+CD8 +(DP) T 세포 및 CD8αSP T 세포를 보였으며, 반면 iTE는 CD8αSP MHC-I+ T 세포 표현형의 명확한 집단을 보였으며, 그들의 흉엽에서 배출하기 전에 긍정적 인 선택을 통해 성공적으로 통과. iTE는 지속적으로 높은 증식능력, 사이토카인 생산, 말초 생존, 및 림프성 호밍18,19,20과관련된 마커인 MHC-I 및 CD62L을 지속적으로 발현한다. 이러한 표현형은 흉선20에서단일 양성 T 세포의 가장 성숙한 집단인 M2 SP 흉선 세포와 일치하며, 이는 iTE가 정상적인 흉선 발달 프로그램을 통해 전이되었음을 시사한다(그림 3). iTE 생성의 효율을 모니터링하기 위해 개별 흉엽에서 배출된 세포를 분리하였다. 7일째에, 흉엽은 하루 평균 1 x 103 라이브 CD8SP CD45.1+ CD3+ iTE를 생성하였다(그림3B). iTE 생산의 유사한 비율은 3D 흉선 코문화의 6일째부터 12일째까지 관찰된다.
항원 의존성 활성화 및 사이토카인의 분비는 백선적으로 교육된 iPSC 유래 미성숙 T 세포의 기능적 특성을 관찰하기 위해 분석되었다. 관련없는 펩티드(뉴클레오프로테인)의 존재에서, Pmel-iTE는 상당한 양의 TNF-α, IL-2, 또는 IFN-γ를 방출하지 않았다. Pmel T 세포(hgp100)에 대한 코그네이트 펩티드를 자극할 때, Pmel-iTE는 강력한 양의 TNF-α 및 IL-2를 방출했으며, 또한 낮은 양의 IFN-γ(그림 4)를 생산하면서, 이는 백선교육을 받은 iTE가 그들의 코그네이트 펩티드를 인식할 수 있음을 나타낸다. 분비 이펙터 사이토카인은 자연적인 최근 흉선 이주자 (RTE)의 것과 유사한 프로파일을 가진.
흉선 교육(즉, iTE 대 엑스트라티믹 T 세포)의 유무에 관계없이 OP9/DLL1에서 분화된 iPSC 유래 T 혈통 세포 간의 전사 적 차이를 조사하기 위해, RNA-seq 분석은 이 두 집단에서 수행되고 비교되었다. OP9/DLL1(DP) 및 1차 순진한 CD8+ Pmel T 세포를 사용하여 분화된 DP T 계보 세포의 것으로. T세포 온토제니, 흉선세포 활성화 및 기억형성에 중요한 역할을 하는 102개의 유전자의 발현을15,20,21,22로분석했다. 그 4개의 연구된 인구의 주요 성분 분석은 iTE가 순진한 T 세포에 더 가깝게 군집되는 동안, 외적으로 생성된DP 및 CD8SP T 세포가 함께 군집되었다는 것을 보여주었습니다 (그림 5). 집합적으로, 이들 데이터는 iTE가 엑스트라티믹 방법에 의해 생성된 T 혈통 세포보다 순진한 T 세포에 더 가까운 표현형을 갖는다는 것을 보여준다.
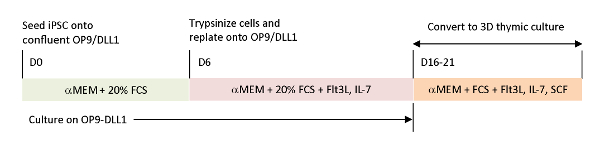
그림 1 : OP9/DLL1 및 3D 흉선 배양을 사용하여 iPSC에서 iTE로의 차별화에 대한 개략적 개요. 프로토콜에는 세 가지 별도의 차별화 단계가 포함됩니다. (왼쪽) iPSC 세포에서 OP9/DLL1(일 0~6일)에 조혈 혈통 세포로(중간)조혈 계보 세포에서 시토카인을 사용하여 OP9/DLL1에 미성숙 T 세포까지(6일째에서 16-21일),미성숙T 세포(일째 16-21)에서 iTE는 3D 흉선 배양 시스템을 사용한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
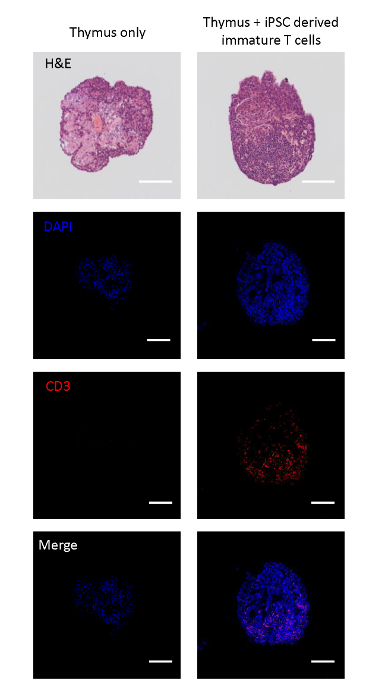
그림 2 : iPSC 유래 미성숙 T 세포로 씨를 뿌릴 수 있는 흉엽의 면역-히스토화학. 상단: iPSC 유래 미성숙 T 세포의 시드가 있는 유무에 관계없이 흉엽의 H&E 염색. 두 번째 위에서 아래로: DAPI(핵), CD3(T 셀)로 염색된 단면 엽의 공초점 이미지, 및 병합. 배율 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
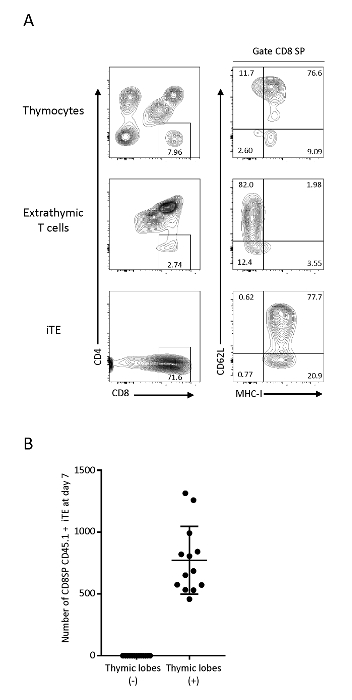
그림 3 : iTE는 포스트 흉선 T 세포 표현형을 보여준다. (A) FACS는 흉선 세포, 엑스트라티믹 T 세포(OP9/DLL1 공동 배양 시스템) 및 Pmel-iTE를 분석하였다. 살아있는 세포는 선천성 CD45+에 문이 있었다. CD8 SP 집단은 CD62L 및 MHC-I 발현에 대해 추가로 분석되었다. (B) CD8SP CD45.1 iTE의 평균 수는 사전 시딩 후 7일 후 로브당 하룻밤 동안 생산되었다. 데이터는 12개의 독립적인 실험으로부터 수집되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
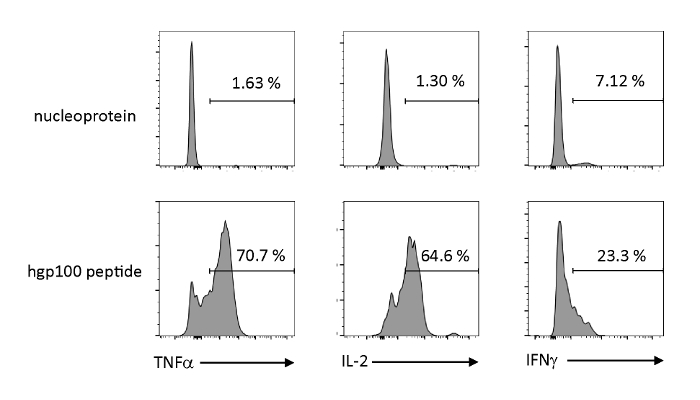
그림 4 : iTE는 항원 특이적 자극에 의해 다양한 사이토카인을 생성한다. FACS는 iTE에 의한 사이토카인의 세포 내 생산을 분석합니다. iTE는 3일 동안 무관(nucleoprotein) 또는 코그네이트(hgp100) 펩티드로 미리 로드된 APC와 공동 배양하였다. 오른쪽 상단 사분면에 표시된 숫자는 사이토카인을 생산하는 iTE의 백분율을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
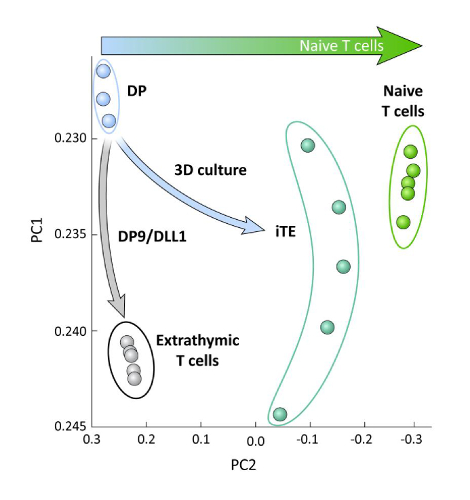
그림 5 : 전체 전사체 분석은 순진한 CD8를 향한 iTE 유전자 발현의 변화를 보여줍니다. + T 세포 프로그램. DP, 엑스트라티믹 CD8 SP, iTE, 및 순진한 T 세포로부터의 RNA-seq 데이터의 원리 성분 분석(PCA). (공공 데이터베이스 GSE105110을 사용하여 흉선 분화와 관련된 102개의 유전자 분석) 15. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
T-iPSC를 사용하여 종양 항원 특이적 T 세포를 재생성으로 하여 개선된 지속성으로 젊은 세포를 생성함으로써 ACT의 현재 장애물의 많은 부분을 극복할 수 있다. OP9/DLL1 공동 배양 시스템을 이용한 여러 가지 방법이 CD8SP 세포 6,7,10,13을 생성하는 것으로 보고되었지만, CD8 분자 및 종양 항원 특이적 TCRs, 글로벌 유전자를 발현하는 발현 패턴 및 기능 분석은 이러한 외인성 재생CD8 SP 세포가 순진한 T 세포와 다르다는 것을 보여준다(도 4). 여기서, 우리는 murine T-iPSC로부터 높은 충실도 및 균질성으로 iPSC 유래 흉선 이주자(iTE)를 생성할 수 있는 3D 흉선 배양 시스템을 설명합니다. iTE는 전 세계적으로 유전자 발현 패턴및 기억형성 및 생체내 항종양 효과와 같은 기능성에서 순진한 T 세포와 유사하여 확립된 종양(15).
고전적인 FTOC 시스템은 시험관에서흉선 선택을 다시 할 수있는 방법입니다. 그것은 흉선 세포(23)의사혈 내 개발을 연구하는 데 사용되어 왔으며, RTE24를생성하는 데 사용되는 FTOC의 몇 가지 보고서가 있습니다. 그러나 FTOC 시스템에는 몇 가지 제한사항이 있습니다. 인공 장기 배양에서 산소의 부족을 처리하기 위해, 몇몇 그룹은 반건조막 계 배양(23) 또는 고산소 침수 배양시스템(25)을사용하였다. 그러나, 현재의 어떤 방법도 지속적으로 포스트 흉선 T 세포의 균일 한 집단을 생성 할 수 없습니다. 고전적인 FTOC 시스템의 한계를 극복하기 위해, 우리는 기존의 방법15에비해 기술적 개선을 제공하는 3D 흉선 배양 시스템을 설계했다. 예를 들어, 우리의 3D 흉선 배양 방법을 사용하여, 최대 산소 교환 및 표면 엽 기계적 스트레스의 부재는 더 생리적 인 환경에서 흉엽을 유지합니다. 추가적으로, 장기 배양은 성숙한 T 세포가 흉엽에서 자연적으로 송신하는 것을 허용합니다. 마지막으로, 실시간 관찰 및 마이크로 조작을 통해 흉엽을 물리적으로 방해하지 않으면서 미디어 교환 및 iTE의 일정한 수집이 가능합니다. 따라서, 3D 흉선 배양 방법은 이전에 사용할 수 없었던 선착순 T 세포를 백선적으로 연구할 수 있는 방법뿐만 아니라 상당한 기술적 개선을 제공한다.
이 3D 흉선 배양 시스템을 사용하여 iTE의 성공적인 생성을 위한 몇 가지 핵심 포인트가 있습니다. FBS 및 배양 조건의 품질은 iPSC 분화를 지원하는 능력을 잃지 않고 OP9/DLL1 세포의 확장을 유지하는 데 매우 중요합니다. 따라서, 우리는 세포 분화 및 노화를 방지하기 위해 80 % 응고뿐만 아니라 지속적으로 통과 FBS 로트의 사전 평가를 권장합니다. 추가적으로, confluent OP9/DLL1 문화는 결합에 있는 다름이 그들의 효율성에 영향을 미칠 수 있기 때문에 미성숙한 T 세포로 iPSC의 시험관 내 분화를 위해 요구됩니다. 마지막으로, 흉엽의 배아 연령은 iTE 생성에 매우 중요합니다. E14.5 - 15.5 백엽을 사용하는 것이 좋습니다.
다른 새 프로토콜과 마찬가지로 이 메서드에는 제한이 있으며 개선될 수 있습니다. 여기에 제시된 배양 기술은 2주 동안 하루에 흉엽 당 약 1000 iTE를 생성한다. 증가된 iTE 생성은 산소 농도, 배지 부피 및 3D 배양 판의 유형 최적화를 포함하는 추가적인 변형으로 가능할 수 있다. 또한 사이토카인의 첨가 또는 제거는 사이토카인 농도의 변화뿐만 아니라, 또한 iTE 수율 향상에 기여할 수 있다.
여기에 제시된 3D 흉선 배양 시스템이 완전히 생체 내 계통에서 흉선 유이주자를 생성할 수 있다는 점을 감안할 때, 이 기술은 T를 포함하되 이에 한정되지 않는 다양한 면역학적 및 입양 세포 전달 연구 프로젝트에 적용될 수 있다. 세포 분화, 포스트 흉선 T 세포 성숙, 조혈 전구 또는 줄기 세포로부터항원 특이적 T 세포의 생성. 이 방법은 인간 샘플에 직접 적용되지는 않지만, iTE 및 3D 흉선 배양 시스템은 양성 및 음성 선택의 분자 메커니즘을 해명할 수 있는 큰 잠재력을 보유하고 있으며, 이를 가능하게 하는 배양 시스템의 생성을 용이하게 할 수 있습니다. ACT에 대한 임상적으로 관련 종양 항원 특이적 순진한 T 세포의 생성.
공개
저자 라울 비즈카르도, 니콜라스 D. 클레멘, 니콜라스 P. Restifo는 국제 특허 출원 PCT / US2017 /65986에 출원 에 발명자입니다, 제목 12 월 13, 2017, 제목 "백성 유이주자 세포의 고립 또는 정제 인구를 준비하는 방법 그리고 동일을 사용하여 처리의 방법."
감사의 말
OP9/DLL1 세포주 제공에 대해 가와모토 히로시와 마스다 쿄코에게 감사드립니다. 앨런 비 후프링과 에리나 Z에게 감사드립니다. 그는 그래픽 지원을 위해. 이 연구는 미국 국립 암 연구소의 교내 연구 프로그램 (ZIA BC010763)과 NCI, NIH에서 세포 기반 치료 센터를위한 암 문샷 프로그램에 의해 지원되었다. 이 작품은 밀스타인 가족 재단의 지원도 받았다.
자료
| Name | Company | Catalog Number | Comments |
| Chemicals, Peptides and Recombinant Proteins | |||
| 2-deoxyguanosine | Sigma-Aldrich | 312693-72-4 | |
| 2-Mercaptoethanol (1,000x) | Thermo Fisher Scientific | 21985-023 | |
| ACK Lysing Buffer | Gibco | A1049201 | |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| Blasticidin | Thermo Fisher Scientific | R21001 | |
| FBS | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| GlutaMAX (100x) | Thermo Fisher Scientific | 35050-061 | |
| hgp100 | Genscript | 282077-1, KVPRNQDWL | |
| Interleukin-2 | R&D Systems | 402-ML | |
| Interleukin-7 | R&D Systems | 407-ML | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| MEM powder | Gibco | 61100061 | |
| Monothioglycerol | Sigma-Aldrich | M-6145 | |
| Nucleoprotein | Global Peptides | ASNENMETM | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Puromycin | Thermo Fisher Scientific | A1113803 | |
| RPMI 1640 | Gibco | 11875093 | |
| Sodium Pyruvate | Thermo Fisher Scientific | 11360-070 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| Stemfactor LIF, Mouse Recombinant | STEMGENT | 03-0011-100 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Cell Culture Vessels and others | |||
| 10 cm dish | Corning, Inc. | 353003 | |
| 12 mL Syringe | Covidien Monoject | 22-652-090 | |
| 6 well plate | Corning/Coster | 3516 | |
| Cell strainer 100 μm | Fisher Scientific | 22-363-549 | |
| Cell strainer 40 μm | Fisher Scientific | 22-363-547 | |
| Forceps | DUMONT | 0108-5PO | |
| Lab soaker mat | Versi-Dry | Cat. EF2175CX 74018-00 | |
| Membrane filters ( 0.8 μm, 47diam) | Whatman | WHA7408004 ALDRICH | |
| Perfecta3D Hanging Drop Plate | Sigma-Aldrich | HDP1096 | |
| U Bottom 96 well plate | Corning/Coster | 3799 | |
| Experimental Cell lines | |||
| CD3-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| MEF-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Mouse Embryonic Fibroblasts (MEF) | ATCC | SCRC-1040; RRID:MGI:5007926 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | |
| Pmel-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Experimental mouse models | |||
| B6.SJL-PtprcaPepcb/BoyCrCrl | Charles River | Strain Code 564; RRID:IMSR_CRL:564 | |
| C57BL/6N | NCI/Charles River | N/A | |
| Pmel-1 mice | Overwijk et al. | J Exp Med 198(4):569-80 | |
| Antibodies | |||
| Anti-aTCR | Biolegend | 109202; RRID:AB_313425 | |
| Anti-CD3 | abcam | ab11089; RRID:AB_369097 | |
| Anti-CD4 | BD Biosciences | 553730; RRID:AB_395014 | |
| Anti-CD44 | BD Biosciences | 559250; RRID:AB_398661 | |
| Anti-CD45.1 | BD Biosciences | 553775; RRID:AB_395043 | |
| Anti-CD45.2 | BD Biosciences | 553772; RRID:AB_395041 | |
| Anti-CD62L | BD Biosciences | 560516; RRID:AB_1645257 | |
| Anti-CD69 | BD Biosciences | 552879; RRID:AB_394508 | |
| Anti-CD8a | BD Biosciences | 557959; RRID:AB_396959 | |
| Anti-CD8b | BD Biosciences | 550798; RRID:AB_393887 | |
| Anti-H-2Kb | BD Biosciences | 553570; RRID:AB_394928 | |
| Anti-IFN-g | BD Biosciences | 557998; RRID:AB_396979 | |
| Anti-IL-2 | BD Biosciences | 554428; RRID:AB_395386 | |
| Anti-TCRb | Thermo Fisher Scientific | 35-5961-81; RRID:AB_469741 | |
| Anti-TCRVb13 | BD Biosciences | 553204; RRID:AB_394706 | |
| Anti-TNFa | BD Biosciences | 557644; RRID:AB_396761 |
참고문헌
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Singh, N., Perazzelli, J., Grupp, S. A., Barrett, D. M. Early memory phenotypes drive T cell proliferation in patients with pediatric malignancies. Science Translational Medicine. 8 (320), 320-323 (2016).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends of Immunology. 35 (4), 178-185 (2014).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Yamagata, T., Mathis, D., Benoist, C. Self-reactivity in thymic double-positive cells commits cells to a CD8 alpha alpha lineage with characteristics of innate immune cells. Nature Immunology. 5 (6), 597-605 (2004).
- Themeli, M., et al. Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nature Biotechnology. 31 (10), 928-933 (2013).
- Serwold, T., Hochedlinger, K., Inlay, M. A., Jaenisch, R., Weissman, I. L. Early TCR expression and aberrant T cell development in mice with endogenous prerearranged T cell receptor genes. Journal of Immunology. 179 (2), 928-938 (2007).
- Lei, F., et al. In vivo programming of tumor antigen-specific T lymphocytes from pluripotent stem cells to promote cancer immunosurveillance. Cancer Research. 71 (14), 4742-4747 (2011).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Serwold, T., et al. T-cell receptor-driven lymphomagenesis in mice derived from a reprogrammed T cell. Proceedings of the National Academy of Sciences of the United States of America. 107 (44), 18939-18943 (2010).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- Jenkinson, W., Jenkinson, E., Anderson, G. Preparation of 2-dGuo-treated thymus organ cultures. Journal of Visualized Experiments. (18), (2008).
- Hamazaki, Y., Sekai, M., Minato, N. Medullary thymic epithelial stem cells: role in thymic epithelial cell maintenance and thymic involution. Immunological Reviews. 271 (1), 38-55 (2016).
- Vivier, E., et al. Innate or adaptive immunity? The example of natural killer cells. Science. 331 (6013), 44-49 (2011).
- Rosen, S. D. Ligands for L-selectin: homing, inflammation, and beyond. Annual Review of Immunology. 22, 129-156 (2004).
- Hogquist, K. A., Xing, Y., Hsu, F. C., Shapiro, V. S. T Cell Adolescence: Maturation Events Beyond Positive Selection. Journal of Immunology. 195 (4), 1351-1357 (2015).
- Best, J. A., et al. Transcriptional insights into the CD8(+) T cell response to infection and memory T cell formation. Nature Immunology. 14 (4), 404-412 (2013).
- Schmitz, I., Clayton, L. K., Reinherz, E. L. Gene expression analysis of thymocyte selection in vivo. International Immunology. 15 (10), 1237-1248 (2003).
- Nitta, T., Ohigashi, I., Takahama, Y. The development of T lymphocytes in fetal thymus organ culture. Methods in Molecular Biology. 946, 85-102 (2013).
- Ueno, T., et al. Role for CCR7 ligands in the emigration of newly generated T lymphocytes from the neonatal thymus. Immunity. 16 (2), 205-218 (2002).
- Watanabe, Y., Katsura, Y. Development of T cell receptor alpha beta-bearing T cells in the submersion organ culture of murine fetal thymus at high oxygen concentration. European Journal of Immunology. 23 (1), 200-205 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유