Method Article
真核硼酸背液转运体的表达、增溶及纯化
摘要
在这里, 我们提出了一个协议, 以表达, 溶解, 并纯化几个真核硼酸盐转运体与同源的 slc4 转运体家族使用酵母。我们还描述了一种化学交联法, 以评估纯化的同源蛋白的多重组装。这些协议可适用于其他具有挑战性的膜蛋白。
摘要
solute carrier 4 (slc4) 系列蛋白质被称为碳酸氢盐转运体, 包括原型蛋白阴离子交换器 1 (ae1, 也称为带 3), 是红血球中最丰富的膜蛋白。slc4 家族与硼酸盐转运体是同源的, 在植物和真菌中都有其特征。将适合结构或功能研究的数量表达和纯化膜运输蛋白的均匀性仍然是一个重大的技术挑战。本文详细介绍了耐酿酒酵母中硼酸盐转运体的过度表达、酵母膜的分离、洗涤剂对蛋白质的增溶以及从 s 中纯化硼酸盐转运体同源物的详细程序。酿酒酵母、拟南芥和水稻。我们还详细介绍了戊二醛交联实验, 以测定同功转运体的多聚化。我们的广义程序可以应用于所有三种蛋白质, 并已优化的疗效。这里开发的许多策略可用于其他具有挑战性的膜蛋白的研究。
引言
在对受体、离子通道和转运体进行结构和功能研究的过程中, 难以获得足够数量的纯化膜蛋白仍然是一个关键的瓶颈。对于中等高吞吐量的管道, 有许多协议可以筛选和发现足够好的候选膜蛋白, 以便随后进行体外研究1、2、3、4.通常情况下, 蛋白质标记为 n-或 c 端绿色荧光蛋白 (gfp), 表达水平通过凝胶荧光或荧光检测大小排除色谱 (fsec)5进行监测。这种方法使膜蛋白候选体被分解成高表达蛋白、中等或低表达蛋白或表达不佳或根本不表达的蛋白质。当实验设计是为了研究大量的候选基因, 目的是选择任何表达最好的蛋白质时, 这种方法效果很好。然而, 在某些情况下, 实验方法的前提是研究一种特定的膜蛋白, 当这种蛋白的表达水平在中等或较低的范围内时, 这种方法可能具有挑战性。此外, 有时在这些情况下, 表达水平只能通过截断、热稳定突变或密码子优化来改变构造, 从而最小地提高表达水平。因此, 有时有必要优化膜蛋白的表达和纯化方案的膜蛋白, 只表达适度良好。
slc4 家族的转运体包括碳酸氢盐转运体阴离子交换器 1 (也称为带 3), 红血球中最丰富的膜蛋白 6, 以及细胞呼吸的关键驱动因素。slc4 系列与硼酸盐运输机是同源的, 这在植物中非常关键, 并已被证明表现出与阴离子交换器1以及钠耦合 slc4 运输机7,8,9 类似的结构,10。在这里, 我们报告优化的蛋白质表达和纯化方案使用酿酒酵母纯化在酵母和植物中发现的三种不同的硼酸盐转运体。我们详细强调了我们为优化均匀性纯化的产量和效率而采取的关键步骤。此外, 我们还报告了一种化学交联试验, 使用戊二醛监测这些运输者的多重组装在纯化的蛋白质去污剂脂质复合体的背景下。交联实验通过评估纯化后低聚转运体的多聚状态, 有助于评价同源和洗涤剂的适用性。
该协议假定所需的转运体已被克隆到2μ衍生质粒在 gal1 启动子的诱导控制下, 在酿酒酵母中表达。在这些程序中, dna 被用来编码全长野生型硼酸盐转运体酿酒酵母 b1 (scbor1) 11,拟南芥 thaliana borate (atbor1)12和oryza持那 (osbor3) 13.每个结构中的 c 端都贴有一个10-his 标记和一个凝血酶裂解点插入在运输机和10-his 标记之间, 以便在需要时将其删除。该协议还将假设质粒已经转化为缺乏组氨酸的完全补充选择性培养基 (csm) 上的酿酒酵母 dsy-5表达株。
研究方案
1. 介质和重要缓冲器的制备
- 加入200克又直的水和去离子水, 使总体积达到500毫升, 制备500毫升的40% 半乳糖。使用热板或微波炉来增加半乳糖进入溶液的速度。带真空过滤装置的无菌过滤器, 由连接在无菌玻璃瓶上的0.2μm 过滤器顶部组成。
注: 所有介质溶液均使用去离子水制备。 - 在500毫升的总体积中加入200克葡萄糖和水, 制备500毫升的40% 葡萄糖。灭菌用高压灭菌器。
- 在四个 2 l 瓶中的每一个, 加入 0.4 g 的完整补充混合物, 不含组氨酸 (csm-hs), 3.35 克酵母氮碱与硫酸铵 (ynb + 氮), 和475毫升水。高压 釜。加入25毫升的40% 葡萄糖, 最终达到2% 的葡萄糖浓度。
- 加入玻璃瓶, 50 克肽和25克酵母提取物和水到375毫升。高压 釜。加入125毫升的40% 半乳糖, 给出5x 酵母肽 (yp) 溶液, 其中含有10% 半乳糖。
- 加入250毫升的烧瓶, 0.04 克 csm-hs, 0.04 g ynb + 氮气, 并将水添加到 47.5 ml。高压 釜。加入2.5 毫升的40% 葡萄糖, 得到50毫升的 CSM-His + ynb + 2% 的葡萄糖。
- 将 121.14 g 的 tris 碱与800毫升的水混合, 制备 1M tris ph 7.0 的1升。加入浓缩的盐酸, 直到 ph 值达到7.0。将水加入1升的最终体积, 并通过0.2μm 的过滤器。
- 将 73.06 g edta 与400毫升水混合, 制备 500 ml 0.5 m 乙二胺四乙酸 (edta) ph 值8.0。加入氢氧化钠颗粒, 直到 edta 溶解, ph 值达到8.0。将水加入到500毫升的最终体积中, 并通过0.2μm 的过滤器。
- 将1.74 克的 pmsf 与200乙醇混合, 制备 100 mm 苯甲磺酰氟化物 (pmsf) 100 毫升。储存在-20°c。
- 准备225毫升的2x 珠洗缓冲液, 包括 50 mm tris ph 7.0、1.4 m 氯化钠、20% 甘油和 1 mm edta ph 8.0。
- 制备100毫升大小排除色谱缓冲液 (s200 缓冲液), 包括 20 mL 4-莫诺林诺-乙酰磺酸水合物 (mes) ph 值 6.5, 100 mL 氯化碳, 2% 甘油, 和0.03% 正十二烷基β--d-麦芽苷 (ddm)。
- 制备100毫升膜再悬浮液, 包括 50 mm tris ph 7.0、500 mm nacl 和10% 甘油。
- 通过混合3毫升20% 十二烷基硫酸钠 (sds)、3毫升甘油、2.4 ml 1m tris ph 6.8、0.03 克溴酚蓝和 1.6 ml 2-硫醇, 制备 3x sds-page 负载染料的10毫升。
2. 硼酸盐转运体在酿酒酵母中的过度表达
- 在 csm-hs + ynb + 2% 葡萄糖培养基的50毫升中接种三个转化酵母菌落, 并在30°c 下的 190 rpm 下过夜。
- 第二天使用分光光度计确定波长为 600 nm (od600) 的光学密度, 并接种到每个包含500毫升 csm-her + ynb + 2% 葡萄糖介质的四个 2 l 瓶中每个0.01 的 od 600.
- 在30°c 下以190转/分的速度晃动 30小时, 使细胞消耗所有葡萄糖并生长到高密度。
注: 更长的生长时间会导致更大的细胞产量, 更大的收获膜产量, 并最终更大的纯化蛋白质产量。 - 通过添加125毫升的 5x yp 介质, 辅以10% 半乳糖, 最终诱导浓度为2% 半乳糖, 从而产生表达。在30°c 下以190转/分的速度晃动16小时。
- 收获细胞, 以 4, 000 x g 的速度旋转 15分钟, 在100毫升冷水中重新移植细胞。
注: 此时细胞可能会在-80°c 无限期冷冻, 或者准备可能会继续进入细胞裂解和膜采集。我们通常收获40-45 克的细胞。
3. 酵母膜的采收
- 加入 1m tris ph 7.0 的细胞再悬浮液 11.25 ml, 0.5 m edta 的 0.45 ml 和 100 mm pmsf 的 2.25 ml, 后者作为蛋白酶抑制剂。将水添加到225毫升的最终体积中, 从而产生 50 mm tris ph 7.0、1 mm edta 和 1 mm pmsf 的细胞再悬浮缓冲液。
注: 如果使用冷冻细胞使细胞在室温下彻底解冻, 约 1小时, 因为如果它们保持部分冷冻, 他们将通过珠子跳动抵抗裂解。 - 将细胞重新悬浮到450毫升的金属罐中, 进行珠子跳动。顶部关闭剩余的体积与冷0.5 毫米玻璃珠。
- 与转子组装一个珠拍打室, 沉浸在冰浴中。执行6分钟脉冲, 间隔2分钟休息时间, 以防止裂解液过热。
- 通过使用塑料一次性瓶装顶部过滤器将真空过滤装置组装成玻璃瓶。取下滤膜, 因为剩余的塑料装置可以捕捉珠子, 同时允许裂解液通过。在应用真空的同时, 将珠子跳动室的内装物浇注到组件上, 将珠子从裂解液中分离出来。
- 用225ml 的2x 洗涤缓冲液清洗珠子殴打室, 其中包含 50 mm tris ph 7.0、1 mm edta、1 mm pmsf、1.4 m nacl 和20% 甘油。将房间里的东西倒在珠子上清洗。
注: 洗涤给出了 ~ 450 毫升裂解细胞的最终体积, 并显著提高了收获的膜产量。最终浓度为 50 mm tris ph 7.0、1 mm edta、1 mm pmsf、10% 甘油和 700 mm nacl, 提高盐浓度的主要目的是帮助分离外周膜蛋白。 - 在 15, 000 x g 的情况下, 将细胞裂解液向下旋转15分钟。将上清液倒入聚碳酸酯瓶中, 在 135, 000 x克的超离心机中旋转 1小时, 以收集膜。
注: 如果没有超离心机, 可通过在 53, 000 x克的情况下旋转3小时来收集膜, 这种力可以在地板模型离心机中实现。 - 丢弃上清液, 用膜颗粒称重瓶子。将膜颗粒在含有 50 mm tris ph 7.0、500 mm nacl 和10% 甘油的约 35 ml 膜再悬浮液中, 并添加到玻璃保镖中。称量空离心管, 以确定所收获的膜的质量。
注: 在有效的膜收获中, 膜的重量将等于用于该膜收获的细胞重量的大约20%。该协议给出了 40-45 g 的典型电池产量, 因此我们同样期望 8-9 g 的细胞产量。 - 将膜和脂肪读入50毫升的锥形管中, 现在可以无限期地储存在-80°c。
注: 在这个实验中, 通常会制作两个等价物, 以便从一个原始细胞制剂中进行两个单独的蛋白质纯化。
4. 蛋白质的溶解和纯化
- 在烧杯上添加一个搅拌棒和150毫克的正十二烷基β-d-maltopyranoside (ddm) 每克膜使用。在任何时候都要将蛋白质保存在冰上或4°c。
注: ddm 是吸湿性的, 不使用时应存放在干燥的玻璃瓶中, 使其在-20°c 时具有干燥剂。此外, 它是典型的使用4-5 克之间的膜在纯化, 以获得相当数量的纯蛋白质。 - 解冻膜, 并在膜再悬浮缓冲液中达到每克膜15毫升的最终体积, 辅以 1 mm 的 pmsf 和 20 mm 的咪唑 ph 8.0。在烧杯上加入 ddm, 在4°c 下搅拌1小时。
注: ddm 浓度为 1% wv, 但对于膜蛋白的增溶, 更重要的是要知道每克膜添加洗涤剂的质量。 - 在 135, 000 x克的4°c 下旋转 25分钟, 以颗粒非溶解性材料。通过5μm 注射器过滤器过滤上清液。
- 通过蠕动泵将样品加载到 1 mlmin 的流速上, 使其达到 1 ml 固定化镍合柱, 平衡在 20 mm tris ph 值7.0、500 mm nacl、10% 甘油、20 mm 咪唑 ph 值8.0 和 0.05% ddm 中平衡。
注: 对于表达较低的蛋白质, 使用 1 ml 而不是 5 ml 柱和镍而不是钴离子进行亲和层析观察到了更高的纯度和产量。 - 用含有 20 mm tris ph 值7.0、500 mm nacl、10% 甘油、80 mm 咪唑 ph 8.0 和 0.05% ddm 的洗涤缓冲液的10柱清洗。
注: 在清洗10-g 标记的蛋白质时, 可以使用咪唑浓度高于人们通常所认识的浓度, 从而提高纯度。 - 在含有 20 mm tris ph 值7.0、200 mm nacl、10% 甘油、300 mm 咪唑 ph 值8.0 和 0.05% ddm 的缓冲液中清除蛋白质。收集洗脱液在 10 1 毫升的分数, 并运行在4-20 的三甘氨酸 sds-page 凝胶与溶解性裂解液和洗涤分数。
- 池峰值分数, 通常约为5-6 毫升, 并在台式离心机在4°c 冷藏的 50 kda 截止集中器中浓缩到500μl 或更小体积。
注: 500μl 是典型的最大体积注入到大小排除色谱 (sec) 列。此时, 蛋白质可以在-80°c 无限期地储存或继续储存到 sec。 - 通过0.2μm 自旋柱过滤器过滤蛋白质, 注入到大小排除柱 (例如, superdex-200) 中平衡 s200 缓冲液:20 mm mes ph 值 6.5, 100 mm nacl, 2% 甘油和 0.03% ddm。
注: 对于随后的戊二醛交联试验, 缓冲剂不得含有原胺。证交会是一个在必要时交换缓冲区的机会, 就像在这里把 tris 换成 mes 时所做的那样。 - 在4-20 的公路甘氨酸 sds-page 凝胶上运行峰值分数。在4°c 下, 在 50 kDa-cutoff 的集中器中, 涂上凝胶, 收集纯峰值分数。
- 通过测量波长为280纳米的吸收率来确定蛋白质浓度, 并在-80°c 无限期地储存。
5. 戊二醛交联检测
- 在 s200 缓冲液中混合 3μl 0.5 mg/ml 蛋白, 在 s200 缓冲液中混合 5μl, 将其中任何一种水的1μl 或20% 的十二烷基硫酸钠 (sds), 然后是1.5% 戊二醛的 1μl, 从而制备10μl 反应。
注: 这将使一个1x 反应 0.15 mgml 蛋白和0.15 戊二醛。含有 sds 预处理的样品是重要的阴性对照, 在加入戊二醛之前, 应在室温下混合孵育5分钟。 - 在室温下将反应孵化30分钟。通过添加5μl 的3xsds-page 凝胶加载染料来终止反应, 该染料含有过量的 tris 缓冲液, 可抑制戊二醛。
- 将所有15μl 加载到4-20 的 ris-甘辛 sds-page 凝胶上, 该凝胶将在每条车道上加载1.5 微克蛋白质。在 200 v 的温度下运行凝胶 30分钟, 并通过有证据确定二聚体交联的程度, 该波段的运行大小是变性单体的两倍。
注: 谷氨醛滴定法和时间过程可以先进行, 以找到最佳条件的同功转运体。
结果
从执行镍亲和层析中提取的洗脱分数的典型凝胶显示所有三种蛋白质都部分纯化 (图 1a)。在梯子的右边是裂解液, 在每一种情况下, 它都没有显示出与硼酸盐转运体相对应的显著带, 这对于不能过度表达的蛋白质来说是典型的。80 mm 的洗车道显示, 尽管咪唑浓度相对较高, 但 10 he 标记蛋白的损失最小。与硼酸盐转运体相对应的带在洗脱的分数中很明显, 在注入 s200 凝胶过滤柱之前, 被认为含有大部分洗脱的蛋白质的分数被集中。在此阶段, 蛋白质在许多下游应用中没有得到足够的纯化, 在注入 s200 柱之前, 集中样品中的额外带表明了这一点 (图 1b)。但是, 将样品注入大小排除柱中会显示出高纯度的洗脱分数 (图 1b-c)。给出了每个硼酸盐转运体的色谱图及其相应的凝胶。尽管亲和层析洗脱后样品纯度适中, 但从凝胶过滤柱中洗脱后, 该蛋白具有高度的纯度。关键的是, 色谱显示每一种蛋白质迁移主要作为一个单一的单分散峰, 很少的蛋白质保留在空隙体积。稳定和折叠的蛋白质通常给出一个单分散和对称的峰值, 而不稳定的、错误折叠的或聚集的蛋白质通常会给出多个不对称峰或空泡体积的一个大峰。对于 scbor1 的酵母培养, 每升的最终产量约为2毫克纯化蛋白, 每升纯化的 atbor1 和 osbor3 的最终产量约为1毫克。这些数字是从4-5 克膜中纯化的蛋白质量, 这些蛋白质来源于我们最初制备细胞的一半。
交联实验表明, 纯化的同功转运体可以很容易地在溶液中进行组装 (图 2)。含有安全数据单预处理的样品的目的是表明交联取决于溶液中的折叠状态, 因此, 当使用苛刻的洗涤剂破坏多聚化时, 不会发生交联。结果表明, 在这些条件下, 三个硼酸盐转运体中的一个在 ddm 中纯化时没有二聚, 而另外两个, atbor1 和 osbor3, 交联并显示二聚化。可以看出, 并不是所有的蛋白质都可能交叉联系。在本例中, 可以看到 osbor3 单体的微量, 而 atbor1 则与完成有交叉链接。交联的程度将取决于彼此接近的赖氨酸残基的数量, 其他交联试剂有可能有效地交联不同的膜蛋白。
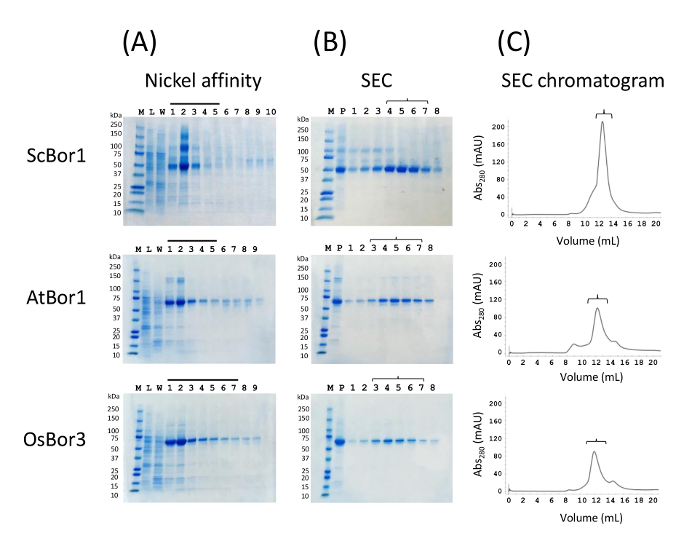
图 1.三种硼酸盐转运体的镍亲和力和大小排除色谱纯化.每个垂直面板 (a)、(b) 和 (c)都包含 scbor1、atbor1 和 osbor3 的数据。(a) 镍亲和性柱。m 是一个分子量标记的梯子, 左边指定了 kda 的重量。l 是粗裂解液, w 是 80 mm 咪唑洗。所有其他编号车道对应于1毫升分数洗脱 300 mm 咪唑。分数上方的条形图表示哪些酒吧被选择合并并集中在柱上注射。(b) p 表示在注射到 s200 柱之前的浓缩蛋白。被洗脱的 sec 分数在右边, 括号用于匹配凝胶车道与它们的色谱分数在 (c)。空隙量在8毫升之后。请点击这里查看此图的较大版本.

图 2.交联分析评估了多聚体组装的纯化转运体.左边是一个分子量大的梯子。高于一切其他车道显示哪些蛋白质是存在的, 并且样品是否有戊二醛添加或在戊二醛添加之前 sds 的预处理。箭头表示 atbor1 和 osbor3 的单体和二聚体的位置。scbor1 是一种比 atbor1 和 osbor3 更小的蛋白质, 如预期的那样运行。请点击这里查看此图的较大版本.
讨论
在这里, 我们分享了详细的协议, 导致纯化到同质性三种不同的真核硼酸盐转运体。这里提出的协议来自于其他协议的整体膜蛋白的表达在酿酒酵母1,14, 我们的优化导致提高纯度和产量。这里优化的参数包括细胞培养生长体积和时间, 珠状裂解过程, 细胞裂解过程中的缓冲液成分和蛋白质纯化量, 每个克膜使用的洗涤剂量, 亲和度纯化中的金属离子识别,亲和柱的体积, 并实施交联法, 通过评估寡聚转运体的多聚状态来评估同源和洗涤剂的适宜性。这些协议是成功的多个 slc4 同源物从植物和真菌物种。整体膜蛋白纯化策略的局限性在于, 不存在保证有效的通用膜蛋白纯化方法。我们的协议有可能在序列识别和结构上更接近 slc4 转运体的蛋白质方面取得成功, 因此 slc4、slc23 和 slc26 家族的成员可能是有希望的目标15。同样, 从进化上看, 膜转运体的距离越远, 协议就越有可能不同, 例如通过改变表达系统、洗涤剂或其他关键参数4。
该协议利用了蛋白质纯化中最常用的亲和标签--his-tag。尽管最初的洗脱分数中存在杂质, 但镍亲和力、广泛洗涤和随后的 sec 纯化的组合导致了高度纯化的蛋白质。10-hs 标签允许更严格的咪唑洗涤, 因此可以去除更多的背景结合蛋白, 而不是在8-hi-hs 或 6-hi-hid 标签允许的洗涤中去除的蛋白质。我们选择的纯分数错误的保守方面的最高的纯凝胶分数, 这对应于峰值证交会分数。最终的蛋白质产量可以通过汇集和浓缩更多的分数来增加, 尽管要权衡稍微不那么纯的蛋白质。这里介绍的方法使 atbor1 的纯化量达到了测定其晶体结构7的效果, 其纯化差异包括切断 hi-tag 和将转运器交换成不同的洗涤剂, 以提高晶体衍射7。
我们的协议提出了重要的考虑选择同源物和洗涤剂用于溶解和纯化它们。ddm 是洗涤剂常见的首选, 因为它相对温和, 在溶解性上往往是成功的, 并已被用于各种膜蛋白的结构和功能研究。在确定洗涤剂是否对膜的选择不佳时, 一种常见的评价方法是, 该蛋白是否在 sec 色谱图上给出了一个单点峰, 而不是在空隙体积中给出一个大峰, 还是给出了一个多分散峰的范围。表示错误折叠或不稳定的蛋白质。我们对 scbor1 的纯化提出了一个更微妙的考虑。它大量净化, 在证交会色谱图上看起来是有利的和单分散的, 这表明它可能是结构研究的一个有吸引力的目标。然而, 我们的交联试验表明, 它是一个单体时, 纯化。虽然 scbor1 有可能在细胞中作为单体本身存在, 但研究表明, slc4 运输机及其同源体很可能是 dimers7、8、9、10。我们在形成并求解 atbor1 结构后, 进行了交联分析。然而, 如果我们能够与 atbor1 相比, 用交联分析来评估 scbor1, 那么宝贵的时间和研究工作本可以被转用于追求 atbor1 而不是 scbor1, 后者最终在结晶和衍射实验。因此, 这种检测可以帮助研究人员区分在进行结构研究时使用的同源物或洗涤剂, 以便确定蛋白质保持其疑似本生构象的条件。此外, 该检测可用于探测哪些氨基酸对多聚至关重要, 以寻找破坏多聚化界面稳定并导致强制单体的氨基酸替代。采用这种方法, 探讨了膜转运体 16、17、18 中同功组装的功能意义。
我们的方法的一个普遍优势是, 酵母已被证明能够表达许多具有挑战性的膜蛋白的各种功能1。此外, 它的低成本和生长时间促进了它的可及性, 许多研究工作, 可能不太能够使用需要组织培养或昂贵的生长介质的表达策略。这里介绍的程序相对便宜, 可以在一周内执行, 这突出了这种方法的可行性。这些协议的实施有助于对其他具有挑战性的膜蛋白进行结构和功能研究。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了戴维森学院创业基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| 4-Morpholinoethanesulfonic acid hydrate (MES) | Acros | 172591000 | |
| Äkta Pure 25 L FPLC | GE Healthcare | 29018224 | |
| Amicon Ultra 15 mL, 50 kDa MWCO concentrator | Millipore | UFC905024 | for concentrating nickel column fractions |
| Amicon Ultra 4 mL, 50 kDa MWCO concentrator | Millipore | UFC805024 | for concentrating S200 fractions |
| Bacto Peptone | BD Diagnostics | 211677 | |
| Bacto Yeast Extract | BD Diagnostics | 288620 | |
| Glass Erlenmeyer flask, 2L | Sigma-Aldrich | CLS44442L | |
| Benchtop centrifuge | Sorvall | Legend RT | |
| Bottle top filter | Nalgene | 595-4520 | the membrane is removed and used to filter glass beads |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Complete supplement mixture without histidine | Sunrise Science | 1006-100 | |
| D-Galactose | Sigma-Aldrich | G0750 | |
| D-Glucose | Sigma-Aldrich | RDD016 | |
| Ethanol, 200 proof | Pharmco-Aaper | 111000200 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Sigma-Aldrich | EDS-500G | |
| Gel tank SDS-PAGE system | Bio-Rad | 1658004 | |
| Glass bead-beating cell disruptor | BioSpec | 1107900 | |
| Glass beads, 0.5mm | BioSpec | 11079105 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16019 | sent as an 8% solution under nitrogen |
| Glycerol | Sigma-Aldrich | G7893 | |
| HiTrap IMAC FF column, 1 mL | GE Healthcare | 17-0921-02 | charged with nickel |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Imidazole | Acros | 12202 | |
| Instant Blue gel stain | Expedeon | ISB1L | |
| JA-10 rotor | Beckman | 369687 | |
| JA-14 rotor | Beckman | 339247 | |
| Microcentrifuge tubes, 1.5mL | Thermo Scientific | 3451 | |
| Microcentrifuge, refrigerated | Fisher | 13-100-676 | |
| Mini-Protean Tris-glycine gels, 4-20% | Bio-Rad | 456-1096 | |
| Minipuls 3 peristaltic pump | Gilson | F155005 | used for loading lysate onto affinity column |
| n-Dodecyl-beta-D-Maltopyranoside (DDM) | Inalco | 1758-1350 | |
| Nickel(II) Sulfate Hexahydrate | Sigma-Aldrich | 227676 | |
| Orbital shaking incubator with temperature control | New Brunswick | C24 | |
| p423 GAL1 plasmid with borate transporter insert | available from authors | ||
| Phenylmethanesulfonyl fluoride (PMSF) | Acros | 215740050 | |
| Polycarbonate ultracentrifuge tubes | Beckman | 355618 | |
| Polypropylene bottles, 250mL | Beckman | 356011 | |
| Polypropylene bottles, 500mL | Beckman | 355607 | |
| Precision Plus Protein Kaleidoscope Standards | Bio-Rad | 1610375 | |
| S. cerevisiae expression strain DSY-5 | available from authors | ||
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Sodium hydroxide | Sigma-Aldrich | S8045 | |
| Spin column with 0.2 µm filter, 0.5mL | Millipore | UFC30GV0S | for filtering protein before injecting onto S200 column |
| Sterile Falcon tubes, 15mL | Lab Depot | TLD431696 | |
| Sterile Falcon tubes, 50mL | Lab Depot | TLD431698 | |
| Superdex 200 10/300 GL column | GE Healthcare | 17-5175-01 | used for SEC purification |
| Syringe filter, 5µm | Pall | 4650 | for filtering lysate before loading affinity column |
| Tris-base | Sigma-Aldrich | T1503 | |
| Type 70 Ti rotor | Beckman | 337922 | |
| Ultracentrifuge | Beckman | L8-70M | |
| YNB+Nitrogen without amino acids | Sunrise Science | 1501-500 |
参考文献
- Drew, D., et al. GFP-based optimization scheme for the overexpression and purification of eukaryotic membrane proteins in Saccharomyces cerevisiae. Nature Protocols. 3 (5), 784-798 (2008).
- Goehring, A., et al. Screening and large-scale expression of membrane proteins in mammalian cells for structural studies. Nature Protocols. 9 (11), 2574-2585 (2014).
- Andréll, J., Tate, C. G. Overexpression of membrane proteins in mammalian cells for structural studies. Molecular Membrane Biology. 30 (1), 52-63 (2013).
- Lyons, J. A., Shahsavar, A., Paulsen, P. A., Pedersen, B. P., Nissen, P. Expression strategies for structural studies of eukaryotic membrane proteins. Current Opinion in Structural Biology. 38, 137-144 (2016).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Thurtle-Schmidt, B. H., Stroud, R. M. Structure of Bor1 supports an elevator transport mechanism for SLC4 anion exchangers. Proceedings of the National Academy of Sciences of the United States of America. 113 (38), 10542-10546 (2016).
- Coudray, N., et al. Structure of the SLC4 transporter Bor1p in an inward-facing conformation. Protein Science. 26 (1), 130-145 (2016).
- Arakawa, T., et al. Crystal structure of the anion exchanger domain of human erythrocyte band 3. Science. 350 (6261), 680-684 (2015).
- Huynh, K. W., et al. CryoEM structure of the human SLC4A4 sodium-coupled acid-base transporter NBCe1. Nature Communications. 9 (1), (2018).
- Zhao, R., Reithmeier, R. A. Expression and characterization of the anion transporter homologue YNL275w in Saccharomyces cerevisiae. American Journal of Physiology Cell Physiology. 281 (1), 33-45 (2001).
- Takano, J., et al. Arabidopsis boron transporter for xylem loading. Nature. 420, 337-340 (2002).
- Nakagawa, Y., et al. Cell-type specificity of the expression of Os BOR1, a rice efflux boron transporter gene, is regulated in response to boron availability for efficient boron uptake and xylem loading. Plant Cell. 19 (8), 2624-2635 (2007).
- Hays, F. A., Roe-Zurz, Z., Stroud, R. M. Overexpression and purification of integral membrane proteins in yeast. Methods in Enzymology. 470, Issue C (2010).
- Chang, Y. -N., Geertsma, E. R. The novel class of seven transmembrane segment inverted repeat carriers. Biological Chemistry. 398 (2), 165-174 (2017).
- Robertson, J. L., Kolmakova-Partensky, L., Miller, C. Design, function and structure of a monomeric ClC transporter. Nature. 468 (7325), 844-847 (2010).
- Last, N. B., Miller, C. Functional Monomerization of a ClC-Type Fluoride Transporter. Journal of Molecular Biology. 427 (22), 3607-3612 (2015).
- Yu, X., et al. Dimeric structure of the uracil:proton symporter UraA provides mechanistic insights into the SLC4/23/26 transporters. Cell Research. 27 (8), 1020-1033 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。