Method Article
Expresión, solubilización y purificación de los transportadores de eucariotas borato de
En este artículo
Resumen
Aquí presentamos un protocolo para expresar, solubilizar y purificar varios transportadores de borato eucariotas con homología a la familia de transportador SLC4 usando levadura. También describimos un análisis Cross-linking químico para evaluar las proteínas purificadas homomeric multimérica Asamblea. Estos protocolos pueden ser adaptados para otras proteínas de membrana desafiante.
Resumen
La familia soluto transportista 4 (SLC4) de proteínas se llama los transportadores de bicarbonato e incluye la proteína arquetípica aniónico intercambiador 1 (AE1, también conocido como banda 3), la proteína de membrana más abundante en los glóbulos rojos. La familia de SLC4 es homóloga con Transportadores de borato, que han sido caracterizadas en plantas y hongos. Sigue siendo un desafío técnico importante para expresar y purificar proteínas de transporte de membrana a homogeneidad en cantidades adecuadas para estudios estructurales o funcionales. Aquí describimos los procedimientos detallados para la sobreexpresión de transportadores de borato en aislamiento de las membranas de la levadura, Saccharomyces cerevisiae, solubilización de proteína por detergente y purificación de homólogos de transportador de borato de S. cerevisiae, Arabidopsis thalianay Oryza sativa. También detallamos un glutaraldehído experimento para ensayo multimerization de homomeric transportadores del cross-linking. Nuestros procedimientos generalizados se pueden aplicar a todas las tres proteínas y han sido optimizados para su eficacia. Muchas de las estrategias desarrolladas aquí pueden ser utilizados para el estudio de otras proteínas de membrana desafiante.
Introducción
La dificultad de obtener suficientes cantidades de proteína purificada de la membrana sigue siendo un cuello de botella fundamental en la búsqueda de estudios estructurales y funcionales de los receptores, canales iónicos y transportadores. Existen muchos protocolos para tuberías moderadamente alto rendimiento a la pantalla y encontrar proteínas de membrana de candidato que expresan lo suficientemente bien como para permitir posteriores en vitro estudios1,2,3,4 . Por lo general, las proteínas están etiquetadas con una proteína fluorescente verde de N o C terminal (GFP) y niveles de expresión son monitoreados por gel-fluorescencia o por fluorescencia-detección tamaño exclusión cromatografía (FSEC)5. Estos enfoques permiten la clasificación de los candidatos de la proteína de membrana proteínas expresando su alta, moderadas o bajas expresión de proteínas, o proteínas que se expresan mal o no. Este enfoque funciona bien cuando el diseño experimental es investigar la gran cantidad de genes candidato con la intención de seleccionar cualquier proteína expresa mejor. Sin embargo, en algunos casos, un enfoque experimental se basa en el estudio de una proteína de membrana particular, que puede ser difícil cuando los niveles de expresión de la proteína están en la gama moderada o baja. Además, a veces en estos casos, niveles de expresión se pueden sólo mínimamente aumentar modificando la construcción mediante truncamientos, mutaciones thermostabilizing u optimización de codón. Por lo tanto, es a veces necesario para optimizar protocolos de expresión y purificación de proteínas membrana las proteínas de membrana que expresan sólo moderadamente bien.
La familia de SLC4 de transportadores incluye el transportador del bicarbonato 1 intercambiador de aniones (también conocido como banda 3), la más abundante proteína de membrana en células de sangre rojas6y un conductor clave de la respiración celular. La familia de SLC4 es homóloga con Transportadores de borato, que son esenciales en las plantas y se han demostrado para exhibir una estructura similar a 1 intercambiador de aniones así como en sodio acoplado SLC4 transportadores7,8,9 ,10. Aquí divulgamos protocolos de expresión y purificación de proteínas optimizado con S. cerevisiae para purificar tres transportadores diferentes de borato encontradas levaduras y plantas. Destacamos en pasos clave detalle que tomamos para optimizar el rendimiento y la eficiencia de las purificaciones a homogeneidad. Además, se presenta un análisis Cross-linking química con glutaraldehído para supervisar el montaje multimérica de estos transportadores en el contexto de un complejo proteína-detergente-lípidos purificado. El cross-linking experimento puede ayudar a evaluar la adecuación homólogo y detergente por evaluar el estado de multimérica de los transportistas tras la purificación.
Este protocolo asume que el transportador deseado ha sido clonado en un plásmido de 2 μ derivado bajo control inducible del promotor GAL1 expresión en S. cerevisiae. Para estos procedimientos, se utilizó ADN codifican transportadores de larga duración de tipo salvaje de borato Bor1 Saccharomyces cerevisiae (ScBor1)11, Arabidopsis thaliana Bor1 (AtBor1)12y Oryza sativa Bor3 (OsBor3)13 . El C-terminal de cada construcción se anexa con una 10-su-etiqueta y un sitio de la hendidura de trombina insertado entre el transportador y la 10-su-etiqueta para permitir su retiro si lo desea. El protocolo también asumirá que el plásmido se ha transformado ya en la DSY-5 expresión cepa de S. cerevisiae en medios selectivos suplementarios completadas (CSM) que carecen de histidina.
Protocolo
1. preparación de medios y tampones importantes
- Preparar 500 mL de galactosa 40% agregar 200 g de galactosa y agua desionizada hasta un volumen total de 500 mL. Use una placa caliente o microondas para aumentar la velocidad de la galactosa en solución. Filtro estéril con un aparato de filtración de vacío consistente en una tapa de filtro de 0.2 μm unida a una botella de vidrio estéril.
Nota: Todas las soluciones de medios de comunicación se preparan con agua desionizada. - Preparar 500 mL de glucosa 40% agregar 200 g de glucosa y agua hasta un volumen total de 500 mL. Autoclave para esterilizar.
- En cada uno de los cuatro frascos de 2 L, agregar 0,4 g de mezcla completa suplemento sin histidina (CSM-su), 3,35 g levadura nitrógeno base con sulfato de amonio (YNB + nitrógeno) y 475 mL de agua. Autoclave. Añadir 25 mL de glucosa 40% para lograr una concentración final de glucosa de 2%.
- Añadir a una botella de cristal, peptona de 50 g y 25 g extracto de levadura y agua 375 mL. Autoclave. Añadir 125 mL de galactosa 40% dar 5 x solución de peptona (YP) de levadura que contenga 10% de galactosa.
- Agregar a un matraz de 250 mL, 0.04 g CSM-su, 0,335 g YNB + nitrógeno y agua a 47,5 mL. Autoclave. Añadir 2,5 mL de glucosa 40% para obtener 50 mL de CSM su YNB + 2% de glucosa.
- Preparar 1 L de Tris 1M pH 7.0 mezclando 121,14 g de Tris base en 800 mL de agua. Añadir ácido clorhídrico concentrado hasta que el pH llegue a 7.0. Agregar agua hasta un volumen final de 1 L y pasar por un filtro de 0.2 μm.
- Preparar 500 mL de 0,5 M pH de ácido (EDTA) etilendiaminotetraacético 8.0 mezclando 73,06 g de EDTA con 400 mL de agua. Añadir gránulos de hidróxido de sodio hasta que el EDTA se haya disuelto y el pH alcanza 8.0. Agregar agua hasta un volumen final de 500 mL y pasar por un filtro de 0.2 μm.
- Preparar 100 mL de fluoruro de phenylmethanesulfonyl de 100 mM (PMSF) 1,74 g de PMSF de mezcla con etanol prueba 200. Almacenar a-20 ° C.
- Preparar 225 mL de 2 x de tampón de lavado del grano que consta de 50 mM de Tris pH 7.0, NaCl de 1,4 M, glicerol 20% y 1 mM EDTA pH 8.0.
- Preparar 100 mL del búfer de cromatografía de exclusión de tamaño (S200 tampón) que consta de 20 mM 4-Morpholinoethanesulfonic ácido hidrato (MES) pH 6.5, 100 mM NaCl, 2% de glicerol y 0.03% n-dodecil-beta-D-Maltopyranoside (DDM).
- Preparar 100 mL de buffer de resuspensión de membrana que consiste en 50 mM Tris, pH 7.0, 500 mM NaCl y glicerol al 10%.
- Preparar 10 mL de 3 x tinte de carga SDS-PAGE mezclando 3 mL 20% sodio dodecil sulfato (SDS), glicerol 3 mL, 2,4 mL 1M Tris pH 6.8, azul de bromofenol 0.03 g y 1,6 mL de 2-Mercaptoetanol.
2. sobreexpresión de transportador de borato en S. cerevisiae
- Sembrar tres colonias de levadura transformadas en 50 mL de CSM su + YNB + medios de glucosa de 2% y agitar durante la noche a 190 rpm a 30 ° C.
- Al día siguiente usar un espectrofotómetro para determinar la densidad óptica a una longitud de onda de 600 nm (OD600) y de inocular a un OD600 de 0.01 de cuatro frascos de 2 L que cada uno contiene 500 mL de CSM su YNB + medios de glucosa de 2%.
- Agite a 190 rpm a 30 ° C 30 h permitir que las células consumen glucosa todos y crecer a una alta densidad.
Nota: Un tiempo de crecimiento rinde resultados en células más grandes, más grandes rendimientos de membrana cosechados, y rendimientos de proteína purificada en última instancia más grande. - Inducen la expresión añadir 125 mL de 5 medios x YP suplementado con 10% de galactosa para una concentración final de la inducción de la galactosa del 2%. Agite a 190 rpm a 30 ° C por 16 h.
- Cosecha de células por giro a 4.000 x g durante 15 min resuspender las células en 100 mL de agua fría.
Nota: en este punto las células pueden ser congeladas a-80 ° C por tiempo indefinido, o puede continuar la preparación en lisis celular y la membrana cosecha. Cosecha típicamente 40-45 g de células.
3. cosecha de levadura membranas
- Añadir a la resuspensión de células 11,25 mL de Tris 1M pH 7.0, 0,45 mL de EDTA de 0,5 M y 2,25 mL de 100 mM PMSF, el último dos de los cuales actúan como inhibidores de la proteasa. Agregar agua hasta un volumen final de 225 mL, que se traduce en un buffer de resuspensión de células de 50 mM Tris pH 7.0, EDTA, 1 mM y 1 mM PMSF.
Nota: Si utilizando congelados células permite células descongelar completamente, aproximadamente 1 h a temperatura ambiente, porque si permanecen parcialmente congelados, resisten lisis por paliza de grano. - Añadir la resuspensión de células en un bote de metal de 450 mL para grano superando. Rematar el volumen restante con perlas de vidrio frío 0,5 mm.
- Montar una cámara de grano-golpeo con el rotor y sumergirlas en un baño de hielo. Realizar seis pulsos de 1 minuto, separados por períodos de descanso de 2 minutos para evitar el sobrecalentamiento del lisado.
- Montar un aparato de filtración de vacío utilizando un plástico botella desechable filtro atornillado en una botella de vidrio. Quitar la membrana de filtración, porque el dispositivo plástico restante puede capturar los granos permitiendo lisado para pasar. Separar los granos de lisado vertiendo el contenido de la cámara de paliza de grano en la Asamblea mientras se aplica el vacío.
- Lavar la cámara de golpes del grano con 225 mL de 2 x de tampón de lavado que contiene 50 mM Tris, pH 7.0, 1 mM EDTA, 1 mM PMSF, 1,4 M de NaCl y 20% de glicerol. Vacíe el contenido de la cámara sobre los granos para lavarlos.
Nota: El lavado da un volumen final de ~ 450 mL lisada y significativamente membrana cosechada aumenta los rendimientos. Las concentraciones finales son 700 mM NaCl, 50 mM Tris, pH 7.0, 1 mM EDTA, 1 mM PMSF y glicerol al 10%, y el propósito principal de elevar la concentración de sal es ayudar a disociar las proteínas periféricas de membrana. - Desactivación de la célula lisada por 15 min a 15.000 x g. Vierta el sobrenadante en botellas de policarbonato y vuelta por 1 h a 135.000 x g en una ultracentrífuga para recoger las membranas.
Nota: Si no hay una ultracentrífuga, las membranas se pueden recoger por spinning por 3 h a 53.000 x g, una fuerza que es realizable en centrífugas de piso modelo. - Deseche el sobrenadante y pesar las botellas con las pelotillas de la membrana. Vuelva a suspender los pellets de membrana en aproximadamente 35 mL membrana resuspensión tampón que contiene 50 mM Tris pH 7.0, 500 mM NaCl y 10% de glicerol y añadir a un douncer de vidrio. Pesar los tubos de centrífuga de vacío para determinar la masa de las membranas cosechadas.
Nota: En una cosecha eficiente de membrana, el peso de las membranas es igual a aproximadamente el 20% el peso de las células utiliza para la cosecha de esa membrana. Este protocolo da rendimientos de la célula típica de 40-45 g, y así además esperar un rendimiento de membranas g 8-9. - Dounce homogeneizar las membranas y Alicuotar en tubos cónicos de 50 mL que ahora pueden ser almacenados indefinidamente a-80 ° C.
Nota: Para este experimento, por lo general dos alícuotas se hacen, para permitir dos purificaciones de proteínas separadas realizar desde una preparación original de la célula.
4. solubilidad y purificación de proteínas
- A un vaso de precipitados agregar una barra de agitación y 150 mg de n-dodecil-β-D-Maltopyranoside (DDM) por membrana g se utiliza. Mantener la proteína en el hielo o a 4 ° C en todo momento.
Nota: DDM es higroscópico y debe almacenarse en un tarro de cristal con desecante a-20 ° C cuando no esté en uso. También, es típico usar entre 4 a 5 g de las membranas de purificación para obtener una cantidad apreciable de proteína pura. - Descongelar las membranas y llevar a un volumen final de 15 mL por g de membrana en membrana resuspensión buffer suplementado con 1 mM PMSF y 20 mM imidazol pH 8.0. Añadir las membranas en el vaso con DDM y revuelva durante 1 h a 4 ° C.
Nota: La concentración de DDM será 1% w/v, pero para la solubilización de proteínas de la membrana es más crítico a tener en cuenta la masa de detergente añadido por membrana g. - Spin 25 min a 135.000 x g a 4 ° C para material no solubilizado de pellets. Filtrar el sobrenadante a través de un filtro de jeringa de 5 μm.
- Equilibrado de carga de la muestra por la bomba peristáltica se establece en un caudal de 1 mL/min en una columna de afinidad de níquel inmovilizado 1 mL en 20 mM de Tris pH 7.0, 500 mM NaCl, 10% glicerol, 20 mM imidazol pH 8.0 y 0.05% DDM.
Nota: Para menor expresa proteínas, rendimientos y mayor pureza se observaron mediante un 1 mL en lugar de la columna de 5 mL y el níquel en lugar de los iones de cobalto para la cromatografía de afinidad. - Lavar la columna con 10 volúmenes de columna de un tampón de lavado que contiene 20 mM Tris, pH 7.0, 500 mM NaCl, 10% glicerol, 80 mM imidazol pH 8.0 y 0.05% DDM.
Nota: La concentración de imidazol que puede ser utilizada durante el lavado para una proteína 10 su etiquetado es superior es comúnmente apreciado y resulta en mayor pureza. - Eluir la proteína en el búfer que contiene 20 mM Tris, pH 7.0, 200 mM NaCl, 10% glicerol, 300 mM imidazol pH 8.0 y 0.05% DDM. Recoger el eluido en diez fracciones de 1 mL y correr en un gel de SDS-PAGE de Tris glicina 4-20% junto con fracciones solubles de lisado y lavar.
- Fracciones del pico de la piscina, generalmente cerca de 5-6 mL y concentrado a 500 μl o menos volumen en un concentrador de corte de 50 kDa en una centrífuga de mesa refrigerada a 4 ° C.
Nota: 500 μl es un volumen máximo típico inyectado en columnas de cromatografía (SEC) de exclusión de tamaño. En este punto la proteína pueden ser almacenadas indefinidamente a-80 ° C o continuar por la SEC. - Filtro de la proteína a través de un filtro de 0.2 μm spin columna e inyectar en una columna exclusión tamaño (por ejemplo, Superdex 200) equilibrada en tampón S200: 20 mM Mes pH 6.5, 100 mM NaCl, 2% de glicerol y 0.03% DDM.
Nota: Para el glutaraldehído subsecuente análisis del cross-linking, el neutralizante no debe contener una amina primaria. SEC es una oportunidad para intercambiar búferes si es necesario, como hace aquí al Tris de cambiar de Mes. - Ejecutar que las fracciones de pico en un Tris glicina 4-20% SDS-PAGE gel. El gel de la mancha, recoger fracciones de puro pico y concentrarse en un concentrador de corte kDa 50 a 4 ° C.
- Determinar la concentración de proteína mediante la medición de la absorbancia a una longitud de onda de 280 nm y almacenar indefinidamente a-80 ° C.
5. análisis del cross-linking de glutaraldehído
- Preparar una reacción μl 10 mezclando 3 μl de proteína de 0.5 mg/mL en tampón de S200, 5 μl de tampón de la S200, 1 μl de agua o 20% sodio dodecil sulfato (SDS), seguido de 1 μl de glutaraldehido de 1.5%.
Nota: Esto le dará una reacción de 1 x de glutaraldehído de 0,15 mg/mL de proteína y 0.15%. Las muestras que contienen un tratamiento previo de la SDS son controles negativos importantes y deben ser mezcladas y se incubó a temperatura ambiente durante 5 minutos antes de agregar el glutaraldehído. - Incubar la reacción durante 30 min a temperatura ambiente. Terminar la reacción mediante la adición de 5μl de 3 x gel de SDS-PAGE carga colorante, que contiene un exceso de tampón de Tris que apaga el glutaraldehído.
- Todos 15 μl en gel de SDS-PAGE de Tris glicina 4-20%, que cargará 1,5 μg proteína por carril de la carga. Correr el gel a 200 V durante 30 minutos la mancha y determinar el grado de dimer reticulación por la evidencia de una banda que va en dos veces el tamaño del monómero desnaturalizado.
Nota: Una valoración de glutaraldehído y curso del tiempo pueden realizarse primero para encontrar las mejores condiciones para un transportador de homomeric.
Resultados
Los geles típicos para las fracciones eluídas de realizar cromatografía de afinidad níquel mostrar todos tres proteínas parcialmente purificadas (figura 1A). A la derecha de la escalera es el lisado, que en cada caso no muestra una banda significativa correspondientes al transporte de borato que es típico de las proteínas que no sobreexpresan bien. El carril de lavado de 80 mM muestra una mínima pérdida de proteína 10-su-etiqueta a pesar de la concentración relativamente alta de imidazol. Bandas correspondientes a los transportadores de borato son evidentes en fracciones eluídas, y fracciones consideradas que contienen la mayor parte de las proteínas eluídas se concentran antes de inyectar en la columna de filtración de gel S200. En esta etapa, las proteínas son purificadas insuficientemente para muchos usos aguas abajo, según lo indicado por bandas adicionales en la muestra concentrada antes de inyectar en la columna de S200 (figura 1B). Sin embargo, la inyección de la muestra en la columna de exclusión de tamaño revela fracciones eluídas de alta pureza (figura 1B-C). Se presentan los cromatogramas y sus correspondientes geles para cada uno de los transportadores de borato. A pesar de la moderada pureza de las muestras en la elución de la cromatografía de afinidad, la proteína es muy pura en el eluyente de la columna de gel filtración. Críticamente, los cromatogramas muestran cada proteína a emigrar sobre todo como un pico único monodispersa con proteína poco conservada en el volumen vacío. Una proteína estable y plegada generalmente da un monodispersa y pico simétrico, aunque inestable, mal plegadas o agregados de proteínas generalmente dará picos asimétricos múltiples o un gran pico en el volumen vacío. Es típico para obtener un rendimiento final de aproximadamente 2 mg purificado proteína por L de cultura de la levadura para ScBor1 y aproximadamente 1 mg de purificada AtBor1 y OsBor3 por cultura L. Estos números son la cantidad de proteína purificada a partir de una alícuota de 4 a 5 g de membranas, que origina una media de nuestra preparación de la célula original.
El cross-linking el experimento muestra que transportistas homomeric purificada pueden tener su montaje en solución fácilmente evaluada (figura 2). El propósito de las muestras que contienen un tratamiento previo de SDS es mostrar que el cross-linking es dependiente de un estado plegado en solución y que Cross-linking, por tanto, no se produce cuando multimerization es interrumpido por un detergente áspero. Los resultados mostrados distinguen que uno de los tres transportadores de borato, ScBor1, no es dimerized cuando purificada en DDM en estas condiciones, mientras que los otros dos, AtBor1 y OsBor3, Santos y mostrar la dimerización. Es posible ver que no toda la proteína puede entrecruzar. En este ejemplo, trazas de monómero de OsBor3 son visibles, mientras que AtBor1 se une a la terminación. El grado de reticulación depende de la cantidad de residuos de lisina en proximidad unos a otros, y es posible que otros reactivos Cross-linking eficientemente pueden entrecruzar proteínas de membrana diferentes.
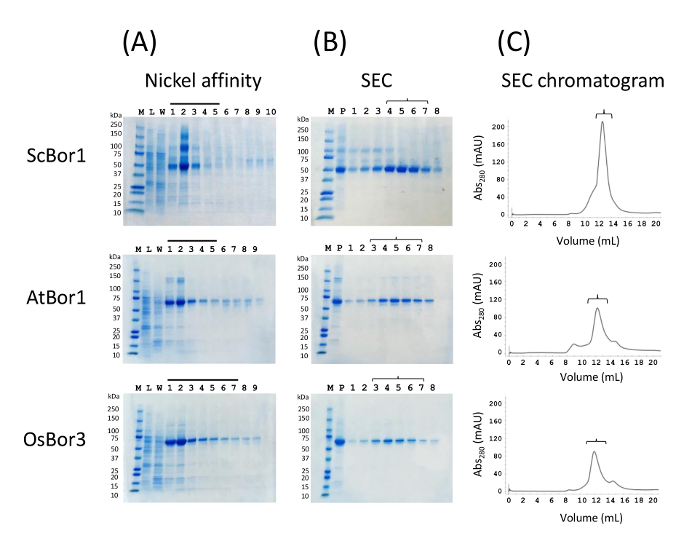
Figura 1 . Afinidad y tamaño purificación cromatografía de exclusión de tres transportadores de borato de níquel. Cada panel vertical (A), (B), y (C) contiene datos para ScBor1, AtBor1 y OsBor3. (A) columna de afinidad de níquel. M es una de los marcadores de peso molecular con peso en kDa especificada a la izquierda. L es el lisado crudo, y W es el lavado de 80 mM imidazol. Todas las otras líneas numeradas corresponden a fracciones de 1 mL eluidos con imidazol de 300 mM. Barras sobre fracciones indican que fueron seleccionados para ser combinados y concentrado para inyecciones en la columna. P (B) indica la proteína concentrada antes de inyectar en la columna de la S200. Fracciones eluídas de SEC están a la derecha, con los soportes que solía coincidir con carriles de gel con sus fracciones del cromatograma en (C). El volumen vacío es justo después de 8 mL. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 . Cross-linking ensayo evalúa purificadas transportadores para ensamble multimérica. Una escalera con pesos moleculares se indica a la izquierda. Sobre todo otros carriles se muestra que la proteína está presente y si la muestra ha tenido glutaraldehído añadido o un tratamiento previo de SDS antes además de glutaraldehído. Las flechas indican las posiciones de monómero y dímero de AtBor1 y OsBor3. ScBor1 es una proteína más pequeña de AtBor1 y OsBor3 y se ejecuta como se esperaba. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí hemos compartido protocolos detallados que resultan en la purificación a homogeneidad de tres transportadores distintos eucariotas borato. Los protocolos aquí presentados se derivan de otros protocolos para la expresión de proteínas de membrana integral en S. cerevisiae1,14y nuestro resultado de optimizaciones de pureza mejorada y mejores rendimientos. Los parámetros optimizados aquí incluyen volúmenes de crecimiento de la célula cultura y tiempos, procedimientos de lisis paliza de grano, composición de búfer durante la lisis celular y purificación de proteínas, cantidad de detergente utilizado por gramo membrana, iones metálicos identificar en la purificación de la afinidad, volumen de la columna de afinidad y la aplicación de un análisis Cross-linking para evaluar idoneidad homólogo y detergente por evaluar el estado de multimérica de los transportadores. Los protocolos son exitosos para múltiples SLC4 homólogos de las especies de plantas y hongos. Una limitación de todas las estrategias para la purificación de proteínas de membrana integral es que no existe ningún método de purificación de proteínas de membrana universal que está garantizado para trabajar. Es posible que nuestros protocolos son más probables ser exitoso para las proteínas en la identidad de secuencia y estructura SLC4 transportadores y, por tanto, los miembros de las familias SLC4, SLC23 y SLC26 podrían ser prometedores objetivos15. Además, evolutivamente más distantes de los transportadores de borato puede ser un transportador de membrana, más probable es que el protocolo tendrá que ser diferente, como variando el sistema de expresión, detergente y otros parámetros clave4.
El protocolo aprovecha la etiqueta de afinidad más utilizados en la purificación de la proteína, la su-etiqueta. A pesar de la presencia de impurezas en las fracciones eluídas iniciales, las combinaciones de afinidad níquel, extenso lavado y posterior purificación de SEC resultado altamente purificado de la proteína. Una 10-su-etiqueta permite el imidazol más estricta se lava y así se puede quitar más proteínas de unión del fondo que puede eliminarse en lavados permitidos por 8 su - o 6-su-etiquetas. Nuestras selecciones para las fracciones puros errar en el lado conservador de las mayoría altamente puros del gel de fracciones, que corresponden a las fracciones de segundo pico. Rendimientos de proteína final pueden incrementarse y concentrando más fracciones, aunque con las ventajas y desventajas de la proteína un poco menos pura. Los métodos presentados aquí permitió la purificación de AtBor1 en cantidades que condujo a la determinación de su estructura de cristal7, con diferencias de purificación consisten en cortar la su-etiqueta e intercambiando el transportador en una diferente detergente para mejorar de difracción del cristal7.
Nuestro protocolo plantea importantes consideraciones para la selección de homólogos y el detergente utilizado para solubilizar y purificarlos. DDM es una opción común en primera para el detergente porque es relativamente suave, a menudo éxito en solubilización y se ha utilizado en estudios estructurales y funcionales de una amplia variedad de proteínas de membrana. En la determinación de si un detergente es una pobre selección de una membrana, un método común de evaluación es si la proteína da un monodispersa solo pico en un cromatograma de seg, en lugar de un pico grande en el volumen vacío o una gama de picos polidispersas, que indicar proteínas mal plegadas o inestable. Una consideración más sutil es elevada por nuestra purificación de ScBor1. Purifica en grandes cantidades y parece favorable y monodispersa en un cromatograma de la SEC, que sugiere que podría ser un objetivo atractivo para estudios estructurales. Sin embargo, nuestro análisis Cross-linking revela que es un monómero cuando purificada. Mientras que es posible que ScBor1 podría existir nativamente como monómero en la célula, los estudios indican que SLC4 transportadoras y sus homólogos suelen ser dímeros7,8,9,10. Nuestro desarrollo de la prueba de cross-linking ocurrió después de la cristalización y la estructura de AtBor1 de problemas. Sin embargo, habíamos sido capaces de evaluar ScBor1 en comparación con el AtBor1 con el ensayo Cross-linking, valiosos esfuerzos de investigación y tiempo podrían sido redirigidos a la búsqueda de AtBor1 en lugar de ScBor1, que finalmente no tuvo éxito en experimentos de cristalización y la difracción. Este ensayo puede así ayudar a los investigadores distinguir entre homólogos o detergentes a utilizar cuando estudios estructurales con el fin de dar prioridad a las condiciones en las que la proteína mantiene su conformación nativa sospecha. Además, el ensayo puede utilizarse para probar que los aminoácidos son esenciales para multimerization, para encontrar sustituciones de aminoácidos que desestabilizan el multimerization interfaz y a obligar a monómeros. Este enfoque se ha utilizado para probar la significación funcional de homomeric Asamblea en transportadores de membrana16,17,18.
Una ventaja general de nuestro método es que la levadura se ha demostrado que permitir la expresión de muchas proteínas de membrana desafiante de diversas funciones1. Además, sus bajo costo y crecimiento veces promoción su accesibilidad para muchos esfuerzos de investigación que pueden ser menos capaces de utilizar estrategias de expresión que requieren cultivo de tejidos o medios de crecimiento caro. Los procedimientos presentados aquí son relativamente baratos y se pueden realizar en una semana que pone de relieve la viabilidad del enfoque. Implementación de estos protocolos puede ayudar a permitir estudios estructurales y funcionales de otras proteínas de membrana desafiante.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada por fondos de inicio en el Davidson College.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| 4-Morpholinoethanesulfonic acid hydrate (MES) | Acros | 172591000 | |
| Äkta Pure 25 L FPLC | GE Healthcare | 29018224 | |
| Amicon Ultra 15 mL, 50 kDa MWCO concentrator | Millipore | UFC905024 | for concentrating nickel column fractions |
| Amicon Ultra 4 mL, 50 kDa MWCO concentrator | Millipore | UFC805024 | for concentrating S200 fractions |
| Bacto Peptone | BD Diagnostics | 211677 | |
| Bacto Yeast Extract | BD Diagnostics | 288620 | |
| Glass Erlenmeyer flask, 2L | Sigma-Aldrich | CLS44442L | |
| Benchtop centrifuge | Sorvall | Legend RT | |
| Bottle top filter | Nalgene | 595-4520 | the membrane is removed and used to filter glass beads |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Complete supplement mixture without histidine | Sunrise Science | 1006-100 | |
| D-Galactose | Sigma-Aldrich | G0750 | |
| D-Glucose | Sigma-Aldrich | RDD016 | |
| Ethanol, 200 proof | Pharmco-Aaper | 111000200 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Sigma-Aldrich | EDS-500G | |
| Gel tank SDS-PAGE system | Bio-Rad | 1658004 | |
| Glass bead-beating cell disruptor | BioSpec | 1107900 | |
| Glass beads, 0.5mm | BioSpec | 11079105 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16019 | sent as an 8% solution under nitrogen |
| Glycerol | Sigma-Aldrich | G7893 | |
| HiTrap IMAC FF column, 1 mL | GE Healthcare | 17-0921-02 | charged with nickel |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| Imidazole | Acros | 12202 | |
| Instant Blue gel stain | Expedeon | ISB1L | |
| JA-10 rotor | Beckman | 369687 | |
| JA-14 rotor | Beckman | 339247 | |
| Microcentrifuge tubes, 1.5mL | Thermo Scientific | 3451 | |
| Microcentrifuge, refrigerated | Fisher | 13-100-676 | |
| Mini-Protean Tris-glycine gels, 4-20% | Bio-Rad | 456-1096 | |
| Minipuls 3 peristaltic pump | Gilson | F155005 | used for loading lysate onto affinity column |
| n-Dodecyl-beta-D-Maltopyranoside (DDM) | Inalco | 1758-1350 | |
| Nickel(II) Sulfate Hexahydrate | Sigma-Aldrich | 227676 | |
| Orbital shaking incubator with temperature control | New Brunswick | C24 | |
| p423 GAL1 plasmid with borate transporter insert | available from authors | ||
| Phenylmethanesulfonyl fluoride (PMSF) | Acros | 215740050 | |
| Polycarbonate ultracentrifuge tubes | Beckman | 355618 | |
| Polypropylene bottles, 250mL | Beckman | 356011 | |
| Polypropylene bottles, 500mL | Beckman | 355607 | |
| Precision Plus Protein Kaleidoscope Standards | Bio-Rad | 1610375 | |
| S. cerevisiae expression strain DSY-5 | available from authors | ||
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Sodium hydroxide | Sigma-Aldrich | S8045 | |
| Spin column with 0.2 µm filter, 0.5mL | Millipore | UFC30GV0S | for filtering protein before injecting onto S200 column |
| Sterile Falcon tubes, 15mL | Lab Depot | TLD431696 | |
| Sterile Falcon tubes, 50mL | Lab Depot | TLD431698 | |
| Superdex 200 10/300 GL column | GE Healthcare | 17-5175-01 | used for SEC purification |
| Syringe filter, 5µm | Pall | 4650 | for filtering lysate before loading affinity column |
| Tris-base | Sigma-Aldrich | T1503 | |
| Type 70 Ti rotor | Beckman | 337922 | |
| Ultracentrifuge | Beckman | L8-70M | |
| YNB+Nitrogen without amino acids | Sunrise Science | 1501-500 |
Referencias
- Drew, D., et al. GFP-based optimization scheme for the overexpression and purification of eukaryotic membrane proteins in Saccharomyces cerevisiae. Nature Protocols. 3 (5), 784-798 (2008).
- Goehring, A., et al. Screening and large-scale expression of membrane proteins in mammalian cells for structural studies. Nature Protocols. 9 (11), 2574-2585 (2014).
- Andréll, J., Tate, C. G. Overexpression of membrane proteins in mammalian cells for structural studies. Molecular Membrane Biology. 30 (1), 52-63 (2013).
- Lyons, J. A., Shahsavar, A., Paulsen, P. A., Pedersen, B. P., Nissen, P. Expression strategies for structural studies of eukaryotic membrane proteins. Current Opinion in Structural Biology. 38, 137-144 (2016).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Fairbanks, G., Steck, T. L., Wallach, D. F. Electrophoretic analysis of the major polypeptides of the human erythrocyte membrane. Biochemistry. 10 (13), 2606-2617 (1971).
- Thurtle-Schmidt, B. H., Stroud, R. M. Structure of Bor1 supports an elevator transport mechanism for SLC4 anion exchangers. Proceedings of the National Academy of Sciences of the United States of America. 113 (38), 10542-10546 (2016).
- Coudray, N., et al. Structure of the SLC4 transporter Bor1p in an inward-facing conformation. Protein Science. 26 (1), 130-145 (2016).
- Arakawa, T., et al. Crystal structure of the anion exchanger domain of human erythrocyte band 3. Science. 350 (6261), 680-684 (2015).
- Huynh, K. W., et al. CryoEM structure of the human SLC4A4 sodium-coupled acid-base transporter NBCe1. Nature Communications. 9 (1), (2018).
- Zhao, R., Reithmeier, R. A. Expression and characterization of the anion transporter homologue YNL275w in Saccharomyces cerevisiae. American Journal of Physiology Cell Physiology. 281 (1), 33-45 (2001).
- Takano, J., et al. Arabidopsis boron transporter for xylem loading. Nature. 420, 337-340 (2002).
- Nakagawa, Y., et al. Cell-type specificity of the expression of Os BOR1, a rice efflux boron transporter gene, is regulated in response to boron availability for efficient boron uptake and xylem loading. Plant Cell. 19 (8), 2624-2635 (2007).
- Hays, F. A., Roe-Zurz, Z., Stroud, R. M. Overexpression and purification of integral membrane proteins in yeast. Methods in Enzymology. 470, Issue C (2010).
- Chang, Y. -N., Geertsma, E. R. The novel class of seven transmembrane segment inverted repeat carriers. Biological Chemistry. 398 (2), 165-174 (2017).
- Robertson, J. L., Kolmakova-Partensky, L., Miller, C. Design, function and structure of a monomeric ClC transporter. Nature. 468 (7325), 844-847 (2010).
- Last, N. B., Miller, C. Functional Monomerization of a ClC-Type Fluoride Transporter. Journal of Molecular Biology. 427 (22), 3607-3612 (2015).
- Yu, X., et al. Dimeric structure of the uracil:proton symporter UraA provides mechanistic insights into the SLC4/23/26 transporters. Cell Research. 27 (8), 1020-1033 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados