Method Article
基于微注射的免疫胚胎心肌细胞体内植入系统
摘要
在这种方法中, 胚胎心脏组织被手术显微解剖, 离解, 荧光标记, 并植入宿主胚胎组织。这为研究异位血流动力学条件下的个体或组织水平发育组织以及/或改变后的副血流/朱克沙林环境提供了一个平台。
摘要
解释细胞自主模式与外在微环境对细胞谱系测定的相对影响是发育生物学研究中的一个普遍挑战。在胚胎心脏, 这可能是特别困难的, 因为区域差异的表达转录调节剂, 副朱克林/朱克辛胺信号提示, 和血流动力学力量都知道影响心肌细胞成熟。因此, 改变正在发育的心肌细胞分子和生物力学微环境的简化方法将成为研究局部条件如何影响细胞命运和功能的有力技术。为了解决这个问题, 我们优化了一种将幼年体心肌细胞移植到心脏或周围胚胎组织异位的方法。这使我们能够研究微环境条件如何影响完整胚胎内单个细胞的心肌细胞命运转变。在这里, 我们描述了一个协议, 其中胚胎肌细胞可以从各种心脏子域分离, 离解, 荧光标记, 并微注射到宿主胚胎与高精度。然后, 可以使用各种成像和组织学技术直接对细胞进行原位分析。该方案是一个强大的替代传统的嫁接实验, 可以是令人望而却步的困难, 在移动组织, 如心脏。该方法的概述也可适用于各种供体组织和宿主环境, 其易用性、低成本和速度使其成为各种发育研究的潜在有用应用。
引言
心脏发育研究从胚系转基因模型系统的出现中获益匪浅, 这些模型系统已经确定了许多基因调控网络, 这些网络的模式是心脏中不同的细胞谱系和功能域。然而, 确定这些基因网络如何与微环境条件相互作用并对其作出反应, 包括辅助神经/朱克沙克林信号和生物物理输入 (拉伸、应变、血流动力学), 可能具有挑战性。因此, 并不总是容易确定细胞表型是遗传扰动的直接结果, 还是适应心脏生物力学或高阶组织成分 1, 2 的次要结果.
嫁接实验通常被用来处理命运规范、承诺、归纳和能力3、4的概念, 它将是规避其中固有的一些挑战的理想方法。定义细胞自主与环境对心脏的影响。不幸的是, 心脏收缩使标准的嫁接方法困难。组织的快速运动通常会阻止移植细胞粘附心脏和大组织穿刺 (通常需要移植), 经常导致心脏衰竭和胚胎死亡5, 6,7.因此, 我们开发了一种基于压力的微注射系统, 用于发育中的雏鸡心脏进行精确的细胞植入, 绕过了前面描述的 8,9的组织移植技术障碍。使用这种技术, 从供体胚胎中分离出的单个或小群心肌细胞可以被微注射到宿主胚胎心脏的各种区域, 从而消除了广泛的宿主准备和大组织侮辱的需要使用标准的嫁接技术。用于这些植入研究的微注射针的外径为 ~ 30-40μm, 这意味着针头可以直接放置在目标组织中 (即可以穿透胚胎心肌壁), 细胞可以集中交付。对周围组织造成的损害最小。该协议可用于执行各种同位素、异位、同极和异质性慢性操作, 为直接研究开发过程中的经典实验胚胎学范式提供了一种快速、灵活、低成本的方法。四腔的心脏。
在下面概述的协议中, 我们用一种蠕动的荧光染料标记供体细胞, 这样可以实时监测微注射实验的成功, 并记录移植细胞的位置, 而不需要任何额外的染色。然而, 应该注意的是, 这种方法最适合短期实验 (约 48小时), 因为荧光染料可以通过细胞分裂丢失。可用于长期实验的替代方法。
当我们在心脏发育的背景下介绍这项技术时, 我们已经将其用于中胚层、头部、四肢和体细胞的细胞植入实验中发挥了巨大的作用。因此, 下面描述的基本方法是高度可操作的, 可以在各种器官系统中使用。
研究方案
所描述的所有方法都遵循北卡罗来纳大学教堂山分校的动物护理指南。
1. 微注射移液器的制备
- 使用微型移液器拉拔玻璃毛细血管。对于某些注射, 建议使用针线斜面, 因为它提供了一个极锐利的表面, 没有结构杂质。为此, 请以45°的角度擦亮斜轮上的拉针末端15-20分钟。
注: 拉拔的确切设置将根据所使用的拉拔器而有所不同。斜面的最终内径应在20-40 微米之间。 - 用硅胶覆盖玻璃毛细管的内外表面。首先将针头浸入硅化剂中, 将针头覆盖针头的外表面, 然后将硅化剂溶液背入每个微移液器中, 使其覆盖内表面。
注: 玻璃毛细血管的涂层应在植入实验前24小时进行。用有机硅涂覆玻璃毛细血管为玻璃提供了化学惰性表面。如果毛细血管不经处理, 以后步骤产生的细胞悬浮液将粘附在玻璃上, 并堵塞针头。因此, 涂层是必要的, 也是该方法成功的关键。
注意: 硅化剂是一种现成的商用七烷混合物和 1, 7-二氯-1、1、3、3、5、5、7、7、7-八甲基四硅氧烷 (材料表)。它是极其易燃和急性毒性。始终在通风柜内处理适当的个人防护设备。- 要对针头进行背载, 将硅化剂的负载 ~ 5-10μl 加载到微注射移液器尖端 (材料表) 中。将微注射尖端放置在拉玻璃毛细管的宽端, 并将尖端放置在尽可能远的下方 (靠近玻璃针尖)。在慢慢拆卸装载移液器的同时, 取出硅化剂, 以最大限度地减少针头中的气泡。
- 将硅化剂留在玻璃针中 10分钟, 用新的装载移液器吸气取出, 并允许针头在烟罩中连夜干燥。
- 实验的早晨, 按照步骤1.2 中的步骤用去离子水冲洗玻璃毛细血管, 并允许干燥3-4小时。
2. 解决方案的准备
- 用750μl 的胎儿牛血清 (fbs) 和50μl 的 penicilinmyin streptomycin 补充 2.4 ml 的 dulbecco 的改良鹰的培养基和 ham 的营养混合物 f12 (dem任何额 f12), 制备5毫升的胰蛋白酶中和溶液。在37°c 下存放, 直至使用。
- 通过将5μl 的 1 mm 库存标签染料 (在二甲基亚硫酸盐 [dmso] 中, 材料表) 移液到汉克平衡盐溶液 (hbss) 的995μl 中, 制备5μm 标记染料溶液。旋涡 1分钟, 储存在 37°c, 直到使用。
- 将 32% pfa 库存溶液的10毫升与分子生物学级水的62毫升和 10倍 dul贝科磷酸盐缓冲盐水 (dpbs) 的8毫升结合, 制备新鲜的聚甲醛 (pfa)。最终浓度为4% 的 pfa 在 1x dbs。
3. 胚胎的制备
- 在38°c 的加湿孵化器中水平培养可育的鸡蛋, 直到汉堡和汉密尔顿 (hh) 第19阶段10.
注: 为操作选择的阶段是灵活的, 完全取决于每个单独实验的目标。 - 沿蛋壳的 "扁平" 端沿鸡蛋赤道得分, 使用角度钳, 使一个小穿刺 & gt;1 毫米直径。通过穿刺插入连接10毫升注射器的 18 g 针, 取出 ~ 5 毫升的白蛋白。
注: 这个解剖位置是在鸡蛋内的 "空气细胞" 外部, 并防止白蛋白泄漏, 一旦穿刺。建议采取此步骤, 因为它将胚胎从蛋壳中 "掉落", 防止在随后的步骤中造成潜在损害。 - 在蛋壳顶部涂上透明胶带。用有角度的钳子打分, 并使用弯曲的肌腱切开剪刀切割一个 ~ 2.5 厘米的窗口。
- 根据汉堡和汉密尔顿10 制定的标准对胚胎进行检查和阶段, 并用透明胶带密封步骤3.2 中的穿刺。
注: 在这里, 阶段 hh19 胚胎被使用, 有37-40 体细胞延伸到尾芽。在沿着鸡蛋顶部打开窗户后, 才应密封穿刺 (步骤 3.3)。 - 使用带有1毫升注射器的 32 g 针在胚胎下注入 ~ 200μl 印度 ink/hbss 混合物 (1: 5)。
注: 印度墨水提供了胚胎和下面的蛋黄之间的视觉对比。替代染料, 如中性红或市售的青色荧光蛋白 (cfp) 或蓝色荧光蛋白 (bfp) 荧光滤光片集, 可用于改善对比度。 - 在胚胎圆盘上滴注1毫升的 hbss, 用石蜡膜密封窗壳。将鸡蛋放回加湿孵化器, 直到准备注射。
4. 供体组织的分离
- 在38°c 的加湿孵化器中孵育供体肥沃的鸡蛋, 直到 hh 19 阶段 (或所需阶段)。
- 从鸡蛋中取出胚胎, 并在室温下 (rt) 将胚胎放入含有无菌 hbss 的100毫米 x 15 毫米培养皿中。
- 通过手术从每个胚胎中对心房供体组织进行显微解剖, 首先将整个胚胎心脏从胚胎中分离出来, 然后在立体解剖显微镜下使用钳子、肌腱剪刀和微铲将心房从心脏中分离出来。池在一个无菌 1.5 ml 微离心管含有1毫升的 hbss 在冰上。
- 一旦收集到所有供体组织, 在4°c 的固定角度微型离心机中, 以 1000 x克的速度对组织进行离心5分钟。
5. 供体组织的胰蛋白酶消化
- 在预热0.05% 的胰蛋白酶 edta 1 毫升中再利用细胞颗粒, 在300rpm 的晃动热块中在37°c 孵育15分钟。或者, 使用定期搅拌样品的水浴。
- 将消化溶液上下移液, 以分解所有剩余的组织, 并按照步骤4.4 中的步骤4.4 中的颗粒。
- 在步骤4.4 中, 将颗粒重新用于胰蛋白酶中和溶液和离心机的1毫升中和。
- 将细胞重新置于400μl 的红色荧光标记染料溶液中, 并在37°c 下在热块中孵育20分钟。此外, 您还可以使用水浴。
- 一旦标记反应完成, 颗粒细胞在步骤4.4 和清洗1毫升的 hbss (清洗步骤的数量可以在1和3之间变化)。
- 将标记的颗粒细胞重新出现在浓度约为 50, 000 细胞/μμl 的情况下, 这通常会产生5-10μl 的工作体积, 具体取决于细胞的总产率。
注: 细胞浓度低于 ~ 50, 000 细胞μl 可导致注射效率低下。
6. 体内注射
- 按照步骤1.2 中的步骤将电池悬浮液背入经过硅胶处理的玻璃毛细管。将移液器安装到压力微喷射器装置中。
- 从加湿孵化器中取出宿主胚胎, 放在荧光灯立体解剖显微镜下的蛋架中。
- 使用无菌细钳打开玻璃体膜, 并在心包中做一个小切口 (长度约 0.5-1.0 mm)。根据注射的目标区域, 可能需要额外的操作/解剖。
- 定位微喷射器, 使微注射针的尖端穿透目标组织。
- 压力注射细胞, 并使用荧光标签来确定植入的细胞存在于所需的组织中。对于典型的注射, 在压力范围为100-400 前的范围内, 应用小于0.5秒的单脉冲。
注: 脉冲长度和绝对压力将根据要注射的细胞数量而有所不同, 并且可以根据个人需要进行修改。 - 在压力注入后, 收回微喷射器装置, 并将鸡蛋从支架上取出。
- 压力注射细胞, 并使用荧光标签来确定植入的细胞存在于所需的组织中。对于典型的注射, 在压力范围为100-400 前的范围内, 应用小于0.5秒的单脉冲。
- 在胚胎上滴注1毫升的温暖 hbss, 用透明的包装胶带密封鸡蛋, 并在38°c 的加湿孵化器中孵育24小时后。
7. 隔离和分析
- 使用钳子、肌腱切开剪刀和类似步骤4.3 的微刺分离 rt hbss 中的宿主胚胎, 并在4°c 下隔夜固定 4% pfa, 轻轻摇晃。
- 在 rt 用温和的摇晃在 hbss 中清洗胚胎 3 x 5分钟, 并在4°c 下储存在 hbss 中进行进一步的下游分析 (显微镜、免疫组织化学、原位杂交等)。
结果
24小时孵育后, 对宿主胚胎的心脏和周围组织进行分离、拍照 (图 1a) 和进行免疫荧光分析。在这个例子中, 供体心房肌细胞被微注射到一个类似的分期宿主胚胎的心外膜。然后用肌肉标记 (mf20 绿色) 和 4 ', 6-二胺-2-苯丁胺 (dapi; 蓝色) 对宿主胚胎进行染色。注入的单元格 (红色) 清晰可见 (图 1b)。如果细胞不可见, 可能需要考虑的调整包括: 供体组织过度消化 (细胞无法附着)、标记染料溶液过于稀释、细胞被过度清洗或多个细胞分裂导致标签丢失。
为了证实这个例子中注射的细胞是心肌细胞, 我们用共聚焦显微镜对这个胚胎进行了光学分离 (图 1c-e)。心外膜 (pe) 中唯一的 mf20 阳性细胞是集中植入的荧光红阳性细胞。
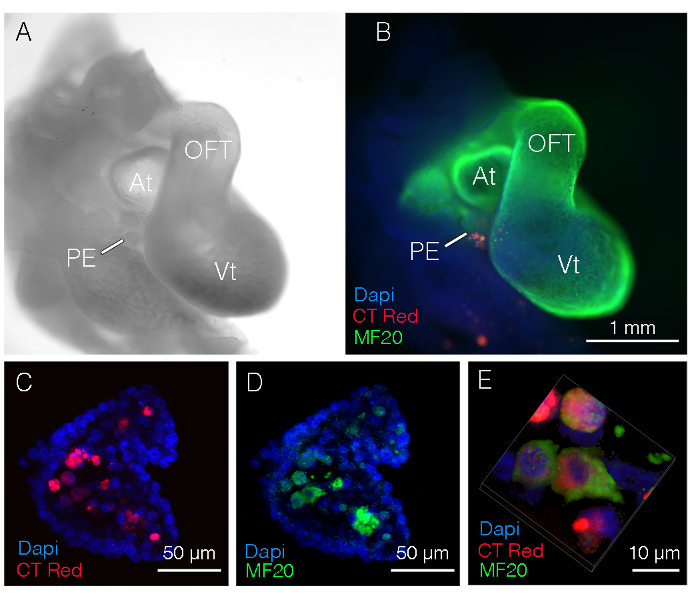
图 1: 注射后24小时分离出的胚胎的代表性图像.(a) e3.5 (hh 阶段 19) 鸡胚胎躯干区域的低放大明亮场图像。(b) 合并图像, 显示注射细胞 (红色)、心肌细胞 (绿色) 和 dapi。从心房分离细胞, 并微注射到心外膜。(c) 高放大共聚焦成像显示在心外膜的核心标记的细胞。(d) 高放大共聚焦成像证实 ct 红色标记细胞为心肌细胞。(e) 从 d 和e 面板重建注入的细胞的三维 (3d)。在, 心房;oft, 流出道;pe, 心外膜;vt, 心室;mf20, 肌球蛋白4。请点击这里查看此图的较大版本.
讨论
能够定义微环境条件如何影响心脏细胞命运的规范和血统稳定是建立先天性心脏病的压缩理解以及制定适当的有效协议的根本干细胞成熟或体细胞重组为基础的心肌细胞。上述协议使研究人员能够在体内改变的条件下直接检测心肌细胞的发育, 从而使细胞自主成熟过程与副瑞克西沙林和/或血流动力学线索分离。当与高分辨率成像、遗传分析和生理检测相结合时, 这种技术可以作为现有转基因模型的有力补充。
从技术立场, 这里介绍的协议依赖于有效的隔离, 标记, 并精确地植入宿主胚胎组织供体心脏细胞。微注射系统的使用极大地帮助了供体细胞的靶向, 并允许成功植入, 而无需在宿主组织中创建一个大型的植入位点。然而, 执行此技术需要一些操作技能, 因为如果注射针没有仔细地放置在目标组织中 (导致心脏破裂或局部血管破裂), 可能会导致生存能力下降。还应该注意和考虑隔离和标记步骤。供体组织的过度消化会导致植入效率低下, 而瞬态标记技术可能会限制可跟踪供体细胞的时间窗口 (因为细胞分裂会冲淡标签)。
这种技术是高度可修改的, 可以适应各种用途。例如, 可以分离出大量组织和阶段的供体细胞 (尽管需要优化酶消化), 同样也可以在不同的发育阶段注射到各种宿主组织中。同样, 可以修改标记方法, 以跟踪不同时间窗口中的细胞, 包括使用荧光无机半导体纳米晶体进行更长的瞬态标记, 以及从绿色植入鹌鹑细胞或细胞荧光蛋白转基因 (gfp +) 供体胚胎11 为永久标记。
虽然我们目前在鸟类植入研究中使用这种技术, 但我们觉得它可以用于未来的大量嵌合研究。例如, 转基因生物的转基因心肌细胞可以使用非常相似的协议被分离并微注射到鸟类心脏中。此外, 从干细胞或通过体细胞重组方法分化为心肌细胞的细胞可以微注射到胚胎心脏, 以评估它们在体内生物力学作用下融入组织和成熟的情况条件。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家卫生研究院、国家心脏、肺和血液研究所 (nhlbi) 颁发的 r00hl122360 赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | BD | 329654 | |
| 1.7 mL Microtubes, Clear | Genesee Scientific | 24-282 | |
| 10 ml Syringe | BD | 305482 | |
| 1000ul Reach Barrier Tip Racked, Sterile | Genesee Scientific | 24-430 | |
| 15 mL Centriguge Tubes, Racked | Genesee Scientific | 28-101 | |
| 1588 Genesis Hova-Bator Incubator | GQF | 813927021221 | |
| 18G x 1 1/2 Needle | BD | 305196 | |
| 200ul Barrier Tip Low Binding, Racked, Sterile | Genesee Scientific | 24-412 | |
| 32G x 1/2" Needle | TSK Steriject Air-Tite | TSK3213 | |
| Alchohol Wipes 70% | Thermo Fisher Scientific | 19015744 | |
| Angled Forceps | Fine Scientific Tools | 11260-20 | |
| Backloading Tips | Eppendorf | 930001007 | |
| Black India Ink | KOH-I-NOOR | 3084-F | |
| CellTracker Green CMF | Thermo Fisher Scientific | C7025 | 1 mM in DMSO |
| CellTracker Red CMTPX | Thermo Fisher Scientific | C34552 | 1 mM in DMSO |
| Centrifuge | Eppendorf | 5424R | |
| Commercial Grade Packing Tape | Staples | 2619001 | |
| Curved Tenotomy Scissors | Fine Scientific Tools | 14067-11 | |
| DMEM/F12 | Thermo Fisher Scientific | 11330-032 | |
| DMSO, anhydrous | Thermo Fisher Scientific | D12345 | |
| DPBS (10X), no calcium, no magnesium | Thermo Fisher Scientific | 14025092 | |
| Femtojet 4i | Eppendorf | 5252000021 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437-028 | |
| Hatching Eggs | Pilgrim's Hatchery | -- | |
| HBSS, calcium, magnesium, no phenol red | Thermo Fisher Scientific | 14025-092 | |
| Injectman 4 | Eppendorf | 5192000027D | |
| Micromanipulator | Leica Microsystems | -- | |
| Parafilm | SIGMA | P6543-1EA | |
| Paraformaldehyde 32% in aqueous solution, EM Grade | VWR | 100496-496 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140-022 | |
| Petri Dish | Genesee Scientific | 32-107 | |
| Pipette Grinder | Narishige | EG-44 | |
| Pipette Puller | HEKA | PIP 6 | |
| Scotch Transparent Tape | Staples | 487909 | |
| Sigmacote | SIGMA | SL2-25ML | |
| Stereo Microscope | Leica | -- | |
| ThermoMixer C | Eppendorf | 5382000023 | |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100F-4 | |
| Transfer Pipette | Thermo Fisher Scientific | 273 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-054 |
参考文献
- Guo, Y. X., Pu, W. T. Genetic Mosaics for Greater Precision in Cardiovascular Research. Circulation Research. 123, 27-29 (2018).
- Guo, Y. X., et al. Analysis of Cardiac Myocyte Maturation Using CASAAV, a Platform for Rapid Dissection of Cardiac Myocyte Gene Function In Vivo. Circulation Research. 120 (12), 1874-1888 (2017).
- Rugh, R. . Experimental embryology; techniques and procedures. 3rd edition. , (1962).
- Slack, J. M. W. . Essential developmental biology. 3rd edition. , (2013).
- Reinecke, H., Zhang, M., Bartosek, T., Murray, C. E. Survival, integration, and differentation of cardiomyocyte grafts: a study in normal and injured rat hearts. Circulation. 100, 193-202 (1999).
- Rojas, S. V., et al. Transplantation of purified iPSC-derived cardiomyocytes in myocardial infarction. PLOS ONE. 12, 0173222 (2017).
- Zhang, M., et al. Cardiomyocyte Grafting for Cardiac Repair: Graft Cell Death and Anti-Death Strategies. Journal of Molecular and Cellular Cardiology. 33 (5), 907-921 (2001).
- Bressan, M., Liu, G., Mikawa, T. Early mesodermal cues assign avian cardiac pacemaker fate potential in a tertiary heart field. Science. 340 (6133), 744-748 (2013).
- Bressan, M., et al. Reciprocal myocardial-endocardial interactions pattern the delay in atrioventricular junction conduction. Development. 141 (21), 4149-4157 (2014).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。