Method Article
Sistema basado en la microinyección en Vivo implantación de cardiomiocitos embrionarios en el embrión aviar
En este artículo
Resumen
En este método, los tejidos cardíacos embrionarios son quirúrgicamente microdissected, disociado, etiquetado fluorescente e implantado en los tejidos embrionarios de host. Esto proporciona una plataforma para el estudio de la organización del desarrollo nivel individuo o tejido bajo condiciones hemodinámicas ectópicas o alteración paracrina/yuxtacrina entornos.
Resumen
Interpretar el impacto relativo del patrón autónomo celular versus extrínseca influencia microambiental en determinación de linaje celular representa un desafío general en investigación de Biología del desarrollo. En el corazón embrionario, esto puede ser particularmente difícil como las diferencias regionales en la expresión de reguladores transcripcionales, señales señalización paracrina/yuxtacrina, y fuerza hemodinámica son conocidos por influir en la maduración de los cardiomiocitos. Un método simplificado para modificar el microambiente molecular y biomecánica de un cardiomiocito en vías de desarrollo, por lo tanto, serviría como una técnica poderosa para examinar cómo local condiciones influencia celular destino y función. Para hacer frente a esto, hemos optimizado un método para físicamente trasplante de cardiomyocytes juvenil en localizaciones ectópicas en el corazón o el tejido embrionario circundante. Esto nos permite examinar cómo microambiental condiciones influencia cardiomiocitos sino transiciones en resolución única célula en el embrión intacto. Aquí, describimos un protocolo en el que miocitos embrionarios pueden ser aislado de una variedad de subdominios cardiacas, disociado, etiquetado fluorescente y microinyectados en embriones de host con la alta precisión. Las células pueden entonces directamente analizarse in situ usando una variedad de técnicas histológicas e imágenes. Este protocolo es una poderosa alternativa a los tradicionales experimentos injertos que puede ser prohibitivamente difícil en un tejido de movimiento como el corazón. El esquema general de este método también puede ser adaptado a una variedad de entornos de host y tejidos de donantes y su facilidad de uso, bajo costo, y velocidad lo hacen una herramienta potencialmente útil para una variedad de estudios del desarrollo.
Introducción
Investigación del desarrollo cardiaco se ha beneficiado enormemente la llegada de los sistemas de modelo transgénico del germline que han identificado muchas de las redes reguladoras del gene eso patrón celular diferentes linajes y dominios funcionales en el corazón. Sin embargo, identificar cómo estas redes de genes interactúan con y responden a condiciones microambiental, incluyendo señales paracrinas/yuxtacrina e insumos biofísicos (estiramiento, tensión, flujo hemodinámico), puede ser difícil. Como tal, no siempre es fácil determinar si un fenotipo celular se presenta como una consecuencia directa de una perturbación genética o como un resultado secundario de una adaptación a los cambios en la biomecánica cardiaca o mayor orden tejido composición1,2 .
Injerto de experimentos, que clásicamente se han utilizado a los conceptos de dirección de la especificación de destino, compromiso, inducción y competencia3,4, representaría un enfoque ideal para sortear algunos de los retos inherentes a definición de célula autónoma contra influencia ambiental en el corazón. Por desgracia, las contracciones del corazón dificultan enfoques injertos estándar. Movimiento rápido de los tejidos a menudo impide que las células injertadas adhiriéndose al corazón y tejido grande punciones (normalmente requerido para injertar) conducen con frecuencia a insuficiencia cardíaca y mortalidad embrionaria5,6,7. Por lo tanto, hemos desarrollado una base de presión, sistema de microinyección para su implantación celular de precisión en el corazón de pollito en desarrollo, burlar los obstáculos técnicos del injerto de tejido descrito previamente8,9. Usando esta técnica, individuales o pequeños grupos de células cardíacas aisladas de un embrión de donante pueden ser microinyectados en una variedad de regiones de un corazón embrionario de host eliminando la necesidad de preparación amplia acogida y los insultos de grande del tejido que ocurren con técnicas de injertos estándar. Las agujas de la microinyección utilizadas para estos estudios de implantación tienen un diámetro exterior de ~ 30−40 μm, lo que significa que la aguja puede colocarse directamente en el tejido de la blanco (es decir, puede penetrar la pared miocardio embrionaria) y las células se pueden entregar focal con daño mínimo al tejido circundante. El protocolo se puede utilizar para realizar una variedad de isótopo, heterotópico, isocórico y manipulaciones heterocrónicas, proporcionando un enfoque rápido, flexible y de bajo costo para examinar directamente la clásicos paradigmas embriológicos experimentales en el desarrollo de la cuatro-"chambré" corazón.
En el protocolo descrito a continuación, etiquetamos donante las células con un colorante fluorescente florescente de la célula, que permite el éxito de un experimento de microinyección para ser monitoreados en tiempo real y la ubicación de células implantadas a documentarse sin necesidad de cualquier adicional de tinción. Sin embargo, cabe señalar que este enfoque es más adecuado para los experimentos a corto plazo (aproximadamente 48 h) como el tinte fluorescente puede ser perdido a través de la división celular. Alternativas se pueden utilizar para los experimentos de plazo más largo.
Mientras que estamos presentando esta técnica en el contexto del desarrollo cardíaco, hemos utilizado lo con gran efecto para los experimentos de implantación de células en el mesodermo, cabeza, extremidades y somitas. Como tal el enfoque básico que se describe a continuación es altamente tratable y puede ser utilizado en una variedad de sistemas del órgano.
Protocolo
Todos los métodos descritos se adhieren a las directrices de cuidado de los animales de la Universidad de North Carolina en Chapel Hill.
1. preparación de la inyección de micro pipetas
- Tire de los tubos capilares de vidrio utilizando un extractor de micropipeta. Para unas inyecciones, aguja biselado es recomendable ya que proporciona una superficie extremadamente aguda desprovisto de impurezas estructurales. Para ello, pulir el extremo de una aguja tirado en una rueda de biselado en ángulo de 45° para 15−20 min.
Nota: La configuración exacta para tirar variará según el extractor se utiliza. El diámetro interior final del bisel debe ser entre 20−40 μm. - Cubra las superficies internas y externas del vaso capilar con silicona. Primero Sumergir las agujas en el agente siliconado para cubrir la superficie externa de la aguja y luego cargue la solución de agente siliconado en cada micropipeta para cubrir la superficie interna.
Nota: El recubrimiento de los tubos capilares de vidrio debe realizarse 24 h antes del experimento de implantación. Capa los tubos capilares de vidrio con silicona proporciona una superficie químicamente inerte al vidrio. Si los capilares quedan sin tratamiento, la suspensión de células generada en los pasos posteriores se adhieren al vidrio y conecte la aguja. Por lo tanto, la capa es necesaria y vital para el éxito del método.
PRECAUCIÓN: El agente siliconado es una mezcla comercialmente disponible confeccionada de heptano y 1, 7-dicloro-1,1,3,3,5,5,7,7-octamethyltetrasiloxane (Tabla de materiales). Es extremadamente inflamable y muy tóxico. Siempre maneje con PPE adecuado dentro de una campana de humos.- A cargue la aguja, cargar ~ 5−10 μl del agente siliconado en una pipeta de microinyección (Tabla de materiales). Coloque la punta de micro inyección en el extremo ancho del vidrio tirado capilar y posicione la punta tan abajo como sea posible (cerca de la punta de la aguja de vidrio). Expulsar al agente siliconado mientras se retira lentamente la pipeta de carga para minimizar las burbujas de aire en la aguja.
- Dejar al agente siliconado en la aguja de vidrio por 10 min, saque por aspiración con una pipeta de carga nuevas y agujas en seco durante la noche en una campana de humos.
- La mañana del experimento, enjuague los tubos capilares de vidrio con agua desionizada, siguiendo el procedimiento en el paso 1.2 y deje que se seque para h 3−4.
2. preparación de soluciones
- Preparar 5 mL de tripsina una solución que neutraliza complementando 4,2 mL de medio modificado Eagle de Dulbecco y mezcla de nutrientes del jamón F12 (DMEM/F12) con 750 μl de suero Fetal bovino (FBS) y 50 μl de penicilina/estreptomicina. Mantenga a 37 ° C hasta su uso.
- Preparar 5 μm etiquetado solución colorante por pipeteo 5 μl del stock de 1 mM etiquetado tinte (en dimetilsulfóxido [DMSO], Tabla de materiales) en 995 μl de Hank equilibrada solución de sal (HBSS). Vortex por 1 min y tienda a 37 ° C hasta su uso.
- Preparar fresco paraformaldehido (PFA) mediante la combinación de 10 mL de solución stock de la PFA de 32% con 62 mL de agua de grado de biología molecular y 8 mL de 10 x solución salina de Dulbecco tamponada con fosfato (DPBS). La concentración final es de 4% PFA en 1 x DPBS.
3. preparación de embriones de host
- Incubar huevos de gallina fértiles en una orientación horizontal en una incubadora humidificada en 38 ° C hasta Hamburger y Hamilton (HH) etapa 1910.
Nota: El escenario elegido para la manipulación es flexible y totalmente dependiente de los objetivos de cada experiencia individual. - Puntuación final "plano" de la cáscara de huevo en el Ecuador del huevo usando pinzas ángulo para hacer una punción pequeña > 1 mm de diámetro. Insertar una aguja de 18 G con jeringa de 10 mL adjunto a través de la punción y retirar ~ 5 mL de albúmina.
Nota: Esta ubicación anatómica es externa a la "celda de aire" dentro del huevo y mantiene la albúmina se escape una vez realizada la punción. Este paso se recomienda como "cae" el embrión de la cáscara de huevo, evitando posibles daños en los pasos posteriores. - Aplique cinta transparente en la parte superior de la cáscara de huevo. Puntuación con pinzas angulares y cortar una ventana de ~2.5 cm con unas tijeras tenotomy curvo.
- Inspeccione y etapa del embrión en base a criterios establecidos por Hamburger y Hamilton10 y sellar la perforación de paso 3.2 con cinta transparente.
Nota: Aquí, embriones de etapa 19 de HH se utilizan que tienen 37−40 somitas que extendía en la yema de la cola. La punción no debe sellar hasta después de que la ventana se abre en la parte superior del huevo (paso 3.3). - Inyectar el ~ 200 μL de mezcla de tinta de la India/HBSS (1:5) bajo el embrión utilizando una aguja de 32 G con jeringa de 1 mL adjunto.
Nota: tinta de la India proporciona contraste visual entre el embrión y la yema por debajo. Alternativa tintes como neutro roja o comercialmente disponible cian proteína fluorescente (PPC) o proteína fluorescente azul (BFP) fluorescencia filtro puede utilizarse para mejorar el contraste. - Añadir 1 mL de HBSS gota a gota sobre el disco embrionario y sellado ventana conchas con la película de parafina. Volver a colocar huevos en la incubadora humidificada hasta que esté listo para la inyección.
4. aislamiento de tejido del donante
- Incubar huevos de gallina fértiles de donantes en una incubadora humidificada a 38 ° C hasta la etapa 19 de HH (o etapa deseada).
- Retire el embrión del huevo y coloque en un plato de petri 100 x 15 mm con HBSS estéril a temperatura ambiente (RT).
- Quirúrgico microdissect atrial tejido del donante de cada embrión aislar primero el entero corazón embrionario del embrión y luego aislando las aurículas del corazón usando microspatula bajo un estéreo microscopio de disección, pinzas y tijera de tenotomía. Piscina en un tubo de microcentrífuga de 1,5 mL estéril que contenga 1 mL de HBSS en hielo.
- Una vez que se ha recogido todo el tejido donante, la pelotilla del tejido por centrifugación a 1000 x g durante 5 min a 4 ° C en una microcentrífuga de ángulo fijo.
5. la digestión tripsina de tejido del donante
- Resuspender el pellet de células en 1 mL de precalentado 0.05% tripsina-EDTA e incubar a 37 ° C durante 15 min en un bloque de calor sacude a 300 rpm. Como alternativa, utilizar un baño de agua con agitación periódica de la muestra.
- Pipetear la solución de digestión hacia arriba y hacia abajo para romper cualquier tejido remanente y la pelotilla como en el paso 4.4.
- Resuspender el precipitado en 1 mL de tripsina neutralizando la solución y centrifugue como en el paso 4.4.
- Resuspender las células en 400 μL de rojo fluorescente etiquetado solución colorante e incubar a 37 ° C por 20 min en un bloque de calor. Como alternativa, utilizar un baño de agua.
- Una vez terminada la reacción etiquetadora, sedimenten las células como en el paso 4.4 y lavado con 1 mL de HBSS (número de lavado pasos pueden variar entre 1 y 3).
- Resuspender las células etiquetadas, concentradas en una concentración de ~ 50.000 células/μl, que generalmente resulta en un volumen de trabajo 5−10 μl dependiendo de la producción total de la célula.
Nota: Las concentraciones de células debajo de ~ 50.000 células/μl pueden resultar en eficiencia de inyección pobre.
6. vivo en inyección
- Cargue la suspensión de células en una pipeta capilar de silicona vidrio tratado, siguiendo los procedimientos en el paso 1.2. Monte la pipeta dentro del aparato de presión microinyector.
- Eliminar embriones host de incubadora humidificada y coloque en un sostenedor del huevo bajo el fluorescente estéreo microscopio de disección.
- Abrir la membrana vitelina con pinzas finas estériles y hacer una pequeña incisión (~0.5−1.0 mm de longitud) en el pericardio. Disección de manipulación adicional puede ser necesaria dependiendo de la región de destino para la inyección.
- Coloque la microinyectora tal que la punta de la aguja de microinyección penetra en el tejido diana.
- Presión de inyectar las células y la etiqueta fluorescente para determinar que las células implantadas están presentes en el tejido deseado. Para las típicas inyecciones, aplicar pulsos individuales de menos de 0.5 s en duración que van desde 100-400 hectopascales de presión.
Nota: Longitud del pulso y la presión absoluta varían dependiendo del número de células que se inyecta y pueden modificarse para adaptarse a las necesidades individuales. - Retraiga el aparato microinyector y retire el huevo del soporte después de la inyección de presión.
- Presión de inyectar las células y la etiqueta fluorescente para determinar que las células implantadas están presentes en el tejido deseado. Para las típicas inyecciones, aplicar pulsos individuales de menos de 0.5 s en duración que van desde 100-400 hectopascales de presión.
- Añadir 1 mL de HBSS caliente gota a gota sobre el embrión, selle con cinta de embalaje transparente de huevos e incubar en la incubadora humidificada a 38 ° C para la implantación de 24 h post.
7. aislamiento y análisis
- Aislar embriones host en HBSS RT utilizando pinzas, tijera de tenotomía y microspatula similar a paso 4.3 y fijar en 4% PFA durante la noche a 4 ° C con oscilación suave.
- Lavar embriones 3 x 5 min en HBSS a TA con suave balanceo y almacenar en HBSS a 4 ° C para posteriores análisis (microscopía, inmunohistoquímica, hibridación in situ, etcetera).
Resultados
Después de 24 h incubación, el corazón y envolvente tejido de host embriones fueron aislados fotografiaron (figura 1A) y procesan para el análisis inmunofluorescente. En este ejemplo, miocitos atriales donantes fueron microinyectados en el proepicardio de una serie de etapas similar embrión. El embrión del anfitrión estaba manchado luego con el marcador de músculo (MF20 verde) y 4', 6-diamidino-2-phenylindole (DAPI; azul). Las células inyectadas (rojo) son claramente visibles (figura 1B). Posibles ajustes a tener en cuenta si las células no son visibles incluyen: tejido del donante más fue digerido (células sería incapaces de fijar), etiquetado solución colorante fue demasiado diluido, las células eran demasiado lavadas o múltiples divisiones celulares resultó en la pérdida de la etiqueta.
Para confirmar que las células inyectadas en este ejemplo fueron del miocardio, ópticamente secciona este embrión utilizando un microscopio confocal (figura 1C-E). Sólo MF20 las células positivas en el proepicardio (PE) son las células positivo rojo fluorescentes que se implantaron focal.
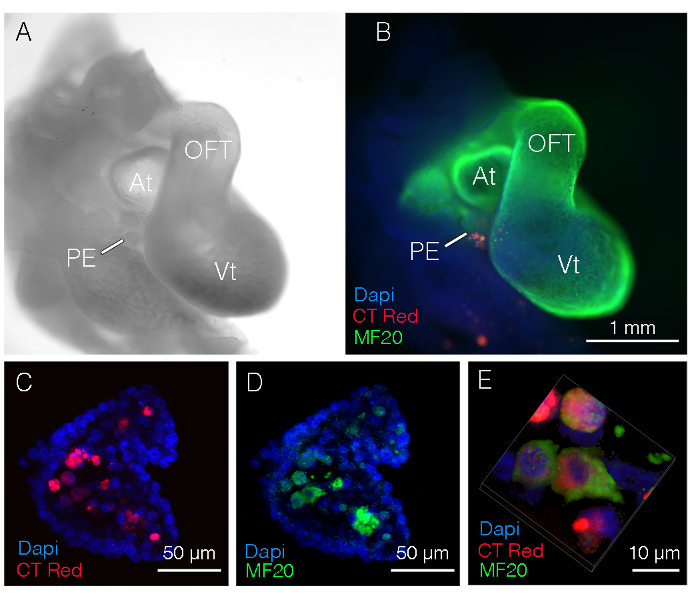
Figura 1 : Imágenes representativas de embriones aislaron 24 horas post inyección. (A) imagen de brightfield Ampliación baja de la región del tronco de un embrión de pollo E3.5 (HH etapa 19). (B) proyección de imagen de Merged inyectado células (rojo), cardiomiocitos (verde) y DAPI. Las células fueron aisladas de las aurículas y microinyectados en el proepicardio. (C) magnificación de alta proyección de imagen confocal mostrando la etiqueta las células en el núcleo del proepicardio. Proyección de imagen confocal de alta magnificación (D) confirmar CT rojo etiquetado células es cardiomiocitos. (E) reconstrucción tridimensional (3D) de las células inyectadas de paneles D y E. En aurículas; OFT, tracto de salida; PE, proepicardio; VT, ventrículo; MF20, miosina 4. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La capacidad de definir cómo microambiental condiciones impacto cardíaco celular destino especificación y linaje estabilización es fundamental para crear un entendimiento compresivo de cardiopatía congénita, así como desarrollo de protocolos eficientes para la adecuada maduración de los cardiomiocitos basado en la reprogramación de células madre o células somáticas. El protocolo descrito anteriormente da los investigadores la capacidad de analizar directamente el desarrollo de la célula cardiaca bajo alterado condiciones in vivo, lo que permite procesos de maduración autónoma la célula de señales paracrinas/yuxtacrina o hemodinámicas. Cuando se combina con la proyección de imagen de alta resolución, análisis genético y ensayos fisiológicos, esta técnica puede servir como un poderoso complemento para modelos transgénicos existentes.
Forma un punto de vista técnico, el protocolo presentado aquí se basa en la eficaz aislamiento, etiquetado y precisa implantación de células de corazón de donante en los tejidos embrionarios de host. El uso de un sistema de microinyección mucho ayuda en la orientación de las células del donante y permite el éxito de la implantación sin la necesidad de crear un sitio de engraftment grandes en el tejido del anfitrión. Es necesaria cierta habilidad operativa para llevar a cabo esta técnica sin embargo, como puede resultar reducida viabilidad si la aguja no se coloca cuidadosamente en el tejido de la blanco (causando ruptura de corazón o vasculatura local). Atención y el pensamiento también se debería a la aislamiento y Etiquetadoras pasos. Sobre la digestión del donante tejido puede llevar a la eficiencia de implantación pobre y transitorio técnicas de etiquetado puede limitar la ventana de tiempo sobre el cual se pueden rastrear las células donantes (como división de célula puede diluir la etiqueta).
Esta técnica es altamente modificable y puede ser adaptada para una variedad de propósitos. Por ejemplo, donante de las células de una amplia gama de tejidos y etapas pueden ser aislado (aunque se requiere la optimización de la digestión enzimática) y semejantemente inyectar en una variedad de tejidos de host a través de diferentes etapas de desarrollo. Del mismo modo, el enfoque de etiquetado puede modificarse para rastrear las células a través de diferentes ventanas temporales, incluyendo el uso de nanocristales de semiconductores inorgánicos fluorescentes para el etiquetado más transitorio y la implantación de células de codorniz o de verde proteína fluorescente transgénicos (GFP +) donantes embriones11 para etiquetado florescente.
Mientras que en la actualidad utilizamos esta técnica para estudios de implantación aviar, creemos que podría ser utilizado para una amplia gama de estudios quiméricos en el futuro. Por ejemplo, alteradas genéticamente células cardíacas de organismos transgénicos podrían aisladas y microinyectadas en pleno aviar utilizando un protocolo muy similar. Además, las células diferenciadas en cardiomiocitos de tallos células o mediante células somáticas reprogramación enfoques podría microinyectados en el corazón embrionario para evaluar su integración en el tejido o la maduración bajo vivo en biomecánica condiciones.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por beca R00HL122360 de los institutos nacionales de salud nacional del corazón, pulmón y sangre Institute (NHLBI).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL Insulin Syringe | BD | 329654 | |
| 1.7 mL Microtubes, Clear | Genesee Scientific | 24-282 | |
| 10 ml Syringe | BD | 305482 | |
| 1000ul Reach Barrier Tip Racked, Sterile | Genesee Scientific | 24-430 | |
| 15 mL Centriguge Tubes, Racked | Genesee Scientific | 28-101 | |
| 1588 Genesis Hova-Bator Incubator | GQF | 813927021221 | |
| 18G x 1 1/2 Needle | BD | 305196 | |
| 200ul Barrier Tip Low Binding, Racked, Sterile | Genesee Scientific | 24-412 | |
| 32G x 1/2" Needle | TSK Steriject Air-Tite | TSK3213 | |
| Alchohol Wipes 70% | Thermo Fisher Scientific | 19015744 | |
| Angled Forceps | Fine Scientific Tools | 11260-20 | |
| Backloading Tips | Eppendorf | 930001007 | |
| Black India Ink | KOH-I-NOOR | 3084-F | |
| CellTracker Green CMF | Thermo Fisher Scientific | C7025 | 1 mM in DMSO |
| CellTracker Red CMTPX | Thermo Fisher Scientific | C34552 | 1 mM in DMSO |
| Centrifuge | Eppendorf | 5424R | |
| Commercial Grade Packing Tape | Staples | 2619001 | |
| Curved Tenotomy Scissors | Fine Scientific Tools | 14067-11 | |
| DMEM/F12 | Thermo Fisher Scientific | 11330-032 | |
| DMSO, anhydrous | Thermo Fisher Scientific | D12345 | |
| DPBS (10X), no calcium, no magnesium | Thermo Fisher Scientific | 14025092 | |
| Femtojet 4i | Eppendorf | 5252000021 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437-028 | |
| Hatching Eggs | Pilgrim's Hatchery | -- | |
| HBSS, calcium, magnesium, no phenol red | Thermo Fisher Scientific | 14025-092 | |
| Injectman 4 | Eppendorf | 5192000027D | |
| Micromanipulator | Leica Microsystems | -- | |
| Parafilm | SIGMA | P6543-1EA | |
| Paraformaldehyde 32% in aqueous solution, EM Grade | VWR | 100496-496 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15140-022 | |
| Petri Dish | Genesee Scientific | 32-107 | |
| Pipette Grinder | Narishige | EG-44 | |
| Pipette Puller | HEKA | PIP 6 | |
| Scotch Transparent Tape | Staples | 487909 | |
| Sigmacote | SIGMA | SL2-25ML | |
| Stereo Microscope | Leica | -- | |
| ThermoMixer C | Eppendorf | 5382000023 | |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100F-4 | |
| Transfer Pipette | Thermo Fisher Scientific | 273 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-054 |
Referencias
- Guo, Y. X., Pu, W. T. Genetic Mosaics for Greater Precision in Cardiovascular Research. Circulation Research. 123, 27-29 (2018).
- Guo, Y. X., et al. Analysis of Cardiac Myocyte Maturation Using CASAAV, a Platform for Rapid Dissection of Cardiac Myocyte Gene Function In Vivo. Circulation Research. 120 (12), 1874-1888 (2017).
- Rugh, R. . Experimental embryology; techniques and procedures. 3rd edition. , (1962).
- Slack, J. M. W. . Essential developmental biology. 3rd edition. , (2013).
- Reinecke, H., Zhang, M., Bartosek, T., Murray, C. E. Survival, integration, and differentation of cardiomyocyte grafts: a study in normal and injured rat hearts. Circulation. 100, 193-202 (1999).
- Rojas, S. V., et al. Transplantation of purified iPSC-derived cardiomyocytes in myocardial infarction. PLOS ONE. 12, 0173222 (2017).
- Zhang, M., et al. Cardiomyocyte Grafting for Cardiac Repair: Graft Cell Death and Anti-Death Strategies. Journal of Molecular and Cellular Cardiology. 33 (5), 907-921 (2001).
- Bressan, M., Liu, G., Mikawa, T. Early mesodermal cues assign avian cardiac pacemaker fate potential in a tertiary heart field. Science. 340 (6133), 744-748 (2013).
- Bressan, M., et al. Reciprocal myocardial-endocardial interactions pattern the delay in atrioventricular junction conduction. Development. 141 (21), 4149-4157 (2014).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados