Method Article
在自抗性混合奇美体模型中, 光激活询问个体自反应萌发中心
摘要
该方案描述了混合小鼠骨髓嵌合体与自发自身免疫性萌发中心的生成, 其中自反应淋巴细胞携带光可活性的绿色荧光蛋白 (PA-GFP) 记者。这提供了将细胞在组织中的位置与下游分子和功能分析联系起来的能力。
摘要
自身免疫性疾病是一个沉重的健康负担。有关自身免疫性疾病的发展和进展的基本问题仍未得到解答。我们对潜在疾病机制和细胞动力学的理解的一个要求是细胞亚群的微观定位与下游分子或功能分析的精确耦合;一个传统上难以实现的目标。稳定的光活性生物荧光体的发展及其与记者菌株的整合, 最近使小鼠模型中的细胞亚群具有精确的显微解剖标记和跟踪。在这里, 我们描述了分析单个萌发中心自活淋巴细胞的能力如何有助于提供新的见解自体免疫, 使用结合一个新的嵌合模型的自体免疫与一个光电记者作为一个例子.我们演示了一个程序, 以产生混合嵌合体与自发自反应萌发中心居住的淋巴细胞携带光可活性绿色荧光蛋白记者。采用体内标记策略, 单次萌发中心可以通过双光子显微镜观察到其淋巴组织及其细胞成分光活化的解释。然后, 可以对单个萌发中心的光活化淋巴细胞进行分析或分类, 将其作为单个细胞或散装流, 并可能进行额外的下游分子和功能分析。这种方法可以直接应用于在自身免疫领域提供新的见解, 但产生骨髓嵌合体的程序和光激活程序还可能在传染病的研究中得到广泛的应用。肿瘤转移。
引言
在过去几十年中, 自身免疫性疾病的发病率迅速上升, 特别是在西方社会。如今, 自身免疫性疾病在西方世界最常见的发病和死亡原因中名列第三.有关自身免疫性疾病的发展和进展的基本问题仍未得到解答。我们对潜在疾病机制和细胞动力学的理解的一个要求是细胞亚群的微观定位与下游分子或功能分析的精确耦合。在过去的十年里, 一些稳定的光可转换、光可激活或光可操作的生物荧光体的发展及其与记者菌株的整合, 使细胞能够精确地进行显微解剖标记和跟踪在小鼠模型的子集。
Kaede 是一种源自石珊瑚的可转换光荧光蛋白, 在暴露于紫罗兰色或紫外光2时, 会经历从绿色荧光到红色荧光的不可逆的光转换。最初用于跟踪单个细胞在发展中的单细胞的动态行为,在发展的大脑切片 3, 生成一个 kaede 敲门砖鼠标随后允许监测细胞在体内的运动, 该系统被应用于分析免疫细胞迁移到淋巴结4。这一方法后来得到了第二代记者的完善。一位类似的记者是 Dendra6, 它最近被用来追踪体内的淋巴结转移 7.
开发的第一种光可激活蛋白是一种绿色荧光蛋白 (GFP), 其设计具有单点突变 (T203H), 导致波长区域的吸收率非常低, 从450纳米到 550nm 8不等。在紫罗兰色光激活后, 这种可激活的绿色荧光蛋白 (PA-GFP) 将其吸收最大值从 ~ 400 纳米切换到 ~ 500 纳米, 在与 488 nm 的波长激发时, 产生大约100倍的强度增加。所有造血细胞表达 PA-GFP 的转基因小鼠的产生, 首次允许深入分析了在解剖定义的萌发中心9的光区和暗区中 B 细胞的选择.
虽然光激活是一种从非荧光状态到荧光状态的不可逆转换, 而光转换是从一个波长到另一个波长的单向转换, 但光可调谐蛋白能够在这两种情况之间穿梭.后一种能力最近被用来设计蛋白质活性的光学控制11。
利用 PA-GFP 记者, 我们最近在一个新的自发性 lupu 样自身免疫12模型中表征了单个萌发中心的 B 细胞凋亡.该模型是基于混合嵌合体与1份骨髓窝藏自反应 b 细胞受体敲与特异性的核糖核酸蛋白复合物 (564igi13,14) 结合2个部分骨髓从任何所需的供。在重建后大约 6周, 在脾脏和皮肤淋巴结中出现自发自反应萌发中心的稳态条件。值得注意的是, 萌发中心 B 细胞群几乎完全是 (~ 95%)由来自非564igi 隔间的细胞组成, 这些野生类型的 B 细胞已成为自反应细胞。因此, 该模型允许使用各种转基因、敲除和记者来分析自反应性萌发中心 B 细胞的 "即插即用" 方法。在这里, 我们描述了产生混合嵌合体与自发自反应萌发中心居住的淋巴细胞携带 PA-GFP 记者的过程。使用体内标记策略, 单个萌发中心可以可视化的解释淋巴组织和他们的细胞成分光激活使用双光子显微镜。随后, 单萌发中心的光活化淋巴细胞可以通过流式细胞仪进行分析, 也可以通过荧光细胞活化细胞分选 (流式细胞仪) 进行分类, 并进行额外的下游分子和功能分析。分析单个萌发中心自反应淋巴细胞的能力可以直接应用于在自身免疫领域提供新的见解, 但所描述的技术和方法还可以在研究中找到相关的应用。传染病和肿瘤转移。
研究方案
所有动物用途都符合欧洲共同体的准则, 并得到丹麦动物研究监察局的批准 (2017-15-0201-001348)。
1. 一般的老鼠饲养和缓冲器和工具的制备
- 在特定的无病原体 (SPF) 条件下, 对老鼠线进行定期监测, 并按照标准指南进行健康状况监测。
- 可选: 验证由于不受监测的不定部感染, 在天真的小鼠中没有自发的萌发中心。这可以通过免疫荧光显微镜 (胚细胞中心结构的存在) 或流式细胞仪 (萌发中心 b 细胞的频率) 来完成, 如前面所述的12。
注: 可以使用女性或男性。一般来说, 它是理想的性匹配捐献者和接受者, 因为性别的不匹配理论上可以导致对男性 y 抗原的同种活动由女性收货者/捐献者15。 - 使用 CD45.1 收件人 (B6。SJL-PTPRCa pocc b/boyj), 年龄在6-10 左右。使用 564Igi (B6。Cg-ghtm1(Igh564)TikIgktm1(Igk564)Tik/j) 和 Pa-gfp (B6.Cg-Tg(UBC-PA-GFP)1Mnz/J) 捐献者, 年龄在6-12。
- 消毒手术工具 (直精细剪刀和 Dumont 钳 #5 和 #7), 通过高压灭菌他们根据常规灭菌指南。
- 制备500毫升骨髓 (BM) 缓冲液, 其中含有磷酸盐缓冲盐水 (PBS)、2% 的胎儿牛血清 (FBS)、1 mM 乙二胺-四乙酸 (EDTA), ph 值7.4。要制备 BM 缓冲液, 请添加10毫升的热失活 (在56°c 的水浴中1小时以灭活补体) FBS 和 4400 mM EDTA 溶液的 1.25 mL (调整为 ph 7.4) 至500毫升的 PBS、pH 7.4, 并混合良好。使用0.2μm 滤瓶过滤缓冲液。
- 用试剂级水稀释10倍库存的1毫升至总体积10毫升, 制备10毫升红细胞 (RBC) 裂解缓冲液 (155 Mm Nh4 cl, 12 mM nahco3, 0.1 mm edta)。用 5 mM EDTA, ph 7.4, 准备50毫升的 PBS。
2. 骨髓混合嵌合体的建立
- 接受者的辐射 (第0天)
- 将 CD45.1 骨髓接受者放置在适当的辐照容器中, 并在伽玛辐射器中照射 1, 100 拉。
注: 可使用替代辐照源。无论来源如何, 剂量/时间都必须优化, 以产生最大的清髓性效果, 同时最大限度地减少对动物的附带组织损伤。 - 放置在抗生素水上 (1 毫克磺胺嗪和0.2 毫克三甲吡啶饮用水)。
- 将 CD45.1 骨髓接受者放置在适当的辐照容器中, 并在伽玛辐射器中照射 1, 100 拉。
- 骨骼的提取 (第1天)
- 通过4% 异氟醚在空气中的连续流动, 对564Igi 骨髓供体进行麻醉, 并通过宫颈脱位对其进行安乐死。用乙醇喷洒捐献者, 并将其放置在流动罩中的无菌手术垫上。继续使用无菌缓冲液和设备来维护无菌条件。
- 要提取股骨和胫骨, 首先在脚踝周围做一个切口, 并使用直的精细剪刀向上延伸到臀部。使用重型钳子或拇指和食指, 将皮肤向上和从腿向身体拉去。同样, 把皮肤拉下来和脚部。
- 通过抓住臀部的腿和用力拉脚, 弹出膝盖和脚踝关节。继续打破踝关节, 并将脚向身体, 同时抓住胫骨, 从而剥离胫骨的肌腱和肌肉。
- 打破膝关节, 释放胫骨, 并同样拉这对身体, 同时坚持股骨, 从而剥离肌腱和肌肉的股骨。在髋关节上做一个切口, 并切断肌腱, 然后将股骨从髋关节插槽中拉出。重复2.2.2 步骤–对侧2.2.4。
- 用粗纸巾擦拭骨头, 仔细清洁骨骼, 以去除所有剩余的肌肉和结缔组织。然后用冰凉的 BM 缓冲液冲洗它们, 最后用一对 Dumont #7 钳子将它们转移到冰上新鲜的冷 BM 缓冲液中。对 PA-GFP 捐助者重复步骤2.2。
注: 单个供体的骨髓细胞数量因性别和年龄而异。根据所需的骨髓比率和数量以及所需的受者数量, 对捐献者的数量进行缩放。如果捐献者很少, 前肢可以包括在骨髓提取。这通常会产生从后肢获得的额外的1.5 至一半的细胞。通常情况下, 每个捐献者可在5000万细胞之间恢复5000万细胞, 具体取决于年龄、性别、背景以及是否只包括后肢或后肢和前肢。
- 骨髓细胞提取
- 在冰凉的 BM 缓冲液中冲洗, 准备砂浆。排出漂洗缓冲液, 并使用带有10毫升血清学移液器的电动移液器控制器, 添加10毫升新鲜的冰凉 BM 缓冲器。
- 用一对 Dumont #7 钳子将骨头从564Igi 捐献者转移到砂浆中, 用子压碎和磨碎骨头以释放骨髓。用10毫升血清学移液器将骨髓提取物吸吸, 并将其通过70μm 的细胞过滤器进入冰上的50毫升管中。
- 在砂浆中添加另外10毫升的新鲜冰凉 BM 缓冲液, 并重复, 以确保细胞完全恢复。用纸巾从砂浆中取出骨材料, 适当丢弃, 用70% 乙醇仔细冲洗砂浆, 然后用 BM 缓冲液冲洗砂浆。对 PA-GFP 骨髓供体组重复步骤2.3。
- 骨髓细胞计数
- 使用微移液器, 将含有40μl 红细胞裂解缓冲液的液滴放在一块塑料石蜡膜上。将564Igi 骨髓管反转几次, 并使用微型移液器取出10Μl 的 aliquot。将其与40μl 的红细胞裂解缓冲液滴混合。
- 随后加入50Μl 的 Trypan 蓝色 (0.4% 在水溶液中) 的下降。立即将产生的混合物装入伯克蒂尔克血细胞仪, 并在显微镜下计数。使用10倍的总稀释系数计算每个 mL 的细胞数。确认足够的细胞活力 & gt;90%。对 PA-GFP 骨髓供体组重复步骤2.4。
- 准备暂停捐献者
- 根据第2.4 步获得的数量和所需的受者人数, 计算两个供体群体中每个供体骨髓的数量, 并将其混合在供体混合管中。
注: 例如, 对于建立一组1:2 混合 564Igi:PA-gfp 烟囱与 6个 CD45.1 收件人: 每个接收者总共需要 20 x 106个供体细胞, 1个部分564igi 和2个部分 PA-GFP。因此, 这需要 6 x 半 x 20 x10 6 = 40 x 10 6 564igi供体细胞和 6 x 2/x20 x 10 6 = 80 x 10 6 pa-gfp 供体细胞. - 将适当数量的 PA-GFP 和564lgi 供体骨髓混合在一个50毫升的锥形管中。用摆动的桶式转子在 200 x g和4°C 下离心骨髓混合物10分钟。
- 在每毫升密度为 1 x 10 8个细胞的情况下, 对上清液进行分解, 并在冰冷的 bm 缓冲液中重新悬浮细胞。在冰上转移到预冷 1.5 mL 微离心管。
- 根据第2.4 步获得的数量和所需的受者人数, 计算两个供体群体中每个供体骨髓的数量, 并将其混合在供体混合管中。
- 用供体骨髓重组骨髓受者
- 在空气中连续流动4% 异氟烷的诱导下, 接受者进行麻醉, 维护率为3.75。通过不使用脚趾夹紧反射来验证足够的麻醉平面。
- 小心地轻触含有骨髓混合物的试管, 以确保骨髓细胞充分重新悬浮, 然后在0.3 毫升, 30 规格的胰岛素注射器中吸入200Μl 的骨髓混合物 (~ 20 x10 6细胞)。
- 将受者放在其一侧, 轻轻拉伸眼睛上方和下方的皮肤, 稍微 "弹出眼睛", 然后以大约30°的角度将注射器的尖端轻轻插入眼窝的前面, 注意避开眼睛和周围的组织。当针头被感觉触摸眼窝下划线的骨头时, 稍微收回 (~ 0.5 毫米), 用稳定的压力慢慢注射供体骨髓。
注: 注射时不应出血, 无液体泄漏, 眼睛也不会轻微鼓胀。 - 用利比特糖抗生素水将鼠标送回笼子, 并验证手术后立即恢复。对每个收件人重复步骤2.6。
注: 尾静脉注射可以用来代替类似的结果, 但在我们手中, 它的速度要慢得多, 这可能是一个问题, 当与大量的接受者合作。应避免直接在小直径床上用品上回收麻醉动物, 因为这会带来吸入和窒息的风险
- 去除抗生素水 (第14天)
- 从笼子里取出抗生素水, 用新鲜的普通饮用水代替。
3. 检查成功的重组并核实适当程度的嵌合体 (第6周)
-
烟囱后眼眶出血及对照
- 根据受者的耳标编号, 通过标记 1.5 mL 微型离心管, 并添加含有 5 mM EDTA 的 50ΜL PBS, 准备采血管。
注: 包括对 PA-GFP、CD45.1 和 CD45.2 以及 9D11 (特定类型) 的适当控制。这可以通过包括 1个 PA-GFP + 鼠标、1个 CD45.1 鼠标、1个 B6 鼠标和 1 564Igi 鼠标来实现。 - 麻醉小鼠, 并验证足够的麻醉平面作为步骤2.6.1。将嵌合体放在它的一侧, 轻轻伸展眼睛上方和下方的皮肤, 稍微 "弹出眼睛"。
- 轻轻地将一个 bopet 包裹的肝化毛细管 (60μl 内量) 大约以40°的角度插入眼窝的前部, 注意避免损坏眼睛和周围组织。轻轻旋转管, 直到它开始充满血液。
- 允许血液通过毛细管作用被动地充满管, 直到几乎完全满, 然后收回管并将其放入相应的预标记收集管, 同时立即放松眼睛周围的抓地力, 让眼睛安顿好, 回到原处。出血应立即停止。
- 确保毛细管已倒入收集管, 并将其丢弃在锐器容器中。关闭管并反转三次, 以确保与 pbsedta 完全混合。
- 将鼠标返回到保持架, 并验证从过程中立即恢复。对每个实验鼠标和相应的控件重复步骤3.1。
注: 使用下颌静脉穿刺时要小心, 因为这种方法可能会对辐照受者造成更大的风险, 然后再进行完全重组。此外, 根据我们的经验, 我们发现, 收集的血液量和因过度出血而损失的血液量变化较大。这两个考虑因素都很重要, 因为骨髓嵌合体在重建阶段是敏感的, 在新骨髓被完全嫁接和造血恢复正常水平之前。
- 根据受者的耳标编号, 通过标记 1.5 mL 微型离心管, 并添加含有 5 mM EDTA 的 50ΜL PBS, 准备采血管。
-
外周血单个核细胞 (PBMC) 纯化
- 血液采集完成后, 以低速 (lt;200 x 克) 短暂离心管, 收集管内底部稀释的稳定血液。
- 用淋巴细胞分离培养基填充10毫升注射器, 并加入 18 G 针。将针头插入第一管底部, 并在血液样本中加入1毫升淋巴细胞分离介质。小心地取出针头, 用纸巾擦拭, 以防止下一个样品交叉污染。
- 在 800 x 克的室温下, 在一个秋千桶离心机中, 在所有样品中进行25分钟的离心, 刹车设置为低。
- 准备一套相应标记的 1.5 mL 微离心管, 每个管含有1毫升的冰凉 BM 缓冲液。
- 离心后, 对于每个样品, 进入上 (等离子体) 层与200Μl 微移液器和吸气的单核细胞 (MNC) 层正上方的接口。将细胞转移到含有1毫升 Bm 缓冲液的相应标记管。合上盖子, 倒置混合。丢弃含血淋巴细胞分离中的导管。
- 继续通过所有样品, 然后离心在 200 x g 5分钟, 4°c 在一个摆动的桶转子。吸吸和丢弃上清液, 并在200μl 的冰凉 BM 缓冲液中重新悬浮颗粒。样品现在已经准备好进行抗体染色和流式细胞仪分析。
-
用于流式细胞仪评估的染色
注: 建议的面板: CD45.1-FITC, B220-Percp5.5, 9D11-a568, CD45.2-APC。在太平洋橙色 (或等效) 通道中检测到非激活的 PA-GFP。由于淋巴细胞分离去除了死亡细胞, 因此不需要使用活度染料。- 使用微移液器, 在96孔板中添加100Μl 的细胞悬浮液, 每个井的嵌合体和对照样品。
- 对于3个非 Pa-gfp 控制样品, 将每个样品剩余的 100μl (总计 300Μl) 集中起来。加入50μl 的这种材料, 用于无染色控制和单染色控制井。对于 PA-GFP 单染色控制, 另外还可添加50Μl 的未染色 PA-GFP 样品。
- 在每口井中, 加入100μl 的缓冲液 (未染色)、单片抗体 (单染色补偿控制, PA-GFP 补偿控制除外) 或抗体混合 (样品)。在冰上孵化20分钟。
- 在4°c 下以 200 x g 离心5分钟。将缓冲区翻转出。在每口井中加入200Μl 的 BM 缓冲液, 再进行离心机清洗。在200μl 的 BM 缓冲液中, 将缓冲液弹出来, 并在每口井中重新悬浮细胞。这些样品现在已经准备好在流式细胞仪上进行分析 (图 1)。
注: 从6周开始, 可在任何时间点分析嵌合体中的萌发中心响应。
4. 在体内标记边缘区/囊下窦, 以帮助识别单个萌发中心
注: 目前的协议被证明为足部淋巴结 (腹股沟淋巴结) 和静脉注射 (即脾脏), 但可以根据目标部位变化。
-
双侧脚垫注射治疗下肢淋巴结贴标
- 2.6.1 的步调一致地对老鼠进行麻醉。
- 在 1.5 mL 微离心管中, 在18μl 的 pbs 中稀释 pe-l 标记大鼠 CD169 抗体, pH 7.4。将两滴10Μl 的混合物放在一块塑料石蜡膜上。用0.3 毫升的胰岛素注射器和30规格的针头对每个液滴进行吸气。
- 在脚垫 (在脚垫中央部以5-10°角与针头进入, 从脚趾开始的近端进入, 并将针头大约向脚后跟插入一半) 或 hock (用针头进入 5-10°角刚好在脚后跟上方, 沿跟腱轴线向膝盖方向插入约一半的长度)。把老鼠送回笼子里, 等大约 15分钟, 然后继续执行第5步。
-
静脉注射治疗脾脏贴药
- 2.6.1 的点对老鼠进行麻醉。
- 在 1.5 mL 微离心管中, 在90μl 的 pbs 中稀释 PE-TAT 标记大鼠抗小鼠 CD169 抗体10μl。用0.3 毫升胰岛素注射器吸入混合物。
- 按照步骤2.6 进行反轨道注射。把老鼠送回笼子里, 等大约 15分钟, 然后继续执行第5步。
注: 作为异氟醚的替代品, 可使用注射麻醉剂, 如凯塔明-西拉嗪混合物;但是, 这通常会导致恢复时间变慢。由于淋巴引流通常受到骨骼肌运动的影响, 预计这将导致缓慢的引流时间。
5. 切除脾脏和淋巴结, 准备光激活
-
准备双面成像和光激活室
- 从20毫升注射器中取出柱塞, 然后用真空润滑脂将真空润滑脂管的喷嘴插入其中, 将柱塞回载。然后从5毫升注射器中取出柱塞, 然后使用20毫升注射器使用真空润滑脂对其进行回装。
- 使用加载的5毫升注射器的真空润滑脂, 通过在平面上放置方形盖板, 并使用真空润滑脂 (从边缘约1-2 毫米) 沿着盖板的边缘进行跟踪, 来准备成像和光激活室。
注: 请注意避免真空润滑脂污染任何和所有表面, 随后接触到显微镜镜头, 因为在浸入水中乳化的真空润滑脂的微滴可能会污染镜头。 - 用冷 BM 缓冲液填充盖滑移真空润滑脂室, 放在冷平面上。
-
收集淋巴结和脾脏
- 对体内标记的嵌合体小鼠进行安乐死标记, 并按每步2.2.1 进行分析。用70% 的乙醇把尸体喷下来。
- 要进入下肢淋巴结, 使用直的精细剪刀在膝盖坑下面的皮肤上做一个切口, 并沿腿筋线向上延伸, 直到髋关节。使用 Dumont #5 或 #7 钳子, 将皮肤的每个暴露的皮瓣向外拉, 以暴露腹股沟窝中的组织 (图 2a)。
- 使用一对 Dumont #5 钳, 小心地进入下肢窝只是内侧到下肢静脉, 并解剖开放脂肪, 通过插入和打开和关闭钳子沿腿部轴线, 以暴露潜在的下肢淋巴结。
- 用拇指和食指将股四头肌从前侧捏到膝盖, 将淋巴结从窝里弹出 (图 2b)。用钳子从下面取下淋巴结, 将其从周围组织中分离出来 (图 2c), 然后将其放置在步骤5.1 中准备的真空润滑脂室中。
- 重复5.2.2 步骤–对侧5.2.4。如果需要, 可以在单个房间内安装多个淋巴结。
- 最后关闭室, 将第二个盖板放在真空润滑脂边缘的顶部, 轻轻按下, 注意挤出所有气泡。
注: 某些缓冲器也可能被推出, 但真空润滑脂应形成紧密密封, 防止液体泄漏 (图 2d)。淋巴结现在处于双面成像室。 - 要进入脾脏, 使用一对直的细剪刀, 通过小鼠左侧的腹壁, 近端的前内侧线, 就在胸腔下方, 并将其延伸到身体周围的后腋窝线。脾脏的尖端应该是可见的 (图 3 a)。
- 用一双 Dumont #7 钳子拔掉脾脏, 并将下面的粘连剪断以释放。使用对直的精细剪刀切割 ~ 2 毫米厚, 横截面, 切片。
- 将切片放入步骤5.1 中准备的真空润滑脂室。如果需要, 可以在一个房间内安装多个脾脏片。
- 最后关闭室, 将第二个盖板放在真空润滑脂边缘的顶部, 轻轻按下, 注意挤出所有气泡。除成像和照片激活期间外, 始终将所有成像室放在冰上。
注: 某些缓冲器也可能被挤出, 但真空润滑脂应形成紧密密封, 防止液体泄漏。脾脏片现在在一个双面成像室 (图 3b)。
6. 光激活
-
确定单一的萌发中心
注: 此协议描述的脾脏, 但完全类似的淋巴结。- 将成像室放置在显微镜舞台上。使用 3.5 mL 塑料转移移液器, 在上盖板上放置一滴蒸馏水, 并将目标降低到接触点。使用透射光聚焦在组织的顶部。
- 切换到暗模式和双光子激发, 并将激光调整到 940 nm。
注: 使用适当的滤波器组, 此波长允许在与主要容器和结构元素相关的含有胶原蛋白的结构中激发和检测第二次谐波的产生, 以及在步骤4.2 中注入的 CD169-PE,确定边缘区域。然而, 940 纳米的激发并不光激活 PA-GFP。 - 在组织表面附近本地化单个白髓区域 (受 CD169-PE 染色的限制), 并通过与中央动脉相关的第二次谐波生成来识别动脉周围的淋巴鞘 (PALM, T 细胞区)。在 PALM 和边缘区域之间的区域中, 寻找高度自体荧光、活化的光体巨噬细胞 (所有通道中的强自体荧光信号、带有暗液泡的类似斑点的外观) (图 4 a)。
注: 如有必要, 由于组织的不良方向, 可翻转成像室, 并可从另一个方向进行成像。 - 根据6.1.3 步骤中确定的特征, 绘制一个感兴趣的区域, 确定一个单一的萌发中心区域。设置约100-150μm 深度的 z 堆栈, 从组织表面开始, 并使用约3μm 的步长。
- 切换到 830 nm 激发波长。关闭或调暗所有通道, 以防止光污染探测器 (因为激光功率和输出荧光通常要高得多, 在这个波长), 然后 "图像" 堆栈。
注: 特定设置, 如激光功率和像素停留时间, 取决于组织的深度、使用的特定组织和成像系统。每个应用程序都必须针对所使用的特定成像系统进行优化。虽然在整个堆栈中获得有效的光激活是必不可少的, 但应该注意不要对细胞进行光适应。 - 切换回 940 nm 激发波长并重新打开通道。通过堆栈扫描以确认整个过程中的有效光激活 (图 4b) 和光采样的缺失 (漫反射、无细胞界的 pa-gfp 信号、暗斑或光激活区域的高度自荧光)。
- 继续拍摄成像室中的所有相关组织, 然后及时将其返回冰层, 直至进一步处理。继续对额外的成像室进行光激活。
注: 组织引导、安装, 尤其是光激活是耗时的过程, 但总周转时间应限制在 4-6, 以防止细胞活力大幅下降。
7. 光活化细胞的回收和分析
-
从淋巴结和脾脏中提取淋巴细胞
- 对于每个光活化样品, 准备一个相应标记的 1.5 mL 微离心管, 其中含有500μl 的 BM 冰上缓冲液。包括来自非 Pa-gfp 控件和非激活的 PA-GFP 鼠标的样本。这可以通过包括一个 B6 控件和一个 PA-GFP 控制鼠标来实现。
- 小心地从成像室取出上盖滑块, 注意保持样品的位置 (如果单个样品存在于一个样品中), 并将每个样品放入各自的样品管中。
- 使用牙分质器, 挤压组织和扭曲在管内的牙舌释放淋巴细胞。使用微移液器, 吸气液, 并通过70μm 的电池过滤器过滤成一个新鲜的, 预冷 1.5 mL 微离心管。对于淋巴结样本, 请跳到步骤7.1.5。
- 对于脾脏样品, 在摇摆不定的桶转子中, 在 200 x g 下离心 5分钟, 在4°c 下。丢弃上清液, 在200μl 的红细胞裂解缓冲液中重新悬浮颗粒。在室温下培养 5分钟, 然后加入800Μl 的冷 BM 缓冲液, 然后继续7.1.5。
- 在摇摆不定的桶式转子中, 以 200 x g 离心, 在4°c 下进行5分钟的离心。丢弃上清液, 在200μl 的冰凉 BM 缓冲液中重新悬浮。如果需要, 样品现在可以染色, 以便进行流式细胞仪评估和分类。
-
用于流式细胞仪评估的染色
注: 建议的面板: CD169-PE, B220-Percp5.5, 9D11-a647, CD38-PE-CY7, 可固定活力染料 e氟-780, GL7-太平洋蓝。在太平洋橙色 (或等效) 通道中检测到非激活的 PA-GFP。在 GFP 通道中检测到光激活的 PA-GFP。任何共同纯化的巨噬细胞 (可能在体内也可能没有用 CD169-PE 标记) 可以通过用 CD169-PE 染色并将其用作转储门来排除。- 使用微移液器, 在96孔板中为每个孔和对照样品添加100Μl 的细胞悬浮液。
- 对于 B6 控制样品, 添加50Μl 的这种材料, 用于未染色控制和单染色控制井。对于未激活的 PA-GFP 单染色控制, 另外添加50Μl 的未染色无源 PA-GFP 样品。对于激活的 PA-GFP 单染色控制, 将所有光激活样品的剩余材料集中起来。
- 在每口井中, 添加100Μl 的缓冲液 (未染色和 PA-GFP 补偿控制)、单抗体 (单染色补偿控制) 或抗体混合 (光激活样品)。在冰上孵化20分钟。
- 在4°C 下以 200 x g 5分钟离心。将缓冲区翻转出。在每口井中加入200Μl 的 BM 缓冲液, 再进行离心机清洗。在200μl 的 BM 缓冲液中, 将缓冲液弹出来, 并在每口井中重新悬浮细胞。这些样品现在已经可以在流式细胞仪或分选仪上进行分析 (图 5中具有代表性的结果)。
结果
混合骨髓嵌合体的产生
如图 1所示的代表性结果所示 (统计意义见 12), 本协议有力地实现了 b 细胞隔间中几乎完全嵌合的混合骨髓嵌合体. 血清分型显示在重建后6周的 B 细胞数 (图 1B), 低频 9D11 (独特型) 阳性循环 b 细胞来自564Igi 隔间 (图 1b)。在总淋巴细胞门内, 残留的沉淀细胞频率较低, 约 6% CD45.1 (Q1), 表明总的嵌合化程度约为 94% (图 1C)。在供体隔间 (CD45.1-、Q4+Q3) 中, 564Igi (第4季度) 与 PA-GFP (第三季度) 的比率约为23% 至77%。这略低于输入33% 至66% 的比率的原因是大量的负选择 b 细胞来自 564Igi隔间12。如图1D 所示, b 细胞隔间 (99.9% CD45.1-) 几乎完全嵌合, PA-GFP 骨髓源 b 细胞 (q3) 占主导地位, 这是564igi 衍生 b 细胞大量负离子选择的结果。
组织的收获、加工和流式细胞仪评估
图 2和图 3演示了解释新鲜隔离的淋巴结和脾脏切片的过程和结果。图 4显示了在一个被解释的脾脏切片中单个萌发中心区域的体内标记和光激活的代表性结果。可以看出 (图 4a), cd169-pe 的体内标记已将边缘区域标记为牢固的标记 (红色, 由 "mz" 表示)。第二谐波信号在含胶原蛋白的结构元素和主要血管 (蓝色) 中表现得很明显, 包括动脉周围淋巴鞘 (PALM) 的中央动脉。高度自体荧光, 活化的肉身巨噬细胞与萌发中心活性 (箭头) 有关。综合来看, 识别边缘区、PAL 和肉身巨噬细胞, 可以识别一个感兴趣的区域, 而该区域可能包含一个单一的萌发中心。感兴趣的区域是光激活的, 如图4B 所示。正如所证明的, 光活化是微观上精确的9, 产生一个明确的激活区域。所介绍的结果还可作为重组嵌合体中高密度 PA-GFP + 淋巴细胞和存在的自发性萌发中心的确认。下游流式细胞仪评估进一步证实了归一化的 B 细胞室数 (图 5D), 一个自发的萌发中心群 (图 5D), 以及已经被光激活 (图 5f)。
因此, 本协议提出了一种具有自发自反应萌发中心的骨髓嵌合体的可靠方法, 该中心主要由携带可拍照记者的野生型 b 细胞组成。这反过来又允许对各个萌发中心进行下游分析 (图 6中的图形概述)。
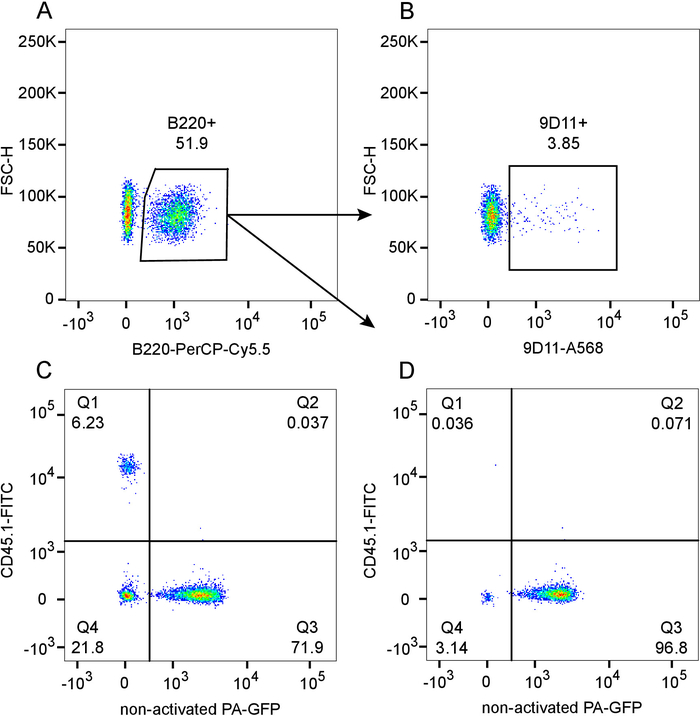
图 1:564igi 血液中嵌合化程度的流式细胞仪评价 (CD45.1-, pa-gfp-):P A-GFP (CD45.1-, PA-GFP +) 混合嵌合体在致命辐射的 CD45.1 收件人 (CD45.1 +, PA-GFP-), 6周后重组后.A) 显示 B220 + b 细胞门控的剧情, 预先门控在单血淋巴细胞上。B) 从图 a 中分孔, 显示 b 细胞群中 9d11+ (独特型) 频率。C) PA-GFP 与 CD45.1 的点击, 预先设定为单倍淋巴细胞。D) 在图 A 的 b 单元子门中绘制 PA-GFP 与 CD45.1. 请点击这里查看这个数字的更大版本.
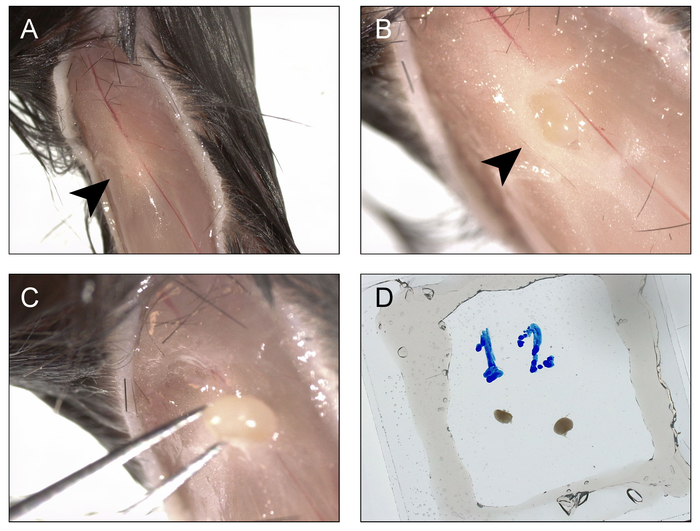
图 2:收集和安装下颌淋巴结的程序, 用于成像和光激活.A) 切口在膝盖以下, 并延伸到髋关节, 边缘被收回到两侧, 以暴露腹股沟窝 (箭头)。B) 上覆的脂肪垫被打开, 并暴露了下肢淋巴结 (箭头)。C) 从窝中取出下肢淋巴结。D) 对侧重复该过程, 两个节点都安装在充满 bm 缓冲液的双面双层真空润滑脂室中。请点击这里查看此图的较大版本.
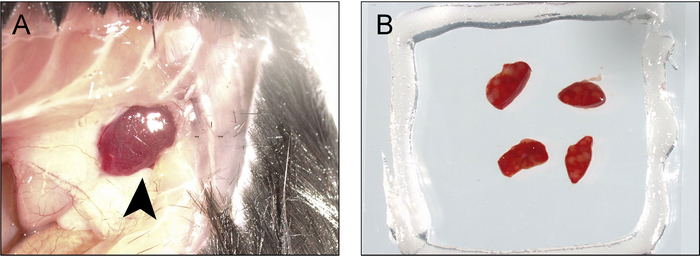
图 3: 用于成像和光激活的脾脏采集和安装过程。A) 在胸腔下面的前内侧线上进行切口, 并将身体周围延伸到后腋窝线, 边缘被缩回以暴露脾脏的尖端 (箭头)。B) 脾脏被收回和切除, 切割成薄片 (1-2 毫米), 这些薄片安装在充满 bm 缓冲液的双面覆盖式/真空润滑脂室中。请点击这里查看此图的较大版本.
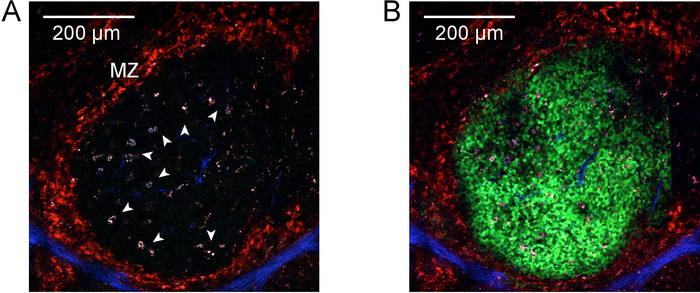
图 4:光激活。A) 光激活前脾脏萌发中心的双光子显微图像。在脾脏收获前, 用抗 CD169-pe 进行体内标记, 以标记边缘区域 (红色, 由 "MZ" 表示)。在与结肠和主要容器 (蓝色) 相关的含胶原蛋白结构中, 第二个谐波信号是显而易见的。箭头识别高度自荧光, 激活的肉身巨噬细胞与萌发中心的活性。成像是在940纳米激发下进行的。左上角的刻度条表示200微米. b) 至于 A , 但在830纳米的光激活后。光活化细胞现在在边缘区域所包围的特定利益区域是可见的 (绿色), 包括先前确定的光体巨噬细胞。请点击这里查看此图的较大版本.
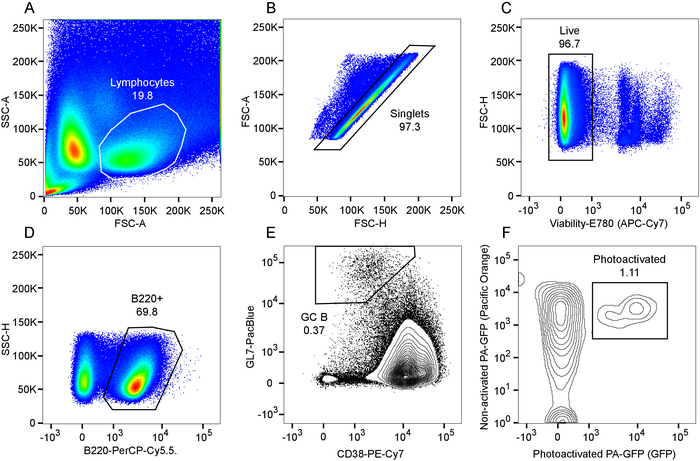
图 5:光活化萌发中心 b 细胞的流式细胞仪分析.A) 向前向向散射和淋巴细胞门的绘制。B) 在淋巴细胞门内绘制向前散射区域作为向前散射高度的函数, 并产生单点门。C) 可活性染料排除情节内的单门门, 并产生活细胞门。D) B220 + b 细胞的分型。E) 萌发中心 b 细胞的门, 在 B220 + 门内被确定为 CD38lo gl7hi 细胞。F) gc b 细胞群中光激活细胞的门化, 被确定为共同表达非活化和光激活 PA-GFP 的细胞子集。请点击这里查看此图的较大版本.
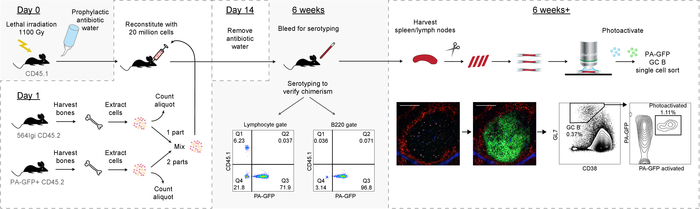
图 6: 协议的图形概述.请点击这里查看此图的较大版本.
讨论
大量的小鼠自身免疫模型是可用的, 其中许多存在于自发萌发中心 16.然而, 许多可用的模型在淋巴细胞增殖或激活的中央调节机构中具有复杂的遗传背景或突变, 因此它们不适合与记者线交叉和正常淋巴细胞行为的研究在自身免疫性, 分别。相反, 目前的模型允许一种 "即插即用" 的方法, 利用任何所需的转基因组合、敲除和记者, 深入分析自反应性野生类型萌发中心 b 细胞, 在本例中, 这种组合所代表的是可拍摄 GFP。使用体内标记策略, 单个萌发中心可以可视化的解释淋巴组织和他们的细胞成分光激活使用双光子显微镜。然后, 可以对单个萌发中心的光活化淋巴细胞进行分析或对流液进行细胞化分类, 作为单个细胞或散装。这些细胞随后可能会接受额外的下游分子和功能分析, 以便在自身免疫领域提供新的见解。
成功执行此过程有一些关键步骤。正如代表性结果所表明的那样, 照射 (1, 100 Rad) 和供体骨髓重建成功地取代了受赠方骨髓隔间, 在 B 细胞隔间产生了近乎完全的嵌合。这是一个重要的问题, 因为残留的沉淀源 b 细胞会使萌发中心种群的一个子集 "变暗"。无论用于辐照的来源是什么, 都必须优化照射的剂量/时间, 以产生最大的清髓性效果, 最大限度地减少对动物的附带组织损伤。为了重建, 发现了拥有 2, 000万个供体细胞的骨挤压协议和重组, 能产生强劲的高重组度。为骨髓提取而在冰上无菌和冰凉的工作可确保供体骨髓的高生存能力。为了达到所需的供体骨髓比率, 在计算细胞的等价物时, 无论是对计数本身的, 还是在取出骨髓的亚样本进行计数时, 都必须非常小心。混合和联合造粒供体骨髓, 而不是单独离心和重新悬浮, 然后混合, 有助于防止细胞计数后供体比例出现任何偏差。
该协议的混合骨髓嵌合体生成可以独立存在, 它使嵌合体的生成具有自反应的萌发中心与任何所需的记者, 转基因或敲除。然而, 对此的一个限制是需要使用与组织兼容的捐献者。564Igi 菌株是在 C57Bl/6J 的同源背景上, 因此, 另一个捐献者和受赠者应该有 H-2b 同源背景 (或者, 564Igi 菌株应与所需的菌株和自身免疫表型回交所。在新的背景下验证)。辐照过程倾向于耐受性环境17, 并且在一些次要的组织相容性抗原的不匹配可能被容忍。然而, 应彻底考虑这一方面, 特别是如果将男性和女性捐献者和/或接受者混合在一起, 因为女性有可能与男性限制的 y 抗原发生反应。
同样, 协议的光激活方面可以是独立的, 并且可以在许多不同的上下文中使用。然而, PA-GFP 记者目前只在 UBC 启动子中可用, 该促进剂在所有造血系细胞中都很活跃, 但在间质细胞中并不活跃。如导言所述, 其他可拍摄、可光可或光可转换的记者菌株可用, 并可替代 PA-GFP, 并适当调整实验条件。
重要的是要避免意外的光激活不良区域, 通过保持激光远远超过900纳米时成像, 因为这个波长不会光激活 PA-GFP。对于光激活本身, 特定的设置, 如激光功率和像素停留时间, 将取决于组织的深度、使用的特定组织和成像系统, 每个应用程序都必须针对所使用的特定成像系统进行优化。注意不要对细胞进行光化, 但同时必须在整个堆栈中获得有效的光激活, 以便获得足够的活化细胞的表示形式, 从而进行下游分析。萌发中心 B 细胞一般占脾脏或皮肤淋巴结 b 细胞的0.5% 至 ~ 2%, 从有代表性的结果 (图 5) 中可以看出, 光活化单个萌发中心 b 细胞可能占总数的1% 左右存在于单个脾脏切片中的种群。因此, 要成功地分析或排序大量的单元格, 就需要处理大量的事件。
披露声明
作者没有什么可透露的。
致谢
SE Degn 是 Lundbeckfonden 研究员和嘉士伯基金会杰出研究员。这项工作在一定程度上得到了 NNF 生物医学赠款 (SE Degn) 的额外支持。
材料
| Name | Company | Catalog Number | Comments |
| Antibody, 9D11-A568 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Biotium 92255 | |
| Antibody, 9D11-A647 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Nordic Biosite ABD-1031 | |
| Antibody, FITC anti-mouse CD45.1 | Biolegend | 110705 | |
| Antibody, Pacific Blue anti-mouse/human GL7 Antigen (T and B cell Activation Marker) | Biolegend | 144613 | |
| Antibody, PE anti-mouse CD169 (Siglec-1) | Biolegend | 142403 | |
| Antibody, PE/Cy7 anti-mouse CD38 | Biolegend | 102717 | |
| Antibody, PerCP/Cy5.5 anti-mouse/human CD45R/B220 | Biolegend | 103235 | |
| Capillary tube, Mylar-wrapped, heparinized | Fisher Scientific | 211766 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Conical tubes, 50 mL | Falcon | 352235 | |
| Cover slip, square, 22x22 mm, 0.13-0.17 mm | Thermo Fisher Scientific | 22X22-1 | |
| EDTA | Merck | 1,084,180,250 | |
| Ethanol, 70% | VWR | 8301.360 | |
| Fetal bovine serum | Life Technologies | 10270106 | |
| Flow cytometer, FACS Canto II | BD Biosciences | 338962 | |
| Flow cytometer, LSRFortessa SORP | BD Biosciences | - | Special order product with 4 lasers (405 nm, 488 nm, 561 nm and 640 nm) |
| Grease, high vacuum, Dow Corning | VWR | DOWC1597418 | |
| Hemocytometer, Burker-Türk | VWR | 630-1544 | |
| Isoflurane, IsoFlo vet. | Orion Pharma | 9658 | |
| Lymphocyte separation medium (Lympholyte-M Cell Separation Media) | Cedarlane | CL5035 | |
| Microcentrifuge tube, 1.5 mL (Eppendorf) | Sarstedt | 72.690.550 | |
| Microscope, Two-photon | Prairie Technologies (now Bruker) | - | Special order Ultima In Vivo Two Photon Microscope |
| Mortar w. lip, unglazed, 75 ml | VWR | 410-0110 | |
| NaHCO3 | Merck | 1063290500 | |
| Needle, 18 gauge | BD Medical | 304622 | |
| NH4Cl | VWR | 87,769,290 | |
| PBS | Sigma | d8537 | |
| Pestle homogenizer | VWR | 47747-358 | |
| Pestle, unglazed, 175 mm | VWR | 410-0122 | |
| Pipette, Serological, 10 ml | VWR | 612-3700 | |
| Pipette, transfer, plastic | Sarstedt | 861,172,001 | |
| Plastic paraffin film (Parafilm M) | Bemis | PM996 | |
| Plate, 96-well | Falcon | 353910 | |
| Surgical forceps, Student Dumont #5 Forceps | FST - Fine Science Tools | 91150-20 | |
| Surgical forceps, Student Dumont #7 Forceps | FST - Fine Science Tools | 91197-00 | |
| Surgical scissors, Student Fine Scissors, Straight | FST - Fine Science Tools | 91460-11 | |
| Syringe, 10 mL | Terumo | SS-10ES1 | |
| Syringe, 20 mL | Terumo | SS-20ES1 | |
| Syringe, 5 mL | Terumo | SS-05S1 | |
| Syringe, Insulin, 0.3 cc | BD Medical | 324827 | |
| Tribrissen vet. 24% inj., containing 200 mg sulfadiazin and 40 mg trimethoprim/ml | MSD Animal health | 431577 | |
| Trypan blue solution, 0.4% | VWR | K940-100ML | |
| Viability dye, eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific | 65-0865-14 |
参考文献
- Lerner, A., Jeremias, P., Matthias, T. The World Incidence and Prevalence of Autoimmune Diseases is Increasing. International Journal of Celiac Disease. 3 (4), 151-155 (2015).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Mutoh, T., Miyata, T., Kashiwagi, S., Miyawaki, A., Ogawa, M. Dynamic behavior of individual cells in developing organotypic brain slices revealed by the photoconvertable protein Kaede. Experimental neurology. 200 (2), 430-437 (2006).
- Tomura, M., et al. Monitoring cellular movement in vivo with photoconvertible fluorescence protein “Kaede” transgenic mice. Proceedings of the National Academy of Sciences. 105 (31), 10871-10876 (2008).
- Tomura, M., et al. Tracking and quantification of dendritic cell migration and antigen trafficking between the skin and lymph nodes. Scientific Reports. 4, 6030 (2014).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature biotechnology. 24 (4), 461-465 (2006).
- Pereira, E. R., et al. Lymph node metastases can invade local blood vessels, exit the node, and colonize distant organs in mice. Science (New York, NY). 359 (6382), 1403-1407 (2018).
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science (New York, NY). 297 (5588), 1873-1877 (2002).
- Victora, G. D., et al. Germinal center dynamics revealed by multiphoton microscopy with a photoactivatable fluorescent reporter. Cell. 143 (4), 592-605 (2010).
- Habuchi, S., et al. Reversible single-molecule photoswitching in the GFP-like fluorescent protein Dronpa. Proceedings of the National Academy of Sciences of the United States of America. 102 (27), 9511-9516 (2005).
- Zhou, X. X., Chung, H. K., Lam, A. J., Lin, M. Z. Optical control of protein activity by fluorescent protein domains. Science (New York, NY). 338 (6108), 810-814 (2012).
- Degn, S. E., et al. Clonal Evolution of Autoreactive Germinal Centers. Cell. 170 (5), 913-926 (2017).
- Berland, R., et al. Toll-like receptor 7-dependent loss of B cell tolerance in pathogenic autoantibody knockin mice. Immunity. 25 (3), 429-440 (2006).
- Chatterjee, P., et al. Complement C4 maintains peripheral B-cell tolerance in a myeloid cell dependent manner. European journal of immunology. 43 (9), 2441-2450 (2013).
- Toubai, T., et al. Induction of acute GVHD by sex-mismatched H-Y antigens in the absence of functional radiosensitive host hematopoietic-derived antigen-presenting cells. Blood. 119 (16), 3844-3853 (2012).
- Luzina, I. G., et al. Spontaneous formation of germinal centers in autoimmune mice. Journal of leukocyte biology. 70 (4), 578-584 (2001).
- Sachs, D. H., Kawai, T., Sykes, M. Induction of tolerance through mixed chimerism. Cold Spring Harbor perspectives in medicine. 4 (1), a015529 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。