Method Article
二次细菌性肺炎的鼠种模型的精确病原体输送与恢复系统
摘要
在这里,我们提出的方法,以改善继发性细菌性肺炎研究,通过提供非侵入性途径注入下呼吸道,然后病原体恢复和抄本分析。这些程序是可重复的,无需专用设备(如导管、导丝或光纤电缆)即可执行。
摘要
流感感染后的继发性细菌性肺炎一直名列美国十大死亡原因之一。迄今为止,合并感染的鼠群模型一直是探索原发和继发性感染病理学的主要工具。尽管这一模式普遍存在,但在研究中,在灌输程序、剂量量和有效性方面存在相当大的差异。此外,这些努力在解决病原体如何直接影响感染后的疾病进展方面基本上尚未完成。在此,我们提供一种精确的病原体输送、恢复和分析方法,用于继发性细菌性肺炎的鼠模型。我们证明,内气管内灌输能够有效和准确地将受控体积直接均匀地输送到下呼吸道。肺可以切除,以恢复和量化病原体的负担。在切除受感染的肺部后,我们描述了一种提取高质量病原体RNA的方法,以便进行转录分析。这个程序受益于非手术的分娩方法,不使用专门的实验室设备,并提供一个可重复的策略,以调查病原体对继发性细菌性肺炎的贡献。
引言
流感感染后继发性细菌性肺炎是美国的主要死因,也是研究1、2的活跃领域。尽管许多研究使用继发性细菌性肺炎的鼠模型,关于病原体灌输和审讯的不一致仍然是3,4,5。此外,虽然以前的许多工作都集中在流感的免疫调节作用,导致易感性地对继发性细菌感染增加,但最近的数据表明,细菌病原体的毒性调节是相等的为疾病建立6、7、8、9的贡献。这些新数据需要一种更精确的方法来探索合并感染的鼠群模型中的继发性细菌性肺炎,从而有助于对病原体反应的调查。
独特的流感合并感染模型,宿主生物是故意免疫功能由原发性流感感染之前,给下继发细菌剂。为了最好地复制在人类宿主身上观察到的疾病发病机制,必须控制初级和次级病原体的病原体负荷,以便观察每种传染剂的个体和组合效应。最常见的是,小鼠的呼吸道感染是通过鼻内分管3、4、5、6、10的。由于此途径在技术上是简单的,并且在某些单剂感染应用中可能适用,因此不适合合并感染模型,因为灌输程序、剂量量和有效性在已发表的文献3,4,5,6。
为了更全面地了解继发性细菌性肺炎发病机制,必须考虑宿主和病原体的贡献。为此,我们开发了一种简单易用的方法,用于从受感染的肺部回收活细菌和病原体RNA。该方法使用简化的非侵入性内切内灌输程序,随后分离细菌RNA。本文所述的内气管灌输程序与前面描述的方法类似,并不限于病原体的传递11、12、13。使用这种特殊程序的好处是成本低,不需要使用专用设备,如管电,导线,或光纤电缆;此外,由于这个程序是非侵入性的,它保证对鼠细胞受试者的最小压力,尽量减少接种机制的炎症反应,并为多受试者的感染提供有效的分娩途径。简单地说,离洛拉麻醉小鼠被悬浮在切口。钳子用于轻轻抓住舌头,然后插入预装的弯曲、钝尖、21 量表的针头进入气管,然后运送病原体负载。通过目视确认均匀分布到肺腔中的染料和恢复细菌负荷,可以证明对此过程的验证。然后,我们演示如何从受感染的肺部恢复可行的金黄色葡萄球菌(S.金黄色葡萄球菌),并描述一种可重复的方法来分离高质量的病原体 RNA。
研究方案
所有方法均符合国家卫生研究院的准则,并经蒙大拿州立大学动物护理和使用委员会 (IACUC) 批准。
1. 内切内灌输
- 准备一个包含以下用品的工作空间:插管平台、无菌 1 mL 注射器、无菌钝尖钳、无菌 21 度钝尖针和两个圆锥管来存放注射器和钳子。
注:插管平台可以商业购买或内部建造。此处使用的插管平台使用 0.25 英寸有机玻璃构建。简单地说,加热施加到有机玻璃上,电路板弯曲到大约65°内部角度。在插管平台的外侧,两个机器螺钉被播种3英寸,两个螺钉之间悬挂了一个橡皮筋。 - 通过连续稀释样品来制备病原体接种,以便获得所需的最终浓度,总体积为50μL。
- 戴上无菌手套,将 21 G 钝尖针弯曲至约 35°。
注:每只鼠标都需要单独的针头。 - 将弯曲的 21 G 钝尖针头固定在 1 mL 注射器上。将100μL气垫放入注射器中,然后加入50μL的传染性剂。将装载的针头和注射器放在一个便于主手接近的位置。
- 使用4%异苯可勒/氧混合物或类似的IACUC批准的麻醉方法对小鼠进行深度麻醉。当呼吸速度减慢到大约每 5–8 s 1 次吸入时,通常会获得适当的麻醉深度,并且可以通过捏住附物和观察小鼠没有反应来确认。
注:这种麻醉方法提供了大约1.5分钟的麻醉时间。这足以让我们实验室的成员学习并执行此灌输过程;然而,其他机构批准的麻醉方法可以采用11,12,13。 - 从麻醉室中取出麻醉小鼠,并将鼠标从上颌切口器上悬挂在插管平台上。
- 要打开进入气管的清晰通道,请使用钝尖钳轻轻抓住并伸出嘴外的舌头。将舌头从钳子转移到非主导手的拇指和食指。
- 保持舌头在非主导手,拿起预装注射器。将针的弯曲端指向远离身体的地方,然后将针头插入口腔到舌头底部。
- 用针头放在舌头底部,轻轻将手腕角度,使针头稍微推离身体。此步骤确保针头将插入气管,而不是食道。
- 慢慢地将针头引导到气管中;当针穿过声带时,通常会有轻微的滴答声。通过气管的针头,直到针遇到卡林纳时感觉到轻微的阻力。
- 稍微抬起近端方向的针,将针头悬挂在卡林纳上方。这使得交付到两个主支气管。完全按下注射器的柱塞,以提供传染性负载。向上抬起并丢弃,将针头从气管中取出。
- 通过按下橡皮筋将鼠标从插管平台中取出,但保持将鼠标保持直立姿势。将手指直接放在鼻腔上,从而阻塞鼻腔。保持此位置约 1 分钟或直到观察到几次深呼吸。
注:最后一步确保总接种量传递到下呼吸道。 - 将鼠标返回到笼子,观察麻醉后完全恢复。
2. 感染肺的切除
- 在层压流罩内工作以保持无菌性,准备一个包含以下物品的工作空间:秤和无菌称重船、解剖平台、包含剪刀和钳子的解剖套件、无菌 RNA 无 RNAE PBS 和无菌纱布。
- 使用CO2或类似的IACUC批准的安乐死方法对受感染的小鼠实施安乐死。
- 将受感染的鼠标放在解剖平台上,并使用每个附属项末端的针脚固定鼠标。用乙醇喷洒鼠标,以帮助保持工作表面的不无菌性。
- 从脐带开始,用一对钳子抬起皮肤,切开气管底部。抓住初始切口两侧的皮肤,将皮肤从身体中拉出,并穿过组织连接。
注:在皮肤上进行几次横向切割,以揭示更多的胸腔区域,会很有帮助。 - 从西佛化过程的基础开始,做一个小切口,意图刺穿膜片。这导致胸腔压力增加,导致肺部缩回。随着肺缩回继续切口,以释放隔膜。
- 沿着肋笼的两侧切开肋骨。这将完全暴露胸腔和肺部。
- 要切除肺部,用钳子抓住心脏底部,向上抬起。将剪刀放在肺后面,开始通过组织连接进行小切口,同时继续向上抬起心脏。
- 一旦肺部被切除,将它们放在无菌纱布上,并取出心脏。心脏可以通过用钳子将其从肺部提起并切断剩余的组织连接来轻松去除。
- 将肺转移到预量称重船并记录重量。
- 在肺被称重后,将它们转移到无菌磷酸盐缓冲盐水(PBS)中,并暂时将它们储存在冰上,直到进入病原体的恢复和分析步骤。
3. 病原体恢复与分析
- 继续在层流罩内工作,准备一个工作空间,提供以下耗材:组织研磨机、无菌RNA无氧PBS、缓冲液RLT辅以β-甲苯乙醇(1:100)和1.5 mL RNAE无微离心管。
注意:在皮肤接触、摄入、眼睛接触或吸入的情况下,β-甲壳乙醇可能很危险。在烟气罩中应将β-甲酮乙醇稀释到缓冲液RLT中。 - 首先,在组织研磨机中加入1 mL无菌RNA无核酶PBS。填充后,将组织研磨机存放在冰上。
- 准备一系列无菌RNA酶无连续稀释管,用于量化从受感染肺部恢复的细菌负荷。这是最容易实现的,将900μL的无菌水分到每个微离心管中,然后连续稀释病原体接种。
注:准确病原体枚举所需的稀释管数量在初始病原体输入和感染持续时间上会有所不同。这必须经过经验确定。 - 使用无菌钳子,将肺转移到准备好的组织研磨机中,并在旋转时按下底座,使组织完全均匀化。
- 将组织研磨机和等质样品的等分 100 μL 开到制备的串行稀释管中。通过电镀到营养琼脂上,连续稀释样品并枚举CCF。CCF 可记录为 CCF/mL 或 CCF/mL/mg 肺组织。
注:在此步骤中,可去除另外200 μL的均质样品,用于纯化病毒RNA(参见材料表),或储存在-80°C下,以供将来分析。 - 在去除等分物以进行CFU测定和/或病毒RNA分离后,在4°C下以4,000rpm(3724 x g)离心10分钟,将研磨底座和颗粒均匀化组织进行颗粒。
- 使用移液器,从颗粒样品中取出上清液,放入 1.5 mL 微离心管中。
注:上清液不含细菌,可储存在-80°C,用于分析可溶性宿主和分泌病原体因素。 - 通过在700 μL缓冲液RLT-α-mercaptoethanol中移液或涡流重新悬浮均质组织颗粒,并将样品转移到无菌无RNA酶的1.5 mL微离心管中。
注:此时样品可在-80°C下储存数月。 - 纯RNA,对制造商的纯化试剂盒协议稍作修改(见材料表);见沃伊奇等人2008年14。
- 将均质肺浆液转移到含有 0.1 mm 硅珠的 2 mL 微离心管中,并在 6 m/s 下通过珠搅拌器处理 20 s。
- 在 1,500 rpm 转速下将样品离心 3 分钟。离心后,将上液液液液液放入新的1.5 mL微离心管中。
- 将 350 μL 的 96%-100% 乙醇加入样品中,并通过移液或倒置彻底混合。
- 将700 μL样品转移到放置在2 mL收集管中的纯化柱中。将样品在 ±8,000 x g下离心 15 s,并丢弃流过。通过上述列运行任何多余的样本。
- 用700 μL缓冲RW1和离心样品以±8,000 x g清洗柱15s。丢弃流过,将硅膜柱转移到新的2 mL收集管中。
- 将 500 μL 的缓冲 RPE 应用于列。以 ± 8,000 x g的离心清洗柱 15 s。丢弃流过。
- 在 8,000 x g下将额外的 500 μL 缓冲 RPE 施加到 RNeasy 柱和离心机 2 分钟。 丢弃流通,并在 ±10,000 x g下离心 1 分钟。
- 要洗脱纯化的RNA,首先将柱转移到新的1.5 mL无RNA酶微离心管。将50μL无RNase水直接输送到柱的硅胶膜上,以±8000 x g离心1分钟。
注:洗脱的RNA可以再次运行在同一列上,以增加RNA的产量。 - 向纯化RNA中加入50μL无RN酶水,使总体积达到100μL。
- 将样品涂在收集管中的净化柱上,以±8000 x g的离心放置15s。丢弃流过,更换收集管。
- 通过添加 350 μL 的缓冲 RW1,然后以 ±8000 x g离心 15 s 来洗涤柱。
- 通过将 10 μL 的 DNase 库存 (750 Kunitz 单位/mL) 添加到 70 μL 的缓冲 RDD 中,制备包含约 27 个 Kunitz 单位的 DNase 溶液。将80μL的DNase溶液直接加入硅胶膜,并在室温下孵育样品15分钟。
- 用350 μL缓冲RW1清洗柱子,用±8000 x g清洗离心机15s,然后丢弃流过。
- 重复步骤 3.9.6~3.9.8 来纯化RNA。
注: 建议按照步骤 3.9.9*3.9.10 和 3.9.6*3.9.8(跳过 DNase 步骤 3.9.11–3.9.13)重复 RNA 清理程序。这种额外的清理结果产生非常高质量的RNA。
- RNA产量可以使用分光光度计进行量化,其读数为260 nM,纯度为260:280 nM。获得RNA产量后,将每个RNA样品的浓度标准化为50纳克/μL。
注:建议在浓度为50纳克/μL时制造多个等分,以避免导致RNA降解的冻结/解冻循环。 - 将纯化RNA储存在-80°C或立即用于抄本分析。
注:在以前的出版物中,3-5只小鼠的RNA被汇集到进行抄本分析。通过优化上述技术,从1只小鼠的RNA被经验确定足以进行转录分析(80×120纳克/μL)。
结果
图1利用0.1%重量/体积的Coomassie亮蓝色溶液来证明,内气管内灌输直接均匀地在下呼吸道内提供接种。图2显示细菌(金黄色)CCFUs直接从均质肺组织中恢复.图3演示了该系统的使用,通过绘制单个小鼠的输入和恢复CCF,精确交付和恢复下呼吸道的接种。图4显示了细菌内务管理基因陀螺杆菌的qRT-PCR扩增曲线,证明细菌RNA可以直接从受感染的肺组织中提取,而DNA污染最小。图5显示了使用qRT-PCR扩增的甲型流感病毒M段的标准曲线结构,以证明病毒RNA可以直接从受感染的肺组织中提取。
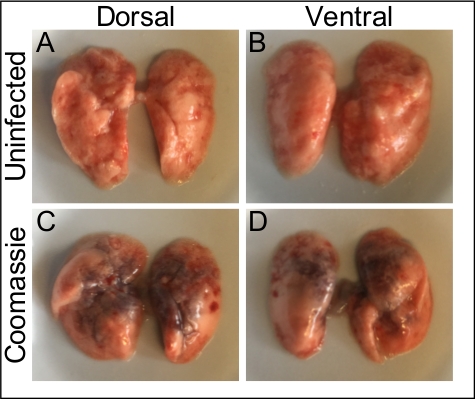
图1:内气管灌输使均匀分布到下呼吸道。(A, B)未受感染的肺在无菌PBS的腔内内注射后从健康小鼠中切除,并从 (A) 背和 (B) 腹腔角度拍摄.(C, D) 50 μL 0.1% 库马西亮蓝色溶液通过内切内施用给麻醉小鼠.(C) 多尔萨尔.(D) 文通.请点击此处查看此图的较大版本。
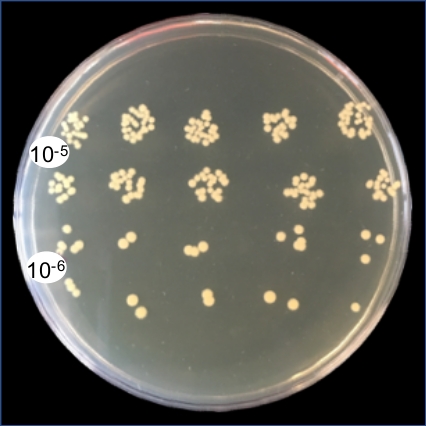
图2:从受感染的肺同质物中代表性地恢复细菌CCF。肺被切除一天后,挑战与S.金黄色。均质化后,100 μL的肺浆被连续稀释到10-6。为了列举回收的CCF,从10-5和10-6稀释液中镀出10μL滴到试胶大豆琼脂(TSA)上,并在37°C下孵育,5%C02过夜。请点击此处查看此图的较大版本。
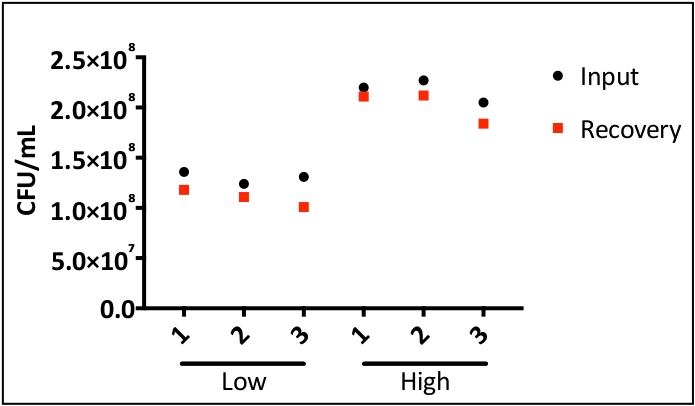
图3:在内切内治疗后,病原体接种的精确传递和恢复。老鼠被分成两组,每组包含三只老鼠。小鼠在1 x 108(低)和2 x 108(高)CFU/mL处接受S.aureus的宫内受精。感染后一小时,小鼠被安乐死,肺部被切除,以证明灌输和恢复的精度。从肺同质物中恢复的细菌接种和细菌在TSA(试量大豆琼脂)上被镀。细菌输入和恢复之间没有显著差异。请点击此处查看此图的较大版本。
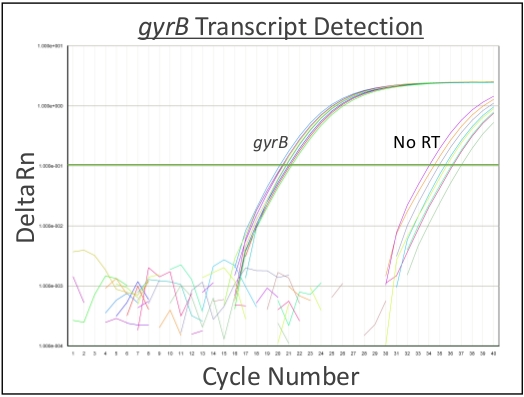
图4:代表性细菌RNA恢复和纯度。在1 x 108 CFU/50 μL的S.aureus内气管内灌输后6小时,小鼠被安乐死。肺被切除和同质化,然后重新悬浮在缓冲液RLT-β-梅尔卡托托乙醇的肺浆。RNA被纯化,如步骤3.914所述。qRT-PCR用于检测细菌内务管理基因陀螺杆菌的转录本。包含不含逆转录酶(nRT)的对照组,以证明已恢复的RNA的纯度。在阈值为 0.1 时,在平均周期 21.1、20.3 和 20.5 时检测到陀螺仪转录本。直到周期平均值 35.9、35.5 和 35.0 之前,未检测到 nRT 控件。n = 3个生物复制,包含3个技术复制/生物复制。请点击此处查看此图的较大版本。
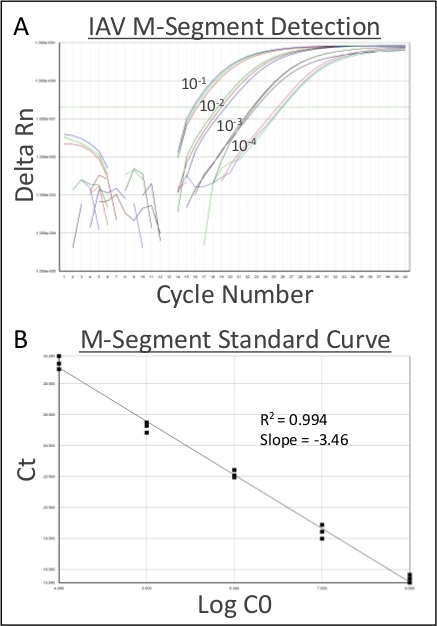
图5:代表性病毒RNA恢复。在用100 PFU/50 μL甲型流感(H1N1)进行内切内注射后六天,小鼠被安乐死。肺被切除和均质化,在病毒RNA纯化之前,收集200μL的同质浆,并通过70μm细胞过滤器。纯化RNA被连续稀释(10-1-10-4),随后扩增甲型M-段。(A) 甲型流感的扩增图,从受感染的肺中恢复并稀释10-1+10-4。(B) 甲型H1N1流感标准曲线。阈值 = 0.2,R2 = 0.994,斜率 = -3.46。请点击此处查看此图的较大版本。
讨论
使用该模型提供了一种高效和可重复的方法来研究继发性细菌感染。严格控制病原体接种的传递的能力能够更精确地观察每种病原体的个体和组合效应。更常见的内向灌输途径效率低下,可能是导致文献中剂量量和浓度的差异。研究继发性细菌性肺炎的精确鼠系统推迟了确定细菌特定反应的发现,从而导致肺共感染的严重程度,这是合理的。开发一个可重复的模型来研究继发性细菌感染期间的毒性表达,这可能导致确定疫苗或药物靶点,以减轻这些感染。
内风管灌输步骤对于成功建立下呼吸道感染和病原体的任何下游分析至关重要。学习这种技术时,在施用传染性材料之前练习使用染料(如方法中所述)可能会有所帮助。使用染料可以直接可视化呼吸道的接种。可能发生的一个常见错误是将钝针插入食道,而不是气管。这将导致将接种液输送到胃部,而不是肺部。为了纠正这个错误,将针头离身体更远的角度,然后将其向下传递到气管中。一旦掌握了,这个程序是非常有效的,可用于进行实验与大量的小鼠。分批对小鼠进行麻醉,每只小鼠大约30秒即可完成内切内灌输。此外,每只小鼠的肺切除可以在2至3分钟内完成。
从受感染的组织中恢复可行和纯细菌RNA对转录分析至关重要。RNases无处不在,可以迅速破坏实验15。一些方法包括使用RNase抑制剂;然而,我们发现,在-80°C冷冻在RLT-β-美尔卡托托乙醇样品或立即使用所有无RNase管和试剂处理样品进行RNA分离,可以有效减少RNase污染。此外,我们建议一次最多纯化六个样品。包括超过6个样本可能导致协议步骤之间的长时间延迟,最终导致RNA降解。一旦纯化,还应注意避免任何不必要的冻融周期。因此,如果对一个样品进行多重分析,建议在-80°C下进行等分纯化RNA的储存。
除了本文审查的技术,这种方法可以通过在肺16的切除和均质之前进行支气管肺泡洗漱补充。这可以通过整个下呼吸道的洗漱或使用缝合线来限制支气管树的一个分支臂,然后通过剩余的分支进行洗漱。通常,这导致病原体负荷的恢复减少,但提供了一个样本,其中一些信息,如乳酸脱氢酶活性,细胞群身份,和细胞因子配置文件可以获得16。这些数据可以共同形成对继发性细菌性肺炎期间发生宿主-病原体相互作用的更全面理解。
虽然所讨论的方法是在继发性细菌性肺炎的背景下,但它们适用于下呼吸道感染的任何鼠模型;具体来说,那些将受益于严格控制的交付和恢复安装的接种。此外,与许多其他感染途径一样,内气管灌输可用于非传染性应用,例如治疗药物和环境化合物12的管理。
披露声明
作者没有什么可透露的。
致谢
作者要感谢蒙大拿州立大学博士/博士妮可·梅斯纳帮助建立了内切内灌输方法。这项工作得到了美国国家卫生研究院(Grants NIH-1R56AI135039-01A1、GM110732、R21AI128295、U54GM115371)以及蒙大拿州大学系统研究计划(51040-MUSRI2015-03)和蒙大拿州立大学的资助。农业试验站。
材料
| Name | Company | Catalog Number | Comments |
| Lysing Matrix B | MP Biomedicals | 6911100 | Referred to in text as "0.1 mm silica beads" |
| 21-gauge blunt needle | SAI | B21-150 | 1.5" is recommended. |
| RNase-Free DNase Set | Qiagen | 79254 | DNase used in the accompanying text. |
| FastPrep-24 Classic Instrument | MP Biomedicals | 116004500 | FastPrep FP120 is no longer available. Referred to in text as "Bead Beater" |
| TaqMan AIV-Matrix Reagents | Applied Biosystems | 4405543 | Influenza A M-segment qRT-PCR kit. |
| Intubation Stand | Kent Scientific | ETI-MES-01 | Referred to in text as "intubation platform." Intubation platform used in the accompanying video was made in house. |
| RNeasy Mini Kit | Qiagen | 74106 | RNA purification kit; contains RNeasy columns, Buffer RLT, Buffer RW1, and Buffer RPE |
| QIAamp Viral RNA Mini Kit | Qiagen | 52904 | Viral RNA purification kit. |
| Tissue Grinders | Thermo Fisher Scientific | 02-542-08 | |
| 2-Mercaptoethanol (β-Mercaptoethanol) | Calbiochem | UN2966 |
参考文献
- Xu, J., Murphy, S. L., Kochanek, K. D., Bastian, B. A. National Vital Statistics Reports Deaths: Final Data for 2013. National Center for Health Statistics. 64 (2), 1 (2013).
- Morris, D. E., Cleary, D. W., Clarke, S. C. Secondary Bacterial Infections Associated with Influenza Pandemics. Frontiers in Microbiology. 8, 1041 (2017).
- Lee, M., Arrecubieta, C., Martin, F. J., Prince, A., Borczuk, A. C., Lowy, F. D. A Postinfluenza Model of Staphylococcus aureus Pneumonia. The Journal of Infectious Diseases. 201 (4), 508-515 (2010).
- Shepardson, K. M., et al. Differential Type I Interferon Signaling Is a Master Regulator of Susceptibility to Postinfluenza Bacterial Superinfection. mBio. , (2016).
- Miller, M. A., et al. Visualization of Murine Intranasal Dosing Efficiency Using Luminescent Francisella tularensis: Effect of Instillation Volume and Form of Anesthesia. PLOS ONE. 7 (2), 31359 (2012).
- Robinson, K. M., et al. Influenza a virus exacerbates staphylococcus aureus pneumonia in mice by attenuating antimicrobial peptide production. Journal of Infectious Diseases. 209 (6), 865-875 (2014).
- Reddinger, R. M., Luke-Marshall, N. R., Hakansson, A. P., Campagnari, A. A. Host physiologic changes induced by influenza a virus lead to Staphylococcus aureus biofilm dispersion and transition from asymptomatic colonization to invasive disease. mBio. 7 (4), (2016).
- Borgogna, T. R., et al. Secondary Bacterial Pneumonia by Staphylococcus aureus Following Influenza A Infection Is SaeR/S Dependent. The Journal of Infectious Diseases. 218 (5), 809-813 (2018).
- Shahangian, A., et al. Type I IFNs mediate development of postinfluenza bacterial pneumonia in mice. Journal of Clinical Investigation. 119 (7), 1910-1920 (2009).
- McAuley, J. L., et al. Expression of the 1918 Influenza A Virus PB1-F2 Enhances the Pathogenesis of Viral and Secondary Bacterial Pneumonia. Cell Host and Microbe. 2 (4), 240-249 (2007).
- Hamacher, J., et al. Microscopic wire guide-based orotracheal mouse intubation: Description, evaluation and comparison with transillumination. Laboratory Animals. 42 (2), 222-230 (2008).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated Intratracheal (IMIT) Instillation: A Noninvasive, Lung-specific Delivery System. Journal of Visualized Experiments. (93), e52261 (2014).
- Cai, Y., Kimura, S. Noninvasive Intratracheal Intubation to Study the Pathology and Physiology of Mouse Lung. Journal of Visualized Experiments. (81), e50601 (2013).
- Voyich, J. M., Sturdevant, D. E., DeLeo, F. R. Analysis of Staphylococcus aureus gene expression during PMN phagocytosis. Methods in molecular biology. 431, 109-122 (2008).
- Dyer, K., Rosenberg, H. The RNase a superfamily: Generation of diversity and innate host defense. Molecular Diversity. 10 (4), 585-597 (2006).
- Van Hoecke, L., Job, E. R., Saelens, X., Roose, K. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。