Method Article
Sekonder Bakteriyel Pnömoni Murine Modelleri için Hassas Patojen Dağıtım ve Kurtarma Sistemi
Bu Makalede
Özet
Burada, alt solunum yollarında non-invaziv aşılama yolu sağlayarak ikincil bakteriyel pnömoni çalışmalarını iyileştirmek için yöntemler sunmakta ve ardından patojen kurtarma ve transkript analizini sayılmaktadır. Bu işlemler tekrarlanabilir ve kanüller, kılavuz teller veya fiber optik kablolar gibi özel ekipmanlar olmadan gerçekleştirilebilir.
Özet
Grip enfeksiyonları sonrasında ikincil bakteriyel pnömoniler sürekli olarak Amerika Birleşik Devletleri'nde ölüm ilk on arasında yer alıyor. Bugüne kadar, ko-enfeksiyon murine modelleri hem primer hem de sekonder enfeksiyonların patolojilerini araştırmak için geliştirilen birincil araç olmuştur. Bu modelin yaygınlığına rağmen, instillasyon prosedürleri, doz hacimleri ve verimlilikleri ile ilgili önemli tutarsızlıklar çalışmalar arasında yaygındır. Ayrıca, bu çabalar patojenin enfeksiyon sonrası hastalığın ilerlemesini doğrudan nasıl etkilemiş olabileceğini ele almakta büyük ölçüde eksik olmuştur. Burada ikincil bakteriyel pnömoni murine modellerinde kullanılmak üzere patojen teslim, kurtarma ve analiz kesin bir yöntem sağlar. İntratrakeal aşılamanın, kontrol edilen hacimlerin doğrudan ve eşit olarak alt solunum yolu içine verimli ve doğru bir şekilde iletilmesini sağladığını gösteriyoruz. Akciğerler patojen yükünü kurtarmak ve ölçmek için eksised olabilir. Enfekte akciğerlerin eksizyonundan sonra, daha sonraki transkripsiyonel analizler için yüksek kaliteli patojen RNA ayıklamak için bir yöntem açıklıyoruz. Bu prosedür, özel laboratuvar ekipmanı kullanılmadan cerrahi olmayan bir doğum yöntemi olmanın yararları ve ikincil bakteriyel pnömoni patojen katkılarını araştırmak için tekrarlanabilir bir strateji sağlar.
Giriş
Grip enfeksiyonu sonrasında ikincil bakteriyel pnömoni Amerika Birleşik Devletleri'nde önde gelen ölüm nedeni ve araştırma aktif biralandır 1,2. Sekonder bakteriyel pnömoni murine modelleri kullanılarak yapılan çok sayıda çalışmaya rağmen, patojen indaması ve sorgulamaile ilgili tutarsızlıklar3,4,5kalır. Buna ek olarak, daha önceki birçok çaba ikincil bakteriyel enfeksiyona karşı artan bir duyarlılığa yol açan influenza immünomodülatör etkileri üzerinde duruldu iken, daha yeni veriler bakteriyel patojen virülans düzenleme eşit olduğunu göstermektedir hastalık 6 ,7,8,9kurulmasına doğru katkıda bulunmaktadır. Bu yeni veriler, patojen yanıtının araştırılmasını kolaylaştıran ortak enfeksiyon modellerinde ikincil bakteriyel pnömoniyi araştırmak için daha kesin bir yöntem gerektirmektedir.
Influenza co-enfeksiyon modellerine özgü olan konak organizmalar, ikincil bakteriyel etkenin uygulanmasından önce birincil grip enfeksiyonu tarafından kasıtlı olarak bağışıklanırlar. İnsan konaklarında gözlenen patogenezin en iyi şekilde kopyalanabilmesi için, her bir enfeksiyöz ajanın bireysel ve kombinatoryal etkilerini gözlemlemek için hem primer hem de sekonder ajanların patojen yükünün kontrol edilmesi zorunludur. En sık, farelerde solunum yolu enfeksiyonları intranazal uygulama yoluyla kurulmuştur3,4,5,6,10. Bu rota teknik olarak basit olduğu ve bazı tek ajan enfeksiyon uygulamalarında uygun olabileceği belirtilse de, aşılama prosedürleri, doz hacimleri ve etkinliği yayınlanan literatür3,4,5,6.
Sekonder bakteriyel pnömoni patogenezi hakkında daha eksiksiz bir anlayış elde etmek için hem konak hem de patojenin katkıları göz önünde bulundurulmalıdır. Bu amaçla, enfekte akciğerlerden canlı bakteri ve patojen RNA kurtarma için basit ve tekrarlanabilir bir yaklaşım geliştirdik. Bu yöntem, bakteriyel RNA'nın daha sonra izole edilmesinin ardından basitleştirilmiş, non-invaziv intratrakeal aşılama prosedürünü kullanır. Burada açıklanan intratrakeal aşılama prosedürü daha önce açıklanan yöntemlere benzer ve patojenteslimatı ilesınırlı değildir 11,12,13. Bu özel prosedürün kullanımı düşük maliyetli olmanın yararları ve kanüller, kılavuz teller veya fiber optik kablo gibi özel ekipman kullanımını gerektirmez; ayrıca, bu prosedür non-invaziv olduğu için, murine denekler üzerinde minimal stres sigortalar, aşı mekaniği bir inflamatuar yanıt en aza indirir, ve birden fazla deneklerin enfeksiyonu için etkili bir dağıtım yolu sağlar. Kısaca, isoflurane anestezili fareler kesici dişlerden uzaklaştırılır. Forceps yavaşça nefes borusuna önceden yüklenmiş bükülmüş, künt uçlu, 21-gauge iğne ve patojen yük teslim ekleme takip dil kavramak için kullanılır. Bu işlemin doğrulanması, boyanın pulmoner kompartmana eşit olarak dağıtılması ve bakteriyel yükün geri kazanımı ile görsel doğrulama ile gösterilmiştir. Daha sonra enfekte akciğerlerden canlı Staphylococcus aureus (S. aureus)kurtarmak ve yüksek kaliteli patojen RNA izole etmek için tekrarlanabilir bir yöntem tanımlamak nasıl göstermek.
Protokol
Tüm yöntemler Ulusal Sağlık Enstitüleri yönergelerine uygundur ve Montana State Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. İntratrakeal Aşılama
- Aşağıdaki malzemeleri içeren bir çalışma alanı hazırlayın: entübasyon platformu, steril 1 mL şırınga, steril künt uçlu büşnler, steril 21-gauge künt uçlu iğne, ve şırınga ve forceps saklamak için iki konik tüpler.
NOT: Entübasyon platformları ticari olarak satın alınabilir veya şirket içinde inşa edilebilir. Burada kullanılan entübasyon platformu 0.25 inç pleksiglas kullanılarak inşa edilmiştir. Kısaca, ısı pleksiglas uygulandı ve kurulu yaklaşık 65 ° iç açı bükülmüş. Entübasyon platformunun dış tarafında, iki makine vidası 3 inç arayla tohumlanmış ve iki vida arasında bir kauçuk bant askıda kalınmıştır. - İstenilen son konsantrasyonun toplam hacmi 50°L'de elde edilen numuneyi seri olarak seyrelterek patojen inokülü hazırlayın.
- Steril eldivenler giyerek, 21 G künt uçlu iğneyi yaklaşık 35°'ye bükün.
NOT: Her fare için ayrı bir iğne gereklidir. - Bükülmüş 21 G künt uçlu iğneyi 1 mL şırıngaya sabitleyin. Şırınganın içine 100 μL'lik bir hava yastığı ve ardından 50 μL'lik enfeksiyöz maddeyi çizin. Yüklü iğne ve şırıngayı baskın eltarafından kolayca erişilebilen bir yere yerleştirin.
- %4 izofluran/oksijen karışımı veya benzer IACUC onaylı anestezi yöntemi ni kullanarak fareyi derinlemesine anestezi edin. Uygun anestezi derinliği genellikle solunum oranları 5-8 s başına yaklaşık 1 teneffüs yavaş elde edilir ve bir uzantıcı pinching ve fareden hiçbir tepki gözlemleyerek teyit edilebilir.
NOT: Bu anestezi yöntemi yaklaşık 1,5 dk yeterli anestezi süresi sağlamıştır. Bu, laboratuarımızdaki üyelerin bu aşılama prosedürünü öğrenmesi ve gerçekleştirmesi için yeterliydi; ancak, diğer kurumsal onaylı anestezi yöntemleri istihdam edilebilir11,12,13. - Anestezi li fareyi anestezi odasından çıkarın ve entübasyon platformundaki fareyi maksiller kesici dişlerden uzaklaştırın.
- Nefes borusuna açık bir geçit açmak için, dili ağız dışına doğru nazikçe kavramak ve uzatmak için künt uçlu çerkeği kullanın. Dili forsepsten baskın olmayan elin başparmak ve işaret parmağına aktarın.
- Baskın olmayan elinde dil tutarak kalmak ve önceden yüklenmiş şırınga almak. İğnenin bükülmüş ucunu vücuttan uzaklaştırın ve iğneyi diltabanına oral kaviteye yerleştirin.
- Dilin tabanında iğne ile, yavaşça uzak vücuttan iğne hafif bir itme neden bilek açı. Bu adım, iğnenin yemek borusuna değil, nefes borusuna yerleştirileceğini sigortalar.
- İğneyi yavaşça nefes borusuna doğru yönlendirin; genellikle iğne ses kıvrımgeçer gibi hafif bir kene hissedilir. İğne karina ile karşılaştığında hafif bir direnç hissedene kadar iğneyi trakeadan geçirin.
- Hafifçe karina üzerinde iğne askıya almak için proksimal yönde iğne kaldırın. Bu iki ana bronş içine teslim sağlar. Enfeksiyöz yükü sağlamak için şırınganın pistonuna tamamen bastırın. İğneyi yukarı kaldırarak nefes borusundan çıkarın ve atın.
- Kauçuk bandı bastırarak fareyi entübasyon platformundan çıkarın, ancak fareyi dik konumda tutmayı koruyun. Doğrudan nares üzerine bir parmak yerleştirerek burun hava yollarını engelleyin. Yaklaşık 1 dakika veya birkaç derin nefes gözlenene kadar bu pozisyonda tutun.
NOT: Bu son adım, toplam inokül hacminin alt solunum yolu içine teslim edilmesini sağlar. - Fareyi kafesine geri getirin ve anesteziden tam bir iyileşme gözlemleyin.
2. Enfekte Akciğerlerin Eksizyonu
- Kısırlığı korumak için laminar akış başlığı içinde çalışmak, aşağıdaki öğelerle bir çalışma alanı hazırlamak: bir ölçek ve steril tartı teknesi, bir diseksiyon platformu, makas ve forceps içeren bir diseksiyon kiti, steril RNAAse-free PBS, ve steril gazlı bez.
- Enfekte olmuş bir fareyi CO2 veya benzer IACUC onaylı ötanazi yöntemiyle ötenazi.
- Enfekte olmuş bir fareyi bir diseksiyon platformuna yerleştirin ve her uzantının sonundaki pimleri kullanarak fareyi sabittutun. Çalışma yüzeylerinin sterilitesini korumaya yardımcı olmak için fareyi etanolle püskürtün.
- Göbek başlayarak, deri kaldırmak ve nefes borusu tabanına kadar bir kesi yapmak için forseps bir çift kullanın. İlk kesinin her iki tarafındaki deriyi kavrayarak, deriyi vücuttan uzaklaştırın ve doku bağlantılarını keser.
NOT: Bu torasik bölgenin daha ortaya çıkarmak için cilt genelinde çeşitli lateral kesikler yapmak yararlı olabilir. - Ksifoid işleminin tabanından başlayarak, diyafram delinme niyeti ile küçük bir kesi yapmak. Bu akciğerlerin geri çekilmesine neden olan torasik kavitede basınç artışı ile sonuçlanır. Akciğerler geri çekilirken diyaframı serbest etmek için kesi devam edin.
- Göğüs kafesinin her iki tarafı boyunca bir kesi yaparak kaburga çıkarın. Bu tamamen göğüs boşluğu ve akciğerler ortaya çıkaracaktır.
- Akciğerleri çıkarmak için, forseps ile kalbin tabanını kavramak ve yukarı kaldırın. Akciğerlerin arkasına makas yerleştirin ve yukarı kalp asansör devam ederken doku bağlantıları ile küçük kesiler yapmaya başlar.
- Akciğerler çıkarıldıktan sonra, steril gazlı bez üzerine yerleştirin ve kalp kaldırın. Kalp, forsepslerle akciğerlerden uzaklaştırılarak ve kalan doku bağlantılarını keserek kolayca çıkarılabilir.
- Akciğerleri önceden taranmış bir tartı teknesine aktarın ve ağırlığı kaydedin.
- Akciğerler tartıldıktan sonra, steril fosfat tamponlu salin (PBS) içine aktarın ve patojen kurtarma ve analiz adımları ileriye doğru hareket edene kadar geçici olarak buz üzerinde saklayın.
3. Patojen Kurtarma ve Analizi
- Laminar akış kaputu içinde çalışmaya devam ederek, aşağıdaki malzemelerle bir çalışma alanı hazırlayın: doku öğütücüsü, steril RNAse içermeyen PBS, ß-mercaptoethanol (1:100) ile desteklenen Tampon RLT ve 1,5 mL RNaAse içermeyen mikrosentrifuge tüpler.
DİkKAT: ß-mercaptoetanol cilt teması, yutma, göz teması veya teneffüs durumunda tehlikeli olabilir. Tampon RLT içine ß-mercaptoetanol seyreltilmesi bir duman başlık yapılmalıdır. - Doku öğütücüse ilk olarak 1 mL steril RNaAse içermeyen PBS ekleyerek başlayın. Doldurulduğunda, doku öğütücüsi buz üzerinde saklayın.
- Enfekte akciğerlerden elde edilen bakteri yükünü ölçmek için kullanılacak steril RNaAse içermeyen seri seyreltme tüpleri bir dizi hazırlayın. Bu en kolay her mikrosantrifüj tüp içine steril su 900 μL aliquoting ve patojen inokül seri seyreltme tarafından gerçekleştirilir.
NOT: Doğru patojen numaralandırma için gerekli seyreltme tüplerinin sayısı ilk patojen girişine ve enfeksiyon süresine göre değişir. Bu ampirik olarak belirlenmeli. - Steril forceps kullanarak, hazırlanan doku öğütücü içine akciğerleri aktarın ve iyice dönerken kaide üzerine bastırarak doku homojenize.
- Hazırlanan seri seyreltme tüplerinin ilkine homojenize numunenin doku öğütücüsünü ve aliquot 100 μL'sini açın. Seri olarak numuneleri seyreltin ve Besin agar üzerine kaplama tarafından CPU'lar sayısal. CPU'lar akciğer dokusunun CPU/mL veya CPU/mL/mg olarak kaydedilebilir.
NOT: Bu adımda, viral RNA'nın saflaştırılması için homojenize numunenin 200°L'lik ek bir kısmı çıkarılabilir (bkz. Malzeme Tablosu)veya ileride analiz için -80°C'de depolanabilir. - CFU tayini ve/veya viral RNA izolasyonu için aliquotlar çıkarıldıktan sonra, 4°C'de 10 dakika boyunca 4.000 rpm (3724 x g)santrifüj ile taşlama kaidesini ve peleti değiştirin.
- Bir pipet kullanarak, peletli numuneden süpernatantçıkarın ve 1,5 mL mikrosantrifüj tüp içine yerleştirin.
NOT: Süpernatant bakteri içermez ve çözünür konak ve salgılanan patojen faktörlerin analizi için -80 °C'de saklanabilir. - Homojenize doku peletini 700 μL tampon RLT-ß-mercaptoethanol'da pipetleme veya girdap ile yeniden askıya alın ve numuneyi steril RNaAse içermeyen 1,5 mL mikrosantrifüj tüpüne aktarın.
NOT: Bu noktada numuneler -80 °C'de birkaç ay saklanabilir. - Üreticinin arıtma kiti protokolünde hafif değişiklikler kullanarak RNA'yı arındırın (bkz. Malzeme Tablosu); Bkz. Voyich ve ark. 200814.
- Homojenize akciğer bulamacını 0,1 mm silika boncuk içeren ve 6 m/s'de 20 s/s'lik bir boncuk çırpıcı ile işlenen 2 mL mikrosantrifüj tüpe aktarın.
- 3 dakika için 1.500 rpm de örnek santrifüj. Santrifüjden sonra, pipet yeni 1.5 mL mikrosantrifüj tüp içine supernatant.
- Numuneye %96-%100 etanol 350 μL ekleyin ve pipetleme veya ters çevirme ile iyice karıştırın.
- Numunenin 700 μL'sini 2 mL'lik bir toplama tüpüne yerleştirilen bir arıtma sütununa aktarın. Numuneyi ≥ 8.000 x g'de 15 s'ye santrifüj edin ve akışı atın. Yukarıdaki açıklandığı gibi aynı sütun üzerinden herhangi bir fazla örnek çalıştırın.
- 15 s için ≥ 8.000 x g'de 700 μL tampon RW1 ve santrifüj numunesi ile kolonu yıkayın.
- Sütuna 500 μL arabellek RPE uygulayın. 15 s. Için ≥ 8.000 x g de santrifüj ile kolon yıkayın.
- RNeasy sütununa 500 μL ek tampon RPE uygulayın ve 2 dk için 8.000 x g'de santrifüj uygulayın.
- Saflaştırılmış RNA'yı aşındırmak için, kolonu yeni bir 1,5 mL RNAse içermeyen mikrosantrifüj tüpüne aktararak başlayın. Pipet 50 μL RNase içermeyen su doğrudan sütunun silika jel membranÜzerine ve 1 dakika için ≥8000 x g santrifüj.
NOT: Eluted RNA RNA verimini artırmak için aynı sütun üzerinde tekrar çalıştırılabilir. - Toplam hacmi 100 μL'ye çıkarmak için saflaştırılmış RNA'ya 50°L RNa'sız su ekleyin.
- Numuneyi bir toplama tüpüne yerleştirilen bir arıtma sütununa uygulayın ve ≥8000 x g'de 15 s. Akış tan zikir atın ve toplama tüpünü değiştirin.
- 15 s için ≥8000 x g'de 350 μL tampon RW1 ekleyerek kolonu yıkayın.
- 70 μL tampon RDD'ye 10 μL DNase stoğu (750 Kunitz birimi/mL) ekleyerek yaklaşık 27 Kunitz birimi içeren bir DNase çözeltisi hazırlayın. 80 μL DNase çözeltisini doğrudan silika jel membranına ekleyin ve numuneyi oda sıcaklığında 15 dakika kuluçkaya yatırın.
- 15 s için ≥8000 x g tampon RW1 ve santrifüj 350 μL ile sütun yıkayın ve akış atın atın.
- RNA'yı arındırmak için 3.9.6-3.9.8 adımlarını tekrarlayın.
NOT: 3.9.9-3.9.10 ve 3.9.6-3.9.8 (DNase adımlarını 3.9.11-3.9.13 atlayarak) adımları izleyerek RNA temizleme işleminin tekrarı önerilir. Bu ek temizleme çok yüksek kaliteli RNA ile sonuçlanır.
- RNA verimi konsantrasyonu belirlemek için 260 nM ve saflık için 260:280 nM okumaları ile bir spektrofotometre kullanılarak ölçülebilir. RNA verimi alındıktan sonra, her RNA numunesinin konsantrasyonu 50 ng/μL'ye standartlaştırın.
NOT: RNA bozulmasına yol açabilecek donma/çözülme döngülerini önlemek için 50 ng/μL konsantrasyonda birden fazla aliquot yapmak önerilir. - Saflaştırılmış RNA'yı -80 °C'de saklayın veya transkript analizi için hemen kullanın.
NOT: Önceki yayınlarda 3-5 fareden RNA transkript analizi için bir araya toplanmış. Yukarıdaki tekniğin optimizasyonu ile, 1 fareden RNA ampirik olarak transkript analizi için yeterli olarak belirlenmiştir (80-120 ng/μL).
Sonuçlar
Şekil 1, intratrakeal aşılamanın inokülü alt solunum yolu içinde doğrudan ve eşit olarak verdiğini göstermek için %0,1 ağırlık/hacim Coomassie parlak mavi solüsyonu kullanır. Şekil 2 bakterilerin(S. aureus) CUS'ların doğrudan homojenleşmiş akciğer dokusundan elde edildiğini göstermektedir. Şekil 3, bu sistemin alt solunum yollarında inokülün hassas bir şekilde teslimi ve geri kazanımı için tek tek farelerden giriş ve kurtarma CPU'larını çizerek kullanımını göstermektedir. Şekil 4 bakteriyel housekeeping gen gyrB qRT-PCR amplifikasyon eğrisi bakteriyel RNA minimal DNA kontaminasyonu ile enfekte akciğer dokusundan doğrudan elde edilebilir göstermek için gösterir. Şekil 5, viral RNA'nın doğrudan enfekte akciğer dokusundan çıkarılabilen bir virüs Olduğunu göstermek için influenza A virüsü M-segmentinin qRT-PCR amplifikasyonu kullanılarak standart bir eğrinin yapımını göstermektedir.
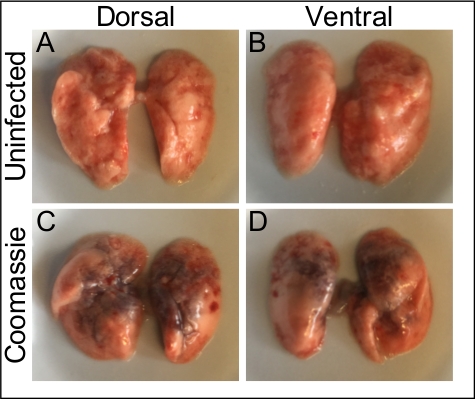
Şekil 1: İntrarakeal aşılama alt solunum yolu içine eşit dağılım sağlar. (A, B) Enfekte olmayan akciğerler steril PBS intratrakeal instillation aşağıdaki sağlıklı bir fare den çıkarıldı ve fotoğraflandı (A) dorsal ve (B) ventral perspektifler. (C, D) %0.1 Coomassie parlak mavi çözeltisinin 50 μL'si intratrakeal uygulama ile anestezili bir fareye uygulandı. (C) Dorsal. (D) Ventral. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
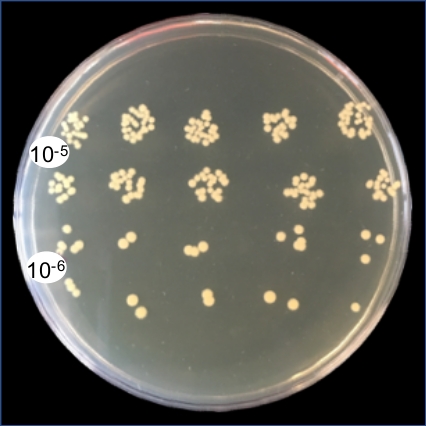
Şekil 2: Enfekte akciğer homojen bakteriyel CPU'ların temsili kurtarma. Akciğerler bir gün S. aureus ile bir gün sonra çıkarıldı. Homojenation sonra, akciğer bulamacı 100 μL seri 10-6ile seyreltildi . Elde edilen CPU'ları doğrulamak için 10-5 ve 10-6 seyreltmelerden triptik soya agarına (TSA) 10°L damla sıyrık saptandı ve bir gecede %5 C02 ile 37 °C'de kuluçkaya yatırıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
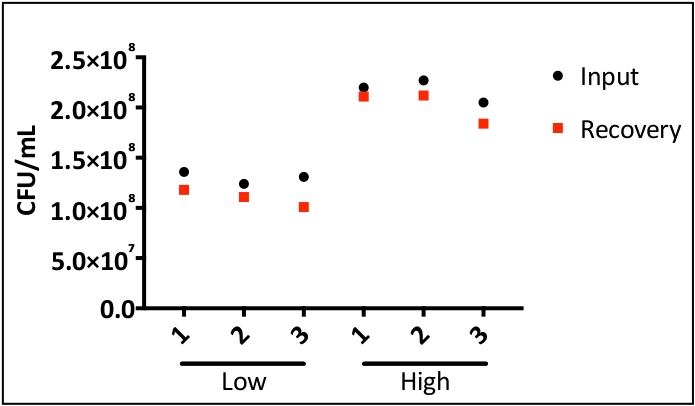
Şekil 3: İntrarakeal uygulama sonrası patojen inokülün kesin olarak verilmesi ve geri kazanılması. Fareler grup başına üç fare içeren iki gruba ayrıldı. Fareler 1 x 108 (düşük) ve 2 x 108 (yüksek) CFU/mL'de S. aureus intratrakeal indamaya maruz kaldı. Bir saat post-enfeksiyon, fareler ötenazi ve akciğerler instillasyon ve kurtarma hassas göstermek için çıkarıldı. Akciğer homojenate'den çıkarılan bakteriyel inokül ve bakteriler TSA (triptik soya agarı) üzerine kaplandı. Bakteriyel girdi ve iyileşme arasında anlamlı fark bildirilmedi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
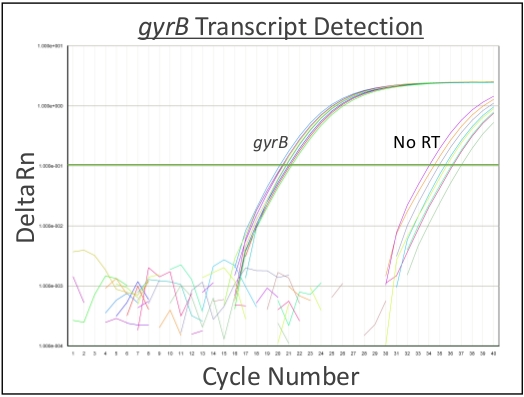
Şekil 4: Temsili bakteriyel RNA kurtarma ve saflık. 1 x 108 CFU/50 μL S. aureusile intratrakeal aşılamadan altı saat sonra fareler ötenazi yapıldı. Akciğerler eksisize edildi ve homojenize edildi ve ardından tampon RLT-ß-mercaptoetanol'de akciğer bulamacı nın yeniden süspansiyonu yapıldı. RNA adım 3.914açıklandığı gibi saflaştırılmış oldu. qRT-PCR bakteriyel temizlik geni gyrB transkriptleri tespit etmek için kullanılmıştır. Kurtarılan RNA'nın saflığını göstermek için ters transkriptaz (nRT) içermeyen bir kontrol eklenmiştir. 0.1 eşiğinde, gyrB transkriptleri ortalama 21.1, 20.3 ve 20.5'te saptandı. nRT kontrolleri döngü ortalamaları 35.9, 35.5 ve 35.0'a kadar algılanmadı. n = 3 biyolojik çoğaltma, içeren 3 teknik çoğaltma/biyolojik çoğaltma. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
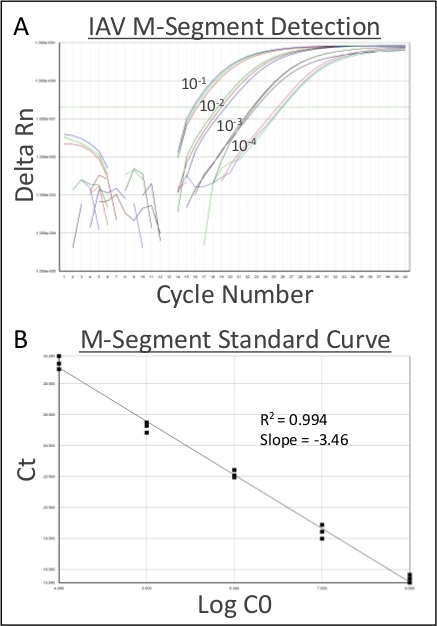
Şekil 5: Temsili viral RNA kurtarma. İntratrakeal instillasyondan altı gün sonra 100 PFU/50 μL influenza A/PR/8/1934 (H1N1) ile fareler ötenazi yapıldı. Akciğerler ekscbize edildi ve homojenize edildi, ve 200 μL homojenize bulamaç toplandı ve viral RNA arıtma önce 70 μm hücresüz geçti. Saflaştırılmış RNA seri olarak seyreltildi (10-1-10-4) ardından influenza A M-segmentinin amplifikasyonu yapıldı. (A) Influenza A RNA amplifikasyon arsa enfekte akciğer kurtarıldı ve seyreltilmiş 10-1-10-4. (B) Grip A-segmentinin standart eğrisi. Eşik = 0,2, R2 = 0,994, eğim = -3,46. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu modelin kullanımı ikincil bakteriyel enfeksiyonları incelemek için son derece verimli ve tekrarlanabilir bir yöntem sağlar. Patojen inokülün teslimini sıkı bir şekilde kontrol edebilme yeteneği, her patojenin bireysel ve kombinatoryal etkilerinin daha hassas gözlemlerini sağlar. Daha yaygın intranazal instillasyon rotasındaki verimsizlikler literatürde bulunan doz hacimleri ve konsantrasyonlarda ki tutarsızlıklara katkıda bulunmuştur. Sekonder bakteriyel pnömoni incelemek için kesin bir mürin sisteminin eksikliği pulmoner ko-enfeksiyonların şiddetine katkıda bakteriyel spesifik yanıtları tanımlayan bulgular geciktirdi makul. Sekonder bakteriyel enfeksiyonlar sırasında virülans ekspresyonunu incelemek için tekrarlanabilir bir model geliştirmek, bu enfeksiyonları iyileştirmek için aşı veya ilaç hedeflerinin belirlenmesine yol açabilir.
İntratrakeal aşılama adımı, daha düşük bir solunum yolu enfeksiyonu ve patojenlerin aşağı akım analizini başarılı bir şekilde oluşturmak için çok önemlidir. Bu tekniği öğrenirken, bulaşıcı materyali yönetmeden önce bir boya (yöntemlerde açıklandığı gibi) kullanarak pratik yapmak yararlı olabilir. Bir boya kullanarak solunum yolu içine inoculum doğrudan görselleştirilmesi için izin verir. Oluşabilecek yaygın bir hata, trakea yerine özofagus içine künt iğne yerleştirerek olduğunu. Bu akciğerler yerine mide içine inoculum teslim neden olacaktır. Bu hatayı düzeltmek için iğneyi vücuttan daha uzağa açıya çevirin ve nefes borusuna geçirin. Bir kez hakim, bu prosedür çok verimli ve farelerin çok sayıda deneyler yapmak için kullanılabilir. Fareleri anestezik gruplar halinde çalışırken, intratrakeal aşılama fare başına yaklaşık 30 saniyede tamamlanabilir. Buna ek olarak, akciğer eksizyonu fare başına 2-3 dakika içinde tamamlanabilir.
Enfekte dokulardan canlı ve saf bakteriyel RNA'nın geri kazanımı transkript analizi için çok önemlidir. RNases her yerde ve hızlı bir deney15berbat edebilirsiniz. Bazı yöntemler rnase inhibitörleri kullanarak içerir; ancak, numunenin RLT-ß-mercaptoethanol'de -80 °C'de dondurulması veya tüm RNase serbest tüpleri ve reaktifleri kullanarak RNA izolasyonu için numunenin hemen işlenmesinin RNa kontaminasyonunu azaltmada etkili olduğunu bulduk. Ayrıca, aynı anda en fazla altı numunenin saflaştırılmasını öneririz. Altıdan fazla örnek dahil olmak, RNA bozulmasıile sonuçlanabilecek protokol adımları arasında uzun süreli gecikmelere neden olabilir. Bir kez saflaştırılmış, bakım da herhangi bir gereksiz donma-çözülme döngüleri önlemek için alınmalıdır. Bu nedenle, tek bir numune üzerinde birden fazla analiz yapılacaksa, -80 °C'de depolanması için saflaştırılmış RNA'nın temizlenmesi önerilir.
Burada gözden geçirilen tekniklere ek olarak, bu yöntem eksizyon ve akciğerlerin homojenation önce bronşiyal alveoler lavaj gerçekleştirerek tamamlanabilir16. Bu tüm alt solunum yolu lavaj veya kalan dal aracılığıyla lavaj takip bronşiyal ağacın bir dallanma kolu kısıtlamak için dikiş ipliği kullanılarak gerçekleştirilebilir. Genellikle bu patojen yükünün kurtarma bir azalmaya yol açar ama laktat dehidrogenaz aktivitesi, hücresel nüfus kimliği ve sitokin profilleri gibi bilgi bunun üzerine bir örnek sağlar16. Birlikte bu veriler ikincil bakteriyel pnömoni sırasında meydana gelen konak-patojen etkileşimleri daha tam bir anlayış oluşturabilir.
Tartışılan yöntemler ikincil bakteriyel pnömoni bağlamında olmakla birlikte, alt solunum yolu enfeksiyonu herhangi bir murine modeline uzatılması uygundur; özellikle, bu sıkıca kontrol edilen teslimat ve yüklü inoculum kurtarma yararlanacaktır. Ayrıca, diğer birçok enfeksiyon yolları gibi, intratrakeal indatasyon gibi terapötik ve çevresel bileşiklerin uygulanması gibi bulaşıcı olmayan uygulamalarda kullanılabilir12.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar Nicole Meissner, M.D./ Ph.D., Montana State University, intratrakeal aşılama yöntemi kurulmasında ona yardım için teşekkür etmek istiyorum. Bu çalışma ABD Ulusal Sağlık Enstitüleri (HibeLER NIH-1R56AI135039-01A1, GM1110732, R21AI128295, U54GM115371) yanı sıra Montana Üniversitesi Sistem Araştırma Girişimi (51040-MUSRI2015-03) ve Montana Devlet Üniversitesi fonları tarafından desteklendi Tarım Deney İstasyonu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Lysing Matrix B | MP Biomedicals | 6911100 | Referred to in text as "0.1 mm silica beads" |
| 21-gauge blunt needle | SAI | B21-150 | 1.5" is recommended. |
| RNase-Free DNase Set | Qiagen | 79254 | DNase used in the accompanying text. |
| FastPrep-24 Classic Instrument | MP Biomedicals | 116004500 | FastPrep FP120 is no longer available. Referred to in text as "Bead Beater" |
| TaqMan AIV-Matrix Reagents | Applied Biosystems | 4405543 | Influenza A M-segment qRT-PCR kit. |
| Intubation Stand | Kent Scientific | ETI-MES-01 | Referred to in text as "intubation platform." Intubation platform used in the accompanying video was made in house. |
| RNeasy Mini Kit | Qiagen | 74106 | RNA purification kit; contains RNeasy columns, Buffer RLT, Buffer RW1, and Buffer RPE |
| QIAamp Viral RNA Mini Kit | Qiagen | 52904 | Viral RNA purification kit. |
| Tissue Grinders | Thermo Fisher Scientific | 02-542-08 | |
| 2-Mercaptoethanol (β-Mercaptoethanol) | Calbiochem | UN2966 |
Referanslar
- Xu, J., Murphy, S. L., Kochanek, K. D., Bastian, B. A. National Vital Statistics Reports Deaths: Final Data for 2013. National Center for Health Statistics. 64 (2), at http://www.cdc.gov/nchs/data/nvsr64/nvsr64_02.pdf 1(2013).
- Morris, D. E., Cleary, D. W., Clarke, S. C. Secondary Bacterial Infections Associated with Influenza Pandemics. Frontiers in Microbiology. 8, 1041(2017).
- Lee, M., Arrecubieta, C., Martin, F. J., Prince, A., Borczuk, A. C., Lowy, F. D. A Postinfluenza Model of Staphylococcus aureus Pneumonia. The Journal of Infectious Diseases. 201 (4), 508-515 (2010).
- Shepardson, K. M., et al. Differential Type I Interferon Signaling Is a Master Regulator of Susceptibility to Postinfluenza Bacterial Superinfection. mBio. , (2016).
- Miller, M. A., et al. Visualization of Murine Intranasal Dosing Efficiency Using Luminescent Francisella tularensis: Effect of Instillation Volume and Form of Anesthesia. PLOS ONE. 7 (2), 31359(2012).
- Robinson, K. M., et al. Influenza a virus exacerbates staphylococcus aureus pneumonia in mice by attenuating antimicrobial peptide production. Journal of Infectious Diseases. 209 (6), 865-875 (2014).
- Reddinger, R. M., Luke-Marshall, N. R., Hakansson, A. P., Campagnari, A. A. Host physiologic changes induced by influenza a virus lead to Staphylococcus aureus biofilm dispersion and transition from asymptomatic colonization to invasive disease. mBio. 7 (4), (2016).
- Borgogna, T. R., et al. Secondary Bacterial Pneumonia by Staphylococcus aureus Following Influenza A Infection Is SaeR/S Dependent. The Journal of Infectious Diseases. 218 (5), 809-813 (2018).
- Shahangian, A., et al. Type I IFNs mediate development of postinfluenza bacterial pneumonia in mice. Journal of Clinical Investigation. 119 (7), 1910-1920 (2009).
- McAuley, J. L., et al. Expression of the 1918 Influenza A Virus PB1-F2 Enhances the Pathogenesis of Viral and Secondary Bacterial Pneumonia. Cell Host and Microbe. 2 (4), 240-249 (2007).
- Hamacher, J., et al. Microscopic wire guide-based orotracheal mouse intubation: Description, evaluation and comparison with transillumination. Laboratory Animals. 42 (2), 222-230 (2008).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated Intratracheal (IMIT) Instillation: A Noninvasive, Lung-specific Delivery System. Journal of Visualized Experiments. (93), e52261(2014).
- Cai, Y., Kimura, S. Noninvasive Intratracheal Intubation to Study the Pathology and Physiology of Mouse Lung. Journal of Visualized Experiments. (81), e50601(2013).
- Voyich, J. M., Sturdevant, D. E., DeLeo, F. R. Analysis of Staphylococcus aureus gene expression during PMN phagocytosis. Methods in molecular biology. 431, Clifton, N.J. 109-122 (2008).
- Dyer, K., Rosenberg, H. The RNase a superfamily: Generation of diversity and innate host defense. Molecular Diversity. 10 (4), 585-597 (2006).
- Van Hoecke, L., Job, E. R., Saelens, X., Roose, K. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398(2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır