Method Article
帕金森病中运动与认知功能的动态数字生物标志物
摘要
该协议提供了一个数字化的部分传统临床任务,通常用于测量认知和运动控制帕金森病。临床任务被数字化,而生物物理节律从神经系统的不同功能水平共同注册,从自愿的,自发的,自动到自主的。
摘要
由于帕金森病 (PD) 是一种异质性疾病,个性化药物是优化护理的真正需要。以目前的形式,纸和铅笔症状的标准分数——传统上用来跟踪疾病进展的测量值过于粗糙(离散),无法捕捉在面对巨大症状时所考虑的临床现象的粒度多样性。因此,传感器、可穿戴设备和移动设备越来越多地纳入 PD 研究和常规护理中。这些数字测量虽然更精确,但产生的数据比传统测量措施的标准化和可解释性较差,因此,这两类数据基本上仍然孤立无误。这两个问题都为该领域最精确的评估工具的广泛临床应用带来障碍。此协议解决了这两个问题。使用传统任务测量认知和运动控制,我们测试参与者,同时使用可穿戴设备不显眼地共同注册生物物理信号。然后,我们将传统纸笔方法的分数与持续注册的数字数据集成在一起。我们提供新的标准化数据类型和统一统计平台,能够动态跟踪不同条件下人随机签名的变化,从而探测神经运动控制的不同功能水平,范围从自愿自主。该协议和标准化统计框架在PD中提供与经验证的临床规模相对应的物理和认知功能的动态数字生物标志物,同时显著提高其精度。
引言
精密医学 (图1) 已成为开发个性化靶向治疗的强大平台.在癌症研究领域,这一模型非常成功,其宗旨必将在不远的将来彻底改变医学领域。PM 结合了多层知识,从患者的自我报告到基因组学。跨所有这些层整合信息可进行个性化评估,从而能够解释数据,并提出更精确的治疗建议,以考虑患者生活的各个方面。
有几个挑战,当试图适应PM平台的神经精神病学和神经系统的神经紊乱2,3,这些挑战最近被表达4。其中包括获得的数据的差异,即从观察指导的临床铅笔和纸方法的离散分数,以及从神经系统输出(例如,使用生物传感器)实际获取的连续生物物理数据。来自临床分数的数据倾向于假设一个大小适合的所有静态模型,该模型强制执行单个(理论)概率分布函数 (PDF)。这种先验的假设是在没有适当的经验验证的情况下强加给数据的,因为规范性数据最初没有获得和特征化。因此,没有适当的相似性-基于公制的标准来描述人类神经系统的神经典型性肌理状态,因为健康人的年龄和用于投射这些参数变化的概率空间会以一定速度变化。如果没有规范的数据和适当的相似性指标,就不可能测量与典型状态的偏离,因为它们在人的生活中动态变化。也不可能预测即将到来的变化的感官后果。
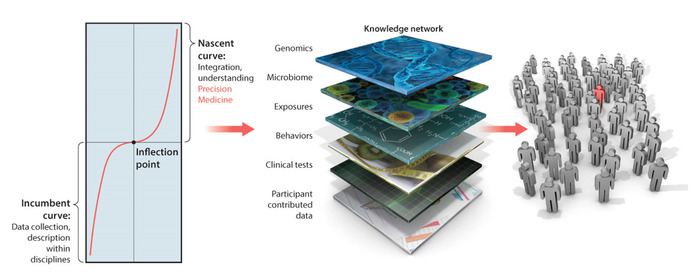
图1:精密医学平台:填补行为与基因组学之间的空白,实现个性化医学中针对神经系统神经和神经精神障碍的治疗发展。用于开发个性化靶向治疗的精密医学平台可以翻译为诊断和治疗神经系统的神经和神经精神病。然而,在知识网络中,行为分析层需要范式转变,将生物物理数据中新出现的数字结果与更传统的临床标准相结合。未来的一个挑战是为这种集成提供统计上可靠的方法和新的直观可视化工具,同时鼓励临床医生、患者和护理人员使用数字结果测量。这一数字已由Hawgood等人修改,并经美国科学促进协会批准。请点击此处查看此图的较大版本。
当前的"大平均"方法在噪声时平滑,即个人在数据中的随机波动,即随着人的自然年龄、紊乱和人的神经系统而表现出的信号变异性接受和回应治疗。缺乏规范性数据(即评估健康人群的大横截面和纵向部分)使我们无法理解健康衰老的神经典型动态。因此,当病理学开始在个体中系统化地显现时,知道如何更普遍地预测特定病理学的后果就成为一项挑战。预测方法对于设计再生疗法和/或神经保护疗法至关重要,可减缓退行性过程。帕金森病是病理学的一个很好的例子,在这种疾病的表现形式之前,许多其他可测量的症状。我们今天知道,可见的运动障碍之前,不太明显的感官问题,如减少嗅觉功能5,6,言语模式的变化,快速眼动(REM)睡眠7,和其他非运动与肠道神经系统功能相关的症状8。当紊乱显现时,系统中已经出现了高多巴胺能耗竭;然而,非运动症状可以预测一些可见的运动损伤,目前主要评估紊乱。
有必要改变现有的分析模型,并考虑正确描述神经系统所有层面的经验数据的重要性,从而体现生物节律运动,并能以时间序列的形式动态利用与众多传感器共同注册。更一般意义上的运动数据不应局限于运动和它们所播的紊乱。来自神经系统所有生物节律的数字数据(包括非运动波形)提供了预测潜力,我们可能需要帮助预防或减缓快速神经退化。然而,当我们扩充数据类型时,我们应该避免参数线性模型用于统计推理和解释的固有假设,因为目前用于分析此类数据。评估这些线性模型是否足够于我们研究的神经系统病理学中受随机变化和动态变化的影响,这一点至关重要。当前假设分析管道循环中的注意事项存在于正在利用的两种数据类型中:离散临床分数和连续数字生物物理波形的数据类型。虽然它们仍然断开连接,但设计新的框架非常重要,这些框架能够正确集成两种类型的数据,使数字结果与临床标准保持一致,从而方便患者使用新兴数字技术,护理人员和临床医生。
为了克服其中一些挑战,我们最近调整了图1中的PM平台,为神经和神经精神病3提供精确的象周。为此,我们设计了一种收集、分析和解释行为数据的新方法,并结合传统的临床评分测试,确定认知和运动现象之间的复杂关系。更确切地说,我们已经数字化了铅笔和纸的方法。仅从这些方法获得的数据就太粗糙了,无法捕获从肉眼逃脱的重要信息。但是,结合生物物理传感器的数字数据,它们为将新兴的数字技术与临床标准联系起来提供了新的途径,以鼓励临床医生在不久的将来采用这些技术。
在这里,我们介绍数字数据在临床评估中的使用。也就是说,当人执行临床任务时,例如,在蒙特利尔认知评估 (MoCA) 测试中绘制时钟时,神经系统输出的生物节律在不同的功能层中共同注册。其中包括脑电图 (EEG)、心电图 (ECG 或 EKG)、来自身体的语音模式和运动学,以及人用于在数字化平板电脑上绘制时钟的手持笔的运动输出。我们还在人画时从面部收集视频数据,以执行情绪分析预测情绪状态。然后,通过新的统计平台对这些数据进行分析,以便进行个性化行为分析 (SPIBA),并根据此类测试的临床标准进行解释。更具体地说,离散分数用于对患者群进行中值排列,并以这种方式根据该临床标准对组进行分层。然后,我们可以检查由此确定的组的连续生物物理数据,以寻找数字驱动的随机标准,将一个患者子集与另一个子集从根本上区分开来,跨越多个参数维度。此外,通过研究连续的生物物理数据本身,根据每个人在队列内的内在波动和失明的临床标准,我们可以搜索在队列内的自我新兴集群,并比较这些聚类映射到临床标准所揭示的亚型的这些子类型。
这种方法提供了一种新方法,用于识别生物物理数字数据中丰富的参数,从而最有效地捕获各子类型之间的差异,并将这些差异作为潜在的良好候选者来分层帕金森氏症患者盲人的疾病(PWP),即从一般人群中随机抽取。此方法的相关性是双重的。我们可以真正个性化治疗,同时正确整合来自生物传感器和临床标准的不同数据类型;即以时间序列形式连续的数字生物物理数据,以及传统测试中的离散临床分数。
虽然这是一种适用于神经系统所有疾病的一般方法,但我们在 PWP 范围内构建工作框架,并提供新方法,对在性能中共同注册的连续数字数据进行统计推断考虑离散临床评分系统的临床试验。因此,该工作使数字结果的临床解释在临床环境中使用。最后,我们提供建议,开始设计新的方法来可视化此类个人结果,以嵌入到新的应用程序中,以便患者、护理人员和临床人员在家庭和临床环境中轻松使用。
研究方案
此处描述的所有方法均已获得罗格斯大学机构审查委员会的批准。
1. 参与者和采集系统建立
- 获得参与者的知情同意。
注:参与者应被诊断为帕金森氏症,或不应诊断为任何神经紊乱,以作为健康控制参与者。健康参与者应与患者参与者的性别和年龄相匹配。所有参与者应具有连续行走 5 分钟的移动性。 - 测量参与者的身体尺寸(身体高度、脚长、臂跨度、脚踝高度、臀部高度、臀部宽度、膝盖高度、肩宽、肩高;图 2A)稍后在运动捕捉系统中创建他/她的身体头像。
注:此信息用于运动捕捉系统,以准确记录参与者身体的位置数据。 - 设置运动捕捉系统,包括 17 个无线运动跟踪传感器和运动跟踪软件。
- 将传感器放置在以下身体部位:头部、胸骨、骨盆、右肩、右上臂、右上臂、右下臂、左肩、左上臂、左下臂、左手、右上腿、右上腿、右脚、左上腿、左下肢脚 (图 2B)用带带固定这些传感器,以便进行不显眼的移动。
- 将所有传感器放置在正确位置后,校准参与者的位置以创建其头像。
注:有关校准方法的详细信息,请参阅 Roetenberg 等人9。
- 设置 EEG 设备和 EEG 录制软件。
- 将 31 个传感器放在头皮上,记录设备位于学员头部后部。将信道传感器放置在以下位置:P7、P4、Cz、Pz、P3、P8、O1、O2、T8、F8、C4、F4、Fp2、Fz、C3、F3、F3、Fp1、T7、F7、PO4、FC6、FC2、AF4、CP6、CP2、CP1、CP1、FC5、AF3、PO3(图2C)。
- 通过将连接的传感器定位在参与者的左侧胃上(图 2C),将剩余的通道传感器 (Oz) 连接到接头以测量心脏信号。
- 将两个参考通道传感器安装在参与者左耳后面,然后使用注射器将电极凝胶插入 EEG 盖上的传感器中(图2C)。
- 完成后,开始流式传输录制软件上的电气活动几分钟,直到其稳定下来。
注:图2D显示了来自中枢神经系统(CNS)和自主神经系统(ANS)的脑电图信号的样本痕迹。
- 设置麦克风以捕获参与者的声音。将麦克风放在参与者的前面,并将其连接到将运行实验室流层 (LSL) 的计算机(参见下面的 LSL)(图 2E)。
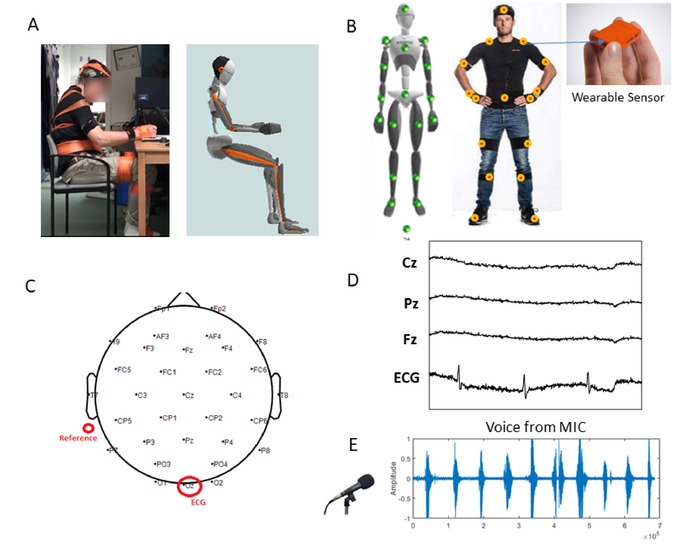
图 2:设置数字化传统临床试验,同时集成来自不显眼的无线可穿戴生物传感器的多个波形。(A) 为绘图任务设置:实际患者穿着不显眼的可穿戴传感器和头像,实时呈现从被收集的运动学。(B) 一组小型和轻型运动跟踪传感器(60 Hz)的传感器位置,从中运动数据在体间同步注册。(C) 脑电图及参考位置.(D) 从从 Oz 引线中提取的 31 条引线和心脏信号中抽取的 EEG 波形样本。(E) 在计数任务期间从参与者的声音中采样波形。请点击此处查看此图的较大版本。
- 设置 LSL 系统以同步 EEG、运动和音频信号的流,以及鼠标单击时间戳(图3A)。
- 打开实验室记录器应用程序。
- 打开 LSL 应用程序用于鼠标和内部构建的 Xsens 同步应用程序,并通过选中"来自流的记录"部分中的"鼠标按钮"和"跟踪器运动学"复选框将它们链接到实验室记录器应用。
注: 鼠标应用将用于在实验期间对事件进行时间戳。 - 通过选中"音频捕获",LSL-EEG,在"从流中的位置"部分,将EEG、运动和音频流链接到实验室录像机应用程序。
注:LSL 系统支持在研究实验中统一收集测量时间序列,处理时间同步,以及网络和实时访问,以及集中收集、查看和磁盘记录数据。在该协议的上下文中,LSL 系统同步从中枢神经系统、外周神经系统 (PNS) 和 ANS 流,因为人自然执行传统的临床任务。
- 设置笔移动录制,包括数位板和运动分析软件 (图 3B)。
- 将绘图片和 Tablet 笔放在参与者前面。
- 将平板电脑连接到将记录移动分析软件的计算机。
- 将白纸放在平板电脑上,用胶带固定。
注:请提前准备论文,以显示一个框,指示参与者将在哪里绘图。
- 开始录制。
- 在LSL、运动捕获软件和 EEG 录制软件中按记录。
- 在每个任务的开始和结束时,通过按运动捕捉软件上的时间戳按钮,通过鼠标单击时间戳。
注: 这样,时间戳将记录在 LSL 流数据和运动捕获数据中。这将确保存在备份时间戳,以防其中一个时间戳功能在录制期间失败。
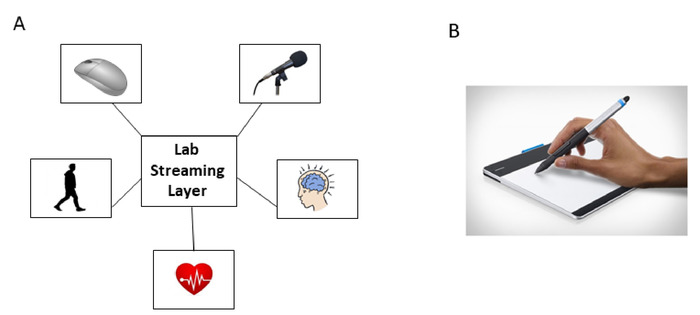
图 3:通过公共中央处理单元的实验室流层 (LSL) 系统实现信号数字化和同步。(A) LSL 系统同步允许通过鼠标单击共同注册运动 (PNS)、EEG (CNS)、ECG (ANS)、语音和时间戳。(B) 在从标准化认知测试绘制任务时,数字化的平板电脑和笔记录笔尖的运动学(位置)。请点击此处查看此图的较大版本。
2. 实验程序
- 执行任务 1 = 本森复杂图副本(立即)10 (1 分钟)。
- 指示学员复制纸张上的 Benson 图,并记住设计,因为稍后将要求学员再次从内存中绘制该图。
注:此测试旨在评估参与者的视觉构造和视觉记忆功能(图4A)。
- 指示学员复制纸张上的 Benson 图,并记住设计,因为稍后将要求学员再次从内存中绘制该图。
- 执行任务 2 和 3 = 跟踪测试 A 部分(3 分钟)。
- 指示参与者在按升序编号的圆圈之间画一条线。
注: 本节中有两个任务,其中第一个(任务 2)是完成示例测试(由 8 个数字组成),下一个任务(任务 3)是完成实际测试(由 25 个数字组成)。此测试是陆军个人测试电池11的组成部分,并评估处理速度和执行功能,并取决于视觉运动和感知扫描技能 (图 4B)。
- 指示参与者在按升序编号的圆圈之间画一条线。
- 执行任务 4 和 5 = 跟踪测试部分 B(5 分钟)。
- 指示参与者在包含数字或字母的圆圈之间按升序绘制一条线,同时在数字和字母之间交替。例如,序列为:A 到 1;1 到 B;B 到 2;2 到 C。
注: 本节中有两个任务,其中第一个(任务 4)是完成样本测试(包括 4 个数字和 4 个字母),下一个(任务 5)是完成实际测试(由 13 个数字和 12 个字母组成)。跟踪制作测试部分 B 与跟踪制作测试部分 A 类似,但随着参与者从数字转移到字母集,需要更大的认知灵活性。(图4B)
- 指示参与者在包含数字或字母的圆圈之间按升序绘制一条线,同时在数字和字母之间交替。例如,序列为:A 到 1;1 到 B;B 到 2;2 到 C。
- 执行任务 6 = 时钟绘制(1 分钟)。
- 指示参与者绘制数字 1 到 12 的模拟时钟,并将时间设置为 10 过去 11。
注:此测试是 MoCA12的一部分,并评估学员的视觉构造技能。(图4C)
- 指示参与者绘制数字 1 到 12 的模拟时钟,并将时间设置为 10 过去 11。
- 执行任务 7 = 本森复杂图副本(延迟)10 (1 分钟)。
- 指示学员在一张空白纸上从记忆中绘制本森复杂图。
注:此测试评估学员的视觉构造和视觉记忆功能。(图4A)
- 指示学员在一张空白纸上从记忆中绘制本森复杂图。
- 执行任务 8 和 9 = 数字跨度测试(向前和向后)13 (10 分钟)。
- 指示参与者重复实验者大声读出的数字。
- 对于任务 8(前进),指示参与者以相同的顺序重复数字,对于任务 9(向后),请以相反的顺序重复这些数字。对于两个测试,每个序列长度有两个试验,从前向 3 到 9 位数字不等,向后测试有 2 到 8 位。继续测试,直到两个长度相同的数字字符串失败。
注: 两个测试都测量短暂保存信息的能力,但后退测试(任务 9)也测量操作数字和反转序列的能力。因此,在本协议中,此任务测量与语音生物节输出相关的记忆和认知组件。
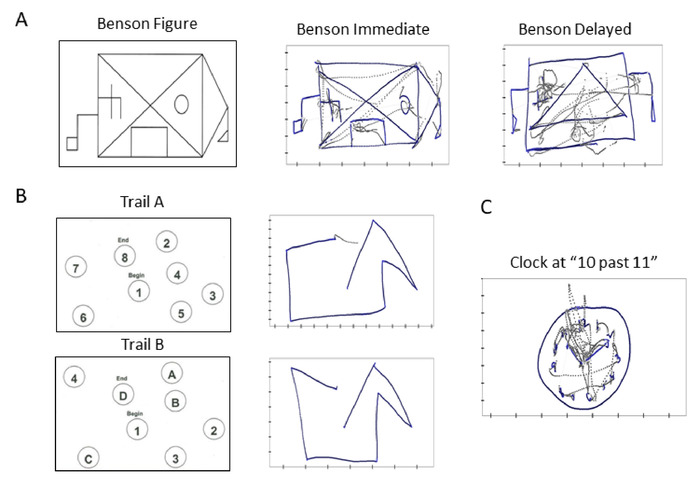
图4:走向临床信息的数字生物标志物和评分卡:传统临床试验的数字化,以实现临床标准和数字生物物理数据的集成。标准化认知测试的样本跟踪。(A) Benson 复杂图提供给参与者立即复制(中心),或在内存延迟 10 分钟之后(右)。(B) 跟踪 任务涉及按升序(顶部)由行连接的数字,以及涉及字母和数字交替的跟踪 B 任务(底部)。(C) 绘制一个时钟,并说明将时间设置为 10 到 11。对于所有样本轨迹,灰色线表示绘图任务期间笔提升的轨迹,蓝线表示实际的笔画。为了进行分析,我们检查了两种类型的轨迹。请点击此处查看此图的较大版本。
- 执行任务 10、11 和 12 = 指点(10 分钟)。
- 将目标放置在参与者的前面以指向和触摸。
- 对于任务 10(控制),指示学员以自定进度的方式用主导手指向目标 40 次。
- 对于任务 11(节拍器),指示参与者以自定进度的方式指向目标 40 次,同时在后台将节拍器节拍设置为 35 bpm,但不指示任何有关节拍器节拍。
- 对于任务 12(节奏指向),指示参与者以节拍点设置为 35 bpm 的速度指向目标 40 次。
注: 指点任务允许通过故意(向前移动,从手静止到手到达目标)和自发(向后移动,从手接触目标到手回到其静止位置)段,从而分析生物物理信号时,参与者施加自愿控制(故意运动),当参与者施加很少的控制(自发运动)(图5A).通过引入节拍器节拍,并要求参与者对节拍节拍的指向步调,当参与者以自定进度的方式移动时,以及当参与者主动控制时,可以比较生物物理信号。运动速度到外部节拍。
- 执行任务 13、14 和 15 = 步行(25 分钟)。
- 指导参与者在三种不同的条件下自然行走5分钟。
- 对于任务 13(控制),指示学员在房间里自然走动。
- 对于任务 14(节拍器),指示参与者在房间内自然走动,同时将节拍器设置为在背景中跳动 12 bpm。
- 对于任务15(节奏呼吸),指示参与者在房间里自然走动,同时他/她将呼吸速率调整到定于12bpm的节拍节拍。
注:通过引入节拍器节拍,当参与者使用整个身体以自定步的方式移动和呼吸,以及当参与者积极控制呼吸速度时,可以比较生物物理信号。在移动整个身体时自动发生 (图 5B)。
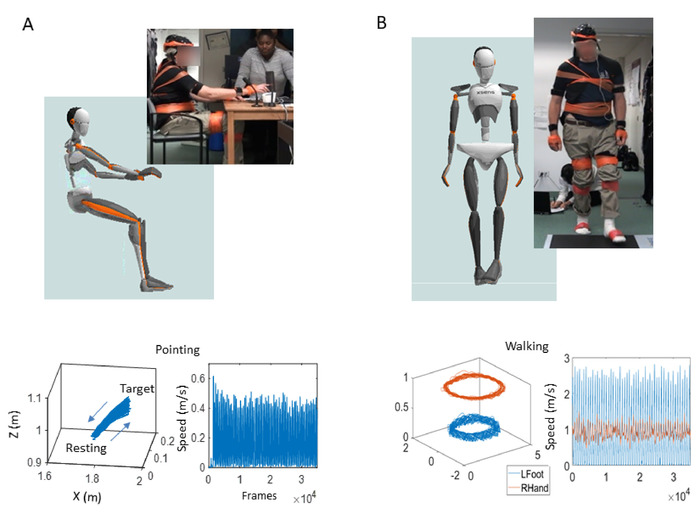
图5:三维(3D) 上半身自愿运动期间轨迹及其速度振幅时间序列输出。目标导向的指向行为,以探索意志控制使用运动障碍协会 -统一帕金森病评级表 (MDS-UPDRS) 的动能震颤任务的版本。(A) 参与者和头像在坐姿上身执行上身,目标定向指点任务(顶部);前进(目标)和向后(到静止位置)移动(左下)的3D位置轨迹;和相应的线性速度曲线,显示速度振幅 (m/s) 和峰值间间隔时序 (ms) 的波动时间序列,从线性速度矢量流(右下角)派生。(B) 行走任务的参与者和头像(上);不同身体部位(左下)和相应速度轮廓(右下角)的 3D 位置轨迹。请点击此处查看此图的较大版本。
- 执行任务 16 和 17 = 面部视频(10 分钟)。
- 指示学员舒适地坐,并在学员面前设置摄像机。
- 对于任务 16(控制),指示学员凝视一个没有任何刺激的空间 5 分钟。
- 对于任务 17(微笑),指示参与者观看有趣的视频 5 分钟。
注:设置大约需要 30 分钟,整个协议大约需要 60 分钟,PWP 需要 10 分钟。
结果
感兴趣的参数
从人神经系统产生的生物物理数字信号的轨迹中,我们可以提取出许多运动参数。在这里,我们专注于脑电图EEG波形(代表中枢神经系统,CNS输出),身体运动(代表周围神经系统,PNS输出)和心脏信号(代表自主神经系统,ANS输出)。
对于与 CNS 和 ANS 相关的信号,我们使用 EEG 和 ECG 波形 (μV) 的峰值振幅波动转换为无单位(标准化)微运动尖峰 (MMS)(见下文)。对于与 PNS 相关的信号,我们使用质量中心 (COM) 及其速度曲线的时间序列 (m/s) 的轨迹来派生相应的无单位彩信。一旦我们收集了彩信,我们可以将它们集成到一个加权无向图中,基于一组跨传感器和神经系统功能级别的对对信号分析。此步骤使我们能够对组合信号使用网络连接分析。然后,我们生成可解释的图形14,15描述自新网络拓扑的变化。特别是,当我们比较三个指向和/或行走任务的这些图形时,我们可以观察到生物物理信号如何被动地响应外部节奏(即,当节拍器自发地跳动时,并发生在主动方式(即,当参与者故意尝试加快手指向或步行运动到节拍器节拍时)。我们还可以研究代表CNS、PNS和ANS函数级别的网络节点的信息传输模式。
生物物理信号的多功能层对MMS的随机分析
从全身传感器的可穿戴网格中利用的生物物理信号,产生峰谷的时间序列,其振幅和时间各不相同。这些生物物理信号16的 MMS 是峰值的振幅和时序的波动,因此振幅归一化为实际 [0,1] 间隔的无单位值,从而允许跨来自神经系统的不同功能层:中枢神经系统、PNS和ANS。这些不同的功能层需要不同级别的神经运动控制,并具有不同的振幅范围在个人之间。它们也有不同的峰间间隔计时。虽然彩信规范化可保留原始峰值的时序,但它也捕获振幅的变化。这种规范化是通过将每个局部峰值振幅除以峰值振幅和围绕峰值的两个相邻局部最小值内采样的信号的平均值来获得的:
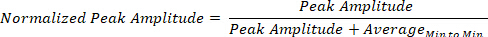
[0,1] 实数间隔中的这些连续峰值保留了有关时序和振幅波动的信息,同时使我们能够将时间序列视为一个随机过程。然后,我们在泊森随机过程的一般参数下采用伽玛过程,通常用于计算神经科学领域,以分析二进制峰值。
这些分析方法已在其他地方详细解释3、14、17、18,参见图6,了解分析管道和建议的可视化,以帮助临床解释。在这里,我们使用伽玛参数平面跨越的伽玛PDF的形状和比例参数,我们从MMS波形的经验估计。我们还在四维图上绘制相应 Gamma 时刻的点,其中均值、方差和偏斜跨越三个维度,而峰度以标记的大小表示,我们用于表示人的随机数签名。
对于每个任务,从生物物理时间序列派生的 MMS 峰值数据会使用最大可能性估计 (MLE) 收集并安装到 Gamma PDF 中,每个 Gamma 参数具有 95% 的置信区间:表示分布形状的形状,以及刻度表示色散(噪声与信号比)。因此,我们以高信心估算,这是最佳连续的 PDF 系列,可捕获个人神经系统的生物节律波动,这些功能水平不同,这些任务需要。这些功能层从高层次的抽象认知技能和记忆能力,到自愿的神经运动控制和从目标导向的任务衍生的自发性结果运动。我们还检查自动运动和系统的物理配合能力,每分钟节拍的节拍。
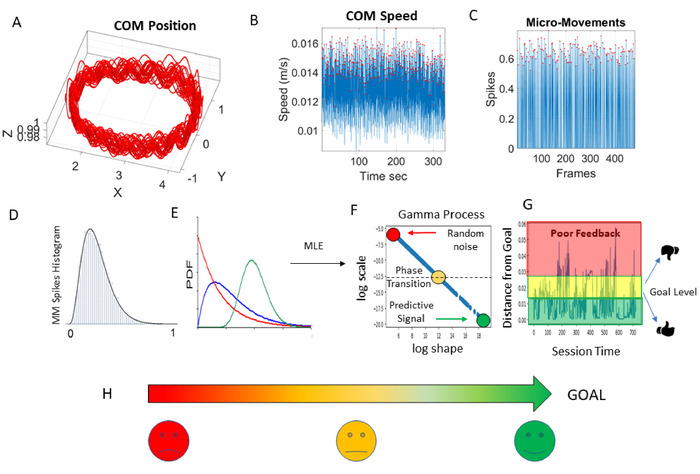
图6:用于开发动态数字生物标志物和应用到未来应用(APP)开发的统计分析管道。(A) 质量中心 (COM) 3D 位置轨迹,而人走动。(B) 具有振幅峰值的 COM 的速度波动,用红点突出显示。(C) 在 [0,1] 实际值间隔内,COM 速度峰值(红点)的波动中的标准化彩信。(D) 彩信峰值的频率直方图(彩信中的红点)。(E) 概率密度函数 (PDF) 适合从内存较少、大多数随机、指数分布(红色)到某些过渡偏斜分布(蓝色)到低的高斯(预测)的时间直方图随时间演变的频率分散(目标,绿色圆圈)。这种理想的分布(绿色)出现在年轻运动员中,并设定了预测性高信噪比情况的目标。(F) 最大可能性估计 (MLE) 用于将最佳 PDF(95% 置信度)适合经验数据。生成的参数值在 Gamma 参数平面上本地化 COM 速度波动中不断演变的随机特征(Gamma 过程):"日志形状"表示从指数到偏斜到对称的分布的形状(理想高斯);"日志刻度"是噪声与信号比(分散),意味着大脑(最有可能)获得22,23运动反馈的类型。颜色表示随机状态,因为它们会随时间动态演变。(G) 概率距离 (Wasserstein 公制距离7) 与神经典型中发现的低噪声-信号比(低色散)和高可预测性(对称分布)的理想目标;远离不良反馈(随机噪声)发现在更先进的PD,聋人患者24,25,26,27,精神分裂症28和自闭症个体3,18,22,29. (H) 简化可视化表示这些随机状态随时间演变是基于形状和比例参数之间的权力定律关系。这些视觉效果可为未来的应用开发提供实时、易于理解的临床反馈,以增强评估和治疗规划的精度。请点击此处查看此图的较大版本。
不同数据模式的结果
为了本文的目的,我们用表1所示的人口统计学数据研究了三个PWP和三个健康的参与者的数据。三个 PWP 是从我们记录的 10 个 PWP 中选择的,代表一个轻度 PD 病例(统一帕金森病评级等级表 [UPDRS] 评分 16)、中度病例(UPDRS 评分 25)和严重病例(UPDRS 评分 44)。两个健康的参与者是从我们记录的15个健康个体中挑选出来的,因为他们在年龄和性别上与PWP最匹配;一个健康的参与者从较年轻的年龄组中选出,作为理想的健康参考进行比较。
| 参与者 | 障碍 | 性 | 年龄 | UPDRSa |
| 1 | PWP | F | 64 | 44 |
| 2 | PWP | M | 65 | 25 |
| 3 | PWP | M | 64 | 16 |
| 4 | 没有 | M | 26 | 不适用 |
| 5 | 没有 | F | 65 | 不适用 |
| 6 | 没有 | M | 67 | 不适用 |
| a最高分 108. | ||||
表1:参与者的人口统计。
在认知和记忆测试(笔运动)中,记录笔运动的位置轨迹,提取线性速度以推导出速度振幅的时间序列。然后,从速度振幅波动中得出每个绘图任务的MMS。患者根据运动障碍协会(MDS-UPDRS)中位评分进行分组,PD严重度最高,最高排名分数高于队列的中值。每个群集的三个代表性参与者,其中所确定分数的中值用于显示与三个代表性控件相关的结果。一个控制是年轻的(26岁男性)代表一个理想的神经运动控制状态在青年时期。另外两个是健康的衰老控制;一名65岁女性和一名67岁男性。图 7描述了 COM 的轨迹,图 8描述了从其轨迹速度配置文件派生的 MMS 的相应 Gamma 过程。
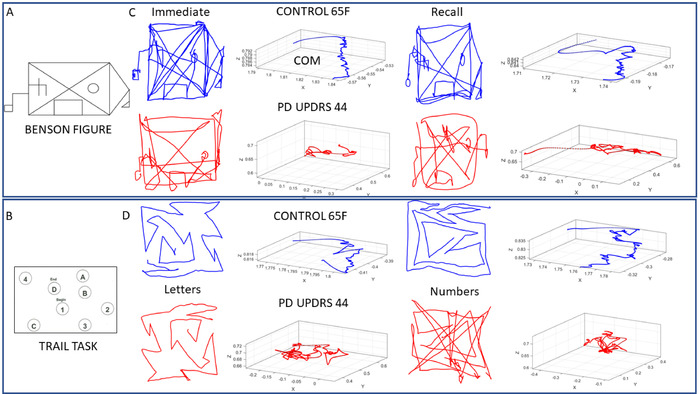
图 7:在使用实际数字化轨迹进行精选认知绘图测试期间,COM 的样本轨迹汇总了 17 个实体位置的轨迹。在 Benson 复杂图(任务 1 和 7)和跟踪测试(任务 2⁄5)期间对性能进行采样。(A) 本森在该协议中使用的复杂图形.(B) 带有数字和字母的跟踪测试,目的是通过沿着有序路径绘制一条线(任务 4 = 路径 B),以规定的顺序连接它们。(C) 本森复杂图和 COM 3D 轨迹的样本笔痕迹,从 65 岁的女性控制(蓝色)和 PWP 与 MDS-UPDRS 得分 44 (红色)。当参与者立即复制图形(任务 1)时,左侧显示结果,右侧显示参与者在延迟 10 分钟(任务 7)后调用图形时。在这两种情况下,都会捕获连续绘图以及笔升降机,以显示犹豫(D)在跟踪 A(任务 3)和跟踪 B(任务 5)任务中控制与 PWP 的性能的变化。请注意 COM 轨迹和实际图形中的更改。请点击此处查看此图的较大版本。
图 8显示了最适合 MLE 的 Gamma-PDF 的结果,健康参与者和患者参与者的置信度为 95%。在每个绘图任务中,患者除了对照组外分层。此外,它们在其组内分层,并根据 MDS-UPDRS 中位分数进行区分。每个患者在顶部面板上表示为经验估计 PDF 的时刻,而底部面板则描述每个参与者的 PDF 曲线。跨面板,读者可以欣赏每个人跨任务跨越的 PDF 系列。将此方法与一刀切(假设)参数模型进行对比。图 8D显示了笔尖(包括升笔)捕获的时钟图(任务 6)的连续绘图。
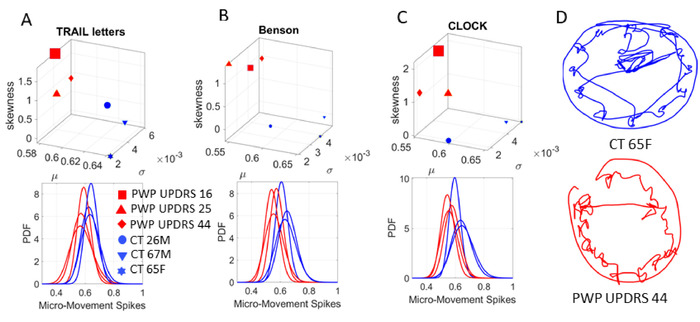
图 8:微运动峰值 (MMS) 对队列进行分层,并为认知任务构建可解释的个性化动态数字生物标志物。在认知测试期间,从 COM 的 3D 轨迹派生的逐点波动(无单位彩信)根据随机地图唯一地本地化每个参与者。COM总结了17个位置轨迹,在人执行认知任务并使用数字平板电脑时,共同注册运动。(A) 伽玛力矩在跟踪 B 测试(任务 5)期间从最大可能性估计中根据最大可能性估计(任务 5)连接字母和数字(均值 x 轴;标准偏差 y 轴;偏斜 z 轴和峰度标记大小)与最大可能性估计(置信度为 95%)顶部面板。每个标记表示人员在概率空间中的独特位置。每个点表示底部面板上显示的唯一可分离 PDF,从而对 PWP(图例)的 UPDRS 中值排名分数进行分层。(B) 复制复杂的本森图的任务(任务1)。(C) 时钟绘制任务 (任务 6)。(D) 数字化笔捕获的实际时钟图纸,显示连续轨迹(包括举数笔)。所有运动学从笔和全身运动同步注册与EEG-EKG(未显示),以经验推导出多层(认知,自愿,自发,自动,自主)随机签名。这种个性化方法(Gamma 过程)与假定理论 PDF 的"一刀切"模型形成鲜明对比,通过大平均值,平滑为波形振幅和时序的重要波动。微运动峰值 (MMS) 和 Gamma 工艺方法对队列进行分层,并为认知任务构建可解释的个性化数字生物标志物。请点击此处查看此图的较大版本。
接下来,我们提出身体运动的结果(自愿指点与自动行走)。绘图运动不需要与指向目标的任务(即任务 10_12)相同的目标直接性级别。为了能够评估意志控制的水平,我们接下来使用指向空间目标的任务。和以前一样,我们使用来自 COM 的轨迹来总结 17 个传感器位置的运动运动(图 9)。我们首先采用速度振幅时间序列,然后从振幅的瞬时波动中推导出彩信。图 10中的左面板显示了在基线(任务 10)的指向任务期间随机分析的结果。图 10中面板显示节拍器设置为 35 bpm 时指向任务的结果,但没有指示参与者其存在(任务 11)。图 10中的右侧面板显示案例的结果,指示参与者按照节拍器的节奏调整指向其指针运动(任务 12)。
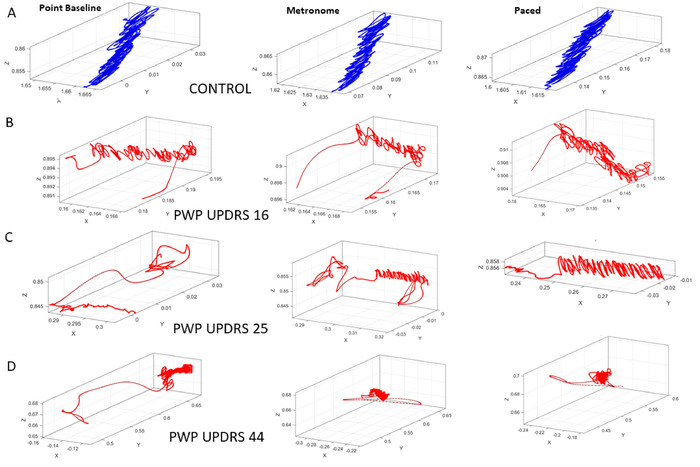
图 9:在指向任务期间 COM 的三维轨迹在三种不同的上下文中,定期指向进行基线测量(任务 10),在 35 bpm 时指向一个节拍器在后台跳动,而不提醒参与者存在节拍器(任务 11),并指向是否存在相同的节拍节拍,但在指示参与者将动作节奏调整到节拍器的节奏(任务 12)后。(A) 控制参与者的性能.(B) 根据整个组姆维德-UPDRS评分的中值,PWP在严重性等级最低的组中的表现。(C) 中严重性范围组中的 PWP.(D) 最高严重性组中的 PWP.请注意,随着 MDS-UPDRS 分数的增加,COM 轨迹的退化。请点击此处查看此图的较大版本。
Gamma 过程的结果如图10所示,通过该结果可以区分每个 PWP 子类型,并跟踪上下文到上下文的随机签名的变化。
指向任务揭示了这些分析对上下文情况的敏感性。对于同一指向任务,节拍器条件的变化在条件之间引起不同的随机特征。特别是,当COM生物节律自发地(没有指示)与节拍器节拍结合时,我们可以观察到COM生物节律的变化,而康症是指示参与者故意将指向节拍器的指针运动对准节拍器的。打。此任务表明,在上半身运动的基线上,PWP 的自愿控制水平因 MSD-UPDRS 分数而异。具体来说,在 Gamma 参数平面上,噪声与信号比(比例参数值)越低(图 10A),PDF形状值越对称。中值的UPDRS分数和数字数据之间的这种有序关系随着节拍器的存在而改变,并进一步区分了自发(未指示)和故意(指示)指向条件。
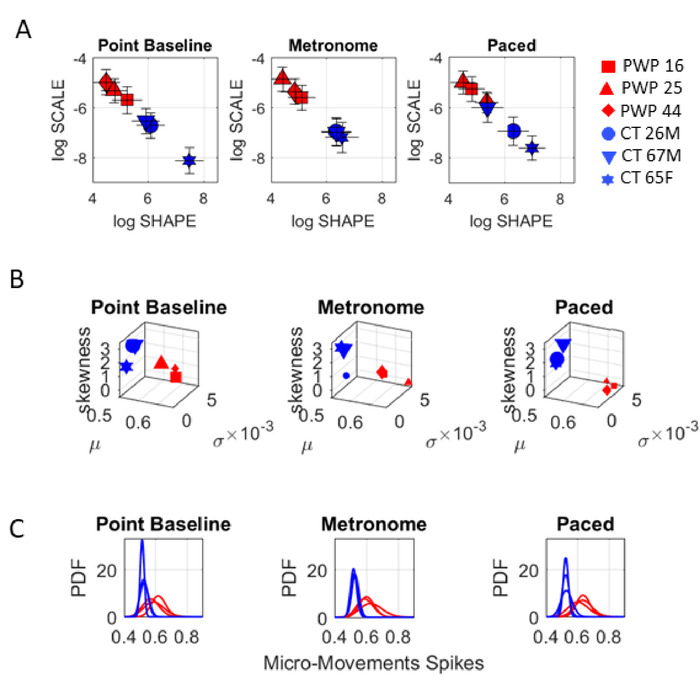
图10:动态数字评估三个具体的指向任务。在三个指向任务(任务 10=12)期间,从 MMS 派生的来自 MMS 的 Gamma 过程输出在 PWP 和控件组之间区分为 PWP 和控件组内部和之间。(A) 伽玛参数平面显示 PWP 和控件之间的差异。(B) 对于每个指向条件,伽玛矩从伽玛过程的经验估计,区分PWP和对照;在每个组中,随机签名将参与者分层到不同的点。每个任务上下文都会更改地图上点的位置。(C) PDF 系列还区分每个参与者、每个组,并揭示目标导向指向的任务上下文之间的统计差异。请点击此处查看此图的较大版本。
然后,我们询问这些不同条件对自愿指点行为的影响是否会延伸到自动步行运动。为此,我们执行了与上述相同的协议,即使用节拍器,而参与者在房间里行走。在这种情况下,节拍的节拍被设置为 12 bpm。图 11显示了控件的 COM 轨迹,以及按 MDS-UPDRS 分数排列的 PWP 中位数。行走任务的随机分析结果如图12所示。
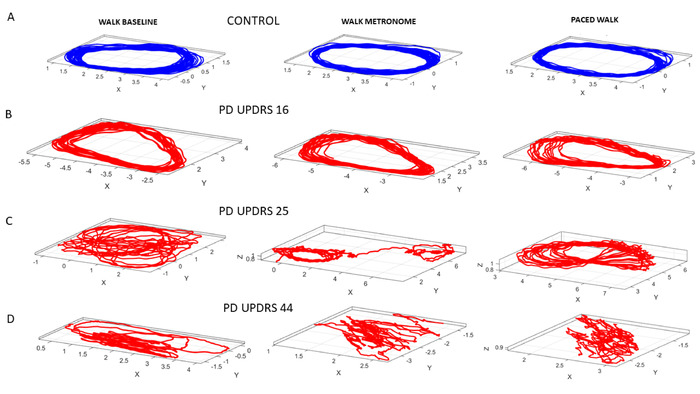
图11:动态数字评估三个具体的行走任务。步行任务,以确定速度振幅波动的噪声与信号比,该比例来自来自整个身体 17 个位置的 COM 的 3D 轨迹。(A) 控制参与者中 COM 的 3D 轨迹,而在自然行走过程中,人员来回走动(任务 13);在没有指示的情况下在节拍器面前行走,测量对节拍器节拍的自发包围(任务14);并按照指示(任务15)故意将呼吸速率调至节拍的节拍。(B) PWP 排名较低的 UPDRS 分数.(C) UPDRS 分数较高的 PWP 会降低 3D COM 轨迹。(D) PWP 与排名最高的 UPDRS 得分显示非常不安的 COM 轨迹.请点击此处查看此图的较大版本。
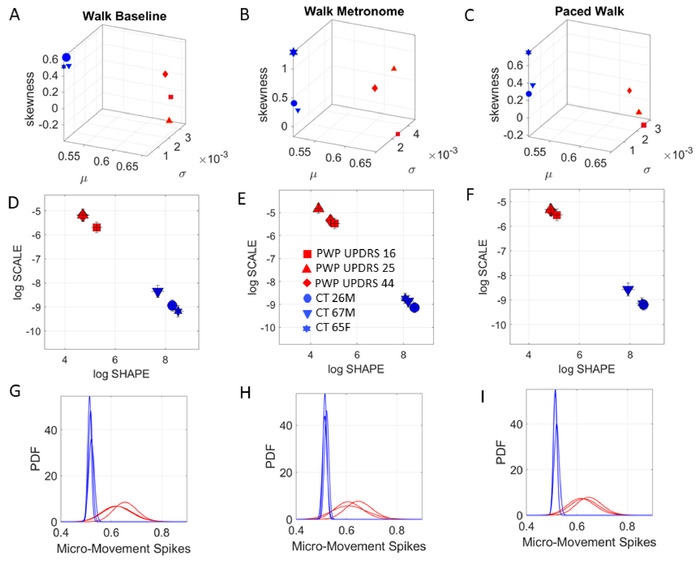
图12:行走时自发和训练物理的载客能力。MDS-UPDRS 信息数字生物标志物的步行任务。(A) 自然行走时PWP的分层与中值分数一致。(B) 大都会自发地改变随机签名.(C) 指示步速走向节拍的节拍再次改变签名.(D-F)Gamma 对数参数平面沿不同的 PDF 形状和比例(噪声与信号比)对组进行本地化,PWP 中具有更嘈杂和更多的随机波动。(G-I)根据上述 D-F 面板中代表的经验估计 PDF,跨越一个随上下文变化的家庭,其方式对每个人而言都是独一无二的。请点击此处查看此图的较大版本。
由于所有认知和记忆任务都可以在计算机的摄像头记录面部时执行,因此可以使用 OpenPose,这是一种开源机器学习软件,可供研究人员公开使用,并提取面部信息,可用于推断与情绪或情感内容相关的信息。通常,在PD中,面部表情会随着多巴胺消耗而减少,最终可能导致肌肉张力低下。在这里,Gamma 过程还可用于确定在给定任务期间最活跃的面部区域,或通过确定情绪之间的区域转换来探测情绪内容。图 13显示了在任务 16 和 17 期间使用参与者面部视频进行此类分析的示例。用于捕捉面部微运动的 70 个点与已知的三叉神经区域 V1 (29)、V2 (14)、V3 (27)8 (图 13A)对应,以评估,例如,在这种情况下,当从中性脸过渡到微笑。这种类型的分析可以系统地用于探索PD的其他非运动方面,包括抑郁症和社会一般沟通。
为了补偿不确定的相机变焦、自然人的运动和实际人脸大小,我们以下列方式对人脸进行规范化:假设摄像机是静止的,我们将每个面映射到具有 x_'、*= = 0 和单位方差的"单位面"。对于视频中的每个帧,我们规范化每个点 x' = x- x_ y= , 并通过给定帧的整体蒙版的方差缩放每个坐标,以实现每个蒙版的单位方差。然后,我们将时间序列中的每个点视为与前一个蒙版的偏差,因为我们假定在记录期间面不会塑性变形。结果是位置坐标的 70 通道时间序列 (图 13B)。从这些时间序列提升的位置和速度流中提取的速度振幅波动转换为彩信并输入伽玛过程,从而揭示 PDF 及其与情绪转换的变化(图 13C)。例如,在图13B中,从中性表达向微笑过渡似乎难以察觉,但随机偏移显示区域V2是最敏感、变化最大的PDF。
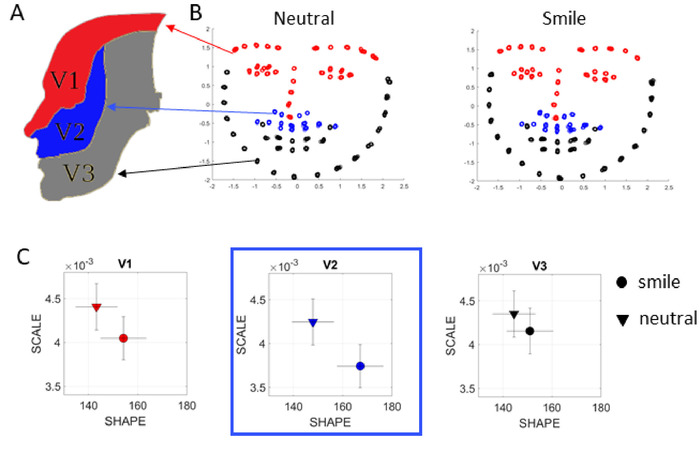
图 13:使用 OpenPose 捕获的视频数据进行情绪分析。(A) 面部区域根据三叉神经,携带一般体性纤维 (GSA)。这些纤维通过眼科 (V1)、上颌 (V2) 和下颌 (V3) 分部对面部皮肤进行内透,用于研究面部表情之间的过渡(中性与微笑)。(B) 使用商用摄像机拍摄的几分钟视频,可以使用 OpenPose 提取人脸信息,并根据 V1、V2、V3 区域(面板 A 中的颜色代码)在面部渲染 70 个点。然后,这些时间序列中的 MMS 被输入到 Gamma 过程,并且根据经验估计每个条件的比例和形状 Gamma 参数。(C) 分析显示,在这种情况下,V2 区域受从中性过渡到微笑的最大影响,对于这个特定的人,因为 PDF 的变化是最大的。请点击此处查看此图的较大版本。
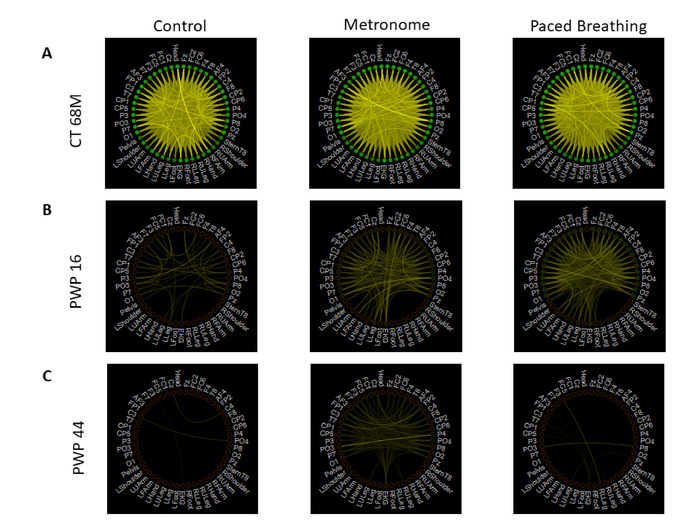
图14:使用加权非定向图形和信息理论方法,整合来自神经系统多层的数字生物物理信号。所有 EEG、运动(磁力计)和 EKG 信号之间的配对相互信息的网络连接。(A) 代表健康参与者在三个行走任务期间的连通性度量 - 任务 13 控制(左),任务 14 自发节拍器放置(中间)和任务 15 指示节奏呼吸(右)。每个节点表示单个传感器的信号;线的颜色表示 MI 的级别,其中较亮的颜色表示更高的连通性;节点颜色表示该传感器与所有其他传感器信号的平均 MI。色阶设置为所有任务和所有参与者的相同,并任意设置为具有最亮的颜色,以表示所有任务和参与者的最大 MI 值,并且在所有任务和参与者中具有最小 MI 值的最暗颜色s. 健康参与者的连接性显示大脑和身体节点之间最强的连接。(B) 具有 UPDRS 16 连接度量值的 PWP 与面板 A 中的原理图布局相同,其连接密度低于健康参与者的网络。(C) 具有 UPDRS 44 连接度量值的 PWP 与面板 A 中的原理图布局相同,显示了整个大脑和身体最稀疏的连接模式。请点击此处查看此图的较大版本。
接下来,我们确定这些生物节律传递的信息量。为此,我们使用 Shannon19开发的信息理论方法,使用每对传感器信号(即 EEG 传感器、运动传感器、ECG 传感器)之间的相互信息 (MI)。为此,我们从每种波形类型中获得了彩信幅。
两个传感器之间的 MI 通过引入另一个传感器信号的信息来评估一个传感器信号中降低的不确定度;当 MI 高时,这意味着两个信号高度连接,而低时则意味着两个信号大部分是独立的。具体而言,MI 的计算方式为:
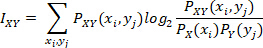
其中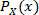 是信号 X 的值分布的规范化直方图值,是
是信号 X 的值分布的规范化直方图值,是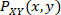 信号 X 和 Y 的值联合分布的规范化直方图值。采样箱设置为以 0.05 为增量,范围从 0.5 到最大振幅值。有关该公式的推导细节,可在许多有关信息理论的文献中找到,并应用于临床分析20、21。
信号 X 和 Y 的值联合分布的规范化直方图值。采样箱设置为以 0.05 为增量,范围从 0.5 到最大振幅值。有关该公式的推导细节,可在许多有关信息理论的文献中找到,并应用于临床分析20、21。
总体而言,健康参与者在三次行走任务中表现出更互联的网络,而患者参与者的关联性更稀疏,如图13所示。不仅通过网络传递信息,即从自感生物节律中产生相互信息的信息,在PWP中要低得多;更重要的是,不同疾病之间的MI传播模式存在根本差异,因患者而异。在这里,我们可以进一步利用网络分析的连接性指标来总结这些不断发展的网络的拓扑特征,并因此提供物理载带能力的其他指标,以及反映大脑、身体和心脏,当与节拍器相关的物理封闭发生时,与当它不发生。
讨论
这项工作引入了一种新的协议,使传统的临床试验与来自神经系统在进行此类测试时从生物物理信号输出的数字数据集成在一起。我们介绍 SPIBA 和 MMS 作为统一平台来组合不同类型的数据,例如来自铅笔和纸张观察方法的离散分数以及来自生物物理传感器的连续数字数据。这些方法使用PWP和年龄和性别匹配对照组进行说明,并辅之以额外的年轻对照作为理想的健康参考进行比较。我们表明,传统的临床试验(例如,那些可能是 MoCA 和 MDS-UPDRS 的一部分)可用于对队列进行排名,并自动从组分数的固有变异性中提取数据,这些信息在数字中分层领域根据临床定义的严重程度水平。这种水平与临床MDS-UPDRS水平和认知/记忆测试性能良好。然后,在另一个实施层,我们检查从中枢神经系统、PNS和ANS层利用的神经系统的生物节律,从而描述不同层次的自主和控制。我们提供样本数据和随机签名,从这些数据派生,通过光学临床标准检查。在这样的方法下,我们可以区分病人与健康的对照;并通过数字生物节律,在PWP内,根据临床确定的严重程度水平进行区分。
通过以这种方式使生物物理数字数据与临床标准保持一致,我们提供一套可解释的标准,可以更动态地跟踪结果中的个性化变化。我们采用这些新结果测量动态数字生物标志物,因为它们基于数字数据,但它们根据成熟和经过验证的临床标准提供可解释的结果。它们来自神经系统过程的时间序列,它们捕捉了这些过程的动态性质。特别是,我们能够同时使用电机和非电机标准。因此,我们可以开始量化PD的非运动方面,现在已知在运动症状恶化之前,这些症状已经定义了迄今为止的紊乱。例如,面部分析,如这里介绍的,可以用来检查在REM睡眠期间的自发面部微手势,以建立一系列可以预测运动活动恶化的清单。同样,我们可以使用这些方法检查日常活动中的疼痛程度,并评估它们与REM睡眠时间活动的潜在相关性。这一点很重要,因为REM睡眠和疼痛调节都已知在运动问题之前,后来定义PD 5,6,7严重程度。利用我们数字化的各种传统临床任务,其他非运动活动嵌入在临床任务用于探索认知和记忆能力的特点,和这些活动的索引映射到运动症状。这些方法适用于帕金森病的基础研究和临床实践。它们也可以扩展到神经系统的其他疾病。
除了面部运动输出外,在REM睡眠期间,我们可以在自我感应或运动性再生的框架下,在自然社交情况下检查面部手势,以测量患者大脑最有可能获得的反馈水平。在这里,尽管与三叉面区域 V1、V2、V3 相对应的面部区域中的微手势存在非常细微的差异,但有可能在代表性参与者中精确定位,面部的哪个区域最大地移动了在中性状态和自然微笑状态之间转换时,随机签名。这表明,使用SPIBA和彩信,我们将能够评估PD的其他非运动(感觉)方面与运动触觉通道的感官输入困难有关。这些已经发现在PD有问题,即使在紊乱的早期阶段24。因为感觉和电机是齐头并进的,这些信息可以帮助我们预测在这种疾病1,7的进展后期浮现出更明显的运动问题。我们认为,这些运动通道沿着面部的三叉体区域也可以帮助我们分离不同类型的疼痛调节,包括那些与睡眠改变5,6相关。
目前的方法提供了一种新的方法来检查从中央、外围和自主神经系统同时获得的生物物理信号,在不同的条件下需要不同的认知技能和不同的自主性,神经运动控制。使用 SPIBA 框架,在标准化彩信数据上应用随机分析和配对网络分析,也可以客观地描述认知活动的特征。本实验中使用的15项任务需要不同类型的认知技能(例如,视觉构造技能、视觉记忆、感知扫描技能)和不同程度的认知控制(例如,故意加快指向速度)速度,按照指示调整呼吸速率)。因此,在执行任务期间显示的生物物理信号的CNS-PNS-ANS信息传输的防病性和连接模式可用于描述不同级别的认知载荷及其对电机输出的影响。
在强调我们新的分析方法和协议的优点的同时,我们还指出了在采用同步数据收集记录平台时应考虑的注意事项和实际限制。这是因为在此设置中,有多个记录软件类型在一台计算机上流式传输以进行同步,要求计算机的计算能力很高,否则可能会导致数据丢失、计算机冻结和/或过量噪声。在当前设计中,两个流式处理软件(EEG 和运动捕获)和 LSL 在一台计算机上运行。因此,我们必须注意处理过载和可能的计算机冻结。这是我们使用 EEG 通道之一提取 ECG 信号的原因之一。具有更高内存容量和更快处理器的计算机可能能够处理单独的 ECG 软件,同时与脑电图和运动学传感器网格一起流式传输。这些问题在本质上是实用的,并且独立于我们提供的分析方法 (SPIBA) 和标准数据类型 (MMS)。然而,我们认为,在设计来自多个流的数据共同注册的协议之前,提醒最终用户需要评估计算能力非常重要。
我们指出的另一个警告是,协议中说明的 15 个任务是可用于开发动态数字生物标志物的子集。为了本文的目的,由于空间限制,我们仅限于几个任务,并选择了涉及不同级别的控制和身体运动的任务,实际上我们可以添加本文中未包括的其他任务。我们的目标是派生一小部分需要较少时间和精力的任务。事实上,在我们的实验室中,指向任务(任务 10-12)是一组任务,我们发现它们是描述生物节的随机特征的有效方法,这些特征因自愿控制和神经疾病(包括 PD)的不同水平而异24,30.
本研究所示的代表性结果是使用 SPIBA 方法从生物传感器波形和摄像机运动字幕派生的 MMS 数据集的一小部分。为了说明目的,我们检查了MMS的振幅,并侧重于从人COM派生的线性速度振幅的波动。COM 是来自我们共同注册的所有 17 个车身传感器网格的摘要信号。但是,我们可以将分析扩展到其他旋转参数,以及生成时间序列波动参数的其他动力学变量(例如,与面数据一样)。此外,由于空间限制,我们只说明了基于其头皮振幅信息的EEG数据分析,但我们也可以将这些分析应用于从源空间31派生的数据。对于所有数据模式,我们还可以检查峰值(而不是峰值振幅)之间的时间,这也生成时间序列。其他时间序列的参数可以从这样的波形派生,其MMS可以用来确定从网络构建32,33,34的内聚性和连接性。此外,这些分析也可以扩展到频域34。除了相互信息网络分析外,我们还可以专注于网络的其他拓扑特征,以区分 PWP 和控制,并分层 PWP。为了本文的目的,我们专注于这些分析作为工具的有用性,但通过这种类型的特征化,我们将获得知识,为这些分析工具提供的数字数据提供临床知识。
本研究中描述的当前方法有助于介绍 SPIBA 和 MMS 应用于临床和数字数据集成的许多可能方法。我们提供这种统一的平台、标准化的数据类型和实验协议,希望最终为临床标准的数字数据提供信息,同时将数字数据的精确性添加到传统的铅笔和纸面方法中。这种改进将 1) 能够更准确地跟踪症状变化,以回应治疗, 2) 增强对自然 PD 进展随时间变化的理解, 3) 促进 PD 症状呈现的分层(这可能决定独特的临床每个子组的建议)。因此,我们希望将这些方法应用于PD的进一步研究,同时也在临床应用中也看到有用性。使用手机等商业级设备,可以获取生物物理数据来执行本文中阐述的分析。目前,在更大规模地收集此类数字数据方面,如罗切斯特大学(https://parkinsonmpower.org)和卡格尔的mPower应用研究。事实上,使用这些开放访问数据存储库,我们能够从手机获得的加速度计数据中分层 PD 和正常老化个体,并自动对此处提供的临床试验中嵌入的活动进行分类35.
作为下一步,我们的目标是从更广泛的 PWP 总体及其匹配的对照参与者中收集更多数据,并在不同时间点记录这些数据,以便能够使用我们的方法执行横截面和纵向分析。我们预计,这些收集到的数字数据将比他们各部分的总和,真正实现神经学和精神病学中精密医学的原理。
披露声明
作者没有什么可透露的。
致谢
这项研究部分资金来自罗格斯发现信息学研究所对JR,罗格斯大学技术先进基金EBT和合资企业,新泽西州州长研究和治疗自闭症理事会对EBT和迈克尔J福克斯基金会对RD。
材料
| Name | Company | Catalog Number | Comments |
| Enobio 32 | NE Neuroelectrics | NE006WF | wearable, wireless electrophysiology sensor system for the recording of EEG. |
| Inking Pen | Wacom | KP1302 | tablet pen |
| Intuos Pro | Wacom | PTH451 | pen tablet |
| Lab Stream Layer System | n/a | n/a | open source software to synchronize different devices |
| Microphone | Zaffiro | B07BDFP6XC | computer microphone |
| MovAlyzeR | Neuroscript | Version 6.1.0.0. | pen movement caption software |
| MTw Awinda wireless motion tracker | Xsens | MTw Awinda | motion capture system |
| MVN Analyze | Xsens | Version 2019 | motion-tracking software |
| NIC 2.0 | NE Neuroelectrics | NE001SW2 | Neuroelectrics Instrument Controller (NIC) EEG streaming software |
| OpenPose | n/a | n/a | open source machine learning software to extract facial information |
参考文献
- Hawgood, S., Hook-Barnard, I. G., O'Brien, T. C., Yamamoto, K. R. Precision medicine: Beyond the inflection point. Science Translational Medicine. 7 (300), 300ps317 (2015).
- Torres, E. B., Whyatt, C. . Autism: The Movement Sensing Perspective. , (2018).
- Torres, E. B., et al. Toward Precision Psychiatry: Statistical Platform for the Personalized Characterization of Natural Behaviors. Frontiers in Neurology. 7, 8 (2016).
- Espay, A. J., et al. Technology in Parkinson's disease: Challenges and opportunities. Movement Disorders. 31 (9), 1272-1282 (2016).
- Ponsen, M. M., Stoffers, D., Wolters, E. C., Booij, J., Berendse, H. W. Olfactory testing combined with dopamine transporter imaging as a method to detect prodromal Parkinson's disease. Journal of Neurology, Neurosurgery & Psychiatry. 81 (4), 396-399 (2010).
- Ponsen, M. M., et al. Idiopathic hyposmia as a preclinical sign of Parkinson's disease. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society. 56 (2), 173-181 (2004).
- Oudre, L., Jakubowicz, J., Bianchi, P., Simon, C. Classification of periodic activities using the Wasserstein distance. IEEE Transactions on Biomedical Engineering. 59 (6), 1610-1619 (2012).
- Derkinderen, P., et al. Parkinson disease: the enteric nervous system spills its guts. Neurology. 77 (19), 1761-1767 (2011).
- Roetenberg, D., Luinge, H., Slycke, P. Xsens MVN: Full 6DOF human motion tracking using miniature inertial sensors. Xsens Motion Technologies BV, Tech. Rep. 1, (2009).
- Possin, K. L., Laluz, V. R., Alcantar, O. Z., Miller, B. L., Kramer, J. H. Distinct neuroanatomical substrates and cognitive mechanisms of figure copy performance in Alzheimer's disease and behavioral variant frontotemporal dementia. Neuropsychologia. 49 (1), 43-48 (2011).
- Army, U. Army individual test battery. Manual of Directions and Scoring. , (1944).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Beekly, D. L., et al. The National Alzheimer's Coordinating Center (NACC) database: the uniform data set. Alzheimer Disease & Associated Disorders. 21 (3), 249-258 (2007).
- Torres, E. B. . Objective Biometric Methods for the Diagnosis and Treatment of Nervous System Disorders. , (2018).
- Ryu, J., Torres, E. B. . Fourth International Symposium on Movement and Computing, MOCO'17. , 1-8 (2017).
- Torres, E. B., Donnellan, A. M. . Autism: The movement perspective. , (2015).
- Torres, E. B., Vero, J., Rai, R. Statistical Platform for Individualized Behavioral Analyses Using Biophysical Micro-Movement Spikes. Sensors (Basel). 18 (4), (2018).
- Torres, E. B., Denisova, K. Motor noise is rich signal in autism research and pharmacological treatments. Scientific Reports. 6, (2016).
- Shannon, C. A mathematical theory of communication. Bell System Technical Journal. 27, 379-423 (1948).
- Silverstein, S. M., Wibral, M., Phillips, W. A. Implications of information theory for computational modeling of schizophrenia. Computational Psychiatry. 1, 82-101 (2017).
- Jeong, J., Gore, J. C., Peterson, B. S. Mutual information analysis of the EEG in patients with Alzheimer's disease. Clinical Neurophysiology. 112 (5), 827-835 (2001).
- Torres, E. B., et al. Autism: the micro-movement perspective. Frontiers in Integrative Neuroscience. 7, 32 (2013).
- Von Holst, E., Mittelstaedt, H., Dodwell, P. C. . Perceptual Processing: Stimulus equivalence and pattern recognition. , 41-72 (1950).
- Torres, E. B., Cole, J., Poizner, H. Motor output variability, deafferentation, and putative deficits in kinesthetic reafference in Parkinson's disease. Frontiers in Human Neuroscience. 8, 823 (2014).
- Yanovich, P., Isenhower, R. W., Sage, J., Torres, E. B. Spatial-orientation priming impedes rather than facilitates the spontaneous control of hand-retraction speeds in patients with Parkinson's disease. PLoS One. 8 (7), e66757 (2013).
- Torres, E. B. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson's disease. Frontiers in Integrative Neuroscience. 7, 50 (2013).
- Torres, E. B., Heilman, K. M., Poizner, H. Impaired endogenously evoked automated reaching in Parkinson's disease. Journal of Neuroscience. 31 (49), 17848-17863 (2011).
- Nguyen, J., Majmudar, U., Papathomas, T. V., Silverstein, S. M., Torres, E. B. Schizophrenia: The micro-movements perspective. Neuropsychologia. 85, 310-326 (2016).
- Torres, E. B. Atypical signatures of motor variability found in an individual with ASD. Neurocase. 19 (2), 150-165 (2013).
- Torres, E. B. Signatures of movement variability anticipate hand speed according to levels of intent. Behavioral Brain Functions. 9, 10 (2013).
- Lai, M., Demuru, M., Hillebrand, A., Fraschini, M. A comparison between scalp-and source-reconstructed EEG networks. Scientific Reports. 8 (1), 12269 (2018).
- Sporns, O. . Networks of the Brain. , (2010).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: uses and interpretations. Neuroimage. 52 (3), 1059-1069 (2010).
- Kalampratsidou, V., Torres, E. B. Peripheral Network Connectivity Analyses for the Real-Time Tracking of Coupled Bodies in Motion. Sensors (Basel). 18 (9), 3117 (2018).
- Torres, E. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson's disease. Frontiers in Integrative Neuroscience. 7 (50), (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。