Method Article
パーキンソン病における運動と認知機能の動的デジタルバイオマーカー
要約
このプロトコルは、パーキンソン病の認知と運動制御を測定するために一般的に使用される従来の臨床タスクの一部のデジタル化を提供します。臨床タスクはデジタル化され、生物物理学のリズムは、自発的、自発的、自動、自律神経に至るまで、神経系の異なる機能レベルから共登録されます。
要約
パーキンソン病(PD)は異種疾患であり、ケアを最適化するためには個別化医療が本当に必要です。現在の形では、紙と鉛筆の症状-疾患の進行を追跡するために伝統的に使用される尺度の基準スコアは、途方もない症状に直面して、検討中の臨床現象の粒度を捕捉するには粗すぎる(離散的)。多様 性。このため、センサー、ウェアラブル、モバイルデバイスは、ますますPD研究や日常的なケアに組み込まれています。これらのデジタルメジャーは、従来のメジャーよりも標準化され解釈しにくいデータをより正確に生成しますが、その結果、2 種類のデータは大きくサイロ化されたままです。これらの問題の両方は、分野の最も精密な評価ツールの広範な臨床応用への障壁を提示する。このプロトコルは、両方の問題を解決します。従来のタスクを使用して認知と運動制御を測定し、参加者をテストし、ウェアラブルを使用して目立たない生物物理信号を同時登録します。その後、従来の紙と鉛筆の方法のスコアを、継続的に登録するデジタルデータと統合します。私たちは、新しい標準化されたデータ型と統一された統計プラットフォームを提供し、異なる状態下で人の確率的シグネチャの変化を動的に追跡し、神経運動制御の異なる機能レベルをプローブすることができます。自律神経に自発的に。プロトコルと標準化された統計フレームワークは、検証された臨床スケールに対応するPDの物理的および認知機能の動的なデジタルバイオマーカーを提供し、その精度を大幅に向上させます。
概要
精密医療(PM)(図1)は、パーソナライズされた標的治療法を開発するための強力なプラットフォームとして登場しました。がん研究の分野では、このモデルは非常に成功しており、その理念は、近い将来に医療分野に革命を起こすに違いありません1.PMは、患者の自己報告からゲノムに至るまで、複数の知識層を組み合わせたものです。これらすべての層に情報を統合すると、パーソナライズされた評価が行われ、データの解釈が可能になり、人の生活のあらゆる側面を考慮することを目的としたより正確な治療勧告が可能になります。
神経系2、3の神経精神疾患にPMプラットフォームを適応させようとすると、いくつかの課題があり、これらの課題は最近4を表明しています。その中には、取得されたデータの不一致、すなわち観察によって導かれる臨床鉛筆と紙の方法からの離散的なスコア、および神経系出力から物理的に取得された連続的な生体物理学データ(例えば、バイオセンサーを使用)があります。臨床スコアからのデータは、単一の(理論的な)確率分布関数(PDF)を強制するすべての静的モデルに1サイズ適合すると仮定する傾向があります。規範的なデータが最初に取得され、特徴付けられていないため、これは、適切な経験的検証なしでデータに課される事前の仮定です。したがって、健康な人が年齢を取り、これらのパラメータ変動をキャストするために使用される確率空間がある程度変化するにつれて、ヒト神経系の神経典型的な合体状態を記述する適切な類似性メトリックベースの基準はありません。規範的なデータと適切な類似性メトリックがなければ、一般的な状態からの逸脱を測定することは不可能です。また、今後の変更の感覚的な結果を予測することもできません。
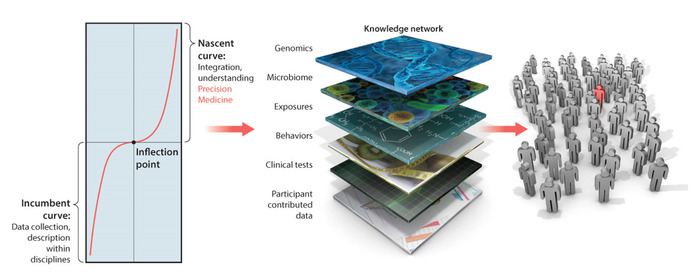
図1:精密医療プラットフォーム:行動とゲノミクスのギャップを埋め、神経系の神経学的および神経精神疾患に翻訳された個別化医療における標的治療開発を可能にする。パーソナライズされた標的治療の開発のための精密医療プラットフォームは、神経系の神経および神経精神疾患を診断し、治療するために翻訳することができます。しかし、ナレッジネットワークでは、行動分析の層は、生物物理学データから新たに出現するデジタル成果をより従来の臨床基準と統合するためのパラダイムシフトを必要としています。今後の課題は、このような統合のための統計的に健全な方法と新しい直感的な視覚化ツールを提供すると同時に、臨床医、患者、介護者によるデジタル結果対策の使用を奨励することです。この数字は、米国科学振興協会の許可を受けて、Hawgoodら1から変更されました。この図のより大きなバージョンを表示するには、ここをクリックしてください。
現在の「グランド・平均化」アプローチは、データ内の個人の確率的変動、すなわち、自然に年齢を表す信号変動、障害の進行に伴う信号変動、および人の神経系としてのノイズとして滑らかになります。治療を受け、対応します。規範的なデータの欠如(すなわち、健康な集団の大きな断面および縦方向の部分を評価する)は、健康な老化の神経典型的なダイナミクスを理解するのを妨げる。したがって、病理学が個人に体系的に現れ始めるので、特定の病理の結果をより一般的に予測する方法を知ることが課題になります。予測アプローチは、変性プロセスを遅くする再生療法や神経保護療法を設計するために重要です。パーキンソン病は、障害の症状が他の多くの測定可能な症状に先行する病理の良い例です。我々は今日、目に見える運動障害が、嗅覚機能5、6の減少、音声パターンの変化、急速眼球運動(REM)睡眠7、およびその他の非運動などの目に見えない感覚的な問題に先行していることを知っている。腸神経系の機能に関連する症状8.障害が現れるまでに, システムに既に高いドーパミン作動性枯渇があります。;しかし、非運動症状は、現在主に評価されている目に見える運動障害の一部を予測することができた。
現在の分析モデルを変更し、神経系のすべてのレベルにわたって経験的データを適切に特徴付ける重要性を考慮する必要があり、それによって生体リズム運動が現れ、時系列の形で動的に利用することができる多数のセンサーと共に登録されています。より一般的な意味でのモーションデータは、動きや放送する障害に限定されるべきではありません。神経系のすべてのバイオリズム(非運動波形を含む)からのデジタルデータは、急速な神経変性を予防または遅くするために我々が助ける必要があるかもしれない予測の可能性を提供します。しかし、データ型のレパートリーを補強するにつれて、現在使用されている統計的推論と解釈のためのパラメトリック線形モデルの本質的な仮定を避ける必要があります。確率的なシフトや動的変化の対象となる神経系病理で研究する非常に非線形問題のタイプに対して、このような線形モデルの妥当性を評価することが重要です。現在の仮定分析パイプラインループの注意点は、個別の臨床スコアと連続的なデジタル生物物理波形からのデータタイプの両方に存在します。切断されたままでは、患者による新しいデジタル技術の使用を容易にするために、デジタル結果を臨床基準に合わせる方法で、両方のタイプのデータを適切に統合できる新しいフレームワークを設計することが重要です。介護者や臨床医。
これらの課題のいくつかを克服するために、我々は最近、神経学的および神経精神的条件3のための精密表現型を提供するために図1のPMプラットフォームを適応させました。そのために、認知現象と運動現象の複雑な関係を確認する従来の臨床スコアリングテストと連携して、行動データを収集、分析、解釈する新しい方法を設計しました。より正確には、鉛筆と紙の方法をデジタル化しました。このような方法のみからのデータは、肉眼から逃れる重要な情報をキャプチャするにはあまりにも粗すぎます。しかし、生体物理センサからのデジタルデータと組み合わせて使用することで、新しいデジタル技術と臨床基準を結び付け、近い将来に臨床医に採用を促す新しい手段が提供されます。
ここでは、臨床評価の文脈におけるデジタルデータの利用について紹介する。すなわち、人が臨床タスクを実行するように、例えば、モントリオール認知評価(MoCA)テストで時計を描く、神経系によって出力されるバイオリズムは、異なる機能層間で共登録される。これには、脳波検査(EEG)、心電図(ECGまたはEKG)、身体からの音声パターンと運動学、および人がデジタル化されたタブレット上で時計を描くために使用する手持ち型ペンからの運動学的出力が含まれます。また、人が描く顔からビデオデータを収集し、感情状態の予測を行います。これらのデータは、個別化行動分析(SPIBA)のための新しい統計プラットフォームの光学を通じて分析され、そのようなテストの基礎となる臨床基準に従って解釈されます。より具体的には、離散スコアは、患者のコホートを中央値にランク付けするために使用され、このようにして、その臨床基準に基づいてグループを階層化する。次に、同定されたグループの連続的な生物物理学データを調べ、患者の1つのサブセットを複数のパラメトリック次元にわたって根本的に分離するデジタル駆動の確率的基準を探します。また、連続的な生物理データを独自に調べることにより、コホート内の各人の固有の変動に応えり、臨床基準から盲目に見なすことで、そのようなクラスターが、臨床基準によって知らされたサブタイプが明らかにしたクラスターにどの程度マッピングされるか。
このアプローチは、膨大な生物物理デジタルデータ内のパラメータを識別する新しい方法を提供し、最も効果的にサブタイプ間の違いをキャプチャし、パーキンソン病患者を階層化するための潜在的に良い候補としてそれらの違いをレンダリングしますブラインドにおける疾患(PWP)、すなわち、一般集団からのランダムな引き出しを横切る。この方法の関連性は 2 つあります。バイオセンサーや臨床基準から異なるデータ型を適切に統合しながら、治療を真にパーソナライズすることができます。すなわち、時系列の形で連続的なデジタル生物物理学データ、および従来のテストから離散的な臨床スコア。
これは一般的なアプローチであり、神経系のすべての障害に適用されますが、我々はPWPの文脈の中で作業をフレーム化し、そのようなパフォーマンスの間に共同登録された連続的なデジタルデータに関する統計的推論を行う新しい方法を提供します。離散的な臨床スコアリングシステムを考慮した臨床検査。そのように、仕事は臨床設定で使用することを可能にするデジタル結果の臨床解釈を可能にする。最後に、患者、介護者、臨床担当者が家庭や臨床の設定で使いやすいように、このような個々の結果を視覚化する新しい方法の設計を開始するための推奨事項を提供します。
プロトコル
ここに記載されているすべての方法は、ラトガース大学機関審査委員会によって承認されています.
1. 参加者と取得システムの設定
- 参加者からインフォームド・コンセントを取得する。
注:参加者はパーキンソン病と診断されるべきか、または健康なコントロール参加者として機能する神経障害と診断されるべきではありません。健康な参加者は、性別と年齢が患者参加者に一致している必要があります。すべての参加者は、5分間連続して歩くモビリティを持っている必要があります。 - 参加者の体の寸法(体の高さ、足の長さ、腕のスパン、足首の高さ、ヒップの高さ、ヒップの幅、膝の高さ、肩幅、肩の高さ)図 2A)後でモーション キャプチャ システムで自分のボディ アバターを作成します。
注:この情報は、参加者の身体の位置データを正確に記録するためにモーションキャプチャシステムで使用されます。 - 17のワイヤレスモーショントラッキングセンサーとモーショントラッキングソフトウェアを含むモーションキャプチャシステムを設定します。
- 次の身体部分にセンサーを配置:頭部、胸骨、骨盤、右上腕、右上腕、右下腕、右手、左肩、左上腕、左下腕、左上腕、右上脚、右下肢、右下肢、左上脚、左下肢、左下肢足 (図 2B)目立たないように、ストラップバンドでこれらのセンサーを固定します。
- すべてのセンサーが適切な場所に配置されたら、参加者の位置を調整してアバターを作成します。
注:キャリブレーション方法の詳細は、ローテンベルクら9.
- 脳波デバイスと脳波記録ソフトウェアをセットアップします。
- 頭皮と記録装置を横切って31のセンサーを参加者の頭の後ろに置きます。次の場所にチャネルセンサーを配置: P7, P4, Cz, Pz, P3, P8, O1, O2, T8, F8, C4, F4, Fp2, Fz, F3, F3, F3, Fp1, T7, F7, PO4, FC6, FC2,AF4, CP6, CP2, CP1, CP1, FC1, FC1, 2
- 残りのチャネルセンサー(Oz)をコネクタに取り付け、参加者の左側の胃に接続されたセンサーを配置して心臓信号を測定します(図2C)。
- 参加者の左耳の後ろに2つのリファレンスチャンネルセンサーを取り付け、注射器を使用してEEGキャップのセンサーに電極ゲルを挿入します(図2C)。
- 完了したら、安定するまで数分間、記録ソフトウェア上の電気活動のストリーミングを開始します。
注:図2Dは、中枢神経系(CNS)および自律神経系(ANS)から利用された脳波信号からのサンプルトレースを示しています。
- 参加者の声をキャプチャするためにマイクを設定します。マイクを参加者の前に置き、ラボ ストリーム 層 (LSL) が実行されているコンピュータに接続します (下の LSL を参照)(図2E)。
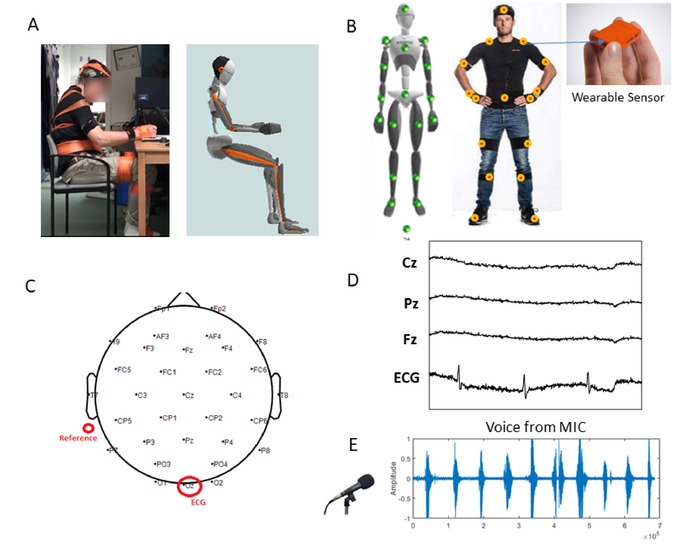
図 2:目立たないワイヤレスウェアラブルバイオセンサーから複数の波形を統合しながら、従来の臨床試験をデジタル化するように設定します。(A) 描画タスクの設定:収集されるキネマティクスからリアルタイムでレンダリングされた目立たないウェアラブルセンサーとアバターを身に着けている実際の患者。(B) モーションデータが本体全体で同期的に登録される小型で軽量なモーショントラッキングセンサー(60 Hz)のセンサー位置。(C) EEGマップと参照場所。(D) Ozリードから抽出された31の鉛および心信号からのサンプル脳波形。(E) カウントタスク中に参加者の声から波形をサンプルします。この図のより大きなバージョンを表示するには、ここをクリックしてください。
- マウスクリックタイムスタンプと共に、EEG、モーション、およびオーディオ信号のストリームを同期する LSL システムを設定します (図 3A)。
- ラボ レコーダー アプリを開きます。
- マウス用のLSLアプリを開き、社内で構築されたXsens同期アプリを開き、「ストリームから記録」セクションの「マウスボタンとトラッカーキネマティクス」チェックボックスをオンにして、ラボレコーダーアプリにリンクします。
注: マウス アプリは、実験中にイベントにタイムスタンプを設定するために使用されます。 - 「オーディオキャプチャーウィン」、LSL-EEG、[ストリームからの録音]セクションの位置をオンにして、脳波、モーション、およびオーディオストリームをラボレコーダーアプリにリンクします。
注:LSLシステムは、時間同期を処理する研究実験で測定時系列を統一的に収集し、ネットワークとリアルタイムアクセス、データの一元的な収集、表示、ディスク記録を可能にします。このプロトコルの文脈では、LSLシステムは、人が自然に伝統的な臨床タスクを実行するように、CNS、末梢神経系(PNS)およびANSから同期的にストリーミングします。
- ペンタブレットや動き解析ソフト(図3B)など、ペンの動きの記録を設定します。
- 描画タブレットとタブレット ペンを参加者の前に置きます。
- 動き解析ソフトウェアが記録されるコンピュータにタブレットを接続します。
- タブレットに白い用紙を置き、テープで固定します。
注: 事前に用紙を準備して、参加者が描画するスペースを示すボックスを表示します。
- 録画を開始します。
- LSL、モーションキャプチャソフトウェア、およびEEG記録ソフトウェアのプレスレコード。
- 各タスクの開始時と終了時に、モーションキャプチャソフトウェアのタイムスタンプボタンを押してマウスをクリックしてタイムスタンプを押します。
注: この方法では、タイムスタンプは LSL ストリーム データとモーション キャプチャ データの両方に記録されます。これにより、記録中にタイムスタンプ機能の 1 つが失敗した場合に、バックアップ タイムスタンプが確実に作成されます。
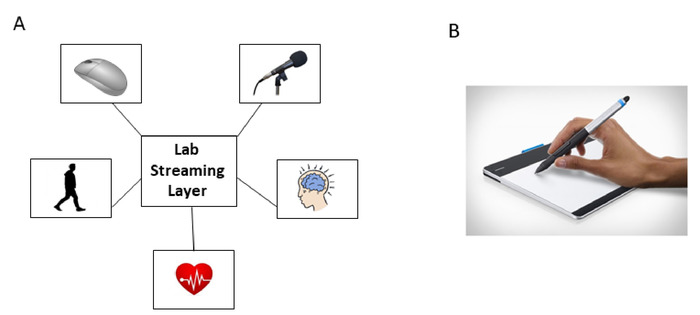
図 3:共通の中央処理装置のラボストリーム層(LSL)システムによる信号のデジタル化と同期。(A) LSLシステムは、マウスクリックによるモーション(PNS)、EEG(CNS)、ECG(ANS)、音声およびタイムスタンプの同時登録を同期的に可能にします。(B) 標準化された認知テストからの描画タスク中に、ペン先のデジタル化されたタブレットとペン記録キネマティクス(位置)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
2. 実験手順
- タスク1 —ベンソン・コンプレックス・フィギュア・コピー(即時)10(1分)を実行します。
- 参加者にベンソンの図を紙にコピーし、後でメモリからもう一度引き出す必要があるため、デザインを覚えておくことを参加者に指示します。
注:このテストは、参加者のvisuo構造および視覚記憶機能を評価するように設計されています (図 4A).
- 参加者にベンソンの図を紙にコピーし、後でメモリからもう一度引き出す必要があるため、デザインを覚えておくことを参加者に指示します。
- タスク 2 および 3 — テスト パート A (3 分) を行うトレイル。
- 昇順に番号が付いた円の間に線を引くよう参加者に指示します。
注: このセクションには、最初の (タスク 2) がサンプル テスト (8 つの数値で構成される) を完了し、次の (タスク 3) が実際のテストを完了する (25 個の数値からなる) 2 つのタスクがあります。このテストは、陸軍個別試験バッテリー11の構成要素であり、処理速度と執行機能を評価し、ビズモーターおよび知覚スキャンスキルに依存します(図4B)。
- 昇順に番号が付いた円の間に線を引くよう参加者に指示します。
- タスク 4 および 5 — トレイルメイキング テスト パート B (5 分) を実行します。
- 数字と文字を交互に昇順に、数字または文字を含む円の間に線を引くよう参加者に指示します。たとえば、シーケンスは A から 1 です。1 から B;B から 2;2~ C.
注: このセクションには、最初の (タスク 4) がサンプル テストを完了する (4 つの数字と 4 文字で構成される) 2 つのタスクがあり、次の (タスク 5) は実際のテストを完了することです (13 の数字と 12 文字で構成されます)。トレイルメイキングテストパートBは、トレイルメイキングテストパートAに似ていますが、参加者が数字セットからレターセットに移行するにつれて、より認知的な柔軟性が必要になります。(図4B)。
- 数字と文字を交互に昇順に、数字または文字を含む円の間に線を引くよう参加者に指示します。たとえば、シーケンスは A から 1 です。1 から B;B から 2;2~ C.
- タスク 6 — クロック描画 (1 分) を実行します。
- 参加者に対して、番号1から12のアナログ時計を描き、時間を10時を過ぎて11に設定するように指示します。
注:このテストはMoCA12の一部であり、参加者のビスオ建設スキルを評価します。(図4C)。
- 参加者に対して、番号1から12のアナログ時計を描き、時間を10時を過ぎて11に設定するように指示します。
- タスク7 —ベンソン・コンプレックス・フィギュア・コピー(遅延)10(1分)を実施する。
- 参加者に、ベンソンの複雑な人物を白紙の紙に記憶から引き出するよう指示する。
注:このテストは、参加者のvisuo構造および視覚記憶機能を評価します。(図4A)。
- 参加者に、ベンソンの複雑な人物を白紙の紙に記憶から引き出するよう指示する。
- タスク 8 および 9 — 数値スパン テスト (前方および後方)13 (10 分) を実行します。
- 実験者が大声で読み上げる数字を繰り返すように参加者に指示します。
- タスク 8 (順方向) の場合は、参加者に同じ順序で数値を繰り返すように指示し、タスク 9 (逆方向) で逆の順序で繰り返すように指示します。どちらの検定にも、フォワードの場合は3~9桁、後方検定では2~8桁のシーケンス長に2つのトライアルがあります。同じ長さの 2 つの数値文字列が失敗するまでテストを続行します。
注: どちらのテストも情報を一時的に保持する容量を測定しますが、後方テスト (タスク 9) では、数値を操作してシーケンスを逆にする機能も測定します。したがって、本プロトコルの文脈において、このタスクは、音声バイオリズム出力に関連してメモリおよび認知成分を測定する。
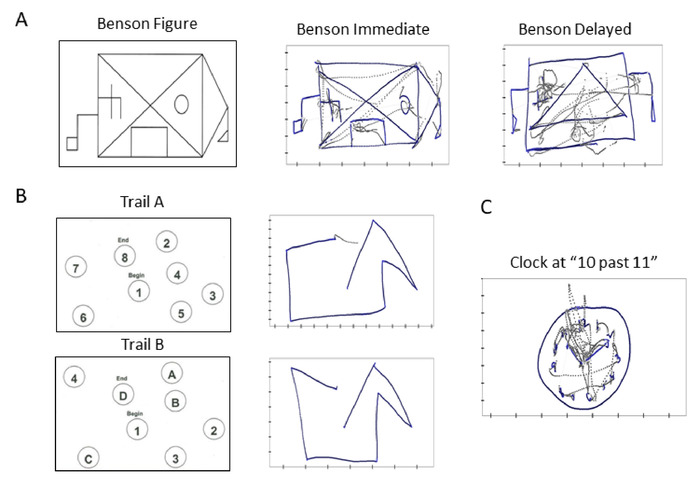
図4:臨床的に情報を得たデジタルバイオマーカーとスコアリングカード:臨床基準とデジタル生物物理データの統合を可能にする従来の臨床検査のデジタル化。標準化された認知テストからのサンプルトレース。(A) ベンソン複合体図は、すぐに再現するために参加者に提供された(中央)、またはメモリから10分の遅延後(右)。(B) トレイル 昇順の行で接続する数値を含むタスク (上)、および文字と数字の交互に行われる Trail B タスク (下)。(C) 11時を過ぎて10時に設定する指示を持つ時計を描画します。すべてのサンプル トレースでは、描画タスク中のペン リフトの軌跡を灰色の線で表し、青い線は実際のペン図面を表します。分析のために、我々は両方のタイプの軌道を調べる。この図のより大きなバージョンを表示するには、ここをクリックしてください。
- タスク 10、11、および 12 — ポインティング (10 分) を実行します。
- ターゲットを参加者の前に配置して、ポイントとタッチを行います。
- タスク10(制御)の場合、参加者に対し、支配的な手で自己ペースで目標を40回指し付ける。
- タスク11(メトロノーム)の場合、参加者に自己ペースでターゲットを40回指し、メトロノームビートをバックグラウンドで35bpmに設定するが、メトロノームビートについて何も指示しないように指示する。
- タスク12(ペースポインティング)の場合、35 bpmに設定されたメトロノームビートに続くペースで目標を40回指し示するように参加者に指示する。
注:ポインティングタスクは、意図的に(前方の動き、手が手が目標に達するまでの手が休息している時から)、自発的な(後方の動き、手がターゲットに触れる時から、ターゲットに触れるまで)によって参加者の動きを分離することができます。手は、その休止位置に戻って到達し、それによって参加者が自発的な制御(意図的な動き)を行使しているとき、および参加者がほとんど制御(自発的な動き)を行使しているときの生物物理信号を分析する(図5A)).メトロノームビートを導入し、参加者がメトロノームビートを指すペースを持つことを参加者に要求することで、参加者が自己ペースで動いているときや参加者が積極的に制御しているときに、外部ビートへの移動ペース。
- 13,14,15 —ウォーキング(25分)を行う。
- 参加者に3つの異なる条件の下で5分間自然に歩くように指示します。
- タスク13(制御)の場合は、参加者に部屋の周りを自然に歩くように指示する。
- タスク14(メトロノーム)の場合、12 bpmのバックグラウンドで打つメトロノームを設定しながら、参加者に部屋の周りを自然に歩くように指示します。
- タスク15(ペース呼吸)の場合、参加者に12bpmに設定されたメトロノームビートに呼吸数をペースしながら、部屋の周りを自然に歩くように指示します。
注:メトロノームビートを導入することにより、参加者が全身を使用して自己ペースで呼吸し、参加者が積極的に呼吸ペースを制御している間に、生物物理信号を比較することができます(通常は本体全体を移動しながら自動的に発生します(図5B)。
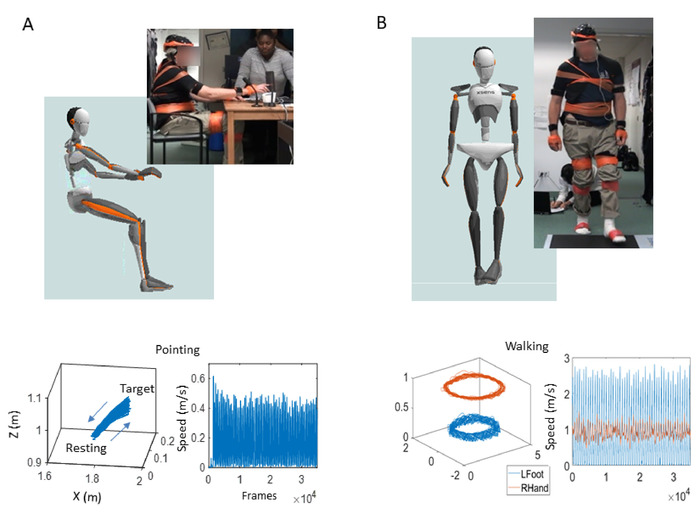
図5:立体(3D)軌道とその速度振幅時系列出力は、上半身の自発的な動きの間に出力されます。運動障害学会の運動性振戦タスクのバージョンを使用して自発的制御をプローブする目標指向の指摘行動 – 統一パーキンソン病評価尺度 (MDS-UPDRS).(A) 上半身を演じる座り位置の参加者とアバター、ゴール指向のポインティングタスク(上)前方(ターゲットへ)と後方(休止位置へ)の3D位置軌道(左下)の動き。線形速度ベクトルフロー(右下)に由来する速度振幅(m/s)とピーク間間隔タイミング(ms)の時系列の変動を示す対応する線形速度プロファイル。(B) ウォーキングタスクの参加者とアバター(上)異なるボディパーツ(左下)と対応する速度プロファイル(右下)の3D位置軌道。この図のより大きなバージョンを表示するには、ここをクリックしてください。
- タスク 16 と 17 — フェイス ビデオ (10 分) を実行します。
- 参加者に快適に座るように指示し、参加者の前にカメラを設置します。
- タスク16(制御)の場合、参加者に5分間刺激のない空間をじっと見つめる。
- タスク17(笑顔)の場合は、参加者に面白いビデオを5分間見るように指示します。
注: セットアップには約 30 分かかり、プロトコル全体の所要時間は約 60 分、PWP の場合はさらに 10 分かかります。
結果
関心のあるパラメータ
人の神経系によって生成される生物物理デジタル信号の軌道から抽出できる運動パラメータはたくさんあります。ここでは、脳波脳波形(中枢神経系の代表、CNS出力)、身体の動き(末梢神経系の代表、PNS出力)、心臓信号(自律神経の代表)に焦点を当てます。神経系、ANS出力)。
CNSおよびANS関連信号では、EEG波形とECG波形(μV)のピーク振幅の変動を、ユニットレス(標準化)マイクロムーブメントスパイク(MMS)に変換します(以下参照)。PNS関連信号では、質量中心(COM)とその速度プロファイルの時系列(m/s)の軌道を使用して、対応するユニットレスMMSを導出します。MMS を収集したら、センサーと神経系機能のレベルにわたるペアワイズ信号分析のセットに基づいて、重み付けされた非指向グラフに統合できます。このステップでは、結合された信号でネットワーク接続解析を使用できます。次に、自己出現型ネットワークトポロジの変化を示す解釈可能なグラフ14,15を生成します。特に、これらのグラフを3つのポインティングタスクとウォーキングタスクで比較すると、バイオフィジカル信号が受動的な方法(すなわち、メトロノームが自発的にバイオリズムを巻き込むとき)で外部リズムにどのように反応するかを観察することができます。アクティブな方法(すなわち、参加者が意図的にメトロノームビートに手を向けるか、または歩行運動をペースにしようとする場合)。また、CNS、PNS、および ANS レベルの機能を表すネットワーク ノード間の情報伝送のパターンについても学習できます。
生物物理信号の多機能層からのMMSの確率解析
全身のセンサーのウェアラブルグリッドから利用される生体物理信号は、振幅とタイミングが異なるピークと谷の時系列を生み出します。これらの生物物理信号16のMMSは、ピークの振幅とタイミングの変動であり、それによって振幅は実際の[0,1]間隔の単位のない値に正規化され、したがって、からの信号間の統合と比較を可能にする。神経系の異なる機能層:CNS、PNSおよびANS。機能のこれらの異なる層は、神経運動制御の異なるレベルを必要とし、個人間で異なる振幅範囲を持っています。また、ピーク間隔のタイミングも異なります。MMS 正規化は元のピークのタイミングを節約しますが、振幅の変動もキャプチャします。このような正規化は、各ローカルピーク振幅をピーク振幅の合計と、ピークを囲む 2 つの隣接するローカル ミニマ内でサンプリングされた信号の平均で割ることによって得られます。
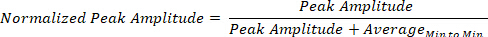
[0,1]の実数間隔のこれらの連続的なスパイクは、タイミングと振幅の変動に関する情報を保持し、時系列をランダムなプロセスとして扱うことを可能にします。次に、ポアソンランダムプロセスの一般的なルーブリックの下でガンマプロセスを採用し、一般的にバイナリスパイクを分析するために計算神経科学の分野で使用されます。
これらの分析方法は、詳細に3、14、17、18の他の場所で説明されており、分析パイプラインの説明と臨床を支援するための提案された可視化の図6を参照してください。解釈。ここでは、MMS波形から経験的に推定するガンマPDFの形状とスケールパラメータにまたがるガンマパラメータ平面を使用します。また、対応するガンマモーメントの点を4次元グラフ上にプロットし、平均、分散、歪度が3次元に及び、尖度は、その人の確率を示すために使用するマーカーのサイズで表されます。署名。
各タスクについて、生物物理学時系列から導き出されたMMSピークデータが収集され、各ガンマパラメータに対して95%の信頼区間を持つ最大尤度推定(MLE)を使用してガンマPDFに適合します。分散を示すスケール(ノイズ対信号比)。したがって、我々は高い信頼を持って、これらのタスクが要求する機能の異なるレベルにわたって人の神経系のバイオリズムの変動をキャプチャするPDFの最高の連続ファミリーを推定します。これらの機能的層は、高レベルの抽象的な認知能力と記憶能力から、自発的な神経運動制御および目標指向のタスクから派生した自発的な結果的な動きに及ぶ。また、自動モーションと、メトロノームの毎分のビートを使用した物理的なエントレインのためのシステムの能力も調べます。
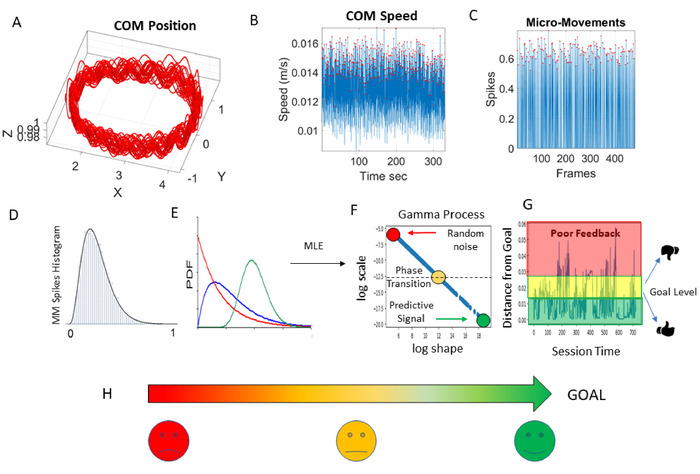
図6:動的デジタルバイオマーカーの開発のための統計分析パイプラインと、将来のアプリケーション(APP)開発への応用(A) 人が歩き回っている間の質量(COM)3D位置軌道。(B) 振幅のピークが赤い点で強調表示された COM の速度変動。(C) [0,1] 実値間隔における COM 速度ピーク (赤い点) の変動から MMS を標準化しました。(D) MMSピークの周波数ヒストグラム(MMSの赤い点)。(E) 確率密度関数(PDF) 時間の経過に伴って進化する周波数ヒストグラムを、メモリの少ない、最もランダムで指数関数的な分布(赤)から、いくつかの遷移歪んだ分布(青)、低いガウス(予測)に合わせる分散(GOAL、緑色の円)。この理想的な分布(緑)は若いアスリートに現れ、予測的、高い信号対雑音比の場合の目標を設定します。(F) 経験的データに最適な PDF (95% の信頼度) を適合させるために使用される最大尤度推定 (MLE) 。結果のパラメータ値は、COM 速度の変動から進化する確率的シグネチャ (ガンマ プロセス) をガンマ パラメータ平面に局在化します。ガウス);「ログスケール」は、脳(最も可能性が高い)が22、23を得る運動性フィードバックのタイプを意味するノイズ対信号比(分散)である。色は、時間の経過と同時に動的に進化する確率的状態を表します。(G) 確率距離(ワッサーシュタインメートル距離7)は、ニューロタイプに見られる低ノイズ対信号比(低分散)と高い予測可能性(対称分布)の理想的なGOALから。より高度なPDで見られる貧弱なフィードバック(ランダムノイズ)から離れて、聴覚障害者患者24、25、26、27、統合失調症28および自閉症の個人3,18歳,22歳,29.(H) 時間的に進化するこれらの確率的状態を表す簡略化された可視化は、形状とスケールパラメータの間の力法関係に基づいている。将来のアプリ開発のためのこのようなビジュアルは、評価と治療計画の精度を向上させるために、PWPとヘルスケアチームにリアルタイムで、理解しやすい、臨床フィードバックを提供することができます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
異なるデータモードの結果
本稿では、表1に示す人口統計を用いて、3つのPWPと3つの健全な参加者のデータを調べた。3つのPWPは、我々が記録した10 PWPから選ばれ、軽度のPD(統一パーキンソン病評価尺度[UPDRS]スコア16)、中等度症例(UPDRSスコア25)、および重症例(UPDRSスコア44)を有する症例を表す。年齢と性別のPWPに最も近いように、2人の健康な参加者は、私たちが記録した15人の健康な個人から選ばれました。1人の健康な参加者は、比較のための理想的な健康的な参照を表すために、若い年齢層から選ばれました。
| 参加者 | 障害 | セックス | 年齢 | UPDRSa |
| 1 | Pwp | F | 64歳 | 44歳 |
| 2 | Pwp | M | 65歳 | 25名 |
| 3 | Pwp | M | 64歳 | 16歳 |
| 4 | なし | M | 26歳 | N/a |
| 5 | なし | F | 65歳 | N/a |
| 6 | なし | M | 67歳 | N/a |
| a.最大スコア108。 | ||||
表 1: 参加者の人口統計。
認知・記憶試験(ペン運動)では、ペン運動の位置軌道を記録し、速度振幅の時系列を導出するために線形速度を抽出した。次に、速度振幅の変動から MMS を各描画タスクに対して導出しました。患者は運動障害学会-UPDRS(MDS-UPDRS)の中央値ランクスコアに従ってグループ化され、コホートの中央値を上回る最高ランクスコアで示された最も高いPD重症度を示した。決定されたスコアの中央値ランキングが使用される各クラスターの3人の代表的な参加者は、3つの代表的なコントロールに関連して結果を表示するために使用されます。1つのコントロールは、若い間に神経運動制御の理想的な状態を表す若い(26歳の男性)です。他の2つは健康的な老化コントロールです。65歳女性1人と67歳男性1人。図 7は COM の軌跡を示し、図 8は軌道速度プロファイルから派生した MMS からの対応するガンマ プロセスを示しています。
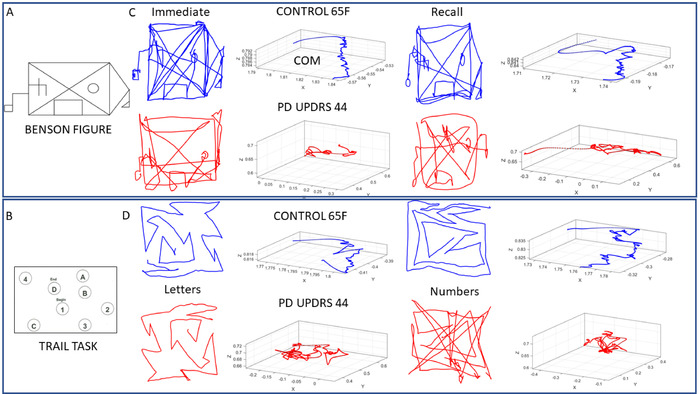
図 7:実際のデジタル化されたトレースを用いた選択認知描画テストのパフォーマンス中に、17体の位置の軌跡を要約したCOMのサンプル軌道。ベンソンの複雑な図 (タスク 1 および 7) とトレイル作成テスト (タスク 2−5) のパフォーマンスのサンプル。(A) このプロトコルで使用されるベンソン複合体図。(B) 数字と文字を含むトレイルテストでは、整然としたパスに沿って線を引くことによって、所定の順序で接続することを目的としています(タスク4 — トレイルB)。(C) 65歳の女性コントロール(青)とPWPからのベンソン複合体図とCOM 3D軌道のサンプルペントレース(赤)。左側は、参加者が直ちに図をコピーしたときの結果を示し(タスク1)、右側は参加者が10分の遅延(タスク7)の後に図を呼び戻したときです。いずれの場合も、ペンリフトと共に連続描画がキャプチャされ、Trail A (タスク 3) タスクとトレイル B (タスク 5) タスクのコントロールのパフォーマンスと PWP のパフォーマンスのバリエーションが表示されます。COM 軌道と実際の図面の変更に注目してください。この図のより大きなバージョンを表示するには、ここをクリックしてください。
図8は、健康な参加者および患者参加者に対して95%の信頼を持つ最高のMLE適合ガンマPDFからの結果を示す。各描画タスクでは、患者はコントロールから離れて階層化しました。さらに、彼らはグループ内で階層化し、MDS-UPDRS中央値ランクスコアに従って区別しました。各患者は、トップパネル上の経験的に推定されたPDFの瞬間として表され、下部パネルは各参加者のPDFカーブを表しています。パネル全体で、読者はタスク全体で各人にまたがる PDF のファミリーを理解できます。このアプローチを、すべての (想定される) パラメトリック モデルと 1 つのサイズで比較します。図 8Dは、ペンの先端 (ペン リフトを含む) によってキャプチャされた時計図 (タスク 6) の連続描画を示しています。
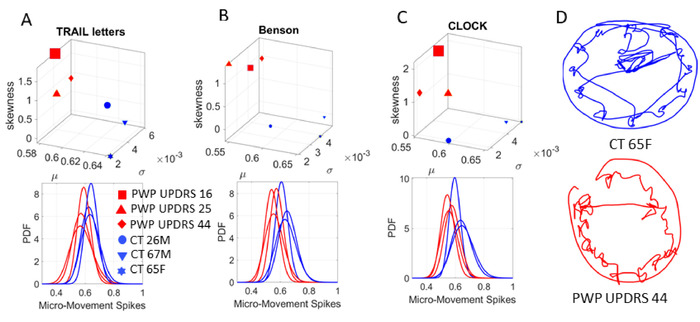
図8:マイクロムーブメントスパイク(MMS)は、コホートを階層化し、認知タスクのための解釈可能なパーソナライズされたダイナミックデジタルバイオマーカーを構築します。認知テスト中の COM の 3D 軌道から派生した瞬間ごとの変動 (ユニットレス MMS) は、確率的マップに沿って各参加者を一意にローカライズします。COMは、人が認知タスクを実行し、デジタルタブレット上で描画しながら、身体全体の17の位置軌道を同時に登録する動きを要約します。(A) ガンマモーメントは、トレイルB検定(タスク5)で文字と数字を接続する経験的に推定された(平均x軸、標準偏差y軸、歪度Z軸および尖度マーカーサイズ)。トップパネル。各マーカーは、確率空間における人物の一意の位置を表します。各ポイントは、下部パネルに表示される一意の分離可能な PDF を示し、PWP (凡例) の UPDRS 中央値ランクスコアを階層化します。(B) 複雑なベンソン図をコピーするタスク(タスク1)。(C) クロック描画タスク(タスク6)。(D) 連続トレースを示すデジタル化されたペンでキャプチャされた実際の時計図面(ペン持ち上げを含む)。ペンと全身運動中のすべての運動学は、多層(認知、自発的、自発的、自動、自律的)確率的署名を経験的に導き出すために、EEG-EKG(図示せず)と同期的に登録されています。このパーソナライズされたアプローチ(ガンマプロセス)は、理論的なPDFを仮定する「ワンサイズフィットオールモデル」とは対照的であり、壮大な平均を通じて、波形の振幅とタイミングの「ノイズ」の重要な変動として滑らかにします。マイクロムーブメントスパイク(MMS)とガンマプロセスアプローチは、コホートを階層化し、認知タスクのための解釈可能なパーソナライズされたデジタルバイオマーカーを構築します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
次に、身体の動き(自発的なポインティングと自動歩行)の結果を提示します。描画モーションでは、ターゲットを指すタスク (タスク 10−12) と同じレベルの目標指向性は必要ありません。自発的な制御のレベルを評価できるように、次に空間ターゲットを指すタスクを使用します。前と同様に、COM の軌道を使用して、17 のセンサー位置の運動運動を要約します (図9)。 まず速度振幅時系列を取り、その後、振幅の瞬間的な変動から MMS を導き出します。図10の左パネルは、ベースラインでのポインティングタスク中の確率分析の結果を示しています(タスク10)。図10の中央パネルは、メトロノームがその存在の参加者に指示することなく、35 bpmに設定されている場合のポインティングタスクからの結果を示す(タスク11)。図10の右パネルは、参加者がメトロノームのリズムに向けてポインティングの動きをペースするように指示された場合の結果を示しています(タスク12)。
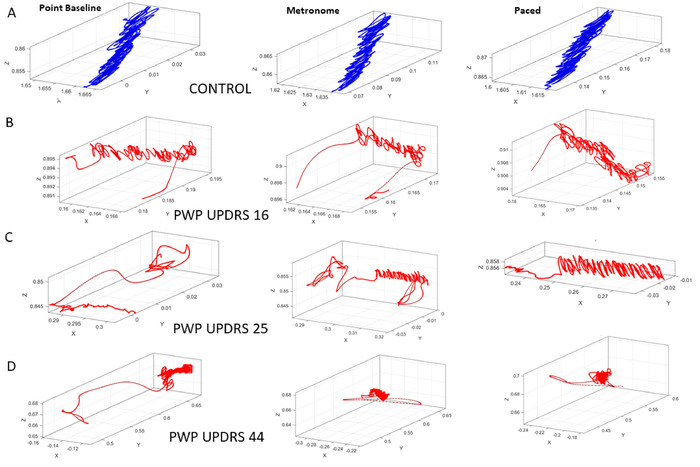
図 9: ポインティング タスク中の COM の 3 次元軌道3つの異なる文脈で、ベースライン測定(タスク10)を取ることを定期的に指し示し、メトロノームがメトロノームの存在を参加者に警告することなく35 bpmでバックグラウンドで拍動している間を指し示し(タスク11)、および同じメトロノームビートが、メトロノームのリズムに動きをペースするように参加者に指示した後(タスク12)。(A) コントロール参加者のパフォーマンス。(B) コホート全体の MDS-UPDRS スコアの中央値ランキングに従って、重大度が最も低いグループにおけるPWPのパフォーマンス。(C) 中級の重大度範囲グループの PWP。(D) 最も重大度の高いグループの PWP。MDS-UPDRS スコアの増加に伴う COM 軌道の劣化に注意してください。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ガンマプロセスの結果を図10に示し、各PWPサブタイプを区別し、確率的シグネチャの変化をコンテキストからコンテキストまで追跡することができます。
ポインティングタスクは、これらの分析がコンテキスト状況に対する感度を明らかにしました。同じポインティング タスクでは、メトロノーム条件の変化によって、条件間で異なる確率的シグネチャが引き起こされました。特に、参加者がメトロノームに向けて意図的に動きをペースするように指示された状態に対して、メトロノームビートを自発的に(指示なし)に巻き込まれた場合、COMバイオリズムの変化を観察することができます。ビート。このタスクは、上半身運動のベースラインで、異なるMSD-UPDRSスコアに応じてPWP間で自発的制御のレベルが異なることを実証しました。具体的には、スコアが低いほど、ガンマパラメータ平面上のノイズ対信号比(スケールパラメータ値)が低くなり(図10A)、PDF形状値がより対称になります。中央値ランクのUPDRSスコアとデジタルデータとの間のこの整然とした関係は、メトロノームの存在によって変更され、自発的(指示されていない)ポインティング条件と意図的な(指示された)ポインティング条件をさらに区別した。
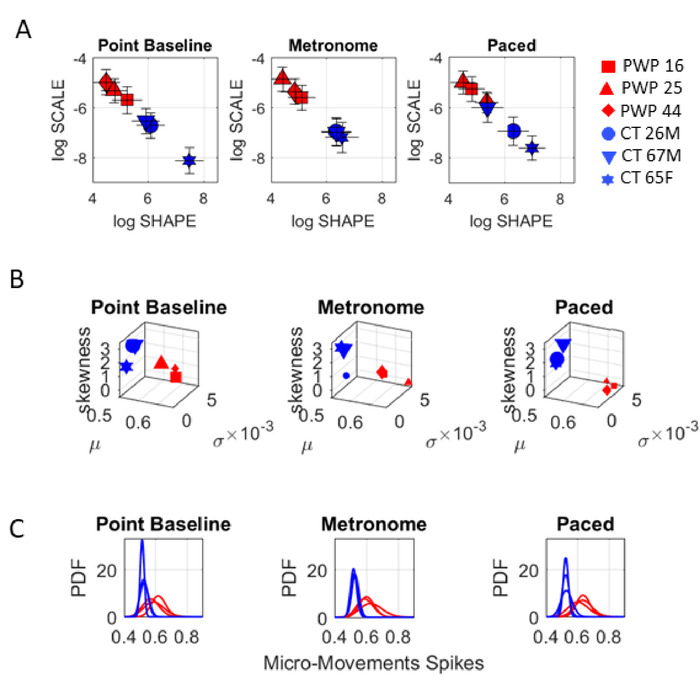
図 10: 3 つの特定のポインティング タスクの動的デジタル評価。COM速度時系列の変動から導き出された MMS からのガンマ プロセス出力は、3 つのポインティング タスク (タスク 10-12)の間に PWP とコントロール グループ内で区別されます。(A) ガンマ パラメータ平面は、PWP とコントロールの違いを示します。(B) 各ポインティング条件について、ガンマプロセスから経験的に推定されたガンマモーメントは、PWPとコントロールを区別する。各グループ内で、確率的な署名は、異なるポイントに参加者を階層化します。各タスク コンテキストは、マップ上のポイントの位置を変更します。(C) PDF ファミリは、各参加者、各グループを区別し、目標指向のポインティングのタスク コンテキスト間の統計的な差別化を明らかにします。この図のより大きなバージョンを表示するには、ここをクリックしてください。
次に、自発的なポインティング行動に対する異なる条件のこれらの影響が自動歩行運動に及ぶかどうかを尋ねました。そのために、参加者が部屋を歩きながら、上記と同じプロトコル、すなわちメトロノームを使用して実行しました。メトロノームのビートは、この場合、12 bpmに設定されました。図 11は、コントロールの COM 軌道と、MDS-UPDRS スコアによってランク付けされた PWP 中央値を示しています。歩行タスクの確率分析の結果を図 12に示します。
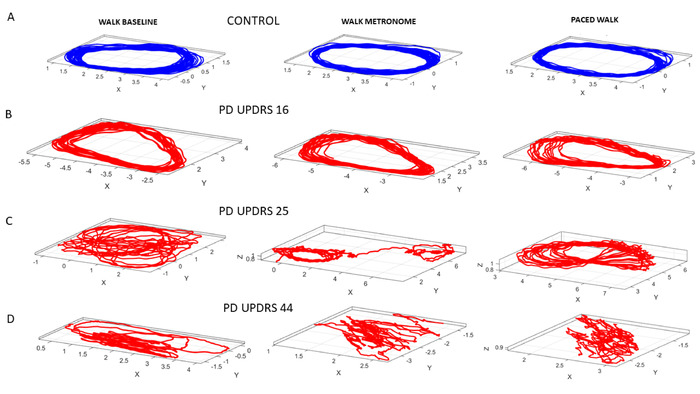
図 11: 3 つの特定の歩行タスクの動的なデジタル評価。歩行タスクは、速度振幅の変動のノイズ対信号比を確認するために、体全体の17箇所からCOMの3D軌道から導き出されます。(A) コントロール参加者におけるCOMの3D軌道は、人が自然歩行中に前後にペースを上げる間(タスク13);。指示なしにメトロノームの存在下を歩いて、メトロノームビートへの自発的な巻き込み(タスク14)を測定する。指示通り、意図的に心拍数をメトロノームの拍に合間しながら歩く(タスク15)。(B) ランクの低い UPDRS スコアを持つ PWP。(C) UPDRS スコアが高い PWP は、3D COM の軌道を劣化させる。(D) 最もランクの高い UPDRS スコアを持つ PWP は、非常に乱れた COM 軌道を示しています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
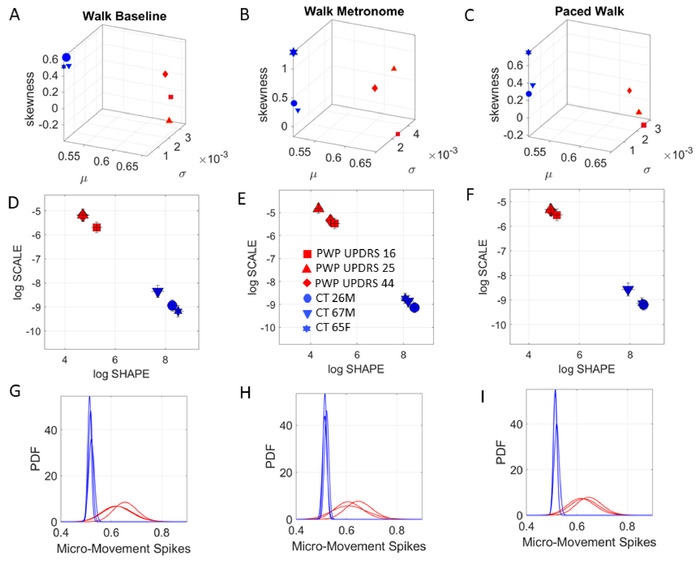
図12:歩行中の自発的および指示された身体的な調像のための能力。歩行タスクのMDS-UPDRS情報デジタルバイオマーカー。(A) 中央値のスコアに沿った自然歩行中のPWPの階層化。(B) メトロノームは、確率的なシグネチャを自発的にシフトします。(C) メトロノームのビートにペースを上げる指示が再び署名を変更します。(D-F)ガンマ ログ パラメータ プレーンは、PWP のノイズが大きく、よりランダムな変動を伴う、異なる PDF シェイプとスケール(ノイズ対信号比)に沿ってグループをローカライズします。(G-I)上記のパネルD-Fで表される経験的に推定されたPDFは、各人に固有の方法でコンテキストと共にシフトするファミリにまたがります。この図のより大きなバージョンを表示するには、ここをクリックしてください。
コンピュータのウェブカメラが顔を記録している間にすべての認知タスクとメモリタスクを実行できるため、研究者が公開しているオープンソースの機械学習ソフトウェアOpenPoseを使用し、顔情報を抽出することができます。感情や感情的なコンテンツに関連する情報を推測するために使用することができます。多くの場合、PDでは、ドーパミンの枯渇が最終的に低い筋肉の緊張をもたらす可能性があるため、表情が減少します。ここでガンマプロセスは、特定のタスク中に最もアクティブな顔の領域を確認したり、感情間の領域遷移を確認することによって感情的なコンテンツを調べたりするためにも使用できます。図13は、タスク16および17の間に参加者の顔からのビデオを使用してそのような分析の例を示す。顔の微小運動を捕捉するために使用される70点は、既知の三叉神経領域V1(29)、V2(14)、V3(27)8(図13A)と一致して配置され、例えば、この場合、どの領域が最大に変化するかを評価する。中立的な顔から笑顔に変わろう。このタイプの分析は、うつ病や社会的コミュニケーション全般を含むPDの他の非運動的側面を系統的に調製するために使用することができる。
不確実なカメラズーム、自然な人間の動き、および実際の顔の大きさを補正するために、カメラが静止していると仮定すると、各面をx³'、0、単位分散を持つ「単位面」にマッピングします。ビデオ内の各フレームについて、各ポイント x' = x- x³、 y' = y- y- を正規化し、各フレームのマスク全体の分散によって各座標をスケールし、各マスクの単位分散を達成します。次に、記録中に面が塑性変形しないと仮定して、面の時系列の各点を前のマスクからの偏差として扱います。結果は、位置座標の 70 チャンネルの時系列です (図 13B)。これらの時系列に上がった位置と速度の流れから抽出された速度振幅の変動はMMSに変換され、ガンマプロセスに入力されるため、PDFとそのシフトが感情的な遷移を明らかにします(図13C)。例えば、ニュートラルな表現から笑顔への移行は図13Bでは見えないようですが、確率的なシフトはゾーンV2を最も敏感で、PDFを最大限に変化させます。
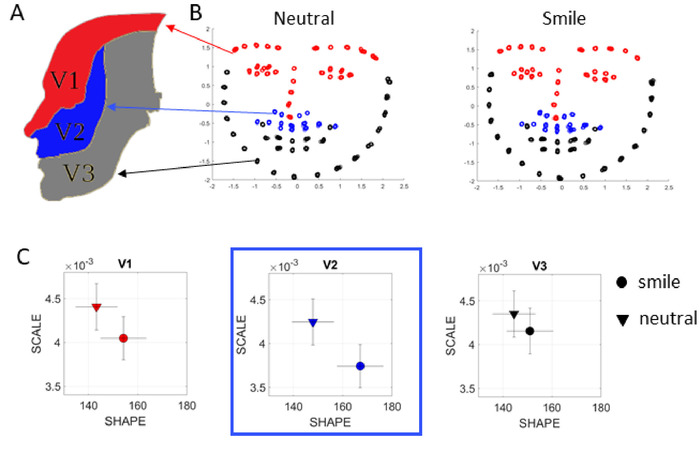
図 13: OpenPose を使用してキャプチャされたビデオ データからのセンチメント分析。(A)一般的な体性アフェレント繊維(GSA)を運ぶ三叉神経による顔面領域。これらの繊維は、顔の表情(ニュートラル対笑顔)を横切る遷移を研究するためにここで使用される眼科(V1)、上顎(V2)および顎(V3)の分裂を介して顔の皮膚を内包する。(B) 市販のビデオカメラで撮影した数分のビデオを使用して、OpenPoseで顔情報を抽出し、V1、V2、V3エリア(パネルAのようにカラーコード)に従って顔全体に70点をレンダリングすることが可能です。次に、これらの時系列の MMS をガンマ プロセスに入力し、各条件について経験的に推定されるガンマ パラメータのスケールとシェイプを入力します。(C) 分析は、この場合、PDFの変化が最も大きいほど、この特定の人物に対して、ニュートラルからスマイルへの移行によってV2が最大の影響を受けることを明らかにする。この図のより大きなバージョンを表示するには、ここをクリックしてください。
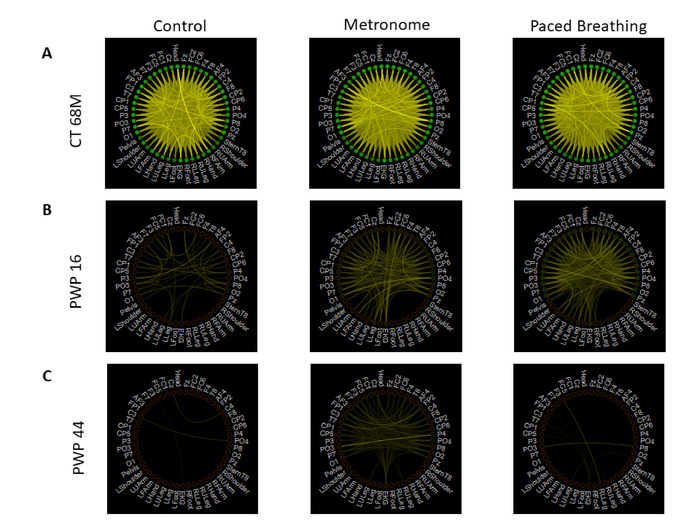
図14:重み付けされた非指向グラフと情報理論手法を用いて、神経系の複数の層からのデジタル生物物理信号を統合する。すべてのEEG、運動(磁力計)、およびEKG信号間のペアワイズ相互情報のネットワーク接続。(A) 3つの歩行タスク中の代表的な健康な参加者の接続性測定- タスク13制御(左)、タスク14自発的なメトロノーム配置(中央)、およびタスク15指示ペース呼吸(右)。各ノードは、単一のセンサーの信号を表します。線の色は MI のレベルを表し、明るい色はより高い接続性を示します。ノードの色は、他のすべてのセンサーと共に、そのセンサーの信号の平均 MI を表します。カラースケールは、すべてのタスクとすべての参加者で同じに設定され、すべてのタスクと参加者の最大MI値の最も明るい色を持ち、すべてのタスクと参加者の最小MI値の最も暗い色を持つするように任意に設定されています。健康な参加者の接続性は、脳と身体のノード間で最も強い接続を示しています。(B) UPDRS 16 接続メジャーを備えた PWP は、パネル A と同じスケマティック レイアウトで、正常な参加者のネットワークよりも接続性の密度が低いことを示します。(C) UPDRS 44 接続メジャーを備えた PWP は、パネル A と同じスケマティック レイアウトで、脳と身体全体で最もスパースな接続パターンを示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
次に、これらのバイオリズムによって伝達される情報の量を確認します。そのために、シャノン19が開発した情報理論的アプローチを使用し、各センサの信号(EEGセンサー、モーションセンサー、ECGセンサー)の間の相互情報(MI)を使用します。そのために、各波形タイプからMMS振幅を得た。
2つのセンサー間のMIは、他方のセンサーの信号の情報を導入することによって、一方のセンサーの信号で減少する不確実性のレベルを評価します。MI が高い場合、これは 2 つの信号が高度に接続されていることを意味し、低い場合は、2 つの信号がほとんど独立していることを意味します。具体的には、MI は次のように計算されます。
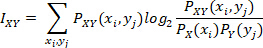
シグナルX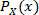 の値の分布の正規化されたヒストグラム値であり、
の値の分布の正規化されたヒストグラム値であり、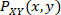 シグナルXとYの値の接合分布の正規化されたヒストグラム値です。サンプリング ビンは 0.05 で増分され、0.5 から最大振幅値まで増加しました。この式の導出に関する詳細は、臨床分析20、21に適用される情報理論に関する多くの文献で見つけることができます。
シグナルXとYの値の接合分布の正規化されたヒストグラム値です。サンプリング ビンは 0.05 で増分され、0.5 から最大振幅値まで増加しました。この式の導出に関する詳細は、臨床分析20、21に適用される情報理論に関する多くの文献で見つけることができます。
全体的に、健全な参加者は3つの歩行タスクの間により接続されたネットワークを示し、患者参加者は図13に示すように、よりパースア接続を持っていました。ネットワークを介した情報伝送だけでなく、相互情報が自己感覚的なバイオリズムから導き出されただけでなく、PWPでははるかに低い。より重要なことは、患者によって異なる条件間のMI伝達のパターンに根本的な違いがある。ここでは、ネットワーク解析からの接続メトリックをさらに活用して、これらの進化するネットワークのトポロジ的特徴を要約し、物理的なエントレインメント能力の追加インデックスを提供し、間の通信レベルを反映します。メトロノームに関連する物理的なエントレインメントが発生する場合とそうでない場合は、脳、身体および心臓。
ディスカッション
本研究では、従来の臨床検査と、神経系が出力する生体物理信号からのデジタルデータとの統合を可能にする新しいプロトコルを導入する。SPIBAとMMSを統一プラットフォームとして導入し、鉛筆と紙の観測方法による離散スコアや生体物理センサからの連続デジタルデータなど、異なる種類のデータを組み合わせたものをご紹介します。これらの方法は、PWPのコホートと年齢と性別に一致するコントロールを使用して説明され、比較のための理想的な健全な基準として追加の若いコントロールを使用しています。我々は、従来の臨床試験(例えば、MoCAとMDS-UPDRSの一部である可能性のあるもの)を使用して、コホートを中央値ランク付けし、グループのスコアの固有の変動から自動的に抽出できることを示し、デジタルのデータを階層化する情報臨床的に定義された重症度のレベルに従って領域。このようなレベルは、臨床MDS-UPDRSのレベルと認知/メモリテストのパフォーマンスによく一致します。その後、実装の別の層では、CNS、PNSおよびANS層から利用される神経系のバイオリズムを調べ、異なるレベルの自律性と制御を特徴付ける。我々は、臨床基準の光学を通じて調べ、そのようなデータから導き出されたサンプルデータと確率的シグネチャを提供する。このようなアプローチの下で、我々は健康なコントロールから患者を区別することができます。そして、デジタルバイオリズムを通じて、PWP内で臨床的に定義された重症度のレベルで区別する。
このように生体物理デジタルデータを臨床基準に合わせることにより、結果の個別化されたシフトをより動的に追跡できる解釈可能な基準セットを提供します。これらの新しい結果は、デジタルデータに基づいているため、動的なデジタルバイオマーカーを測定しますが、確立され検証された臨床基準に従って解釈可能な結果を提供します。それらは神経系プロセスの時系列から導き出され、そのような動的な性質を捕捉する。特に、モータと非モータの両方の基準を使用することができます。そのため、従来から障害を定義してきた運動症状の悪化に先行することが知られているPDの非運動的側面を定量化し始めることができる。例えば、ここで提示されたような顔の分析は、レム睡眠中に自発的な顔のマイクロジェスチャーを調べ、運動活動の悪化を予測できるレパートリーを構築するために使用することができる。同様に, これらの方法を使用して、毎日の活動中の痛みのレベルを調べ、レム睡眠時間中の活動との潜在的な相関関係を評価することができます。.レム睡眠と疼痛調節の両方が後でPD 5、6、7の重症度のレベルを定義する運動の問題に先行することが知られているので、これは重要です。様々な従来の臨床タスクのデジタル化を用いて、認知能力と記憶能力をプローブするために使用される臨床タスクに組み込まれた他の非運動活動を特徴とし、そのような活動の指標を運動症状にマッピングした。これらの方法は、パーキンソン病の基礎研究と臨床実践を結び付けるために適しています。彼らはまた、神経系の他の障害に拡張することができます。
顔からの運動出力に加えて、レム睡眠中に、自己感知または運動性リファレンスのフレーム内の自然な社会的状況の間に顔のジェスチャーを調べることができ、患者の脳が最も可能性の高いフィードバックのレベルを測定することができます。ここで、三叉領域V1、V2、V3に対応する顔面領域全体のマイクロジェスチャーの非常に微妙な違いにもかかわらず、顔のどの領域が最大にシフトした代表的な参加者に特定することが可能であった。中立状態と自然に微笑む状態の間を遷移する際の確率的な署名。これは、SPIBAとMMSを用いて、運動タッチチャネルからの感覚入力の困難に関連するPDの他の非モータ(感覚)の側面を評価できることを示唆している。これらは、障害24の初期段階においても、PDにおいて問題があることが見出されている。感覚とモーターが手をつないで行くので、この情報は、この障害の進行の後半に浮かび上がるより明白な運動問題を予測するのに役立ちます1,7.我々は、顔の三叉領域に沿ったこれらの運動チャネルが、睡眠変化5、6に関連するものを含む異なるタイプの疼痛調節を解離するのに役立つかもしれないと考えている。
現在の方法は、異なる認知能力と異なるレベルの自律性を必要とする異なる条件下で、中央、末梢および自律神経系から得られた生物物理信号を並行して調べる新しい方法を提供する。神経モーター制御。標準化されたMMSデータに確率的解析とペアワイズネットワーク解析を適用するSPIBAフレームワークを使用して、認知活動を客観的に特徴付けることもできます。この実験で使用された15のタスクは、異なるタイプの認知スキル(例えば、visuo-構造スキル、視覚記憶、知覚スキャンスキル)と認知制御の異なるレベル(例えば、意図的にポイントをペース)を必要とします。速度、指示に従って呼吸数をペース)。そのため、これらのタスク中に示された生物物理信号のCNS-PNS-ANS情報伝達の確率的および接続性パターンは、異なるレベルの認知負荷とモータ出力への影響を特徴付けるために使用することができる。
新しい分析方法とプロトコルの利点を強調しながら、同期データ収集用の記録プラットフォームを採用する際に考慮すべき注意事項と実用的な制限も指摘します。これは、この設定では、同期のために 1 台のコンピュータにストリーミングする複数の記録ソフトウェアの種類があり、コンピュータの計算能力が高い必要があるか、データの損失、コンピュータのフリーズ、および/または過剰が発生する可能性があるためです。ノイズ。現在の設計では、2つのストリーミングソフトウェア(EEG、モーションキャプチャ)とLSLが1台のコンピュータ上で実行されました。そのため、処理の過負荷とコンピュータのフリーズの可能性に注意する必要がありました。これは、EEGチャネルの1つを使用してECG信号を抽出した理由の1つでした。より高いメモリ容量と高速プロセッサを備えたコンピュータは、キネマティクスのEEGとセンサーグリッドを同時にストリーミングする別のECGソフトウェアを処理できる場合があります。これらの問題は本質的に実用的であり、当社が提供する分析方法(SPIBA)および標準データ型(MMS)とは無関係です。しかし、複数のストリームからのデータ共登録のためのプロトコルを設計する前に、計算能力を評価する必要性をエンドユーザーに警告することが重要であると考えています。
もう一つの注意点は、プロトコルに示されている15のタスクは、動的デジタルバイオマーカーの開発に使用できるもののサブセットである。このホワイト ペーパーでは、スペースの制約によりいくつかのタスクに限定し、異なるレベルの制御と身体の動きを含むタスクを選択し、実際にこのホワイト ペーパーに含まれていない他のタスクを追加できます。私たちの目標は、より少ない時間と労力を必要とするタスクの小さなサブセットを導き出することです。実際、私たちの研究室から、ポインティングタスク(タスク10−12)は、PDを含む自発的なコントロールと神経疾患のレベルが異なるバイオリズムの確率的シグネチャを特徴付ける効果的かつ効率的な方法であることが判明した一連のタスクです。24歳,30.
本研究で示す代表的な結果は、SPIBA法を用いてバイオセンサ波形とカメラのモーションキャプションから導き出されたMMSデータセットで何ができるかの小さなサブセットである。例示のために、MMSを振幅で調べ、人のCOMから導き出される線形速度振幅の変動に焦点を当てた。COMは、当社が共同登録した全17のボディセンサーグリッドからの要約信号です。ただし、解析を他の回転パラメータや、時系列の変動パラメータを生成する他の運動変数(力や圧力など)に拡張できます(例: 顔データと同様)。また、空間的制約のため、頭皮振幅情報に基づくEEGデータの分析のみを図示したが、これらの分析をソース空間31から導き出したデータに適用することもできる。すべてのデータモードについて、時系列を生成するピーク間の時間の確率を調べることもできます(ピーク振幅の代わりに)。他の時系列のパラメータは、このような波形から導き出ることができ、そのMMSは、32、33、34を構築されたネットワークからの凝縮性と接続性を確認するために使用することができます。さらに、これらの分析は、周波数ドメイン34に拡張することもできる。相互情報ネットワーク分析に加えて、PWP とコントロールを区別し、PWP を階層化するために、ネットワークの他のトポロジ機能に焦点を当てることができました。本稿では、これらの分析のツールとしての有用性に焦点を当てていますが、この種の特性を通じて、これらの分析ツールが提供するデジタルデータの臨床的に情報に基づいた解釈を提供する知識を得る。
本研究で説明する現在の方法は、SPIBAとMMSが臨床およびデジタルデータ統合に適用できる多くの可能な方法のいくつかを紹介するのに役立つ。私たちは、最終的に臨床基準のデジタルデータを通知し、同様に従来の鉛筆と紙の方法にデジタルデータからより多くの精度を追加することを期待して、この統一プラットフォーム、標準化されたデータタイプと実験プロトコルを提供しています。このような改善は、1)治療に応答して症状変化のより正確な追跡を可能にし、2)時間の経過とともに自然なPD進行の理解を高め、3)PD症状プレゼンテーションの階層化を容易にする(これは、ユニークな臨床を指示する可能性がある)各サブグループの推奨事項)。そのため、これらの手法をPDのさらなる研究に応用するだけでなく、臨床応用にも役立てていきたいと考えています。携帯電話などの商用グレードのデバイスを使用して、生体物理データを取得して、本稿で示した分析を実行します。現在、ロチェスター大学(https://parkinsonmpower.org)やKaggleのmPowerアプリ研究など、より大きな規模でデジタルデータを収集する取り組みが行われています。実際、これらのオープンアクセスデータリポジトリを使用して、携帯電話から取得した加速度計データからPDと正常な老化した個人を階層化し、ここで提示した臨床試験に組み込まれた活動を自動的に分類することができました。35.
次のステップとして、より広い範囲のPWP集団とその一致したコントロール参加者からより多くのデータを収集し、異なる時点でそれらを記録し、我々の方法を使用して断面分析と縦方向分析の両方を実行できるようにする。このような収集されたデジタルデータは、その部分の合計よりもはるかに多くを提供し、神経学と精神医学における精密医療の理念を真に実現すると予見しています。
開示事項
著者は何も開示していない。
謝辞
この研究の一部は、ラトガース・ディスカバリー・インフォマティクス・インスティテュートからJR、ラトガース大学テックアドバンス・ファンドからEBTとJV、ニュージャージー州知事のEBTへの自閉症の研究と治療のための協議会、およびマイケル・J・フォックス財団からRDに資金提供されています。
資料
| Name | Company | Catalog Number | Comments |
| Enobio 32 | NE Neuroelectrics | NE006WF | wearable, wireless electrophysiology sensor system for the recording of EEG. |
| Inking Pen | Wacom | KP1302 | tablet pen |
| Intuos Pro | Wacom | PTH451 | pen tablet |
| Lab Stream Layer System | n/a | n/a | open source software to synchronize different devices |
| Microphone | Zaffiro | B07BDFP6XC | computer microphone |
| MovAlyzeR | Neuroscript | Version 6.1.0.0. | pen movement caption software |
| MTw Awinda wireless motion tracker | Xsens | MTw Awinda | motion capture system |
| MVN Analyze | Xsens | Version 2019 | motion-tracking software |
| NIC 2.0 | NE Neuroelectrics | NE001SW2 | Neuroelectrics Instrument Controller (NIC) EEG streaming software |
| OpenPose | n/a | n/a | open source machine learning software to extract facial information |
参考文献
- Hawgood, S., Hook-Barnard, I. G., O'Brien, T. C., Yamamoto, K. R. Precision medicine: Beyond the inflection point. Science Translational Medicine. 7 (300), 300ps317 (2015).
- Torres, E. B., Whyatt, C. . Autism: The Movement Sensing Perspective. , (2018).
- Torres, E. B., et al. Toward Precision Psychiatry: Statistical Platform for the Personalized Characterization of Natural Behaviors. Frontiers in Neurology. 7, 8 (2016).
- Espay, A. J., et al. Technology in Parkinson's disease: Challenges and opportunities. Movement Disorders. 31 (9), 1272-1282 (2016).
- Ponsen, M. M., Stoffers, D., Wolters, E. C., Booij, J., Berendse, H. W. Olfactory testing combined with dopamine transporter imaging as a method to detect prodromal Parkinson's disease. Journal of Neurology, Neurosurgery & Psychiatry. 81 (4), 396-399 (2010).
- Ponsen, M. M., et al. Idiopathic hyposmia as a preclinical sign of Parkinson's disease. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society. 56 (2), 173-181 (2004).
- Oudre, L., Jakubowicz, J., Bianchi, P., Simon, C. Classification of periodic activities using the Wasserstein distance. IEEE Transactions on Biomedical Engineering. 59 (6), 1610-1619 (2012).
- Derkinderen, P., et al. Parkinson disease: the enteric nervous system spills its guts. Neurology. 77 (19), 1761-1767 (2011).
- Roetenberg, D., Luinge, H., Slycke, P. Xsens MVN: Full 6DOF human motion tracking using miniature inertial sensors. Xsens Motion Technologies BV, Tech. Rep. 1, (2009).
- Possin, K. L., Laluz, V. R., Alcantar, O. Z., Miller, B. L., Kramer, J. H. Distinct neuroanatomical substrates and cognitive mechanisms of figure copy performance in Alzheimer's disease and behavioral variant frontotemporal dementia. Neuropsychologia. 49 (1), 43-48 (2011).
- Army, U. Army individual test battery. Manual of Directions and Scoring. , (1944).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Beekly, D. L., et al. The National Alzheimer's Coordinating Center (NACC) database: the uniform data set. Alzheimer Disease & Associated Disorders. 21 (3), 249-258 (2007).
- Torres, E. B. . Objective Biometric Methods for the Diagnosis and Treatment of Nervous System Disorders. , (2018).
- Ryu, J., Torres, E. B. . Fourth International Symposium on Movement and Computing, MOCO'17. , 1-8 (2017).
- Torres, E. B., Donnellan, A. M. . Autism: The movement perspective. , (2015).
- Torres, E. B., Vero, J., Rai, R. Statistical Platform for Individualized Behavioral Analyses Using Biophysical Micro-Movement Spikes. Sensors (Basel). 18 (4), (2018).
- Torres, E. B., Denisova, K. Motor noise is rich signal in autism research and pharmacological treatments. Scientific Reports. 6, (2016).
- Shannon, C. A mathematical theory of communication. Bell System Technical Journal. 27, 379-423 (1948).
- Silverstein, S. M., Wibral, M., Phillips, W. A. Implications of information theory for computational modeling of schizophrenia. Computational Psychiatry. 1, 82-101 (2017).
- Jeong, J., Gore, J. C., Peterson, B. S. Mutual information analysis of the EEG in patients with Alzheimer's disease. Clinical Neurophysiology. 112 (5), 827-835 (2001).
- Torres, E. B., et al. Autism: the micro-movement perspective. Frontiers in Integrative Neuroscience. 7, 32 (2013).
- Von Holst, E., Mittelstaedt, H., Dodwell, P. C. . Perceptual Processing: Stimulus equivalence and pattern recognition. , 41-72 (1950).
- Torres, E. B., Cole, J., Poizner, H. Motor output variability, deafferentation, and putative deficits in kinesthetic reafference in Parkinson's disease. Frontiers in Human Neuroscience. 8, 823 (2014).
- Yanovich, P., Isenhower, R. W., Sage, J., Torres, E. B. Spatial-orientation priming impedes rather than facilitates the spontaneous control of hand-retraction speeds in patients with Parkinson's disease. PLoS One. 8 (7), e66757 (2013).
- Torres, E. B. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson's disease. Frontiers in Integrative Neuroscience. 7, 50 (2013).
- Torres, E. B., Heilman, K. M., Poizner, H. Impaired endogenously evoked automated reaching in Parkinson's disease. Journal of Neuroscience. 31 (49), 17848-17863 (2011).
- Nguyen, J., Majmudar, U., Papathomas, T. V., Silverstein, S. M., Torres, E. B. Schizophrenia: The micro-movements perspective. Neuropsychologia. 85, 310-326 (2016).
- Torres, E. B. Atypical signatures of motor variability found in an individual with ASD. Neurocase. 19 (2), 150-165 (2013).
- Torres, E. B. Signatures of movement variability anticipate hand speed according to levels of intent. Behavioral Brain Functions. 9, 10 (2013).
- Lai, M., Demuru, M., Hillebrand, A., Fraschini, M. A comparison between scalp-and source-reconstructed EEG networks. Scientific Reports. 8 (1), 12269 (2018).
- Sporns, O. . Networks of the Brain. , (2010).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: uses and interpretations. Neuroimage. 52 (3), 1059-1069 (2010).
- Kalampratsidou, V., Torres, E. B. Peripheral Network Connectivity Analyses for the Real-Time Tracking of Coupled Bodies in Motion. Sensors (Basel). 18 (9), 3117 (2018).
- Torres, E. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson's disease. Frontiers in Integrative Neuroscience. 7 (50), (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved