Method Article
管状结构组织工程的核心/壳印刷支架
摘要
这里介绍的是一个简单易用,核心/外壳,三维生物打印设置一步制造空心脚手架,适用于血管和其他管状结构的组织工程。
摘要
芯/壳丝的三维(3D)打印允许直接制造通道结构,其稳定外壳与液体芯的界面交联。后者在印刷后被移除,留下一个空心管。整合增材制造技术(如此处描述的与定制[生物]油墨,在结构和生化上模仿原生细胞外基质 [ECM]) 是迈向先进组织工程的重要一步。然而,对定义良好的结构进行精确制造需要针对使用的材料进行定制的制造策略。因此,明智的做法是,首先采用可自定义、易于使用且与各种材料和应用兼容的设置。这项工作提供了一个易于制造的核心/壳喷嘴,具有luer兼容性,以探索木桩结构的核心/壳打印,测试与定义明确,基于藻酸盐的脚手架材料配方。
引言
可以说,组织工程(TE)的最终目标是在体外产生功能性组织或器官,可用于再生或替换人体损伤或患病部位1,2,3。目前组织工程(TE)的研究集中在该领域的个别方面(脚手架材料、制造程序、细胞来源等)4,5, 以及开发简单的体外模型组织和器官,模仿其体内对等的基本方面.这种模型已经可用于许多应用,如药物筛选和毒性研究,特别是在传统的二维细胞培养无法模仿原生组织的动态反应的情况下。8,9.三维体外模型通常通过结合细胞10、物理化学线索11和生物活性分子12、13在支架上构建,这些分子来自脱细胞组织或从生物或生物相容性材料14、15、16、17、18构造。
脚手架必须重述原生组织的复杂3D微架构和分层结构,使工程组织具有功能,代表体内组织19。尽管TE技术有重大进步,但发展生理相关的人工组织结构仍是一个挑战。厚组织(厚度>200μm)特别成问题,因为氧气和营养扩散等限制20。在更大的组织结构方面取得了进展;然而,为了输送氧气和营养,促进废物清除,必须重述细胞与血管的高度接近程度。组织的血管化(或者,在组织构造内制造互连的3D血管网络)在维持细胞活力和促进体外工程组织功能方面起着关键作用,这对于模型在长期实验21,22。此外,所需的分辨率、结构完整性和同时生物相容性尚未实现23。
为了构建血管状结构并促进体外血管化,提出了几种TE方法。一些例子包括播种内皮细胞(也与其他细胞类型(如成纤维细胞)共同培养,这些细胞自组装以生成微血管网络24,使用血管祖细胞和促进内皮细胞的围细胞生长21,25,传递血管生成生长因子,诱导血管化20,26,使用细胞片技术,允许控制血管分层20,并制造高多孔的脚手架结构,促进血管生成27。上述方法侧重于血管生成诱导,这通常需要大量的额外生长因子(如VEGF)和时间形成。然而,最大的缺点是它们有限的可重复性和对血管模式的空间控制受限,通常导致组织结构内的随机血管分布,不一定有利于灌注。
增材制造(AM,如 3D 生物打印)越来越多地使用生物或生物相容性材料制造 3D 结构,以创建适合 TE 的脚手架。正在并行使用和开发几种 AM 方法(例如,基于喷墨和微挤网的方法、不同类型的平版印刷技术),以生产能够模仿原生组织在结构、生物化学和功能方面的支架.个别技术表现出某些优缺点28,这就是为什么各种修改正在探索(例如,微模式,诱导血管生成等),以增加大,复杂和稳定血管的程度网络可以制造22,29,30。
其中,挤出生物印刷是最常用的方法,特别是由于广泛的兼容材料(一般细胞友好工艺28,31,32),以及特殊的多功能性应用条款(例如嵌入式和牺牲印刷23、33、制造空心结构34、35等)。当前研究的主要挑战包括从 2D 结构转移到 3D 结构,形成具有高空间分辨率的密集空心管网络,以及细胞培养中流体流动期间的整体机械完整性和形状保真度条件30.
对可渗透组织最直接的方法是在构造中构建一个互连的通道网络。在组织支架内建立这种可渗透通道有望解决上述许多问题,因为它能立即在清除废物的同时扩散营养和氧气。因此,避免了构造内坏死区的潜在形成36。这种通道可以另外播种与内皮细胞(ECs),并作为人造血管在3D组织模型37。在最基本的意义上,容器可以由空心通道、软层 EC 和硬壳组成。最近,使用同轴针进行挤出的两种不同材料的 3D 挤出获得了极大的兴趣,38、39、40、41,因为它允许制造空心管。
与传统的微挤离 3D 打印类似,核心/壳体打印使用同轴喷嘴执行(例如,两个直径不同的针以一种方式对齐在同一轴上,以便较宽的针包围较窄的针)。因此,两种材料可以同时拉伸,一种作为中央灯丝或"内部"芯,另一种作为"外部"外壳41。迄今为止,已利用同轴生物印刷法制造具有固体42、核心/壳43和空心绞线40、44的结构;然而,所使用的材料尚未针对印刷结构的最佳细胞活力和机械鲁棒性进行优化。如前所述,该技术提供了将具有不同机械特性的生物材料相结合的可能性,其中较硬的材料支持较软的材料。更重要的是,如果脚手架材料(例如,藻酸盐、碳化物甲基纤维素)作为外壳被挤出,而由交联剂(例如氯化钙)组成的芯从内毛细管中分配,然后在印刷后冲洗出来,则有可能在一个步骤45中制造一个连续的空心管。
考虑到这一点,开发了一种简单且可重复的一步法,用于构建定义明确且可渗透的脚手架,用于血管结构和其他管状组织的工程。要开发经济高效的技术,理想情况下,制造应该是一个单步过程。因此,对核心/外壳设置进行了调整,并将其集成到 3D 生物打印机中。基本设计由金属制成的中央喷嘴组成,以避免喷射过程中变形,围绕该喷嘴放置一个直径较大的第二个喷嘴。这种共轴喷嘴设置允许两个流量的共挤和挤出水凝胶通道的即时交联。这使得多层空心丝的直接制造,而随后与高浓度氯化钙(CaCl2)的交联可确保从外部更永久地稳定。
因此,此方法允许同时打印脚手架和微通道,其中空心水凝胶灯丝作为支架,以支持 3D 结构的机械完整性,同时作为内置微通道提供细胞生长的营养。该协议提供了核心/壳体 3D 生物打印策略的详细过程,该策略基于使用定制的同轴喷嘴,其中水凝胶 3D 结构与内置通道通过控制交联来生产空心丝,在细胞培养过程中仍然具有可渗透性。
本作品中使用的 3D 打印设置按巴诺维奇和维哈尔46之前所述进行配置,可分为三个主要组件:A) 三轴 CNC 机械设置,在 X、Y 和 Z 方向具有 50 μm 定位精度;B) 两个挤出机,适用于一次性的5 mL luer锁注射器,具有1.2 μL体素分辨率;和 C) 控制电子和软件。
为了便于芯/壳打印,开发了一个合适的喷嘴,可安装在其中一个挤出机(主挤出机,打印型芯)上,并与 G27 钝端针兼容。它还具有 luer 锁兼容性,可与第二个挤出机连接(打印外壳)。第一批原型是通过将钝端 G27 针(内径 = 210 μm,外径 = 410 μm)插入 G21 针(内径 = 510 μm,外径 = 820 μm)或 G20 锥形尖端(内径 = 600 μm)或 G20 锥尖(内径 = 600 μm)进行制造,然后插入二次 n横向提供外壳材料。但是,由于针轴轻微弯曲,无法产生与内针和外针同心对齐的喷嘴尖端。
为了解决这个问题,设计了符合以下标准的新喷嘴设计:1)它可以使用3轴数控铣床制造,2)它可以由各种材料(高性能塑料,如PEEK或金属)制成,3)具有锁的兼容性用于应用外壳材料,4) 与 G27 钝端针兼容,并将其固定在两个位置,使尖端与中轴对齐。喷嘴原型的示意图如图1所示。
研究方案
1. 制备水凝胶和交联解决方案
- 简单地说,通过大力混合,在超纯水中溶解ALG和CMC粉末,获得总共3wt%ALG和3wt%CMC溶液。
注:在本作品中,5 mL注射器用于打印;因此,最终材料量将调整到该体积。但是,对于其他挤出盒和打印样品尺寸,应相应地调整制备材料的数量。 - 在 ALG-CMC 混合物中加入 1.5 wt% 纤维素纳米纤维,以增强额外的机械增强,达到所需的粘度,适合印刷。
- 使用架空混合器搅拌水凝胶悬浮液,直到均匀。
注:水凝胶中不应存在纤维或气泡。 - 在超纯水中制备10mL的100mM氯化钙(CaCl2)溶液,作为印刷的主要交联溶液。
- 在超纯水中制备 10 mL 的 5 wt.% CaCl2溶液,在脚手架后处理中用作二次交联解决方案。
注:通常,所有适用于即时化学交联的水凝胶配方,允许一步制造空心管,并可用于这种类型的芯/壳设置。需要相应地优化打印和交联机制。水凝胶的粘度会因所需的成分而异;然而,它可以调整与聚合物浓度和增稠剂(如纳米纤维)的添加。稳定结构 3D 打印的理想粘度足够高,使拉伸灯丝保持其形状,使支架在交联前保持自己的重量。
2. 可渗透脚手架的核心/外壳打印
- 在打印之前,通过彻底喷洒 70% 乙醇对生物打印机进行消毒,并将其暴露在紫外线下 1 小时。
- 打开生物打印机并运行控制软件,该软件与 3D 打印机捆绑在一起。
- 通过按"主页"图标执行定位过程。
- 使用工具栏命令文件|导入 G 代码,导入生成的基架 g 代码。
- 将水凝胶转移到无菌的 5 mL 注射器中,并将其放入 3D 打印机的挤出机支座之一。通过锁芯和短管,将其连接到芯/壳喷嘴的侧芯输入。
- 将交联溶液(100 mM CaCl2)转移到另一个无菌 5 mL 注射器,并连接 G27 钝端针头,并将其插入芯/壳喷嘴的顶部针架。内针应从外芯/壳体喷嘴稍微伸出(±1 毫米)。手动调整对齐方式。将第二个注射器插入挤出支座。
- 要将注射器正确插入支座(如图 2所示的设置),请单击 A和 B以及向上和向下箭头手动控制两个拉伸支座。
- 在开始打印之前,分别挤出水凝胶和交联溶液,以清除芯/壳喷嘴中的所有多余的气泡,并确保水凝胶流。
- 使用Z和向上和向下箭头手动调整喷嘴和打印基板之间的距离。建议使用平板玻璃印刷基板,具有良好的附着力。挤出喷嘴不应与基板接触,以允许水凝胶不间断流动。喷嘴和基板之间的最佳距离(层高度)通常与外部喷嘴直径的宽度相同,但会根据所用材料和各个打印参数进行调整。根据个人需要调整开始打印高度。
- 按"播放"按钮开始打印过程。
注:建议在脚手架周围包括印花裙子(图3),以确保在开始打印实际脚手架之前铺设均匀的空心灯丝。实现最佳水凝胶流,意图打印最佳脚手架,改变配方组成,交联溶液组成,以及打印参数(即打印速度、挤出压力、打印温度、两者之间的距离)基板和挤出喷嘴等)。 - 打印后,小心地取出带有打印脚手架的基板,并将二次交联溶液(5 wt.% CaCl2)倒在整个脚手架上,以确保整个脚手架上的交叉链接。在室温 (RT) 下孵育 1 分钟。
注:确保整个基架淹没在交联解决方案中。此步骤对于实现脚手架所需的强度特性至关重要,但会因所使用的材料和交联方法而异。 - 使用手术刀手动切割多余的裙子材料。
- 在紫外线下对脚手架进行30分钟的消毒。小心地翻转脚手架并重复灭菌过程。
- 轻轻侧拉支架,小心地将脚手架从基板上拆下。如果支架牢固地粘附在基板上,则通过在基板之间插入锋利的边缘来将其分开。
- 将支架转移到无色细胞培养基培养基(DMEM辅以5 wt.%FBS、100 U/mL青霉素和1毫克/mL链霉素),并在含有5 wt.% CO2的氛围中孵育,至少24小时。
3. 内皮细胞和活/死测定溶液的制备
- 对于细胞培养,准备先进的DMEM细胞培养基,加入苯酚红,并补充5wt.% FBS和2 mM L-谷氨酰胺。加入100 U/mL青霉素和1毫克/mL链霉素。
- 启动人类脐带内皮细胞(HUVEC)线,并按照HUVEC培养方案通过,如描述47。
注:建议在细胞培养基培养中培养带有苯酚红的细胞,以便在将细胞注射到白色半透明支架中进行简单可视化,如下所述。 - 对于细胞计数,移液器100μL的细胞悬浮在细胞培养基,并染色他们与900μL的0.1wt.% 锥蓝色溶液。
- 使用自动细胞计数器或手动血细胞计对悬浮细胞的估计数量进行计数和获取。
- 对于活/死测定,在无菌PBS中制备4mM钙辛-AM和2 mM碘化钠溶液。
注:在进行测定之前,应直接准备活/死溶液。
4. 将细胞转移到脚手架
- 从细胞培养基中取出脚手架,并将其转移到足够大的玻璃培养皿中。
- 在将细胞注射到支架之前,使用0.25 wt.%胰蛋白酶处理,将HUVECs与烧瓶分离。
- 简单地说,在37°C下,处理细胞培养基,用0.25 wt.% 胰蛋白酶(±2 mL)孵育细胞5分钟。
- 孵育后,向胰蛋白酶化细胞中加入+3 mL的细胞培养基,并将所有分离的细胞转移到离心管中。
- 在200 x g下将细胞离心5分钟,并处理上清液。
- 在新鲜细胞培养基中重新悬浮细胞。
- 如前所述,对单元格进行计数。根据个人需要调整细胞总浓度。在这项工作中,使用340,000个细胞/mL的起始浓度。
- 用连接的钝G27针将细胞重新固定在无菌注射器中。
- 找到入口点,开始小心地将细胞注入基架。通过半透明支架的细胞悬浮液应可见。确保整个支架充满电池悬架。
- 将基架浸入细胞培养基培养基中,在含有5 wt.% CO2的大气中在37°C下孵育,长达10天。
- 根据实验需要补充细胞培养基。
5. 活/死测定和细胞成像
- 孵育后,用PBS冲洗脚手架。
- 用钝端针,小心地将先前制备的活/死溶液(PBS 中的4 mM钙素-AM和2 mM碘化钠)注射到脚手架中,并在37°C下在PBS中孵育30分钟。确保解决方案流经整个基架的长度。
- 用 PBS 冲洗脚手架。
- 小心地将脚手架转移到玻璃滑块上。
- 在荧光显微镜下直接观察脚手架上的染色细胞。
注:活细胞产生绿色荧光,死细胞发出红色荧光。
结果
这项工作的目的是开发一种易于制造的核心/壳喷嘴,其核/壳结构的核心/壳印刷具有luer兼容性。此外,还描述了一种简单且可重复的一步打印协议,它易于修改,并适合各种材料和不同的化学交联机制,以构建定义明确且可渗透的脚手架。血管和其他管状组织结构的工程。
芯/壳喷嘴
喷嘴由 G27 钝端针(用于打印内轴向灯丝)和喷嘴主体组成,后者将针头固定到位,并为外壳灯丝创建外部喷嘴,并带有用于材料输入的连接端口。图1显示了原理图。 两个 5 mL 注射器,它们被放置在单独的挤出机中,并提供芯和壳体材料。管将喷嘴体与注射器连接,提供外壳材料。
核心/壳体喷嘴和注射器设置的完整组件如图2所示。喷嘴体的第一个功能原型由 CNC 铣削聚氧乙烯 (POM) 制成。通过安装在 Vitaprint 中,测试了元件、G27 针和管之间的兼容性和密封性。在喷嘴、锁紧接头或车身和针头之间未发现壳体材料泄漏。喷嘴主体与针轮毂(luer 连接器)紧密配合,确保整个喷嘴与挤出机同步运动。
脚手架建筑
制造脚手架的最直接方法是逐层沉积材料,每个连续层(通常以 90° 角)更改打印方向。由于水凝胶的粘弹性和吸湿特性,保持印刷结构的形状保真度仍然具有挑战性。此协议部分的主要目的是使用两种聚合物对可渗透的核心/外壳支架进行 3D 打印,这两种聚合物之前已显示出脚手架建筑(ALG 和 CMC)的可喜成果,并添加纤维素纳米纤维 (NFC), 以增强机械稳定性。ALG 和 CMC 均带负电荷,水溶性线性共聚物48且均含有 Carboxyl 基团,可与二价阳离子的添加相互关联。Ca2+颗粒与两个功能组同时形成离子键,在聚合物链之间形成连接,提高凝胶刚度。
可使用脚手架的打印
这个过程的目的是3D打印简单的木桩脚手架结构,跨越多个层,并保持其形状保真度,以及渗透性,直到成为完全交联。这甚至需要核心和外壳的共挤,无需交叉或回缩运动,这可能会中断流量。因此,典型的CAD建模和切片方法不太合适。在这项工作中,使用手动设计的 g 代码,并开发了一个基于 python 的 g 代码生成器,用于快速编写 g 代码。
脚手架以木桩网格形状结构,建在平坦的玻璃表面上。制造是逐层进行的,将每个后续层的交叉线与上一层的角度90°。此外,在 X 和 Y 方向中,每个后续层的窄 2%,确保前一层的连续灯丝支撑。通过考虑拉伸灯丝的外径(0.8 mm)和网格线之间的距离(3 mm),可以在 g 码中精确设计灯丝之间的距离(宏孔尺寸)。
脚手架需要满足关键包含标准,以便进一步考虑。首先,在印刷过程中,需要至少4层高的脚手架保持其结构完整性和几何形状(例如宏孔尺寸),才有资格进行进一步开发。其次,即使在37°C的细胞培养基培养基中孵育7天后,脚手架也需要保持可渗透(稳定的微通道)。在适当的时间间隔(1、2、5 和 7 天)将脚手架从培养介质中取出并进行测试,看它们是否仍然可用。在图4A中,新印刷和经过后加工的脚手架的横截面在灯丝内显示一个清晰可见的空心通道。在图4B中,很明显,即使在细胞培养基培养基在37°C下孵育72小时后,灯丝在整个支架长度中仍保留空心结构。
几种配方可印刷,结构稳定,保留了印刷几何形状,并且保持可渗透性;但是,选择一个用于进一步测试(即 3 wt.% ALG = 3 wt.% CMC = 1.5 wt.% NFC),允许打印最多 10 层可使用的脚手架。使用自定义喷嘴的打印过程如图5A所示。核心/壳打印是可能的,粘性较差的配方;然而,浓度较高的凝胶不允许连续流过喷嘴。对于初级交联(核心材料,在打印过程中交付)100 mM CaCl2被使用,这充分稳定了空心灯丝的连续形成,而不会在喷嘴内造成凝胶凝固。印刷后,脚手架浸泡在 5 wt.% CaCl2溶液中,完全交叉连接水凝胶,获得长期形状保真度。图5B中所示,已完成的基架示例。在优化过程中,在核心溶液中采用人工染料的配方过程,以便进行视觉评估和检查挤出灯丝的质量。该染料没有用于制造最后的脚手架,这些脚手架是为细胞播种和种植而准备的。
活/死测定
孵育后,使用活/死测定来可视化EC,并区分孵化脚手架内的活(绿色)和死(红)细胞。这有两个主要目的:A) 确定支架是否提供生物相容性环境,以促进生长和粘附,而不对细胞造成有害影响;B) 形象化管状结构的结构完整性及其内部通道系统。
活/死测定的结果如图6所示。在细胞内酯类存在的情况下,血浆膜渗透的钙质-AM被转换成钙质,在活细胞中发出绿色荧光光。另一方面,凋亡细胞被膜不透水的碘化钠可视化,当在DNA双螺旋中穿插时,碘化钠会发出红色荧光。将脚手架的实时/死图像和明亮场图像相结合,帮助可视化空心通道内的细胞。注射染色溶液,在脚手架细胞孵育48小时后,直接在3D打印脚手架中进行测定。
应该指出,使用EC的种子密度相对较小(340,000个单元/mL),因为这项研究仅作为可渗透脚手架核心/壳打印的概念证明。活/死测定的最重要结论是,即使在48小时后,也没有观察到死细胞(红色),证明脚手架材料本身及其降解产物均无毒性作用。此外,EC实际上确实坚持并固定在脚手架内,当在通道内生长时,似乎形成均匀分布的聚集体。这表明,所述的制造方法和脚手架配方为在体内构建相关管状组织形态提供了一个合适的框架。除了在所有三个空间维度中模拟细胞-ECM相互作用和紧密的细胞-细胞通信外,复杂的组织工程还需要不断的细胞接触新鲜介质,以维持其生存能力。反过来,这可以通过连续灌注的密集通道网络来实现,这需要进一步研究,并且需要优化材料和生长参数,以促进血管的长期组织工程。
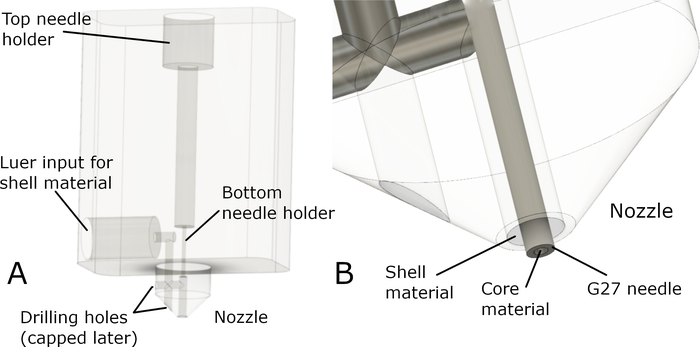
图1:芯/壳喷嘴原型。(A)显示了喷嘴体原型的总体设计和主要部件。喷嘴通过顶部插入钝端 G27 针完成。顶部和底部针架固定和重新对齐针与喷嘴轴,确保尖端从喷嘴延伸到中心。 要将喷嘴与从辅助注射器挤出的"壳"材料连接,将带锁紧接头的管道连接到侧侧输入。从这里,材料通过狭窄的通道转发到喷嘴。上述通道的制造需要在两个位置钻孔,从而产生制造后需要盖上盖的孔)。(B)图所示是喷嘴的特写,带有插入的 G27 指针,伸出喷嘴。请点击此处查看此图的较大版本。
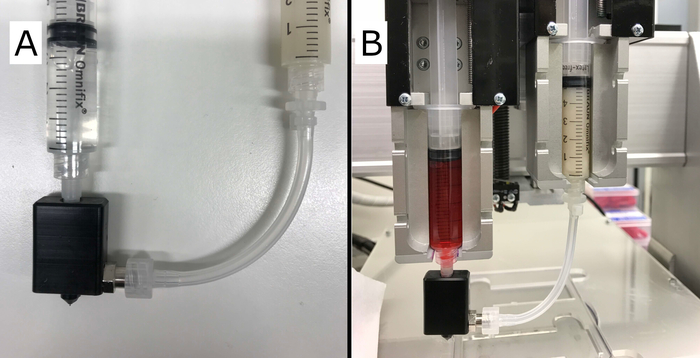
图 2:最终核心/外壳设置。(A)所示为已完成的芯/壳喷嘴,其正确连接的注射器包含水凝胶(右),构建"壳"和交联溶液(左)挤压为"核心"。(B)图所示是安装在 Vitaprint 系统中的芯/壳装置,带有两个挤出机。请点击此处查看此图的较大版本。
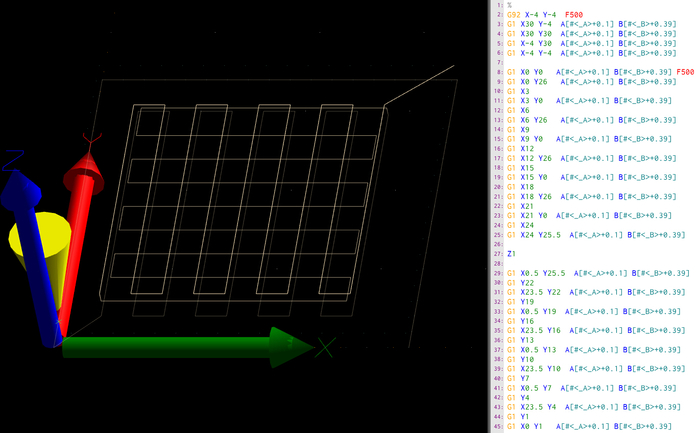
图3:管状支架的G代码。这里显示了打印机软件的屏幕截图,特别是第一层(B) 的路径预览 (A) 和原始 g 代码。g 代码是一组指令,目标坐标在绝对空间方向(X、Y、Z)上,以及相对方向的拉伸 (A、B)。G 命令确定指令类型,而 G1 表示向目标坐标的线性移动,G92 确定初始起始位置。此外,以下命令的馈送速率由指令 F 以毫米/分钟为单位确定。请点击此处查看此图的较大版本。
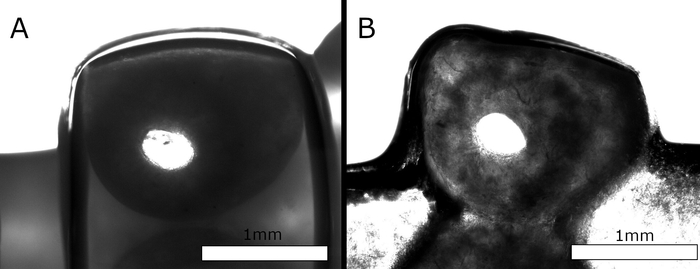
图4:脚手架链的横截面,内部为空心。(A)图所示为新印刷和经过后加工的支架的横截面切片。(B)图所示为在细胞培养基中孵育 72 小时后脚手架的横截面切片。虽然喷嘴形状定义了具有圆形横截面的管的挤出,但灯丝在沉积时似乎有些扁平。然而,内部通道在孵育期间保持完整并保持其形式。请点击此处查看此图的较大版本。
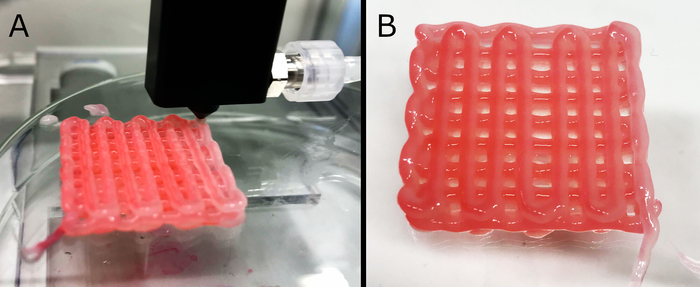
图5:脚手架的核心/外壳打印。这里显示了三层空心管脚手架的制造 (A) 及其最终形式 (B) .为了改进可视化效果,核心中的交联解决方案被红色染料染色。该配方具有足够的机械稳定性,可保持脚手架的稳定性,即使结构较厚(最多 10 层,数据未显示)是制造的。最终结构的外层尺寸约为27毫米x27毫米x3.5毫米。请点击此处查看该图的较大版本。
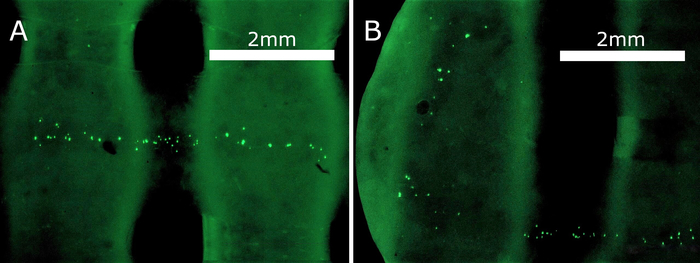
图6:直接在脚手架上进行现场/死测定。HUVECs的悬浮液被注入内脚手架通道,孵育48小时,用活/死染料处理。可行的HUVECs发出绿色荧光,在图像的亮点中表示。死细胞发出绿色荧光;但是,在观察到的脚手架中看不到任何功能。细胞的分布也表示通道的形状和保留的灌注功能。在较小程度上,活/死测定溶液还染色了脚手架材料,在显微镜下产生荧光。请点击此处查看此图的较大版本。
讨论
喷嘴设计
使用开发的核心/外壳喷嘴,集成到双挤出Vitaprint系统中,空心的管状脚手架在单步工艺中制造。为了通过大多数准备好的脚手架实现管壁的均匀厚度,针需要集中放置在外挤压环的轴上。标准仪表指针通常从轴上表现出轻微但显著的偏心。因此,喷嘴主体设计为将针头固定在两个位置,一次在顶部(固定轮毂),一次在最终芯/壳室之前(固定管扣本身),以校正其轴向对齐。轴向对齐的精度随固定点之间的距离而增加。但是,在针长度和可用喷嘴室体积之间有一个权衡。为了进一步提高设置的功能,可以对喷嘴进行某些修改:A) 喷嘴安装具有更高的稳定性,B) 附加喷嘴,用于更广泛的针相容性,C) 针到喷嘴定位和 D) 集成额外的输入和微流体设备,用于飞行材料制备。
水凝胶优化
为了确定最佳 ALG:CMC 比率,评估了多个材料迭代。通常,两个组件的浓度超过 3 wt.% 的芯/壳打印都是不可能的,因为它不允许连续的水凝胶流动或导致喷嘴堵塞。具体来说,ALG浓度超过3 wt.%会增加粘度,导致喷嘴堵塞,而较低的ALG浓度和较高的CMC(>3 wt.%)浓度减缓了交联时间,因此无法提供足够的脚手架的结构支撑。核心/壳打印是可能的,粘性较差的配方;然而,挤出凝胶粘度必须足以维持长期形状保真度。最后,1:1 ALG:CMC比率被证明是最合适的选择,这证实了Maver等人先前的研究。NFC 的加入显著提高了型芯/壳打印支架的可打印性和结构刚度,但对材料的交联性能没有显著影响。
针对特定细胞类型和实验设置进行优化的定制应用将需要经过精心定制的脚手架材料,这些材料的组成和交联机制各不相同。本工作中描述的方法基于藻酸盐-纤维素混合聚合物溶液,该溶液使用Ca2+离子进行交联电通。藻酸盐本身是一种线性聚合物块(1,4)链接β-d-曼诺酸酯(M)和β-l-古罗酸(G)残留物,可以通过Ca2+和其他二价阳离子的应用,如Sr2+,Br2+,Mg,可逆电并联2+.然而,最广泛使用的环联藻酸盐的电子仍然是Ca2+的形式Ca22。Ca2+也可以以 CaSO4或 CaCO3的形式使用 ;然而,相对于CaCl 2,CaSO4的低溶解度意味着凝胶化速度较慢。CaCO3产生更慢的凝胶化时间,这可能导致机械性能弱和不一致。
较长的凝胶化时间通常产生更均匀的结构,但是,某些应用,如芯/壳打印需要快速凝胶率50。Mg2+离子也诱导凝胶化;然而,与Ca2+相比,它们的交联效率降低了约5倍-10倍,交联时间为2-3小时。此外,镁离子对古语单位更具选择性,因此交联更依赖于ALG51的化学成分。在这种情况下,快速凝胶率对于确保空心结构在空心结构坍塌之前连续形成至关重要。CaCl2产生最快的凝胶率,这对空心丝的直接沉积至关重要。使用了 100 mM CaCl2,充分稳定了空心灯丝的连续形成,而不会在喷嘴内造成凝胶凝固。
脚手架的印刷和后处理
在此过程的这一部分,应考虑以下步骤,包括 1) 确保所有溶液和材料(包括 3D 生物打印机)在打印前都经过适当消毒。2) 制备水凝胶时,材料的均匀性对于连续打印至关重要。应避免引入杂质或气泡,因为它们会堵塞喷嘴和/或破坏挤出。3) 注射器应通过 luer 锁机构正确连接到芯/壳喷嘴,并正确插入挤出机支座,如图2A,B所示。4) 在打印复杂结构之前,建议预先挤出凝胶和交联溶液的一小部分,以清除芯/壳喷嘴中的多余气泡,并确保水凝胶流连续。这可以直接合并到 g 代码中,以提高可重复性。5) 在脚手架周围添加一条裙,以确保在脚手架本身开始打印之前铺设均匀的空心灯丝, 这很有帮助。
此外,6) 为了改善印刷灯丝和基板之间的附着力,建议使用粘附良好的平面(即玻璃滑块或培养皿)。7) 挤出喷嘴不应直接接触基板,以便水凝胶能够不间断地流动。初始距离将强烈地影响打印质量,但拉伸灯丝的厚度是初始设置的近似值。8) g 代码中的起始打印高度应根据个人需要进行调整。优化打印参数后,应将基架 g 代码导入行星 CNC 软件,并启动协议中所述的打印过程。9) 为了控制和优化水凝胶流,以打印最佳脚手架,配方组成和打印参数应变化(即打印速度、挤出压力、打印温度、基材与挤出喷嘴、层高度、支架尺寸等)。
通常,打印粘度较高的配方需要更高的流速。如前所述,所有适用于即时化学交联的水凝胶配方均允许一步制造空心管,并可与所述芯/壳设置一起使用。需要相应地优化打印和交联机制。打印后,所有支架均通过二次交联与 5 wt.% CaCl2解决方案进行后处理,确保 ALG-CMC 组件完全交联,并在紫外线下从两侧进行至少 30 分钟的消毒。应确保用交联解决方案完全吞噬脚手架,并孵育足够长的时间,以完成交联过程。后处理会因所使用的材料和交联机制而异,应事先考虑。经过后处理后,应小心地从基材中取出支架,转移到细胞培养基中,并在受控环境中孵育至少24小时,然后再进行细胞播种。使用无色介质将提高注射到支架期间细胞悬浮液的可见性。
活/死测定
活/死溶液应在进行测定前直接制备,并在进行测定前保持在黑暗中,因为它含有容易漂白的荧光染料。在所需的孵育时间后,应小心地丢弃脚手架周围的细胞培养基培养物,然后用PBS冲洗。理想情况下,同一入口点应用于细胞播种,然后将活/死测定注入脚手架。
结果的重要性
ALG 和 CMC 已经用于促进体外血管生成。基于ECM-模组特性、物理交联和生物相容性,ALG通常用作血管生成生长因子(例如,bFGF、HGF、VEGF164和Ang-1_分别)的传递和控制释放的部件,52,53,54.此外,与明胶结合,CMC也被用于封装血管内皮细胞,由于其快速交联能力在生理条件下55。增加了NFC以进一步提高脚手架的机械稳定性和形状保真度。应该强调,目标不是加强血管化,而是证明有可能生产可渗透的、空心的ALG-CMC脚手架,以核心/外壳方式印刷,这也有助于附件和扩散胡韦克斯。使用 ALG-CMC 混合物的选择基于常用、易于获取和生物相容的基材的发现,这些材料可实现空心通道的核心/外壳打印。许多其他材料可能是增强血管生成更可行的选择;然而,有些不适合芯/壳打印,因为它们不利于快速凝胶化/交联,这在这种方法中至关重要。
披露声明
提交人宣称,他们没有相互竞争的经济利益。
致谢
作者感谢斯洛文尼亚研究局(赠款编号:P3-0036和I0-0029)和科学、教育和体育部(赠款号码:5442-1/2018/59)为该项目提供的财政支助。
材料
| Name | Company | Catalog Number | Comments |
| Alginic acid sodium salt | Sigma-Aldrich (Germany) | 180947 | powder; Mw ~80,000 |
| ATTC HUV-EC-C [HUVEC] | LGC Standards (UK) | ATCC-CRL-1730 | Endothelial Cell Growth Supplement (ECGS) and unidentified factors from bovine pituitary, hypothalamus or whole brain extracts are mitogenic for this line; the cells have a life expectancy of 50 to 60 population doublings. |
| Axiovert 40 inverted optical microscope | Carl Zeiss Microscopy GmbH (Germany) | three contrastingtechniques in one objective – e.g. brightfield,phase contrast and PlasDIC | |
| Calcium chloride | Sigma-Aldrich (Germany) | C1016 | anhydrou; granular; ≤7.0 mm; ≥93.0% |
| Cellulose nanofibrils suspension (NFC, 3% (w/v)) | The Process Development Center, University of Maine (Maine, USA) | nominal fiber width of 50 nm; lengths of up to several hundred microns | |
| ELGA Purelab water purification system | Veolia Water Technologies (UK) | ||
| EVOS FL Cell Imaging System | ThermoFisher Scientific Inc. (Germany) | AMF4300 | a fully integrated, digital, inverted imaging system for four-color fluorescence and transmitted-light applications |
| Gibco Advanced Dulbecco’s modified Eagle’s medium (Advance DMEM) | ThermoFisher Scientific Inc. (Germany) | 12491015 | high glucose; no glutamine; phenol red |
| Gibco Dulbecco’s modified Eagle’s medium (DMEM) | ThermoFisher Scientific Inc. (Germany) | 21063029 | high glucose; L-glutamine; HEPES; no phenol red |
| Gibco Fetal Bovine Serum (FBS), qualified | ThermoFisher Scientific Inc. (Germany) | 10270106 | FBS origin: Brazil; 5 % (w/v) FBS |
| Hypodermic Sterican needle | B. Braun Melsungen AG (Germany) | 9180117 | 0.40 x 25mm, 27G x 1'' |
| L-glutamine | Sigma-Aldrich (Germany) | G3126 | ReagentPlus®, ≥99% (HPLC) |
| Live/Dead Cell Double Staining Kit | Sigma-Aldrich (Germany) | 4511 | contains calcein-AM and propidium iodide (PI) solutions; suitable for fluorescence |
| Nunc EasYFlask cell culture flasks | ThermoFisher Scientific Inc. (Germany) | 156367 | Nunclon Delta certified for monolayer formation, cloning efficiency, non-cytotoxic, non-pyrogenic, and sterility; filter caps; culture area of 25 cm2 |
| Omnifix syringe | B. Braun Melsungen AG (Germany) | 4617053V | 5 mL Luer Lock |
| Penicillin G sodium salt | Sigma-Aldrich (Germany) | P3032 | powder; BioReagent; suitable for cell culture |
| Phosphate buffered saline | Sigma-Aldrich (Germany) | P4417 | tablet; one tablet dissolved in 200 mL of deionized water yields 0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4, at 25 °C |
| Sodium carboxymethyl cellulose | Sigma-Aldrich (Germany) | 419338 | powder; average Mw ~700,000 |
| Streptomycin sulfate salt | Sigma-Aldrich (Germany) | S9137 | powder; BioReagent; suitable for cell culture |
| Ultra-pure water | Veolia Water Technologies (UK) | 18.2 m? cm at 25?C | |
| VitaPrint 3D bio-printer | IRNAS (Slovenia) |
参考文献
- Langer, R., Vacanti, J. Advances in tissue engineering. Journal of pediatric surgery. 51 (1), 8-12 (2016).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), (2012).
- Khademhosseini, A., Vacanti, J. P., Langer, R. Progress in tissue engineering. Scientific American. 300 (5), 64-71 (2009).
- Wobma, H., Vunjak-Novakovic, G. Tissue Engineering and Regenerative Medicine 2015: A Year in Review. Tissue Engineering Part B: Reviews. 22 (2), 101-113 (2016).
- Park, K. M., Shin, Y. M., Kim, K., Shin, H. Tissue Engineering and Regenerative Medicine 2017: A Year in Review. Tissue Engineering Part B: Reviews. 24 (5), 327-344 (2018).
- Mattei, G., Giusti, S., Ahluwalia, A. Design criteria for generating physiologically relevant in vitro models in bioreactors. Processes. 2 (3), 548-569 (2014).
- Elliott, N. T., Yuan, F. A review of three‐dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2011).
- Breslin, S., O’Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5-6), 240-249 (2013).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews Drug Discovery. 15 (11), 751-769 (2016).
- Di Nardo, P., Minieri, M., Ahluwalia, A. . Stem Cell Engineering. , 41-59 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: general approaches and a review of recent developments. Journal of the Royal Society Interface. 8 (55), 153-170 (2011).
- Tayalia, P., Mooney, D. J. Controlled growth factor delivery for tissue engineering. Advanced Materials. 21 (3233), 3269-3285 (2009).
- Caddeo, S., Boffito, M., Sartori, S. Tissue Engineering Approaches in the Design of Healthy and Pathological In Vitro Tissue Models. Frontiers in Bioengineering and Biotechnology. 5, 40 (2017).
- Chang, H. -. I., Wang, Y. . Regenerative medicine and tissue engineering-cells and biomaterials. , (2011).
- Rice, J. J., et al. Engineering the regenerative microenvironment with biomaterials. Advanced Healthcare Materials. 2 (1), 57-71 (2013).
- Khademhosseini, A., Langer, R. A decade of progress in tissue engineering. Nature Protocols. 11 (10), 1775-1781 (2016).
- Yu, Y., Alkhawaji, A., Ding, Y., Mei, J. Decellularized scaffolds in regenerative medicine. Oncotarget. 7 (36), 58671-58683 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and bioengineering. 103 (4), 655-663 (2009).
- Lovett, M., Lee, K., Edwards, A., Kaplan, D. L. Vascularization strategies for tissue engineering. Tissue Engineering Part B: Reviews. 15 (3), 353-370 (2009).
- Rouwkema, J., Rivron, N. C., van Blitterswijk, C. A. Vascularization in tissue engineering. Trends in Biotechnology. 26 (8), 434-441 (2008).
- Bae, H., et al. Building vascular networks. Sci Transl Med. 4 (160), (2012).
- Štumberger, G., Vihar, B. Freeform Perfusable Microfluidics Embedded in Hydrogel Matrices. Materials. 11 (12), 2529 (2018).
- Ibrahim, M., Richardson, M. K. Beyond organoids: In vitro vasculogenesis and angiogenesis using cells from mammals and zebrafish. Reproductive Toxicology. 73, 292-311 (2017).
- Sorrell, J. M., Baber, M. A., Caplan, A. I. Influence of adult mesenchymal stem cells on in vitro vascular formation. Tissue Engineering Part A. 15 (7), 1751-1761 (2009).
- Davies, N. H., Schmidt, C., Bezuidenhout, D., Zilla, P. Sustaining neovascularization of a scaffold through staged release of vascular endothelial growth factor-A and platelet-derived growth factor-BB. Tissue Engineering Part A. 18 (1-2), 26-34 (2012).
- Li, X., He, J., Zhang, W., Jiang, N., Li, D. Additive manufacturing of biomedical constructs with biomimetic structural organizations. Materials. 9 (11), 909 (2016).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773 (2014).
- Hasan, A., et al. Microfluidic techniques for development of 3D vascularized tissue. Biomaterials. 35 (26), 7308-7325 (2014).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Advanced Materials. 26 (19), 3124-3130 (2014).
- Huang, Y., Zhang, X. F., Gao, G., Yonezawa, T., Cui, X. 3D bioprinting and the current applications in tissue engineering. Biotechnology Journal. , (2017).
- Wang, X., et al. 3D bioprinting technologies for hard tissue and organ engineering. Materials. 9 (10), 802 (2016).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Rocca, M., Fragasso, A., Liu, W., Heinrich, M. A., Zhang, Y. S. Embedded Multimaterial Extrusion Bioprinting. SLAS Technology. 23 (2), 154-163 (2018).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Huang, S., Yang, Y., Yang, Q., Zhao, Q., Ye, X. Engineered circulatory scaffolds for building cardiac tissue. Journal of Thoracic Disease. 10 (Suppl 20), S2312-S2328 (2018).
- Hoch, E., Tovar, G. E., Borchers, K. Bioprinting of artificial blood vessels: current approaches towards a demanding goal. European Journal of Cardiothoracic Surgery. 46 (5), 767-778 (2014).
- Yeo, M., Lee, J. S., Chun, W., Kim, G. H. An Innovative Collagen-Based Cell-Printing Method for Obtaining Human Adipose Stem Cell-Laden Structures Consisting of Core-Sheath Structures for Tissue Engineering. Biomacromolecules. 17 (4), 1365-1375 (2016).
- Liu, W., et al. Coaxial extrusion bioprinting of 3D microfibrous constructs with cell-favorable gelatin methacryloyl microenvironments. Biofabrication. 10 (2), 024102 (2018).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Akkineni, A. R., Ahlfeld, T., Lode, A., Gelinsky, M. A versatile method for combining different biopolymers in a core/shell fashion by 3D plotting to achieve mechanically robust constructs. Biofabrication. 8 (4), 045001 (2016).
- Colosi, C., et al. Microfluidic Bioprinting of Heterogeneous 3D Tissue Constructs Using Low-Viscosity Bioink. Advanced Materials. 28 (4), 677-684 (2016).
- Kim, G., Ahn, S., Kim, Y., Cho, Y., Chun, W. Coaxial structured collagen–alginate scaffolds: fabrication, physical properties, and biomedical application for skin tissue regeneration. Journal of Materials Chemistry. 21 (17), 6165-6172 (2011).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Mistry, P., et al. Bioprinting Using Mechanically Robust Core-Shell Cell-Laden Hydrogel Strands. Macromolecular Bioscience. 17 (6), (2017).
- Banović, L., Vihar, B. Development of an extruder for open source 3D bioprinting. Journal of Open Hardware. 2 (1), (2018).
- Habib, A., Sathish, V., Mallik, S., Khoda, B. 3D printability of alginate-carboxymethyl cellulose hydrogel. Materials. 11 (3), 454 (2018).
- Maver, T., et al. Combining 3D printing and electrospinning for preparation of pain-relieving wound-dressing materials. Journal of Sol-Gel Science and Technology. , 1-16 (2018).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: Part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Topuz, F., Henke, A., Richtering, W., Groll, J. Magnesium ions and alginate do form hydrogels: a rheological study. Soft Matter. 8 (18), 4877-4881 (2012).
- Perets, A., et al. Enhancing the vascularization of three-dimensional porous alginate scaffolds by incorporating controlled release basic fibroblast growth factor microspheres. Journal of Biomedical Materials Research Part A. 65 (4), 489-497 (2003).
- Ruvinov, E., Leor, J., Cohen, S. The effects of controlled HGF delivery from an affinity-binding alginate biomaterial on angiogenesis and blood perfusion in a hindlimb ischemia model. Biomaterials. 31 (16), 4573-4582 (2010).
- Peirce, S. M., Price, R. J., Skalak, T. C. Spatial and temporal control of angiogenesis and arterialization using focal applications of VEGF164 and Ang-1. American Journal of Physiology-Heart and Circulatory Physiology. 286 (3), H918-H925 (2004).
- Kageyama, T., et al. In situ cross-linkable gelatin-CMC hydrogels designed for rapid engineering of perfusable vasculatures. ACS Biomaterials Science & Engineering. 2 (6), 1059-1066 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。