Method Article
二进制和三元深结构系统的制备
摘要
该协议旨在使整个科学界的深层欧洲系统的准备工作标准化,以便这些系统能够重现。
摘要
制备深结构系统(DES)是一个简单的程序。根据定义,两个或多个组件以给定摩尔比混合在一起,形成 DES。然而,根据我们在实验室的经验,有必要标准化编写、描述和报告不同研究人员遵循的方法的程序,以便可以重现所发表的结果。在这项工作中,我们测试了文献中报告的不同方法,以制备环境系统,并评估水在室温下成功制备液体系统的重要性。这些已发表的eutec系统由柠檬酸、葡萄糖、蔗糖、苹果酸、β-丙氨酸、L-酒石酸和βine组成,并非所有所述制备方法都可以重现。然而,在某些情况下,有可能重现所述系统,将水作为欧特克混合物的第三个组成部分。
引言
深溶剂被命名为21世纪的溶剂,被认为是新一代的溶剂。它们被定义为两种或两种以上化合物的混合物,其比重为特定的摩尔比,导致单个组分的熔融温度显著降低,在室温1、2下变成液体。3.从这个意义上说,溶剂的制备不需要任何化学反应,因此产量为100%。2011年,Choi和同事报告了自然发生DES的可能性,并命名为它们,天然深水溶剂(NADES)3,4,5。NADES可以从糖、氨基酸、有机酸和胆碱衍生物的不同组合中制备;这些由天然成分制备的系统具有固有的生物相容性和可生物降解性,与其他替代溶剂(如离子液体)5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、6、5、 7,8.自2015年以来,该领域的出版物数量呈指数级增长,NADES的可能应用非常广泛。尽管许多手稿和评论已经出版,但一些基本问题依然存在,科学家尚未找到诸如DES形成机制等有趣问题的答案。了解DES的形成机制将导致对开发新系统采取综合办法,而不是目前的试验和错误办法。此外,随着消费者更加意识到其产品的可持续性,不仅在其最终寿命方面,而且在加工本身方面,这一机会每天都在增加。 10.为了推动深溶剂领域的重大创新,首先需要生产和表征方法的标准化。文献中报告的一些系统缺乏可重复性,这是我们多次面对这个问题时发展这项工作的动机。在此,我们证明了准确描述材料和方法的必要性和关键的重要性,并表明,虽然DES的编制是一个简单明了的程序,但有一些关键方面(例如,存在/水量),即必须始终讨论。
研究方案
注:研究的NADES为βine:L-(+)-酒石酸(2:1),β-丙氨酸:DL-苹果酸(3:2),葡萄糖:蔗糖(1:1)和柠檬酸:葡萄糖(2:1)。这些系统采用不同方法制备:冷冻干燥(FD)、真空蒸发(VE)以及带水和无水的热和搅拌(HS)。例如,给出了系统柠檬酸:葡萄糖(2:1)的协议。NADES的特点是差分扫描热度(DSC)、极化光学显微镜(POM)、含水量和核磁共振(NMR)光谱。
1. NADES 准备
- 冷冻干燥
- 在单独的容器中,加入2克柠檬酸单水合物和0.9530克葡萄糖单水合物。在每个水中加入10 mL的去离子水,搅拌,直到化合物完全溶解。
- 将两种解决方案混合在一起,确保最终解决方案的均质化。将溶液放入圆形底瓶中。
- 用液氮冷冻。将烧瓶放入冷冻干燥器中 48 小时,以确保从样品中取出所有水。
- 真空蒸发
- 在单独的容器中称量2克柠檬酸单水合物和0.9530克葡萄糖单水合物。在每个水中加入10 mL的去离子水,搅拌,直到化合物完全溶解。
- 将两种解决方案混合在一起,确保解决方案的均质化。将溶液放入圆形底瓶中。
- 使用旋转蒸发器干燥样品,直到形成透明粘性液体。
- 加热和搅拌
- 将2克柠檬酸单水合物和0.9530克葡萄糖单水合水液称重至同一小瓶中。加入278 μL的水。
- 将小瓶与磁性搅拌棒放在 50°C 水浴中。
- 离开样品,直到形成透明粘性液体。
2. NADES 特性
- 极化光学显微镜 (POM)
- 将一滴 NADES 放在显微镜玻璃幻灯片上进行观察。
- 使用显微镜的传输模式,在室温下对样品进行光学表征。
- 卡尔-菲舍尔滴定
- 在注射器中收集100μL的NADES,然后清洁外部多余的液体。
- 将注射器放在秤上,然后将其放入。
- 按 KF 设备上的START,向容器中添加一小滴样品。
- 称量注射器,进入 KF 设备上的质量,然后按ENTER。结果将以 ppm 的水为单位显示在屏幕上。
- 差分扫描热度 (DSC)
- 将每个样品的3-10毫克放入带盖盖的密封铝锅中。用样品按压机关闭平底锅。
- 使用温度范围为-90°C到降解温度的DSC分析样品,加热速率为10°C/min。在氮气(50 mL/min)下,以2分钟的等温保持执行两个循环,并进行分析。
- 核磁共振(NMR)
- 用250μL的二甲基磺酸-d6(DMSO-d6)溶解250μL的NADES,制备5毫米NMR管。
- 在 400 MHz 光谱仪上以 25 °C 采集1 个H 和 NOESY 光谱。
- 使用适当的软件分析光谱,并使用 DMSO-d6 的化学偏移(± 2.50 ppm)分配每个组件的所有信号。
结果
从NADES的制备,我们期望得到的结果如图1所示。下面将介绍每个系统。使用冷冻干燥方法,结果应该是固体或非常密集的糊状物,因为所有的水都从系统中去除。使用蒸发法,结果应该是透明粘性液体。使用加热和搅拌方法,加入少量水,结果应该是一个清晰和非常粘稠的液体。
从 POM 获得的结果如图1所示。当 NADES 完全形成时,我们期望看到一个黑色图像,表明样品是完全无定形的,并且系统中没有残留的晶体。表2描述了从KF滴定中获得的结果。除了添加到系统中的水量外,最终混合物的水量也取决于试剂的含水量。
关于DSC,该技术的目标还在于确认系统在将应用的温度范围内是液体,因此预期的结果是具有一个热图,在感兴趣的温度范围内显示没有热事件(表2)).NMR技术用于确认氢键形成的存在,这是NADES系统的主要特征。这可以通过观察每个信号的化学变化,并通过对NOESY光谱的分析来证实,该光谱显示了空间和分子间的相关性(图2)。
| 组件 1 | 组件 2 | 制备方法 | 参考 |
| 贝塔因(贝特) | L-(+)-酒石酸(LTA) | 真空蒸发 (VE) | 戴等人(2013年)5和埃斯皮诺等人(2016年)6 |
| β-阿兰宁 (β-A) | DL-马里奇酸(MA) | 真空蒸发 (VE) | 戴等人(2013年)5和埃斯皮诺等人(2016年)6 |
| 葡萄糖(葡萄糖) | 蔗糖(蔗) | 冷冻干燥 (FD) | Choi等人(2011年)4和埃斯皮诺等人(2016年) 6 |
| 柠檬酸 | 葡萄糖(葡萄糖) | 冷冻干燥 (FD) | Choi等人(2011年)4和埃斯皮诺等人(2016年) 6 |
表 1:文献中报告的系统及其制备方法。
| NADES | 制备方法 | 含水量(%) |
| 卡尔·菲舍尔测量 | ||
| 投注:LTA (2:1 + 20% 水) | 加热和搅拌,加水 | 19.94 × 1.28 |
| 投注:LTA (2:1) | 真空蒸发 | 11.36 ± 0.78 |
| +-A:MA (3:2 + 11% 水) | 加热和搅拌,加水 | 11.45 ± 0.25 |
| +-A:MA (3:2) | 真空蒸发 | 18.84 × 1.78 |
| 格鲁克:苏克(1:1 + 21%水) | 加热和搅拌,加水 | 20.88 × 0.13 |
| 格鲁克:苏克 (1:1) | 真空蒸发 | 22.56 × 0.48 |
| CA:格鲁克(2:1 + 17% 水) | 加热和搅拌,加水 | 17.33 ± 0.68 |
| CA:格鲁克 (2:1) | 真空蒸发 | 20.04 ± 0.26 |
表 2:含水量(%)用不同方法制备的系统。

图1:NADES的代表性结果,当由a)冷冻干燥,b)真空蒸发和c)加热和搅拌加水。图片显示,当系统冻结干燥时,获得的结果是晶体,因为所有水都从混合物中去除,而当使用VE和HS方法时,NADES形成所需的水量存在,所得结果是一个水室温下原体液体。请点击此处查看此图的较大版本。

图2:CA:Glu(2:1)的极化光学显微镜采用不同方法制备,具有交叉偏振器(左图)和平行偏振器(右图)=100μm(10倍放大)。黑色图像显示样品在室温下是液体。FD样品是完全结晶的,因为从该技术获得的结果不是液体。请点击此处查看此图的较大版本。
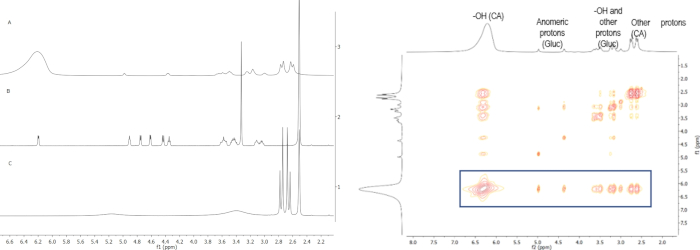
图 3:a)(A) NADES 系统柠檬酸的1H NMR 光谱:葡萄糖:水 (2:1:4)、(B) 葡萄糖和 (C) 柠檬酸;b) NADES系统柠檬酸的NOESY光谱:葡萄糖:水(2:1:4)。叠加光谱显示了DES形成时每个组分的化学变化差异,其起因是它们之间建立氢键。NOESY光谱显示来自柠檬酸的OH质子与两个组分的其余质子之间的相互作用。请点击此处查看此图的较大版本。
讨论
文献中报告的用于制备NADES的不同方法是加热和搅拌方法(HS)、真空蒸发(VE)和冷冻干燥(FD)。我们在这项工作中准备的系统是由不同的作者在文献4,5,6,10,11中描述。表1列出了原稿中报告的每种混合物的成分及其制备方法。
经过对上述系统的重现研究,我们意识到在某些情况下,不可能在室温下实现类似的NADES,即透明、粘性液体样品。准备 NADES 取决于许多因素。有些可以很容易地控制,但有些更难标准化。要考虑的最重要因素是,最终产品不能依赖于外部因素,如所使用的设备。
然后对采用不同方法制备的系统进行了描述。使用偏振光学显微镜(POM),观察到在HS方法没有水的情况下,即使在不同的温度下,NADES也没有形成清晰和粘稠的液体。然而,在用少量水应用HS方法和VE方法制备NADES时,观察到了同质和透明粘性液体,如图1所示。
DSC 用于确定混合物的热事件。结果表明,该系统在室温下为液体,温度高达130°C,因为热图显示无热事件。每个样品的含水量由卡尔-菲舍尔滴定测量,结果在表2中显示。必须报告系统的含水量,因为它是影响所获取液体特性的参数,如粘度和极性。这些变化对设计 NADES 的应用程序的结果有很大的影响。
NMR还用于确认上述NADES系统的形成,通过在每个系统的分子之间形成氢键。在 NADES系统柠檬酸:葡萄糖 (2:1) 图 2 中给出了一个示例,其中 HS 获取了 17% 的水,其中此 NADES 的质子光谱和起始材料(柠檬酸和葡萄糖)覆盖(图 2a)。从中,可以观察到每个分子中某些质子的化学转移变化。主要的变化是OH质子从柠檬酸的转移。最初,此信号出现在 5.16 ppm,但由于氢键的形成,该信号转移到 6.22 ppm。这一点由NOESY光谱(图2b)证实,其中来自柠檬酸的OH和其余质子之间的强相互作用是可见的。其他NADES系统也观察到类似的相互作用。
在这项研究中,我们观察到,由于缺乏有关大多数系统含水量的信息,文献中报告的eutectic系统的制备方法的描述有时不完整。在VE方法中,通过制备不同成分的溶液并在温度下混合,从而形成水系系统来添加水;但是,我们无法确定所需的最低含水量。因此,考虑对形成系统所需的水百分比的了解,这是应始终报告的一个关键点,以便其他人能够重现不同水混合物的制备。
最好的使用方法是添加水的 HS 方法,因为对于已经描述含水量的情况,准备时间更少。但是,如果此信息不可用,最简单的方法是 VE 方法,其中所有可用水被移除,系统中仅保留与 NADES 组件交互的水。在任何情况下,研究人员都应该让系统蒸发足够长的时间,以确保从系统中去除游离水。此时间取决于设备,因此在材料部分描述 VE 方法的持续时间是不够的,但水含量始终要报告。
披露声明
作者没有什么可透露的。
致谢
该项目根据No ERC-2016-CoG 725034的赠款协议,根据欧盟Horizon 2020研究和创新计划,获得了欧洲研究理事会(ERC)的资助。这项工作还得到了绿色化学-LAQV副实验室的支持,该实验室由FCT/MCTES(UID/QUI/50006/2019)的国家基金资助,并通过CryoDES项目(PTDC/EQU-EQU/29851/2017)获得FCT/MCTES的支持。
材料
| Name | Company | Catalog Number | Comments |
| 5 mm NMR tube | Norell | ||
| Acid citric monohydrate | Sigma-Aldrich | ||
| Advance III spectrometer | Bruker | ||
| Deionized water | |||
| dimethyl sulfoxide-d6 | Sigma-Aldrich | ||
| DSC Q200 | TA Instruments, USA | ||
| Freeze-dryer CHRIST ALPHA 1-4 | Braun Biotec International | ||
| Glucose monohydrate | Cmd chemicals | ||
| Karl Fisher Coulometer | Metrohm | ||
| Olympus BX-51 polarized optical microscope | Olympus |
参考文献
- Paiva, A., et al. Natural deep eutectic solvents - solvents for the 21st century. ACS Sustainable Chemistry & Engineering. 2, 1063-1071 (2014).
- Abbott, A. P., Capper, G., Davies, D. L., Rasheed, R. K., Tambyrajah, V. Novel solvent properties of choline chloride/urea mixtures. Chemical Communications. , 70-71 (2003).
- Liu, Y., et al. Natural deep eutectic solvents: properties, applications, and perspectives. Journal of Natural Products. 81, 679-690 (2018).
- Choi, Y. H., et al. Are natural deep eutectic solvents the missing link in understanding cellular metabolism and physiology. Plant Physiology. 156, 1701-1705 (2011).
- Dai, Y., Spromsen, J. V., Witkamp, G. -. J., Verpoorte, R., Choi, Y. H. Natural deep eutectic solvents as new potential media for green technology. Analytica Chimica Acta. 766, 61-68 (2013).
- Espino, M., Fernández, M. A., Gomez, F. J. V., Silva, M. F. Natural designer solvents for greening analytical chemistry. Trends in Analytical Chemistry. 76, 126-136 (2016).
- Hayyan, M., et al. Natural deep eutectic solvents: cytotoxic profile. Springer Plus. 5, 913 (2016).
- Dai, Y., Witkamp, G. -. J., Verpoorte, R., Choi, Y. H. Tailoring properties of natural deep eutectic solvents with water to facilitate their applications. Food Chemistry. 187, 14-19 (2015).
- Choi, Y. H., Verpoorte, R. Green solvents for the extraction of bioactive compounds from natural products using ionic liquids and deep eutectic solvents. Current Opinion in Food Science. 26, 87-93 (2019).
- Guitérrez, M. C., Ferrer, M. L., Mateo, C. R., Del Monte, F. Freeze-drying of aqueous solutions of deep eutectic solvents: a suitable approach to deep eutectic suspensions of self-assembled structures. Langmuir. 25, 5509-5515 (2009).
- Gomez, F. J. V., Espino, M., Fernández, M. A., Silva, M. F. A greener approach to prepare natural deep eutectic solvents. Chemistry Select. 3, 6122-6125 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。