Method Article
重建线粒体膜动力学的模型膜平台
摘要
线粒体融合是线粒体动力学基础的重要恒态反应。这里描述的是 一个体外 重组系统,研究线粒体内膜融合,可以解决膜系绳、对接、血融液和孔隙开口。讨论了该方法在探索细胞膜系统的多功能性。
摘要
线粒体动力学对于细胞器的不同功能和细胞反应至关重要。拥挤的、空间复杂的线粒体膜是区分调控因素的具有挑战性的环境。蛋白质和脂质成分的实验控制可以帮助回答特定的调控问题。然而,在细胞测定中,对这些因素的定量操作是具有挑战性的。为了研究线粒体内膜融合的分子机制,我们引入了一个模仿线粒in vitro体内膜脂质环境的体外重组平台。在这里,我们描述了准备脂质双层体和重组线粒体膜蛋白的详细步骤。该平台允许以定量方式分析线粒体内膜融合中的中间体,以及单个过渡的动力学。该协议描述了具有不对称脂质组合物的双层的制造,并描述了将转膜蛋白重组为缓冲双层的一般考虑因素。该方法可用于研究其他膜系统。
引言
膜分块是真核细胞1的标志(图1A)。生物膜越来越被公认为二维溶剂,被认为是在调节蛋白质功能和大分子复合体组装2、3方面起着至关重要作用的环境。原生脂质是调节膜蛋白活性的配体3,3,4。膜空间组织和膜被雕刻成不同形状的能力是选择新功能3,5的重要物理属性。
模型膜平台是仿生系统,可以帮助我们了解细胞膜的结构,动力学和功能6,7,8。,7,8模型膜通常包括定义明确的组合物的脂质混合物,具有定义的生物物理特性(刚度、厚度和弹性)。结合荧光成像,模型膜平台允许对膜结构和功能9,10,1110进行定量分析。9脂质双层重组策略已用于研究SNARE中层膜融合9、10、DNA中介9,膜融合12、病毒融合11、13。11,13这种方法的优点是有可能获得可观察反应事件14之前的中间步骤的动力学信息。
利用模型膜对等离子膜进行了广泛的研究。已开发出具有脂相分离的双层,以研究在细胞信号11、15、16,中重要的脂,质筏结构。微层脂板双层17、18,18已用于研究细胞受体的组织。聚合物或凝胶支持的膜已被用作仿生系统,用于研究膜-细胞骨架组织、细胞信号期间的膜蛋白分割以及细胞接触体19的迁移。
人工膜系统也应用于研究亚细胞器20。组织具有创建不同子环境的特征形态。内质网(ER)网络就是一个例子。在将电核糖重新构成脂质体后,形成具有类似细胞ER特性的管状膜结构。添加的地图集素,一种ER融合蛋白,可以诱导脂质管从脂质体形成一个网络20。这是蛋白质体如何提供细胞器形态和动力学功能洞察的一个例子。
线粒体膜融合和裂变对线粒,体22、23、24、25,23,24等人群的健康至关重要。一组 dynamin 系列 GTPas 催化线粒体膜融合。Mfn 1/2 催化外膜融合。Opa1调解膜内融合26(图1B)。Opa1有两种形式:长形式(l-Opa1),跨膜锚定到线粒体内膜,和"可溶性"短形式(s-Opa1),存在于膜间空间。两种Opa1形式的比例由两个蛋白酶,Oma1和Yme1L27,28,29,3027,28,29,的活动调节。Opa1 法规中的重要问题包括:Opa1 的两种形式(短和长)如何调解膜融合及其调控相互作用 28、29、31、32、33。28,29,31,32,33
在这里,我们描述了一个成功应用于研究线粒体内膜融合的重组策略,该策略阐明了l-和s-Opa1在膜内融合中的角色。我们开发了一个平台,使用聚合物系绳脂双层和200nm单核囊泡模拟线粒体内膜。脂质双层层下方聚合物系绳的好处包括:首先,它保留了重组的跨膜蛋白,否则可能会因靠近玻璃滑梯34而中断。其次,它服务于脂质双层和玻璃基板之间的厚水层,这有利于孔隙开口9的研究,第三,PEG聚合物的粘弹性性质允许膜曲率变化35。我们使用三色荧光成像来描述膜融合中的步骤(图1C-F)。
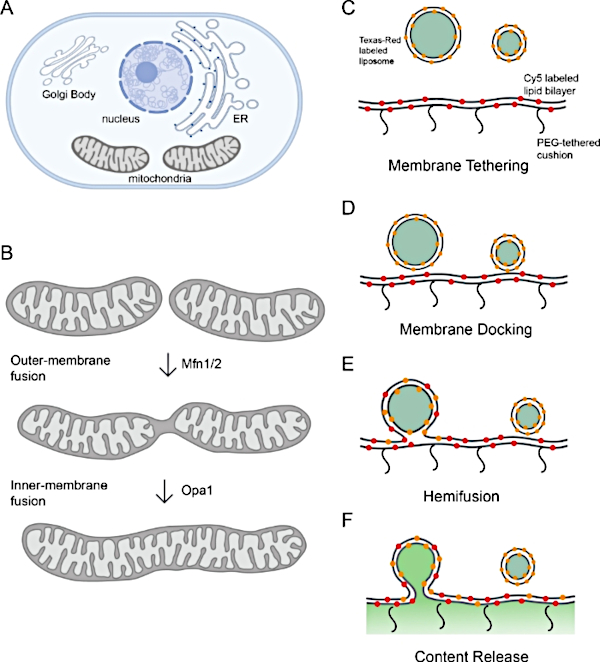
图1:监测线粒体膜融合。
(A) 器官是细胞膜隔间。(B) 线粒体膜融合的连续步骤。线粒体外膜的融合由Mfn1和/或Mfn2催化,而内膜融合由Opa1进行调解。(C-F)体外 重组平台的 原理图研究线粒体膜融合。该平台包括两个部分:蛋白石体和聚合物系绳脂双层体,均具有重组的l-Opa1。荧光标签,包括两种不同的荧光膜染料和一个含量标记,有助于区分膜融合过程中的步骤。两个膜标记(Cy5-PE(红色)和德州红PE(橙色)使F FRET对,可以报告关闭膜对接。为蛋白体标记的德州红皮的扩散是脂质脱脂(血液)的指标。通过钙化物信号的除去监控内容释放(以绿色显示)。使用 Biorender 创建的面板 A 和 B。 请单击此处查看此图的较大版本。
研究方案
1. 脂质混合物的制备
- 通过溶解 1,2- 二醇 - sn - 甘油 - 3 磷胆碱 (DOPC), 1 - 棕榈 - 2 - 奥利奥yl - sn - 甘油 - 3 - 磷氨酰胺 (POPE), L - α - 磷酰胺醇 (利弗皮), 心脂素, 和1,2-二醇-糖-3-磷氨基胺-N-甲氧(聚乙二醇)-2000年(18:1PEG2000 PE)在浓度为25毫克/mL时进入氯仿。溶解荧光染料结合脂质(德州DHPE和Cy5 DOPE)氯仿浓度为1mg/mL。将脂质溶液存放在琥珀小瓶中,采用耐氯仿衬,用聚四氟乙烯胶带进一步密封。溶液可保持在-20°C长达6个月。
- 制定解决方案 A 和 B。
- 混合脂质,准备溶液 A(最终浓度1mg/mL),其中含有多PC(52.8摩尔%),POPE(20摩尔),肝脏PI(7摩尔%)和心电平(20摩尔)和0.2摩尔%荧光。
- 使溶液B(最终浓度1毫克/mL)含有多PC(47.8摩尔),POPE(20摩尔),肝PI(7摩尔),心电平(20摩尔%)和兴奋剂 PEG2000 (5 摩尔%) 和 0.2 摩尔% 荧光。
- 使用玻璃注射器将计算的存储溶液添加到琥珀小瓶中,生成脂质混合物。通过将额外的氯仿添加到小瓶中来匹配最终体积。
注:对于FCS(荧光相关光谱),将染料结合脂质的比例降低至0.002 mol%,用DPC代替其余。
2. 脂质双层机的制造
- 在 520°C 下将显微镜盖玻璃幻灯片烘烤 30 分钟。烘烤后,将盖子冷却至室温。
- 重约10克氢氧化钠,搅拌时加入500 mL甲醇。搅拌2小时,继续在溶液中加入氢氧化钠,直到沉淀物开始显示。确保在整个过程中佩戴适当的 PPE。
- 在10%的硫酸钠溶液中清洁玻璃滑梯;含有氢氧化钠的甲醇;和50 mM盐酸,按顺序(浴声在每个条件下30分钟)。在每种情况下,在超纯水中清洁玻璃滑梯 10 分钟。
注:虽然强烈建议使用新鲜的解决方案进行玻璃滑梯制备,但每个解决方案可重复使用多达 5 倍,或在 1 个月内重复使用,以先到者为准。每次使用前,请务必搅拌混合溶液。 - 将清洁的盖玻璃密封在 HCl 溶液中长达 2 周,以确保良好的双层质量。如果储存在超纯水中,请一周内使用滑梯。
- 使用氯仿和超纯水清洁朗穆尔-布洛杰特浸渍系统的聚四氟乙烯槽,直到在槽上未观察到湿润。在槽面上喷洒氯仿,用纤维素湿巾彻底擦拭3倍。用超纯水冲洗,然后通过吸水去除水。重复 3x 。
- 用干净的超纯水覆盖槽表面。
- 从清洁溶液或超纯水中拿 2 块表面处理盖玻璃,然后用超纯水冲洗玻璃滑梯约 30 s。
- 以背对背的方式放置盖玻璃。使用基板夹握住玻璃滑梯。通过手动单击 Langmuir 控制软件上的"浸式向下",将玻璃滑梯浸入水面下方。
- 零膜平衡,小心地在空气-水界面上一滴一滴地铺开溶液B(图2A)。确保脂质仅在空气-水界面扩散,没有氯仿和脂质液滴沉入聚四氟乙烯表面的底部。 未能确保这将创建脂质"通道",并防止单层形成。
- 停止添加脂质,直到薄膜平衡读出约 ±15-20 mN/m,等待 ±10-15 分钟。启动阻隔控制器,通过单击"开始实验"来改变表面积,直到薄膜平衡读出到 37 mN/m。保持压力约20-30分钟(图2B)。
- 以 22 mm/min 的速度升起盖玻璃,同时保持表面张力为 37 mN/m。通过Blodgett浸渍工艺,将将聚合物系绳的脂质单层从空气-水界面转移到盖玻璃表面(图2C)。这形成了脂质双层的底传单。
- 通过吸气清洁空气-水界面,用超纯水冲洗槽。
- 使用前,使用氯仿、乙醇和超纯水清洁单井玻璃滑梯(例如 Shaefer 幻灯片)。将干净的玻璃滑梯放在水槽上,在水层下方用超纯水。确保井朝上朝向空气水界面,并倒入新鲜的超纯水,直到玻璃滑梯完全覆盖。重复步骤 2.8。
- 使用硅吸盘(确保单层侧远离吸盘),用脂质单层从步骤 2.4 中握住盖玻璃,轻轻地将脂质单层推到空气水界面,在界面上将盖玻璃按住 ±2-3 s,然后将盖玻璃推到幻灯片上(图 2D)。用盖板幻灯片将幻灯片拿出来。
注:脂质双层夹将放在两张幻灯片之间的夹层区域的盖玻璃表面(图2E)。 - 将带双层玻璃的盖玻璃置于荧光显微镜中。成像脂质双层。如果观察到脂质染料的均匀分布,将双层的一小块区域光漂白 30 秒,关闭光源约 30 s-1 分钟,然后再次图像以观察恢复情况。脂质双层将显示荧光恢复。
注:有缺陷或荧光恢复不良的膜不应用于进一步实验。
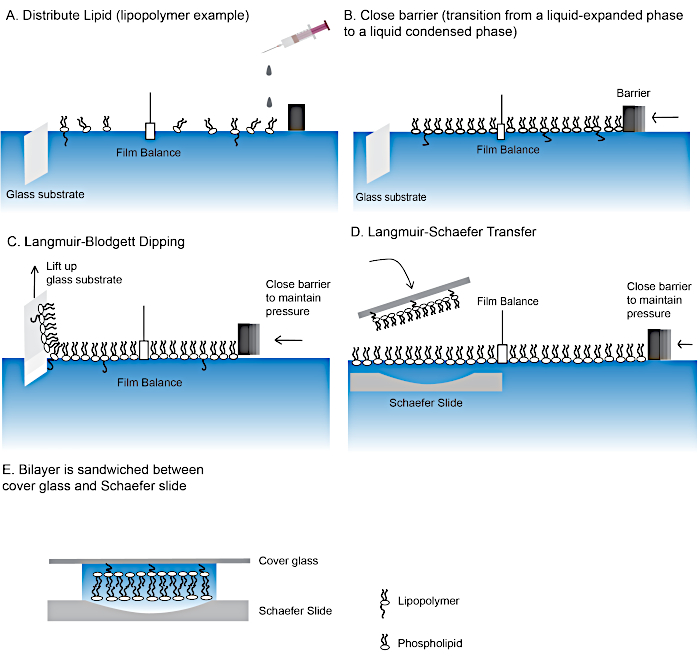
图2:制造聚合物系绳脂双层的步骤。
使用朗穆尔-布洛杰特浸渍(A-C)和朗缪尔-舍费尔转移 ( D ) 技术制作脂质双层层的步骤.(E) 包含脂质双层的最后的"三明治"。 请单击此处查看此图的较大版本。
3. 蛋白质重组成聚合物系绳脂双层
- 准备含有超纯水的结晶盘。准备一个干净的显微镜图像环,并放在盘子下面。
- 浸入舍费尔幻灯片的"三明治"和水下含有脂质双层玻璃的盖玻璃,轻轻分离舍费尔幻灯片和盖玻璃,从底部握住盖玻璃滑梯,远离双层玻璃,将盖玻璃转移到图像环中,关闭图像环。
注:确保带脂质双层的盖玻璃始终在水中,且环密封良好。 - 用 Bis-Tris NaCl 缓冲器更换图像环中的超纯水,确保脂质双层玻璃不会暴露于任何气泡。将 1.1 x 10-9 M n-Octyl-β-β-D-Glucopyranoside 添加到脂质双层层中。立即将 1.2 x 10-9 M 的 DDM 和 1.3 x 10-12 mol 纯化 l-Opa1-12 36的混合物添加到图像环中。在低速台式摇床上孵育样品2小时(图3)。
注:洗涤剂可能因要重组的蛋白质而异。 - 将 30 mg SM-2 树脂珠分到 3 mL 的 Bis-Tris 缓冲液中,并在涂抹前摇动。使用塑料移液器将5~10μL的SM-2树脂珠添加到图像环中,孵育10分钟,通过冲洗去除树脂珠。图像环中缓冲区的最终体积为 1.5 mL。
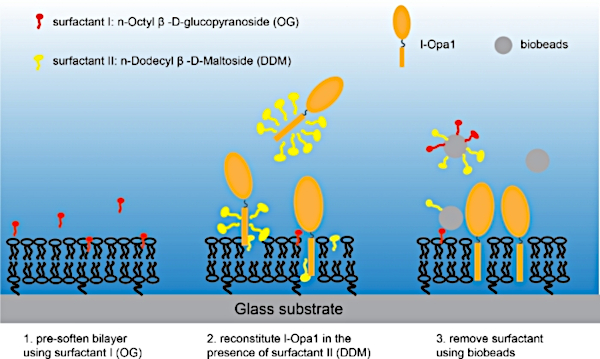
图3:将l-Opa1重组为聚合物系绳脂双层体的程序。请单击此处查看此图的较大版本。
4. 蛋白质体的准备
- 在氯仿溶液中准备1毫克脂质混合物。在氮流下蒸发氯仿20分钟,在真空下过夜,形成脂质膜。
- 通过溶解 15.56 g 钙化物至 50 mL 的 1.5 mol NaOH 溶液,在室温下搅拌,直到钙化物完全溶解,加入 12.5 mM Bis-Tris 和超纯水,将 500 mL 的最终体积添加到 500 mL 中,以补充 50 mM 钙素。,准备含有缓冲液的 50 mM 钙素。将 pH 调整为 7.5。
- 悬浮含钙化物缓冲液中的脂质膜,在65°C加热悬浮液20分钟,200nm脂质体通过聚碳酸酯膜挤出形成,使脂质完全合润。
- 在0.5 μM DDM中加入2μg的l-Opa1,加入0.2毫克脂体,在4°C下孵育1.5小时。使用透析去除表面活性剂,使用 3.5 kDa 透析盒对 250 ml 的 25mM Bis-Tris、150 mM NaCl 和 50 mM 钙素缓冲液在 4 °C 过夜,两次更换缓冲液。
- 使用 PD-10 脱盐柱去除额外的钙化物。
5. 成像和数据分析
- 使用 100 倍油浸目标 (N.A 1.4) 获取 TIRF 图像。使用 543 nm 激光和 488 nm 激光分析德州红皮标记脂质体和用钙化物封装的蛋白体。使用 633 nm 激光分析嵌入在平面脂质双层层中的 Cy5-PE。
- 使用脂质双层机对齐TIRF角度以获得最大排放。在25°C下使用100x油目标观察重组后脂质双层的质量。 磷脂和重组的双层的扩散系数是使用FCS确定的,协议描述在其他地方37。
- 将 10 μL 的 2 mg/mL 蛋白体添加到图像环中,并在图像前 10 分钟设置。GTP、GMPPCP 或 GDP 被添加到反应环中,其核苷酸为 1 mM MgCl2 和 1 mM。
- 为了确定s-Opa1在膜融合中的影响,将s-Opa1滴定入含有l-Opa1的蛋白糖体/受支持双层样品,并记录融合事件。
- 德州红-DHPE和钙素的同步成像是通过波束分割系统实现的。488 nm 和 543 nm 激光器同时作为荧光激发源应用于样品。然后使用 560 nm 光束分路器对发射光进行分割。然后,分片发射灯由带宽为 42 nm 的 510 nm 滤波器和带宽为 40 nm 的 609 nm 滤波器进行过滤。过滤光束投影到摄像机芯片上的两个相邻区域。
- 荧光发射同时通过带宽为 40 nm 的 609 发射滤波器和带宽为 70 nm 的 698 发射滤波器进行记录。显微镜系统配有CMOS摄像机,维护温度为-10°C。
- 可以使用基于高斯粒子识别算法对脂质体进行粒子识别。对粒子分布和强度进行通道分析。脂质双层信号用作隔离粒子的掩码。
结果
重组后的跨膜蛋白自由扩散,均匀地分布在膜中。
图4显示了脂质双层体及其通过荧光显微镜验证的脂质双层体及其脂质流动性 的示例图像。光漂白之前和之后双层的脂质分布如图 4A、B所示。脂质双层的同质性在重组前和重组后使用荧光显微镜进行可视化(图4D,E)。l-Opa1在脂质双层体中重组,通过荧光相关光谱(FCS)进行验证。我们使用染料结合脂质来评估双层的脂质扩散性。重组的Opa1使用荧光标记的抗Opa1 C-终端抗体进行标记。双层脂扩散度为1.46±0.12μm2/s,而双层重组l-Opa1的扩散系数为0.88±0.10μm2/s。从FCS曲线的强度读出表明75%的l-Opa1被重建到脂质双层层(图4G,H)。这些结果表明,l-Opa1可自由扩散在聚合物系绳脂双层体中,具有自组装成功能复合体的潜力。
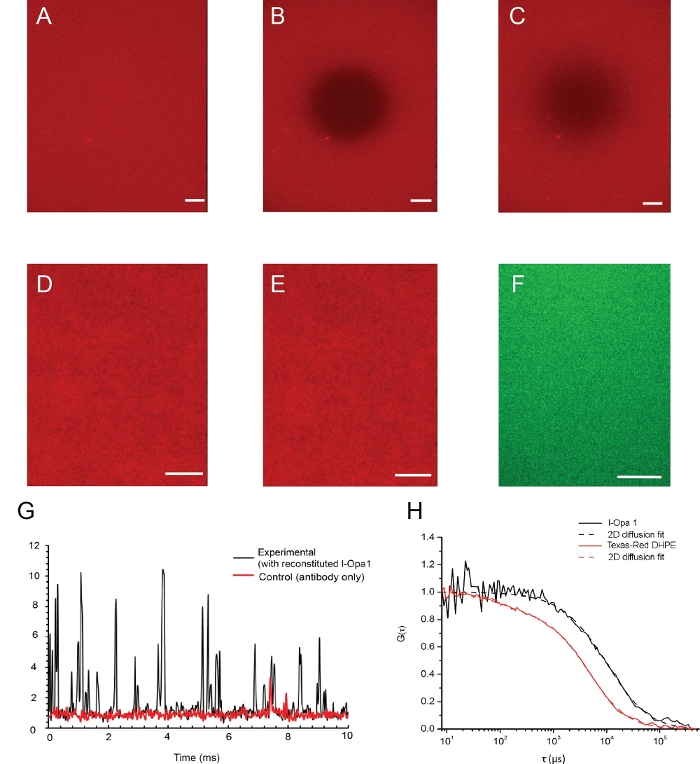
图4:模型膜中脂质和重组蛋白的分布。
(A-C)脂质双层体及其脂质流动性的示例图像,通过荧光显微镜进行验证。(A) 光漂白前在双层层中均匀的脂质分布。(B) 光漂白后立即拍摄快照。(C) 荧光恢复后成像的双层层表明重组后膜的脂质流动性良好。(D, E)脂质分布(D)之前和(E)l-Opa1重组后的代表图像表明重组过程在双层层中没有产生缺陷。标有Alexa488结合抗体(F)的l-Opa1代表TIRF图像,显示重组时Opa1的均匀分布。G. 通过荧光相关光谱,代表l-Opa1信号的原始光子计数。在控制中,在双层层中未重组l-Opa1,同时添加和冲洗抗体。l-Opa1 的扩散速度明显慢于膜中的脂质,与跨膜 l-Opa1 ( H ) 的成功重组一致。比例线: 10 μm. 请单击此处查看此图的较大版本。
荧光步漂白表明,在给定的脂体中平均重组了2-3份l-Opa1(图5A,B)。使用DLS重组后对Opa1重组蛋白体的大小分布进行了测试(图5C)。使用FCS验证了蛋白体中Opa1的重组。自由抗体的扩散系数为164~22μm2/s;标有脂质染料的脂质染料的脂质体扩散系数为2.22±0.33 μm2/s,与德州红标记的抗血性抗体结合的l-Opa1蛋白体体扩散系数为2.12±0.36μm2/s。
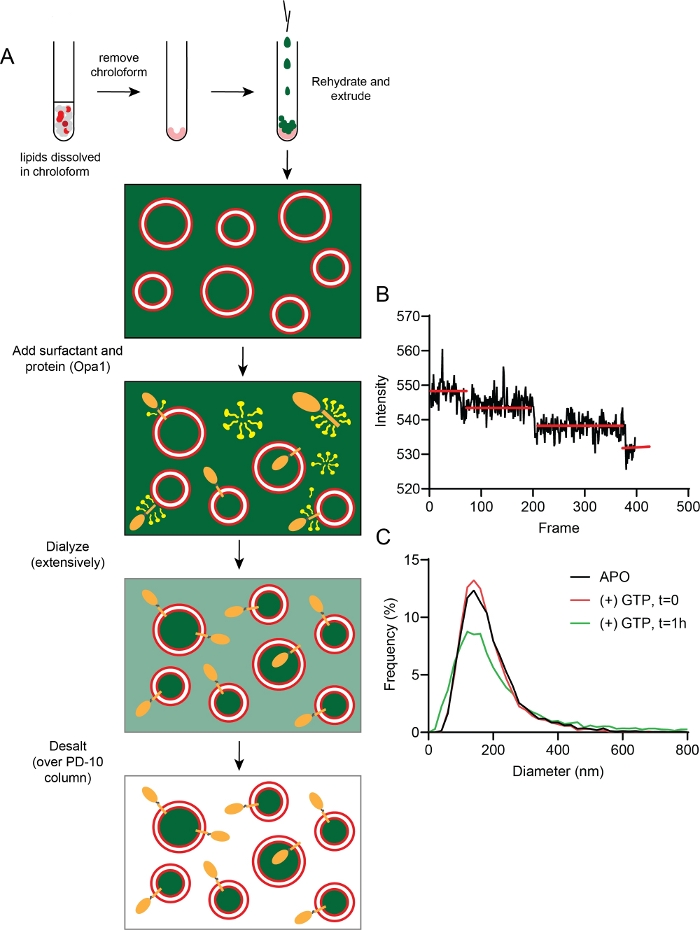
图5:蛋白质体的制造和表征。
(A) 用封装的淬火蛋白制造蛋白体的步骤。(B) 荧光步进漂白的代表性数据显示,脂体中嵌入的l-Opa1平均有2-3份。(C) GTP孵育后(绿色)后没有任何核苷酸1h的蛋白糖体(红色)的代表性大小分布。 请单击此处查看此图的较大版本。
通过荧光显微镜检测膜系绳、脂质脱脂/血液和孔隙开口。
使用TIRF显微镜观察脂质双层表面上的德州红信号(图6A),监测膜系绳。当染料从脂质体扩散到脂质双层体时,通过 TexasRed 监测膜脂质脱脂(浸液)行为。钙化物去挤压有助于区分完全融合孔隙的形成和仅脂质脱脂。这允许比较粒子在中融状态(图6B)停止的条件和进入完全融合的粒子(图6C)。
膜系绳由脂质体的稳定脂质信号表示。根据两个膜36的标签之间的F FRET信号可以评估距离。注入信号在钙化信号(图6B,下排)中没有脱流,但德州红信号的快速衰减表明染料扩散到脂质双层(图6B上排)。完全融合(带孔隙开口)具有脂质衰变和内容释放(图 6C)。德州红的强度和钙蛋白强度可以跟踪在时间依赖的方式,提供定量细节的动力学膜融合36。

图 6:显示粒子系绳(A,比例杆 10 μm)、下分(B、比例杆 0.5 μm)和聚变(C、比例杆 0.5 μm)的代表性结果。
(A) 在GTP添加之前,将蛋白体系在Opa1-重组的脂质双层上。(B) 血液的例子.B 中的上行显示脂质 demixing(德州红色信号,红色),B 中的下行在这些条件下显示无内容释放(钙素信号,绿色)。(C) 蛋白体与脂质双层体有代表性的痕迹。内容释放可以从显示钙素(下行,绿色)的下行图像中观察到。 请单击此处查看此图的较大版本。
讨论
体外模型膜系统可以描述在明确定义的条件下复杂的膜过程。这些系统可以区分复杂分子过程所需的最小成分,以揭示分子机制,6、15、20、38。15,20,38对于膜蛋白,脂质体和平面支持的双层层是常见的重组系统。与固体支持的脂质双层体相比,基板与支撑膜之间的聚合物缓冲允许大型膜蛋白和跨膜蛋白的自由移动,以自由扩散和组装34。这些功能帮助我们研究线粒体内膜融合36的动力学。
我们使用朗穆尔-布洛杰特/朗穆尔-舍费尔(LB/LS)技术准备了聚合物系绳脂双层玻璃。这使我们能够准备一个双层与不对称的脂质成分。细胞膜具有不对称的传单成分,LB/LS方法允许研究这种双层膜。通过舍费尔传输,整个玻璃基板可以覆盖脂质双层层。为双层准备准备一个干净的表面至关重要。此外,需要练习才能正确执行舍费尔传输。不成功的舍费尔转移可以在脂质双层层中产生不必要的缺陷。在此协议中,添加到薄膜平衡的压力适用于包含 20% 心力平的双层。对于具有其他部件的双层,请参阅关键部件的表面压力区域等温。另一种方法是Langmuir-Blodgett/囊泡融合(LB/VF)方法,其中底部脂质单层从朗穆尔槽的空水界面转移到干净的基材上,然后脂质体融合到支持的脂质单层的顶部,形成最终的双层39。使用LB/VF方法重组膜蛋白比LB/LS简单,因为可以通过蛋白体体融合进行重组。然而,囊泡融合需要增加多余的脂质体,这可能使依赖于浓度依赖蛋白-蛋白质相互作用的膜事件的研究复杂化。
将跨膜蛋白成功地重组为聚合物系绳脂双层体和脂质体,以首选功能方向进行重组非常重要,但很难实施。需要实验控制来解释这一点。对于聚合物系绳脂双层体,在重组过程中保持脂质双层体的完整性也很重要。表面活性剂浓度必须保持相对较低,以防止溶解脂质双层,但足够高,以防止感兴趣的蛋白质变性37,40。,40此处描述的方法非常适合为单分子研究重组膜蛋白,但不一定可扩展用于大规模研究。表面活性剂的选择是另一个重要的考虑因素。通常,用于纯化和储存的表面活性剂是一个很好的起点。表面活性剂的最大浓度通常比CMC36低200倍,在其中表面活性剂保持蛋白质稳定性并防止蛋白质聚集,同时保持膜36的完整性。可考虑使用含有 2 或 3 种表面活性剂的鸡尾酒。为了重新构成脂质体,不需要低浓度的表面活性剂。然而,CMC 以下的表面活性剂浓度最好保持脂质体的统一大小和形态分布。为了防止含量染料泄漏,有必要对含染料的缓冲液进行透析。
与基于脂体聚变的聚变分析相比,我们建立的平台提供了一种研究膜融合每个步骤动力学的方法。此方法提供了在接近原生条件下研究跨膜融合蛋白的能力。模型膜平台可用于研究膜蛋白组装和寡聚化、膜"雕刻"以及亚细胞环境中蛋白质的蛋白质脂质相互作用,如线粒体内膜。该方法还允许探索膜蛋白相互作用中的重要生理条件,如双层组合物不对称。关键线粒体脂质心电图在脂质体和聚合物支持的双层体的双层特性中的作用仍有待确定。离子强度、膜厚度、膜刚度、膜曲率和膜弹性粘度特性等特性都可能影响蛋白质组装到特定功能状态的能力。未来创造性地应用模型膜系统的研究有可能揭示膜蛋白组织和功能的新方面。
披露声明
没有。
致谢
作者感谢查尔斯·胡德基金会儿童健康研究奖的支持以及马萨诸塞州总医院分子生物学系的慷慨支持。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(Cyanine 5) | Avanti polar lipid | Cat #: 810335C1mg | membrane fluorescent markers |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar lipids | Cat #: 880130P | lipid molecules |
| 1',3'-bis[1,2-dioleoyl-sn-glycero-3-phospho]-glycerol (sodium salt) | Avanti Polar lipids | Cat #: 710335P | lipid molecules |
| 18:1 (Δ9-Cis) PC (DOPC) | Avanti Polar lipids | Cat #: 850375P | lipid molecules |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar lipids | Cat #: 850757P | lipid molecules |
| Alexa Fluor 488 Antibody Labeling Kit | ThermoFisher Scientific | A20181 | |
| Amber vial with PTFE liner | Fisher scientific | 14-955-332 | sample vials to keep lipid solutions |
| Calcein | Sigma-Aldrich | Cat #: C0875; PubChem Substance ID: 24892279 | fluorescent dye |
| Chloroform | Fisher scientific | 298-500/ C295-4 | Fisher brand Chloroform is usually quite reliable for lipid works. |
| Concavity slide (1 well) | Electron Microscopy Science | 71878-05 | applied as Schaefer Slide |
| FCS analysis tool | Smith Lab, University of Akron | software tool | |
| Fiji /ImageJ | Fiji | SCR_002285 | software tool |
| Fisherbrand Cover Glasses: Circles | Fisher scientific | 12-545-102 | Cover glass for solid supported lipid bilayers, the item is now discontinued as authors prepared the manuscript. An alternative is Fisher brand premium cover glass with catalog number: 12-548-5M |
| GTP Disodium salt | SIGMA-ALDRICH INC | Cat #: 10106399001 | |
| Langmuir & Langmuir-Blodgett Trough | Biolin Scientifc | KN2002 | |
| L-α-lysophosphatidylinositol (Liver, Bovine) (sodium salt) | Avanti Polar lipids | Cat #: 850091P | lipid molecules |
| Mini Extruder | Avanti Polar lipids | 610020 | |
| n-Dodecyl-β-D-Maltopyranoside | Anatrace | Cat #: D310 25 GM | surfactant for reconstitution |
| n-Octyl-α-D-Glucopyranoside | Anatrace | Cat #: O311HA 25 GM | surfactant for reconstitution |
| PC Membranes 0.2μm | Avanti Polar Lipids | 610006 | |
| Rabbit Anti-Opa1 antibody | NOVUS BIOLOGICALS | Cat #: NBP2-59770 | antibody for Opa1 C-terminal detection |
| Slidebook | Intelligent imaging | RRID: SCR_014300 | software tool |
| Teflon threaded seal tape | Fisher Scientific | NC0636085 | taflon tape for sample storage |
| Texas Red 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine, Triethylammonium Salt (Texas Red DHPE) | ThermoFisher Scientific | Cat #: T1395MP | membrane fluorescent markers |
参考文献
- Sackmann, E., Lipowsky, R., Sackmann, E. Biological membranes architecture and function. Structure and Dynamics of Membranes. 1, 1-63 (1995).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118, 1099-1102 (2005).
- Schink, K. O., Tan, K. W., Stenmark, H. Phosphoinositides in Control of Membrane Dynamics. Annual Review of Cell and Developmental Biology. 32, 143-171 (2016).
- Gu, R. X., Ingolfsson, H. I., de Vries, A. H., Marrink, S. J., Tieleman, D. P. Ganglioside-Lipid and Ganglioside-Protein Interactions Revealed by Coarse-Grained and Atomistic Molecular Dynamics Simulations. Journal of Physical Chemistry B. 121 (15), 3262-3275 (2017).
- Schafer, D. A. Coupling actin dynamics and membrane dynamics during endocytosis. Current Opinion in Cell Biology. 14 (1), 76-81 (2002).
- Chan, Y. H., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Biswas, K. H., Groves, J. T. Hybrid Live Cell-Supported Membrane Interfaces for Signaling Studies. Annual Reviews in Biophysics. 48, 537-562 (2019).
- Pick, H., Alves, A. C., Vogel, H. Single-Vesicle Assays Using Liposomes and Cell-Derived Vesicles: From Modeling Complex Membrane Processes to Synthetic Biology and Biomedical Applications. Chemical Reviews. 118 (18), 8598-8654 (2018).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophysical Journal. 99 (12), 4047-4055 (2010).
- Kiessling, V., et al. Rapid fusion of synaptic vesicles with reconstituted target SNARE membranes. Biophysical Journal. 104 (9), 1950-1958 (2013).
- Yang, S. T., Kiessling, V., Tamm, L. K. Line tension at lipid phase boundaries as driving force for HIV fusion peptide-mediated fusion. Nature Communication. 7, 11401 (2016).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophysical Journal. 101 (8), 37 (2011).
- Chao, L. H., Klein, D. E., Schmidt, A. G., Pena, J. M., Harrison, S. C. Sequential conformational rearrangements in flavivirus membrane fusion. Elife. 3, 04389 (2014).
- Floyd, D. L., Harrison, S. C., van Oijen, A. M. Analysis of kinetic intermediates in single-particle dwell-time distributions. Biophysical Journal. 99 (2), 360-366 (2010).
- Sezgin, E., Schwille, P. Model membrane platforms to study protein-membrane interactions. Molecular Membrane Biology. 29 (5), 144-154 (2012).
- Ge, Y., Gao, J., Jordan, R., Naumann, C. A. Changes in Cholesterol Level Alter Integrin Sequestration in Raft-Mimicking Lipid Mixtures. Biophysical Journal. 114 (1), 158-167 (2018).
- Dutta, D., Kam, L. C. Micropatterned, multicomponent supported lipid bilayers for cellular systems. Methods in Cell Biology. 120, 53-67 (2014).
- Groves, J., Ferrari, M., Desai, T., Bhatia, S. Supported Lipid Bilayers as Mimics for Cell Surfaces and as Tools in Biotechnology. BioMEMS and Biomedical Nanotechnology. , (2006).
- Shoaib, T., Nalam, P. C., He, Y., Chen, Y., Espinosa-Marzal, R. M. Assembly, Morphology, Diffusivity, and Indentation of Hydrogel-Supported Lipid Bilayers. Langmuir. 33 (28), 7105-7117 (2017).
- Wang, N., Rapoport, T. A. Reconstituting the reticular ER network - mechanistic implications and open questions. Journal of Cell Science. 132 (4), 227611 (2019).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Chan, D. C. Fusion and fission: interlinked processes critical for mitochondrial health. Annual Reviews of Genetics. 46, 265-287 (2012).
- Nunnari, J., Suomalainen, A. Mitochondria: in sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wai, T., Langer, T. Mitochondrial Dynamics and Metabolic Regulation. Trends in Endocrinology Metabolism. 27 (2), 105-117 (2016).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nature Reviews Molecular Cell Biology. 11 (12), 872-884 (2010).
- Chen, H., et al. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development. Journal of Cell Biology. 160 (2), 189-200 (2003).
- Ishihara, N., Fujita, Y., Oka, T., Mihara, K. Regulation of mitochondrial morphology through proteolytic cleavage of OPA1. EMBO Journal. 25 (13), 2966-2977 (2006).
- Anand, R., et al. The i-AAA protease YME1L and OMA1 cleave OPA1 to balance mitochondrial fusion and fission. Journal of Cell Biology. 204 (6), 919-929 (2014).
- Mishra, P., Carelli, V., Manfredi, G., Chan, D. C. Proteolytic cleavage of Opa1 stimulates mitochondrial inner membrane fusion and couples fusion to oxidative phosphorylation. Cell Metabolism. 19 (4), 630-641 (2014).
- Baker, M. J., et al. Stress-induced OMA1 activation and autocatalytic turnover regulate OPA1-dependent mitochondrial dynamics. EMBO Journal. 33 (6), 578-593 (2014).
- DeVay, R. M., et al. Coassembly of Mgm1 isoforms requires cardiolipin and mediates mitochondrial inner membrane fusion. Journal of Cell Biology. 186 (6), 793-803 (2009).
- Rainbolt, T. K., Lebeau, J., Puchades, C., Wiseman, R. L. Reciprocal Degradation of YME1L and OMA1 Adapts Mitochondrial Proteolytic Activity during Stress. Cell Reports. 14 (9), 2041-2049 (2016).
- Ban, T., et al. Molecular basis of selective mitochondrial fusion by heterotypic action between OPA1 and cardiolipin. Nature Cell Biology. 19 (7), 856-863 (2017).
- Tanaka, M., Sackmann, E. Polymer-supported membranes as models of the cell surface. Nature. 437 (7059), 656-663 (2005).
- Shilts, K., Naumann, C. A. Tunable cell-surface mimetics as engineered cell substrates. Biochimica Biophysica Acta Biomembrane. 1860 (10), 2076-2093 (2018).
- Ge, Y., et al. Two forms of Opa1 cooperate to complete fusion of the mitochondrial inner-membrane. Elife. 9, 50973 (2020).
- Ge, Y., Siegel, A. P., Jordan, R., Naumann, C. A. Ligand binding alters dimerization and sequestering of urokinase receptors in raft-mimicking lipid mixtures. Biophysical Journal. 107 (9), 2101-2111 (2014).
- Simons, K., Vaz, W. L. Model systems, lipid rafts, and cell membranes. Annual Review of Biophysics and Biomolecular Structure. 33, 269-295 (2004).
- Kiessling, V., Liang, B., Tamm, L. K. Reconstituting SNARE-mediated membrane fusion at the single liposome level. Methods in Cell Biology. 128, 339-363 (2015).
- Siegel, A. P., Kimble-Hill, A., Garg, S., Jordan, R., Naumann, C. A. Native ligands change integrin sequestering but not oligomerization in raft-mimicking lipid mixtures. Biophysics Journal. 101 (7), 1642-1650 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。