Method Article
Uma plataforma de membrana modelo para reconstituir a dinâmica da membrana mitocondrial
Neste Artigo
Resumo
A fusão mitocondrial é uma importante reação homeostática subjacente à dinâmica mitocondrial. Descrito aqui é um sistema de reconstituição in vitro para estudar a fusão mitocondrial de membrana interna que pode resolver amarração de membrana, acoplamento, hemifusão e abertura de poros. Discute-se a versatilidade dessa abordagem na exploração de sistemas de membrana celular.
Resumo
A dinâmica mitocondrial é essencial para as diversas funções e respostas celulares da organela. A membrana mitocondrial lotada, espacialmente complexa, é um ambiente desafiador para distinguir fatores regulatórios. O controle experimental de componentes proteicos e lipídicos pode ajudar a responder a questões específicas de regulação. No entanto, a manipulação quantitativa desses fatores é desafiadora nos ensaios celulares. Para investigar o mecanismo molecular da fusão da membrana interna mitocôndria, introduzimos uma plataforma de reconstituição in vitro que imita o ambiente lipídudo da membrana interior mitocondrial. Aqui descrevemos passos detalhados para preparar bicamadas lipídicas e reconstituir proteínas de membrana mitocondrial. A plataforma permitiu a análise de intermediários na fusão mitocondrial da membrana interna, e a cinética para transições individuais, de forma quantitativa. Este protocolo descreve a fabricação de bicamadas com composição lipídica assimétrica e descreve considerações gerais para a reconstitução de proteínas transmembranas em uma bicamada amortecida. O método pode ser aplicado para estudar outros sistemas de membrana.
Introdução
A compartimentação da membrana é uma marca registrada das células eucarióticas1 (Figura 1A). As membranas biológicas são cada vez mais reconhecidas como solventes bidimensionais, e são consideradas como um ambiente que desempenha papéis críticos na regulação da função proteica e no conjunto complexo macromolecular2,3. Lipídios nativos são ligantes que regulam a atividade proteica da membrana3,4. A organização espacial da membrana e a capacidade das membranas de serem esculpidas em diversas formas são propriedades físicas importantes para a seleção de novas funções3,,5.
As plataformas de membrana modelo são sistemas biomiméticos que podem nos ajudar a entender a estrutura da membrana celular, a dinâmica e a função6,,7,,8. As membranas modelo tipicamente compreendem uma mistura lipídica de composição bem definida, com propriedades biofísicas definidas (rigidez, espessura e elasticidade). Acopladas à imagem de fluorescência, as plataformas de membrana modelo permitem a análise quantitativa da estrutura e função da membrana9,,10,,11. Estratégias de reconstituição de bicamadas lipídicas têm sido usadas para estudar a fusão de membrana mediada por SNARE9,,10, fusão de membrana mediada pelo DNA12e fusão viral11,13. Uma vantagem desses métodos é o potencial de obter informações cinéticas para etapas intermediárias que precedem um evento de reação observável14.
A membrana plasmática tem sido extensivamente estudada usando membranas modelo. Bicamadas com separação de fase lipídica foram desenvolvidas para estudar estruturas de jangadas lipídicas importantes na sinalização celular11,,15,16. Bicamadas planar lipídicas micropatteradas17,18 foram usadas para investigar a organização de receptores celulares. As membranas polimeras ou gel têm sido usadas como sistemas biomiméticos para estudar a organização membrana-citoesqueleto, particionamento de proteína de membrana durante a sinalização celular e migração em contatos célula-células19.
Sistemas de membrana artificial também estão sendo aplicados para estudar organelas subcelulares20. Organelas apresentam morfologias características que criam subsemo ambientes distintos. A rede de ânticulo endoplasmático (ER) é um exemplo. Após a reconstituição de reticulantes em lipossomos, estruturas de membrana tubular com propriedades semelhantes ao ER celular são formadas21. A adição de atlastina, uma proteína de fusão ER, pode induzir túbulos lipídicos de lipossomos para formar uma rede20. Este é um exemplo de como os proteoliposomes podem fornecer uma visão funcional sobre morfologia e dinâmica organela.
A fusão e a fissão da membrana mitocondrial são essenciais para a saúde da população mitocondrial22,23,24,,25. Um conjunto de gtpases da família dinamite catalisa fusão de membrana mitocôndrias. Mfn 1/2 catalisa fusão de membrana externa. Opa1 media a fusão da membrana interna26 (Figura 1B). Opa1 tem duas formas: uma forma longa (l-Opa1), transmembrana ancorada na membrana interior mitocondrial, e uma forma curta 'solúvel' (s-Opa1), presente no espaço intermembrano. A razão das duas formas Opa1 é regulada pela atividade de dois proteases, Oma1 e Yme1L27,28,29,30. Questões importantes na regulamentação Opa1 incluem: como as duas formas de Opa1, (curta e longa) mediam a fusão da membrana e sua interplay regulatória28,,29,,31,,32,,33.
Aqui descrevemos uma estratégia de reconstituição aplicada com sucesso para investigar a fusão mitocondrial de membrana interna que esclareceu os papéis de l- e s-Opa1 na fusão de membrana interna. Desenvolvemos uma plataforma imitando a membrana interior mitocondrial usando uma bicamada lipídica de polímero e vesículas unilamellar de 200 nm. Os benefícios de uma corda de polímero sob a bicamadas lipídica incluem o seguinte. Primeiro, preserva a proteína transmembrana reconstituída, que de outra forma poderia ser interrompida pela proximidade do deslizamento de vidro34. Em segundo lugar, serve uma espessa camada de água entre a bicamada lipídica e o substrato de vidro, o que facilita estudos de abertura de poros9, e em terceiro lugar a natureza viscoelástica do polímero PEG permite alterações de curvatura de membrana35. Utilizamos imagens de fluorescência tricolor para caracterizar etapas na fusão de membrana(Figura 1C-F).
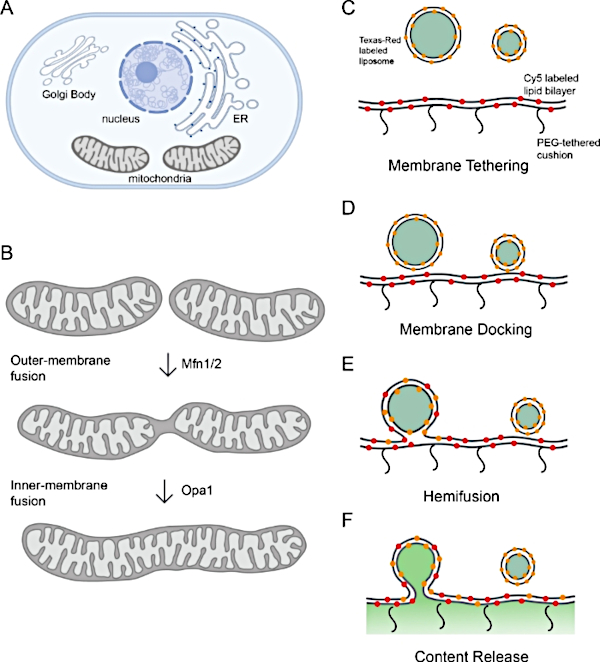
Figura 1: Monitorando a fusão da membrana mitocondrial.
(A)Organelas são compartimentos de membrana celular. (B) Etapas sequenciais da fusão da membrana mitocondrial. A fusão da membrana externa das mitocôndrias é catalisada por Mfn1 e/ou Mfn2, enquanto a fusão da membrana interna é mediada por Opa1. (C-F) Esquema da plataforma de reconstituição in vitro para estudar a fusão da membrana mitocondrial. A plataforma inclui duas partes: um proteoliposome e um polimer-tethered lipid bilayer, ambos com l-Opa1 reconstituído. Rótulos fluorescentes, incluindo dois diferentes corantes de membrana fluorescente e um marcador de conteúdo, ajudam a distinguir passos durante a fusão da membrana. Os dois marcadores de membrana (Cy5-PE (vermelho) e TexasRed PE (laranja) fazem um par DE FRET, que pode relatar o acoplamento de membrana próxima. A difusão do TexasRed-PE que rotula proteoliposome é um indicador de desmixagem lipídica (hemifusão). A liberação de conteúdo é monitorada através da desmesturação do sinal de calcein (mostrado em verde). Painéis A e B criados usando Biorender. Clique aqui para ver uma versão maior desta figura.
Protocolo
1. Preparação de misturas lipídicas
- Prepare uma solução de estoque lipídico dissolvendo 1,2-dioleoyl-sn-glycero-3phosphocholine (DOPC), 1-palmitoyl-2-oleoyl-sn-gliceo-3-phosphoethanolamina (POPE), L-α-phosphatidylinositol (Fígado PI), cardiolipin, e 1,2-dioleoyl-sn-glycero-3-fosfoethanolamina-N-[metoxi (polietileno glicol)-2000] (18:1 PEG2000 PE) em clorofórmio na concentração de 25 mg/mL. Dissolver o lipídeto fluorescente conjugado por corante (TexasRed DHPE e Cy5 DOPE) clorofórmio a uma concentração de 1 mg/mL. Guarde a solução lipídica em frascos âmbar com forro resistente a clorofórmio, ainda mais selado com fita politefluoroetileno. A solução pode ser mantida a -20 °C por até 6 meses.
- Faça soluções A e B.
- Misture lipídio para preparar a solução A (concentração final 1 mg/mL) que contenha DOPC (52,8 mol%), POPE (20 mol%), Liver PI (7 mol%) e cardiolipina (20 mol%), e 0,2 mol% fluoróforo.
- Faça a solução B (concentração final 1 mg/mL) contendo DOPC (47,8 mol%), POPE (20 mol%), fígado PI (7 mol%), cardiolipina (20 mol%) e DOPE-PEG2000 (5 mol%), e 0,2 mol% fluoróforo.
- Gere a mistura lipídica adicionando o volume calculado da solução de armazenamento em frascos âmbar usando uma seringa de vidro. Combine o volume final adicionando clorofórmio extra nos frascos.
NOTA: Para FCS (espectroscopia de correlação de fluorescência), diminua a proporção de lipídio conjugado de corante para 0,002 mol% e substitua o resto pelo DOPC.
2. Fabricação de bicamadas lipídicas
- Assar slides de vidro de cobertura de microscópio a 520 °C por 30 min. Depois de assar, esfrie as lâminas de cobertura até a temperatura ambiente.
- Pesar aproximadamente 10 g de hidróxido de sódio e adicionar a 500 mL de metanol durante a agitação. Mexa por 2h, continue adicionando hidróxido de sódio na solução até que os precipitados comecem a aparecer. Certifique-se de usar EPI apropriado durante todo o processo.
- Limpe as lâminas de vidro em solução de sulfato de dodecyl de sódio de 10%; metanol saturado com hidróxido de sódio; e ácido clorídrico de 50 mM, sequencialmente (sônica de banho em cada condição por 30 min). Limpe o deslizamento de vidro em água ultrauso por 10 minutos entre cada condição.
NOTA: Embora altamente recomendado para usar soluções frescas para preparação de lâminas de vidro, cada solução pode ser reutilizada em até 5x ou dentro de 1 mês, o que vier primeiro. Certifique-se de misturar a solução antes de cada uso. - Armazene o vidro de cobertura limpo selado na solução HCl até 2 semanas para garantir uma boa qualidade de bicamada. Se armazenado em água ultrauso, use os slides dentro de uma semana.
- Limpe o cocho de politetrafluoroetileno do sistema de imersão Langmuir-Blodgett usando clorofórmio e água ultrapura até que nenhum molhar seja observado no cocho. Pulverize o clorofórmio na superfície do cocho, limpe bem com os lenços de celulose 3x. Enxágüe com água ultrauso e remova a água através de sucção. Repita 3x.
- Cubra a superfície do cocho com água ultrapura limpa.
- Pegue 2 pedaços de vidro de cobertura tratado pela superfície da solução de limpeza ou água ultrauso, e enxágue o escorregador de vidro com água ultrapura por aproximadamente 30 s.
- Coloque o vidro de cobertura de uma maneira de trás para trás. Use o grampo do substrato para segurar as lâminas de vidro. Mergulhe o deslizamento de vidro sob a superfície da água clicando manualmente em "dipper down" no software de controle Langmuir.
- Zero o equilíbrio do filme, espalhando cuidadosamente a solução B gota a gota na interface ar-água(Figura 2A). Certifique-se de que os lipídios estão se espalhando apenas na interface ar-água, sem baixinhas de clorofórmio e lipídios afundando até o fundo da superfície do politetrafluoroetileno. Falha em garantir que isso criará um "canal" lipídedo e evitará a formação de monocamadas.
- Pare de adicionar lipídios até que o equilíbrio do filme seja lido em torno de ~15-20 mN/m, espere por ~10-15 min. Inicie o controlador de barreira para alterar a área da superfície clicando em "iniciar experimentos", até a leitura do balanço do filme para 37 mN/m. Mantenha a pressão por ~20-30 min (Figura 2B).
- Levante o vidro de cobertura à velocidade de 22 mm/min, mantendo a tensão superficial a 37 mN/m. Uma monocamada lipídica com amarração de polímero será transferida da interface ar-água para a superfície do vidro de cobertura através do processo de imersão blodgett(Figura 2C). Isso forma o folheto inferior do bicamador lipídudo.
- Limpe a interface ar-água por sucção, enxágue o cocho com água ultrapura.
- Limpe um slide de vidro de um poço (por exemplo, slide Shaefer) usando clorofórmio, etanol e água ultrapura antes de usar. Coloque o escorregador de vidro limpo no cocho com água ultrapurada sob a camada de água. Certifique-se de que o poço está voltado para a interface ar-água e despeje água ultrapura fresca até que o escorregador de vidro esteja totalmente coberto. Repita o passo 2.8.
- Segure o vidro de cobertura com monocamada lipídica da etapa 2.4 usando um copo de sucção de silício (certifique-se de que o lado da monocamada esteja longe do copo de sucção), empurre suavemente a monocamada lipídica para a interface ar-água, segure o vidro de cobertura por ~2-3 s na interface e, em seguida, empurre o copo de tampa contra o slide(Figura 2D). Leve o slide para fora com um slide de cobertura.
NOTA: A bicamada lipídica será mantida na superfície do vidro de cobertura voltado para a área sanduíche entre os dois slides(Figura 2E). - Leve o vidro de cobertura com o bicamador para um microscópio de epifluorescência. Imagem do bicamheiro lipída. Se for observada uma distribuição homogênea de corante lipíduo, fotobleach uma pequena área da bicamadas para 30 s, desligue a fonte de luz por ~30 s-1 min., em seguida, imagem novamente para observar a recuperação. Bicamadas lipídicas mostrarão recuperação de fluorescência.
NOTA: Membranas com defeitos ou recuperação de fluorescência ruim não devem ser utilizadas para outros experimentos.
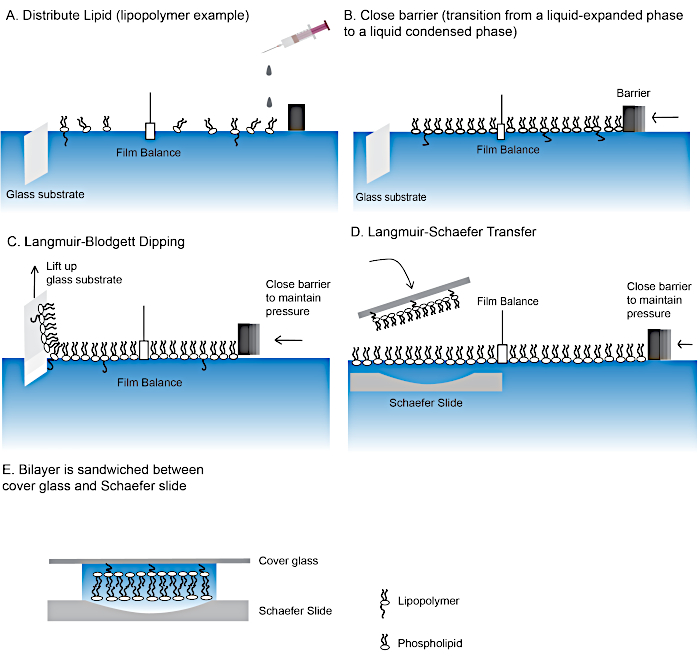
Figura 2: Passos na fabricação de uma bicamada lipídica de polímero.
Passos de fazer bicamadas lipídicas usando técnicas de mergulho Langmuir-Blodgett(A-C) e langmuir-schaefer(D). (E) O "sanduíche" final contendo a bicamada lipídica. Clique aqui para ver uma versão maior desta figura.
3. Reconstituição de proteínas na bicamada lipídica de polímero
- Prepare um prato de cristalização contendo água ultrauso. Prepare um anel de imagem de microscópio limpo e coloque embaixo do prato.
- Mergulhe o "sanduíche" do escorregador de Schaefer e cubra o vidro que contém bicamada lipídica sob a água, separe suavemente o slide e o vidro de cobertura, segure o deslizamento de vidro de cobertura da parte inferior, longe do lado bicamada, transfira o vidro de cobertura para o anel de imagem, feche o anel de imagem.
NOTA: Certifique-se de que o copo de cobertura com bicamada lipídica está sempre na água, e o anel está bem selado. - Substitua a água ultrauso no anel de imagem por um tampão Bis-Tris NaCl, certifique-se de que o bicamado lipídrico não esteja exposto a nenhuma bolha de ar. Adicione 1.1 x 10-9 M n-Octyl-β-D-Glucopyranoside à bicamada lipídica. Adicione imediatamente a mistura de 1,2 x 10-9 M de DDM e 1,3 x 10-12 mol purificado l-Opa136 no anel de imagem. Incubar amostra em um shaker de bancada em baixa velocidade por 2 h(Figura 3).
NOTA: Os detergentes podem variar dependendo da proteína a ser reconstituída. - Distribua contas de resina SM-2 de 30 mg em 3 mL de buffer Bis-Tris e agite antes de aplicar. Use uma pipeta de plástico para adicionar 5~10 μL de contas de resina SM-2 ao anel de imagem, incubar por 10 minutos, remover contas de resina enxaguando. O volume final do buffer no anel de imagem é de 1,5 mL.
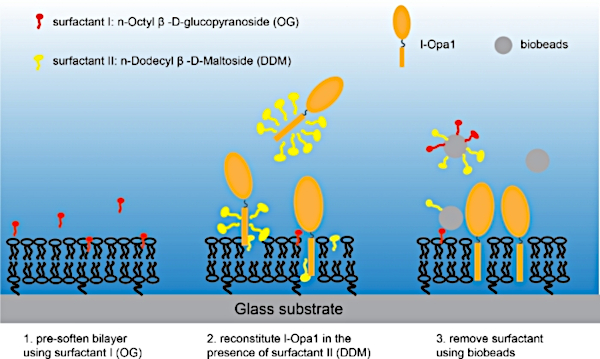
Figura 3: Procedimento para reconstituir l-Opa1 em uma bicamada lipídica de polímero. Clique aqui para ver uma versão maior desta figura.
4. Preparação de proteoliposomes
- Prepare 1 mg de mistura lipídica A em solução de clorofórmio. Evaporar clorofórmio sob fluxo de nitrogênio por 20 minutos e manter sob vácuo durante a noite e formar um filme lipídico.
- Prepare 50 mM de calceina contendo tampão dissolvendo 15,56 g de calcein a 50 mL de solução NaOH mol 1,5, mexa à temperatura ambiente até que a calceina seja completamente dissolvida, adicionada 12,5 mM Bis-Tris e água ultrauso ao volume final de 500 mL. Ajuste o pH para 7,5.
- Suspender a película lipídica em calceína contendo tampão, hidratar totalmente o lipídio aquecendo a suspensão a 65 °C por 20 min. 200 nm lipossomos são formados através de extrusão usando uma membrana policarbonato.
- Adicione 2 μg de l-Opa1 em 0,5 μM DDM a 0,2 mg de liposesomo e incubar a 4 °C por 1,5 h. Remova o surfactante por diálise usando um de diálise de 3,5 kDa contra 250 ml de 25 mM Bis-Tris, 150 mM NaCl e 50 mM tampão de calcein a 4 °C durante a noite, alterando o buffer duas vezes.
- Remova calcein extra usando uma coluna de desalting PD-10.
5. Análise de imagens e dados
- Adquira imagens TIRF usando um objetivo de imersão em óleo de 100x (N.A 1.4). Use laser de 543 nm e um laser de 488 nm para a análise de lipossomos rotulados texasred-PE e proteoliposomes encapsulados com calcein. Use um laser de 633 nm para a análise de Cy5-PE embutido na bicamadas lipídica do planar.
- Alinhe o ângulo TIRF usando uma bicamadas lipídica para obter a emissão máxima. A qualidade da bicamadas lipídica após a reconstituição é observada utilizando um objetivo de óleo de 100x a 25 °C. O coeficiente de difusão de bicamadas fosfolipídida e reconstituída são determinados usando FCS com um protocolo descrito em outro lugar37.
- Adicione 10 μL de 2 mg/mL proteoliposomes ao anel de imagem e coloque por 10 minutos antes da imagem. GTP, GMPPCP ou PIB são adicionados no anel de reação com 1 mM MgCl2 e 1 mM de nucleotídeo.
- Para determinar a influência do s-Opa1 na fusão de membrana, titular s-Opa1 em uma amostra de bicamadas proteoliposome/suportada contendo l-Opa1, e eventos de fusão de registro.
- A imagem simultânea de TexasRed-DHPE e calcein é obtida através de um sistema de divisão de feixes. Ambos os lasers de 488 nm e 543 nm são simultaneamente aplicados à amostra como fontes de excitação de farinha. A luz de emissão é então dividida usando um divisor de feixe de 560 nm. A luz de emissão dividida é então filtrada por um filtro de 510 nm com uma largura de banda de 42 nm e um filtro de 609 nm com largura de banda de 40 nm. O feixe filtrado é projetado para duas áreas adjacentes no chip da câmera.
- A emissão fluorescente é registrada simultaneamente através de um filtro de 609 emissões com uma largura de banda de 40 nm, e um filtro de 698 emissões com uma largura de banda de 70 nm. O sistema de microscópio é equipado com uma câmera CMOS mantida a -10 °C.
- A identificação de partículas dos lipossomos pode ser realizada usando um algoritmo de reconhecimento de partículas baseado na Gaussian. A distribuição e intensidade das partículas são analisadas canal por canal. Um sinal de bicamadas lipídica é usado como uma máscara para isolar partículas.
Resultados
A proteína transmembrana reconstituída difunde livremente e é distribuída de forma homogênea na membrana.
Imagens de exemplo de um bicamador lipídico e sua fluidez lipídica validada pela microscopia de epifluorescência são mostradas na Figura 4. A distribuição lipídica em bicamadas antes e depois do fotobleaching é mostrada na Figura 4A,B. A homogeneidade do bicamadorão lipídico foi visualizada utilizando um microscópio de epifluorescência antes e depois da reconstituição(Figura 4D,E). l-Opa1 reconstituído em bicamada lipídica foi validado por espectroscopia de correlação de fluorescência (FCS). Usamos lipídios conjugados de corante para avaliar a difusividade lipídica da bicamada. O Opa1 reconstituído foi rotulado usando um anticorpo anti-Opa1 C-terminal marcado por fluorescentes. A difusão lipídica bilayer foi medida como 1,46 ± 0,12 μm2/s, enquanto o coeficiente de difusão de l-Opa1 bicamada-reconstituída foi de 0,88 ± 0,10 μm2/s. A leitura de intensidade das curvas fcs indicou que 75% do l-Opa1 é reconstituído na bicamada lipídica(Figura 4G,H). Esses resultados sugerem que l-Opa1 difunde livremente na bicamada lipídica de polímero com potencial para se auto-montar em complexos funcionais.
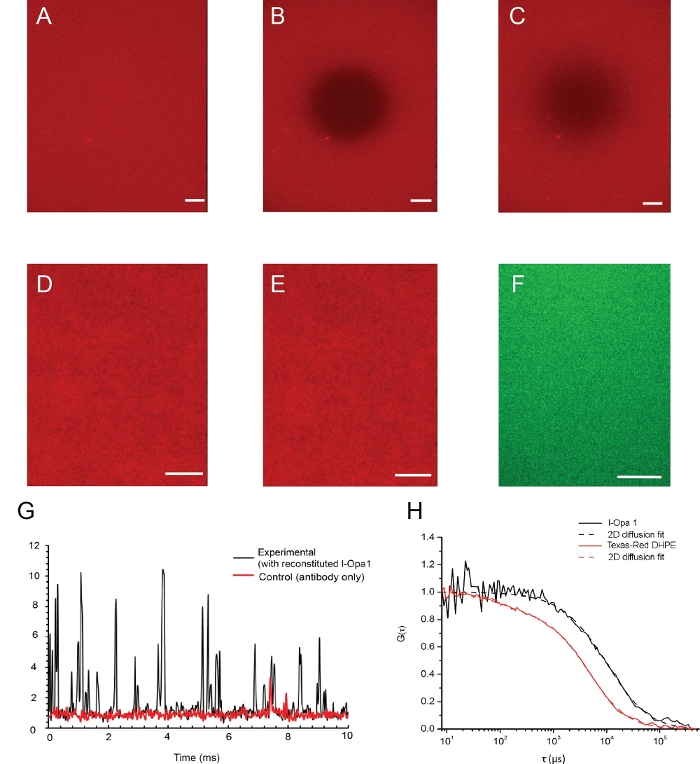
Figura 4: Distribuição de proteína lipídica e reconstituída na membrana modelo.
(A-C) Exemplos de imagens de um bicamador lipídico e sua fluidez lipídica validada por microscopia de epifluorescência. (A) Distribuição de lipídios homogêneos em bicamadas antes de fotobleaching. (B) Instantâneo imediatamente após o fotobleaching. (C) Bicamada imagem após a recuperação da fluorescência indica boa fluidez lipídica da membrana após a reconstituição. (D,E) Imagens representativas da distribuição lipídica antes(D)e depois(E)l-Opa1 reconstituição indicam que o processo de reconstituição não criou defeitos na bicamada. Imagem tirf representativa de l-Opa1 rotulada com alexa 488 anticorpo conjugado (F) mostrando uma distribuição homogênea de Opa1 após a reconstituição. G. Representativo contagem de fótons brutos de sinal l-Opa1 por espectroscopia de correlação fluorescente. No controle, nenhum l-Opa1 foi reconstituído na bicamada, enquanto o anticorpo foi adicionado e enxaguado. A difusão do l-Opa1 é significativamente mais lenta do que os lipídios na membrana, consistente com a reconstituição bem sucedida da transmembrana l-Opa1(H). Barra de escala: 10 μm. Clique aqui para ver uma versão maior desta figura.
O branqueamento da etapa de fluorescência indicou que uma média de 2-3 cópias de l-Opa1 foram reconstituídas em um dado lipossomo(Figura 5A,B). A distribuição de tamanho dos proteoliposomes reconstituídos Opa1 foi testada após a reconstituição utilizando DLS (Figura 5C). A reconstituição de Opa1 em proteoliposomes também foi verificada por meio da FCS. O coeficiente de difusão de anticorpos livres foi de 164 ± 22 μm2/s; O coeficiente de difusão para lipossomos rotulado com corante lipídico foi de 2,22 ± 0,33 μm2/s, e o coeficiente de difusão para l-Opa1oliposomes ligado a um anticorpo rotulado texasRed foi de 2,12 ± 0,36 μm2/s.
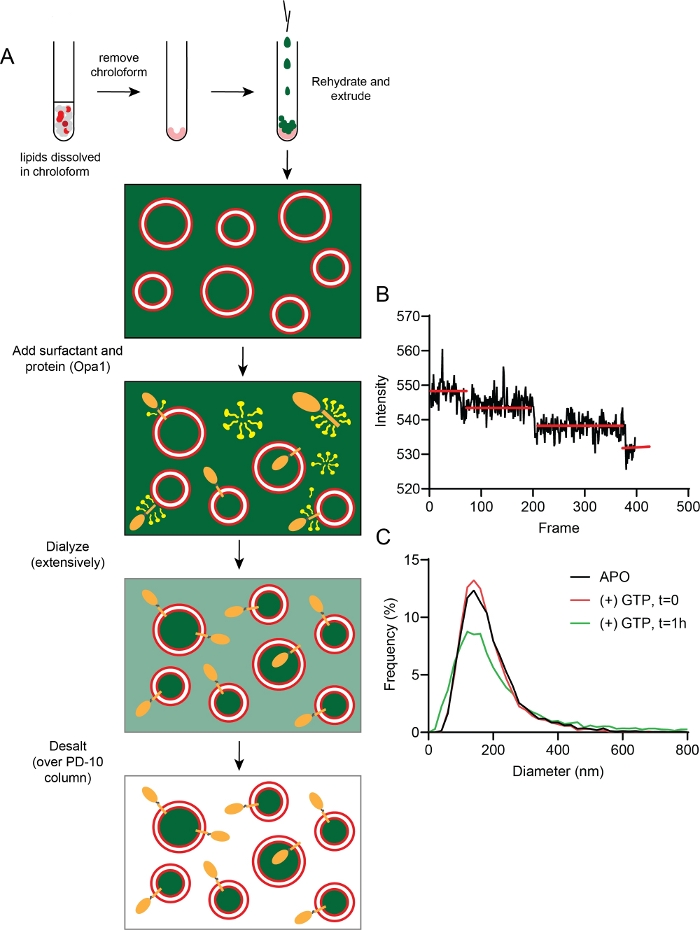
Figura 5: Fabricação e caracterização de proteolipóss.
(A) Etapas na fabricação de proteoliposomes com calcein encapsulado e saciado. (B) Dados representativos de branqueamento de passos fluorescentes mostram uma média de 2-3 cópias de l-Opa1 embutidas no lipossomo. (C) Distribuições de tamanho representativo de proteolipóss (vermelho) sem qualquer nucleotídeo 1 h após a incubação GTP (verde). Clique aqui para ver uma versão maior desta figura.
Detecção de amarração de membrana, demixing lipídudo/hemifusão e abertura de poros por microscopia fluorescente.
A tethering de membrana é monitorada observando o sinal de TexasRed na superfície da bicamada lipídica usando microscopia TIRF(Figura 6A). O comportamento de mistura lipídica da membrana (hemifusão) foi monitorado através do TexasRed como os dilúdidos difusos dos lipossomos para a bicamada lipídica. O desconching de calcein ajuda a distinguir a formação completa de poros de fusão apenas de mistura lipídica. Isso permite a comparação entre condições em que as partículas param na hemifusão (Fig 6B), e partículas que prosseguem para a fusão total(Figura 6C).
A amarração da membrana é indicada por um sinal lipíduol estável de lipossomos. A distância poderia ser avaliada com base no sinal FRET entre os rótulos das duas membranas36. O sinal de hemifusão não apresenta descostura no sinal de calcein(Figura 6B, linha inferior), mas uma rápida decadência do sinal TexasRed indica difusão do corante na bicamada lipídica(Figura 6B linha superior). A fusão completa (com abertura de poros) apresenta decaimento lipídico e liberação de conteúdo(Figura 6C). A intensidade da intensidade do TexasRed e da calceina podem ser rastreadas de forma dependente do tempo para fornecer detalhes quantitativos para a cinética da fusão de membrana36.

Figura 6: Resultados representativos mostrando amarração de partículas (A, barra de escala 10 μm), hemifusão (B, barra de escala 0,5 μm) e fusão (C, barra de escala 0,5 μm).
(A) Proteolipósmos amarrados ao bicamado lipídedo opa1-reconstituído antes da adição de GTP. (B) Um exemplo de hemifusão. A linha superior em B mostra desmixing lipídid (sinal TexasRed, vermelho), linha inferior em B não mostra liberação de conteúdo (sinal de calcein, verde) nessas condições. (C) Um traço representativo de fusão proteoliposome com a bicamadas lipídica. A liberação do conteúdo pode ser observada a partir de imagens na linha inferior de mostrar desmeto de calcein (linha inferior, verde). Clique aqui para ver uma versão maior desta figura.
Discussão
Sistemas de membrana de modelo in vitro podem descrever processos complexos de membrana em condições bem definidas. Esses sistemas podem distinguir componentes mínimos necessários para processos moleculares complexos revelarem mecanismos moleculares6,,15,,20,38. Para proteínas de membrana, lipossomos e bicamadas apoiadas por planar são sistemas comuns de reconstituição. Em contraste com bicamadas lipídicas de suporte sólido, a almofada de polímero entre o substrato e a membrana suportada em bicamadas de polímero permite a mobilidade livre de grandes proteínas de membrana, e proteínas transmembranas para difundir e montar livremente34. Essas características nos ajudaram a investigar a cinética da fusão de membrana interna mitocôndria36.
Preparamos uma bicamada lipídica de polímero usando técnicas de Langmuir-Blodgett/Langmuir-Schaefer (LB/LS). Isso nos permite preparar uma bicamadas com componentes lipíduos assimétricos. As membranas celulares têm composição de folhetos assimétricos, e a abordagem LB/LS permite o estudo dessas bicamadas. Com a transferência de Schaefer, um substrato de vidro inteiro pode ser coberto por um bicamadorão lipídedo. É fundamental preparar uma superfície limpa para a preparação de bicamadas. Além disso, é preciso prática para realizar uma transferência schaefer corretamente. Transferência schaefer mal sucedida pode criar defeitos indesejados em um bicamado lipídeto. Neste protocolo, a pressão adicionada ao equilíbrio do filme é aplicável para uma bicamada contendo 20% de cardiolipina. Para bicamadas com outros componentes, consulte o isotherm da área de pressão superficial dos componentes-chave. Um método alternativo é o método Langmuir-Blodgett/vesicle fusion (LB/VF), onde a monocamada lipídica inferior é transferida da interface ar-água de um cocho Langmuir em um substrato limpo, em seguida, lipossomos fundem-se ao topo da monocamada lipídica suportada e formam o bicamado final39. A reconstituição de proteínas de membrana usando o método LB/VF é mais simples do que a LB/LS, pois a reconstituição pode ser realizada através da fusão de proteolipóss. No entanto, a fusão vesícula requer a adição de lipossomos em excesso, o que pode complicar o estudo de eventos de membrana dependentes de interações proteicas dependentes de concentração.
A reconstituição bem sucedida de proteínas transmembranas em bicamadas lipídicas e lipossas em uma orientação funcional preferida é importante, mas difícil de aplicar. Controles experimentais são necessários para explicar isso. Para bicamadas lipídicas de polímero, também é importante manter a integridade da bicamada lipídica durante a reconstituição. As concentrações surfactantes devem ser mantidas relativamente baixas para evitar a dissolução da bicamadas lipídicas, mas altas o suficiente para evitar a desnaturação da proteína de interesse37,40. O método descrito aqui é ideal para a reconstitução de proteínas de membrana para estudos de molécula única, mas não é necessariamente escalável para estudos de maior escala. A escolha do surfactante é outra consideração importante. Frequentemente, o surfactante usado para purificação e armazenamento é um bom ponto de partida. A concentração máxima de surfactante é geralmente ~200 vezes menor do CMC36, em uma faixa onde o surfactante mantém a estabilidade da proteína e previne a agregação de proteínas, mantendo a integridade da membrana36. Podem ser considerados coquetéis contendo 2 ou 3 surfactantes. Para a reconstituição em lipossomos, não é necessária uma baixa concentração de surfactante. No entanto, as concentrações surfactantes abaixo da CMC são preferíveis para manter o tamanho uniforme e a distribuição de morfologia para os lipossomos. Para evitar vazamento de corante de conteúdo, é necessário dilícito contra um tampão contendo corante.
Em contraste com os ensaios de fusão baseados em liposome, a plataforma que estabelecemos fornece uma abordagem para investigar a cinética de cada passo da fusão de membrana. Este método fornece a capacidade de estudar proteínas de fusão transmembrana em condições quase nativas. Plataformas de membrana modelo podem ser aplicadas para estudar montagem e oligomerização de proteínas de membrana, "escultura" da membrana e interações proteína-lipídicas de proteínas em ambientes subcelulares, como a membrana interior mitocondrial. Este método também permite a exploração de condições fisiológicas importantes na interação membrana-proteína, como a assimetria de composição bicamadas. O papel de um lipídio mitocondrial chave, cardiolipina, nas propriedades bicamadas de lipossomos e bicamadas apoiadas por polímero permanece a ser definido. Propriedades como a resistência iônica, a espessura da membrana, a rigidez da membrana, a curvatura da membrana e as propriedades de viscosidade elástica da membrana podem influenciar a capacidade das proteínas de serem colocadas em estados funcionais específicos. Estudos futuros que aplicam criativamente sistemas de membrana modelo têm potencial para descobrir novos aspectos da organização e função da proteína da membrana.
Divulgações
Nenhum.
Agradecimentos
Os autores reconhecem o apoio do Charles H. Hood Foundation Child Health Research Award e o generoso apoio do Departamento de Biologia Molecular do Hospital Geral de Massachusetts.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(Cyanine 5) | Avanti polar lipid | Cat #: 810335C1mg | membrane fluorescent markers |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar lipids | Cat #: 880130P | lipid molecules |
| 1',3'-bis[1,2-dioleoyl-sn-glycero-3-phospho]-glycerol (sodium salt) | Avanti Polar lipids | Cat #: 710335P | lipid molecules |
| 18:1 (Δ9-Cis) PC (DOPC) | Avanti Polar lipids | Cat #: 850375P | lipid molecules |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar lipids | Cat #: 850757P | lipid molecules |
| Alexa Fluor 488 Antibody Labeling Kit | ThermoFisher Scientific | A20181 | |
| Amber vial with PTFE liner | Fisher scientific | 14-955-332 | sample vials to keep lipid solutions |
| Calcein | Sigma-Aldrich | Cat #: C0875; PubChem Substance ID: 24892279 | fluorescent dye |
| Chloroform | Fisher scientific | 298-500/ C295-4 | Fisher brand Chloroform is usually quite reliable for lipid works. |
| Concavity slide (1 well) | Electron Microscopy Science | 71878-05 | applied as Schaefer Slide |
| FCS analysis tool | Smith Lab, University of Akron | software tool | |
| Fiji /ImageJ | Fiji | SCR_002285 | software tool |
| Fisherbrand Cover Glasses: Circles | Fisher scientific | 12-545-102 | Cover glass for solid supported lipid bilayers, the item is now discontinued as authors prepared the manuscript. An alternative is Fisher brand premium cover glass with catalog number: 12-548-5M |
| GTP Disodium salt | SIGMA-ALDRICH INC | Cat #: 10106399001 | |
| Langmuir & Langmuir-Blodgett Trough | Biolin Scientifc | KN2002 | |
| L-α-lysophosphatidylinositol (Liver, Bovine) (sodium salt) | Avanti Polar lipids | Cat #: 850091P | lipid molecules |
| Mini Extruder | Avanti Polar lipids | 610020 | |
| n-Dodecyl-β-D-Maltopyranoside | Anatrace | Cat #: D310 25 GM | surfactant for reconstitution |
| n-Octyl-α-D-Glucopyranoside | Anatrace | Cat #: O311HA 25 GM | surfactant for reconstitution |
| PC Membranes 0.2μm | Avanti Polar Lipids | 610006 | |
| Rabbit Anti-Opa1 antibody | NOVUS BIOLOGICALS | Cat #: NBP2-59770 | antibody for Opa1 C-terminal detection |
| Slidebook | Intelligent imaging | RRID: SCR_014300 | software tool |
| Teflon threaded seal tape | Fisher Scientific | NC0636085 | taflon tape for sample storage |
| Texas Red 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine, Triethylammonium Salt (Texas Red DHPE) | ThermoFisher Scientific | Cat #: T1395MP | membrane fluorescent markers |
Referências
- Sackmann, E., Lipowsky, R., Sackmann, E. Biological membranes architecture and function. Structure and Dynamics of Membranes. 1, 1-63 (1995).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118, 1099-1102 (2005).
- Schink, K. O., Tan, K. W., Stenmark, H. Phosphoinositides in Control of Membrane Dynamics. Annual Review of Cell and Developmental Biology. 32, 143-171 (2016).
- Gu, R. X., Ingolfsson, H. I., de Vries, A. H., Marrink, S. J., Tieleman, D. P. Ganglioside-Lipid and Ganglioside-Protein Interactions Revealed by Coarse-Grained and Atomistic Molecular Dynamics Simulations. Journal of Physical Chemistry B. 121 (15), 3262-3275 (2017).
- Schafer, D. A. Coupling actin dynamics and membrane dynamics during endocytosis. Current Opinion in Cell Biology. 14 (1), 76-81 (2002).
- Chan, Y. H., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Biswas, K. H., Groves, J. T. Hybrid Live Cell-Supported Membrane Interfaces for Signaling Studies. Annual Reviews in Biophysics. 48, 537-562 (2019).
- Pick, H., Alves, A. C., Vogel, H. Single-Vesicle Assays Using Liposomes and Cell-Derived Vesicles: From Modeling Complex Membrane Processes to Synthetic Biology and Biomedical Applications. Chemical Reviews. 118 (18), 8598-8654 (2018).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophysical Journal. 99 (12), 4047-4055 (2010).
- Kiessling, V., et al. Rapid fusion of synaptic vesicles with reconstituted target SNARE membranes. Biophysical Journal. 104 (9), 1950-1958 (2013).
- Yang, S. T., Kiessling, V., Tamm, L. K. Line tension at lipid phase boundaries as driving force for HIV fusion peptide-mediated fusion. Nature Communication. 7, 11401 (2016).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophysical Journal. 101 (8), 37 (2011).
- Chao, L. H., Klein, D. E., Schmidt, A. G., Pena, J. M., Harrison, S. C. Sequential conformational rearrangements in flavivirus membrane fusion. Elife. 3, 04389 (2014).
- Floyd, D. L., Harrison, S. C., van Oijen, A. M. Analysis of kinetic intermediates in single-particle dwell-time distributions. Biophysical Journal. 99 (2), 360-366 (2010).
- Sezgin, E., Schwille, P. Model membrane platforms to study protein-membrane interactions. Molecular Membrane Biology. 29 (5), 144-154 (2012).
- Ge, Y., Gao, J., Jordan, R., Naumann, C. A. Changes in Cholesterol Level Alter Integrin Sequestration in Raft-Mimicking Lipid Mixtures. Biophysical Journal. 114 (1), 158-167 (2018).
- Dutta, D., Kam, L. C. Micropatterned, multicomponent supported lipid bilayers for cellular systems. Methods in Cell Biology. 120, 53-67 (2014).
- Groves, J., Ferrari, M., Desai, T., Bhatia, S. Supported Lipid Bilayers as Mimics for Cell Surfaces and as Tools in Biotechnology. BioMEMS and Biomedical Nanotechnology. , (2006).
- Shoaib, T., Nalam, P. C., He, Y., Chen, Y., Espinosa-Marzal, R. M. Assembly, Morphology, Diffusivity, and Indentation of Hydrogel-Supported Lipid Bilayers. Langmuir. 33 (28), 7105-7117 (2017).
- Wang, N., Rapoport, T. A. Reconstituting the reticular ER network - mechanistic implications and open questions. Journal of Cell Science. 132 (4), 227611 (2019).
- Powers, R. E., Wang, S., Liu, T. Y., Rapoport, T. A. Reconstitution of the tubular endoplasmic reticulum network with purified components. Nature. 543 (7644), 257-260 (2017).
- Chan, D. C. Fusion and fission: interlinked processes critical for mitochondrial health. Annual Reviews of Genetics. 46, 265-287 (2012).
- Nunnari, J., Suomalainen, A. Mitochondria: in sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wai, T., Langer, T. Mitochondrial Dynamics and Metabolic Regulation. Trends in Endocrinology Metabolism. 27 (2), 105-117 (2016).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nature Reviews Molecular Cell Biology. 11 (12), 872-884 (2010).
- Chen, H., et al. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development. Journal of Cell Biology. 160 (2), 189-200 (2003).
- Ishihara, N., Fujita, Y., Oka, T., Mihara, K. Regulation of mitochondrial morphology through proteolytic cleavage of OPA1. EMBO Journal. 25 (13), 2966-2977 (2006).
- Anand, R., et al. The i-AAA protease YME1L and OMA1 cleave OPA1 to balance mitochondrial fusion and fission. Journal of Cell Biology. 204 (6), 919-929 (2014).
- Mishra, P., Carelli, V., Manfredi, G., Chan, D. C. Proteolytic cleavage of Opa1 stimulates mitochondrial inner membrane fusion and couples fusion to oxidative phosphorylation. Cell Metabolism. 19 (4), 630-641 (2014).
- Baker, M. J., et al. Stress-induced OMA1 activation and autocatalytic turnover regulate OPA1-dependent mitochondrial dynamics. EMBO Journal. 33 (6), 578-593 (2014).
- DeVay, R. M., et al. Coassembly of Mgm1 isoforms requires cardiolipin and mediates mitochondrial inner membrane fusion. Journal of Cell Biology. 186 (6), 793-803 (2009).
- Rainbolt, T. K., Lebeau, J., Puchades, C., Wiseman, R. L. Reciprocal Degradation of YME1L and OMA1 Adapts Mitochondrial Proteolytic Activity during Stress. Cell Reports. 14 (9), 2041-2049 (2016).
- Ban, T., et al. Molecular basis of selective mitochondrial fusion by heterotypic action between OPA1 and cardiolipin. Nature Cell Biology. 19 (7), 856-863 (2017).
- Tanaka, M., Sackmann, E. Polymer-supported membranes as models of the cell surface. Nature. 437 (7059), 656-663 (2005).
- Shilts, K., Naumann, C. A. Tunable cell-surface mimetics as engineered cell substrates. Biochimica Biophysica Acta Biomembrane. 1860 (10), 2076-2093 (2018).
- Ge, Y., et al. Two forms of Opa1 cooperate to complete fusion of the mitochondrial inner-membrane. Elife. 9, 50973 (2020).
- Ge, Y., Siegel, A. P., Jordan, R., Naumann, C. A. Ligand binding alters dimerization and sequestering of urokinase receptors in raft-mimicking lipid mixtures. Biophysical Journal. 107 (9), 2101-2111 (2014).
- Simons, K., Vaz, W. L. Model systems, lipid rafts, and cell membranes. Annual Review of Biophysics and Biomolecular Structure. 33, 269-295 (2004).
- Kiessling, V., Liang, B., Tamm, L. K. Reconstituting SNARE-mediated membrane fusion at the single liposome level. Methods in Cell Biology. 128, 339-363 (2015).
- Siegel, A. P., Kimble-Hill, A., Garg, S., Jordan, R., Naumann, C. A. Native ligands change integrin sequestering but not oligomerization in raft-mimicking lipid mixtures. Biophysics Journal. 101 (7), 1642-1650 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados