Method Article
冷冻损伤在蝾螈和超声心动图中诱导心脏再生以及无偏倚的定量组织学评估再生进展
摘要
在这里,我们提出了一种手术方案,以诱导蝾螈心室心肌的冷冻损伤。此外,我们提出了一种方案,用于用超声心动图在再生过程中无创估计梗死分数,以及一种方案,以无偏定量组织学精确测量切除心脏的梗死分数。
摘要
urodele 两栖动物、蝾螈和蝾螈代表了最接近能够在脑室切除术后进行完全心肌再生的哺乳动物的系统发育组。切除模型生成了心脏修复所涉及的过程的基本知识。然而,该模型与临床情况没有很好的关系,在这些临床情况下,组织损伤、细胞凋亡、坏死、纤维化和肥大都是缺血引起的心肌梗死而不是组织切除的主要有害后果。另一方面,冷冻损伤诱发的心肌梗死与缺血诱发的心肌梗死更相似。在这里,我们提供了蝾螈 (Ambystoma mexicanum) 中冷冻损伤程序的详细描述,这为研究四足动物模型中心脏修复的基本机制提供了工具。此外,我们还提供定量方法,用于用超声心动图在体内无创估计梗死大小,以及用无偏倚的体外定量组织学精确测量梗死大小。
引言
缺血性心脏病是全球死亡的主要原因 1,2。缺血诱导的心肌梗死导致心肌细胞中广泛的细胞死亡3。尽管快速医疗干预可以降低立即死亡的风险,但人类与传统哺乳动物模式动物(小鼠、大鼠、兔子、猪等)共享的随之而来的纤维化反应会导致疤痕组织形成,最终导致心脏肥大、心律失常和心力衰竭4。与哺乳动物相反,心脏再生在一些非羊膜动物模型中已经建立起来,例如斑马鱼5 (zebrafish) 和蝾螈 6 (salamanders6)。传统上,已在脑室部分切除术或捏合后在这些物种中研究心脏再生 5,6,7,8,9,10。然而,在 2011 年,三个小组独立开发了一种斑马鱼冷冻损伤诱导的心肌梗死技术 11,12,13。与心室切除术相比,冷冻损伤技术导致斑马鱼心室主要部分坏死和细胞凋亡以及纤维化组织的初始积累,这更接近于缺血性梗死后哺乳动物心脏的病理发展 11,12,13.此外,在小鼠和猪中通过冠状动脉结扎术对冷冻损伤诱导的心肌梗死与缺血诱导的心肌梗死的方法学比较证明,冷冻损伤技术在哺乳动物模型中是一种有用的替代方案14,15。受斑马鱼冷冻损伤模型16,17 中涉及的方法的启发,我们在蝾螈 18 中开发了一个类似的模型,蝾螈18 是一种以其再生能力19 而闻名的两栖动物,它允许研究该四足动物在组织损伤而不是组织切除后心脏修复所涉及的机制。
在这里,我们提出了有关如何在蝾螈中进行冷冻损伤诱导的心肌梗死的详细方案。我们特别强调提高生存率、恢复率和实验可重复性的快速和微创关键步骤。此外,我们还提供了使用超声心动图评估体内解剖再生和使用基于无偏畸形学的定量组织学离体评估体外解剖再生的适当技术的说明。
冷冻损伤诱导的蝾螈心肌梗死可用于研究该四足动物心肌再生的基本机制。蝾螈耐受冷冻损伤引起的心肌梗塞,该心肌梗塞影响至少 45% 的心室,导致每搏输出量和心输出量减少,而其相对懒散的生活方式没有任何行为改变,然而,更严重的伤害可能会导致动物健康状况下降。
简而言之,为了诱发冷冻损伤,在麻醉的蝾螈的胸部做一个腹侧切口。使用钝性解剖进入心室,并使用预冷的冷冻探针 10 秒以诱导冷冻损伤。缝合腹侧切口,动物在恢复意识后迅速恢复,没有行为变化的迹象。对照/假动物接受类似的处理,但经历非冷却的低温探针。可以使用超声心动图(需要高频超声系统,≥20 MHz)监测心脏功能,如在20 岁之前的健康蝾螈心脏上详尽描述的那样,并且可以在再生过程中无创和重复地估计梗死分数。在3个月的再生过程中,可以随时采集梗死的心脏,冷冻切片进行组织学检查,并使用标准程序(例如,伊红和苏木精或Masson的三色染色)进行染色。特别是,Masson 的三色染色可以清楚地区分心室的梗塞部分和健康部分。心室的梗死分数是使用先前描述的心脏研究21 中描述的立体学技术来确定的。
研究方案
该协议符合所有机构(奥胡斯大学)和国家(丹麦国家动物实验检查局协议#2015-15-0201-00615)动物护理法规和指南。
1. 冷冻探针的制备
- 将三股直径为 1 毫米的铜线剪成 10 厘米的小块。
- 将铜绞线卷成一根线。
- 使用气体火炬熔化铜串的一端,形成直径为 2 mm 的球形末端。
注意:铜具有高导热性(0 °C 时为 401 W m-1 K-1 ),并且可以在易于控制的温度(熔点 1084.6 °C)下成型,但铜表面会随着时间的推移而腐蚀,特别是当它与血液接触时,这会显着降低导热性。因此,铜基低温探针必须偶尔抛光。也可用于低温探针的另一种更稳定的金属是银(0 °C 时导热系数 428 W m-1 K-1 ,熔点 961.8 °C)和金(0 °C 时导热系数 318 W m-1 K-1 ,熔点 1064.2 °C)。 - 从 2 mL 注射器中取出活塞,然后拉下软橡胶头。
- 将铜线的非球形端穿过注射器,并将其系在手枪上
- 将活塞放回注射器中(图 1A)。
注意:不使用低温探针时,应通过将活塞完全向后拉来保护铜串。使用时,将活塞完全推入,使铜串暴露在冷却槽中。
2. 冷冻损伤诱发的心肌梗死
- 通过将蝾螈浸入 200 mg/L 苯佐卡因麻醉剂中来麻醉蝾螈。浸泡 30 分钟将产生 ~2.5 小时的完全麻醉。
注:苯佐卡因不溶于水,应首先溶解在 3 mL(每 200 mg 苯佐卡因)丙酮中,然后加入水浴中。长时间浸泡在苯佐卡因中会影响恢复,因此应仔细监测在苯佐卡因中的时间。 - 将蝾螈腹侧朝上放在手术盘上(右撇子外科医生向左)。通过将除胸部以外的所有身体部位包裹在浸泡在麻醉溶液中的组织湿巾中来固定(图 1B)。
注意:将动物包裹在湿纸巾中可确保潮湿的环境,这对水生两栖动物至关重要,并且无需在眼睛上涂抹兽医药膏。在后续步骤中使用高压灭菌器械,以确保手术期间的无菌。 - 使用虹膜切除术剪刀在皮肤上做一个 ~1 厘米的纵向切口,略偏右于胸部中线(图 1C)。
- 使用镊子释放胸带的软骨板。
注意:胸带是一个精致的结构,应注意不要损坏其元件,因为这会损害以后的伤口愈合以及动物的运动和福利。 - 用切口轻轻打开暴露的心包,不要损坏下面的心脏结构。在心包液泄漏之前,将其吸入带有钝 2 号针头的 1 mL 注射器中(图 1D)。
- 将具有固定开口 (~1 cm) 的钝镊子放在伤口中,以保持伤口边缘和软骨板分开(图 1E)。
- 将低温探针置于液体 N2 中,使铜线暴露至少 2 分钟。
注意:如果铜线的质量太小(即太短)或冷却不足,可能会导致不希望的不完全透壁冷冻损伤。 - 用棉签或用力卷起的组织湿巾轻轻擦拭暴露的心室,以确保心室表面没有液体(图 1F)。
- 从液体 N2 中取出冷却至 -196 °C 的冷冻探针,并将其直接应用于暴露的心室(图 1H)。它会附着在心室上。冷冻探针放置在心室的外侧,朝向心尖,以避免损伤其他心脏结构,并允许随后的横向切片用于显微镜检查,同时包含健康和梗死心肌。10 秒后,将先前收集的心包液涂抹在冷冻探针尖端(图 1I)。这将解冻探头并允许从心室分离。
注意:如果探头加热过快,将冷冻探针应用于水过多的心室会导致不完全的冷冻梗死,或者如果覆盖心室整个表面的薄水层瞬间冻结,会导致心肌损伤过大。这两种情况都是不可取的。在成功诱导冷冻损伤的情况下,心室上会出现一个小的红色圆形肿胀(图1J)。处理假动物时,以类似的方式放置未冷却的低温探针 10 秒(图 1G)。 - 将心包放在心室顶部,取下保持伤口开放的镊子,并重新排列胸带的软骨板。
注意:如果进行后续超声心动图以评估心脏功能,则必须去除所有气穴,甚至是软骨板下容易出现的微小气泡,因为这些会诱发成像伪影。这些气泡可以通过轻轻按压组织或向伤口表面添加高压灭菌的两栖动物林格氏溶液(6.6 g/L NaCl、0.15 g/L KCl、0.15 g/L CaCl2、0.2 g/L NaHCO3 蒸馏水中)来去除,以溶解气泡。 - 使用可溶解线 (3-5) 缝合皮肤(6-0 缝合)(图 1K)。
- 用掀起伤口上方的湿组织湿巾覆盖手术区域,然后用麻醉液浸泡。
- 将装有动物的手术皿放在冰上 2 小时,以允许伤口表皮的初始形成,在动物暴露于其非无菌水生环境之前密封伤口边缘。
- 将动物转移到装有水族箱水的干净容器中。这只动物此时应该已经恢复意识了。观察动物,直到它恢复完全意识和协调运动。手术后两天停止喂食和换水,并将蝾螈单独放在自己的水族箱中,以便在再次引入干扰之前闭合伤口。
注意:恢复意识后,大多数蝾螈都有吞咽空气的欲望。为了缓解这个过程并限制所需的运动量,在手术后不久降低水族箱中的水位在手术后 1-2 天内可能是有益的。低浓度的苯佐卡因 (20 mg/L) 可用作术后 24 小时的镇痛药。
3. 超声心动图无创测量梗死分数
- 如步骤 2.1 中所述麻醉蝾螈。
- 将动物仰卧位放在一个小容器中,腹面覆盖 3-5 毫米的麻醉溶液。
- 将超声换能器沿动物的长轴略微放在胸部区域中线的右侧。
- 对于梗死分数的二维估计 [IF(超声,2D)],平移换能器,直到梗塞区和心室在 B 模式下出现最大值(图 2AD, 补充材料 1-2)。
- 以 > 50 帧/秒的速度获取 ≥3 个心动周期。
- 测量舒张末期心室 (CSAv) 和梗死区 (CSAi) 的横截面积,并通过使用以下公式假设球形心室形状和半球形梗死区形状来估计二维梗死分数:
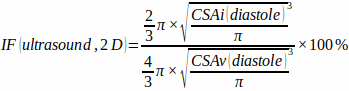 (1)
(1)
注意:为了评估心室和违规区形状的几何假设,可以将换能器旋转 90° 以显示心脏的短轴视图(图 2EF, 补充材料 3)。 - 为了对梗死分数进行三维估计,将换能器放置在左侧或右侧,直到在心室舒张期末端仅出现一小部分脑室。
- 在 0.5 毫米(对于小动物,体重≤ 20 克)或 1 毫米(大型动物,体重> 20 克)的步长 (z) 中,将换能器穿过心室并每步/切片至少获得 3 个心动周期。
注意:为了获得合理的精度,应获取 8 – 12 个切片 (n)。 - 测量每个切片 (j) 舒张末期的 CSAv 和 CSAi,并使用以下方程估计三维梗死分数 [IF(超声,3D)],而无需对心室和撞击形状进行任何几何假设:
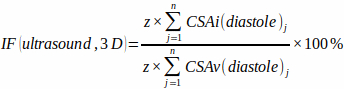 (2)
(2)
注意:二维和三维采集都可用于几何测量心脏功能(每搏输出量和心输出量),如 Dittrich 等人 (2018) 20 的第 3 节和第 6 节所述。同样,脉冲波速度获得速度时间积分(图 2G)也可用于测量心脏功能,如 Dittrich 等人 (2018)20 的第 3 节所述。 - 在步骤 3.9 中提取绘制的 CSAv 和 CSAi 的感兴趣区域作为二元掩码,切片之间具有 z 间距,以对舒张末期和收缩末期的心室和梗塞区进行三维建模(图 2H, 补充材料 4)。
4. 无偏倚的定量组织学测量梗死分数
- 探索步骤 2.2 – 2.6 中描述的麻醉蝾螈的心脏。
- 使用配备有 26 号针头的 1 mL 注射器,将 5 μL/g 体重的 1000 IU/mL 肝素化两栖动物林格氏溶液缓慢注入静脉窦中,并等待 2 分钟,让抗凝剂在循环中分布。
- 通过斩首和脑裂开来实施安乐死,并通过首先切断流入血管,然后切断流出道来切除整个心脏。
- 通过流出道轻轻提起心脏,将其转移到含有两栖动物林格溶液的 60 × 15 mm2 培养皿中。
- 在放大下,用 100 IU/mL 肝素化林格溶液轻轻填充静脉窦,洗去心脏中残留的血液。
注:虽然可以通过用缓冲福尔马林或多聚甲醛灌注心脏来进行心脏预固定,但这不是必需的,因为切片是在冰冻温度下进行的。随后,可以将切片固定在载玻片上。完全清洗的心脏会显得苍白发白,不含红细胞痕迹。心室和心房表面可能会形成小血凝块。它们不会影响后续定量组织学程序的精确度。 - 将心脏转移到无绒纸巾上吸干 1 分钟。
- 通过滴入一滴最佳切割温度化合物来准备足够大小的冷冻模具,然后将心转移到液滴中。轻轻挤压心脏到底部。
- 使用更理想的切割温度化合物来填充冷冻模具,并确保心室保持在底部。将模具放置 5 分钟,让最佳切割温度化合物分布在样品中。
- 将模具放在漂浮在液氮上的移液器吸头盒的盖子上,将其快速冷冻。
注:为了更受控的快速冷冻,可以将心脏在 10-30% 蔗糖溶液中储存 1 小时过夜,并且可以使用液氮冷却的异戊烷(2-甲基丁烷)进行快速冷冻。根据我们的经验,最终结果并没有明显的差异。 - 切片前,在设置为 -18 至 -22 °C 的低温恒温器中将低温模具回火至少 1 小时。
- 以 10 μm 的切片厚度切片样品,每 10个 切片收集一次,以提供 100 μm 的板坯厚度 (t)。继续切片,直到整个心脏被切片。
注意:可以使用不同的切片和平板厚度,但重要的是,切片收集从刀片接触心室的那一刻开始,并且整个心脏至少用 10-12 个均匀分布的平板切片。每个板可以收集多个切片以提供重复集。 - 使用标准方案对苏木精和伊红或Masson的Trichrome进行染色,以提供清晰的心外膜、心肌、瓣膜和梗死区之间的区别。
- 使用相机显微镜或载玻片扫描仪以足够的放大倍率对组织切片进行数字化,以清楚地揭示蝾螈脑室的小梁结构(图 2I)。
- 将图像堆栈加载到 ImageJ (https://imagej.nih.gov/ij/index.html) 中并初始化单元格计数器插件 (https://imagej.nih.gov/ij/plugins/cell-counter.html)。
- 运行多用途栅格宏 (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) 并生成具有足够栅格密度的点栅格。
注意:网格密度(网格面积)取决于样本大小和形态。为了提供理想的精度,应确保至少 100-200 个网格点的交集和每个感兴趣的结构。 - 使用细胞计数器插件计算点网格和感兴趣结构之间的交集数量(图 2I,右侧的放大倍数)。
注意:精度必须仅包括那些精确出现在十字准线瞄准点的交叉点。 - 根据预定义的点网格区域 [Ai(p) 和 Av(p)]、板厚以及每个板 (PJ) 与梗死心肌和总心室心肌的点网格交点数计算梗死分数使用以下公式:
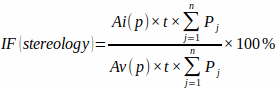 (3)
(3)
结果
在体重为 11.8 ± 1.3 g、总长度为 11.8 ± 0.5 cm 的蝾螈中,使用 2 毫米(直径)冷冻探针进行的冷冻损伤手术导致在受伤后 7 天覆盖 45.4 ± 14.2% 的心室心肌的梗塞区域,其中梗塞区完全发育 [图 2I,比较健康心脏发作前(上)和发作后 7 天(下)的切片]。该程序的死亡率为 2.2% (2/90 只动物)。该程序会产生一个定义明确的损伤区,可以通过无创超声心动图进行可视化、量化和建模(图 2CH,补充材料 1-4)。最初,冷冻损伤诱发的心肌梗死对心脏功能有显著影响,相对于受伤前,受伤后 7 天每搏输出量减少到 62.2%,心输出量减少到 73.9%,并且在三个月内形式和功能逐渐恢复(数据未显示)。在相对平静的蝾螈中未观察到心肌冷冻损伤后的行为变化。
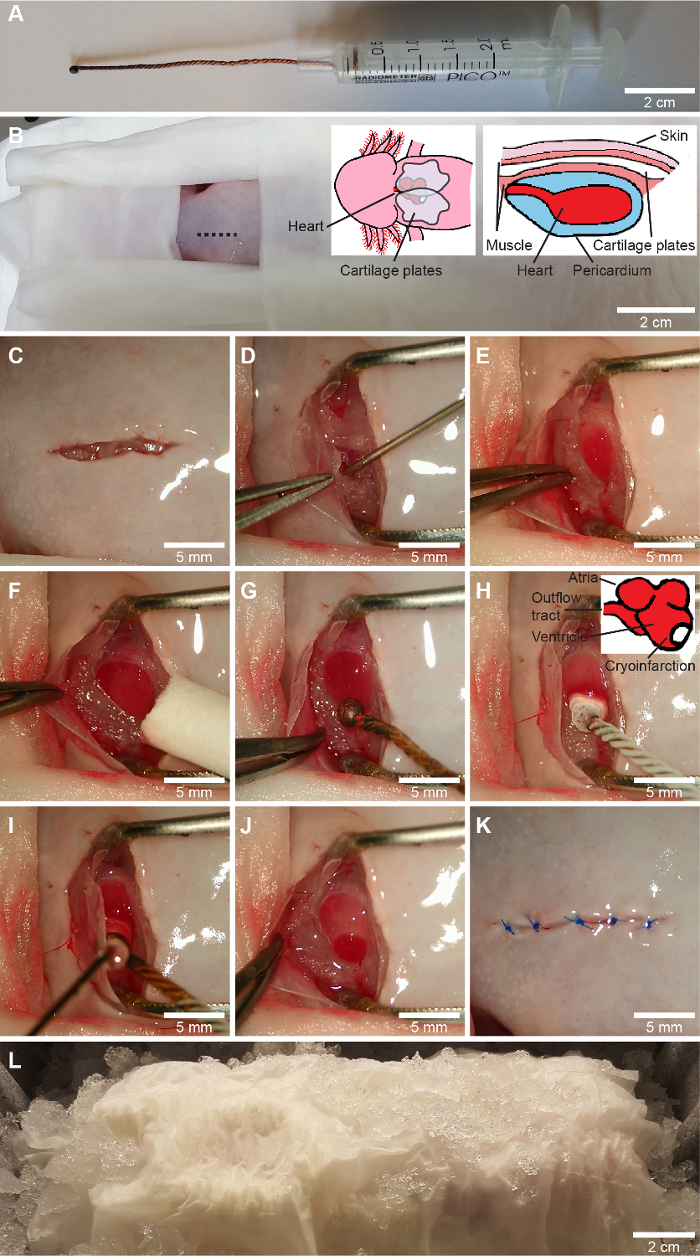
图 1:冷冻梗死程序。 答:定制的低温探针是通过盘绕三根铜线,将尖端熔化成球体并将导线连接到 2.5 mL 注射器的活塞上制成的。B-L,冷冻梗死手术。在将除手术区以外的所有身体部位包裹在湿组织拭子 (B) 中后,用虹膜切除术剪刀 (C) 在胸部略微偏右的中线右侧(如 B 所示)进行腹侧切口,并通过残端解剖释放胸带。用切口轻轻打开心包,并使用钝的 23 号针头 (D) 将心包液吸入 1 mL 注射器中。暴露心室,用具有预定义开口宽度 (E) 的镊子保持伤口开放,并擦去心室上的任何剩余液体 (F)。对于假手术,非冷却冷冻探针 (G) 的应用方式与冷冻损伤相同,其中在液氮 (-196 °C) 中冷却的冷冻探针应用于心室的侧壁,朝向心尖 (H)。10 秒后,将心包液重新应用于冷冻探针以将其从心室 (I) 中释放出来。这产生了一个明确定义的冷冻损伤区 (J)。最后,将心包和胸带放在心脏顶部,并用可溶解缝合线 (K) 缝合皮肤(3-5 缝)。将动物放在冰上 2 小时以启动伤口愈合过程 (L)。颅骨在 B-L 上向左,代表具有惯用右手的外科医生的动物方向。请单击此处查看此图的较大版本。
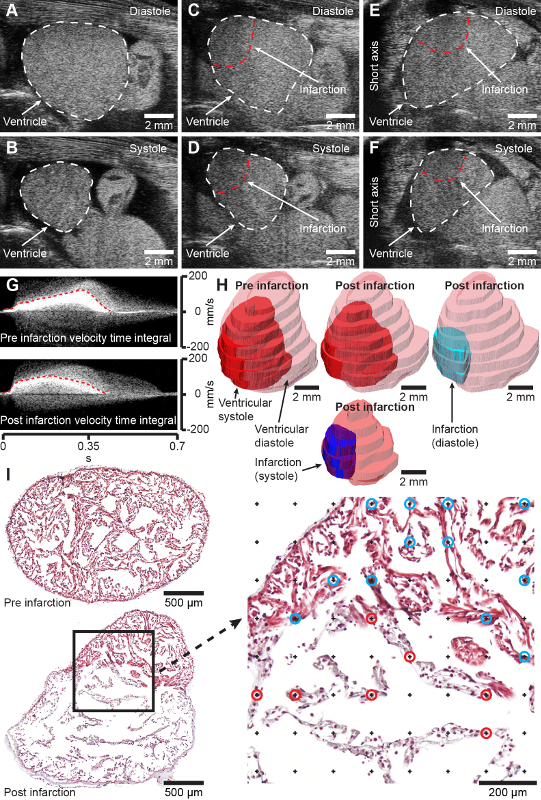
图 2:预期结果。 A 和 B,舒张期 (A) 和收缩期 (B) 中健康蝾螈心室的 B 型长轴图像。 C 和 D,冷冻损伤(受伤后 2 天)舒张期 (C) 和收缩期 (D) 蝾螈脑室的 B 型长轴图像。 E 和 F,冷冻损伤(受伤后 2 天)舒张期 (E) 和收缩期 (F) 蝾螈脑室的 B 型短轴图像。 G,脉搏波多普勒获得性心脏梗死前(上)和心肌梗死后 2 天(下)的速度时间积分。 H,通过三维超声采集对梗死前和梗死后 2 天的心脏进行建模。 I,假手术后 4 天(上)和梗死后 7 天(下)通过蝾螈脑室的代表性横向组织学切片,用 Masson 三色染色。右侧的放大倍率显示了用于 infarcion fraction 立体测量的点网格。用蓝色和红色圆圈标记的点表示与健康(蓝色圆圈)和梗塞(红色圆圈)组织的交集。颅骨在 A-D 中向右,动物右侧在 E-F 中向左,这代表了超声心动图图像的常规显示。 请单击此处查看此图的较大版本。
补充材料 1: 长轴,健康的心室梗死前,B 型(见 图 2AB)。 请点击此处下载此视频。
补充材料 2: 长轴,梗死脑室(梗死后 2 天),B 型(见 图 2CD)。 请点击此处下载此视频。
补充材料 3: 短轴电轴、梗塞脑室(梗死后 2 天)、B 型(见 图 2EF)。 请点击此处下载此视频。
补充材料 4: 如图 2AH 和补充材料 1-3 梗死前后所示的同一心脏的三维交互式模型。在 Adobe Acrobat Reader 9 或更高版本中启动交互式 PDF 文件。单击模型以激活 3D 特征。使用光标旋转、缩放和平移模型。在屏幕左侧的模型树中,所有段都可以激活/停用或变为透明。模型树构造为一个层次结构,其中包含多个可以打开的子层(通过选择 +)。 请点击此处下载此文件。
讨论
为了尽量减少实验变化,冷冻损伤的外科手术应遵循无菌程序,并且在尝试使用动物进行特定的再生实验之前,应对许多动物进行外科训练。通过培训,冷冻损伤手术可以对各种大小和年龄的蝾螈进行,从幼年(5 g、7 cm)到大型成人(100 g、25 cm)。至关重要的是,冷冻探针具有足够的尺寸并经过充分冷却,以便为蝾螈心室提供坚固且可重复的冷冻损伤。对于非常小的动物(5-8 g、7-9 cm),冷冻探针可以构造成更小的直径。虽然必须使用具有镇痛特性的麻醉剂(如苯佐卡因和 MS-222)进行冷冻损伤方案(或额外应用二级镇痛剂),但后续超声心动图可以使用其他具有有限镇痛特性的麻醉剂进行,例如异丙酚,据描述其对心脏功能的影响小于苯佐卡因和蝾螈22 中的 MS-222。
冷冻损伤手术的局限性在于它不会像冠状动脉结扎手术那样通过冠状动脉闭塞产生缺血诱导的心肌梗死,后者更类似于人类心肌梗死的临床病例。然而,基于结扎的方法不适用于冠状动脉脉管系统非常少且大部分管腔供氧的骨干两栖动物心脏。此外,冷冻损伤诱发的心肌梗死已被描述为概括缺血诱发心肌梗死的大部分病理后果14,16。冷冻损伤产生的损伤区高度定位于靠近冷冻探针的组织,虽然这不像冠状动脉阻塞引起的复杂和分支状梗塞,但它在实验环境中是有利的,因为可以很容易地识别健康和梗死组织之间的边界区,并且可以研究新形成的心肌细胞的进展。
蝾螈是一种比斑马鱼大得多的动物,具有更复杂的心血管系统,包括一个由三个腔室(两个心房、一个心室)组成的心脏和一个功能性的(虽然不是解剖学的)氧合和脱氧电流中的血流分离23 与硬骨中的两个腔室心脏和串联流系统相比。先前在斑马鱼中描述的冷冻损伤程序不涉及术后切开腹面的缝合16,17。这在蝾螈中是必要的,以避免心脏不必要地暴露在动物实验室栖息地的非无菌水生环境中。
目前在再生领域,基于无偏倚立体学的定量组织学被低估,其中大多数梗死分数的定量测量依赖于在梗死中段的组织学切片上绘制的面积,在某些情况下,两个相邻的切片24。由于立体学的概念可以应用于任何模式物种的组织学检查,以提供更稳健和公正的测量,我们建议这种免费可用的方法不仅应纳入蝾螈心脏再生的定量评估,而且应纳入所有再生物种的心脏再生。
披露声明
作者没有什么可披露的。
致谢
我们要感谢 Casper Bindzus Foldager、Asger Andersen 和 Michael Pedersen(均在奥胡斯大学临床医学系)和 David Gardiner(加州大学尔湾分校发育与细胞生物学系)在蝾螈冷冻损伤模型和超声检查的初始开发中提供的帮助。
材料
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
参考文献
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503(2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666(2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089(2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。