Method Article
Rigenerazione cardiaca indotta da criolesione nell'axolotl e nell'ecocardiografia e istologia quantitativa imparziale per valutare la progressione rigenerativa
In questo articolo
Riepilogo
Qui presentiamo un protocollo chirurgico per indurre la criolesione al miocardio ventricolare dell'axolotl. Inoltre, presentiamo un protocollo per stimare in modo non invasivo la frazione di infarto durante il processo rigenerativo con ecocardiografia e un protocollo per misurare con precisione la frazione di infarto nel cuore asportato con un'istologia quantitativa imparziale.
Abstract
Gli urodeli, anfibi, salamandre e tritoni, rappresentano il gruppo filogenetico più vicino ai mammiferi in grado di effettuare una rigenerazione miocardica completa a seguito di resezione ventricolare. Il modello di resezione ha generato una conoscenza di base dei processi coinvolti nella riparazione cardiaca. Tuttavia, il modello non si relaziona bene con le situazioni cliniche in cui il danno tissutale, l'apoptosi, la necrosi, la fibrosi e l'ipertrofia sono tutte conseguenze dannose chiave degli infarti miocardici indotti da ischemia piuttosto che la rimozione dei tessuti. D'altra parte, l'infarto miocardico indotto da criolesione assomiglia più da vicino all'infarto miocardico indotto da ischemia. Qui forniamo una descrizione dettagliata della procedura di criolesione nell'axolotl (Ambystoma mexicanum), che fornisce uno strumento per studiare i meccanismi di base nella riparazione cardiaca in un modello di tetrapodi. Inoltre, forniamo metodi quantitativi per stimare le dimensioni dell'infarto in modo non invasivo in vivo con l'ecocardiografia e per misurare con precisione le dimensioni dell'infarto con un'istologia quantitativa imparziale ex vivo.
Introduzione
La cardiopatia ischemica è una delle principali cause di decesso a livello globale 1,2. L'infarto del miocardio indotto da ischemia provoca una diffusa morte cellulare nei cardiomiociti3. Sebbene un rapido intervento medico possa ridurre il rischio di morte immediata, la conseguente risposta fibrotica che gli esseri umani condividono con i tradizionali animali modello di mammiferi (topo, ratto, coniglio, maiale, ecc.) provoca la formazione di tessuto cicatriziale che può portare a ipertrofia cardiaca, aritmie e insufficienza cardiaca4. Contrariamente ai mammiferi, la rigenerazione cardiaca è ben consolidata in alcuni modelli animali non amnionici come il pesce zebra5 e le salamandre6. Tradizionalmente, la rigenerazione cardiaca è stata studiata in queste specie dopo resezione ventricolare parziale o pizzicamento 5,6,7,8,9,10. Tuttavia, nel 2011, tre gruppi hanno sviluppato in modo indipendente una tecnica di infarto miocardico indotta da criolesione nel pesce zebra 11,12,13. La tecnica della criolesione provoca necrosi e apoptosi in una parte importante del ventricolo cardiaco del pesce zebra e un accumulo iniziale di tessuto fibrotico che modella più da vicino lo sviluppo patologico del cuore dei mammiferi dopo infarto ischemico rispetto alla resezione ventricolare 11,12,13 . Inoltre, i confronti metodologici tra l'infarto miocardico indotto da criolesione e l'infarto miocardico indotto da ischemia mediante legatura dell'arteria coronarica nel topo e nel maiale hanno dimostrato che la tecnica della criolesione è un'utile alternativa nei modelli animali di mammifero14,15. Ispirati dai metodi coinvolti nel modello di criolesione del pesce zebra 16,17, abbiamo sviluppato un modello simile nell'axolotl18, un anfibio rinomato per le sue capacità rigenerative19, che consente di studiare i meccanismi coinvolti nella riparazione cardiaca in questo tetrapode dopo un danno tissutale piuttosto che la rimozione dei tessuti.
Qui presentiamo un protocollo dettagliato su come eseguire l'infarto miocardico indotto da criolesione nell'axolotl. Poniamo particolare enfasi su passaggi cruciali rapidi e minimamente invasivi che aumentano la sopravvivenza, il recupero e la riproducibilità sperimentale. Inoltre, forniamo istruzioni per le tecniche appropriate per valutare la rigenerazione anatomica in vivo utilizzando l'ecocardiografia ed ex vivo utilizzando l'istologia quantitativa basata su stereologia imparziale.
L'infarto miocardico indotto da criolesione nell'axolotl può essere applicato per studiare i meccanismi di base coinvolti nella rigenerazione miocardica in questo tetrapode. L'axolotl è tollerante all'infarto miocardico indotto da criolesione, che colpisce almeno il 45% del ventricolo, con conseguente diminuzione della gittata sistolica e della gittata cardiaca senza alcun cambiamento comportamentale nel suo stile di vita relativamente languido, tuttavia, lesioni più gravi porteranno potenzialmente a una diminuzione della salute degli animali.
In breve, per indurre la criolesione, viene praticata un'incisione ventrale sul torace di un axolotl anestetizzato. L'accesso al ventricolo avviene mediante dissezione smussata e viene applicata una criosonda preraffreddata per 10 s per indurre la criolesione. L'incisione ventrale viene suturata e l'animale si riprende rapidamente senza segni di cambiamenti comportamentali dopo che la coscienza è ripresa. Gli animali di controllo/fittizio ricevono un trattamento simile, ma sperimentano una criosonda non raffreddata. Le prestazioni cardiache possono essere monitorate utilizzando l'ecocardiografia (sono necessari sistemi a ultrasuoni ad alta frequenza, ≥20 MHz) come descritto in modo esaustivo su cuori sani di axolotl precedentemente20, e la frazione di infarto può essere stimata in modo non invasivo e ripetuto durante il processo rigenerativo. I cuori infartuati possono essere prelevati in qualsiasi momento durante il processo rigenerativo di 3 mesi, criosezionati per l'istologia e colorati utilizzando procedure standard (ad esempio, eosina ed ematossilina o colorazione tricromica di Masson). In particolare, la colorazione tricromica di Masson consente una chiara distinzione tra parti infartuate e sane del ventricolo. La frazione di infarto del ventricolo viene determinata utilizzando tecniche stereologiche precedentemente descritte per gli studi cardiaci21.
Protocollo
Questo protocollo è conforme a tutte le normative e le linee guida istituzionali (Università di Aarhus) e nazionali (Danish National Animal Experiments Inspectorate protocol# 2015−15−0201−00615) per la cura degli animali.
1. Preparazione della criosonda
- Tagliare tre fili di filo di rame con diametro di 1 mm in pezzi di 10 cm.
- Avvolgere i trefoli di rame in una corda.
- Con un cannello a gas fondere un'estremità della corda di rame per formare un'estremità sferica con un diametro di 2 mm.
NOTA: Il rame ha un'elevata conducibilità termica (401 W m-1 K-1 a 0 °C) e può essere modellato a temperature facilmente gestibili (punto di fusione 1084,6 °C) ma una superficie di rame ha la tendenza a corrodersi nel tempo soprattutto se viene a contatto con il sangue, il che abbassa notevolmente la conducibilità termica. Pertanto, una criosonda a base di rame deve essere lucidata di tanto in tanto. Metalli alternativi più stabili che possono essere utilizzati anche per le criosonde sono l'argento (conducibilità termica 428 W m-1 K-1 a 0 °C, punto di fusione 961,8 °C) e l'oro (conducibilità termica 318 W m-1 K-1 a 0 °C, punto di fusione 1064,2 °C). - Rimuovere il pistone da una siringa da 2 ml ed estrarre la testina in gomma morbida.
- Inserire l'estremità non sferica della corda di rame attraverso la siringa e legarla alla pistola
- Riposizionare il pistone nella siringa (Figura 1A).
NOTA: Quando la criosonda non è in uso, la stringa di rame deve essere protetta tirando completamente indietro il pistone. Durante l'uso, il pistone viene spinto fino in fondo per esporre la stringa di rame al bagno di raffreddamento.
2. Infarto miocardico indotto da criolesione
- Anestetizzare l'axolotl immergendolo in 200 mg/L di anestetico benzocaina. Trenta minuti di immersione produrranno ~2,5 ore di anestesia completa.
NOTA: La benzocaina è insolubile in acqua e deve essere prima solubilizzata in 3 mL (per 200 mg di benzocaina) di acetone che viene successivamente aggiunto al bagnomaria. L'immersione prolungata nella benzocaina può compromettere il recupero, quindi il tempo nella benzocaina deve essere monitorato attentamente. - Posizionare l'axolotl con il lato ventrale rivolto verso l'alto su un piatto chirurgico (testa a sinistra per un chirurgo destrorso). Immobilizzare avvolgendo tutte le parti del corpo tranne il torace in salviette di tessuto imbevute di soluzione anestetica (Figura 1B).
NOTA: Racchiudere l'animale in salviette di tessuto bagnate garantisce un ambiente umido cruciale per un anfibio acquatico ed elimina la necessità di un unguento veterinario sugli occhi. Utilizzare strumenti autoclavati nei passaggi successivi per garantire la sterilità durante l'intervento chirurgico. - Utilizzare le forbici per iridectomia per praticare un'incisione longitudinale di ~ 1 cm nella pelle leggermente a destra fino alla linea mediana del torace (Figura 1C).
- Usa una pinza per liberare le placche cartilaginee del cingolo pettorale.
NOTA: La cintura pettorale è una struttura delicata e bisogna fare attenzione a non danneggiare i suoi elementi in quanto ciò può compromettere la successiva guarigione delle ferite e la locomozione e il benessere degli animali. - Aprire delicatamente il pericardio esposto con un'incisione senza danneggiare le strutture cardiache sottostanti. Prima che il liquido pericardico fuoriesca, aspirarlo in una siringa da 1 ml contenente un ago smussato da 2 gauge (Figura 1D).
- Posizionare una pinza smussata con un'apertura fissa (~1 cm) nella ferita per tenere separati i bordi della ferita e le placche cartilaginee (Figura 1E).
- Posizionare la criosonda nel liquido N2 con il filo di rame esposto per almeno 2 minuti.
NOTA: Se la massa del filo di rame è troppo piccola (cioè è troppo corta) o se è raffreddato in modo insufficiente, può verificarsi una criolesione transmurale indesiderata e incompleta. - Strofinare delicatamente il ventricolo esposto con un batuffolo di cotone o salviette in tessuto ben arrotolate per assicurarsi che non sia presente alcun liquido sulla superficie del ventricolo (Figura 1F).
- Rimuovere la criosonda raffreddata a -196 °C dal liquido N2 e applicarla direttamente sul ventricolo esposto (Figura 1H). Si attaccherà al ventricolo. Il posizionamento della criosonda deve avvenire sul lato laterale del ventricolo verso l'apice per evitare danni ad altre strutture cardiache e consentire successive sezioni trasversali per la microscopia contenente miocardio sano e infartuato. Dopo 10 s applicare il liquido pericardico precedentemente raccolto sulla punta della criosonda (Figura 1I). Questo scongelerà la sonda e consentirà il distacco dal ventricolo.
NOTA: L'applicazione della criosonda su un ventricolo con acqua eccessiva provoca un crioinfarto incompleto, se la sonda viene riscaldata troppo rapidamente, o un danno miocardico troppo esteso, se un sottile strato d'acqua che copre l'intera superficie del ventricolo viene istantaneamente congelato. Nessuna delle due situazioni è auspicabile. In caso di induzione riuscita della criolesione, sul ventricolo apparirà un piccolo gonfiore circolare rosso (Figura 1J). Quando si maneggiano animali fittizi, una criosonda non raffreddata viene posizionata in modo simile per 10 s (Figura 1G). - Posizionare il pericardio sopra il ventricolo, rimuovere la pinza che teneva aperta la ferita e riorganizzare le placche cartilaginee del cingolo pettorale.
NOTA: Se si esegue un'ecocardiografia successiva per valutare la funzione cardiaca, è fondamentale che tutte le sacche d'aria, anche le minuscole bolle che tendono a formarsi sotto le placche cartilaginee, vengano rimosse poiché inducono artefatti di imaging. Queste bolle possono essere rimosse premendo delicatamente il tessuto o aggiungendo la soluzione di Ringer per anfibi autoclavata (6,6 g/L di NaCl, 0,15 g/L di KCl, 0,15 g/L di CaCl2, 0,2 g/L di NaHCO3 in acqua distillata) sulla superficie della ferita per sciogliere le bolle d'aria. - Suturare la pelle (3-5 punti) utilizzando filo solubile (6-0) (Figura 1K).
- Coprire l'area chirurgica con salviette di tessuto bagnate sollevate sopra la ferita e quindi immergere con soluzione anestetica.
- Posizionare la capsula chirurgica con l'animale sul ghiaccio per 2 ore per consentire la formazione iniziale di un'epidermide della ferita, sigillando i bordi della ferita prima che l'animale sia esposto al suo ambiente acquatico non sterile.
- Trasferisci l'animale in un contenitore pulito con acqua dell'acquario. L'animale dovrebbe riprendere conoscenza a questo punto. Osserva l'animale fino a quando non ha riacquistato la piena coscienza e i movimenti coordinati. Interrompere l'alimentazione e il cambio dell'acqua per due giorni dopo l'intervento e tenere l'axolotl da solo nel proprio acquario per consentire la chiusura della ferita prima che vengano reintrodotti disturbi.
NOTA: Dopo aver ripreso conoscenza, la maggior parte degli axolotl ha il desiderio di inghiottire aria. Per facilitare questo processo e limitare la quantità di movimento necessaria, può essere utile abbassare il livello dell'acqua nell'acquario poco dopo l'intervento chirurgico per 1-2 giorni dopo l'intervento. Una bassa concentrazione di benzocaina (20 mg/L) può essere utilizzata come analgesico per 24 ore dopo l'intervento chirurgico.
3. Misurazione non invasiva della frazione infartuale con ecocardiografia
- Anestetizzare axolotl come descritto nel passaggio 2.1.
- Posizionare l'animale in posizione supina in un piccolo contenitore con 3-5 mm di soluzione anestesiologica che copre la superficie ventrale.
- Posizionare il trasduttore a ultrasuoni lungo l'asse lungo dell'animale leggermente a destra della linea mediana della regione toracica.
- Per una stima bidimensionale della frazione di infarto [IF(ultrasound, 2D)], tradurre il trasduttore fino a quando la zona di infarto e il ventricolo appaiono massimi in modalità B (Figura 2A-D, Materiale supplementare 1-2).
- Acquisisci ≥3 cicli cardiaci con > 50 fotogrammi/s.
- Misurare l'area della sezione trasversale del ventricolo (CSAv) e della zona di infarto (CSAi) alla fine della diastole e stimare la frazione di infarto bidimensionale assumendo una forma del ventricolo sferico e una forma della zona di infarto emisferico utilizzando l'equazione:
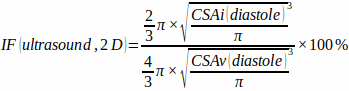 (1)
(1)
NOTA: Per valutare le ipotesi geometriche della forma del ventricolo e della zona di infrazione, il trasduttore può essere ruotato di 90° per visualizzare la vista dell'asse corto del cuore (Figura 2E-F, Materiale supplementare 3). - Per una stima tridimensionale della frazione di infarto, posizionare il trasduttore a sinistra o a destra fino a quando solo una piccola porzione del ventricolo appare in vista alla fine della diastole ventricolare.
- Con incrementi (z) di 0,5 mm (per animali di piccola taglia, massa corporea ≤ 20 g) o 1 mm (animali di grossa taglia, massa corporea > 20 g) spostare il trasduttore attraverso il ventricolo e acquisire almeno 3 cicli cardiaci per passo/fetta.
NOTA: Per una precisione ragionevole, è necessario acquisire 8 – 12 fette (n). - Misurare CSAv e CSAi alla fine della diastole per ciascuna fetta (j) e stimare la frazione di infarto tridimensionale [IF(ultrasuoni, 3D)] senza alcuna ipotesi geometrica della forma del ventricolo e dell'infrazione utilizzando l'equazione:
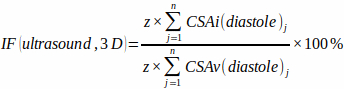 (2)
(2)
NOTA: Sia l'acquisizione bidimensionale che quella tridimensionale possono essere utilizzate per misurare geometricamente la funzione cardiaca (gittata sistolica) come descritto nelle sezioni 3 e 6 di Dittrich et al. (2018)20. Allo stesso modo, gli integrali tempo-velocità acquisiti dalla velocità dell'onda pulsata (Figura 2G) possono essere utilizzati anche per misurare la funzione cardiaca come descritto nella sezione 3 di Dittrich et al. (2018)20. - Estrarre le regioni di interesse di CSAv e CSAi disegnate nel passaggio 3.9 come maschere binarie con spaziatura z tra le fette per modellare tridimensionalmente il ventricolo e la zona di infarto alla fine della diastole e alla fine della sistole (Figura 2H, Materiale supplementare 4).
4. Istologia quantitativa imparziale per misurare la frazione di infarto
- Esplora il cuore di un axolotl anestetizzato descritto nei passaggi 2.2 – 2.6.
- Utilizzando una siringa da 1 ml dotata di un ago calibro 26, iniettare lentamente 5 μL/g di massa corporea di 1000 UI/mL di soluzione di anfibio eparinizzato di Ringer nel seno venoso e attendere 2 minuti per consentire all'anticoagulante di distribuirsi in circolo.
- Eutanasia per decapitazione e assaggio del cervello e asportare l'intero cuore tagliando prima i vasi di afflusso e poi il tratto di deflusso.
- Trasferire il cuore sollevandolo delicatamente dal tratto di deflusso in una piastra di Petri da 60 × 15 mmcontenente la soluzione di Ringer per anfibi.
- Sotto ingrandimento, lavare via il sangue residuo nel cuore riempiendo delicatamente il seno venoso con 100 UI/mL di soluzione di Ringer eparinizzata.
NOTA: Sebbene la prefissazione del cuore possa essere condotta perfondendo il cuore con formalina tamponata o paraformaldeide, ciò non è necessario, poiché il sezionamento viene effettuato a una temperatura di congelamento. Successivamente, è possibile eseguire il fissaggio delle sezioni su vetrini. Un cuore completamente lavato apparirà pallido e biancastro e non conterrà tracce di globuli rossi. È probabile che si formino piccoli coaguli di sangue sulla superficie del ventricolo e degli atri. Non influiscono sulla precisione nella successiva procedura di istologia quantitativa. - Trasferire il cuore su carta velina priva di lanugine per asciugare per 1 minuto.
- Preparare un criomold di dimensioni adeguate applicando una sola goccia di composto per la temperatura di taglio ottimale e trasferire il cuore sulla goccia. Stringi delicatamente il cuore fino in fondo.
- Applicare un composto più ottimale per la temperatura di taglio per riempire il criomold e assicurarsi che il ventricolo rimanga sul fondo. Lasciare lo stampo per 5 minuti per consentire al composto di temperatura di taglio ottimale di distribuirsi nel campione.
- Congelare lo stampo posizionandolo su un coperchio da una scatola di puntali per pipette che galleggia sull'azoto liquido.
NOTA: Per un congelamento rapido più controllato, i cuori possono essere conservati per 1 ora durante la notte in una soluzione di saccarosio al 10-30% e il congelamento rapido può essere eseguito utilizzando isopentano (2-metilbutano) raffreddato con azoto liquido. Nella nostra esperienza, il risultato finale non è molto diverso. - Temperare il criomedio in un criostato impostato a una temperatura compresa tra -18 e -22 °C per almeno 1 ora prima del sezionamento.
- Sezionare il campione con uno spessore della fetta di 10 μm e raccogliere ogni 10fette per ottenere uno spessore della lastra (t) di 100 μm. Continua il sezionamento fino a sezionare l'intero cuore.
NOTA: È possibile utilizzare diversi spessori di fette e lastre, tuttavia è importante che la raccolta delle fette inizi nel punto esatto in cui la lama tocca il ventricolo e che l'intero cuore sia sezionato con almeno 10-12 lastre equidistanti. È possibile raccogliere più di una sezione per lastra per fornire set duplicati. - Colorare le sezioni di tessuto con protocolli standard per ematossilina ed eosina o Tricromia di Masson per fornire una chiara distinzione tra epicardio, miocardio, valvole e zona di infarto.
- Digitalizzare la sezione dei tessuti utilizzando un microscopio fotografico o uno scanner per vetrini a un ingrandimento sufficiente per rivelare chiaramente la struttura trabecolata del ventricolo axolotl (Figura 2I).
- Caricare lo stack di immagini in ImageJ (https://imagej.nih.gov/ij/index.html) e inizializzare il plug-in del contatore di celle (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Eseguire una macro di griglia multiuso (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) e generare una griglia di punti con una densità di griglia adeguata.
NOTA: La densità della griglia (area della griglia) dipende dalle dimensioni e dalla morfologia del campione. Per fornire una precisione desiderabile, dovrebbero essere garantite almeno 100-200 intersezioni di punti della griglia e ciascuna delle strutture di interesse. - Conta il numero di intersezioni tra la griglia di punti e le strutture di interesse utilizzando il plug-in del contatore di celle (Figura 2I, ingrandimento a destra).
NOTA: Per la precisione, è importante includere solo le intersezioni che appaiono esattamente nel punto di mira del mirino. - Calcolare la frazione di infarto dall'area della griglia di punti predefinita [Ai(p) e Av(p)], dallo spessore della soletta e dal numero di intersezioni della griglia di punti in ciascuna lastra (Pj) con miocardio infartuato e miocardio ventricolare totale utilizzando la formula:
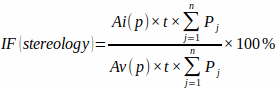 (3)
(3)
Risultati
Negli axolotl con una massa corporea di 11,8 ± 1,3 g e una lunghezza totale di 11,8 ± 0,5 cm, la procedura di criolesione eseguita con una criosonda di 2 mm (diametro) risulta in un'area infartuata che copre il 45,4 ± il 14,2% del miocardio ventricolare a 7 giorni dopo l'infortunio in cui la zona di infarto è completamente sviluppata [Figura 2I, confronta la sezione del cuore sano prima dell'infrazione (in alto) e 7 giorni dopo l'infrazione (in basso)]. La procedura ha un tasso di mortalità del 2,2% (2/90 animali). La procedura si traduce in una zona di lesione ben definita che può essere visualizzata, quantificata e modellata con l'ecocardiografia non invasiva (Figura 2C-H, materiale supplementare 1-4). Inizialmente, l'infarto miocardico indotto da criolesione influisce significativamente sulla funzione cardiaca, riducendo la gittata sistolica al 62,2% e la gittata cardiaca al 73,9% a 7 giorni dopo l'infortunio rispetto a prima dell'infortunio con un recupero graduale di forma e funzione nell'arco di tre mesi (dati non mostrati). Non si osservano cambiamenti comportamentali a seguito di criolesione miocardica nell'axolotl relativamente tranquillo.
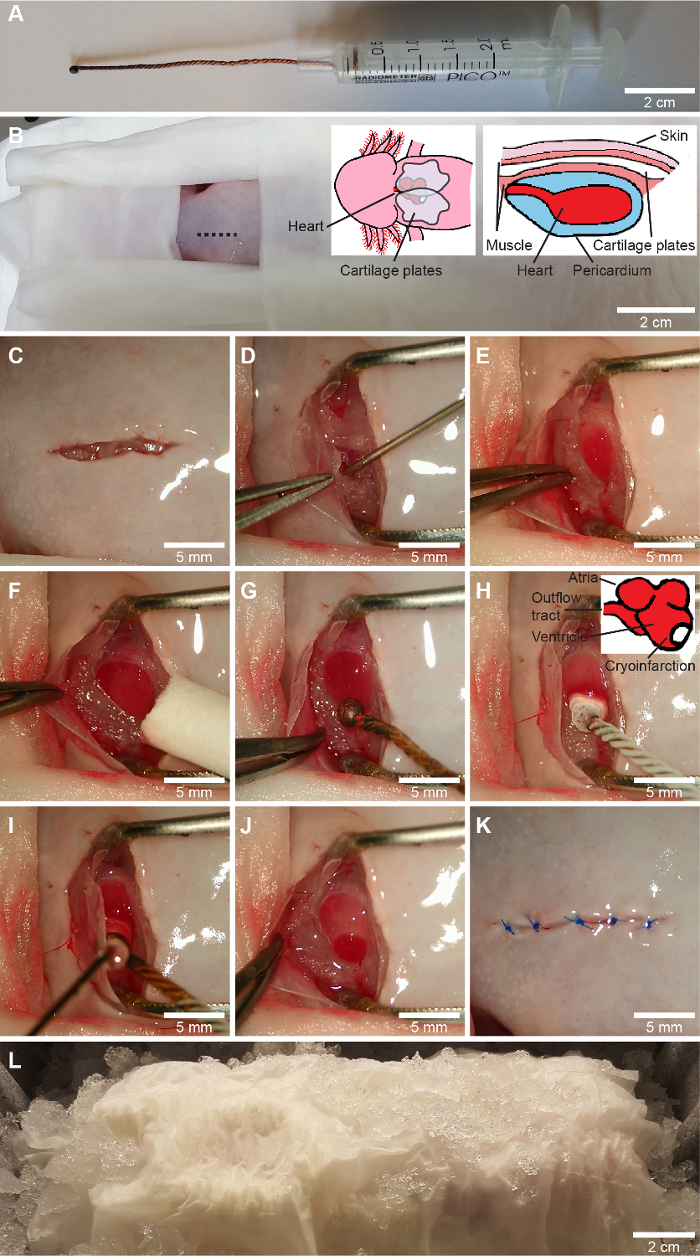
Figura 1: Procedura di crioinfarto. A, una criosonda su misura viene realizzata avvolgendo tre fili di rame, fondendo la punta in una sfera e collegando il filo al pistone di una siringa da 2,5 ml. B-L, la procedura di crioinfarto. Dopo l'incapsulamento di tutte le parti del corpo tranne la zona chirurgica in salviette di tessuto umido (B), viene eseguita un'incisione ventrale sul torace leggermente a destra della linea mediana (mostrata su B) con forbici per iridectomia (C) e il cingolo pettorale viene liberato mediante dissezione del moncone. Il pericardio viene aperto delicatamente con un'incisione e il liquido pericardico viene aspirato in una siringa da 1 ml utilizzando un ago smussato calibro 23 (D). Il ventricolo viene esposto e la ferita viene mantenuta aperta con una pinza con una larghezza di apertura predefinita (E) e l'eventuale liquido rimanente sul ventricolo viene rimosso (F). Per la chirurgia fittizia viene applicata una criosonda (G) non raffreddata allo stesso modo della criolesione, in cui la criosonda raffreddata in azoto liquido (-196 °C) viene applicata alla parete laterale del ventricolo verso l'apice (H). Dopo 10 s, il liquido pericardico viene riapplicato alla criosonda per rilasciarlo dal ventricolo (I). In questo modo si ottiene una zona di criolesione (J) chiaramente definita. Infine, il pericardio e la cintura pettorale vengono adagiati sulla parte superiore del cuore e la pelle viene suturata (3-5 punti) con una sutura solubile (K). L'animale viene lasciato in ghiaccio per 2 ore per avviare il processo di guarigione della ferita (L). Il cranio è verso sinistra su B-L, che rappresenta l'orientamento dell'animale per un chirurgo con una mano destra dominante. Clicca qui per visualizzare una versione più grande di questa figura.
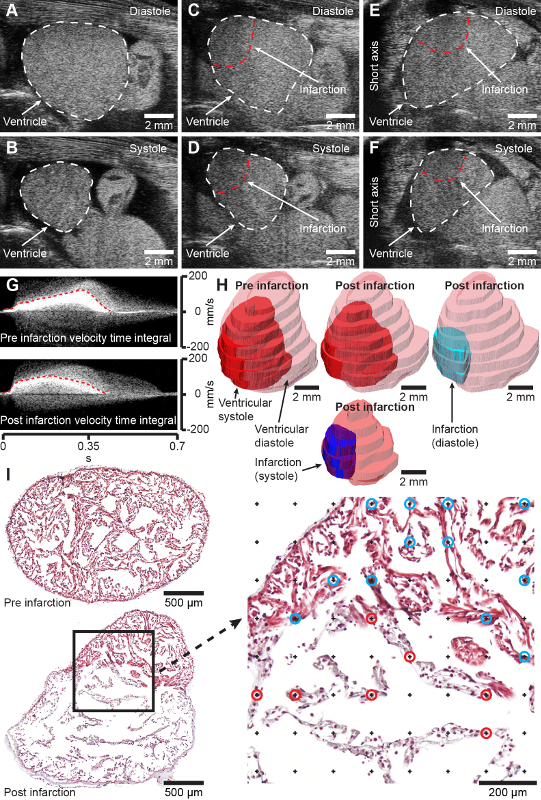
Figura 2: Risultati previsti. A e B, immagini dell'asse lungo in modalità B del ventricolo axolotl sano in diastole (A) e sistole (B). C e D, immagini dell'asse lungo in modalità B del ventricolo axolotl criolesionato (2 giorni dopo l'infortunio) in diastole (C) e sistole (D). E e F, immagini dell'asse corto in modalità B del ventricolo axolotl criolesionato (2 giorni dopo l'infortunio) in diastole (E) e sistole (F). G, Pulse wave Doppler ha acquisito integrali di velocità e tempo del cuore pre (in alto) e del cuore post infarto di 2 giorni (in basso). H, Modellazione del cuore pre infartuale e post infartuato di 2 giorni dall'acquisizione ecografica tridimensionale. I, sezioni istologie trasversali rappresentative attraverso il ventricolo axolotl 4 giorni dopo lo sham (in alto) e 7 giorni dopo l'infarto (in basso) colorate con Tricromo di Masson. L'ingrandimento a destra mostra la griglia di punti per la misurazione stereologica della frazione di infarto. I punti contrassegnati da cerchi blu e rossi rappresentano l'intersezione con tessuti sani (cerchi blu) e infarti (cerchi rossi). Il cranio è verso destra in A-D e la destra degli animali è verso sinistra in E-F, che rappresenta la visualizzazione convenzionale delle immagini ecocardiografiche. Clicca qui per visualizzare una versione più grande di questa figura.
Materiale supplementare 1: Asse lungo, ventricolo sano pre-infarto, modalità B (vedi Figura 2A-B). Clicca qui per scaricare questo video.
Materiale supplementare 2: Asse lungo, ventricolo infartuato (2 giorni dopo l'infarto), modalità B (vedi Figura 2C-D). Clicca qui per scaricare questo video.
Materiale supplementare 3: Asse corto, ventricolo infartuato (2 giorni dopo l'infarto), modalità B (vedi Figura 2E-F). Clicca qui per scaricare questo video.
Materiale supplementare 4: Modelli interattivi tridimensionali dello stesso cuore come si vede nella Figura 2A-H e nel materiale supplementare 1-3 prima e dopo l'infarto. Avvia il file PDF interattivo in Adobe Acrobat Reader 9 o versioni successive. Fare clic sul modello per attivare la funzione 3D. Ruotare, ingrandire e spostare il modello utilizzando il cursore. Nell'albero del modello sul lato sinistro dello schermo, tutti i segmenti possono essere attivati/disattivati o resi trasparenti. L'albero del modello è costruito come una gerarchia che contiene diversi sottolivelli che possono essere aperti (selezionando +). Clicca qui per scaricare questo file.
Discussione
Per ridurre al minimo la variazione sperimentale, la procedura chirurgica della criolesione dovrebbe seguire procedure sterili e la formazione chirurgica dovrebbe essere condotta su un certo numero di animali prima di tentare di utilizzare gli animali per specifici esperimenti rigenerativi. Con l'allenamento, la procedura di criolesione può essere condotta su un'ampia gamma di dimensioni ed età dell'axolotl, dai giovani (5 g, 7 cm) ai grandi adulti (100 g, 25 cm). È fondamentale che la criosonda abbia dimensioni sufficienti e sia raffreddata adeguatamente per fornire una criolesione robusta e ripetibile al ventricolo axolotl. Per animali molto piccoli (5-8 g, 7-9 cm), la criosonda può essere costruita con un diametro inferiore. Sebbene sia imperativo che il protocollo di criolesione sia condotto utilizzando un anestetico con proprietà analgesiche come la benzocaina e l'MS-222 (o con l'applicazione aggiuntiva di un agente analgesico secondario), l'ecocardiografia di follow-up può essere condotta con altri anestetici con proprietà analgesiche solo limitate, come il propofol, che è stato descritto per influenzare la funzione cardiaca meno della benzocaina e l'MS-222 nell'axolotl22.
La procedura di criolesione è limitata nel senso che non produce un infarto miocardico indotto da ischemia mediante occlusione dell'arteria coronarica allo stesso modo delle procedure di legatura dell'arteria coronarica che assomigliano più da vicino ai casi clinici di infarto del miocardio nell'uomo. Tuttavia, il metodo basato sulla legatura non è applicabile nel cuore di anfibio trabecolato con pochissima vascolarizzazione coronarica e un apporto di ossigeno prevalentemente luminale. Inoltre, è stato descritto che l'infarto del miocardio indotto da criolesione ricapitola la maggior parte delle conseguenze patologiche degli infarti miocardici indotti da ischemia14,16. La zona di lesione generata dalla criolesione è altamente localizzata nel tessuto in prossimità della criosonda e, sebbene ciò non assomigli a un infarto complesso e ramificato derivante da un blocco coronarico, è vantaggioso in un contesto sperimentale in quanto la zona di confine tra tessuto sano e infartuato può essere facilmente riconosciuta e la progressione dei cardiomiociti di nuova formazione può essere studiata.
L'axolotl è un animale considerevolmente più grande del pesce zebra con un sistema cardiovascolare più complicato, che include un cuore che consiste di tre camere (due atri, un ventricolo) e una separazione funzionale, anche se non anatomica, del flusso sanguigno nelle correnti ossigenate e deossigenate23 rispetto al cuore a due camere e al sistema di flusso seriale che si trova nei teleostei. La procedura di criolesione precedentemente descritta nel pesce zebra non comporta la sutura post-operatoria della superficie ventrale incisa16,17. Questo è necessario nell'axolotl per evitare l'esposizione non necessaria del cuore all'ambiente acquatico non sterile nell'habitat di laboratorio dell'animale.
L'istologia quantitativa basata sulla stereologia imparziale è attualmente sottostimata nel campo rigenerativo, in cui la maggior parte delle misurazioni quantitative della frazione di infarto si basa sull'area che disegna la sezione istologica nella zona di infarto medio e in alcuni casi in due sezioni adiacenti24. Poiché il concetto di stereologia può essere applicato negli esami istologici in qualsiasi specie modello per fornire misurazioni più robuste e imparziali, proponiamo che questo metodo liberamente disponibile dovrebbe essere incorporato nelle valutazioni quantitative della rigenerazione cardiaca non solo nell'axolotl, ma in tutte le specie rigenerative.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Desideriamo ringraziare Casper Bindzus Foldager, Asger Andersen e Michael Pedersen (tutti presso il Dipartimento di Medicina Clinica dell'Università di Aarhus) e David Gardiner (Dipartimento di Biologia Cellulare e dello Sviluppo dell'Università della California, Irvine) per l'aiuto nello sviluppo iniziale del modello di criolesione axolotl e dell'esame ecografico.
Materiali
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
Riferimenti
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503(2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666(2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089(2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548(2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon