Method Article
从冷冻嵌合肝组织中提取染色质,用于染色质免疫沉淀分析
摘要
该协议侧重于从快速冷冻组织中制备染色质,适用于交联染色质免疫沉淀(X-ChIP),然后进行定量PCR分析(X-ChIP-qPCR)或下一代测序方法(X-ChIP-seq)。
摘要
交联染色质免疫沉淀 (X-ChIP) 是一种广泛使用的技术,用于评估组蛋白标记水平和宿主和/或病原体染色质上转录因子的占用率。从组织中制备染色质带来了额外的挑战,需要克服这些挑战才能获得与细胞培养方案相当的可重复且可靠的方案。组织破碎和固定是实现染色质有效剪切的关键步骤。不同细胞类型和簇的共存也可能需要不同的剪切时间才能达到最佳片段大小并阻碍剪切重现性。该方法的目的是从适用于 ChIP-qPCR 和下一代测序 (NGS) 应用的冷冻组织(肝脏)中获得可靠且可重现的宿主染色质制备。我们观察到,与仅匀浆相比,液氮组织粉碎和均质化的组合导致可提高重现性,因为它提供了主要由可以有效剪切的解离单细胞组成的悬浮液。此外,固定步骤应在温和旋转下进行,以提供均匀的交联。然后,固定材料适用于基于缓冲液的细胞核分离,以减少细胞质蛋白和病原体DNA和RNA(如果适用)的污染,避免耗时的离心梯度。随后的超声处理将完成核溶解并剪切染色质,根据所选的剪切条件产生特定的尺寸范围。对于 NGS 应用,尺寸范围应在 100 到 300 nt 之间,而对于 ChIP-qPCR 分析,尺寸范围可能更高 (300-700 nt)。这种方案调整可以极大地改善冷冻组织标本的染色质分析。
引言
自发现以来,哺乳动物细胞中的表观遗传调控已获得越来越多的认可1,考虑到对这些机制的理解不仅将在细胞生物学中提供关键见解,而且将在疾病和肿瘤生物学中提供关键见解。此外,感染因子也可能引起宿主表观遗传变化2 ,而宿主细胞机制也可能影响病原体的染色质,例如持续存在的DNA病毒3,4。这种宿主-病原体相互作用似乎在感染持续性中发挥作用。阿拉伯数字
通过与DNA的可逆结合,组蛋白形成一种称为核小体的复合物。核小体依次达到称为染色质的更高层次的组织。众所周知,染色质重塑会严格调节基因表达,授予或拒绝获取转录因子(TF)5。这些因素可以触发或阻止RNA聚合酶II(PolII)募集到基因启动子上,从而影响DNA模板的mRNA合成6。组蛋白含有尾巴7,位于组蛋白折叠的两端,可以受到翻译后修饰(PTM),允许通过结构染色质变化严格调节基因转录。大多数组蛋白PTM位于尾部N末端,乙酰化和甲基化是研究得最好的PTM,尽管磷酸化8,泛素化9 和核糖基化10 也有报道。因此,表征和研究这些蛋白质对于深入了解基因调控至关重要。
目前,有一些成熟的方法和工具可用于研究直接的DNA-蛋白质相互作用:电泳迁移率转移测定(EMSA),酵母单杂交测定(Y1H)和DNA足迹11。然而,这些方法 本身 侧重于单个DNA-蛋白质相互作用,不适用于全基因组研究。这些技术的另一个局限性是缺乏组蛋白与所研究的DNA片段的关联。因此,这些方法并不意味着反映 体内 转录机制的复杂性,并且它们没有考虑可能影响(促进或抑制)蛋白质与DNA结合的重要结构变化12 或其他必需的酶/辅因子13 。
用甲醛(FA)等试剂固定细胞可以提供蛋白质-DNA相互作用的 体内 快照的想法,为染色质免疫沉淀测定(ChIP)的发展奠定了基础14。这一点,再加上定量 PCR (qPCR) 技术和高度特异性抗体的可用性,使 ChIP-qPCR 检测得以开发。随后,成本越来越实惠的下一代测序技术 (NGS) 的出现,将 ChIP 实验与 NGS 方法 (ChIP-seq) 相结合,从而为研究人员提供了新的强大工具,能够研究染色质调控。在这些测定中,用戊二酸二琥珀酰亚胺酯(DSG)和/或FA固定分离或培养的细胞,分离细胞核,然后染色质被目标抗体片段化和沉淀。此后,通过PCR或NGS方法纯化和分析DNA。与 EMSA、Y1H 和 DNA 足迹相比,ChIP 检测能够提供细胞内蛋白质-DNA 相互作用的全局快照。这提供了灵活性,并允许分析同一样品中的多个位点。然而,由于测定的性质,当对直接蛋白质-DNA 相互作用感兴趣时,ChIP 最终不仅可以检测直接相互作用,还可以检测间接相互作用,无法提供上述方法的精度。
来自细胞培养材料的染色质制备方案是成熟的15并且高度可重复,允许用户在1-2个工作日内获得适用于qPCR和NGS方法的染色质。然而,从整个组织获得高质量的染色质仍然是一个挑战,因为需要在实现染色质的最佳固定和剪切的同时解离组织内的细胞。此外,不同类型组织的组成和形态各不相同,因此需要调整现有的方案16,17。与新鲜样品相比,使用冷冻保存的组织带来了额外的挑战。这是由于难以在不造成大量材料损失的情况下获得单细胞悬液。这会导致剪切不当,阻碍下游应用。尽管如此,使用冷冻组织标本而不是新鲜标本不仅增加了工作灵活性,而且还可能是研究人员使用来自纵向或比较研究的标本的唯一选择。已经发表了一些用于冷冻组织的染色质制备方案。这些主要基于样品解冻,然后切碎,手动/机器解离或液氮粉碎步骤18,19,20。
在这里,我们描述了一种用于冷冻未固定肝脏标本的优化染色质制备方法15 ,该方法将液氮中的组织粉碎与杵均质化相结合,以实现适用于X-ChIP方法的可重复染色质剪切,旨在分析病毒和宿主基因组。
研究方案
根据欧盟指令86/609 / EEC进行人肝嵌合小鼠21 的组织取样,并由汉堡市和州伦理委员会根据赫尔辛基宣言的原则批准。
1. 试剂制备
- 在去离子水中制备1.25M甘氨酸溶液。无菌过滤器,带0.22μm孔径过滤器。储存在4°C。
- 准备5 M氯化钠(NaCl)溶液。在室温下储存。
- 制备CaCl2 溶液:在去离子水中制备300 mM CaCl2 和10 mM Tris-HCl pH 8。无菌过滤器,带0.22μm孔径过滤器并储存在室温下。
- 在去离子水中制备10%的Triton X-100稀释液。存放在RT。
- 制备Tris-EDTA缓冲液:1 mM EDTA和10 mM Tris pH 8在去离子水中。储存在4°C。
- 根据所需量准备以下缓冲液:
- 在去离子水中制备缓冲液A:50 mM Hepes-KOH pH 7.5,140 mM NaCl,1 mM乙二胺四乙酸(EDTA),10%甘油,0.5%NP-40和0.25%Triton X-100。无菌过滤器,带0.22μm孔径过滤器。储存在4°C。
- 制备缓冲液B:10 mM Tris-HCl pH 8,200 mM NaCl,1mM EDTA,0.5 mM乙二氮酸(EGTA)。无菌过滤器,带0.22μm孔径过滤器。储存在4°C。
- 在去离子水中制备缓冲液C:1%SDS,10 mM EDTA和50 mM Tris-HCl pH 8。无菌过滤器,带0.22μm孔径过滤器。存放在RT。
- 制备染色质稀释缓冲液:0.01%SDS,1.1%Triton X-100,1.2 mM EDTA,16.6 mM Tris-HCl pH 8和166 mM NaCl在去离子水中。无菌过滤器,带0.22μm孔径过滤器。储存在4°C。
2. 材料准备
- 收集干冰、冰和液氮。
注意:处理干冰和液氮时要小心,以避免烫伤。 - 将离心机预冷至4°C。
注意:此步骤对于避免洗涤步骤中的蛋白质降解和去交联很重要,因为这会降低染色质的质量。 - 将无菌板放在干冰上,让它冷却。
注意: 确保板足够大以方便切割过程。建议使用 100 mm 培养皿/细胞培养皿。 - 取出甘氨酸1.25 M的必要等分试样,使其达到RT。
- 取出缓冲液 A、B 和 PBS 的必要等分试样。加入蛋白酶和/或脱乙酰酶和磷酸酶抑制剂以达到 1 倍浓度并将它们放在冰上。
- 取出缓冲液C的必要等分试样,将其留在室温下。除非指定,否则不要添加蛋白酶和/或脱乙酰酶和磷酸酶抑制剂。
- 取出必要的RT PBS等分试样。
注意:缓冲液C含有十二烷基硫酸钠(SDS)。制备缓冲液时采取适当的安全措施。
注意:SDS在冰上沉淀,蛋白酶和脱乙酰酶抑制剂在室温下不稳定。 - 严格按照供应商的说明,在其腔室中预冷倒液氮的砂浆。将金属杵在干冰中冷却至少5分钟。
注意:可以使用建议的砂浆的替代迫击炮。然而,该协议中使用的设备由于其特殊的结构,允许在粉碎过程中处理少量组织而不会造成实质性损失。 - 将Dounce均质机与相关的研杵A在冰上预冷。
注意:杵A与均质机配合松散。这允许在没有显着细胞裂解的情况下获得单细胞悬液。
3. 组织交联
- 在手术刀和镊子的帮助下,在干冰上直接在培养皿上切下约50毫克的冷冻组织。
注意:建议将手术刀保持在室温处,因为这将简化切割过程。避免在手术刀上施加太大的压力,因为这会增加将组织碎片散落在切割区域之外的风险。需要注意的是,50毫克的组织(在这种情况下是肝脏)应该产生大约500万个细胞。请注意,温暖的刀片会解冻切削刃。然而,考虑到组织片的尺寸相对较大,这应该效果有限。当切割较小的碎片时,使用冷手术刀注意避免组织散落可能是有益的。 - 将切割的组织放入已经在干冰上冷却的 1.5 mL 管中。避免组织解冻。
- 将装有组织的管子移动到研钵上,让它在那里静置5分钟。
注意:让样品静置在研钵中会降低其温度(从-80°C到-196°C)。这增加了其韧性,并使粉碎步骤更容易。 - 在预冷的杵的帮助下对样品施加压力,直到看不到更多的固体碎屑。
注意:避免通过过大的旋转力加热杵很重要,因为这会解冻样品。每次样品粉碎后,用70%乙醇(EtOH)清洁杵,使其在干冰上再次冷却。 - 从研钵中取出装有样品的试管,加入 950 μL 冰冷的 PBS 和所需的抑制剂。轻轻上下移液,直到样品完全重新悬浮。立即继续执行步骤 3.6。
- 将组织悬浮液转移到均质器中,并用研杵A施加20-30次冲程以获得更精细的悬浮液。避免起泡。
注意:行程量应根据组织稠度进行优化。该步骤进一步解离粉碎后获得的小细胞簇。不适当的均质化会影响剪切效率。 - 将匀浆转移到已在冰上预冷的新 1.5 mL 管中。
- 在4°C下以1,300× g 离心5分钟,并小心地除去上清液。
- 通过轻柔移液将沉淀完全重悬于 950 μL RT PBS 中,并加入 63.6 μL 16% 无 MeOH FA,以获得 1% 的终浓度。立即继续执行步骤 3.10。
注意:FA是一种有毒化学物质。在通风橱下处理它,并采取适当的安全措施。
注意:在固定步骤中,不完全重悬会引起细胞聚集。这阻碍了裂解和剪切过程。 - 在室温下旋转 10 分钟,然后立即执行步骤 3.11
注意:必须旋转以避免聚合。应根据感兴趣的靶标和样品类型优化固定所需的时间。重要的是要注意,过多的固定时间可能会妨碍适当的剪切。 - 在室温下加入 113 μL 1.25 M 甘氨酸以获得 125 mM 终浓度并旋转 5 分钟。
注意:甘氨酸淬灭固定反应,避免过度交联。 - 在4°C下以1,300× g 离心3分钟。
- 弃去上清液,并通过移液到含有所需抑制剂的 950 μL 冰冷 PBS 中小心重悬沉淀。
- 在4°C下以1,300× g 离心3分钟。
- 重复步骤3.13-3.14,并立即进行染色质分离步骤。
4. 染色质分离
- 向沉淀中加入 950 μL 缓冲液 A 和所需的抑制剂。通过移液轻轻混合,直到沉淀完全重悬并在4°C下旋转10分钟。
注意:此步骤裂解固定的单细胞悬液,无需细胞核裂解。这允许去除细胞溶质蛋白和RNA的样品。延长裂解时间可能对难以裂解的细胞有益,但会增加组织的处理时间。此时,可以在台盼蓝/ DAPI染色后在显微镜下检查制剂,以检查簇的大小和单细胞的存在。然而,由于固定的组织材料,单个细胞核可能不容易欣赏。 - 在4°C下以2,000× g 离心5分钟,并小心地除去上清液。
- 向沉淀中加入 950 μL 缓冲液 B 和所需的抑制剂。通过移液轻轻混合,直到沉淀完全重悬并在4°C下旋转10分钟。
注意:此步骤从细胞核制备中洗去裂解缓冲液,以避免进一步不需要的裂解。 - 在4°C下以2000× g 离心5分钟。 同时,将所需的抑制剂(与步骤2.5相同)添加到缓冲液C中。
- 小心地除去上清液。
- 将 300 μL RT 缓冲液 C 加入沉淀中并大力移液。
- 涡旋样品15-30秒,并短暂旋转管以收集盖子上的液滴。
注意:此步骤对于释放和裂解固定细胞核很重要。为了保持样品的完整性,同时避免SDS沉淀,在超声处理之前将样品保存在冰上的塑料架中,以保持9-11°C的温度。
5. 染色质碎裂
- 将样品转移到三个干净的 0.65 mL 超声认证管中,确保每管具有 100 μL 裂解的细胞核悬浮液。
注意:可以使用最大体积为 300 μL 的 1.5 mL 超声认证管。需要为这些管子安装一个特定的支架。由于每管样品体积较小,因此 0.65 mL 应提供更均匀的剪切。 - 在 30 秒 ON 和 30 s OFF 设置下以高强度超声处理染色质 28 个周期。确保超声仪浴液已正确冷却(冰或冷却装置)。
注意:此步骤几乎在每种情况下都需要优化。用户应记住,增加剪切时间将提供更小、更均匀的碎片;然而,这可能会增加降低染色质质量的机会。选择提供所需片段大小的最小周期数。在此步骤的优化过程中,进行核染色以检查循环次数是否足以裂解大部分细胞核是有用的。 - 将超声染色质转移到先前在冰上冷却的新 1.5 mL 管中。
- 加入 30 μL Triton X-100 10% 溶液并涡旋 5-10 秒。
注意:Triton X-100结合SDS,防止在4°C下进一步沉淀。 Triton X-100 的最终数量应始终为 1%。 - 在4°C下以16,000× g 离心15分钟。
- 将上清液转移到在冰上预冷的干净 1.5 mL 管中。
- 注意:上清液含有剪切染色质,应呈透明状态。颗粒包含"不可剪切"的休息物,它应该保持相当小(如果是肝组织,主要是棕色的)。寻找剪切不成功的迹象:染色质溶液没有变得更清晰,并且颗粒尺寸与步骤4.5中的颗粒尺寸相似。
6. 脱氧核糖核酸纯化
- 将 10-25 μL 剪切染色质转移到新管中,并加入缓冲液 C 以达到 200 μL 的最终体积。 将其余染色质储存在-80°C直至进一步使用。如果需要,可以在此步骤中断该过程并将样品储存在-20°C。
- 加入 8 μL 的 5 M NaCl,并在 65 °C 下在加热块中以 1000 rpm 振荡孵育至少 6 小时。
注意:此步骤使染色质去交联。如果可能的话,将去交联延长过夜会更安全。NaCl的存在使该过程更加高效。 - 让样品在室温下冷却 5 分钟,然后加入 2 μL RNase A。
- 在37°C下以1000rpm振荡孵育1小时。
- 从加热块中取出样品,加入 7 μL 300 mM CaCl 2 和2 μL 蛋白酶 K。
- 将加热块置于56°C,并在1000rpm振荡下孵育30分钟。同时,通过在4°C下以16,000× g 离心1分钟,为每个样品准备一个相分离管。
注意:这些特殊管使核酸苯酚-氯仿提取过程中的相分离更容易。 - 从加热块中取出管子,让它们在室温下平衡3分钟。
- 将 400 μL 样品转移到先前离心的相分离管中。
- 加入 400 μL 苯酚-氯仿-异戊醇溶液 (PCI) 并涡旋 5 秒。
注意:PCI是一种高度挥发性和毒性的化合物。请在通风橱下采取必要的安全措施进行处理。 - 在4°C下以16,000× g 离心5分钟。
- 加入 400 μL 氯仿并涡旋 5 秒。
注意:氯仿是一种高度挥发性和毒性的化合物。请在通风橱下采取必要的安全措施进行处理。
注意:此步骤会洗掉可能干扰下游PCR应用的苯酚残留物。 - 在4°C下以16,000× g 离心5分钟。
- 将 400 μL 上相转移到新的 1.5 mL 试管中,其中加入 24 μL 5 M NaCl 和 0.75 μL 糖原。短暂涡旋。
- 加入 1,055 μL 100% EtOH 并彻底涡旋。确保正确混合。
- 在-80°C孵育1小时或在-20°C下孵育过夜(ON)。
注意:此步骤沉淀剪切的DNA;为了最大限度地提高产量,建议选择ON孵育。 - 在4°C下以16,000× g 离心30分钟。
- 小心地除去上清液,注意不要使沉淀脱臼。
- 加入 500 μL 冷的 70% 乙醇。轻轻倾斜管子以确保颗粒被清洗。
注意:此步骤对于去除可能与核酸共沉淀的盐残留物至关重要。盐会干扰其他下游应用。 - 在4°C下以16,000× g 离心15分钟。
- 小心地除去整个上清液,让沉淀在室温下干燥。
注意:在37°C的加热块上孵育管将减少干燥所需的时间。 - 加入50μLTris-EDTA溶液(TE-缓冲液),并将管放在37°C的加热块上,以300rpm振荡5-10分钟。
注意:此步骤可确保颗粒溶解。该方案可以在此处暂停,样品可以在4°C下储存长达1周,或在-20°C下储存更长时间。 - 对1%琼脂糖凝胶进行DNA分析。
7. DNA大小分析
- 通过每 100 mL 电泳缓冲液(即乙酸三酯-EDTA (TAE) 或三硼酸盐-EDTA (TBE))混合 1 g 琼脂糖来制备 1% 琼脂糖凝胶。加热悬浮液直到琼脂糖完全溶解。在倒入凝胶溶液之前,每 100 mL 琼脂糖溶液加入 10 μL EtBr。
注意:EtBr是一种已知具有致癌性的DNA插层剂。请在通风橱下采取必要的安全措施进行处理。
注意:强烈建议进行EtBr染色(直接在凝胶中或在电泳后)。其他DNA插层染料在处理DNA涂片时在我们的手中表现不佳。与较宽的装载井相比,窄装载井提供更好的分辨率。 - 将 10 μL 样品与 2 μL 6x 上样染料混合。接下来,在凝胶中上样 10 μL 样品并运行,直到上样染料的最后一条带运行凝胶的 2/3。确保添加DNA分子量标准。
- 对凝胶进行成像并验证涂片尺寸是否在所需应用的范围内。
如果染色质通过质量控制,则可以用于下游应用。
结果
制备染色质是成功实现 ChIP 的关键步骤。为了从冷冻标本中制备出高质量的染色质,我们应该确保在固定前有效地破坏组织,以避免存在可能阻碍有效剪切的组织团块。图 1 显示了该协议的汇总管道。仅粉碎不足以完全解离组织,因为它会产生大小可变且单个细胞很少的细胞簇(图1a)。将第一个粉碎步骤与Dounce均质化相关联,组织团块的数量大大减少,其余组织团块的量更小(图1b)。在固定和裂解步骤之后,可见单核的数量(图1c)增加,而典型的球形外观丢失。超声处理28个周期后,核染色(Hoechst 33258 / DAPI)几乎不再可见。这确实是成功剪切的标志(图1d)。在染色质等分试样的去交联和琼脂糖凝胶上DNA的可视化之后,可以通过存在100-300 bp范围内的片段来识别成功的剪切(图2a)DNA的量可以根据制备的组织片的组成而变化。这种染色质可以成功地用于ChIP-qPCR。如图2b所示,染色质可以成功地用H3K4me3、H3K27ac(活性基因相关修饰)和H3K27me3(沉默基因相关修饰)抗体沉淀。与同源盒C13(HOXC13)、同源盒C12(HOXC12)和小鼠髓鞘转录因子1(mMyt1)启动子区域相比,1号染色体开放阅读框43(C1orf43),蛋白酶体20S亚基β2(PSMB2)和甘油醛3-磷酸脱氢酶(mGapdh)启动子区域在H3K4me3和H3K27ac中富集(表1)。这是因为C1orf43,PSMB2和mGapdh在肝脏中被组成性转录,而HOXC13,HOXC12和mMyt1被沉默。H3K27me3 显示出相反的行为,证实了 ChIP 测定的成功。这些小鼠的肝脏是一种嵌合体,这一事实使我们能够分析小鼠和人类染色质。此外,相同的染色质可以成功地用于ChIP-seq实验。在测序步骤之后,将读数与由小鼠和人类基因组组成的索引对齐,以减少未对齐片段的数量。随后,根据物种分离读数并用EaSeq 22进一步分析。然后在每个基因的转录起始位点(TSS)测量信号强度,并将结果分类为H3K4me3信号强度。图3a和图3c显示了小鼠和人类染色质中相当一部分基因的TSS中H3K4me3和H3K27ac的显着存在。除此之外,H3K27me3与H3K4me3 / H3K27ac有反相关。H3K27me3存在于基因的整个长度上,而不仅仅是TSS,正如该PTM所预期的那样。图3b和图3d显示了已知富含H3K27me3并且在小鼠和人类肝脏中转录无活性的HOXC / HoxC簇。H3K4me3和H3K27ac的剖析显示了这两个PTM的峰值,而H3K27me3的信号强度往往更低且分布更广。
由于染色质制备的复杂性,可能会发生过度固定,裂解或超声时间可能欠佳,大细胞团块可能持续存在,或者样品处理不当可能不充分。这些都是影响准备质量的事件。在某些情况下,正确大小的染色质片段的富集仍然存在或将转移到更高的大小。在其他情况下,由于过早裂解或剪切不成功,可能会出现材料损失。 图 4 显示了此类负结果和次优结果的一些示例。泳道 3 和 4 显示片段大小在 200 bp 和 800 bp 之间富集。然而,很明显,片段大小从100 bp到>10,000 bp不等。在泳道5和6中,存在100-250 bp范围内的富集,在制备过程中存在明显的材料损失。这可以解释为什么超声处理会产生较小的碎片。泳道 7 显示略微次优的制备,碎片范围增加,而泳道 8 显示几乎完全的材料损失。这可能是由过早的核溶解或组织解离不足引起的,从而导致步骤5.5之后的损失。
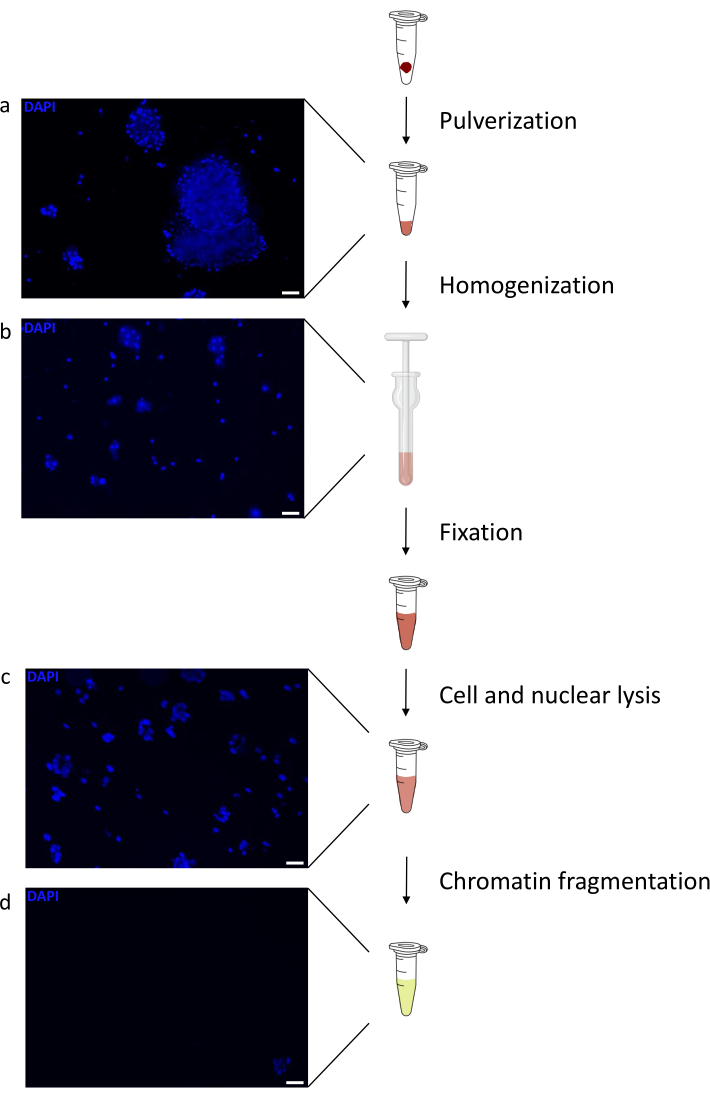
图 1:染色质制备方案概述。 在组织粉碎(a),额外的手动匀浆(b),核裂解后(c)和超声处理后(离心前)(d)拍摄照片。用Hoechst 33258 / DAPI进行核染色。比例尺 = 200 μm。 请点击此处查看此图的大图。
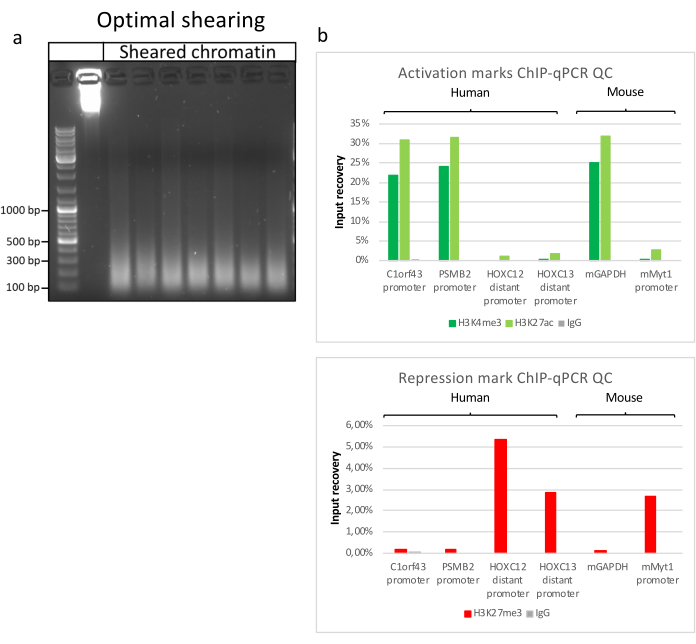
图 2:代表性染色质剪切及其质量通过 ChIP-qPCR 评估 。 1%琼脂糖凝胶,根据不同染色质制剂的方案,与碎片化的染色质样品。添加未剪切染色质的对照以确保事先没有染色质/ DNA降解 (a)。剪切染色质已经过质量测试,可进行 ChIP-qPCR 测定。采用H3K4me3、H3K27ac和H3K27me3抗体沉淀新鲜制备的染色质。( b) 对人(C1orf43和PSMB2),小鼠(Gapdh)活性启动子和人(HOXC13,HOXC12),小鼠(Myt1)非活性启动子进行qPCR分析。 请点击此处查看此图的大图。
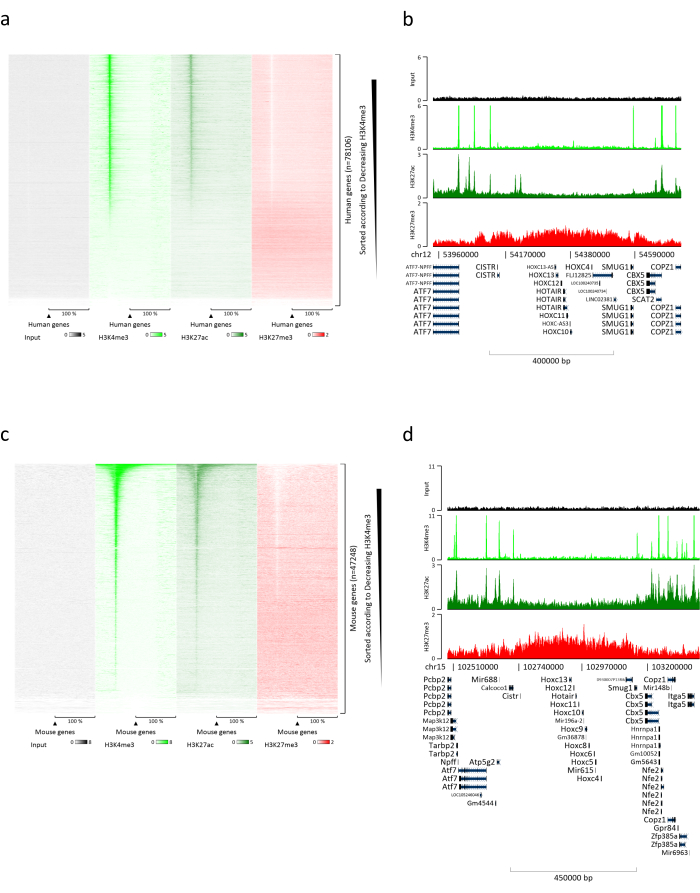
图 3:代表性的 ChIP-seq 分析。 读数已与使用人类和小鼠基因组(hg19和mm10)创建的索引对齐。对齐后,将人类和小鼠的读数分开并进一步分析。人类基因的热图,其中信号在TSS上量化,并按H3K4me3强度(a)的降序显示。被活性基因(b)包围的被抑制基因(HOX簇)的人类基因簇示例。鼠基因的热图,其中信号在TSS上定量,并按H3K4me3强度(c)的降序显示。被活性基因(d)包围的被抑制基因(Hox簇)包围的小鼠基因簇的示例。显示的所有数据均已按每百万次读取 的 EaSeq 进行归一化。 请点击此处查看此图的大图。

图 4:染色质制备欠佳和失败。 1%琼脂糖凝胶,根据方案与碎片染色质样品。该图包含用作对照(泳道 2)、非最佳剪切(泳道 3-4)、具有明显材料损失的最佳剪切(泳道 5-6)、次优剪切(泳道 7)和大量材料损失(泳道 8)的未剪切染色质。请点击此处查看此图的大图。
| 引物名称 | 序列 | |
| C1orf43启动子 | 向前 | AGTGGGTGGAGAATGCAGAC |
| 反向 | GAGATTACCCCACCCCATTC | |
| PSMB2启动子 | 向前 | CTTATTCAACCCCCGACAAA |
| 反向 | GATGAAGGACGGTGAGAGGA | |
| HOXC13远端启动子 | 向前 | GAGCCCGAGATTCACTCAAC |
| 反向 | TTATGCCCAGTTTTTGGGGTA | |
| HOXC12远端启动子 | 向前 | AAAGCTTCCCACTGCAAAGA |
| 反向 | AAATCTGGGGGCGAACTACT | |
| mGAPDH启动子 | 向前 | GGTCCAAAGAGGGAGGAG |
| 反向 | GCCCTGCTTATCCAGTCCTA | |
| mMYT启动子 | 向前 | CAGCCCAATTCTAGCCACAT |
| 反向 | CCAAAGCAGGGGGGAGTAGGAG |
表 1:用于 ChIP-qPCR 测定的活性和非活性基因的 qPCR 引物列表。
讨论
从快速冷冻组织制备染色质仍然是一个挑战,因为需要优化许多步骤才能获得可重复和可靠的结果。大多数已经发表的方案16,23 要求在手动解离(扩增)之前切碎组织。我们尽量避免在固定样品之前可能引起蛋白质降解的步骤。粉碎步骤已经用于冷冻肝脏制剂24 ,并且使手动解离更容易且可重复(见 图2a)。通过使用专为 1.5 mL 管设计的研钵(参见协议),粉碎过程中的标本损失减少,允许处理少量组织,例如肝活检标本。原则上,可以使用直接组织均质化,而无需任何研磨步骤;然而,根据我们的经验,没有先前粉碎的组织均质化具有较差的重现性,并且下游应用出现问题的出现更高(数据未显示)。
从组织中制备染色质时遇到的大多数问题源于这些样品的性质以及无法正确检查细胞簇是否足够小以进行固定而不会降低质量。此外,在每个步骤中检查每个等分试样将非常耗时,从而增加蛋白质降解的机会。
固定(步骤3.9)是染色质制备的基本和关键部分。由于组织的性质,固定步骤被推迟到组织均质化。这种推迟的固定步骤的优点是产生更均匀的细胞悬液。但是,我们认识到,对于特别对操作敏感的目标,可能需要在步骤3.6之前执行固定。这将有助于保护极其敏感的蛋白质或PTM,尽管它可能会增加细胞簇的大小,但当固定时可能导致非均匀剪切。协议中使用的FA溶液的浓度是标准的,但是,可以对其进行修改以尝试改善整体固定。这里选择的注视时间也反映了现场常用的标准条件。在固定溶液浓度较高的情况下,固定时间可以减少,而在较低量的情况下,应增加固定时间。操作人员应考虑固定时间的改变可能导致样品过度固定或为蛋白质降解留出空间。如果旨在沉淀大复合物(或其的一部分)和TF,则使用DSG溶液进行双步固定,然后使用FA溶液进行双步固定25,26将是有利的。在这种情况下,DSG将稳定蛋白质 - 蛋白质相互作用,而甲醛主要作用于直接的DNA-蛋白质相互作用27。
操作人员应考虑从步骤6.7开始实施基于柱的DNA纯化试剂盒的可能性,该试剂盒速度更快且不使用有毒化合物。然而,总会有一定数量的未结合的DNA丢失。因此,我们建议使用经典的苯酚-氯仿萃取,然后使用EtOH沉淀。此外,在运行琼脂糖凝胶(步骤7.2)之前,测量DNA浓度并为每个孔加载相同的量以获得更清晰的图像可能是有益的。
该协议的局限性源于我们仅使用来自人肝嵌合小鼠的肝脏标本探索和利用该协议28。肝脏本身由上皮和结缔组织组成29.在疾病的情况下,可能存在纤维化组织和脂肪组织30,31 ,在组织破坏过程中产生额外的挑战。然而,我们认识到,如果不优化解离和超声处理步骤,我们的方案可能无法用于骨骼、肌肉和脂肪组织。需要注意的是,由于缺乏适合所有组织的方案,例如细胞培养样品15,因此每种组织都需要进行某种优化。然而,我们相信,通过很少或根本没有优化,该协议可以成功地应用于与肝脏成分相似的其他组织,如肺,肠,胃,胰腺或肾组织。
我们的协议也已成功用于分析HBV共价闭合DNA表观体(cccDNA)上的TF和组蛋白修饰32。这为将这种方法应用于影响肝脏的其他病毒基因组(如人类巨细胞病毒33(hCMV)和人类腺病毒34(HAdV))提供了机会。不排除有可能分析在其他组织中建立持续感染的其他 DNA 病毒,如卡波西肉瘤疱疹病毒35 (KHSV)、单纯疱疹病毒 36 (HSV1/2) 多瘤病毒、爱泼斯坦-巴尔病毒37 (EBV)。
披露声明
作者没有什么可透露的。
致谢
该研究得到了德国研究基金会(DFG)对Maura Dandri(SFB 841 A5)和汉堡州研究计划(LFF-FV44:EPILOG)的支持。
我们要感谢Tassilo Volz博士,Yvonne Ladiges和Annika Volmari的技术帮助和批判性地阅读手稿。Thomas Günther博士和Adam Grundhoff教授为ChIP-qPCR分析提供了非常有用的建议和引物集。
材料
| Name | Company | Catalog Number | Comments |
| 0.22µm sterile syringe filter | Labsolute | 7699822 | |
| 1.5 mL Safeseal tubes | Sarstedt | 7,27,06,400 | |
| 6x orange loading dye | Thermofisher | R0631 | |
| Benchtop refrigerated centrifuge | |||
| Bioruptor NGS | Diagenode | ||
| Blade or Scalpel | |||
| Calcium chloride dihydrate | Carl Roth | HN04 | |
| Chloroform | Sigma Aldrich (Merck) | C2432 | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | |
| Deacetylase Inhibitor | Active Motif | 37494 | |
| Dounce tissue grinder set | Sigma Aldrich (Merck) | DWK885300-0001-1EA | |
| EDTA 500 mM solution | PanReac AppliChem | A4892 | |
| EGTA | Sigma Aldrich (Merck) | E4378 | |
| EtBr | Carl Roth | 2218 | Concentration 10mg/mL |
| Ethanol absolute | CHEMSOLUTE | 2273 | |
| Glycerol | Sigma Aldrich (Merck) | G9012 | |
| Glycin | Carl Roth | 0079 | |
| Glycogen | Roche | 10901393001 | Concentration: 20mg/mL |
| Heating block | |||
| HEPES | Sigma Aldrich (Merck) | H4034 | |
| LE Agarose | Biozym | 840000 | |
| Liquid nitrogen cooled mini mortar | Bel-Art | H37260-0100 | |
| MeOH free Formaldehyde 16% | Thermofisher | 28908 | |
| NP-40 | Roche | 11332473001 | |
| PBS 1x | Thermofisher | 10010015 | |
| Pefabloc SC-Protease-Inhibitor | Sigma Aldrich (Merck) | 11429868001 | |
| Phase Lock Gel - Heavy | QuantaBio | 2302830 | |
| Phenol:Chloroform:Isoamyl alcohol 25:24:1 | Sigma Aldrich (Merck) | P3803 | |
| Potassium chloride | Carl Roth | 6781 | |
| Potassium hydroxyde | Merck | 105033 | |
| Proteinase K | Lucigen | MPRK092 | Concentration: 50 µg/µL |
| RNAse A | Lucigen | MRNA092 | Concentration: 5 mg/mL |
| SDS 10% solution | PanReac AppliChem | A3950 | |
| Sodium carbonate anhydrous | Carl Roth | A135 | |
| Sodium chloride | Sigma Aldrich (Merck) | S7653 | |
| Sterile Petri dishes | Sarstedt | 83,39,02,500 | |
| Tris-HCl solution | Sigma Aldrich (Merck) | T2694 | |
| Triton-X100 | Sigma Aldrich (Merck) | X100 |
参考文献
- Waddington, C. H., Pantelouris, E. M. Transplantation of nuclei in newt's eggs. Nature. 172 (4388), 1050-1051 (1953).
- Silmon de Monerri, N. C., Kim, K. Pathogens hijack the epigenome: A new twist on host-pathogen interactions. American Journal of Pathology. 184 (4), 897-911 (2014).
- Knipe, D. M., et al. Snapshots: chromatin control of viral infection. Virology. 435 (1), 141-156 (2013).
- Tropberger, P., et al. Mapping of histone modifications in episomal HBV cccDNA uncovers an unusual chromatin organization amenable to epigenetic manipulation. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 5715-5724 (2015).
- Sproul, D., Gilbert, N., Bickmore, W. A. The role of chromatin structure in regulating the expression of clustered genes. Nature Reviews Genetics. 6 (10), 775-781 (2005).
- Fischle, W., Wang, Y., Allis, C. D. Histone and chromatin cross-talk. Current Opinion in Cell Biology. 15 (2), 172-183 (2003).
- Ling, X., Harkness, T. A., Schultz, M. C., Fisher-Adams, G., Grunstein, M. Yeast histone H3 and H4 amino termini are important for nucleosome assembly in vivo and in vitro: redundant and position-independent functions in assembly but not in gene regulation. Genes & Development. 10 (6), 686-699 (1996).
- Zhang, L., Eugeni, E. E., Parthun, M. R., Freitas, M. A. Identification of novel histone post-translational modifications by peptide mass fingerprinting. Chromosoma. 112 (2), 77-86 (2003).
- Wang, H., et al. Role of histone H2A ubiquitination in Polycomb silencing. Nature. 431 (7010), 873-878 (2004).
- Hassa, P. O., Haenni, S. S., Elser, M., Hottiger, M. O. Nuclear ADP-ribosylation reactions in mammalian cells: where are we today and where are we going. Microbiology and Molecular Biology Reviews. 70 (3), 789-829 (2006).
- Dey, B., et al. DNA-protein interactions: methods for detection and analysis. Molecular and Cellular Biochemistry. 365 (1-2), 279-299 (2012).
- Hager, G. L., McNally, J. G., Misteli, T. Transcription dynamics. Molecular Cell. 35 (6), 741-753 (2009).
- Nagy, Z., Tora, L. Distinct GCN5/PCAF-containing complexes function as co-activators and are involved in transcription factor and global histone acetylation. Oncogene. 26 (37), 5341-5357 (2007).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping protein-DNA interactions in vivo with formaldehyde: evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Gunther, T., Theiss, J. M., Fischer, N., Grundhoff, A. Investigation of viral and host chromatin by ChIP-PCR or ChIP-Seq analysis. Current Protocols in Microbiology. 40, 11-21 (2016).
- Cotney, J. L., Noonan, J. P. Chromatin immunoprecipitation with fixed animal tissues and preparation for high-throughput sequencing. Cold Spring Harbor Protocols. 2015 (4), 419(2015).
- Haim, Y., Tarnovscki, T., Bashari, D., Rudich, A. A chromatin immunoprecipitation (ChIP) protocol for use in whole human adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 305 (9), 1172-1177 (2013).
- Castellano-Castillo, D., et al. Chromatin immunoprecipitation improvements for the processing of small frozen pieces of adipose tissue. PLoS One. 13 (2), 0192314(2018).
- Savic, D., Gertz, J., Jain, P., Cooper, G. M., Myers, R. M. Mapping genome-wide transcription factor binding sites in frozen tissues. Epigenetics Chromatin. 6 (1), 30(2013).
- Perna, A., Alberi, L. A. TF-ChIP method for tissue-specific gene targets. Frontiers Cell Neuroscience. 13, 95(2019).
- Allweiss, L., et al. Proliferation of primary human hepatocytes and prevention of hepatitis B virus reinfection efficiently deplete nuclear cccDNA in vivo. Gut. 67 (3), 542-552 (2018).
- Lerdrup, M., Johansen, J. V., Agrawal-Singh, S., Hansen, K. An interactive environment for agile analysis and visualization of ChIP-sequencing data. Nature Structural & Molecular Biology. 23 (4), 349-357 (2016).
- Perna, A., Alberi, L. A. TF-ChIP Method for Tissue-Specific Gene Targets. Frontiers in Cellular Neuroscience. 13, 95(2019).
- Liang, N., Fan, R., Goni, S., Treuter, E. Preparation of Frozen Liver Tissues for Integrated Omics Analysis. Methods in Molecular Biology. 1951, 167-178 (2019).
- Liu, Z., et al. Proteomic and network analysis of human serum albuminome by integrated use of quick crosslinking and two-step precipitation. Scientific Reports. 7 (1), 9856(2017).
- Singh, A. A., et al. Optimized ChIP-seq method facilitates transcription factor profiling in human tumors. Life Science Alliance. 2 (1), 201800115(2019).
- Aoki, T., et al. Bi-functional cross-linking reagents efficiently capture protein-DNA complexes in Drosophila embryos. Fly. 8 (1), 43-51 (2014).
- Allweiss, L., Dandri, M. Experimental in vitro and in vivo models for the study of human hepatitis B virus infection. Journal of Hepatology. 64, 1 Suppl 17-31 (2016).
- Krishna, M. Microscopic anatomy of the liver. Clinics in Liver Disease. 2, Suppl 1 4-7 (2013).
- Tannapfel, A., et al. Histopathological diagnosis of non-alcoholic and alcoholic fatty liver disease. Virchows Archiv. 458 (5), 511-523 (2011).
- Schuppan, D., Afdhal, N. H. Liver cirrhosis. Lancet. 371 (9615), 838-851 (2008).
- Allweiss, L., et al. Therapeutic shutdown of HBV transcripts promotes reappearance of the SMC5/6 complex and silencing of the viral genome in vivo. Gut. , 322571(2021).
- Gerna, G., Kabanova, A., Lilleri, D. Human cytomegalovirus cell tropism and host cell receptors. Vaccines. 7 (3), (2019).
- Echavarria, M. Adenoviruses in immunocompromised hosts. Clinical Microbiology Reviews. 21 (4), 704-715 (2008).
- Frohlich, J., Grundhoff, A. Epigenetic control in Kaposi sarcoma-associated herpesvirus infection and associated disease. Seminars in Immunopathology. 42 (2), 143-157 (2020).
- Nicoll, M. P., Proenca, J. T., Efstathiou, S. The molecular basis of herpes simplex virus latency. FEMS Microbiology Reviews. 36 (3), 684-705 (2012).
- Thorley-Lawson, D. A., Hawkins, J. B., Tracy, S. I., Shapiro, M. The pathogenesis of Epstein-Barr virus persistent infection. Current Opinion in Virology. 3 (3), 227-232 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。