Method Article
VMXm 光束线微晶样品制备管道
摘要
数据的信号与噪声比是执行微晶 X 射线衍射测量中最重要的考虑因素之一。VMXm 光束线为此类实验提供了低噪音环境和微束。在这里,我们描述了 VMXm 和其他微焦大分子晶体光束线的安装和冷却微晶体的样品制备方法。
摘要
单晶低温晶体学的微晶(<10 μm)的安装提出了一个非平凡的挑战。随着光束线光学、光束稳定性和变光束尺寸从亚微米到微米的聚焦,例如钻石光源1的 VMXm 光束线的发展,微晶数据质量得到了改善。通过改善样品环境和样品制备,将进一步改善数据质量。微晶本身产生较弱的衍射,因此改善信号到噪声是收集高质量 X 射线衍射数据的关键,主要来自背景噪声的降低。衍射实验中X射线背景噪声的主要来源来自它们与样品前后空气路径的相互作用、样品周围的过量结晶溶液、结晶冰的存在以及从任何其他光束线仪器或X射线窗口散射而来。VMXm 光束线包括仪器和样品制备协议,以减少所有这些噪音源。
首先,VMXm 的真空采样环境可消除 X 射线源和样品之间的空气路径。其次,VMXm 大分子晶体学的样品制备协议利用了许多从低温技术中改编的工艺和工具。其中包括铜网格与孔碳支持膜,自动印迹和暴跌冷却机器人利用液体乙烷。这些工具能够在单个低温TEM网格上制备数百个微晶,在低噪音支持下使用最少的周围液体。它们还最大限度地减少了晶体周围任何剩余液体的结晶冰的形成。
在将样品安装到 VMXm 光束线上进行 X 射线衍射实验之前,我们介绍了使用可见光和扫描电子显微镜制备和评估可溶性蛋白质微晶体质量的过程。我们还将提供高质量样品以及需要进一步优化和战略的样品示例。
引言
通过大分子晶体学(MX)确定生物分子高分辨率结构的主要障碍仍然是以适宜的尺寸生产衍射良好的晶体。实现这一目标的策略有很多,从重组蛋白基因结构设计到大型稀疏矩阵搜索化学鸡尾酒,可能会产生初始晶体2。对于后者,晶体学家往往需要优化任何初始命中,以获得具有足够衍射质量和大小的晶体,用于结构确定研究3。尽管有这些选择,一些目标分子可能永远不会产生大(>10 μm),很好地衍射晶体,因此晶体学家必须坚持他们的微晶和这些样品的挑战。这些措施包括适当安装和低温保护晶体,管理固有的较弱的衍射和提高辐射敏感性。微晶是由比较大的晶体更少的单位细胞和分子形成的,因此,衍射与较大的晶体相比不会放大到同样的程度,从而产生固有的较弱的衍射强度。重要的是,背景信号不能掩盖这些反射,特别是在更高的分辨率,弱反射强度可以失去4。此外,微晶对辐射损伤更敏感,尽管在液氮温度5时记录了衍射,但可能无法从单个晶体中收集完整数据,因此有必要从大量晶体中收集数据,以生成一个完整的数据集6。
X 射线自由电子激光器 (XFELs) 的日益普及以及串行晶体学方法 (SFX)7 的演变为从较小的微晶收集数据提供了途径。然而,这些都是定制的样品递送方法,这需要大量的硬件和软件专业知识,其中实验仅限于室温,通常样品消耗高(数百微升),仍然可能需要进一步优化8。因此,只能进行数量有限的微晶的项目不适合 SFX。
与此同时,同步加速器光束技术近几十年来已发展到生产更小,更稳定的光束9与辉煌,允许数据收集从越来越小的晶体10,11。微焦光束线,如NSLS-II的FMX和钻石光源的I24,已经能够从最大尺寸为+3 μm12的晶体中确定新的结构,并证明能够从更小的晶体中收集可用数据,尺寸为±1微米13。光束线必须精确配置,具有出色的高分辨率轴视光学元件、样品旋转的极小混淆球体以及与 X 射线束重合的精确对齐旋转轴。重要的是要密切匹配X射线束轮廓与晶体体积,并确保晶体精确对齐的X射线束 - 水晶的挑战<5 μm14。在光束线上满足这些实验条件对于记录微晶中质量最好的数据至关重要。
从微晶体收集数据的剩余和可能最重要的方面是晶体向X射线束的显示。微晶体通常安装在微米样品安装件上,由聚酰胺制成,聚酰胺是一种低X射线散射材料,光圈小至10微米15,16。聚酰胺网被安装在一个标准针,设置为磁性脊柱基座,使其与大多数MX光束线17兼容。网状坐骑通常采用与使用标准回路式安装安装 100 μm 晶体相同的程序,从结晶滴中捞取晶体。虽然晶体可能分布在网格上,但一个关键缺点是,在收获时,网状物和针脚可以携带相对大量的液体(图1C,D)。这种液体体积比晶体本身大很多倍,当用X射线照射时,会助致背景噪音。如果液体在闪光冷却过程中形成结晶冰,则此背景散射可能更强,从而降低冰衍分辨率内本已弱强度的信号与噪声比。因此,从样品中去除多余的液体是确保记录所有可能的信号的关键。在脂质立方相(LCP)内形成的膜蛋白晶体中,这一挑战更大,LCP产生强大的背景散射,也很难从晶体周围去除。
钻石光源的全新多功能大分子晶体学微焦 (VMXm) 光束线为从可能尺寸小于一微米的晶体收集数据提供了条件。光束线设计用于提供测量 0.3 μm x 0.5 μm (VxH)1的光束轮廓、一个混淆范围不超过 60 nm 的流光度计和一个 真空 样本环境。VMXm 端站的这些设计特点最大限度地减少了光束设备在数据收集过程中产生的背景 X 射线噪声,而样本14产生的背景来源最大。
专为 VMXm 光束线设计的特定示例制备方法提供了减少此背景并进一步改善衍射数据的信号到噪声的机会,最大限度地提高了可从测量< 10 μm 的微晶记录的数据的质量。这里概述的许多关于微晶低背景衍射的要求也常见于低温传输电子显微镜(低温)19和微晶电子衍射(微ED)20。因此,已经为低温TEM样品的制备开发的许多工具适合进行一些适应,用于微晶的制备。在为单粒子低温TEM准备样品时,所调查的粒子嵌入非常薄的层(通常 <为100纳米)的层中,使电子能够通过样品传输。薄均匀层通过清除多余的液体来实现,样品的光度通过快速冷却样品(+104 Ks-1)21通过跳入保存在+93 K22的液态乙烷中来实现。相比之下,液氮,通常用于MX样品制备,是一种效率低于乙烷的低温,在样品21中具有更大的晶体冰形成倾向。晶体冰的形成,可以降解衍射和产生背景噪音,通常通过使用低温保护化合物23缓解。低分子量聚合物,如聚乙烯乙二醇(PEG)400和甲基-2,4-五氯苯酚(MPD),糖,油或饱和盐可以添加到低浓度24结晶溶液的盐 - 没有"一刀切"的解决方案来选择最合适的低温保护剂,这通常需要优化25.晶体在采集和冷冻保护过程中也经过多次操作,可能导致晶体受损,利用液态乙烷的机会允许忽略这一步骤,并有助于保护晶体的完整性。
虽然液态乙烷是微晶(<10 μm)的有效低温源,但由于样品的稀薄,有防止晶体结冰的替代方法,特别是在较大的晶体中,包括使用严格控制的潮湿环境26降低晶体的含水量,或通过将多余的液体从晶体27的环和表面排出但是,这些再次需要对样品进行更大的操作。使用自动印迹和与液体乙烷的暴跌冷冻,如在低温TEM,一起删除多余的结晶解决方案,并提供一种手段,以控制的方式闪烁冷却微晶体,同时试图尽量减少操作。
在这里,我们提出了一个协议,不仅可以由VMXm光束线的用户和其他微焦光束线收集高信号到噪声衍射数据,但也可能有助于那些准备可溶性蛋白质晶体和洗涤剂为基础的膜蛋白晶体样品进行微ED实验。虽然 VMXm 提供所有准备和评估样品的设施,但许多结构生物学实验室越来越多地配备低温TEM 样品制备设备。因此,我们设想一些用户可能希望使用自己的设施,在 VMXm 上准备样品,以备不时之用。
研究方案
1. 设备设置
注:此处描述的方法使用单个印迹臂的暴跌冷冻仪器。有些仪器配有两个印迹臂,我们建议用户检查制造商调整仪器的说明,以便只使用一个印迹臂。
- 确保光显微镜位于俯冲冷冻仪器附近,最好使显微镜和俯冲冰柜都能够方便用户使用。
- 根据制造商的说明设置并冷却自动跳投冰柜。
注:样品室温度应设置为晶体生长的温度。不要在样品室中放置印迹纸。
警告:液态乙烷是一种高度易燃的炸药,只能用于远离潜在火花源的通风良好的区域。 - 适当标记网格盒,然后使用液氮在小德瓦尔中冷却。
- 小心地将网格、碳膜侧向上放置,放在适当的载体上进行发光放电(如用护栏膜包裹的玻璃显微镜滑梯)。
- 使用 15 mA 的电流,在 0.39 mBar 下为 25 s 发光放电低温电格。在网格使用之前发光放电。将发光放电的网格放在有盖的培养皿中,直到准备好;如果发光放电后 30 分钟失效,重复发光放电。
注:在准备跳水冰柜和电网时,注意力可以转向样品。
2. 确定初始印迹参数
- 将样品室的相对湿度设置为 90%,将印迹时间设置为 5 s,并确保在污迹完格后,将防爆冰柜自动将样品放入。
注:这些起始参数最适合 Leica GP 跳水冰柜,其他参数(如印迹力)可在 FEI Vitrobot 上找到。然而,根据我们的经验,使用单个印迹手臂更可能保持晶体完整性。 - 为了能够密封结晶托盘,一旦感兴趣的井打开,削减一小块胶带和折叠在一端,以创建一个选项卡,以方便打开密封和小心地放置在一边。
- 切开结晶井上的密封件,包括储层。快速工作,将 2-5 μL 的储液溶液应用于含滴晶体,以保持液量下降。
- 使用胶带标签再重新对油井进行重新保套,并确保结晶滴不会干涸。
- 暂时将胶带打开结晶井,将 10 μL 的储层溶液转移到 0.5 mL 管中,用于以后的步骤。
- 重新对油井进行采油。
- 将一张预切的印迹纸放在防爆仪器的印迹臂上。
- 将单个发光放电网格置于跳动冻结钳中,并加载到仪器中,使碳侧朝远离印迹臂。
- 确保印迹室内的相对湿度为 90%。
- 旋转钳子,使碳膜侧面朝印臂。
- 使用 2.5 μL 移液器,将 0.5 mL 管中的 2 μL 储层溶液应用到低温电格格的非支撑(闪亮铜)侧。
- 旋转网格,使碳支持侧面向远离印迹臂并重复该过程,小心地将液体涂抹到网格的碳膜支持侧。避免用移液器尖端接触碳膜,以免损坏碳膜。液体应分散在电网中,因为发光放电过程中沉积的电荷。
- 在观察网格的同时启动印迹过程。为此目的,Leica GP2 上提供了查看范围。
- 在此期间观察液体是否来自网格的碳表面,这从网格上的大部分液体在液体通过网格时被压扁开始。随着每个网格方块中的液体进一步减少,可以观察到网格表面的"爆裂"波。如果观察到此效果,则可以在弹出效果结束后 2-3 s 内停止印迹。没有必要将可以丢弃的测试网格跳入。
- 如果不观察到所谓的"爆裂"效果,重复步骤 2.11-2.14,每次将印迹时间延长 1-2 s,直到在印迹臂从网格中收回之前观察到弹出效果。请注意,这次是第 3 步。
注:重要的是,印迹停止,只要这种弹出效应已经发生,以确保在这个过程中,晶体不会脱水过度印迹。使用储层中的结晶溶液对样品进行反印和稀释,因为它可确保晶体受到一致解决方案的约束,从而降低破坏晶体稳定的风险。
3. 收获晶体
- 将结晶板置于光显微镜下,并将目标放置在视野内。
- 将新鲜、发光的放电网格放在爆胎冰柜钳中,并将钳子安装在防爆冰柜中,碳膜侧面朝外远离印迹臂。
- 旋转钳子,使碳膜侧面朝印臂。
- 使用 2.5 μL 移液器,将 0.5 mL 管中的 2 μL 储层溶液应用到低温电格格的非支撑侧,并旋转网格,使碳膜支持侧面向跳动冰柜的样品端口。
- 剥回临时密封件,将移液器设置为 2 μL,轻轻地反复吸气结晶掉落以悬挂微晶(重要的是不要将气泡引入滴管)。
注:在光显微镜下观察这个过程,以确保晶体从任何表面皮肤或井底释放,这一点至关重要。如果晶体被卡住,没有用吸气器绘制,无论是移液器尖端或其他结晶工具,如针灸针,可以用来轻轻地脱落晶体。根据晶体的大小和光显微镜的场的深度,有时可以使用显微镜查看进入移液器尖端的晶体。 - 将吸气微晶体泥浆的 2 μL 转移到跳水冰柜中,并将所有样品涂抹到低温电格的碳侧。
- 在第 2 步确定的时间,并立即启动暴跌冻结。在涂抹时,观察整个网格中出现的弹出波效应,并注意这是否完全发生在网格中。晶体的存在会影响初始的印迹时间,因此可能需要将后续网格调整为 1-2 s。
- 快速工作,将网格从液态乙烷转移到浸入液氮的网格盒中。残留乙烷进入液氮后,会变成电网上不透明的白色固体。为了减少这种情况,将网格从液态乙烷中稳定地移出,然后迅速转移到液氮储层。
- 一旦将 4 个网格放入网格盒中,用螺丝固定盒子的盖子,然后将其转移到液氮泡沫脱瓦尔中,以便使用扫描电子显微镜 (SEM) 进行进一步样品评估,或者使用适当的存储容器将其转移到液氮储存除瓦。
4. 光显微镜的样本密度评估
警告:这种方法具有破坏性。如果样品的可用性有限,例如只有一两个结晶液滴,建议跳过此步骤。在暴跌冷冻样品(第3.7步)后,可以评估晶体在整个电网的分布情况。
- 将干燥的室温低温温度网格安装在防跌冰柜钳中,并将钳子放在光显微镜的一侧,并让网格处于视野中。设置适当的放大倍数和焦点,以便解决整个网格和单个网格方块的问题。
- 按照步骤 3.1-3.7 进行。
- 而不是将网格转移到网格盒(第 3.8 步),而是通过重置跳转冰柜从液态乙烷中收回暴跌的网格。
警告:网格和样品将加热到室温,不能用于进一步的衍射实验。 - 从暴跌冻结仪器中取出钳子。
- 将网格固定在钳子内时,将网格置于光显微镜下 - 焦点已大致设置。
- 执行精细的对焦并评估整个网格晶体的密度。一个好的网格将包含几个孤立的晶体远离每个网格方块内的网格条和晶体的团块是最小的。
- 如果网格内晶体的密度导致只有几个孤立晶体的晶体团块,进一步稀释储层溶液的晶体泥浆并重复第 3 步。稀释样品时要小心,以免稀释导致晶体溶解。
- 使用小批量 0.5-1 μL 分步稀释晶体。
5. 通过扫描电子显微镜进行样品评估
注:低温TEM网格上的微晶制备最好在低温条件下通过扫描电子显微镜(SEM)进行评估,这可以通过安装低温阶段的SEM来实现。在 VMXm,使用 JEOL JSM-IT100 SEM(钨源),并使用Quum PP3006气闸和低温。为确保在VMXm28、29号上查看样品时辐射损害最小,使用以下设置:5千伏加速电压:点大小为 40(JEOL JSM-IT100 上的任意单位);10 毫米工作距离。图像使用辅助电子探测器进行记录,用于样品对齐和聚焦居住时间为 0.8 μs,而使用 16 μs 的居住时间捕获单个晶体的高分辨率图像。在将样品加载到 SEM 之前,显微镜必须按照制造商的说明对齐。建议只将单个网格加载到 SEM 中,而使用相同参数准备的任何剩余网格则保留用于 X 射线衍射实验。
- 根据制造商的指示,将样品低温阶段冷却到 -180 °C,从而准备 SEM。按照将低温TEM网格加载到可用特定系统的说明。
- 当样品加载到 SEM 中时,打开电子束,对齐样品,并使用高放大倍率(0.8 μs 停留时间)设置对焦。
- 首先,针对低放大倍率 (x45) 对整个网格进行初始评估。在此放大镜下录制图像。
- 增加放大倍数,以便更仔细地检查单个网格方块,单个晶体应非常清晰地观察。
- 在网格中移动,捕获晶体的静止图像(16 μs 停留时间),确保它们在继续运行之前满足以下要求:
- 确保网格平整,碳支持膜基本完好无损。
- 确保水晶周围有无数带有窄光环的光晕的单晶。
- 确保碳支持膜上的孔是可见的。
- 确保没有由黑暗和光滑的外观定义的大面积的紫外液体。
- 确保很少或根本没有六边形冰,或表面冰散落在网格中。
- 确保晶体均匀分布在支撑膜上,并且不会重叠。
- 此时,精确测量多个晶体的尺寸,以便在以后的衍射实验中获得准确的 X 射线束大小相关性。
- 可可靠地从 SEM 检索并在低温下保存的样品以后可用于 X 射线衍射实验。如果这是不可能的,处理这些样品。
注:在对整个网格和单个微晶体(分别约为 x45 和 x700 放大倍率)进行成像时,应评估是否使用相同的参数准备的网格进入光束线,或者某些参数是否需要在第 3 步期间进行调整。网格应满足第 5.5 步中描述的测试。如果网格不符合这些标准,则在重复步骤 5 之前需要在第 3 步进行进一步优化。
6. 为 VMXm 的衍射实验准备网格
- 使用液氮将 VMXm 样品保持器 (图 4A)(最多 5) 与样品装载机一起装入样品盒(带盖子)的所需的数量冷却,这可能需要大量的液氮。液氮水平应略高于样品装载机上的样品位置。
- 准备圆环和工具。
- 将包括剪贴工具、钳子和 VMXm 样品钳在内的工具放入样品装载机中的孔中冷却。在德瓦尔之上安排一个聚光灯是很有用的。
- 将包含微晶加载网格的网格盒快速转移到样品装载机上的网格盒凹槽中,并拧开盖子使其松动且可旋转(不要拆下)。
- 在液氮下,用大钳子从样品盒中取出盖子,并将其置于样品装载机下面。
- 使用 VMXm 样品钳将样品支架提升到样品装载机上,确保支架朝上,以便接受网格。在正确位置时,样品装载机上的小引脚将与样品支架中间的小孔接合。
- 使用冷却的细钳,小心地将网格从网格盒中取出,并靠近样品支架上的网格开口。旋转网格使其平放(支持胶片侧朝哪个方向并不重要)。
- 轻轻降低钳子,使网格尽可能接近网格打开上方(小心不要弯曲网格),并将网格释放到开口中。如果网格不能正确放置,请小心使用细钳将网格推入位置,或用较大的钳子轻轻敲击样品支架。
- 将预冷却的圆环工具快速放在网格打开的网格上,并通过按下按钮将圆环坐下。应用按钮的 2 个凹陷可以有帮助,以确保圆环正确坐着。
- 充值液氮,使水平比样品支架高 1.5 厘米。使用 VMXm 样品钳,小心地将装载的样品支架向上和在样品装载机上的小别针上抬起,然后放回样品盒中。注意样品盒中样本持有人的位置编号。
- 继续将网格加载到样品支架中,直到所有样品都加载。
- 如果样品留在内部,将网格盒返回到存储去瓦尔,并将样品装载机从德瓦尔中取出,以创造更多的空间。
- 更换墨盒盖,确保墨盒顶部的销与盖子上的孔配合。
- 冷却并填充 VMXm 气闸去瓦尔液氮,并放置在含有装载样品盒的泡沫脱瓦尔旁边。
- 使用 VMXm 墨盒工具,小心地将工具放入墨盒侧面的山脊中,并迅速将墨盒提升到气闸中。
- 确保液氮水平覆盖墨盒。
- 将盖子放在气闸上,然后用装载的样品盒进入 VMXm 端站。
注:将样品盒加载到 VMXm 端站将由光束线工作人员执行。
结果
此协议的目的是实现晶莹剔透的微晶体,在晶体周围具有最小体积的液体,使 X 射线衍射实验具有最小的背景散射,以改善衍射信号。图 1A、B 和 图2显示在低温TEM网格上为最小背景散射而准备的微晶的示例SEM图像。分布均匀的单晶格网将提供最高效的网格使用,并具有良好的信号到噪声。但是,这通常不可能在整个网格中出现,某些区域可能会显示一定数量的团块(图 2A、B)。尽管这种纠结,这些例子仍然显示一个有用的单个孤立晶体,将提供低背景衍射(图5)。仍保持低背景散射的印迹水平可能有所不同。强烈的印迹使碳支持膜上的孔清晰可见,但晶体保持水分是目标(图2C,D)。但是,优质网格仍然可以在支撑膜孔内显示一些液体,尽管孔的位置仍应是可识别的(图 2A、B)。重要的是,所有这些示例都显示单个孤立的晶体,在晶体周围带有一个光晕的液体光环,以保持在污点和凹陷冻结之间水化。
许多样品可能需要进一步优化(图3),其中可以包括印迹时间的变化或微晶的浓度。过载晶体的网格将显示印迹效率降低,并可能导致多个格子记录在单个衍射图像中(图3A、B)。更粘稠的结晶条件,如含有8%PEG 4000和15%乙二醇(图3C)的试丁二烯,可导致需要更长的印迹时间(>10s)。相反,粘度非常低的结晶条件,斑点非常快,可能会遭受分布问题,由于重力导致在印迹发生前沉降,导致所有的微晶沿着网格的一侧沉降(图3D)。
最佳的样品制备使VMXm的全部功能得以利用,以最高分辨率收集高信号到噪声的高质量X射线衍射数据(图5)。这些样本受益于与 真空中的 样本环境兼容,导致衍射图像的平均背景计数非常低或为零。使用不具有低温保护剂的液态乙烷会导致没有冰环(图5),尽管晶体靠近铜网格条,X射线束可以扫视冰柱,导致铜粉衍射环为 +2.1 + 和 +1.8 + 。

图1:微晶安装在微米安装和cyoTEM网格上的比较。扫描电子显微图的暴跌冷冻微晶体的病毒多面体测量2.5μm跨越(A,B)5千伏加速电压,点大小39(任意单位)和居住时间16μs。网格没有多余的液体(A),在晶体周围观察到狭窄的液体光环(B)。在液氮闪烁冷却之前,将相同的样品安装在微米(20μm 光圈)上,并使用光束线 I24 正面(C)和侧面(D)的轴观视系统进行观察。面对面查看时,光学失真(C)指示整个微米的液体厚度程度,这在查看微米侧面(D)时更清晰。 C 和 D 中的红色目标表示 X 射线束的位置和大小。请单击此处查看此图的较大版本。

图2:优质样品示例。聚海德拉晶体(A) 在单个 +100 μm 网格方块中观察到。虽然有些晶体稍微结块,显示周围液体的某种连接性,但晶体周围有一些孤立的单晶,周围有少量液体光环。稍大一点的胰岛素晶体(B) 测量 +5 x 5 μm 也显示一些团块, 但再次有很好的孤立个别晶体。针状晶体的尺寸非常窄,需要微束,如这些针状的酶晶体(C)。在这些晶体周围可以看到一个狭窄的液体带(浅灰色光环)。较大的微晶体可达几十微米,也可以很好地安装在低温TEM网格上,如这些 +7 μm 蛋白酶 K 晶体(D)。在(C) 和(D) 和(A)的较小程度上,碳支持膜的孔清晰可见,表明存在很少/没有液体。例如 B,虽然没有观察到空孔,但仍可以识别孔的位置,表明液体只填充支撑膜中的孔。在所有这些示例中,在网格方形(圆形内方形)的边缘可以看到液体光环,其中孔的灰色外观较浅。这是精心准备的网格的一个常见功能。请单击此处查看此图的较大版本。

图3:需要进一步优化的样品示例。超载的微晶(A、B)网格可以增加背景散射,因为样品阻挡支撑膜中的孔,降低印迹效率,晶体之间的表面张力较高,因此会保留更多的液体。除了信号到噪声的退化导致信息丢失,还可能会记录多个格子。使用不够长的印迹时间,或高粘性结晶溶液可能导致样品(C)过湿,同时产生低信号到噪声。没有沉淀剂的结晶条件,如牛胰岛素(D),粘度非常低。虽然这会导致很短的印迹时间,但它也可能导致晶体在印迹之前和期间由于重力的影响而穿过网格。这通常会导致一个基本上空的网格,沿着一个边缘(D)的晶体浓度很高。在将乙二醇等粘性剂应用于晶格之前,在晶体浆中加入粘性剂(如乙二醇)是有利的,以减少晶体流动并改善晶体的分布。这还可以延长印迹时间,从而更容易观察印迹。请单击此处查看此图的较大版本。

图4:VMXm样品加载工具。定制工具集已设计为加载 VMXm 样品持有人(A)。样品装载机(B)在工作时具有单个 VMXm 样品支架、网格盒和工具存储的空间。它还设计为允许在液氮表面以下工作,并允许样品盒适合下面(B)。气闸脱瓦尔(C),适合在VMXm终端上的气闸氮气盒,用于将装载的样品盒从实验室带到光束线实验小屋。为了查看离线 SEM 中的样品,已制作了由 VMXm 样品支架组成的定制穿梭机(D),以便对梁线上使用的样品支架进行评估。请单击此处查看此图的较大版本。
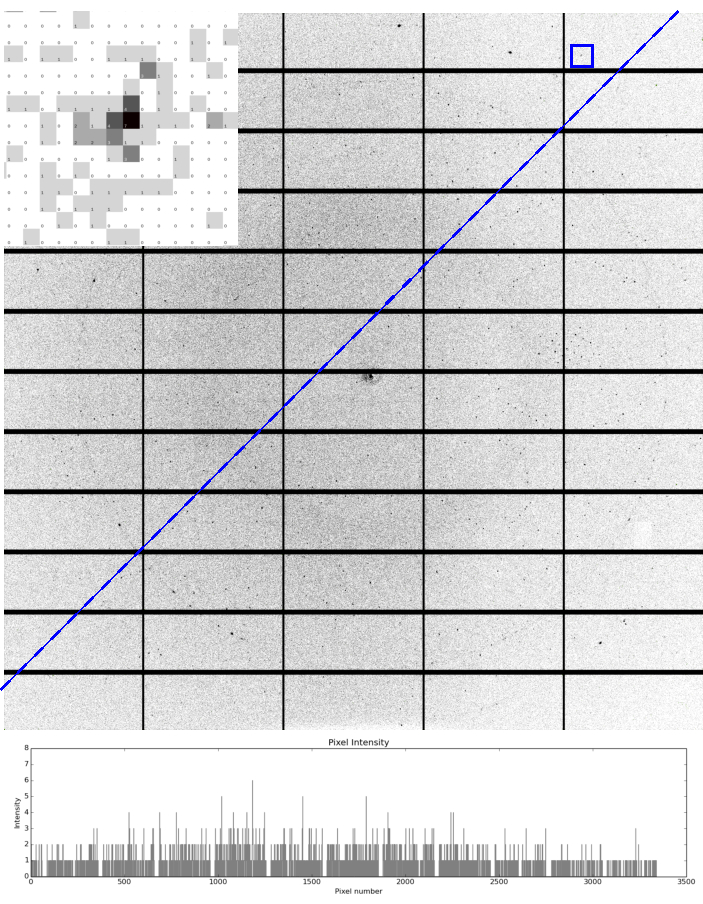
图5: VMXm微晶的示例衍射。 使用 Pilatus 3 6M 探测器在 VMXm 上使用使用凹陷冻结方法安装在低温特姆网格上的 +3 μm 病毒多面体晶体的单个衍射图像。衍射观察到 1.7 é 以上,并插入 1.74 + 的反射(蓝色方形),显示低背景散射,具有数量为零的高像素。乙二醇最终浓度为50%v/v,在将其应用于电网之前,在晶体浆料中加入。VMXm 样品位置的低背景性质通过图像的恒定背景来证明,如绘制在蓝色冲线下方的强度所示,甚至在光束中心附近。绘制的强度显示背景仍低于 3 计数。在 2.15 + 和 1.86 + 观察到两个微弱的环,它们是由低温电格栅铜的粉末衍射产生的。没有可检测到的冰环,表明印迹的有效性,然后用液态乙烷冷却。请单击此处查看此图的较大版本。
讨论
该协议演示了冷冻TEM样品制备工具如何用于在微焦光束线上进行X射线衍射实验的微晶制备。标准光束线仪表以针安装样品为中心,虽然已努力为微晶安装提供样品支持,但它们通常难以加载样品,同时确保实现最高信号到噪声(图 1C,D)。其中许多样品可能还需要优化低温保护条件,以确保样品是四肢的。暴跌冷冻方法提供了一种可重复的方式,以去除多余的液体,并在高效低温中闪烁冷却样品(图1A,B)。然后,网格可以安装在标准光束线上,并安装有基于钳子的引脚安装,VMXm 样品支架经过专门设计,通过导电冷却将网格接收到真空环境中的玻璃过渡温度以下。VMXm 的样本环境支持低背景数据收集,其中样本是背景的剩余来源,并提供了可用于匹配尺寸小于 10 μm 的晶体的微光束。这种样品制备方法还可用于为电子衍射准备纳米晶体,因为电子渗透力弱,因此对超量液体和四维样品也要求很少。虽然低温TEM网格很脆弱,但那些在循环中采集晶体的经验将迅速适应网格的处理。由于经验丰富,在协议的印迹、冻结和加载阶段,很少会丢失网格。然而,优化步骤对于这一成功至关重要,仔细准备将减少失去晶体或降低晶体完整性的机会。
CryoTEM 电网提供了一个相对较大的单个支架,可以容纳数百个晶体,从而提高了吞吐量,而可能只能记录一小块衍射数据楔形。单个网格也可以提供足够的晶体来确定蛋白质结构,特别是在高对称晶体中。如果只有一两个单个结晶滴产生微晶,则仅对结晶条件进行试印有助于确保当微晶被弄脏时,所用时间尽可能接近生成初始优质样品所需的时间。碳膜支架对 X 射线不可见,并且具有不同的孔间距,可用于适应特定的形态。我们最常使用 2 μm 孔的支撑膜,间距为 2 μm,但间距较大的小孔可能更适合小于 2 μm 的晶体。其他支持膜(如 1 μm 孔、4 μm 间距)以及具有不同形状孔的支持膜,所有这些都将影响印迹时间。网格方网大小为 200(每英寸 200 平方),也为铜网格条之间提供了足够的空间(+100 μm),使 X 射线束不会与铜强相互作用,同时为装有晶体的碳膜提供足够的结构支持。液体乙烷的使用否定了对低温保护剂的需求,进而减少了对样品体积的要求,而样品量本来会用于优化低温保护条件。
在此过程中要优化的主要参数是印迹时间和样品稀释。印迹时间应该足够长,在暴跌冻结之前观察整个网格的"弹出"效果。过度印迹可能导致晶体脱水,但是,控制样品室内的湿度是为了尽量减少这种影响。虽然建议使用相对湿度为 90%,但某些样品可能有助于优化湿度。湿度可能会影响印迹纸的印迹效率,而印迹纸会慢慢饱和水。此外,样品室内的湿度控制可用于提高晶体30的衍射质量。建议在检查衍射完整性之前对湿度进行小的更改(<5%),以确保衍射质量不会降解。
非珍贵样品的优化可以使用光显微镜代替SEM进行。虽然具有破坏性,但它有助于评估整个网格晶体的密度,并有助于决定样品应稀释还是浓缩以更好地分散整个网格中的晶体。当有大量的晶体可用,特别是高度集中的样品时,此步骤最有用。应避免将晶体聚集在一起(图3),因为如果在数据收集过程中同时点亮两颗晶体,则不是大问题,因为晶体团周围可能会有更大的液体量,从而减少信号到噪声(图5)。虽然使用光显微镜可以观察全球电网中大量液体的过量,但只能使用装有低温真空转移系统和舞台的电子显微镜来评估微晶周围的液体体积和结晶冰的存在。有时,在将晶体应用于网格并发生印迹之前,低粘度溶液中的晶体可能会沿着网格的一个边缘沉淀。我们发现,将乙二醇最终浓度加起来达到50%,可以减缓晶体通过滴流的移动,确保微晶在电网中更好地分布,并通过增加印迹时间(图3D)对印迹进行更好的控制。
一些含有粘性沉淀剂(如高分子量 PEG)的结晶溶液可能难以抹黑,需要越来越长的印迹时间(>10s)。在这种情况下,有助于减少沉积在网格背面的液体体积以及包含晶体的溶液体积,以支持网格的胶片侧。策略,如使用2层印迹纸或玻璃纤维也可能有助于印迹在这些困难的情况下31。
虽然这种管道适用于可溶性蛋白质晶体,但在非常粘稠的介质(如 LCP 中的膜蛋白)中形成的晶体提出了不同的挑战,而此协议不适合这些挑战。然而,正在制定战略,在低温TEM网格上为微教育制备LCP晶体,其中包括通过诱导LCP的阶段变化来降低样品的粘度。这允许样品以与本文中描述的方式类似的方式应用于网格。最后,样品可以用聚焦离子束碾磨,以去除多余的非晶体材料32,33,34。
总体而言,此管道通常需要 1-2 小时(包括设备设置时间),从到达 VMXm 的样品到提供分布良好、经过维尔庄化的样品的优化网格,具体取决于样品可用性、晶体浓度和结晶溶液的粘度。这些方法已经成功地用于为X射线衍射实验准备微晶,探索微晶体的辐射损伤,其中样品周围最小体积的液体是必不可少的28,35。应当指出,该协议可以应用于所有可溶性微晶体样品,而不仅仅是对已经优化的散射良好的样品。生产微晶材料的结晶实验传统上是优化的目标,目的是获得更大的晶体,但是,这种样品制备方法和 VMXm 的能力可能允许在没有进一步优化的情况下从这些样品中收集到足够的数据。或者,如果这种微晶样品衍射不良,使用这种样品制备方法从VMXm收集的数据仍然可以作为进一步优化结晶条件的有用指南。用于准备网格的工具,包括发光放电和骤降冻结,现已在配备低温TEM实验的研究机构中广泛提供,许多用户将能够在 VMXm 的光束时间之前准备样品。
披露声明
没有利益冲突要声明。
致谢
作者感谢杰里米·基恩、乔恩·格里姆斯、杰夫·萨顿和戴夫·斯图亚特、牛津大学和南安普敦大学的雷切尔·博尔顿,他们除了为光束线启用外,还为VMXm光束线的样品制备方法的开发和演示提供了微晶样品。作者还要感谢 iNEXT 发现(项目编号871037)在出版此手稿方面提供的机会和支持。
材料
| Name | Company | Catalog Number | Comments |
| Automated Cryo-EM plunge freezing instrument | Leica or ThermoFisher | Various | |
| Benchtop light microscope with light source | Various | Various | |
| Blade/Scalpel | Fisher Scientific | Various | |
| CryoTEM Copper 200 mesh grids with carbon support film with 2 µm holes | Quantifoil | N1-C16nCu20-50 | |
| CryoTEM grid storage boxes | Agar Scientific | AGG3727 | |
| ddH2O | n/a | n/a | |
| Ethane gas supply | n/a | n/a | |
| Ethylene Glycol | Acros Organics | 146750010 | |
| Glass microscope slides | FisherBrand | 12383118 | |
| Glass petri dish | FisherBrand | 455732 | |
| Glow discharging device | Pelco | 91000S | |
| Laboratory wrapping film (Parafilm) | Bemis | HS234526B | |
| Large and small, fine forceps | Agar Scientific | Various | |
| Liquid nitrogen supply | n/a | n/a | |
| Pipette tips | Various | Various | |
| Pipetting devices | Various | Various | |
| Sealing tape for crystallisation plates. | Molecular Dimensions | MD6-01 | |
| Small/medium liquid nitrogen dewars | Spearlab | Various | |
| Sprung circlip clipping tool | Subangstrom | SCT08 | |
| Whatmann No.1 pre-cut filter paper | Leica | 16706440 |
参考文献
- Laundy, D., et al. Development of a multi-lane X-ray mirror providing variable beam sizes. Review of Scientific Instruments. 87 (5), 051802-051806 (2016).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- McPherson, A., Cudney, B. Optimization of crystallization conditions for biological macromolecules. Acta crystallographica. Section F, Structural biology communications. 70 (11), 1445-1467 (2014).
- Holton, J. M., Frankel, K. A. The minimum crystal size needed for a complete diffraction data set. Acta Crystallographica Section D. 66, 393-408 (2010).
- Garman, E. F., Owen, R. L. Cryocooling and radiation damage in macromolecular crystallography. Acta Crystallographica Section D. 62 (1), 32-47 (2005).
- Gildea, R. J., et al. New methods for indexing multi-lattice diffraction data. Acta Crystallographica Section D. 70, 2652-2666 (2014).
- Chapman, H. N. X-Ray Free-Electron Lasers for the Structure and Dynamics of Macromolecules. Annual Review of Biochemistry. 88 (1), 35-58 (2019).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Smith, J. L., Fischetti, R. F., Yamamoto, M. Micro-crystallography comes of age. Current Opinion in Structural Biology. 22 (5), 602-612 (2012).
- Owen, R. L., Juanhuix, J., Fuchs, M. Current advances in synchrotron radiation instrumentation for MX experiments. Archives of Biochemistry and Biophysics. 602, 21-31 (2016).
- Miller, M., et al. Getting the Most Out of Your Crystals: Data Collection at the New High-Flux, Microfocus MX Beamlines at NSLS-II. Molecules. 24 (3), 496 (2019).
- Axford, D., Ji, X., Stuart, D. I., Sutton, G. In cellulo structure determination of a novel cypovirus polyhedrin. Acta Crystallographica Section D. 70, 1435-1441 (2014).
- Ji, X., et al. Polyhedra structures and the evolution of the insect viruses. Journal of structural biology. 192 (1), 88-99 (2015).
- Evans, G., Axford, D., Owen, R. L. The design of macromolecular crystallography diffraction experiments. Acta Crystallographica Section D. 67, 261-270 (2011).
- . MiTeGen Available from: https://www.mitegen.com/product/micromeshes/ (2020)
- Guo, G., et al. Sample manipulation and data assembly for robust microcrystal synchrotron crystallography. IUCrJ. 5, 238-246 (2018).
- Cipriani, F., et al. Automation of sample mounting for macromolecular crystallography. Acta Crystallographica Section D. 62 (10), 1251-1259 (2006).
- Caffrey, M. A comprehensive review of the lipid cubic phase or in mesomethod for crystallizing membrane and soluble proteins and complexes. Acta crystallographica. Section F, Structural biology communications. 71 (1), 3-18 (2015).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Nannenga, B. L. MicroED methodology and development. Structural Dynamics. , 1-8 (2020).
- Dubochet, J., et al. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (2), 129-228 (1988).
- Tivol, W. F., Briegel, A., Jensen, G. J. An improved cryogen for plunge freezing. Microscopy and Microanalysis. 14 (5), 375-379 (2008).
- Garman, E. F., Schneider, T. R. Macromolecular Cryocrystallography. Journal of Applied Crystallography. 30 (3), 211-237 (1997).
- Pflugrath, J. W. Practical macromolecular cryocrystallography. Acta Crystallographica Section F. 71 (6), 622-642 (2015).
- Alcorn, T., Juers, D. H. Progress in rational methods of cryoprotection in macromolecular crystallography. Acta crystallographica Section D. 66, 366-373 (2010).
- Bowler, M. W., Montgomery, M. G., Leslie, A. G. W., Walker, J. E. Reproducible improvements in order and diffraction limit of crystals of bovine mitochondrial F(1)-ATPase by controlled dehydration. Acta Crystallographica Section D. 62, 991-995 (2006).
- Pellegrini, E., Piano, D., Bowler, M. W. Direct cryocooling of naked crystals: are cryoprotection agents always necessary. Acta Crystallographica Section D. 67, 902-906 (2011).
- Beale, E. V., et al. Scanning electron microscopy as a method for sample visualization in protein X-ray crystallography. IUCrJ. , 1-9 (2020).
- Hattne, J., et al. Analysis of Global and Site-Specific Radiation Damage in Cryo-EM. Structure. 26 (5), 759-766 (2018).
- Sanchez-Weatherby, J., et al. Improving diffraction by humidity control: a novel device compatible with X-ray beamlines. Acta crystallographica Section D. 65 (12), 1237-1246 (2009).
- Tan, Y. Z., Rubinstein, J. L. Through-grid wicking enables high-speed cryoEM specimen preparation. Acta Crystallographica Section D. 76 (11), 1092-1103 (2020).
- Martynowycz, M. W., Khan, F., Hattne, J., Abramson, J., Gonen, T. MicroED structure of lipid-embedded mammalian mitochondrial voltage-dependent anion channel. Proceedings of the National Academy of Sciences. 117 (51), 32380-32385 (2020).
- Zhu, L., et al. Structure Determination from Lipidic Cubic Phase Embedded Microcrystals by MicroED. Structure. 28 (10), 1149-1159 (2020).
- Polovinkin, V., et al. Demonstration of electron diffraction from membrane protein crystals grown in a lipidic mesophase after lamella preparation by focused ion beam milling at cryogenic temperatures. Journal of Applied Crystallography. 53 (6), 1416-1424 (2020).
- Storm, S. L. S., et al. Measuring energy-dependent photoelectron escape in microcrystals. IUCrJ. 7 (1), 129-135 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。