Method Article
改进酶保护测定法研究 金黄色葡萄球菌 内化和抗菌化合物的细胞内效
* 这些作者具有相同的贡献
Erratum Notice
摘要
该协议旨在描述如何研究 金黄色葡萄球菌 内化的程度及其在人类宿主细胞内存活的能力,以及抗菌化合物的细胞内功效。
摘要
金黄色葡萄球菌 表达毒力因子,以触发其内化为真核生物细胞并在不同的亚细胞区室内存活。本文介绍了一种酶保护测定法,以研究 金黄色葡萄球菌 内化的程度及其在贴壁非专业吞噬细胞(NPPCs)中的细胞内存活率以及抗菌化合物的细胞内功效。NPPCs在多孔板中生长,直到它们达到100%汇合。 金黄色葡萄球菌 培养物在细胞培养基中生长过夜。根据每孔的细胞数量稀释细菌悬浮液,以受控的感染多重性接种细胞。接种的细胞孵育2小时,以使细菌被NPPC内化,然后将溶菌素加入培养基中以选择性地杀死细胞外细菌。溶菌素磷脂存在于实验其余部分的培养基中。
此时,可以将受感染的细胞与抗菌化合物一起孵育,以评估其对 金黄色葡萄球菌的细胞内活性。接下来,将细胞洗涤三次以除去药物,然后通过在琼脂平板上培养来量化细胞内 金黄色葡萄球菌 负载。或者,为了研究参与细胞内存活和细胞毒性的葡萄球菌毒力因子,溶菌素可以用蛋白酶K灭活以消除洗涤步骤的需要。该提示提高了细胞内细菌负荷定量的可靠性,特别是如果细胞由于细胞内 金黄色葡萄球菌的增殖而变得严重感染时倾向于从培养板中分离。这些实验方案可用于几乎所有类型的贴壁NPPC和3D细胞培养模型,如类器官。
引言
金黄色葡萄球菌 既是一种危及生命的病原体,也是一种皮肤和粘膜共生细菌,在全世界20亿人中定居1。在人类中, 金黄色葡萄球菌 的鼻携带者感染自身携带菌株的风险增加;然而, 金黄色葡萄球菌 黏膜携带的多因素决定因素尚不清楚1,2。除急性感染外,患者还可能发展为慢性 金黄色葡萄球菌 感染,这些感染通常难以治愈3。更好地了解定植和感染期间宿主-病原体的相互作用对于开发新的治疗策略和改善患者管理至关重要。
在体外, 金黄色葡萄球菌 可以触发其内化为表达α5β1整合素4的宿主细胞。锚定在 金黄色葡萄球菌细胞壁上的葡萄球菌纤连蛋白、纤连蛋白与宿主细胞表面表达的β1整合素之间的三方相互作用是众所周知的金 黄色葡萄球菌 内化的主要途径,如角质形成细胞、成骨细胞、成纤维细胞以及上皮细胞和内皮细胞4。最近的研究表明,金 黄色葡萄球菌 可以在鼻定植5,6 和感染期间在人体细胞内发现7。然而,细胞内储库在 金黄色葡萄球菌 感染发病机制中的作用尚不清楚。宿主细胞可以作为 金黄色葡萄球菌的庇护所,金黄色葡萄球菌 受到免疫系统8 和大多数抗菌化合物的保护6,9。
Proctor10在20世纪80年代早期描述的溶菌脂保护测定法能够研究参与金黄色葡萄球菌分离物内化的细菌和宿主因子。溶菌素是一种由葡萄球菌产生的细菌素,对几乎所有金黄色葡萄球菌分离株(包括抗生素耐药菌株)表现出有效的活性11。溶菌素已被用于仅破坏细胞外金黄色葡萄球菌,以便仅计数活的细胞内细菌12。该技术已被广泛使用,并有助于发现金黄色葡萄球菌的几种毒力因子。庆大霉素单独与溶菌素联合使用,也广泛用于研究细胞内细菌。
然而,最近的一项研究表明,庆大霉素进入真核细胞并以时间和浓度依赖性的方式到达内化细菌13。该研究还表明,溶菌素不会进入真核细胞,证实基于溶菌素的酶保护测定(EPA)是通过培养量化细胞内 金黄色葡萄球菌 负荷的最准确测定13。无论使用哪种化合物来破坏细胞外细菌(例如,溶菌素或庆大霉素),在将细胞内金黄色葡萄 球菌 接种在琼脂平板上之前,应通过洗涤细胞来除去。连续洗涤可能导致细胞脱离,特别是贴壁不良的细胞(例如,严重感染的细胞),这将导致细胞内 金黄色葡萄球菌 负荷的低估。本文详细介绍了如何使用EPA来量化细胞内 金黄色葡萄球菌 负荷,并使用 体外 模型测量抗菌素化合物的细胞内功效。值得注意的是,已经提出了一种简单的方法,通过避免密集洗涤来提高细胞内负荷定量的可靠性。
研究方案
1. 人上皮细胞培养
- 用Dulbecco的改良鹰培养基(DMEM)高葡萄糖和酚红制备完整的培养基,并补充10%胎儿牛血清(FBS)而不使用抗生素。
- 在36±1°C的5%CO 2中在完全培养基中生长A549上皮细胞。确保使用适当大小的培养容器,以便有足够的细胞用于后续步骤(参见步骤1.10)。
注意:一个75 cm 2 (T-75)烧瓶足以接种两个24孔板并传代培养细胞。 - 感染前两天,准备一个24孔板。
- 从T-75烧瓶中取出并丢弃用过的培养基,并用10mLDulbecco's磷酸盐缓冲盐水(DPBS)洗涤细胞一次。
- 加入5mL胰蛋白酶-EDTA,并在36±1°C下在5%CO 2中孵育细胞5分钟。
- 加入5mL完整培养基并将细胞转移到管中。
- 将细胞在300× g下离心5分钟。
- 弃去上清液并将细胞重悬于10mL新鲜完整培养基中。
- 使用自动细胞计数器(或计数室)对细胞进行计数。
- 在完整的培养基中稀释细胞,以2.0×105 个细胞/ mL的浓度制备30mL细胞悬浮液。
- 向24孔板的每个孔中加入1mL细胞悬浮液,这对应于约1.0×105 个细胞/ cm²的细胞密度,孔面积为2 cm²。
- 将细胞在36±1°C下在5%CO 2 中孵育48小时,直到它们达到100%汇合。
注意:除了要测试的条件外,还应保留三个孔用于感染当天的细胞计数(见步骤3.1.4)。根据要测试的条件数量,最多可以同时制备两个24孔板。协议中指示的体积应相应增加。
2. 金黄色葡萄球菌 菌株培养
- 感染前两天,用不含酚红的DMEM高葡萄糖制备完整的感染培养基,并辅以10%FBS无抗生素。
- 解冻 金黄色葡萄球菌 菌株将在琼脂平板上进行测试。
- 将琼脂平板在36±1°C孵育18-24小时。
- 在接种前一天,接种一个 金黄色葡萄球菌 菌株集落,在10 mL完全感染培养基中进行测试。
- 将细菌在36±1°C下孵育18-24小时,以160rpm振荡。使用50 mL管保持45°,以避免细菌沉降。
注意:在开始使用新菌株之前,建议在用于进一步实验的相同培养条件下(培养基,细菌负荷和溶菌素浓度和孵育时间)中验证其溶菌素敏感性。确定对应于OD 600nm为0.5 的细菌负载也很重要,因为它可能因菌株而异。细菌菌株的培养条件可根据实验目的进行调整。
3. 金黄色葡萄球菌感染试验
- 测定细胞密度和活力
- 从专用于计数A549细胞的三个孔中取出并丢弃用过的培养基。
- 加入1mL含有5μg/ mLHoechst 33342和1μg/ mL碘化丙啶的完整感染培养基。
注意:Hoechst 33342是一种已知的诱变剂,应谨慎处理。碘化丙啶是一种潜在的诱变剂,必须小心处理,并根据适用的法规安全处置。 - 将细胞在36±1°C下在5%CO 2中孵育30分钟。
- 计算细胞数量并使用宽视场荧光显微镜计算细胞活力。
注意:如果没有荧光显微镜,可以使用细胞计数室使用台盼蓝染色来计算细胞密度和活力。
- 细菌悬浮液的制备
- 在管中分配25mL完全感染培养基,并在36±1°C下预热。
- 使用细胞密度计将金黄色葡萄球菌悬浮液在完全感染培养基中调节至0.5的anOD600nm。
- 通过在完整的感染培养基中稀释0.5 OD 600nm来制备20mL 用于细胞接种的细菌悬浮液,以根据每孔的细胞数实现1的感染多重性(MOI)。
注意:MOI对应于每个孔中每个细胞添加的细菌数量。例如,要达到1.0×每孔106 个细胞的MOI,以2.0×106 CFU / mL制备细菌悬浮液,以便可以在500μL的体积中加入106 CFU(参见步骤3.3.3)。MOI可以根据要测试的细胞类型和细菌菌株进行调整。 - 使用自动螺旋压板机确定用于细胞接种步骤的稀释细菌悬浮液的 金黄色葡萄球菌 负荷。
- 将琼脂平板在36±1°C孵育18-24小时。
- 第二天,用菌落计数器计算菌落的数量,以计算每个测试菌株的准确MOI。
注意:如果没有自动螺旋压板机可用,细菌负荷可以通过在琼脂平板上连续稀释来确定。有关详细信息,请参阅细菌学分析手册14。
- 细胞接种
- 通过低倍率显微镜观察24孔板的每个孔,以确保细胞健康并按预期生长。
- 从24孔板中取出并丢弃用过的细胞培养基。
- 向每个孔中加入500μL用于接种的细菌悬浮液,其中100%汇合细胞。
- 将细胞在36±1°C和5%CO 2下孵育2小时。
注意:建议对要测试的每个条件使用三个孔板(一式三份),并进行至少三次独立实验。孵育的延迟可以根据实验目的进行调整。
- 通过改进的酶保护测定法 (iEPA) 对细胞内细菌进行定量
- 在无菌水中制备7 mL 4x裂解缓冲液,加入3.5 mL 2% Triton X-100和3.5 mL胰蛋白酶-EDTA。
- 在醋酸盐缓冲液中以10mg / mL制备溶菌素储备溶液,并将25μL等分试样放入冷冻管中。在-80°C下储存长达6个月。
- 通过混合25μL溶菌素储备溶液(10mg / mL)和225μL0.1M Tris-HCl,以1mg / mL制备250μL新鲜溶菌素工作溶液。在4°C下储存长达48小时。
- 通过将6 mL完全感染培养基加入250μL溶菌素工作溶液,制备6.25mL补充溶菌素的完整感染培养基。
- 将250μL补充有溶菌素的完整感染培养基加入每个孔中,并通过用手旋转板轻轻搅拌板。
- 将细胞在36±1°C下在5%CO 2 中孵育1小时,以使溶菌素杀死细胞外细菌。
- 在孵育时间结束时,向每个孔中加入10μL蛋白酶K以20mg / mL以灭活溶菌素。
- 在室温下孵育细胞2分钟。
- 加入250μL4x裂解缓冲液,通过渗透性休克裂解细胞。
- 将细胞在36±1°C孵育10分钟。
- 通过在孔的底部上下移液十次来彻底混合,以确保细胞完全裂解和均质化。
- 使用自动螺旋压板机确定每个孔的 金黄色葡萄球菌 负荷。
- 将琼脂平板在36±1°C孵育18-24小时。
- 第二天,用菌落计数器计算菌落的数量,以计算每个孔的细胞内 金黄色葡萄球菌 负荷。
- 使用酶保护测定法(EPA)测量抗菌化合物的细胞内功效
- 在无菌水中制备25 mL 1x裂解缓冲液和3.125 mL 2% Triton X-100,6.25 mL胰蛋白酶-EDTA和15.625 mL无菌水。
- 通过混合25μL溶菌素储备溶液(10mg / mL)和225μL0.1M Tris-HCl,以1mg / mL制备250μL新鲜溶菌素工作溶液。
- 通过将24.75mL完全感染培养基加入250μL溶菌素工作溶液来制备25mL补充溶菌素的完全感染培养基。
- 对于要测试的每种抗菌化合物,制备3.1mL补充溶菌素和待研究浓度的抗菌化合物的完整感染培养基。
- 从24孔板中取出并丢弃用过的细胞培养基。
- 加入 1 mL 补充溶菌素的完全感染培养基。
- 将细胞在36±1°C下在5%CO 2 中孵育1小时,以使溶菌素杀死细胞外细菌。
- 从24孔板中取出并丢弃补充有溶菌素的培养基。
- 用1 mL补充溶菌素的培养基和待测试的抗菌化合物填充三个孔。
- 对要测试的每种抗菌化合物重复步骤3.5.9。
- 对于对照条件,用1 mL补充溶菌素的培养基填充三个孔,不含任何抗菌化合物。
- 将细胞在36±1°C下在5%CO 2中孵育24小时。
- 在孵育期结束时,取出并丢弃用过的培养基,并用CaCl2和MgCl2的无菌DPBS轻轻洗涤每个孔三次。
- 向每个孔中加入1mL的1x裂解缓冲液,以通过渗透性休克分离和裂解细胞。
- 将细胞在36±1°C孵育10分钟。
- 通过在整个孔中上下移液十次来彻底混合,以确保细胞完全裂解和均质化。
- 使用自动螺旋压板机确定每个孔的 金黄色葡萄球菌 负荷。
- 将琼脂平板在36±1°C孵育18-24小时。
- 第二天,用菌落计数器计算菌落的数量,以计算每个孔的细胞内 金黄色葡萄球菌 负荷。
注意:每种抗菌化合物的细胞内活性应根据对照条件的细菌负荷来计算。检查所有抗菌化合物的细胞毒性也很重要,以证明在对照组和化合物之间观察到的差异不是由于细胞死亡引起的。
结果
A549上皮细胞内化 金黄色葡萄球菌 的结果如图 1A所示。将A549细胞接种金 黄色葡萄球菌 SF8300 WT和SF8300 ΔfnbA / B,其缺乏纤连蛋白结合蛋白A和B,MOI为1小时2小时。为了破坏细胞外的 金黄色葡萄球菌,将溶菌素加入培养基中,并将细胞孵育1小时。接下来,溶菌素通过洗涤EPA去除或用蛋白酶K灭活用于iEPA。然后,在裂解缓冲液中破坏细胞,并通过培养物定量细菌负荷。通过使用EPA,SF8300 WT和SF8300 ΔfnbA / B的平均细胞内载量分别为4.46和0.49 Log CFU / mL(图1A,绿色条)。使用iEPA,SF8300 WT和SF8300 ΔfnbA / B的平均细胞内载量分别为4.53和0.56 Log CFU / mL(图1A,红色条)。有趣的是,EPA和iEPA都显示出类似的结果,这可以解释为当细胞处于良好状态时易于进行洗涤,并且因为金 黄色葡萄球菌诱导的细胞毒性在这些实验环境中非常低(数据未显示)。
万古霉素、利福平和左氧氟沙星对金黄色葡萄 球菌 的细胞内活性结果如图 1B所示。为了测量这些抗生素的细胞内活性,将HaCaT细胞接种金 黄色葡萄球菌 ATCC 29213,MOI为1小时2小时。将细胞与溶菌素孵育,有或没有待测试的抗菌化合物,24小时。接下来,通过洗涤除去溶菌素和抗菌化合物。在裂解缓冲液中破坏细胞,并通过培养物定量细菌负荷。对照的平均细胞内载量分别为4.57,4.51,3.03和2.91 log CFU / mL,万古霉素(50μg/ mL),利福平(7μg/ mL)和左氧氟沙星(10μg/ mL)(图1B)。
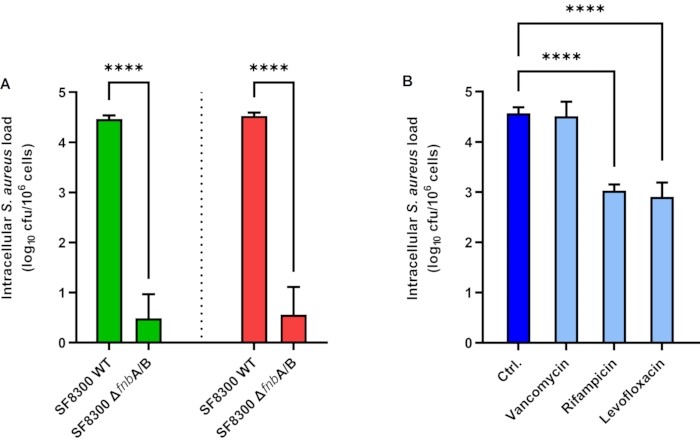
图1:上皮细胞中的细胞内金黄色葡萄球菌上载量。(A)感染金黄色葡萄球菌SF8300 WT和ΔfnbA / B的A549细胞中的酶保护测定(绿色条)和改进的酶保护测定(红色条)。 ATCC 29213.条形图表示三个独立实验的平均值,一式三份。误差线表示标准偏差。p < 0.0001。缩写: Ctrl = 控制;cfu = 菌落形成单位。请点击此处查看此图的放大版本。
讨论
这里描述的测定对于研究NPPC中 金黄色葡萄球菌 的内化程度和细胞内存活率以及抗菌化合物的细胞内功效很有价值6,15,16。两种测定方案中的某些步骤可能至关重要。健康条件和细胞密度必须得到完美控制,并在独立实验之间保持一致。细菌接种物必须仔细标准化,以获得接近目标理论MOI的真实MOI。通常,移液时必须注意不要分离任何细胞。去除溶菌素和抗生素的洗涤剂是EPA的关键步骤。已经发现,在不使用抗生素的情况下,使用蛋白酶K可以改善这一步骤(见下文)。最后但并非最不重要的一点是,细胞应在每个孔中完全分离,并在与裂解缓冲液孵育后彻底匀浆,以可靠地量化 金黄色葡萄球菌 细胞内负荷。
在某些情况下,可能会遇到问题,必须首先检查几个要点。在缺乏可重复性的情况下,必须记住 金黄色葡萄球菌 可以形成团块,使吸光度定量不准确。如果要更换培养基(例如,用于消除分泌的蛋白质),则可通过离心和洗涤步骤增加细菌的聚集。细菌悬浮液应迅速使用,因为细菌在室温下继续生长。溶菌素的功效可能由于不正确的储存条件,培养基中酶活性的pH值欠佳,批次和提供者之间酶活性的可变性以及某些菌株在特定生长条件下缺乏溶菌素敏感性而降低。酚红可能具有轻微的抑菌作用,特别是当培养基与用于生长细菌的典型肉汤相比营养相对较差时。因此,建议使用不含酚红的细胞培养基,这也通过降低背景噪声来改善荧光显微镜观察。
虽然这种方法是研究不同菌株的细胞内命运的宝贵工具,但应考虑该方法的一些局限性。使用非常高的MOI可以使NPPC的内化能力过载,并平衡所测试的不同菌株之间的差异。大多数细胞毒性菌株的内化程度可能被低估,因为溶菌素(或抗生素)会迅速破坏受损细胞释放的 金黄色葡萄球菌 。因此,具有较长持续时间的实验(即,研究抗生素的细胞内存活或细胞内活性)更容易与具有低细胞毒性的菌株建立。因此,应根据菌株毒力,细胞类型和实验目的准确调整孵育时间和MOI。
这里描述的使用溶菌素的方法比基于庆大霉素的方法更可靠,因为与溶霉素不同,庆大霉素倾向于被宿主细胞内化13。另一个优点是可以灭活溶杆菌素。Kim等人报告了使用EDTA螯合锌离子或1,10 -菲罗啉的溶菌素活性的抑制;然而,在细菌电镀之前,仍然需要密集洗涤以除去酶。在这里,蛋白酶K能够快速灭活溶菌素。我们观察到,由于细胞内 金黄色葡萄球菌的增殖,当它们受到严重感染时,细胞往往会从培养板中分离出来。通过跳过最后的洗涤步骤,iEPA方法大大简化了技术处理,并能够在松散贴壁或已经分离的细胞中恢复内化细菌。
iEPA中使用的更浓缩的试剂和缓冲液也有助于减少移液工作量并最大限度地减少细胞损失。此外,iEPA可用于悬浮液中的细胞,以及难以洗涤的类器官。总之,酶保护测定能够研究 金黄色葡萄球菌的内化程度和细胞内命运,以及具有不同 体外 模型的抗菌药物的细胞内活性。应进行改进以更好地表征内化和细胞毒性之间的关系,以更好地理解开发能够到达细胞内 金黄色葡萄球菌 的药物的重要性。
披露声明
作者没有利益冲突要声明。
致谢
金黄色葡萄球菌 菌株SF8300 WT和SF8300 ΔfnbA / B由Binh Diep教授(美国加州大学旧金山分校)慷慨赠送。这项工作得到了FINOVI协会(#AO13 FINOVI)在里昂大学基金会的支持下的资助。
材料
| Name | Company | Catalog Number | Comments |
| 24-well plate | CORNING-FALCON | 353047 | |
| A549 cell line | ATCC | CCL-185 | |
| Acetate buffer solution pH 4.6 | Fluka | 31048 | Used to prepare lysostpahine stock solution at 10 mg/mL in 20 mM sodium acetate. |
| AMBICIN (Recombinant lysostaphin) | AMBI | LSPN-50 | Lyophilized recominant lysostaphin. Freeze at -80 °C for long-term storage. |
| COS - Colombia agar + 5% sheep blood | Biomerieux | 43049 | Any agar plate suitable for growing staphylococci can be used instead. |
| Densitometer WPA CO8000 | Biochrom Ltd. | 80-3000-45 | Cell density meter |
| Dulbecco’s Modified Eagle’s Medium, high glucose with phenol red | Sigma-Aldrich | D6429 | |
| Dulbecco’s Modified Eagle’s Medium, high glucose without phenol red | Sigma-Aldrich | D1145 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dulbecco′s Phosphate-buffered Saline with MgCl2 and CaCl2, sterile-filtered | Sigma-Aldrich | D8662 | |
| Dulbecco′s Phosphate-buffered Saline, sterile-filtered | Sigma-Aldrich | D8537 | |
| Easyspiral dilute | Interscience | 414000 | Automatic diluter and spiral plater |
| Fetal bovine serum | Gibco | 10270-106 | |
| HaCaT cell line | Cell lines service (CLS) | 300493 | |
| Hoechst 33342, Trihydrochloride, Trihydrate, 10 mg/mL Solution in Water | Fisher scientific | 11534886 | |
| Propidium iodide, 1.0 mg/mL solution in water | Invitrogen | P3566 | |
| Proteinase K, recombinant 20 mg/mL | Eurobio | GEXPRK01-B5 | > 30 U/mg, lot 901727 |
| Scan 4000 | Interscience | 438000 | Automatic colony counter |
| Sterile water | OTEC | 600500 | |
| T-75 culture flask | CORNING-FALCON | 353136 | |
| TC20 Automated cell counter | Biorad | 1450102 | Automatic cell counter |
| Tris 1 M pH 8.0 | Invitrogen | AM9855G | Used to prepare lysostaphine working solution at 1 mg/mL in 0.1 M Tris-HCl. |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin - EDTA solution | Sigma-Aldrich | T3924 | 0.05% porcine trypsin and 0.02% EDTA in Hanks′ Balanced Salt Solution with phenol red |
| Wide-field fluorescence microscope | Nikon | Ti2 |
参考文献
- Verhoeven, P. O., et al. Detection and clinical relevance of Staphylococcus aureus nasal carriage: an update. Expert Review of Anti-Infective Therapy. 12 (1), 75-89 (2014).
- Gagnaire, J., et al. Epidemiology and clinical relevance of Staphylococcus aureus intestinal carriage: a systematic review and meta-analysis. Expert Review of Anti-Infective Therapy. 15 (8), 767-785 (2017).
- Tong, S. Y. C., Davis, J. S., Eichenberger, E., Holland, T. L., Fowler, V. G. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clinical Microbiology Reviews. 28 (3), 603-661 (2015).
- Josse, J., Laurent, F., Diot, A. Staphylococcal adhesion and host cell invasion: fibronectin-binding and other mechanisms. Frontiers in Microbiology. 8, 2433 (2017).
- Hanssen, A. -. M., et al. Localization of Staphylococcus aureus in tissue from the nasal vestibule in healthy carriers. BMC Microbiology. 17 (1), 89 (2017).
- Rigaill, J., et al. Evaluation of the intracellular efficacy of antimicrobial agents used for Staphylococcus aureus decolonization in a cell model mimicking nasal colonization. Journal of Antimicrobial Chemotherapy. 73 (11), 3044-3048 (2018).
- Yang, D., et al. Novel insights into Staphylococcus aureus deep bone infections: the Involvement of osteocytes. mBio. 9 (2), 00415-00418 (2018).
- Tuchscherr, L., et al. Staphylococcus aureus phenotype switching: an effective bacterial strategy to escape host immune response and establish a chronic infection. EMBO Molecular Medicine. 3 (3), 129-141 (2011).
- Valour, F., et al. Antimicrobial activity against intraosteoblastic Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 59 (4), 2029-2036 (2015).
- Proctor, R. A., Prendergast, E., Mosher, D. F. Fibronectin mediates attachment of Staphylococcus aureus to human neutrophils. Blood. 59 (4), 681-687 (1982).
- Climo, M. W., Ehlert, K., Archer, G. L. Mechanism and suppression of lysostaphin resistance in oxacillin-resistant Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 45 (5), 1431-1437 (2001).
- Bur, S., Preissner, K. T., Herrmann, M., Bischoff, M. The Staphylococcus aureus extracellular adherence protein promotes bacterial internalisation by keratinocytes independent of fibronectin-binding proteins. Journal of Investigative Dermatology. 133 (8), 2004-2012 (2013).
- Kim, J. -. H., Chaurasia, A. K., Batool, N., Ko, K. S., Kim, K. K. Alternative enzyme protection assay to overcome the drawbacks of the gentamicin protection assay for measuring entry and intracellular survival of Staphylococci. Infection and Immunity. 87 (5), 00119 (2019).
- Aerobic plate count. Bacteriological Analytical Manual., Edition 8, Revision A Available from: https://www.fda.gov/food/laboratory-methods-food/bam-chapter-3-aerobic-plate-count (2021)
- Kolenda, C., et al. Evaluation of the activity of a combination of three bacteriophages alone or in association with antibiotics on Staphylococcus aureus embedded in biofilm or internalized in Osteoblasts. Antimicrobial Agents and Chemotherapy. 64 (3), 02231 (2020).
- Abad, L., et al. Antibiofilm and intraosteoblastic activities of rifamycins against Staphylococcus aureus: promising in vitro profile of rifabutin. Journal of Antimicrobial Chemotherapy. 75 (6), 1466-1473 (2020).
Erratum
Formal Correction: Erratum: Improved Enzyme Protection Assay to Study Staphylococcus aureus Internalization and Intracellular Efficacy of Antimicrobial Compounds
Posted by JoVE Editors on 1/19/2022. Citeable Link.
An erratum was issued for: Improved Enzyme Protection Assay to Study Staphylococcus aureus Internalization and Intracellular Efficacy of Antimicrobial Compounds. One of the affiliations was updated.
The fifth affiliation was updated from:
Département de Bactériologie, Institut des Agents Infectieux, Hospices Civils de Lyon, Lyon, France
to:
Department of Bacteriology, Institute for Infectious Agents, Hospices Civils de Lyon, Lyon, France
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。