Method Article
Essai de protection enzymatique amélioré pour étudier l’internalisation de Staphylococcus aureus et l’efficacité intracellulaire des composés antimicrobiens
* Ces auteurs ont contribué à parts égales
Dans cet article
Erratum Notice
Résumé
Ce protocole vise à décrire comment étudier l’étendue de l’internalisation de Staphylococcus aureus et sa capacité à survivre à l’intérieur de la cellule hôte humaine, ainsi que l’efficacité intracellulaire des composés antimicrobiens.
Résumé
Staphylococcus aureus exprime des facteurs de virulence pour déclencher son internalisation dans les cellules eucaryotes et pour survivre à l’intérieur de différents compartiments subcellulaires. Cet article décrit un test de protection enzymatique pour étudier l’étendue de l’internalisation de S. aureus et sa survie intracellulaire dans les cellules phagocytaires non professionnelles adhérentes (NPPC) ainsi que l’efficacité intracellulaire des composés antimicrobiens. Les CENTRALESN sont cultivées dans une plaque multipuit jusqu’à ce qu’elles atteignent 100 % de confluence. Les cultures de S. aureus sont cultivées pendant la nuit dans un milieu de culture cellulaire. La suspension bactérienne est diluée en fonction du nombre de cellules par puits pour inoculer les cellules à une multiplicité contrôlée d’infection. Les cellules inoculées sont incubées pendant 2 h pour permettre aux bactéries d’être internalisées par les NPPC, après quoi la lysostaphine est ajoutée au milieu de culture pour tuer sélectivement les bactéries extracellulaires. La lysostaphine est présente dans le milieu de culture pour le reste de l’expérience.
À ce stade, les cellules infectées pourraient être incubées avec des composés antimicrobiens pour évaluer leurs activités intracellulaires contre S. aureus. Ensuite, les cellules sont lavées trois fois pour éliminer les médicaments, et la charge intracellulaire de S. aureus est ensuite quantifiée en cultivant sur des plaques de gélose. Alternativement, pour étudier les facteurs de virulence staphylococciques impliqués dans la survie intracellulaire et la toxicité cellulaire, la lysostaphine pourrait être inactivée avec la protéinase K pour éliminer le besoin d’étapes de lavage. Cette astuce améliore la fiabilité de la quantification de la charge bactérienne intracellulaire, en particulier si les cellules ont tendance à se détacher de la plaque de culture lorsqu’elles sont fortement infectées en raison de la multiplication de S. aureus intracellulaire. Ces protocoles peuvent être utilisés avec pratiquement tous les types de NPPC adhérents et avec des modèles de culture cellulaire 3D tels que les organoïdes.
Introduction
Staphylococcus aureus est à la fois un agent pathogène potentiellement mortel et une bactérie commensale de la peau et de la muqueuse qui colonise deux milliards d’individus dans le monde1. Chez l’homme, les porteurs nasaux de S. aureus ont un risque accru d’infection par leur propre souche de portage; toutefois, les déterminants multifactoriels du transport muqueux de S. aureus ne sont toujours pas clairs1,2. En plus des infections aiguës, les patients peuvent également développer des infections chroniques à S. aureus qui sont souvent difficiles à guérir3. Une meilleure compréhension des interactions hôte-pathogène pendant la colonisation et l’infection est cruciale pour développer de nouvelles stratégies thérapeutiques et améliorer la prise en charge des patients.
In vitro, S. aureus peut déclencher son internalisation dans les cellules hôtes exprimant l’intégrine α5β14. L’interaction tripartite entre les protéines staphylococciques de liaison à la fibronectine ancrées à la paroi cellulaire de S. aureus, la fibronectine et l’intégrine β1 exprimée à la surface de la cellule hôte est bien connue comme la principale voie d’internalisation de S. aureus dans les NPPC tels que les kératinocytes, les ostéoblastes, les fibroblastes et les cellules épithéliales et endothéliales4. Des études récentes montrent que S. aureus peut être trouvé à l’intérieur des cellules humaines lors de la colonisation nasale5,6 et de l’infection7. Cependant, le rôle du réservoir intracellulaire dans la pathogenèse de l’infection à S. aureus reste incertain. Les cellules hôtes pourraient servir d’abri à S. aureus, qui est protégé à la fois du système immunitaire8 et de la plupart des composés antimicrobiens6,9.
Le test de protection contre la lysostaphine, décrit par Proctor10 plus tôt dans les années 1980, permet d’étudier les facteurs bactériens et hôtes impliqués dans l’internalisation des isolats de S. aureus. La lysostaphine est une bactériocine produite par Staphylococcus simulans, qui présente une activité puissante contre presque tous les isolats de S. aureus, y compris les souches résistantes aux antibiotiques11. La lysostaphine a été utilisée pour détruire uniquement S. aureus extracellulaire afin de permettre le comptage des seules bactéries intracellulaires viables12. Cette technique a été largement utilisée et a contribué à la découverte de plusieurs facteurs de virulence de S. aureus. La gentamycine, seule et combinée avec la lysostaphine, est également largement utilisée pour étudier les bactéries intracellulaires.
Cependant, une étude récente a montré que la gentamycine pénètre dans les cellules eucaryotes et atteint les bactéries internalisées de manière dépendante du temps et de la concentration13. Cette étude a également démontré que le lysostaphine ne pénètre pas dans les cellules eucaryotes, confirmant qu’un test de protection enzymatique (EPA) à base de lysostaphine est le test le plus précis pour quantifier la charge intracellulaire de S. aureus par culture13. Quel que soit le composé utilisé pour détruire les bactéries extracellulaires (par exemple, la lysostaphine ou la ggéntamycine), il doit être éliminé en lavant les cellules avant de plaquer S. aureus intracellulaire sur des plaques d’agar. Les lavages successifs peuvent entraîner le détachement des cellules, en particulier des cellules peu adhérentes (par exemple, des cellules fortement infectées), ce qui entraînerait une sous-estimation de la charge intracellulaire de S. aureus . Cet article décrit en détail comment l’EPA peut être utilisé pour quantifier la charge intracellulaire de S. aureus et pour mesurer l’efficacité intracellulaire des composés antimicrobiens à l’aide d’un modèle in vitro . Il est à noter qu’une méthode simple a été proposée pour améliorer la fiabilité de la quantification de la charge intracellulaire en évitant les lavages intensifs.
Protocole
1. Culture de cellules épithéliales humaines
- Préparer un milieu de culture complet avec le milieu Eagle modifié (DMEM) de Dulbecco avec du rouge phénol, complété par 10% de sérum fœtal bovin (FBS) sans antibiotiques.
- Cultiver des cellules épithéliales A549 dans un milieu de culture complet à 36 ± 1 °C dans 5 % de CO2. S’assurer de l’utilisation d’un récipient de culture de taille appropriée pour avoir suffisamment de cellules pour les étapes suivantes (voir l’étape 1.10).
REMARQUE: Une fiole de 75 cm2 (T-75) est suffisante pour ensemencer deux plaques de 24 puits et sous-cultiver les cellules. - Deux jours avant l’infection, préparez une seule assiette de 24 puits.
- Retirer et jeter le milieu de culture usé de la fiole T-75 et laver les cellules une fois avec 10 mL de solution saline tamponnée au phosphate (DPBS) de Dulbecco.
- Ajouter 5 mL de trypsine-EDTA et incuber les cellules pendant 5 min à 36 ± 1 °C dans 5 % de CO2.
- Ajouter 5 mL de milieu de culture complet et transférer les cellules dans un tube.
- Centrifuger les cellules pendant 5 min à 300 × g.
- Jeter le surnageant et remettre les cellules en suspension dans 10 mL de milieu de culture complet frais.
- Comptez les cellules avec un compteur de cellules automatique (ou une chambre de comptage).
- Diluer les cellules dans un milieu de culture complet pour préparer 30 mL de suspension cellulaire à une concentration de 2,0 × 105 cellules/mL.
- Ajouter 1 mL de suspension cellulaire à chaque puits d’une plaque de 24 puits, ce qui correspond à une densité cellulaire d’environ 1,0 × 105 cellules/cm² pour une surface de puits de 2 cm².
- Incuber les cellules pendant 48 h à 36 ± 1 °C dans 5 % de CO2 jusqu’à ce qu’elles atteignent 100 % de confluence.
REMARQUE : En plus des conditions à tester, trois puits doivent être réservés au comptage cellulaire le jour de l’infection (voir étape 3.1.4). Selon le nombre de conditions à tester, jusqu’à deux plaques de 24 puits peuvent être préparées simultanément. Les volumes indiqués dans le protocole devraient être augmentés en conséquence.
2. Culture de souches de S. aureus
- Deux jours avant l’infection, préparez un milieu infectieux complet avec DMEM glucose élevé sans rouge phénol, complété par 10% FBS sans antibiotiques.
- Décongeler les souches de S. aureus à tester sur des plaques de gélose.
- Incuber les plaques de gélose pendant 18-24 h à 36 ± 1 °C.
- La veille de l’inoculation, inoculer une colonie de la souche de S. aureus à tester dans 10 mL de milieu infectieux complet.
- Incuber les bactéries pendant 18-24 h à 36 ± 1 °C en agitant à 160 tr/min. Utilisez des tubes de 50 mL maintenus à 45° pour éviter que les bactéries ne se déposent.
REMARQUE: Avant de commencer avec une nouvelle souche, il est recommandé de vérifier sa susceptibilité à la lysostaphine dans les mêmes conditions de culture que celles qui seront utilisées pour d’autres expériences (milieux, charges bactériennes et concentration de lysostaphine et temps d’incubation). Il est également important de déterminer la charge bactérienne correspondant à une OD600nm de 0,5 car elle pourrait varier légèrement d’une souche à l’autre. Les conditions de culture des souches bactériennes pourraient être adaptées en fonction de l’objectif expérimental.
3. Dosage de l’infection avec S. aureus
- Détermination de la densité cellulaire et de la viabilité
- Retirer et jeter le milieu de culture usé des trois puits dédiés au comptage des cellules A549.
- Ajouter 1 mL de milieu infectieux complet contenant 5 μg/mL de Hoechst 33342 et 1 μg/mL d’iodure de propidium.
REMARQUE: Hoechst 33342 est un mutagène connu et doit être manipulé avec soin. L’iodure de propidium, un mutagène potentiel, doit être manipulé avec soin et éliminé en toute sécurité conformément à la réglementation applicable. - Incuber les cellules pendant 30 min à 36 ± 1 °C dans 5% de CO2.
- Comptez le nombre de cellules et calculez la viabilité des cellules à l’aide d’un microscope à fluorescence à champ maniable.
REMARQUE: Si un microscope à fluorescence n’est pas disponible, la densité et la viabilité des cellules peuvent être calculées avec la coloration au bleu trypan à l’aide d’une chambre de comptage cellulaire.
- Préparation de la suspension bactérienne
- Distribuer 25 mL de milieu infectieux complet dans un tube et préchauffer à 36 ± 1 °C.
- Réglez la suspension de S. aureus à un DOD600nm de 0,5 dans un milieu d’infection complet à l’aide d’un densimètre cellulaire.
- Préparer 20 mL de suspension bactérienne pour l’inoculation cellulaire en diluant le 0,5 OD600nm dans un milieu infectieux complet pour obtenir une multiplicité d’infection (MOI) de 1 selon le nombre de cellules par puits.
NOTE : Le MOI correspond au nombre de bactéries ajoutées par cellule dans chaque puits. Par exemple, pour obtenir un MOI de 1 avec 1,0 × 106 cellules par puits, préparez une suspension bactérienne à 2,0 × 106 UFC/mL afin que 106 UFC puissent être ajoutés dans un volume de 500 μL (voir étape 3.3.3). Le MOI peut être ajusté en fonction des types de cellules et des souches bactériennes à tester. - Utilisez une plaque spirale automatique pour déterminer la charge de S. aureus de la suspension bactérienne diluée à utiliser pour l’étape d’inoculation cellulaire.
- Incuber les plaques de gélose pendant 18-24 h à 36 ± 1 °C.
- Le lendemain, comptez le nombre de colonies avec un compteur de colonies pour calculer le MOI précis pour chaque souche testée.
REMARQUE: Si aucune plaque spirale automatique n’est disponible, la charge bactérienne peut être déterminée par dilution en série sur une plaque de gélose. Voir le manuel d’analyse bactériologique pour plus de détails14.
- Inoculation cellulaire
- Observez chaque puits de la plaque de 24 puits par microscopie à faible grossissement pour vous assurer que les cellules sont en bonne santé et se développent comme prévu.
- Retirer et jeter le milieu de culture cellulaire usé de la plaque de 24 puits.
- Ajouter 500 μL de la suspension bactérienne pour l’inoculation à chaque puits avec des cellules 100% confluentes.
- Incuber les cellules pendant 2 h à 36 ± 1 °C et 5 % de CO2.
REMARQUE: il est recommandé d’utiliser trois puits de la plaque pour chaque condition à tester (triple) et d’effectuer au moins trois expériences indépendantes. Le délai d’incubation peut être adapté en fonction de l’objectif expérimental.
- Quantification des bactéries intracellulaires avec un test de protection enzymatique amélioré (iEPA)
- Préparer 7 mL de tampon de lyse 4x avec 3,5 mL de Triton X-100 à 2 % dans de l’eau stérile et 3,5 mL de trypsine-EDTA.
- Préparer une solution mère de lysostaphine à 10 mg/mL dans un tampon d’acétate et aliquoter 25 μL dans des cryoviales. Conserver à -80 °C jusqu’à 6 mois.
- Préparer 250 μL d’une solution de travail de lysostaphine fraîche à 1 mg/mL en mélangeant 25 μL de la solution mère de lysostaphine (10 mg/mL) et 225 μL de 0,1 M Tris-HCl. Conserver à 4 °C jusqu’à 48 h.
- Préparer 6,25 mL de milieu infectieux complet complété par de la lysostaphine en ajoutant 6 mL de milieu infectieux complet à 250 μL de la solution de travail de lysostaphine.
- Ajouter 250 μL de milieu infectieux complet complété par de la lysostaphine dans chaque puits et agiter doucement la plaque en faisant pivoter la plaque à la main.
- Incuber les cellules pendant 1 h à 36 ± 1 °C dans 5 % de CO2 pour permettre à la lysostaphine de tuer les bactéries extracellulaires.
- À la fin du temps d’incubation, ajouter 10 μL de protéinase K à 20 mg/mL dans chaque puits pour inactiver la lysostaphine.
- Incuber les cellules pendant 2 min à température ambiante.
- Ajouter 250 μL de tampon de lyse 4x pour lyser les cellules par choc osmotique.
- Incuber les cellules pendant 10 min à 36 ± 1 °C.
- Mélangez bien en pipetant de haut en bas dix fois tout au fond du puits pour vous assurer que les cellules sont entièrement lysées et homogénéisées.
- Utilisez une plaqueuse spirale automatique pour déterminer la charge de S. aureus de chaque puits.
- Incuber les plaques de gélose pendant 18-24 h à 36 ± 1 °C.
- Le lendemain, comptez le nombre de colonies avec un compteur de colonies pour calculer la charge intracellulaire de S. aureus de chaque puits.
- Mesure de l’efficacité intracellulaire des composés antimicrobiens avec dosage de protection enzymatique (EPA)
- Préparer 25 mL de tampon de lyse 1x avec 3,125 mL de Triton X-100 à 2 % dans de l’eau stérile, 6,25 mL de trypsine-EDTA et 15,625 mL d’eau stérile.
- Préparer 250 μL d’une solution de travail de lysostaphine fraîche à 1 mg/mL en mélangeant 25 μL d’une solution mère de lysostaphine (10 mg/mL) et 225 μL de 0,1 M Tris-HCl.
- Préparer 25 mL de milieu infectieux complet complété par de la lysostaphine en ajoutant 24,75 mL de milieu infectieux complet à 250 μL de la solution de travail de lysostaphine.
- Pour chaque composé antimicrobien à tester, préparer 3,1 mL de milieu infectieux complet complété par de la lysostaphine et le composé antimicrobien à la concentration à étudier.
- Retirer et jeter le milieu de culture cellulaire usé de la plaque de 24 puits.
- Ajouter 1 mL de milieu infectieux complet complété par de la lysostaphine.
- Incuber les cellules pendant 1 h à 36 ± 1 °C dans 5 % de CO2 pour permettre à la lysostaphine de tuer les bactéries extracellulaires.
- Retirer et jeter le milieu supplémenté en lysostaphine de la plaque de 24 puits.
- Remplir trois puits avec 1 mL de milieu complété par de la lysostaphine plus le composé antimicrobien à tester.
- Répétez l’étape 3.5.9 pour chaque composé antimicrobien à tester.
- Pour la condition de contrôle, remplissez trois puits avec 1 mL de milieu complété par de la lysostaphine sans aucun composé antimicrobien.
- Incuber les cellules pendant 24 h à 36 ± 1 °C dans 5 % de CO2.
- À la fin de la période d’incubation, retirer et jeter le milieu usé et laver doucement chaque puits trois fois avec du DPBS stérile avec Du CaCl2 et du MgCl2.
- Ajouter 1 mL de tampon de lyse 1x à chaque puits pour détacher et lyser les cellules par choc osmotique.
- Incuber les cellules pendant 10 min à 36 ± 1 °C.
- Mélangez soigneusement en pipetant de haut en bas dix fois sur tout le puits pour vous assurer que les cellules sont entièrement lysées et homogénéisées.
- Utilisez une plaqueuse spirale automatique pour déterminer la charge de S. aureus de chaque puits.
- Incuber les plaques de gélose pendant 18-24 h à 36 ± 1 °C.
- Le lendemain, comptez le nombre de colonies avec un compteur de colonies pour calculer la charge intracellulaire de S. aureus de chaque puits.
REMARQUE: L’activité intracellulaire de chaque composé antimicrobien doit être calculée en fonction de la charge bactérienne de la condition de contrôle. Il est également important de vérifier la cytotoxicité de tous les composés antimicrobiens pour prouver que les différences observées entre le témoin et les composés ne sont pas dues à la mort cellulaire.
Résultats
Les résultats de l’internalisation de S. aureus par les cellules épithéliales A549 sont représentés à la figure 1A. Les cellules A549 ont été inoculées avec S. aureus SF8300 WT et SF8300 ΔfnbA/B, qui manque de protéines de liaison à la fibronectine A et B, à un MOI de 1 pendant 2 h. Pour détruire S. aureus extracellulaire, la lysostaphine a été ajoutée au milieu de culture et les cellules ont été incubées pendant 1 h. Ensuite, la lysostaphine a été soit éliminée par lavage pour l’EPA, soit inactivée avec la protéinase K pour l’iEPA. Ensuite, les cellules ont été perturbées dans le tampon de lyse, et la charge bactérienne a été quantifiée par culture. En utilisant l’EPA, les charges intracellulaires moyennes étaient de 4,46 et 0,49 Log CFU/mL pour SF8300 WT et SF8300 ΔfnbA/B, respectivement (Figure 1A, barres vertes). En utilisant l’iEPA, les charges intracellulaires moyennes étaient de 4,53 et 0,56 Log UFC/mL pour SF8300 WT et SF8300 ΔfnbA/B, respectivement (Figure 1A, barres rouges). Il est intéressant de noter que l’EPA et l’iEPA ont montré des résultats similaires, ce qui peut s’expliquer par la facilité d’effectuer les lavages lorsque les cellules sont en bon état et parce que la cytotoxicité induite par S. aureus est très faible dans ces contextes expérimentaux (données non montrées).
Les résultats de l’activité intracellulaire de la vancomycine, de la rifampicine et de la lévofloxacine contre S. aureus sont représentés à la figure 1B. Pour mesurer l’activité intracellulaire de ces antibiotiques, les cellules HaCaT ont été inoculées avec S. aureus ATCC 29213 à un MOI de 1 pendant 2 h. Les cellules ont été incubées avec de la lysostaphine, avec ou sans les composés antimicrobiens à tester, pendant 24 heures. Ensuite, la lysostaphine et les composés antimicrobiens ont été éliminés par lavage. Les cellules ont été perturbées dans le tampon de lyse et la charge bactérienne a été quantifiée par culture. Les charges intracellulaires moyennes étaient de 4,57, 4,51, 3,03 et 2,91 log UFC/mL pour le contrôle, la vancomycine (50 μg/mL), la rifampicine (7 μg/mL) et la lévofloxacine (10 μg/mL), respectivement (figure 1B).
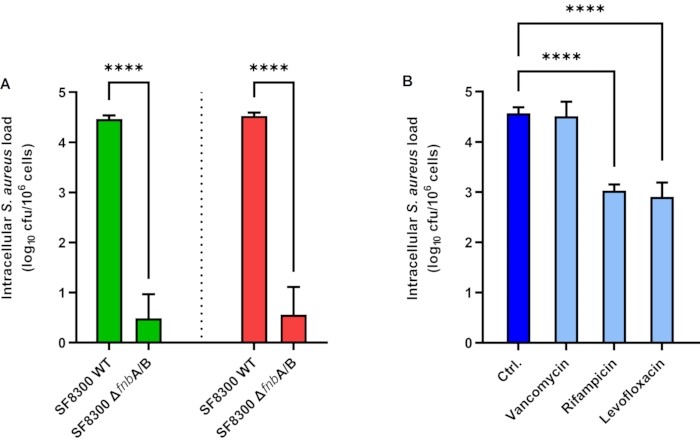
Figure 1 : Charge intracellulaire de Staphylococcus aureus dans les cellules épithéliales. (A) Dosage de protection enzymatique (barres vertes) et dosage amélioré de protection enzymatique (barres rouges) dans les cellules A549 infectées par S. aureus SF8300 WT et ΔfnbA/B. (B) Activité intracellulaire des composés antimicrobiens dans les cellules HaCaT infectées par S. aureus ATCC 29213. Les barres représentent les valeurs moyennes de trois expériences indépendantes réalisées en trois exemplaires. Les barres d’erreur représentent les écarts-types. p < 0,0001. Abréviations : Ctrl = contrôle ; ufc = unités formant des colonies. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les essais décrits ici sont utiles pour étudier l’étendue de l’internalisation et la survie intracellulaire de S. aureus dans les NPPC, ainsi que l’efficacité intracellulaire des composés antimicrobiens6,15,16. Certaines étapes des deux protocoles d’essai peuvent être critiques. L’état de santé et la densité des cellules doivent être parfaitement contrôlés et cohérents entre des expériences indépendantes. L’inoculum bactérien doit être soigneusement standardisé pour obtenir un MOI réel proche du MOI théorique ciblé. En général, il faut veiller à ne détacher aucune des cellules lors du pipetage. Les lavages pour éliminer la lysostaphine et les antibiotiques sont des étapes critiques de l’EPA. L’utilisation de la protéinase K s’est avérée améliorer cette étape lorsqu’aucun antibiotique n’est utilisé (voir ci-dessous). Enfin, les cellules doivent être complètement détachées dans chaque puits et complètement homogénéisées après l’incubation avec le tampon de lyse pour quantifier de manière fiable la charge intracellulaire de S. aureus.
Dans certains cas, des problèmes peuvent être rencontrés et plusieurs points doivent d’abord être vérifiés. En cas de manque de reproductibilité, il faut garder à l’esprit que S. aureus peut former des amas, rendant la quantification par absorbance inexacte. L’agglutination des bactéries peut être augmentée par des étapes de centrifugation et de lavage si le milieu de culture doit être remplacé (par exemple, pour éliminer une protéine sécrétée). La suspension bactérienne doit être utilisée rapidement car les bactéries continuent de se développer à température ambiante. L’efficacité de la lysostaphine pourrait diminuer en raison de conditions de stockage incorrectes, d’un pH sous-optimal pour l’activité enzymatique dans les milieux de culture, de la variabilité de l’activité enzymatique entre les lots et les fournisseurs et du manque de sensibilité à la lysostaphine de certaines souches dans des conditions de croissance spécifiques. Le rouge phénol pourrait avoir un léger effet bactériostatique, en particulier lorsque le milieu de culture est relativement pauvre en nutriments par rapport aux bouillons typiques utilisés pour la croissance des bactéries. Ainsi, il est conseillé d’utiliser un milieu de culture cellulaire sans rouge phénol, ce qui améliore également les observations microscopiques à fluorescence en réduisant le bruit de fond.
Bien que cette méthode soit un outil précieux pour étudier le devenir intracellulaire de différentes souches, certaines limites de la méthode doivent être prises en compte. L’utilisation d’un MOI très élevé peut surcharger la capacité d’internalisation par les CENTRALES et niveler les différences entre les différentes souches testées. L’étendue de l’internalisation des souches les plus cytotoxiques peut être sous-estimée car la lysostaphine (ou antibiotiques) détruit rapidement S. aureus qui est libérée par les cellules endommagées. Ainsi, les expériences de longue durée (c’est-à-dire pour étudier la survie intracellulaire ou l’activité intracellulaire des antibiotiques) sont plus faciles à mettre en place avec des souches à faible cytotoxicité. Par conséquent, le temps d’incubation et le MOI doivent être ajustés avec précision en fonction de la virulence de la souche, du type de cellule et de l’objectif expérimental.
La méthode décrite ici avec l’utilisation de la lysostaphine est plus fiable que celles à base de gentamicine car, contrairement à la lysostaphine, la gentamicine a tendance à être internalisée par les cellules hôtes13. L’autre avantage est la possibilité d’inactiver la lysostaphine. L’inhibition de l’activité de la lysostaphine a été rapportée par Kim et al.13 avec l’utilisation d’EDTA pour chélater les ions zinc ou la 1,10-phénanthroline; cependant, des lavages intensifs sont toujours nécessaires pour éliminer l’enzyme avant le placage de la bactérie. Ici, la protéinase K permet une inactivation rapide de la lysostaphine. Nous avons observé que les cellules ont tendance à se détacher de la plaque de culture lorsqu’elles sont fortement infectées en raison de la multiplication de S. aureus intracellulaire. En sautant l’étape finale de lavage, la méthode iEPA a grandement simplifié la manipulation technique et permis la récupération des bactéries internalisées dans des cellules faiblement adhérentes ou déjà détachées.
Les réactifs et les tampons plus concentrés utilisés dans l’iEPA ont également contribué à réduire l’effort de pipetage et à minimiser la perte de cellules. En outre, iEPA peut être utilisé avec des cellules en suspension, ainsi qu’avec des organoïdes difficiles à laver. En conclusion, les tests de protection enzymatique permettent d’étudier l’étendue de l’internalisation et le devenir intracellulaire de S. aureus, ainsi que l’activité intracellulaire des médicaments antimicrobiens avec différents modèles in vitro . Des améliorations devraient être apportées pour mieux caractériser la relation entre l’internalisation et la cytotoxicité afin de mieux apprécier l’importance de développer des médicaments capables d’atteindre S. aureus à l’intérieur de la cellule.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Les souches sf8300 WT et SF8300 ΔfnbA/B de S. aureus ont été généreusement offertes par le professeur Binh Diep (Université de Californie, San Francisco, États-Unis). Ce travail a été soutenu par une subvention de l’association FINOVI (#AO13 FINOVI) sous l’égide de la Fondation pour l’Université de Lyon.
matériels
| Name | Company | Catalog Number | Comments |
| 24-well plate | CORNING-FALCON | 353047 | |
| A549 cell line | ATCC | CCL-185 | |
| Acetate buffer solution pH 4.6 | Fluka | 31048 | Used to prepare lysostpahine stock solution at 10 mg/mL in 20 mM sodium acetate. |
| AMBICIN (Recombinant lysostaphin) | AMBI | LSPN-50 | Lyophilized recominant lysostaphin. Freeze at -80 °C for long-term storage. |
| COS - Colombia agar + 5% sheep blood | Biomerieux | 43049 | Any agar plate suitable for growing staphylococci can be used instead. |
| Densitometer WPA CO8000 | Biochrom Ltd. | 80-3000-45 | Cell density meter |
| Dulbecco’s Modified Eagle’s Medium, high glucose with phenol red | Sigma-Aldrich | D6429 | |
| Dulbecco’s Modified Eagle’s Medium, high glucose without phenol red | Sigma-Aldrich | D1145 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dulbecco′s Phosphate-buffered Saline with MgCl2 and CaCl2, sterile-filtered | Sigma-Aldrich | D8662 | |
| Dulbecco′s Phosphate-buffered Saline, sterile-filtered | Sigma-Aldrich | D8537 | |
| Easyspiral dilute | Interscience | 414000 | Automatic diluter and spiral plater |
| Fetal bovine serum | Gibco | 10270-106 | |
| HaCaT cell line | Cell lines service (CLS) | 300493 | |
| Hoechst 33342, Trihydrochloride, Trihydrate, 10 mg/mL Solution in Water | Fisher scientific | 11534886 | |
| Propidium iodide, 1.0 mg/mL solution in water | Invitrogen | P3566 | |
| Proteinase K, recombinant 20 mg/mL | Eurobio | GEXPRK01-B5 | > 30 U/mg, lot 901727 |
| Scan 4000 | Interscience | 438000 | Automatic colony counter |
| Sterile water | OTEC | 600500 | |
| T-75 culture flask | CORNING-FALCON | 353136 | |
| TC20 Automated cell counter | Biorad | 1450102 | Automatic cell counter |
| Tris 1 M pH 8.0 | Invitrogen | AM9855G | Used to prepare lysostaphine working solution at 1 mg/mL in 0.1 M Tris-HCl. |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Trypsin - EDTA solution | Sigma-Aldrich | T3924 | 0.05% porcine trypsin and 0.02% EDTA in Hanks′ Balanced Salt Solution with phenol red |
| Wide-field fluorescence microscope | Nikon | Ti2 |
Références
- Verhoeven, P. O., et al. Detection and clinical relevance of Staphylococcus aureus nasal carriage: an update. Expert Review of Anti-Infective Therapy. 12 (1), 75-89 (2014).
- Gagnaire, J., et al. Epidemiology and clinical relevance of Staphylococcus aureus intestinal carriage: a systematic review and meta-analysis. Expert Review of Anti-Infective Therapy. 15 (8), 767-785 (2017).
- Tong, S. Y. C., Davis, J. S., Eichenberger, E., Holland, T. L., Fowler, V. G. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clinical Microbiology Reviews. 28 (3), 603-661 (2015).
- Josse, J., Laurent, F., Diot, A. Staphylococcal adhesion and host cell invasion: fibronectin-binding and other mechanisms. Frontiers in Microbiology. 8, 2433(2017).
- Hanssen, A. -M., et al. Localization of Staphylococcus aureus in tissue from the nasal vestibule in healthy carriers. BMC Microbiology. 17 (1), 89(2017).
- Rigaill, J., et al. Evaluation of the intracellular efficacy of antimicrobial agents used for Staphylococcus aureus decolonization in a cell model mimicking nasal colonization. Journal of Antimicrobial Chemotherapy. 73 (11), 3044-3048 (2018).
- Yang, D., et al. Novel insights into Staphylococcus aureus deep bone infections: the Involvement of osteocytes. mBio. 9 (2), 00415-00418 (2018).
- Tuchscherr, L., et al. Staphylococcus aureus phenotype switching: an effective bacterial strategy to escape host immune response and establish a chronic infection. EMBO Molecular Medicine. 3 (3), 129-141 (2011).
- Valour, F., et al. Antimicrobial activity against intraosteoblastic Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 59 (4), 2029-2036 (2015).
- Proctor, R. A., Prendergast, E., Mosher, D. F. Fibronectin mediates attachment of Staphylococcus aureus to human neutrophils. Blood. 59 (4), 681-687 (1982).
- Climo, M. W., Ehlert, K., Archer, G. L. Mechanism and suppression of lysostaphin resistance in oxacillin-resistant Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 45 (5), 1431-1437 (2001).
- Bur, S., Preissner, K. T., Herrmann, M., Bischoff, M. The Staphylococcus aureus extracellular adherence protein promotes bacterial internalisation by keratinocytes independent of fibronectin-binding proteins. Journal of Investigative Dermatology. 133 (8), 2004-2012 (2013).
- Kim, J. -H., Chaurasia, A. K., Batool, N., Ko, K. S., Kim, K. K. Alternative enzyme protection assay to overcome the drawbacks of the gentamicin protection assay for measuring entry and intracellular survival of Staphylococci. Infection and Immunity. 87 (5), 00119(2019).
- Maturin, L., Peeler, J. T. Aerobic plate count. Bacteriological Analytical Manual., Edition 8, Revision A. 3, Available from: https://www.fda.gov/food/laboratory-methods-food/bam-chapter-3-aerobic-plate-count 3(2021).
- Kolenda, C., et al. Evaluation of the activity of a combination of three bacteriophages alone or in association with antibiotics on Staphylococcus aureus embedded in biofilm or internalized in Osteoblasts. Antimicrobial Agents and Chemotherapy. 64 (3), 02231(2020).
- Abad, L., et al. Antibiofilm and intraosteoblastic activities of rifamycins against Staphylococcus aureus: promising in vitro profile of rifabutin. Journal of Antimicrobial Chemotherapy. 75 (6), 1466-1473 (2020).
Erratum
Formal Correction: Erratum: Improved Enzyme Protection Assay to Study Staphylococcus aureus Internalization and Intracellular Efficacy of Antimicrobial Compounds
Posted by JoVE Editors on 1/19/2022. Citeable Link.
An erratum was issued for: Improved Enzyme Protection Assay to Study Staphylococcus aureus Internalization and Intracellular Efficacy of Antimicrobial Compounds. One of the affiliations was updated.
The fifth affiliation was updated from:
Département de Bactériologie, Institut des Agents Infectieux, Hospices Civils de Lyon, Lyon, France
to:
Department of Bacteriology, Institute for Infectious Agents, Hospices Civils de Lyon, Lyon, France
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon