Method Article
引发分枝杆菌葡萄膜炎(PMU)作为感染后葡萄膜炎的模型
摘要
该协议概述了在小鼠中诱导启动分枝杆菌葡萄膜炎(PMU)的步骤。该方法概述了帮助在小鼠模型系统中产生可靠和强大的眼部炎症的步骤。使用该协议,我们从单个动物中生成了葡萄膜眼和未发炎的同伴眼睛,以便通过免疫学,转录组学和蛋白质组学测定进行进一步评估。
摘要
术语"葡萄膜炎"描述了一组异质性疾病,这些疾病都具有眼内炎症。从广义上讲,葡萄膜炎由病因定义:感染或自身免疫。感染性葡萄膜炎需要使用适当的抗菌药物治疗,而自身免疫性葡萄膜炎需要使用皮质类固醇或其他免疫抑制剂进行治疗。感染后葡萄膜炎是慢性葡萄膜炎的一种形式,需要皮质类固醇来控制初始感染后的免疫后遗症。与 结核分枝杆菌 (Mtb) 感染相关的葡萄膜炎是一种公认的感染后葡萄膜炎形式,但疾病机制尚不完全清楚。为了了解分枝杆菌抗原和先天配体在刺激mTB感染后慢性眼部炎症中的作用,开发了用于小鼠的模型启动分枝杆菌葡萄膜炎(PMU)。本手稿概述了使用色底和光学相干断层扫描 (OCT) 成像生成 PMU 和监测炎症临床病程的方法。PMU是通过用热杀灭分枝杆菌提取物免疫,然后在7天后将同一提取物玻璃体内注射到一只眼睛中来诱导的。使用体内成像纵向监测眼部炎症,然后采集样本以进行各种测定,包括组织学、流式细胞术、细胞因子分析、qPCR 或 mRNA 测序。PMU小鼠模型是研究眼部对mTB的反应,慢性葡萄膜炎的机制以及新抗炎疗法的临床前有效性测试的有用新工具。
引言
术语"葡萄膜炎"描述了一组以眼内炎症为特征的异质性疾病1。葡萄膜炎的动物模型对于了解疾病机制和新疗法的临床前测试非常重要。已经建立了许多葡萄膜炎的动物模型2。研究最广泛的两种是实验性自身免疫性葡萄膜炎(或葡萄膜视网膜炎;EAU)和内毒素诱导的葡萄膜炎(EIU)。EAU 通常由眼部抗原免疫产生,或者在缺乏 AIRE 基因3,4 的情况下中枢耐受性被破坏时自发发生。此后开发了该模型的其他变体5,6,7,以包括不同的葡萄质激素肽;这些已经广泛审查了8,9,10。EAU是T细胞依赖性自身免疫性葡萄膜炎的主要模型,例如Vogt-Koyanagi-Harada病和人类鸟射脉络膜视网膜炎。EIU是通过全身或局部注射细菌脂多糖(LPS)产生的10,11。EIU已被用作由先天免疫信号通路激活产生的急性葡萄膜炎的模型12。这两种模型都有助于目前对眼部免疫学的理解,但对于感染后慢性葡萄膜炎,两者都不是有效的模型。最近在小鼠中建立的启动分枝杆菌葡萄膜炎(PMU)模型现在提供了一种询问和评估这种葡萄膜炎的临床和细胞方面的方法13。
全球分枝杆菌感染患病率很高,世界卫生组织在2019年报告了超过1000万例新发病例和140多万例死亡14。活动性结核 (TB) 感染的肺外表现包括葡萄膜炎,是感染性葡萄膜炎的公认病因15,16。结核相关性葡萄膜炎的表现是多变的,这可能反映了多种不同的疾病机制,包括直接眼部感染以及不太清楚的免疫介导炎症17,18,19。这些感染后后遗症的拟议机制包括由视网膜色素上皮(RPE)中少杆菌感染的持续刺激的慢性炎症反应,由成功清除的眼部感染的残留病原体相关分子模式(PAMP)的存在刺激的慢性炎症反应,以及通过分子模拟或抗原过程对眼部抗原的适应性免疫应答的不适当激活 由全身性结核感染引起的传播20,21,22,23。
为了更好地了解慢性感染后葡萄膜炎的机制并研究分枝杆菌抗原在疾病引发中的作用,开发了用于小鼠的PMU模型13,24。因此,为了引起炎症,小鼠首先接受来自热杀死的结核分枝杆菌H37Ra菌株的皮下注射抗原以模拟全身感染,然后在7天后玻璃体内注射相同的抗原施用于左眼或右眼以模拟局部眼部感染。随后的葡萄膜炎的强度和持续时间通过纵向体内光学相干断层扫描(OCT)和眼底成像监测25。PMU的特征是急性骨髓显性全葡萄膜炎,发展为慢性T细胞显性后葡萄膜炎,伴有玻璃体炎,血管周围视网膜炎症和视网膜外损伤的局灶性区域26。眼睛后段存在肉芽肿性炎症表明,PMU 模型可用于研究某些形式的前部(肉芽肿性和非肉芽肿性)和中间葡萄膜炎,见于有既往 Mtb 感染免疫学证据的患者27。此外,PMU模型中使用的热杀伤Mtb成分被认为可以触发对抗结核治疗(ATT)有反应的眼结核患者复发性葡萄膜炎方面的免疫反应28。由于与EAU和EIU相比,疾病起始和炎症过程的差异,PMU代表了葡萄膜炎的新动物模型,它不依赖于眼部抗原免疫,可能有助于阐明慢性葡萄膜炎患者的疾病机制。该协议概述了产生PMU,监测炎症临床过程以及收集眼部样本以进行流式细胞术尸检分析的方法。
研究方案
所有执行的程序均由华盛顿大学动物护理和使用委员会(动物研究协议#4481-02)在当地批准,或符合英国内政部许可证(PPL 30/3281)和布里斯托大学伦理审查小组。在这两个机构进行的实验符合视觉和眼科研究协会(ARVO)关于在眼科和视觉研究中使用动物的声明。PMU在6-10周龄的C57BL / 6J小鼠中产生;所有小鼠在葡萄膜炎诱导时体重至少为18g,并且被确认为Crb1基因29的R8突变阴性。 在特定的 无病原体条件下,用标准食物和药水(对乙酰氨基酚200-300mg / kg /天)随意维持小鼠。动物安乐死使用标准的二氧化碳吸入方法30进行。
1.皮下注射抗原制剂
- 在化学通风橱内执行本节中的所有程序,以防止吸入或皮肤接触 Mtb H37Ra 粉末。根据您的机构政策处理完全弗氏佐剂(通常为 BSL-1)。这包括使用耐化学腐蚀的手套、安全眼镜和防护工作服(实验室外套)。
- 使用良好的无菌技术来防止将引入实验动物的试剂污染。
- 通过在 5 mL 微量离心管中混合 5 mg 冻干、热杀灭结 核分枝杆菌 H37Ra 粉末与 2.5 mL 冷 PBS,在 PBS 中制备 Mtb 悬浮液。涡旋一次30秒,然后放在冰上。
- 为了在PBS中产生H37Ra的精细悬浮液,请将悬浮液在冰上超声处理5分钟。
- 松开转换器单元的主体,用 70% (v/v) 酒精棉签清洁探头。
- 打开超声仪,通过转动功率控制旋钮将功率设置调整为 4,然后将探头的尖端浸入含有 PBS 的分枝杆菌粉末中。确保探针尖端浸入样品深度的至少一半,并且探针尖端不接触微量离心管的壁。
- 将混合物在冰上超声处理30秒,暂停30秒,重复总共5分钟,以使粉末完全分散到均匀的悬浮液中,而无需加热液体。
- 向混合物中加入 2.5 mL 弗氏不完全佐剂,并在冰上重复超声处理过程,直到乳液形成牙膏状稠度。
- 使用控制旋钮将功率设置为 0,然后关闭设备以结束超声处理。从悬浮液中取出尖端,然后用酒精棉签擦拭探头。
- 将抗原乳剂储存在4°C。 分批制作乳液将有助于确保实验之间的一致性。乳液可在4°C下储存长达3个月。
2.皮下注射
- 在玻璃体内注射前一周进行皮下注射(指定为-7天)。
- 用分枝杆菌乳剂装入 1 mL 注射器(未连接针头)。由于乳液的粘度和不透明度,难以看到的气泡会充满注射器。
- 为防止注射器中出现气泡,在装入0.2-0.3毫升乳液后,倒置注射器(尖端朝上),并在计数器边缘反复轻轻敲击注射器,使气泡浮出水面。
- 从注射器中排出空气并继续填充注射器。倒置并间歇性点击直至填满。
- 将25 G针头放在注射器上,并推进乳液以填充针头。将注射器存放在冰上直至使用。
- 为了安全地进行皮下注射,要么麻醉小鼠,要么利用人道的约束方法,以便于接近动物后躯31。
- 为了麻醉皮下注射,将动物置于异氟醚诱导室中(诱导3%-4%,维持1%-3%)。麻醉后,确保小鼠呼吸频率缓慢且没有呼吸窘迫的迹象。
- 将皮下注射放在臀部的背表面,或腹股沟淋巴结区域近端的腿腹面。
- 小心地插入针头以防止注射到肌肉中。将 0.05 mL 的 Mtb 乳剂注入皮下腔。不要立即取出针头,以使浓稠的乳液完全注入。
- 在左侧和右侧重复注射,每只动物总共0.1mL。
- 如果麻醉,将鼠标放在温暖的加热垫上,直到完全恢复。在小鼠恢复足够的意识以维持胸骨卧位之前,不要让鼠标无人看管。
- 完全恢复后将小鼠放回笼子,并在笼卡上标记皮下注射日期。
- 口服对乙酰氨基酚(200 mg/kg/天)提供镇痛,但不能使用非甾体抗炎药,因为抗炎药会影响葡萄膜炎的诱导。
3.玻璃体内注射用抗原原液制备
- 在适当的无菌条件下执行本节中的所有程序,以防止玻璃体内Mtb悬浮液的污染。
- 进行玻璃体内悬浮液。
- 对于轻度至中度全葡萄膜炎的诱导,通过将 5 mg 分枝杆菌提取物加入 1 mL 的 1x PBS 中,使玻璃体内悬浮液浓度为 5 mg/mL。
- 对于中度至重度全葡萄膜炎的诱导,通过将 10 mg 分枝杆菌提取物添加到 1 mL 的 1x PBS 中,使玻璃体内悬浮液浓度为 10 mg/mL。
- 涡旋一次30秒,然后放在冰上。
- 为了在PBS中产生H37Ra的精细悬浮液,如步骤1.4中所述,将悬浮液在冰上超声处理10分钟。将该储备溶液分装在100μL体积中,并储存在-20°C。
- 使用前,在室温下解冻并在高温下涡旋1分钟。将等分试样放在冰上,同时运送到动物设施。
4. 第0天玻璃体内注射程序
- 动物制备
- 戴上合身的检查手套,将鼠标放在称量天平上,以获得其重量(克)。
- 腹膜内注射0.02mL/g体重含有100mg/mL氯胺酮和20mg/mL甲苯噻嗪的溶液,与无菌水混合,以麻醉动物。另一种方法是使用~1.5%异氟醚(吸入)进行诱导。
- 等待大约2分钟让鼠标入睡,然后将鼠标放入加热盒中并盖上盖子。进行疼痛反射测试,如耳朵、脚趾和尾巴捏,以评估手术的麻醉深度32.
- 入睡后,用1滴0.5%(v / v)丁卡因麻醉角膜。避免在小鼠的鼻子或嘴巴附近沾染丁卡因。10秒后,擦去多余的液体。
注意:据观察,局部麻醉时虹膜扩张和前房(AC)可视化得到改善,这可能是由于全身麻醉和局部麻醉联合改善了角膜反射抑制。但是,如果需要,可以省略此步骤。 - 用 1 滴 2.5% (v/v) 去氧肾上腺素扩张瞳孔。小心避免任何可能进入鼻子或嘴巴的多余飞沫。2-3分钟后,擦去多余的液体。
- 为了降低眼内炎的风险,在眼睛表面和周围的头发上添加1滴5%的甜菜碱。留在眼睛上2-3分钟。
注意:在适当的无菌条件下执行本节中的所有程序,以防止眼内炎。 - 去除甜菜碱并用羟丙甲纤维素(0.3%)或卡波姆眼凝胶0.2%w / w)覆盖眼睛,以防止麻醉下干燥。这也将有助于预防白内障的形成。
- 设置显微注射系统
- 使用连接到微量注射器泵控制器和注射注射器的微泵进行玻璃体内注射(图1A-C)。或者,如第4.4小节所述,用连接到汉密尔顿注射器的33G针头注射。
- 将 34 G 针头连接到注射支架以组装注射器。松开注射支架前端的银色螺帽,将针头滑入支架主体约一半。拧紧银色螺旋盖手指。
- 按照步骤4.2.4-4.2.5所述将管道连接到注射支架。
- 要将管子插入注射支架上,请松开支架后端的塑料螺钉,将管道滑过内部的垫圈并拧紧螺钉。
- 与管子末端保持轻微的间隙,以防止在注射过程中损坏管子。请参阅 图 1C。
- 解冻 100 μL 等分试样的分枝杆菌原液悬浮液。
- 加入 3 μL 1% 荧光素钠 (AK-Fluor) 溶液并涡旋良好。
- 用抗原和荧光素混合物加载 10 μL 注射器,不含任何气泡。
- 从注射器中取出装载针头,然后将管子滑过银色螺旋盖垫圈,直到尖端达到注射器主体中的零标记。
- 一旦管子的尖端正确对准所需位置,请拧紧螺旋盖手指。
- 通过注射管冲洗注射器中的溶液以完全加载系统。然后重复步骤4.2.8-4.2.11以重新装填注射器进行注射。
- 要将装载的注射器安装在微型泵上,请按下微型泵末端的夹子释放按钮以打开注射器夹。
- 将柱塞盖放入微泵后端的柱塞盖支架中。
- 然后将注射器套圈滑到环挡块上,并将注射器主体滑入注射器夹中。
- 松开夹紧按钮并拧紧柱塞固定螺钉。请参阅 图 1D。
- 将注射支架和针头滑过立体定向注射装置上的O形夹。这是一个自定义平台;或者,注射器可以手动握住和定位。
- 在微量注射泵控制器上设置输液量和输液量速率,分别以40nL / s的速率在每个周期注射500nL。
注意:可以使用更快的注射速率,但是,在实现针头重新定位之前可能会经历更多的回流。 - 在进行玻璃体内注射之前测试系统以确保功能正常。
注意:当注射系统正常运行时,使用脚踏板或控制垫激活注射循环将产生柱塞帽支架的可见运动,并且在针尖处会看到一小滴绿色液体。在没有产生液体的情况下,激活额外的循环或冲洗并重新加载注射器。 - 在注射眼睛之前,用95%乙醇垫轻轻擦拭针头。
- 玻璃体内注射程序
- 将鼠标放置在立体定位装置上以执行注射程序。
- 通过在鼠标表面上贴上 2-3 张纸巾来保持鼠标休息的载物台/平台温暖。
- 将鼠标放在平台上的俯卧位置。使用左右耳杆轻轻固定动物的头部。请参阅 图 1E。
- 将鼠标定位并在瞄准镜下方定向,以便可以看到右眼的鼻上侧。
- 使用30克针移位睫毛并露出巩膜。可视化视角膜缘和桡骨血管。
- 使用无菌 30 G 针在巩膜边缘后方 1-2 mm 处开一个引导孔。
- 将连接到注射支架的34 G针头通过导孔以避开晶状体的角度插入眼睛,但将针尖放入玻璃体腔中。
- 使用微量注射器泵控制器,小心地将 1 μL Mtb 提取物注入玻璃体腔。在持续回流的情况下,将进样体积增加到1.5μL以确保足够的剂量输送。
注意:对于假对照,将 1 μL PBS 注入动物的眼睛。 - 通过观察眼睛中的绿色反射来验证玻璃体内放置。请参阅 图 1F。
- 10秒后,从眼睛上拔出针头。注意任何反流。
- 从平台上取出鼠标,将0.3%羟丙甲纤维素或0.2%w/w卡波姆眼膏放在双眼上以保护角膜,然后移至恢复加热箱。
- 在小鼠恢复足够的意识以维持胸骨卧位之前,不要让鼠标无人看管。在完全康复之前,不要回到其他动物的陪伴下。
- 当小鼠完全清醒时,返回笼子并加入对乙酰氨基酚(200-300mg / kg /天)药水瓶。在笼卡上标记IVT注射的日期。
- 玻璃体内注射通常耐受性良好。可能提示疼痛和需要从研究中移除的临床体征包括眼周脱发(提示自我创伤)、角膜溃疡、体重减轻和驼背姿势。
- 玻璃体内注射的替代方法
注意:此过程使用手术显微镜和微量注射器上的33 G针头进行。- 撑起眼睛并用一对镊子将其固定到位。
- 然后涂抹 0.2% w/w 或 0.3% 羟丙甲纤维素眼部凝胶,并将圆形盖玻片(直径 7 毫米)放在眼睛上。
- 将 33 G 皮下注射针头安装在 5 μL 汉密尔顿注射器上,并以 ~45° 注射角将其沿角膜缘圆周约 2 mm 插入。
- 将针斜面引导到玻璃体中,停在晶状体和视盘之间(从外科医生的相对角度来看,这是在视盘上方/覆盖 - 距离插入部位约 1.5 毫米),并缓慢注射 2 μL Mtb(PBS 中的 2.5 ug/μL)。
- 短暂地将针头固定到位(以减少注射液的反流量),然后将其取出。
- 注射后,通过释放镊子来重新放置地球。此时可以滴1%的w/w氯霉素软膏给眼睛,以提供额外的保护,防止注射后眼内炎。
- 注射后,如步骤4.3.11-4.3.13所述移至恢复加温箱。
5. OCT成像检测和量化葡萄膜炎
- 动物制备
- 按照步骤4.1.2-4.1.4中所述麻醉鼠标
- 用1滴2.5%去氧肾上腺素扩张瞳孔。小心避免任何可能进入鼻子或嘴巴的多余飞沫。2-3分钟后,擦去多余的液体。
- 将0.3%羟丙甲纤维素或0.2%w / w卡波姆凝胶放在眼睛上,以防止麻醉时干燥。这也将有助于预防白内障的形成。
- 将鼠标包裹在一层手术纱布中以保持身体温暖,并将其放在动物盒上。将头部与咬杆对齐。
- 获取前房和后房的OCT图像。
注意:如果获取前房和后房图像,请先获取后房(PC)图像,以防止白内障形成后的图像退化。通过频繁润滑和使用 0.3% 羟丙甲纤维素或 0.2% w/w 卡波姆眼凝胶可以预防白内障的形成。对于扩展成像(>10分钟),保持鼠标温暖(通过使用加热垫)也有帮助。- 打开OCT成像系统后,固定正确的成像镜头并根据需要调整参考臂位置。
- 打开成像软件,创建唯一的鼠标 ID,然后按照 OCT 制造商的协议开始成像。
- 使用快速扫描方案的 "自由运行 "选项,将眼睛的视神经定位在后房图像中心或角膜顶点放在前房图像上。
注意: 表1 包含两种市售小动物成像系统的成像协议参数。有关产品规格,请参阅材料表 。 - 对于后房成像,将 OCT 靠近眼睛表面。小心避免使晶状体表面与眼睛接触。
- 眼睛正确定位后,停止快速扫描并选择体积扫描协议,然后使用 瞄准 选项激活扫描。
- 对于后节图像,调整直到视神经在水平B扫描对齐图像中居中,并且视网膜与垂直对齐轴对齐
- 对于前节图像,调整位置以使水平B扫描对齐图像和垂直对齐B扫描对齐图像中的角膜顶点居中。两个图像中存在反射伪影将确认正确对齐。然后将水平图像移动到足以删除反射伪影的程度。请参阅 图 2。
- 单击 快照 以捕获卷扫描映像,然后单击 保存。
- 接下来,获取平均中心插管扫描。打开扫描协议,然后单击瞄准,然后单击快照。右键单击同一面板,然后单击平均。
- 对双眼双眼重复步骤5.2.1-5.2.9。
- 收集所有图像后,从暗盒中取出鼠标,并在恢复期间提供角膜保护,如步骤4.3.11-4.3.13所示。
6. OCT对炎症进行评分
- 在被掩盖在治疗条件下的分级师的帮助下对OCT图像进行评分。
注:对于鼠标型号中的PMU,建议使用 表2 中提供的评分系统。 - 如果同时获得前房(AC)和后房(PC)图像,则合并这些分数以获得每只眼睛的最终分数。
注意:前房炎症在后房炎症之前消退。
7. 通过尸检组织学对炎症进行评分
- 在实验结束时,通过眼球摘除收集个体眼睛,在4%甲醛中固定过夜,然后进行石蜡包埋,切片和H&E染色33。
注意:建议沿瞳孔视神经轴线进行多个4-8μm切片。
注意:每只眼睛的三个部分由蒙面分级师使用 表3中提供的评分系统进行评分,三个部分的平均分数报告为最终的组织学炎症评分。
结果
该协议证明了使用启动分枝杆菌葡萄膜炎模型(PMU)诱导小鼠葡萄膜炎。确保皮下注射的一致性和玻璃体内注射的准确性是开发启动分枝杆菌葡萄膜炎模型(PMU)的关键步骤。 图1 显示了使用立体定位装置的小鼠玻璃体内注射程序。耳条有助于将头部轻轻地定位在显微镜下的相同位置(图1E)。它们还可以在玻璃体内注射过程中保持头部稳定,从而降低注射创伤的风险。成功注射后,注射溶液中的荧光素从眼睛内产生绿色反射,可以在显微镜下或从侧视图看到,如图 1F所示。
当按概述执行时,该方案会产生强大的急性葡萄膜炎,最早可以在玻璃体内注射后 10 小时使用 OCT 和眼底成像检测到。 图2 显示了OCT成像中眼睛的正确对齐方式。 表 1A 列出了 OCT 协议中使用的参数。获取图像的系统方法将提供可随时间比较的高质量图像。前房图像使用面部SLO图像(图2A)以角膜顶点为中心,虹膜平行于水平和垂直平面对齐(图2B,C)。体积和线扫描以垂直对齐方式捕获,因此可以同时查看下部和上部区域。后节图像使用面部SLO图像以视神经为中心(图2D),并且RPE的亮带用于将视网膜平行于水平和垂直平面(图2E,F)。
图3显示了使用OCT成像的PMU眼部炎症的典型发现。玻璃体内注射后24小时,在房水和玻璃体中可见炎症细胞(图3B)。在存在中度或重度炎症的情况下,在 AC 的下角会出现低脓。可以使用 表2中列出的标准对这些OCT图像上的眼部炎症程度进行评分。 图4显示了展示每个分数典型炎症特征的代表性图像示例。AC和PC室分数可以相加以生成OCT组合分数。综合得分 >0 和 ≤2.5 代表轻度炎症。中度炎症由评分 >2.5 至 ≤4.5 决定。得分 >4.5 可识别严重炎症。炎症通常在玻璃体内注射后 48 小时达到峰值,AC 和 PC 的 OCT 评分在 1 到 3 之间(综合评分在 2 到 6 之间)。AC 和 PC 分数为 0.5 或 4 不太常见。如果经常遇到超出典型范围的分数,则可能需要进行故障排除以确定导致异常值分数的因素(请参阅讨论部分)。玻璃体内注射后一周内前房炎症评分趋于恢复为零。相反,后验评分不会恢复为零;相反,低水平的慢性炎症以玻璃体炎的形式持续存在,血管周围淋巴细胞在玻璃体内注射后浸润视网膜 1-2 个月。
PMU 的炎症评分也可以使用组织学确定。 图5 显示了代表性的H&E切片,用于通过组织学对PMU的严重程度进行评分。计数房水和玻璃体中的炎症细胞数量,并使用 表3中列出的评分标准确定严重程度。睫状体的炎性细胞浸润常见于轻度或中度炎症的组织切片一侧(单侧受累)。当炎症严重时,这反映在晶状体两侧睫状体中存在炎症细胞浸润(称为双侧受累)。在玻璃体内注射后的后期时间点,还可以识别慢性炎症表现,包括血管周围和视网膜内白细胞和视网膜外褶皱的存在。组织学也有助于识别受不良注射技术影响的眼睛。玻璃体内注射期间晶状体的创伤可以通过创伤区域附近的晶状体囊外存在无定形曙红染色(粉红色)晶状体蛋白来识别。玻璃体内mTB反流到结膜下间隙会产生眼外炎症,可以通过仔细检查切片上的眼周结构来识别。由于未能将mTB提取物保留在眼睛内,这些眼睛通常具有较低的OCT评分炎症。
明场眼底成像也可用于识别 PMU 的临床相关方面,包括出现低痣、玻璃体炎以及视网膜或血管周围炎性细胞浸润。 图6 显示了在眼底图像上可以看到视网膜和血管周围炎症的两个示例。这两只眼睛还显示了PMU模型中常见的炎症范围。 表1B 列出了眼底/视网膜OCT成像系统中使用的参数。注意严重炎症对图像质量(图6,第2天,OCT和顶行眼底图像)和第21天存在的疾病范围的影响。角膜水肿也会降低急性炎症期间的图像质量;然而,角膜水肿仅因炎症而严重的情况并不常见。更常见的是,成像和麻醉事件期间由于表面保护不完全而导致上皮损伤,图像质量会降低。
PMU模型可用于诱导任何小鼠品种或基因型的葡萄膜炎。在白化眼中,OCT 仍可用于对炎症进行评分,但由于缺乏眼底色素,明场成像难以观察炎症13,34。尸检可对眼组织、区域淋巴结或脾脏进行。一些例子包括免疫细胞存在的测定,例如流式细胞术和免疫组织化学以及炎症细胞因子的测量。在用PMU开始炎症后测试的所有时间点(第1天至第56天),个体眼睛中存在足够的CD45 + 炎症细胞,可通过多参数流动分析检测眼睛中的许多主要白细胞群12,35。可以从发炎的眼睛中收集水性 (2-5 μL) 和玻璃体 (5-10 μL) 体液,用于蛋白质浓度测定、蛋白质组学研究或细胞因子浓度测定36。

图1:小鼠玻璃体内注射设置。 玻璃体内注射使用(A)连接到(B)微型泵的微型注射器泵控制器和(C)注射注射器在小鼠眼睛上进行。注射器装载并安装在(D)微泵上。鼠标头使用(E)耳条定位,以确保玻璃体内注射过程中的稳定性和一致性。(F)注射液中的荧光素在成功手术后从眼睛内产生绿色反射。 请点击此处查看此图的大图。
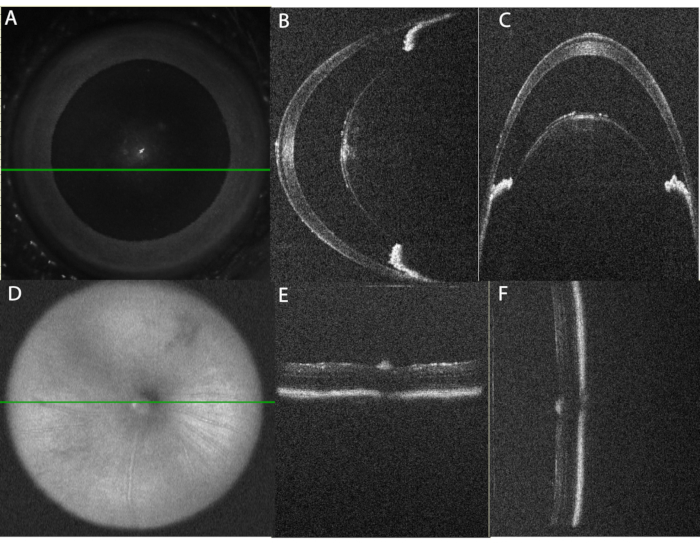
图 2:OCT 成像的眼睛正确对齐 。 (A)使用面部扫描激光检眼镜(SLO)图像,将眼睛居中以进行前房成像。绿线表示面板(B)中显示的水平线扫描的位置。请注意,应避免使用中央角膜以减少反射伪影。(C)通过副中央前房的垂直B扫描。此扫描是从水平扫描以 90° 角度获得的。请注意,镜头两侧的虹膜部分的对齐在水平扫描(图B)中是水平的,在垂直扫描中一个在另一个之上排列(图C)。(D)使用SLO图像,后房图像以视神经为中心。(e) 水平B扫描对准,(f)垂直B扫描对准。 请点击此处查看此图的大图。
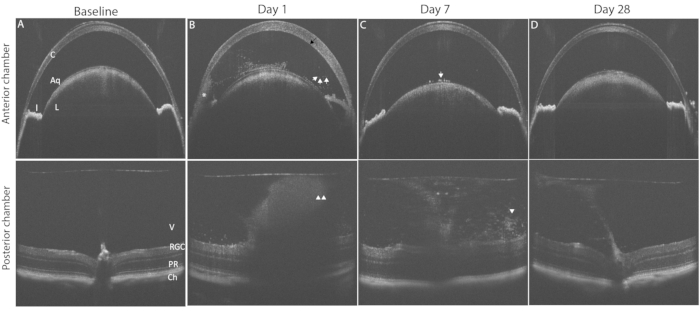
图 3:诱导 PMU 会产生全葡萄膜炎,可通过纵向 OCT 成像进行监测。 顶行显示前房 (AC);底行显示后房 (PC) OCT 图像,以突出显示病程中的病理变化。(A)诱导葡萄膜炎前AC(上)和PC(下)的基线OCT图像,均得分为0。(B)玻璃体内注射后第1天显示角膜水肿(黑色箭头),AC中存在多个自由漂浮的炎症细胞(白色箭头)和PC中的玻璃体炎(白色箭头)。(C)玻璃体内注射后第7天,晶状体前囊上的AC细胞很少(白色箭头)和玻璃体炎减少(白色箭头)。(D)玻璃体内注射前房后第28天,AC炎症和轻度玻璃体炎消退。缩写:C-角膜,L-晶状体,I-虹膜,Aq-水,V玻璃体,RGC-视网膜神经节细胞,PR-光感受器,Ch-脉络膜。 请点击此处查看此图的大图。

图 4:OCT 分数示例。 使用 表2所示的分类系统为每个AC映像和PC映像分配0到4之间的OCT分数。AC和PC分数合并为眼睛的最终OCT分数。(公元,卒)零分的示例。(乙,东)分数为 0.5 的示例。(中,女)分数为 1 的示例。(G,J)得分为 2 的示例。(H,K)3 分的示例。(一,中)4分的例子见图 I 和 L。 请点击此处查看此图的大图。
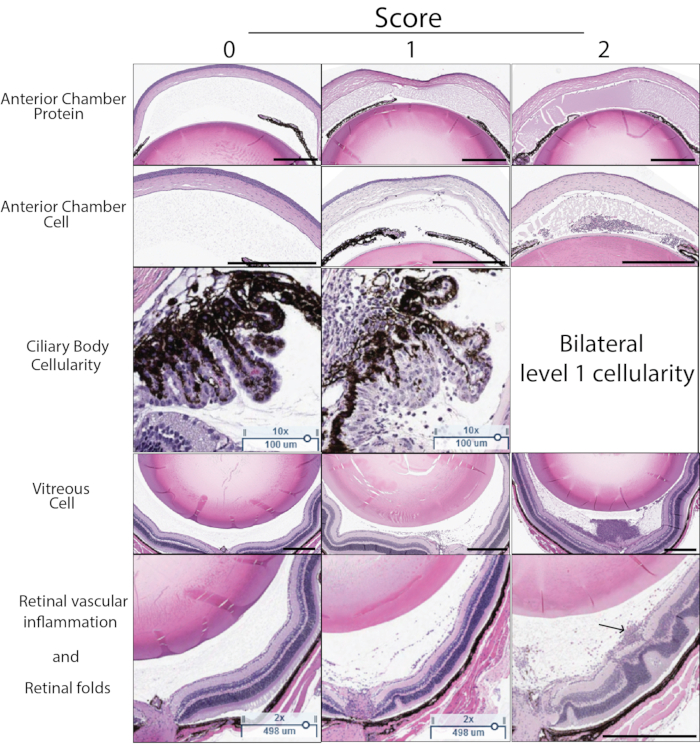
图 5:组织学评分示例。 组织学评分根据H&E切片中可见的五个特征确定:前房蛋白密度,前房细胞数,睫状体免疫细胞浸润,玻璃体细胞密度,视网膜血管炎症和视网膜结构变化。为每个特征分配 0-2 分。每个分数的说明见 表3。此图中显示了每个特征的代表性示例分数 0-2。左列显示分数为零。中间列显示分数 1 的示例。右列显示分数 2 的示例。如果同一切片晶状体两侧的睫状体显示细胞炎症,则睫状体评分为 2 分。最终的组织学评分是五个标准中每个标准的分数之和(最高 10 分)。右下面板中的箭头表示与浅表视网膜血管相关的血管周围白细胞。黑色比例尺表示 500 μm。睫状比例尺表示 100 μm。 请点击此处查看此图的大图。
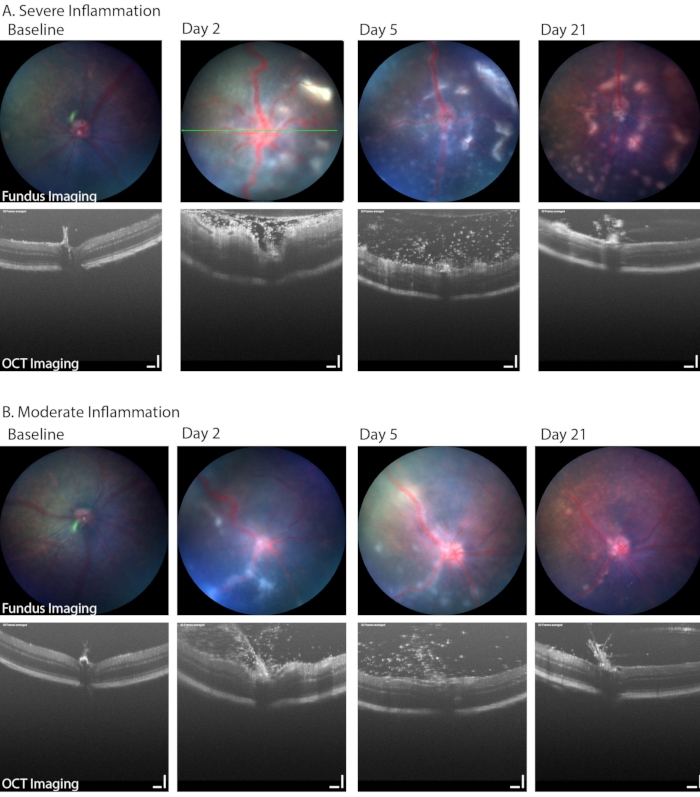
图 6:PMU 的纵向眼底成像确定了一系列疾病严重程度 。 (A)严重发炎的眼睛在彩色眼底成像(上排)上显示视网膜中有多处白色浸润和血管曲折,以及第2天OCT(底排)的致密玻璃体炎和视网膜水肿。视网膜病变数量随时间推移可见进展,同时玻璃体炎改善。绿线表示 OCT 图像的位置。(B)轻度发炎的眼睛显示眼底中离散的线性病变越来越少,玻璃体腔中有许多浸润细胞。比例尺 = 100 μm。 请点击此处查看此图的大图。
| 一个 | |||
| 小鼠前房 | 快速扫描 | 卷扫描 | 线性扫描 |
| 长 x 宽 | 4.0 毫米 x 4.0 毫米 | 3.6 毫米 x 3.6 毫米 | 3.6 毫米 |
| 角度 | 0 | 90 | 90 |
| A扫描/B扫描 | 800 | 1000 | 1000 |
| # B 扫描 | 50 | 400 | 1 |
| 帧/ B扫描 | 1 | 3 | 20 |
| 小鼠后房 | 快速扫描 | 卷扫描 | 线性扫描 |
| 长 x 宽 | 1.6 毫米 x 1.6 毫米 | 1.6 毫米 x 1.6 毫米 | 1.6 毫米 |
| 角度 | 0 | 0 | 0 |
| A扫描/B扫描 | 800 | 1000 | 1000 |
| # B 扫描 | 50 | 200 | 1 |
| 帧/ B扫描 | 1 | 3 | 20 |
| B | |||
| 小鼠后房 | 卷扫描 | 线性扫描 | |
| 长 x 宽 | 0.9 毫米 x 0.9 毫米 | 1.8 毫米 | |
| 角度 | 0 | 任意(通常为 0 或 90) | |
| A扫描/B扫描 | 1024 | 1024 | |
| # B 扫描 | 512 | 1 | |
| 帧/ B扫描 | 1 | 30 |
表 1:扫描参数。 (A) OCT 扫描参数。(B) 眼底/视网膜OCT扫描参数
| 华侨城分数说明 | ||||||
| 得分 | 前房 | 后房 | ||||
| 那 | 前角膜以外无视野 | 无后节视图 | ||||
| 0 | 无炎症 | 无炎症 | ||||
| 0.5 | 水溶液中的1-5个细胞 | 少数细胞占据玻璃体面积的不到10% | ||||
| 或角膜水肿 | 无视网膜下或视网膜内浸润或视网膜结构破坏 | |||||
| 1 | 水溶液中6-20个细胞 | 弥漫性细胞(无致密团块)占玻璃体面积的10%至50%。 | ||||
| 或晶状体前囊上的单层细胞 | 无视网膜下或视网膜内浸润或视网膜结构破坏 | |||||
| 2 | 水溶液中 20–100 个细胞 | 弥漫性细胞(无致密团块)占玻璃体面积的 50% > | ||||
| 或少于 20 个细胞且存在脓肿 | 无视网膜下或视网膜内浸润或视网膜结构破坏 | |||||
| 3 | 水溶液中 20–100 个细胞 | 扩散细胞等于 2 级和 1 级 | ||||
| 和下瞳或瞳孔膜 | 并且至少有一个致密的玻璃体混浊,占玻璃体面积的 10%–20%,或者存在等于 2 级的玻璃体细胞和罕见的 (≤ 2) 视网膜下或视网膜下混浊 | |||||
| 4 | 任意数量的水性细胞 | 致密的玻璃体混浊>占玻璃体面积的20%。 | ||||
| 以及由于严重炎症而导致的大下瞳和瞳孔膜或前结构丧失 | 或具有大视网膜下或视网膜内阴影的弥漫性玻璃体细胞 | |||||
表2:PMU OCT评分标准: OCT 图像根据表中列出的标准进行评分。将AC和PC分数相加以获得眼睛的最终分数。在没有获得眼睛清晰视图的情况下,为图像分配了NA分数,这些图像被排除在研究之外。
| 组织学评分说明 | |||
| 特征 | 0 | 1 | 2 |
| 前房 (AC) 蛋白 | 在AC中用伊红染色的无细胞颗粒很少 | AC任何部位的细胞外曙红染色中度但不融合 | 整个AC的汇合或接近融合的细胞外曙红染色 |
| 前房 (AC) 细胞 | 无细胞 | 1-100 个细胞,但没有密集的细胞聚集 | >100 个细胞,或细胞的密集聚集 |
| 睫状体炎症 | 睫状体或玻璃体周围无白细胞浸润 | 单侧存在白细胞浸润睫状体和/或玻璃体周围。 | 双侧存在白细胞浸润睫状体和/或玻璃体周围。 |
| 视网膜血管炎症 | 无血管周围白细胞的视网膜血管 | 每节一个血管,有血管周围白细胞 | 每节>1个血管,血管周围白细胞 |
| 视网膜褶皱或损伤 | 无视网膜损伤 | 每节 1-3 个视网膜褶皱 | 每节>3个视网膜褶皱,或任何其他视网膜层破坏或视网膜内出血 |
表 3:PMU 组织学评分标准: 眼睛的H&E切片根据表中列出的标准进行评分。对同一只眼睛的三个切片进行评分和平均,以获得眼睛的最终组织学评分。
讨论
葡萄膜炎的动物模型有助于了解眼部炎症和体内平衡的机制,以及能够对葡萄膜炎37患者的药物和手术疗法进行临床前评估。PMU模型的兔子和大鼠变体都通过概念验证研究38,39,40证明了它们在临床前治疗中的价值。由于小鼠中存在多种转基因菌株,建立小鼠PMU模型系统现在允许进行更详细的机制研究,以确定有助于该疾病病理的特定细胞类型,途径和基因。
葡萄膜炎的动物模型可以证明动物间炎症发生率和强度的变异性41。在C57BL / 6小鼠品系中,使用此处概述的协议可靠地生成PMU。据报道,EAU 和 EIU 的葡萄膜炎病程和强度存在菌株特异性变化42,43。虽然尚未通过实验测量菌株对PMU严重程度和病程的特异性影响,但该模型已用于野生型C57BL / 6J以及白化小鼠(B6(Cg)-Tyrc-2J / J)并产生类似的炎症反应。在生成PMU模型时,控制下面列出的考虑因素可以帮助新研究人员限制变异性,并产生最一致和可重现的葡萄膜炎。
确保皮下注射的一致性:
为了提供一致的皮下注射,请确保从乳液中去除所有气泡。考虑因素包括在装入注射器之前对预制乳液进行短离心(400 x g时30秒)。这将去除乳液中滞留的空气。此外,在装入注射器时,定期倒置(向上倾斜)并敲击注射器以去除任何气泡。注射时,不要将注射器放置得太深,以避免肌肉注射。相反,浅(皮内)注射可导致乳液通过皮肤侵蚀。请记住在从注射部位取出注射器之前短暂暂停,以确保完全注射粘稠的乳液并防止皮肤反流。
皮下注射7天后,确认后腿两侧有可触及的结节。如果无法识别结节,则可能是注入了空气而不是乳液。在这种情况下,急性炎症可能不那么强烈,慢性炎症可能不会发展。
预防感染性眼内炎的发展:
如果不预防,细菌性或真菌性眼内炎将产生混杂变量44。为了预防细菌性眼内炎,在进行玻璃体内悬浮液、处理和清洁所有与眼睛接触的可重复使用的工具时,请始终采用良好的无菌技术。使用无菌一次性物品、高压灭菌或使用 95% 酒精洗涤或湿巾清洁很重要。适当使用甜菜碱应用于眼表、眼睑和眼周毛皮也有助于预防眼内炎45。识别感染的眼睛很简单,因为在注射后过程中,眼部结构会被极度炎症抹去。这对于 PMU 来说并不典型。眼内出血的存在也可能提示眼内炎或注射创伤。在这种情况下,将这些动物排除在研究之外。
确保玻璃体内注射的一致性:
玻璃体内注射是诱导PMU中可靠且可重复的炎症的关键步骤。每次注射时提供一致量的Mtb悬浮液,避免创伤,防止悬浮液回流都是进行注射时应考虑的因素。为确保一致的悬浮液,请在解冻时和装入注射器之前彻底涡旋库存悬浮液。由于使用的这种Mtb提取物不会形成溶液,因此悬浮液会随着时间的推移而沉降。为确保每次注射中Mtb提取物的均匀浓度,请在装载后15分钟内使用或排出并重新加载注射器。去氧肾上腺素用于扩张,为后眼提供更大的视野,并降低注射过程中眼睛创伤的风险。这种滴液会产生自然的眼睑回缩和眼球的轻微突出,可以很好地观察视角膜缘后方 1-2 mm 的区域,而无需用镊子抓住眼睛。使用镊子抑制眼睛可能会导致潜在的创伤,并暂时增加眼内压和Mtb悬浮液反流的风险。试图向眼睛注入过多的体积也可能引起创伤。注射体积限制在2μL,以防止眼内压显着和长时间升高和眼睛创伤。此外,年幼动物的眼睛会比成年小鼠小。通常6-8周小鼠(20-25g)提供均匀的眼睛大小,并确保注射Mtb后炎症的更大一致性。在较小的小鼠中观察到分枝杆菌悬浮液注射后反流的频率较高。反过来,这会导致低于预期的急性炎症。稀释的荧光素溶液用于为新手进样器提供关于其进样技术成功的视觉反馈。注射时的扩张将允许玻璃体腔中注射材料的直接可视化,并有机会注意到晶状体创伤的任何证据。在晶状体创伤的情况下,它可能导致晶状体清晰度的变化,从而导致白内障,白内障可以在OCT上可视化。在眼外伤的情况下,由于晶状体诱导的葡萄膜炎的可能性,眼睛需要从研究中排除46。我们建议在从眼睛上取下注射器之前暂停10秒,以使Mtb悬浮液在眼睛内分散并减少反流。
可以通过改变玻璃体内注射中Mtb的浓度来修改PMU模型以改变急性炎症的强度。从 2.5 μg/μL 到 15 μg/μL 的不同剂量之前已经在我们的实验室进行了测试。然而,发现高于 10 μg/μL 的剂量会导致严重的眼损伤,包括自发性晶状体破裂、严重的角膜水肿和瘢痕形成以及前房积血。这种严重程度在感染后葡萄膜炎的人类患者中并不典型,因此不推荐这些浓度。发现 5 μg/μL 剂量可可靠地产生轻度至中度急性炎症和轻度慢性葡萄膜炎;10 μg/μL 剂量可产生可靠的中度至重度急性疾病和更显著的慢性疾病。因此,根据实验问题,改变玻璃体内浓度可以提供替代的疾病严重程度,以便根据需要使用。应选择对照,以确保结果是由于对mTB的反应,而不是与皮下或玻璃体内注射相关的创伤。在假注射对照中,可以使用PBS代替mTB提取物。为了与未暴露的动物进行比较,应该考虑真正的幼稚样本,因为其他眼睛并不总是等效的。
由于小鼠眼睛的尺寸较小,OCT可以比直接可视化或显微明场摄影更灵敏地检测前房炎症。先前在大鼠25中使用PMU的工作确定,组织学可以检测到的细胞比OCT多,但两种模式之间存在良好的相关性。OCT的另一个优点是,它可以用来纵向监测同一动物的炎症。葡萄膜炎的其他主要小鼠模型,如EAU和EIU,也采用OCT进行定量分析12,47,48。在小鼠的PMU模型中,前房细胞仅在OCT上可见,除非存在大的hypopyon,否则在临床检查中看不到。玻璃体炎症(玻璃体炎)可通过色底成像观察到,但仅可通过OCT成像检测定量变化。该模型的其他方面,如视网膜血管炎症和视网膜损伤,可以通过OCT和显微镜明场眼底摄影轻松识别。
使用 OCT 时,重要的是要考虑炎症程度的区域差异如何影响局部成像。先前的报告已经发现人类前房中细胞分布不均匀,更多的细胞位于49以下。在小鼠中,类似的易感性很常见。因此,通过AC进行垂直或径向扫描将有助于确保图像能够捕获炎症范围。此外,在同一位置进行成像也将为纵向在同一只眼睛中收集的图像提供一致性。要获得眼睛同一部位的图像,请使用稳定的地标和系统的方法。对于前房图像,图像紧邻角膜顶点的中心并垂直定向,以便可以在下角检测到下痉的存在。对于后节图像,图像以视神经为中心。建议考虑使用至少 3 次线扫描进行评分,以确保捕获区域差异。如果炎症仅限于外周部位,则进行体积扫描可能会有所帮助。收集卷扫描还可以帮助捕获区域差异,但会增加数据存储要求。
可用于表征PMU小鼠模型中炎症的其他体内测定包括生物发光成像13,35。可以进行多参数流式细胞术分析等尸检测定,以鉴定和量化眼腔和后房中的浸润免疫细胞类型群体12,26。在PMU模型中,急性炎症的特征是先天反应,主要为中性粒细胞浸润,然后是持续超过一个月的慢性和持续的适应性T细胞显性反应35。可以在死后组织上进行的其他免疫功能测定包括眼液细胞因子分析。此外,其他下游检测,如mRNA测序和免疫荧光成像,可用于评估葡萄膜炎50,51中视网膜免疫细胞群的基因和蛋白质表达模式。
PMU模型可以在其他啮齿动物系统中复制,使用适合不同物种的适应性。PMU模型以前已用于大鼠和兔38,39,40。在大鼠中,玻璃体内注射后发生急性全葡萄膜炎,在 14 天内自发消退,组织学检查没有出现慢性炎症迹象24.在兔中,葡萄膜炎的诱导在玻璃体内注射之前利用两轮皮下注射,但也会产生强烈的全葡萄膜炎。使用小鼠模型的优点之一是许多转基因和敲除菌株的现成可用性,可以帮助了解葡萄膜炎52的基本机制。所有啮齿动物模型都可用于临床前治疗测试,如果该药物是全身给药或作为局部滴剂给药的。然而,由于它们的尺寸较大,大鼠和兔眼是用于葡萄膜炎植入式或局部注射治疗方案的临床前研究的更好模型。
总之,该协议为有兴趣研究慢性眼部炎症机制的研究人员提供了一种不依赖于先前用眼部抗原免疫的新工具。
披露声明
作者没有财务冲突需要披露。
致谢
这项工作得到了美国马里兰州贝塞斯达国立卫生研究院(KP)K08EY0123998,(KP)R01EY030431,(KP)R21 EY02939,UW视觉研究核心资助(NEI P30EY01730),Mark Daily,MD研究基金和Christopher和Alida Latham研究基金的礼物,预防失明研究的无限制部门资助以及预防失明研究(KP)的职业发展奖。在布里斯托尔进行的工作得到了英国视力研究公司和安德伍德信托基金会的额外资助。
材料
| Name | Company | Catalog Number | Comments |
| AK-FLUOR | Akorn Pharmaceuticals, IL, USA | 10% Fluorescein sodium 100 mg/mL in 5 mL vial | |
| AnaSed | Akorn Animal Health, IL, USA | NDC 59399-110-20 | Xylazine 20 mg/mL |
| Betadine 5% Sterile Ophthalmic Prep Solution | Alcon, TX, USA | 8007-1 | |
| B-D Precision Glide Needles -25 G | Becton, Dickinson and Company, NJ, USA | 305122 | |
| B-D Precision Glide needle -30-G | Becton, Dickinson and Company, NJ, USA | 305106 | |
| Bond MAX, Bond Rx | Leica Biosystems, IL,USA | Automated IHC staining system | |
| Chloramphenicol ointment | Martindale Pharma, Romford, UK | 1% w/w Chloramphenicol | |
| EG1150H | Leica Biosystems, IL,USA | Tissue Embedding | |
| Envisu R2300 | Bioptigen/Leica | OCT Machine | |
| Freund's Incomplete Adjuvant | BD Difco, NJ, USA | 263910 | |
| GenTeal lubricant eye ointment | Alcon, TX, USA | --- | |
| GenTeal lubricant eye gel | Alcon, TX, USA | --- | |
| H37Ra lyophilized Mycobacteria extract | BD Difco, NJ, USA | 231141 | |
| Hamilton RN Needle (33/12/2)S | Hamilton, Reno, NV | 7803-05(33/12/2) | 33 G |
| Hamilton syringe | Hamilton, Reno, NV | CAL7633-01 | 5 µL |
| Insulin needle | Exel International, USA | 26029 | 1 mL |
| Isoflurane | |||
| Ketaset | Zoetis, USA | 377341 | Ketamine HCL 100 mg/mL |
| Microinjection Syringe Pump and Micro4Controller | World Precision Instruments, FL, USA | UMP3 | |
| Micron IV | Phoenix Research Laboratories, Pleasanton, CA | Alternative Imaging/OCT Machine | |
| Nanofil 10 µL syringe | World Precision Instruments, FL, USA | NANOFIL | |
| Nanofil Intraocular Injection Kit | World Precision Instruments, FL, USA | IO-KIT | |
| Olympus SZX10 | Olympus | Dissection scope | |
| PBS | Gibco | 14190 | |
| Phenylephrine Hydrochloride Ophthalmic Solution USP 2.5% Sterile 15 mL | Akorn Pharmaceuticals, IL, USA | 17478020115 | |
| RM2255 | Leica Biosystems, IL,USA | Tissue Sectioning | |
| TB Syringe | Becton, Dickinson and Company, NJ, USA | 309602 | 1 mL |
| Tetracaine 0.5% | Alcon, TX, USA | 1041544 | |
| Tissue Tek VIP series | Sakura Finetek USA, Inc.,CA. | Histology Tissue Processing | |
| Tropicamide 1% | Chauvin Pharmaceuticals, Romford, UK | Minims | |
| Tylenol | Johnson & Johnson Consumer Inc, PA, USA | NDC 50580-614-01 | Acetaminophen |
| Viscotears | Novartis Pharmaceuticals, Camberley, UK | Carbomer eye gel 0.2% w/w |
参考文献
- American Academy of Ophthalmology. Aao 2019-2020 Basic and Clinical Science Course, Section 09: Uveitis and Ocular Inflammation. American Academy of Ophthalmology. , (2019).
- Caspi, R. R. Animal models of autoimmune and immune-mediated uveitis. Drug Discovery today. Disease Models. 3 (1), 3-9 (2006).
- DeVoss, J., et al. Spontaneous autoimmunity prevented by thymic expression of a single self-antigen. The Journal of Experimental Medicine. 203 (12), 2727-2735 (2006).
- Caspi, R. R., et al. A new model of autoimmune disease. Experimental autoimmune uveoretinitis induced in mice with two different retinal antigens. Journal of Immunology. 140 (5), 1490-1495 (1988).
- Tang, J., Zhu, W., Silver, P. B., Su, S. -B., Chan, C. -C., Caspi, R. R. Autoimmune uveitis elicited with antigen-pulsed dendritic cells has a distinct clinical signature and is driven by unique effector mechanisms: Initial encounter with autoantigen defines disease phenotype. The Journal of Immunology. 178 (9), 5578-5587 (2007).
- Broekhuyse, R. M., Kuhlmann, E. D., Winkens, H. J. Experimental melanin-protein induced uveitis (EMIU) is the sole type of uveitis evoked by a diversity of ocular melanin preparations and melanin-derived soluble polypeptides. Japanese Journal of Ophthalmology. 40 (4), 459-468 (1996).
- Pennesi, G., et al. A humanized model of experimental autoimmune uveitis in HLA class II transgenic mice. The Journal of Clinical Investigation. 111 (8), 1171-1180 (2003).
- Caspi, R. R. Understanding autoimmune uveitis through animal models. The Friedenwald lecture. Investigative Ophthalmology & Visual Science. 52 (3), 1872-1879 (2011).
- Bansal, S., Barathi, V. A., Iwata, D., Agrawal, R. Experimental autoimmune uveitis and other animal models of uveitis: An update. Indian Journal of Ophthalmology. 63 (3), 211-218 (2015).
- Smith, J. R., Hart, P. H., Williams, K. A. Basic pathogenic mechanisms operating in experimental models of acute anterior uveitis. Immunology and Cell Biology. 76 (6), 497-512 (1998).
- Rosenbaum, J. T., McDevitt, H. O., Guss, R. B., Egbert, P. R. Endotoxin-induced uveitis in rats as a model for human disease. Nature. 286 (5773), 611-613 (1980).
- Chu, C. J., et al. Multimodal analysis of ocular inflammation using the endotoxin-induced uveitis mouse model. Disease Models & Mechanisms. 9 (4), 473-481 (2016).
- Gutowski, M. B., Wilson, L., Van Gelder, R. N., Pepple, K. L. In vivo bioluminescence imaging for longitudinal monitoring of inflammation in animal models of uveitis. Investigative Ophthalmology & Visual Science. 58 (3), 1521-1528 (2017).
- World Health Organization. Global tuberculosis report 2019. World Health Organization. , (2019).
- Biswas, J., Badrinath, S. S. Ocular morbidity in patients with active systemic tuberculosis. International Ophthalmology. 19 (5), 293-298 (1995).
- Donahue, H. C. Ophthalmologic experience in a tuberculosis sanatorium. American Journal of Ophthalmology. 64 (4), 742-748 (1967).
- El-Asrar, M. A., Abouammoh, M., Al-Mezaine, H. S. Tuberculous uveitis. Middle East African Journal of Ophthalmology. 16 (4), 188-201 (2009).
- Bodaghi, B., et al. Chronic severe uveitis: etiology and visual outcome in 927 patients from a single center. Medicine. 80 (4), 263-270 (2001).
- Cunningham, E. T., Forrester, J. V., Rao, N. A., Zierhut, M. Post-infectious uveitis. Ocular Immunology and Inflammation. 24 (6), 603-606 (2016).
- Wroblewski, K. J., Hidayat, A. A., Neafie, R. C., Rao, N. A., Zapor, M. Ocular tuberculosis: a clinicopathologic and molecular study. Ophthalmology. 118 (4), 772-777 (2011).
- Yeh, S., Sen, H. N., Colyer, M., Zapor, M., Wroblewski, K. Update on ocular tuberculosis. Current Opinion in Ophthalmology. 23 (6), 551-556 (2012).
- Tagirasa, R., Parmar, S., Barik, M. R., Devadas, S., Basu, S. Autoreactive T cells in immunopathogenesis of TB-associated uveitis. Investigative Ophthalmology & Visual Science. 58 (13), 5682-5691 (2017).
- Agrawal, R., et al. Insights into the molecular pathogenesis of ocular tuberculosis. Tuberculosis. 126, 102018(2021).
- Pepple, K. L., et al. Primed mycobacterial uveitis (PMU): Histologic and cytokine characterization of a model of uveitis in rats. Investigative Ophthalmology & Visual Science. 56 (13), 8438-8448 (2015).
- Pepple, K. L., Choi, W. J., Wilson, L., Van Gelder, R. N., Wang, R. K. Quantitative assessment of anterior segment inflammation in a rat model of uveitis using spectral-domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (8), 3567-3575 (2016).
- Pepple, K. L., Wilson, L., Van Gelder, R. N. Comparison of aqueous and vitreous Lymphocyte populations from two rat models of experimental uveitis. Investigative Ophthalmology & Visual Science. 59 (6), 2504-2511 (2018).
- Basu, S., Elkington, P., Rao, N. A. Pathogenesis of ocular tuberculosis: New observations and future directions. Tuberculosis. 124, 101961(2020).
- Basu, S., Rao, N., Elkington, P. Animal models of ocular tuberculosis: Implications for diagnosis and treatment. Ocular Immunology and Inflammation. , 1-7 (2020).
- Mattapallil, M. J., et al. The Rd8 mutation of the Crb1 gene is present in vendor lines of C57BL/6N mice and embryonic stem cells, and confounds ocular induced mutant phenotypes. Investigative Ophthalmology & Visual Science. 53 (6), 2921-2927 (2012).
- Underwood, W., Anthony, R. AVMA guidelines for the euthanasia of animals: 2020 edition. 2013 (30), 2020-2021 (2020).
- Donovan, J., Brown, P., et al. Handling and restraint. Current protocols in immunology. Coligan, J. E., et al. , John Wiley & Sons, Inc. Chapter 1, Unit 1.3 (2006).
- Tremoleda, J. L., Kerton, A., Gsell, W. Anaesthesia and physiological monitoring during in vivo imaging of laboratory rodents: considerations on experimental outcomes and animal welfare. EJNMMI Research. 2 (1), 44(2012).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor protocols. 2014 (6), 655-658 (2014).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- John, S., Rolnick, K., Wilson, L., Wong, S., Van Gelder, R. N., Pepple, K. L. Bioluminescence for in vivo detection of cell-type-specific inflammation in a mouse model of uveitis. Scientific Reports. 10 (1), 11377(2020).
- Fortmann, S. D., Lorenc, V. E., Hackett, S., Campochiaro, P. A. Murine Vitreous Tap (MurViTap): a novel technique to extract uncontaminated mouse vitreous humor, quantify retinal vascular permeability, and compare proteins secreted by diseased and normal retina. Investigative ophthalmology & visual science. 58 (8), 5978(2017).
- Caspi, R. R. Understanding autoimmunity in the eye: from animal models to novel therapies. Discovery Medicine. 17 (93), 155-162 (2014).
- Mruthyunjaya, P., et al. Efficacy of low-release-rate fluocinolone acetonide intravitreal implants to treat experimental uveitis. Archives of Ophthalmology. 124 (7), 1012-1018 (2006).
- Jaffe, G. J., Yang, C. S., Wang, X. C., Cousins, S. W., Gallemore, R. P., Ashton, P. Intravitreal sustained-release cyclosporine in the treatment of experimental uveitis. Ophthalmology. 105 (1), 46-56 (1998).
- Pepple, K. L., et al. Uveitis therapy with shark variable novel antigen receptor domains targeting tumor necrosis factor alpha or inducible t-cell costimulatory ligand. Translational Vision Science & Technology. 8 (5), 11(2019).
- Mattapallil, M. J., et al. Characterization of a New epitope of IRBP that induces moderate to severe uveoretinitis in mice with H-2b haplotype. Investigative Ophthalmology & Visual Science. 56 (9), 5439-5449 (2015).
- Silver, P. B., Chan, C. C., Wiggert, B., Caspi, R. R. The requirement for pertussis to induce EAU is strain-dependent: B10.RIII, but not B10.A mice, develop EAU and Th1 responses to IRBP without pertussis treatment. Investigative Ophthalmology & Visual Science. 40 (12), 2898-2905 (1999).
- Li, Q., Peng, B., Whitcup, S. M., Jang, S. U., Chan, C. C. Endotoxin induced uveitis in the mouse: susceptibility and genetic control. Experimental Eye Research. 61 (5), 629-632 (1995).
- Astley, R. A., Coburn, P. S., Parkunan, S. M., Callegan, M. C. Modeling intraocular bacterial infections. Progress in Retinal and Eye Research. 54, 30-48 (2016).
- Lau, P. E., Jenkins, K. S., Layton, C. J. Current evidence for the prevention of endophthalmitis in anti-VEGF intravitreal injections. Journal of Ophthalmology. 2018, 8567912(2018).
- Nche, E. N., Amer, R. Lens-induced uveitis: an update. Graefe's Archive for Clinical and Experimental Ophthalmology. 258 (7), 1359-1365 (2020).
- Chu, C. J., et al. Assessment and in vivo scoring of murine experimental autoimmune uveoretinitis using optical coherence tomography. PLoS ONE. 8 (5), 63002(2013).
- Harimoto, K., Ito, M., Karasawa, Y., Sakurai, Y., Takeuchi, M. Evaluation of mouse experimental autoimmune uveoretinitis by spectral domain optical coherence tomography. The British Journal of Ophthalmology. 98 (6), 808-812 (2014).
- Li, Y., Lowder, C., Zhang, X., Huang, D. Anterior chamber cell grading by optical coherence tomography. Investigative Ophthalmology & Visual Science. 54 (1), 258-265 (2013).
- Bell, O. H., et al. Single eye mRNA-seq reveals normalisation of the retinal microglial transcriptome following acute inflammation. Frontiers in Immunology. 10, 3033(2019).
- Lipski, D. A., et al. Retinal endothelial cell phenotypic modifications during experimental autoimmune uveitis: a transcriptomic approach. BMC Ophthalmology. 20 (1), 106(2020).
- Agarwal, R. K., Silver, P. B., Caspi, R. R. Rodent Models of Experimental Autoimmune Uveitis. Autoimmunity. Methods in Molecular Biology (Methods and Protocols). Perl, A. , Humana Press. Totowa, NJ. 443-469 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。