Method Article
Post-Enfeksiyöz Üveit için Bir Model Olarak Astarlanmış Mikobakteriyel Üveit (PMU)
Bu Makalede
Özet
Bu protokol, farelerde Astarlı Mikobakteriyel Üveit'i (PMU) indükleme adımlarını özetlemektedir. Bu yöntem, fare modeli sisteminde güvenilir ve sağlam oküler inflamasyon üretmeye yardımcı olacak adımları özetlemektedir. Bu protokolü kullanarak, immünolojik, transkriptomik ve proteomik tahlillerle daha ileri değerlendirme için tek hayvanlardan uveitik gözler ve iltihapsız diğer gözler ürettik.
Özet
'Üveit' terimi, hepsinde göz içi inflamasyon bulunan heterojen bir dizi durumu tanımlar. Genel olarak, üveit etiyoloji ile tanımlanır: enfeksiyon veya otoimmünite. Enfeksiyöz üveit, uygun antimikrobiyal ajanlarla tedavi gerektirirken, otoimmün üveit, kortikosteroidler veya diğer immünsüpresif ajanlarla tedavi gerektirir. Post-enfeksiyöz üveit, ilk enfeksiyonu takiben immün sekeli kontrol etmek için kortikosteroid gerektiren kronik bir üveit şeklidir. Mycobacterium tuberculosis (Mtb ) enfeksiyonu ile ilişkili üveit, post-enfeksiyöz üveitin iyi bilinen bir şeklidir, ancak hastalığın mekanizmaları tam olarak anlaşılamamıştır. Mikobakteriyel antijenlerin ve doğuştan gelen ligandların mTB enfeksiyonunu takiben kronik oküler inflamasyonu uyarmada oynadığı rolü anlamak için, farelerde kullanılmak üzere Primed Mycobacterial Uveitis (PMU) modeli geliştirilmiştir. Bu yazıda renkli fundus ve optik koherens tomografi (OCT) görüntülemesi kullanılarak PMU oluşturma ve inflamasyonun klinik seyrini izleme yöntemleri özetlenmiştir. PMU, ısıl öldürücü mikobakteriyel ekstrakt ile bağışıklama ve ardından aynı ekstraktın yedi gün sonra bir göze intravitreal enjeksiyonu ile indüklenir. Oküler inflamasyon, in vivo görüntüleme kullanılarak uzunlamasına izlenir ve ardından histoloji, akış sitometrisi, sitokin analizi, qPCR veya mRNA dizilimi dahil olmak üzere çok çeşitli tahliller için örnek toplanır. PMU'nun fare modeli, mTB'ye oküler yanıtları, kronik üveit mekanizmasını incelemek ve yeni anti-enflamatuar tedavilerin klinik öncesi etkinlik testleri için yararlı yeni bir araçtır.
Giriş
'Üveit' terimi, hepsinde göz içi inflamasyon1 bulunan heterojen bir dizi durumu tanımlar. Üveitin hayvan modelleri, hastalık mekanizmalarını anlamak ve yeni tedavilerin klinik öncesi testleri için önemlidir. Üveitin bir dizi hayvan modeli oluşturulmuştur2. En kapsamlı olarak çalışılan ikisi deneysel otoimmün üveit (veya üveoretinit; EAU) ve endotoksin kaynaklı üveit (EIU). EAU tipik olarak oküler antijenlerle immünizasyon ile üretilir veya AIRE geninin yokluğunda merkezi tolerans bozulduğunda kendiliğinden ortaya çıkabilir 3,4. Modelin diğer varyantları o zamandan beri farklı uveitojenik peptitleri içerecek şekilde 5,6,7 geliştirilmiştir; bunlarkapsamlı bir şekilde gözden geçirilmiştir 8,9,10. EAU, insanlarda Vogt-Koyanagi-Harada hastalığı ve birdshot chorioretinitis gibi T hücresine bağımlı otoimmün üveit formları için birincil modeldir. EIU, bakteriyel lipopolisakkarit (LPS) 10,11'in sistemik veya lokal enjeksiyonu ile üretilir. EIU, doğuştan gelen immün sinyal yolaklarının aktivasyonu ile üretilen akut üveit modeli olarak kullanılmıştır12. Her iki model de oküler immünolojinin mevcut anlayışında etkili olmuştur, ancak ikisi de post-enfeksiyöz kronik üveit için etkili modeller değildir. Son zamanlarda farelerde kurulan Primed Mikobakteriyel Üveit (PMU) modeli, şimdi bu üveit13 formunun klinik ve hücresel yönlerini sorgulamak ve değerlendirmek için bir yaklaşım sunmaktadır.
Dünya Sağlık Örgütü tarafından 2019 yılında bildirilen 10 milyondan fazla yeni vaka ve 1,4 milyondan fazla ölümle dünya çapında yüksek bir mikobakteriyel enfeksiyon prevalansı vardır14. Aktif tüberküloz (TB) enfeksiyonunun ekstrapulmoner bulguları üveiti içerir ve enfeksiyöz üveitin iyi bilinen bir nedenidir15,16. TB ile ilişkili üveitin belirtileri proteandır ve muhtemelen doğrudan oküler enfeksiyonun yanı sıra daha az iyi anlaşılmış immün aracılı inflamasyonu içeren birçok farklı hastalık mekanizmasını yansıtır17,18,19. Bu post-enfeksiyöz sekeller için önerilen mekanizmalar, retinal pigment epitelinde (RPE) bir pauci-basiller enfeksiyonun kalıcılığı ile uyarılan kronik bir enflamatuar yanıtı, başarılı bir şekilde temizlenmiş bir oküler enfeksiyondan kalan patojenle ilişkili moleküler paternlerin (PAMP'ler) varlığı ile uyarılan kronik bir enflamatuar yanıtı ve moleküler taklit veya antijen süreci yoluyla oküler antijenlere karşı adaptif immün yanıtın uygunsuz aktivasyonunu içerir. sistemik tüberküloz enfeksiyonunun neden olduğu yayılım20,21,22,23.
Kronik post-enfeksiyöz üveitin mekanik olarak daha iyi anlaşılmasını sağlamak ve mikobakteriyel antijenlerin hastalığın başlangıcındaki rolünü incelemek için, PMU modeli farelerde kullanılmak üzere geliştirilmiştir13,24. Buna göre, inflamasyonu ortaya çıkarmak için, fare ilk önce sistemik enfeksiyonu taklit etmek için ısıda öldürülen Mycobacterium tuberculosis H37Ra suşundan deri altı antijen enjeksiyonu alır, ardından yedi gün sonra lokal oküler enfeksiyonu taklit etmek için sol veya sağ göze uygulanan aynı antijenin intravitreal enjeksiyonu ile takip edilir. Takip eden üveitin yoğunluğu ve süresi, uzunlamasına in vivo Optik Koherens Tomografi (OCT) ve gözün fundal görüntülemesi ile izlenir25. PMU, vitrit, perivasküler retina inflamasyonu ve dış retinal hasarın fokal alanları ile kronik T hücresi baskın posterior üveite dönüşen akut, miyeloid dominant panüveit ile karakterizedir26. Gözün arka segmentinde granülomatöz inflamasyonun varlığı, PMU modelinin, geçmiş Mtb enfeksiyonunun immünolojik kanıtı olan hastalarda görülen bazı anterior (granülomatöz ve granülomatöz olmayan) ve ara üveit formlarını incelemek için kullanılabileceğini düşündürmektedir27. Ek olarak, PMU modelinde kullanılan ısıdan öldürülen Mtb'nin bileşenlerinin, anti-tüberküloz tedavisine (ATT) yanıt veren oküler tüberkülozlu hastalarda tekrarlayan üveitin altında yatan immün yanıtları tetiklediği öne sürülmüştür (ATT)28. EAU ve EIU ile karşılaştırıldığında hastalığın başlaması ve inflamatuar seyrindeki farklılıklar nedeniyle, PMU, oküler antijenlerle immünizasyona bağımlı olmayan ve kronik üveitli hastalarda hastalık mekanizmalarını aydınlatmaya yardımcı olabilecek yeni bir üveit hayvan modelini temsil etmektedir. Bu protokol, PMU oluşturma, inflamasyonun klinik seyrini izleme ve akış sitometrisi ile post-mortem analiz için oküler örneklerin toplanması için yöntemleri özetlemektedir.
Protokol
Yapılan tüm prosedürler, Washington Üniversitesi Hayvan Bakımı ve Kullanımı Komitesi (hayvan çalışma protokolü # 4481-02) tarafından veya Birleşik Krallık İçişleri Bakanlığı lisansı (PPL 30/3281) ve Bristol Üniversitesi Etik İnceleme Grubu ile uyumlu olarak yerel olarak onaylanmıştır. Her iki kurumda da yapılan deneyler, Görme ve Oftalmoloji Araştırmaları Derneği (ARVO) Oftalmik ve Görsel Araştırmalarda Hayvanların Kullanımı Beyanı ile uyumluydu. PMU, 6-10 haftalık C57BL / 6J farelerde üretildi; Tüm fareler üveit indüksiyonu sırasında en az 18 g ağırlığındaydı ve Crb1 geni29'un rd8 mutasyonu için negatif olarak doğrulandı. Fareler, spesifik patojensiz koşullar altında standart chow ve ilaçlı su (asetaminofen 200-300 mg / kg / gün) ad libitum ile muhafaza edildi. Hayvan ötenazisi, standart bir karbondioksit inhalasyon yöntemi30 kullanılarak gerçekleştirildi.
1. Subkutan enjeksiyon için antijen hazırlığı
- Mtb H37Ra tozu ile solunmasını veya cilt temasını önlemek için bu bölümdeki tüm prosedürleri kimyasal bir duman davlumbazının içinde gerçekleştirin. Complete Freund's Adjuvant (tipik olarak BSL-1) için kurumsal politikalarınıza göre davranın. Bu, kimyasallara dayanıklı eldivenler, güvenlik gözlükleri ve koruyucu iş kıyafetleri (laboratuvar önlüğü) kullanmayı içerir.
- Deney hayvanlarına sokulacak reaktiflerin kontaminasyonunu önlemek için iyi bir steril teknik kullanın.
- PBS'de Mtb süspansiyonunu, 5 mL'lik bir mikrosantrifüj tüpünde 5 mg liyofilize, ısıl öldürücü M. tuberculosis H37Ra tozunu 2.5 mL soğuk PBS ile karıştırarak yapın. Vorteksi 30 sn boyunca bir kez yapın ve sonra buzun üzerine yerleştirin.
- PBS'de H37Ra'nın ince bir süspansiyonunu oluşturmak için, süspansiyonu 5 dakika boyunca buz üzerinde sonikleştirin.
- Konvertör ünitesinin gövdesini açın ve probu %70 (v/v) alkollü çubukla temizleyin.
- Sonikatöre basın, güç kontrol düğmesini çevirerek güç ayarını 4'e ayarlayın ve probun ucunu PBS içeren mikobakteriyel toza batırın. Prob ucunun numunenin derinliğinin en az yarısına daldırıldığından ve prob ucunun mikrosantrifüj tüpünün duvarına temas etmediğinden emin olun.
- Karışımı buz üzerinde 30 s boyunca sonikleştirin, 30 s duraklatın ve tozu sıvıyı ısıtmadan eşit bir süspansiyona tamamen dağıtmak için toplam 5 dakika tekrarlayın.
- Karışıma 2.5 mL Freund'un Tamamlanmamış Adjuvanını ekleyin ve emülsiyon diş macunu benzeri bir kıvam oluşturana kadar sonikasyon işlemini buz üzerinde tekrarlayın.
- Kontrol düğmesini kullanarak gücü 0 olarak ayarlayın ve sonikasyonu sonlandırmak için üniteyi kapatın. Ucu süspansiyondan çıkarın ve probu alkollü çubukla silin.
- Antijen emülsiyonunu 4 °C'de saklayın. Emülsiyonun partilerini yapmak, deneyler arasında tutarlılık sağlamaya yardımcı olacaktır. Emülsiyon 4 °C'de 3 aya kadar saklanabilir.
2. Subkutan enjeksiyon
- İntravitreal enjeksiyondan bir hafta önce deri altı enjeksiyonu yapın (gün -7 olarak adlandırılır).
- Mikobakteriyel emülsiyon ile 1 mL'lik bir şırınga (iğne takılı değil) yükleyin. Emülsiyonun viskozitesi ve opaklığı nedeniyle, görülmesi zor hava kabarcıkları şırıngayı doldurabilir.
- Şırıngadaki hava kabarcıklarını önlemek için, 0.2-0.3 mL emülsiyon yükledikten sonra, şırıngayı ters çevirin (ucu yukarı bakacak şekilde) ve kabarcıkları yüzeye çıkarmak için şırıngayı bir tezgahın kenarına yavaşça hafifçe dokunun.
- Havayı şırıngadan dışarı atın ve şırıngayı doldurmaya devam edin. Ters çevirin ve dolana kadar aralıklı olarak dokunun.
- Şırıngaya 25 G'lık bir iğne yerleştirin ve iğneyi doldurmak için emülsiyonu ilerletin. Şırıngayı kullanılana kadar buz üzerinde saklayın.
- Subkutan enjeksiyonu güvenli bir şekilde gerçekleştirmek için, fareyi uyuşturun veya hayvanın arka kısımlarına kolay erişim sağlayan insancıl kısıtlama yöntemlerini kullanın31.
- Subkutan enjeksiyon için anestezi yapmak için, hayvanı bir izofluran indüksiyon odasına yerleştirin (indüksiyon için% 3-4 ve bakım için% 1-3). Anestezi uygulandıktan sonra, farenin yavaş bir solunum hızına sahip olduğundan ve solunum sıkıntısı belirtisi göstermediğinden emin olun.
- Subkutan enjeksiyonları kalçaların dorsal yüzeyine veya inguinal lenf nodlarının bölgesine proksimal bacakların ventral yüzeyine yerleştirin.
- Kasın içine enjekte edilmesini önlemek için iğneyi dikkatlice yerleştirin. Mtb emülsiyonunun 0.05 mL'sini deri altı boşluğuna enjekte edin. Kalın emülsiyonun tamamen enjekte edilmesini sağlamak için iğneyi hemen çıkarmayın.
- Enjeksiyonu hem sol hem de sağ tarafta, hayvan başına toplam 0,1 mL boyunca tekrarlayın.
- Anestezi uygulanmışsa, fareyi tamamen iyileşene kadar sıcak bir ısıtma yastığına yerleştirin. Sternal yatışlığı korumak için yeterli bilinci yeniden kazanana kadar fareyi gözetimsiz bırakmayın.
- Tamamen iyileştikten sonra fareyi kafesine geri döndürün ve kafes kartını deri altı enjeksiyon tarihi ile etiketleyin.
- Oral asetaminofen (200 mg / kg / gün) ile analjezi sağlayın, ancak anti-enflamatuar ajanlar üveit indüksiyonunu etkileyebileceğinden NSAID'ler sağlamaz.
3. İntravitreal enjeksiyon için antijen stok hazırlığı
- İntravitreal Mtb süspansiyonunun kontaminasyonunu önlemek için bu bölümdeki tüm prosedürleri uygun steril koşullar altında gerçekleştirin.
- İntravitreal süspansiyonları yapın.
- Hafif ila orta dereceli panüveit indüksiyonu için, 1 mL 1x PBS'ye 5 mg mikobakteri ekstraktı ekleyerek intravitreal süspansiyonu 5 mg / mL konsantrasyonda yapın.
- Orta ila şiddetli panüveit indüksiyonu için, 1 mL 1x PBS'ye 10 mg mikobakteri ekstraktı ekleyerek intravitreal süspansiyonu 10 mg / mL konsantrasyonda yapın.
- Vorteksi 30 sn boyunca bir kez yapın ve sonra buzun üzerine yerleştirin.
- PBS'de H37Ra'nın ince bir süspansiyonunu oluşturmak için, süspansiyonu adım 1.4'te açıklandığı gibi 10 dakika boyunca buz üzerinde sonikleştirin. Bu stok çözeltisini 100 μL hacimlerde alıkoyun ve -20 °C'de saklayın.
- Kullanmadan önce, oda sıcaklığında çözün ve 1 dakika boyunca yüksekte vorteks yapın. Hayvan tesisine taşınırken alikotları buz üzerinde tutun.
4. 0. günde intravitreal enjeksiyon prosedürü
- Hayvan hazırlığı
- Takılı muayene eldivenleri giyin, ağırlığını gram cinsinden elde etmek için fareyi bir tartım terazisine yerleştirin.
- Hayvanı uyuşturmak için steril suyla karıştırılmış 100 mg / mL Ketamin ve 20 mg / mL Ksilazin içeren bir çözeltinin 0.02 mL / g vücut ağırlığına intraperitoneal enjeksiyonu yapın. Alternatif bir yaklaşım, ~% 1.5 izofluran (solunan) kullanılarak indüksiyonu içerir.
- Farenin uykuya dalması için yaklaşık 2 dakika bekleyin ve ardından fareyi bir ısıtma kutusuna yerleştirip kapağı örtün. İşlem için anestezi derinliğini değerlendirmek için kulak, ayak parmağı ve kuyruk sıkışması gibi ağrı refleks testleri yapın32.
- Uyuduktan sonra, korneayı 1 damla% 0.5 (v / v) tetrakain ile uyuşturun. Tetrakaini farenin burnuna veya ağzına yakın bir yere götürmekten kaçının. 10 saniye sonra, fazla sıvıyı temizleyin.
NOT: Topikal anestezi uygulandığında, muhtemelen kombine sistemik ve topikal anestezi ile kornea refleks supresyonunun iyileşmesi nedeniyle, iris dilatasyonu ve ön kamara (AC) görselleştirmesinin iyileştiği gözlenmiştir. Ancak, istenirse bu adım atlanabilir. - Öğrenciyi 1 damla% 2.5 (v / v) fenilefrin ile genişletin. Burun veya ağza girebilecek aşırı damlacıkları önlemek için dikkatli olun. 2-3 dakika sonra, fazla sıvıyı temizleyin.
- Endoftalmi riskini azaltmak için, göz yüzeyine ve çevresindeki saçlara 1 damla% 5 betadin ekleyin. 2-3 dakika göz üzerinde bırakın.
NOT: Endoftalmi önlemek için bu bölümdeki tüm prosedürleri uygun steril koşullar altında gerçekleştirin. - Betadini çıkarın ve anestezi altında kuruluğu önlemek için gözü hipromeloz (% 0.3) veya% 0.2 w / w ile örtün. Bu aynı zamanda katarakt oluşumunu önlemeye yardımcı olacaktır.
- Mikroenjeksiyon sisteminin kurulması
- İntravitreal enjeksiyonu, bir mikroşırınga pompası kontrolörüne bağlı bir mikropompa ve bir enjeksiyon şırıngası kullanarak gerçekleştirin (Şekil 1A-C). Alternatif olarak, alt bölüm 4.4'te açıklandığı gibi bir Hamilton şırıngasına bağlı 33 G'lik bir iğne ile enjekte edin.
- Enjektörü monte etmek için enjeksiyon tutucuya 34 G'lik bir iğne bağlayın. Enjeksiyon tutucunun ön ucundaki gümüş vidalı kapağı gevşetin ve iğneyi tutucunun gövdesine yaklaşık yarıya kadar kaydırın. Gümüş vidalı kapağı parmağınızla sıkın.
- Boruyu, 4.2.4-4.2.5 adımlarında belirtildiği gibi enjeksiyon tutucuya bağlayın.
- Boruyu enjeksiyon tutucuya yerleştirmek için, tutucunun arka ucundaki plastik vidayı gevşetin, boruyu içindeki contadan kaydırın ve vidayı sıkın.
- Enjeksiyon sırasında boru hasarını önlemek için borunun ucunda hafif bir boşluk bırakın. Şekil 1C'ye bakınız.
- Mikobakteri stok süspansiyonunun 100 μL'lik bir alikotunu çözün.
- % 1'lik bir floresein sodyum (AK-Flor) çözeltisinden 3 μL ekleyin ve vorteks kuyusu ekleyin.
- Herhangi bir hava kabarcığı eklemeden antijen ve floresein karışımı ile 10 μL'lik bir şırınga yükleyin.
- Yükleme iğnesini şırıngadan çıkarın ve uç şırınga gövdesindeki sıfır işaretine ulaşana kadar boruyu gümüş vidalı kapak contasından kaydırın.
- Borunun ucu istenen konuma doğru bir şekilde hizalandıktan sonra, vidalı kapağı parmağınızı sıkıca sıkın.
- Sistemi tamamen yüklemek için şırıngadaki çözeltiyi enjeksiyon borusundan yıkayın. Ardından, şırıngayı enjeksiyon için yeniden yüklemek için 4.2.8-4.2.11 adımlarını tekrarlayın.
- Yüklü şırıngayı mikro pompaya monte etmek için, şırınga kelepçelerini açmak üzere mikro pompanın sonundaki kelepçe serbest bırakma düğmesine basın.
- Pistonun kapağını mikro pompanın arka ucundaki piston kapağı tutucusuna yerleştirin.
- Daha sonra şırınga tasmasını yaka durağına ve şırınga gövdesini şırınga kelepçesine kaydırın.
- Kelepçe düğmesini serbest bırakın ve piston tutma vidasını sıkın. Şekil 1D'ye bakın.
- Enjeksiyon tutucuyu ve iğneyi stereotaktik enjeksiyon aparatı üzerindeki o-kelepçesinden kaydırın. Bu özel bir platformdur; alternatif olarak, şırınga manuel olarak tutulabilir ve konumlandırılabilir.
- Mikroşırınga pompası kontrolöründeki infüzyon hacmini ve infüzyon hacmi oranını, sırasıyla 40 nL / s oranında döngü başına 500 nL enjekte edecek şekilde ayarlayın.
NOT: Daha hızlı enjeksiyon hızları kullanılabilir, ancak iğne yeniden konumlandırması sağlanmadan önce daha fazla reflü yaşanabilir. - İntravitreal enjeksiyon yapmadan önce doğru çalıştığından emin olmak için sistemi test edin.
NOT: Enjeksiyon sistemi doğru çalıştığında, ayak pedalı veya kontrol pedi kullanılarak bir enjeksiyon döngüsünün aktivasyonu, piston kapağı tutucusunun görünür hareketini üretecek ve iğnenin ucunda küçük bir yeşilimsi sıvı damlacığı görülecektir. Sıvı üretilmemesi durumunda, ek döngüleri etkinleştirin veya şırıngayı yıkayın ve yeniden yükleyin. - Göze enjekte etmeden önce, iğneyi% 95 etanol pedi ile nazikçe silin.
- İntravitreal enjeksiyon prosedürü
- Fare, enjeksiyon prosedürünü gerçekleştirmek için stereotaksik bir aparat üzerine yerleştirilir.
- Farenin üzerinde durduğu sahneyi/platformu yüzeyine 2-3 kağıt havlu takarak sıcak tutun.
- Fareyi platformda eğilimli bir konuma getirin. Hayvanın kafasını hafifçe sabitlemek için sağ ve sol kulak çubuklarını kullanın. Şekil 1E'ye bakın.
- Fareyi konumlandırın ve sağ gözün üstün burun yönü görülebilecek şekilde kapsamın altına doğru yönlendirin.
- Kirpikleri yerinden çıkarmak ve sklerayı açığa çıkarmak için 30 G'lik bir iğne kullanın. Limbus ve radyal kan damarını görselleştirin.
- Sklerada limbusun 1-2 mm posteriorunda bir kılavuz delik açmak için steril bir 30 G iğne kullanın.
- Enjeksiyon tutucuya bağlı 34 G iğneyi, kılavuz deliğinden lensten kaçınacak bir açıyla göze yerleştirin, ancak iğne ucunu vitreus boşluğuna yerleştirin.
- Mikroşırınga pompa kontrolörünü kullanarak, Mtb ekstraktının 1 μL'sini vitreus boşluğuna dikkatlice enjekte edin. Tutarlı reflü durumunda, yeterli doz verilmesini sağlamak için enjeksiyon hacmini 1.5 μL'ye yükseltin.
NOT: Sahte kontroller için, hayvanın gözüne 1 μL PBS enjekte edin. - Gözdeki yeşilimsi bir refleksi görselleştirerek intravitreal yerleşimi doğrulayın. Şekil 1F'ye bakın.
- 10 sn sonra iğneyi gözden çekin. Herhangi bir reflüye dikkat edin.
- Fareyi platformdan çıkarın, kornea koruması için her iki göze % 0.3 hipromeloz veya% 0.2 w / w karbomer göz merhemi yerleştirin ve iyileşme ısıtma kutusuna geçin.
- Sternal yatışlığı korumak için yeterli bilinci yeniden kazanana kadar fareyi gözetimsiz bırakmayın. Tamamen iyileşene kadar diğer hayvanların şirketine geri dönmeyin.
- Fare tamamen uyanık olduğunda, kafese geri dönün ve asetaminofen (200-300 mg / kg / gün) ilaçlı su şişesi ekleyin. Kafes kartını IVT enjeksiyon tarihi ile etiketleyin.
- İntravitreal enjeksiyonlar genellikle iyi tolere edilir. Ağrıyı ve çalışmadan çıkarılma ihtiyacını gösterebilecek klinik belirtiler arasında perioküler alopesi (kendi kendine travmanın göstergesi), kornea ülserasyonu, kilo kaybı ve kambur duruş sayılabilir.
- İntravitreal enjeksiyon için alternatif yöntem
NOT: Bu prosedür, bir mikroşırınga üzerinde bir işletim mikroskobu ve 33 G'lik bir iğne kullanılarak gerçekleştirilir.- Gözü proptoz haline getirin ve bir çift forseps ile pozisyonda tutun.
- Daha sonra karbomer göz jeli % 0.2 w / w veya% 0.3 hipromeloz göz jeli uygulayın ve gözün üzerine dairesel bir örtü kayması (7 mm çapında) yerleştirin.
- 5 μL Hamilton şırıngasına 33 G'lik bir hipodermik iğne takın ve ~ 45 ° enjeksiyon açısıyla kornea limbusuna yaklaşık 2 mm çevre içine yerleştirin.
- İğne eğimini vitreusun içine doğru yönlendirin, lens ile optik disk arasında durun (cerrahın göreceli bakış açısından, bu optik diskin üstünde / kaplıdır - yerleştirme bölgesinden yaklaşık 1,5 mm) ve yavaşça 2 μL Mtb (PBS'de 2,5 ug / μL'de) enjekte edin.
- İğneyi kısa bir süre yerinde tutun (enjekte edilen reflü miktarını azaltmak için) ve ardından çıkarın.
- Enjeksiyon sonrası, forsepsleri serbest bırakarak dünyayı yeniden konumlandırın. Enjeksiyon sonrası endoftalmite karşı ek koruma sağlamak için şu anda göze% 1'lik bir damla w / w kloramfenikol merhem uygulanabilir.
- Enjeksiyon sonrası, 4.3.11-4.3.13 adımlarında belirtildiği gibi iyileşme ısınma kutusuna geçin.
5. Üveiti tespit etmek ve ölçmek için OCT görüntüleme
- Hayvan hazırlığı
- Fareyi adım 4.1.2-4.1.4'te açıklandığı gibi anestezi altına alın
- Öğrenciyi 1 damla% 2.5 fenilefrin ile genişletin. Burun veya ağza girebilecek aşırı damlacıkları önlemek için dikkatli olun. 2-3 dakika sonra, fazla sıvıyı temizleyin.
- Anestezi altındayken kuruluğu önlemek için göz üzerine% 0.3 hipromeloz veya% 0.2 w / w karbomer jel yerleştirin. Bu aynı zamanda katarakt oluşumunu önlemeye yardımcı olacaktır.
- Vücut sıcaklığını korumak için fareyi bir cerrahi gazlı bez tabakasına sarın ve hayvan kasetine yerleştirin. Kafayı ısırık çubuğuyla konumlandırın.
- Ön ve arka odaların OCT görüntülerini elde edin.
NOT: Ön ve arka kamara görüntüleri elde ediliyorsa, katarakt oluşumunu takiben görüntü bozulmasını önlemek için önce arka kamara (PC) görüntülerini elde edin. Katarakt oluşumu sık yağlama ve %0.3 hipromeloz veya %0.2 karbomer göz jeli ile önlenebilir. Uzun süreli görüntüleme için (>10 dakika), fareyi sıcak tutmak (bir ısı yastığı kullanarak) da yardımcı olur.- OCT görüntüleme sistemini açtıktan sonra, doğru görüntüleme lensini sabitleyin ve referans kolu konumunu gerektiği gibi ayarlayın.
- Görüntüleme yazılımını açın, benzersiz fare kimliğini oluşturun ve OCT üreticisinin protokolüne göre görüntülemeye başlayın.
- Hızlı tarama protokolü ile Serbest Çalıştırma seçeneğini kullanarak, gözü optik sinir arka kamara görüntülerine veya korneanın tepesine ortalanmış olarak ön kamara görüntülerine yerleştirin.
NOT: Tablo 1 , ticari olarak temin edilebilen iki küçük hayvan görüntüleme sistemi için görüntüleme protokolü parametrelerini içermektedir. Ürün özellikleri için Malzeme Tablosu'na bakın. - Arka kamara görüntüleme için, OCT'yi göz yüzeyine yaklaştırın. Lensin yüzeyini gözle temas ettirmekten kaçınmak için dikkatli olun.
- Göz doğru şekilde konumlandırıldıktan sonra, hızlı taramayı durdurun ve ses tarama protokolünü seçin ve taramayı Hedefle seçeneğiyle etkinleştirin.
- Arka segment görüntüleri için, optik sinir Yatay B-Tarama Hizalama görüntüsünde ortalanana ve retina Dikey Hizalama ekseni ile hizalanana kadar ayarlayın
- Ön segment görüntüleri için, hem Yatay B-Tarama Hizalama görüntüsünde hem de Dikey Hizalama B-Tarama Hizalama görüntüsünde korneanın tepesini ortalayacak konumu ayarlayın. Her iki görüntüde de bir yansıma artefaktının varlığı, doğru hizalamayı doğrulayacaktır. Ardından, yatay görüntüyü yansıma yapıtını kaldıracak kadar kaydırın. Şekil 2'ye bakın.
- Birim tarama görüntüsünü yakalamak için Anlık Görüntü'ye tıklayın ve ardından Kaydet'e tıklayın.
- Ardından, ortalaması alınan merkezi hat taramasını elde edin. Tarama protokolünü açın ve Hedef'e ve ardından Anlık Görüntü'ye tıklayın. Aynı panele sağ tıklayın ve ardından Ortalama'ya tıklayın.
- Her iki lense de sahip her göz için 5.2.1-5.2.9 arasındaki adımları tekrarlayın.
- Tüm görüntüler toplandıktan sonra, fareyi kasetten çıkarın ve 4.3.11-4.3.13 numaralı adımlarda listelendiği gibi iyileşme sırasında kornea koruması sağlayın.
6. OKT ile inflamasyonu puanlama
- OCT görüntülerini, tedavi durumuna maskelenmiş greyderlerin yardımıyla puanlayın.
NOT: Fare modelindeki PMU için, Tablo 2'de sağlanan puanlama sistemi önerilir. - Hem ön kamara (AC) hem de arka kamara (PC) görüntüleri elde edildiyse, her göz için nihai skoru elde etmek için bu puanları birleştirin.
NOT: Ön kamara iltihabı, arka kamara iltihabından önce düzelir.
7. Post-mortem histoloji ile inflamasyonun puanlanması
- Deneyin sonunda, enükleasyon yoluyla bireysel gözleri toplayın, gece boyunca% 4 formaldehit içinde sabitleyin ve parafin gömme, kesitleme ve H & E boyama33 için devam edin.
NOT: Pupilla-optik sinir ekseni boyunca birden fazla 4-8 μm kesit önerilir.
NOT: Göz başına üç bölüm, maskeli bir not veren tarafından Tablo 3'te verilen puanlama sistemi kullanılarak puanlanır ve üç bölümün ortalama puanı, son histoloji inflamasyon skoru olarak rapor edilir.
Sonuçlar
Bu protokol, astarlanmış mikobakteriyel üveit modelini (PMU) kullanarak farelerde üveit indüksiyonunu göstermektedir. Subkutan enjeksiyonda tutarlılığın sağlanması ve intravitreal enjeksiyonun doğruluğu, astarlanmış mikobakteriyel üveit modelinin (PMU) geliştirilmesinde kilit adımlardır. Şekil 1 , stereotaksik bir aparat kullanarak fare intravitreal enjeksiyon prosedürünü göstermektedir. Kulak çubukları, kafayı mikroskop altında aynı yere hafifçe yerleştirmeye yardımcı olur (Şekil 1E). Ayrıca intravitreal enjeksiyon prosedürü sırasında kafayı sabit tutarlar ve bu da enjeksiyon travması riskini azaltır. Başarılı bir enjeksiyonun ardından, enjeksiyon çözeltisindeki floresein, mikroskop altında veya Şekil 1F'de gösterildiği gibi yan görünümden görülebilen gözün içinden yeşilimsi bir yansıma üretir.
Belirtildiği gibi yapıldığında, protokol, intravitreal enjeksiyondan 10 saat sonra OCT ve fundus görüntüleme kullanılarak tespit edilebilen sağlam akut üveit üretir. Şekil 2 , OCT görüntüleme için gözün doğru hizalanmasını göstermektedir. Tablo 1A , OCT protokolünde kullanılan parametreleri listeler. Görüntü elde etmek için sistematik bir yaklaşım, zaman içinde karşılaştırılabilecek yüksek kaliteli görüntüler sağlayacaktır. Ön kamara görüntüleri, en face SLO görüntüsü (Şekil 2A) kullanılarak korneanın tepesinde ortalanır ve iris hem yatay hem de dikey düzlemlere paralel olarak hizalanır (Şekil 2B, C). Ses ve çizgi taramaları, alt ve üst bölgelerin aynı anda görüntülenebileceği şekilde dikey bir hizalamayla yakalanır. Arka segment görüntüleri, en face SLO görüntüsü kullanılarak optik sinir üzerinde ortalanır (Şekil 2D) ve retinayı hem yatay hem de dikey düzlemlere paralel olarak hizalamak için RPE'nin parlak bandı kullanılır (Şekil 2E, F).
Şekil 3, OCT görüntüleme kullanılarak PMU oküler inflamasyonunun tipik bulgularını göstermektedir. İntravitreal enjeksiyondan yirmi dört saat sonra sulu ve vitreusta inflamatuar hücreler görülür (Şekil 3B). Orta veya şiddetli inflamasyon varlığında, AC'deki inferior açıda bir hipopyon görülecektir. Oküler inflamasyonun derecesi, Tablo 2'de listelenen kriterler kullanılarak bu OCT görüntülerinde puanlanabilir. Her skor için tipik olan inflamatuar özellikleri gösteren görüntülerin temsili örnekleri Şekil 4'te gösterilmiştir. AC ve PC oda puanları, birleşik OCT skorunu oluşturmak için birlikte eklenebilir. Kombine skorlar >0, ancak ≤2.5 hafif inflamasyonu temsil eder. Orta derecede inflamasyon >2.5, ancak ≤4.5 skorları ile belirlenir. Skorlar >4.5 şiddetli inflamasyonu tanımlar. Enflamasyon tipik olarak intravitreal enjeksiyondan 48 saat sonra zirveye ulaşır ve AC ve PC'de OCT skorları 1 ile 3 arasındadır (2 ile 6 arasında kombine skorlar). 0,5 veya 4 AC ve PC puanları daha az yaygındır. Tipik aralığın dışındaki puanlarla sık sık karşılaşılması durumunda, aykırı değer puanlarına katkıda bulunan faktörleri belirlemek için sorun giderme gerekebilir (tartışma bölümüne bakın). Ön odadaki inflamasyon skorları, intravitreal enjeksiyonu takip eden bir hafta içinde sıfıra dönme eğilimindedir. Buna karşılık, posterior skorlar sıfıra dönmez; Bunun yerine, düşük seviyeli kronik inflamasyon vitrit şeklinde devam eder ve perivasküler lenfositler intravitreal enjeksiyonu takiben 1-2 ay boyunca retinaya sızar.
PMU'da inflamasyon skoru histoloji kullanılarak da belirlenebilir. Şekil 5 , PMU'nun ciddiyetinin histoloji ile puanlanmasında kullanılmak üzere temsili H&E bölümlerini göstermektedir. Sulu ve vitreustaki inflamatuar hücrelerin sayısı sayılır ve Tablo 3'te listelenen skor kriterleri kullanılarak şiddeti belirlemek için kullanılır. Siliyer cismin inflamatuar hücre infiltrasyonu hafif veya orta şiddette inflamasyonda sıklıkla histoloji bölümünün bir tarafında (tek taraflı tutulum) görülür. Enflamasyon şiddetli olduğunda, bu, lensin her iki tarafındaki siliyer gövdeye sızan inflamatuar bir hücrenin varlığı ile yansıtılır (bilateral tutulum olarak adlandırılır). İntravitreal enjeksiyondan sonraki zaman noktalarında, perivasküler ve intraretinal lökositlerin ve dış retinal kıvrımların varlığı da dahil olmak üzere kronik inflamasyon belirtileri de tanımlanabilir. Histoloji, zayıf enjeksiyon tekniklerinden etkilenen gözlerin tanımlanmasında da yardımcı olabilir. İntravitreal enjeksiyon sırasında lense travma, travma bölgesine bitişik lens kapsülünün dışında amorf eozin boyalı (pembe) lens proteinlerinin varlığı ile tanımlanabilir. İntravitreal mTB'nin subkonjonktival boşluğa reflü, kesitlerde bulunan perioküler yapıların dikkatli bir şekilde gözden geçirilmesiyle tanımlanabilen göz dışında iltihaplanma yaratacaktır. Gözlerde mTB ekstraktının tutulmaması nedeniyle, bu gözler tipik olarak düşük OCT inflamasyon skorlarına sahip olacaktır.
Brightfield fundus görüntüleme, hipopyon, vitrit ve retinal veya perivasküler inflamatuar hücre infiltrasyonunun gelişimi de dahil olmak üzere PMU'nun klinik olarak ilgili yönlerini tanımlamak için de kullanılabilir. Şekil 6 , fundus görüntülerinde retinal ve perivasküler inflamasyonun görülebildiği iki örnek göstermektedir. Bu iki göz ayrıca PMU modelinde yaygın olan iltihaplanma aralığını da gösterir. Tablo 1B'de fundus/retinal OCT görüntüleme sisteminde kullanılan parametreler listelenmiştir. Şiddetli inflamasyonun görüntü kalitesi (Şekil 6, gün 2, OCT ve en üst sıradaki fundus görüntüleri) ve 21. günde mevcut olan hastalığın derecesi üzerindeki etkisine dikkat edin. Kornea ödemi ayrıca akut inflamasyon sırasında görüntü kalitesini düşürebilir; Bununla birlikte, kornea ödeminin tek başına inflamasyondan şiddetli olması nadirdir. Daha yaygın olarak, görüntüleme ve anestezi olayları sırasında eksik yüzey korumasından kaynaklanan epitel hasarı nedeniyle görüntü kalitesi düşecektir.
PMU modeli, herhangi bir fare ırkında veya genotipinde üveiti indüklemek için kullanılabilir. Albino gözlerde, OCT hala inflamasyonu puanlamak için kullanılabilir, ancak fundus pigmentinin yokluğu, parlak alan görüntüleme13,34 ile inflamasyonun görselleştirilmesini zorlaştırır. Post mortem çalışmalar oküler dokular, bölgesel lenf düğümleri veya dalak üzerinde yapılabilir. Bazı örnekler arasında akım sitometrisi ve immünohistokimya gibi immün hücrelerin varlığı için testler ve inflamatuar sitokinlerin ölçümü sayılabilir. PMU ile inflamasyonun başlamasından sonra test edilen tüm zaman noktalarında (gün 1 ila gün 56), çok parametreli akış analizi12,35 ile gözdeki birçok majör lökosit popülasyonunu tespit etmek için bireysel gözlerde yeterli CD45 + inflamatuar hücre bulunmaktadır. Sulu (2-5 μL) ve vitreus (5-10 μL) mizahlar, protein konsantrasyonu tayini, proteomik çalışmalar veya sitokin konsantrasyonu tayini için iltihaplı gözlerden toplanabilir36.

Şekil 1: Fare intravitreal enjeksiyon kurulumu. İntravitreal enjeksiyon, fare gözünde (A) (B) Mikropompaya bağlı bir mikroşırınga pompası kontrolörü ve (C) bir enjeksiyon şırıngası kullanılarak gerçekleştirilir. Şırınga yüklenir ve (D) Mikropompaya monte edilir. Fare kafası, intravitreal enjeksiyon prosedürü sırasında stabilite ve tutarlılık sağlamak için (E) kulak çubukları kullanılarak konumlandırılmıştır. (F) Enjeksiyon çözeltisindeki floresein, başarılı bir işlemden sonra gözün içinden yeşilimsi bir yansıma üretir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
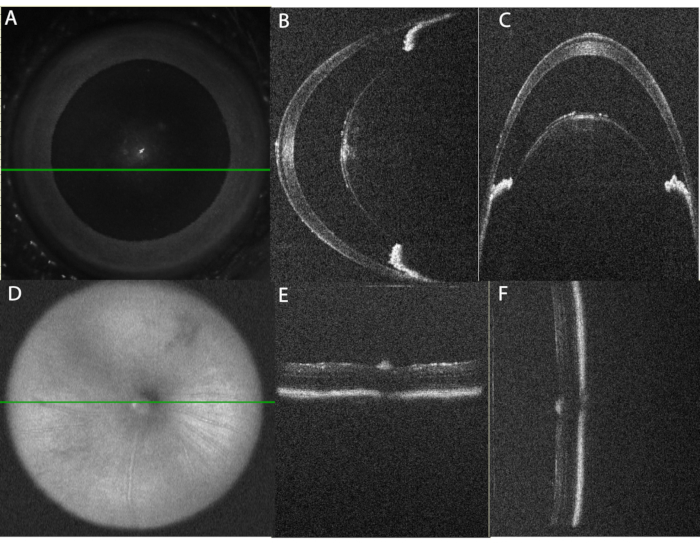
Şekil 2: OCT görüntüleme için gözün uygun şekilde hizalanması . (A) En-face taramalı lazer oftalmoskop (SLO) görüntüsü kullanılarak göz, ön kamara görüntülemesi için ortalanır. Yeşil çizgi, panelde (B) gösterilen yatay çizgi taramasının konumunu gösterir. Yansıma artefaktını azaltmak için merkezi korneadan kaçınıldığını unutmayın. (C) Parasantral ön odacıktan dikey B-Tarama. Bu tarama, yatay taramadan 90° C'de elde edilir. Lensin her iki tarafındaki iris bölümlerinin hizalamasının yatay taramada (panel B) eşit olduğunu ve dikey taramada (panel C) birbiri üzerine yerleştirildiğini unutmayın. (D) SLO görüntüsü kullanılarak, arka kamara görüntüsü optik sinir üzerinde ortalanır. (E) Yatay B-Tarama Hizalaması, (F) Dikey B-Tarama Hizalaması. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
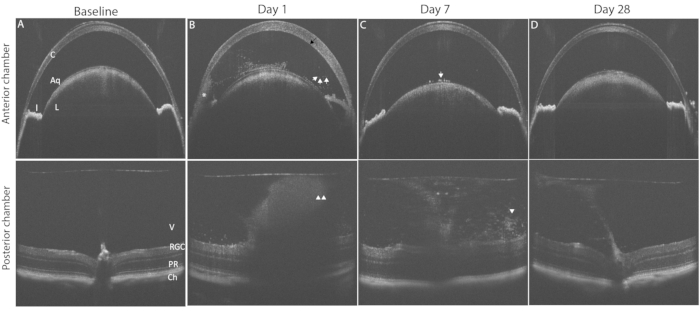
Şekil 3: PMU'nun indüksiyonu, uzunlamasına OCT görüntüleme ile izlenebilen panüveit oluşturur. Üst sıra ön kamara (AC) gösterir; alt sıra, hastalık seyrindeki patolojik değişiklikleri vurgulamak için arka kamara (PC) OCT görüntülerini gösterir. (A) Üveit indüksiyonundan önce AC (üstte) ve PC'nin (altta) temel OCT görüntüsü, her ikisi de 0 puan. (B) İntravitreal enjeksiyondan sonraki 1. gün, kornea ödemi (siyah ok), AC'de (beyaz oklar) çoklu serbest yüzen inflamatuar hücrelerin (*) ve PC'de vitritin (beyaz ok uçları) varlığını gösterir. (C) Ön lens kapsülünde az sayıda AC hücresi (beyaz ok) ve azalmış vitrit (beyaz ok ucu) ile intravitreal enjeksiyondan sonraki 7. gün. (D) İntravitreal enjeksiyondan sonraki 28. gün, AC inflamasyonu ve hafif vitriti çözülmüş ön kamara. Kısaltmalar: C- kornea, L - lens, I - iris, Aq - sulu, V vitreus, RGC - retinal ganglion hücreleri, PR - fotoreseptörler, Ch- koroid. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: OCT puanı örnekleri. Tablo 2'de gösterilen kategorik sistem kullanılarak her AC görüntüsüne ve PC görüntüsüne 0 ile 4 arasında bir OCT puanı atanır. AC ve PC skorları, gözün son OCT skoru için birleştirilir. (A,D) Sıfır puan örnekleri. (B,E) 0,5 puan örnekleri. (C,F) 1 puan örnekleri. (G,J) 2 puan örnekleri. (H,K) 3 puan örnekleri. (I,L) 4 puanlık örnekler I ve L panellerinde gösterilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
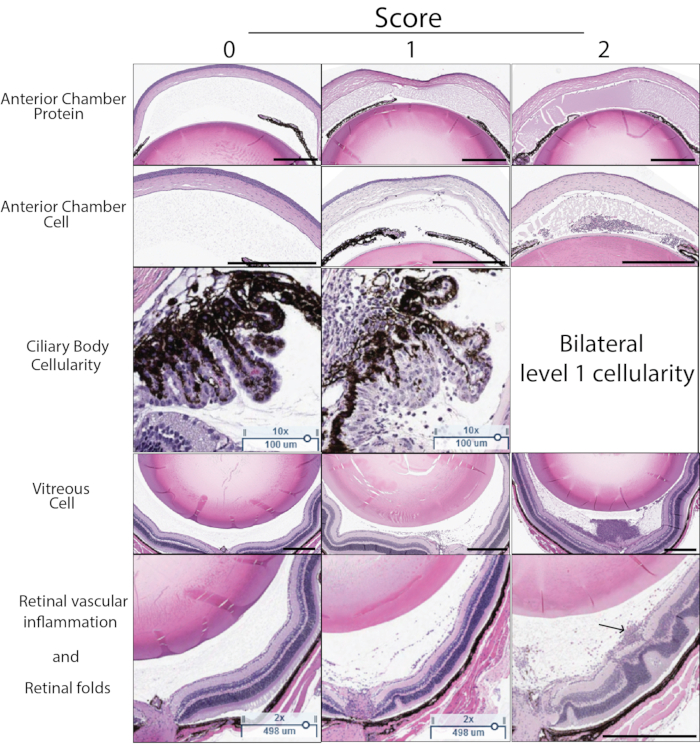
Şekil 5: Histoloji puanı örnekleri. Histoloji skoru, H&E kesitlerinde görülebilen beş özelliğe göre belirlenir: Ön kamara protein yoğunluğu, ön kamara hücre sayısı, siliyer cismin immün hücre infiltrasyonu, vitreus hücre yoğunluğu, retinal vasküler inflamasyon ve yapısal retinal değişiklikler. Her özellik için 0-2 arasında bir puan atanır. Her puanın açıklaması Tablo 3'te bulunur. Bu şekilde, her bir özellik için 0-2 arasında temsili bir örnek puan gösterilmektedir. Sol sütunda sıfır puanı gösterilir. Orta sütunda skor 1 örnekleri gösterilir. Sağ sütunda skor 2 örnekleri gösterilir. Aynı bölümdeki lensin her iki tarafındaki siliyer cisim hücresel inflamasyon gösteriyorsa, siliyer vücut skoru için 2 puan atanır. Son histoloji puanı, beş kriterin her biri için puanın toplamıdır (maksimum puan 10). Sağ alt paneldeki ok, yüzeysel retinal damarla ilişkili perivasküler lökositleri gösterir. Siyah ölçek çubuğu 500 μm'yi gösterir. Siliyer ölçek çubukları 100 μm'yi gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
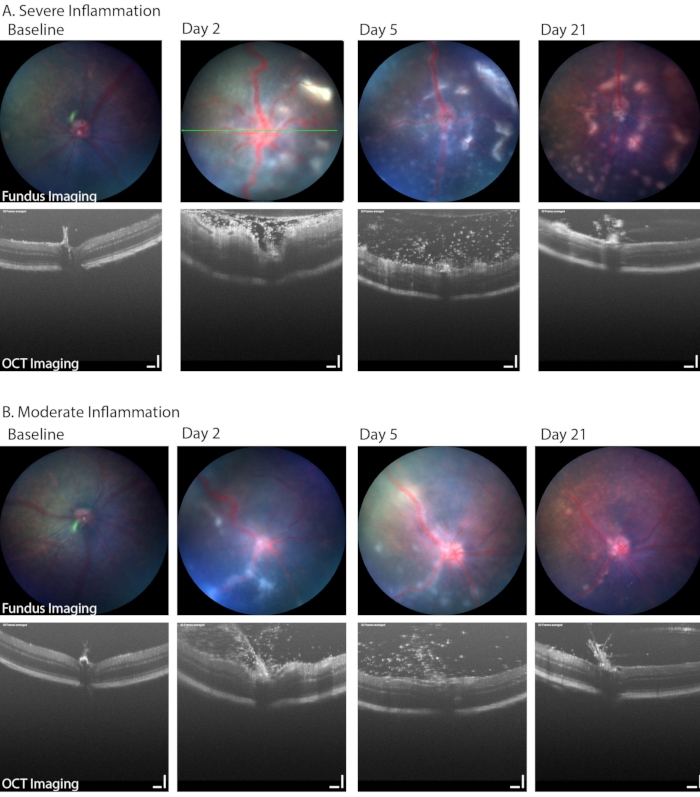
Şekil 6: PMÜ'de uzunlamasına fundus görüntülemede bir dizi hastalık şiddeti saptandı. (A) Şiddetli iltihaplı gözlerde retinada çoklu beyaz infiltrasyonlar ve renkli fundus görüntülemede (üst sıra) vasküler kıvrımlılığın yanı sıra 2. günde OCT'de (alt sıra) yoğun vitrit ve retinal ödem saptandı. Vitrit düzelirken retinal lezyonların sayısındaki ilerleme zamanla görülebilir. Yeşil çizgi, OCT görüntüsünün konumunu gösterir. (B) Hafif iltihaplı gözler, fundusta giderek daha az sayıda ayrık lineer lezyon ve vitreus boşluğunda bir dizi sızan hücre gösterir. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| A | |||
| Fare Ön Odası | Hızlı Tarama | Birim Taraması | Doğrusal Tarama |
| Uzunluk X Genişlik | 4,0 mm x 4,0 mm | 3,6 mm x 3,6 mm | 3,6 mm |
| Açı | 0 | 90 | 90 |
| A-tarama/B-Tarama | 800 | 1000 | 1000 |
| # B-taramaları | 50 | 400 | 1 |
| Çerçeveler / B-tarama | 1 | 3 | 20 |
| Fare Arka Odası | Hızlı Tarama | Birim Taraması | Doğrusal Tarama |
| Uzunluk X Genişlik | 1,6 mm x 1,6 mm | 1,6 mm x 1,6 mm | 1,6 mm |
| Açı | 0 | 0 | 0 |
| A-tarama/B-Tarama | 800 | 1000 | 1000 |
| # B-taramaları | 50 | 200 | 1 |
| Çerçeveler / B-tarama | 1 | 3 | 20 |
| B | |||
| Fare Arka Odası | Birim Taraması | Doğrusal Tarama | |
| Uzunluk X Genişlik | 0,9 mm x 0,9 mm | 1,8 mm | |
| Açı | 0 | Herhangi biri (genellikle 0 veya 90) | |
| A-tarama/B-Tarama | 1024 | 1024 | |
| # B-taramaları | 512 | 1 | |
| Çerçeveler / B-tarama | 1 | 30 |
Tablo 1: Tarama parametreleri. (A) OCT tarama parametreleri. (B) Fundus/retinal OCT tarama parametreleri
| OCT Puanı açıklamaları | ||||||
| Puan | Ön Oda | Arka Oda | ||||
| NA | Ön korneanın ötesinde görüş yok | Arka segmentin görünümü yok | ||||
| 0 | Enflamasyon yok | Enflamasyon yok | ||||
| 0.5 | Sulu suda 1-5 hücre | Vitröz alanın% 10'undan azını kaplayan az sayıda hücre | ||||
| VEYA kornea ödemi | Subretinal veya intraretinal infiltrasyon veya retinal mimari bozulma yok | |||||
| 1 | Sulu suda 6-20 hücre | Vitreus alanının% 10 ila% 50'sini kaplayan dağınık hücreler (yoğun kümeler yok). | ||||
| VEYA ön lens kapsülü üzerindeki tek bir hücre tabakası | Subretinal veya intraretinal infiltrasyon veya retinal mimari bozulma yok | |||||
| 2 | Sulu suda 20-100 hücre | Vitröz alanın% 50'sini > kaplayan dağınık hücreler (yoğun kümeler yok) | ||||
| VEYA 20'den az hücre ve bir hipopyon mevcut | Subretinal veya intraretinal infiltrasyon veya retinal mimari bozulma yok | |||||
| 3 | Sulu suda 20-100 hücre | Derece 2 ve 1'e eşit dağınık hücreler | ||||
| VE bir hipopyon VEYA pupilla zarı | VE vitreus alanının% 10-20'sini kaplayan en az bir yoğun vitreus opaklığı VEYA derece 2'ye eşit vitreus hücrelerinin varlığı ve nadir (≤ 2) subretinal veya ntraretinal opasiteler | |||||
| 4 | Herhangi bir sayıda sulu hücre | Yoğun vitreus opaklığı vitreus bölgesinin %20'> kaplar. | ||||
| VE ciddi inflamasyona bağlı büyük bir hipopyon ve pupilla zarı VEYA ön yapı kaybı | VEYA büyük subretinal veya intraretinal opaklıklara sahip diffüz vitreus hücreleri | |||||
Tablo 2: HSB OCT puan kriterleri: OCT görüntüleri tabloda listelenen kriterlere göre puanlanır. AC ve PC skorları gözün nihai skorunu elde etmek için eklenir. Gözün net bir görünümünün elde edilmediği durumlarda, görüntülere NA puanı atandı ve bunlar çalışmanın dışında bırakıldı.
| Histoloji Puanı Açıklaması | |||
| Özellik | 0 | 1 | 2 |
| Ön Kamara (AC) Proteini | AC'de eozin ile boyanan yetersiz asellüler parçacıkları | AC'nin herhangi bir yerinde orta, ancak birleşik olmayan, hücre dışı eozin boyama | AC boyunca konfluent veya nearfluent ekstrasellüler eozin boyama |
| Ön Kamara (AC) Hücre | Hücre yok | 1-100 hücre, ancak yoğun hücre kümelenmesi yok | >100 hücre veya yoğun hücre kümelenmeleri |
| Siliyer Vücut Enflamasyonu | Siliyer cisimcik veya çevresindeki vitreusun lökosit infiltrasyonu yoktur | Siliyer cisimcik ve/veya çevresindeki vitreusa sızan lökositlerin tek taraflı varlığı. | Siliyer cisimcik ve/veya çevresindeki vitreusa sızan lökositlerin bilateral varlığı. |
| Retinal Vasküler Enflamasyon | Perivasküler lökositli retinal damar yok | Perivasküler lökositlerle bölüm başına bir kap | > evreküler lökositli kesit başına 1 damar |
| Retina katlanması veya hasarı | Retina hasarı yok | Bölüm başına 1–3 retinal kıvrım | >3 kesit başına retinal kıvrımlar veya başka herhangi bir retina tabakası yıkımı veya retina içi kanama |
Tablo 3: HSB histoloji puan kriterleri: Gözün H&E bölümleri tabloda listelenen kriterlere göre puanlandı. Aynı gözden üç bölüm puanlandı ve gözün son histoloji skorunu elde etmek için ortalaması alındı.
Tartışmalar
Üveitin hayvan modelleri, oküler inflamasyon ve homeostaz mekanizmalarının anlaşılmasında ve üveitli hastalar için tıbbi ve cerrahi tedavilerin klinik öncesi değerlendirilmesinde etkili olmuştur37. PMU modelinin hem tavşan hem de sıçan varyantları, kavram kanıtı çalışmaları 38,39,40 ile klinik öncesi tedavideki değerlerini göstermiştir. Farelerde çeşitli transgenik suşların mevcudiyeti nedeniyle, fare PMU model sisteminin kurulması artık bu hastalığın patolojisine katkıda bulunan spesifik hücre tiplerini, yollarını ve genleri tanımlamak için daha ayrıntılı mekanik çalışmalara izin vermektedir.
Üveitin hayvan modelleri, inflamasyonun insidansı ve yoğunluğunda hayvandan hayvana değişkenlik gösterebilir41. C57BL/6 fare suşunda, PMU burada özetlenen protokol kullanılarak güvenilir bir şekilde oluşturulur. Hem EAU hem de EIU42,43 için üveit seyri ve yoğunluğundaki gerinime özgü değişiklikler bildirilmiştir. PMU'nun şiddeti ve seyri üzerindeki suşa özgü etkiler deneysel olarak ölçülmemiş olsa da, bu model vahşi tip C57BL / 6J'de ve albino farelerde (B6 (Cg) -Tyrc-2J / J) kullanılmış ve benzer enflamatuar yanıtlar üretmiştir. PMU modelini oluştururken, aşağıda listelenen hususları kontrol etmek, yeni araştırmacıların değişkenliği sınırlamasına ve en tutarlı ve tekrarlanabilir üveiti üretmesine yardımcı olabilir.
Subkutan enjeksiyonlarda tutarlılık sağlayın:
Tutarlı bir deri altı enjeksiyonu sağlamak için, tüm hava kabarcıklarının emülsiyondan çıkarıldığından emin olun. Dikkat edilmesi gereken noktalar, şırıngayı yüklemeden önce önceden hazırlanmış emülsiyonun kısa bir santrifüjünü (400 x g'de 30 s) içerir. Bu, emülsiyonda sıkışmış havayı giderecektir. Ayrıca, şırıngayı yüklerken, periyodik olarak ters çevirin (devrilme) ve hava kabarcıklarını gidermek için şırıngaya dokunun. Enjekte ederken, kas içi enjeksiyondan kaçınmak için şırıngayı çok derine yerleştirmeyin. Tersine, sığ (intradermal) bir enjeksiyon, emülsiyonun deriden erozyonuna neden olabilir. Kalın viskoz emülsiyonun tam enjeksiyonunu sağlamak ve deriden reflüyü önlemek için şırıngayı enjeksiyon bölgesinden çıkarmadan önce kısa bir süre duraklamayı unutmayın.
Subkutan enjeksiyonu yerleştirdikten yedi gün sonra, arka bacakların her iki tarafında palpe edilebilir nodüllerin varlığını doğrulayın. Nodüller tanımlanamazsa, emülsiyon yerine havanın enjekte edilmesi mümkündür. Bu durumda, akut inflamasyon sağlam olmayabilir ve kronik inflamasyon gelişmeyebilir.
Enfeksiyöz endoftalmi gelişimini önleyin:
Bakteriyel veya fungal endoftalmi, önlenmezse kafa karıştırıcı bir değişken üretecektir44. Bakteriyel endoftalmi önlemek için, gözle temas edecek tüm yeniden kullanılabilir aletleri intravitreal süspansiyon yaparken, kullanırken ve temizlerken daima iyi bir aseptik teknik uygulayın. Steril tek kullanımlık ürünler kullanmak, otoklavlama yapmak veya% 95 alkollü yıkama veya mendil ile temizlik önemlidir. Oküler yüzeye, kapaklara ve perioküler kürke uygulanan betadinin uygun kullanımı da endoftalmitin önlenmesine yardımcı olacaktır45. Oküler yapılar enjeksiyon sonrası seyir sırasında aşırı inflamasyon ile yok olacağından, enfeksiyonlu bir gözü tanımak kolaydır. Bu, PMU için tipik değildir. Göz içi kanamasının varlığı da enjeksiyondan endoftalmi veya travma önerebilir. Bu gibi durumlarda, bu hayvanları çalışmadan hariç tutun.
İntravitreal enjeksiyonda tutarlılık sağlayın:
İntravitreal enjeksiyon, PMU'da güvenilir ve tekrarlanabilir inflamasyonun indüklenmesinde kritik bir adımdır. Her enjeksiyonda tutarlı miktarda Mtb süspansiyonu sağlamak, travmayı önlemek ve süspansiyonun reflüsünü önlemek, enjeksiyonları gerçekleştirirken göz önünde bulundurulması gereken faktörlerdir. Tutarlı bir süspansiyon sağlamak için, stok süspansiyonunu çözüldükten sonra ve şırıngaya yüklemeden önce iyice vorteksleyin. Kullanılan bu Mtb ekstraktı bir çözelti oluşturmadığından, süspansiyon zamanla çökelmeye maruz kalabilir. Her enjeksiyonda Mtb ekstraktının eşit konsantrasyonunu sağlamak için, şırıngayı yüklemeden sonraki 15 dakika içinde kullanın veya dışarı atın ve yeniden yükleyin. Fenilefrin, arka göze daha geniş bir görüş alanı sağlamak ve enjeksiyon sırasında göze travma riskini azaltmak için dilatasyon için kullanılır. Bu damla, doğal kapak geri çekilmesini ve dünyanın hafif proptozunu oluşturur ve gözü forseps ile kavramaya gerek kalmadan limbusun 1-2 mm arka tarafının iyi bir şekilde görüntülenmesini sağlar. Gözü kısıtlamak için forseps kullanmak potansiyel travmaya neden olabilir ve göz içi basıncını ve Mtb süspansiyonunun reflü riskini geçici olarak artırabilir. Travma, göze çok fazla hacim enjekte etmeye çalışmaktan da kaynaklanabilir. Göz içi basıncının ve göze travmanın önemli ve uzun süreli yükselmesini önlemek için enjeksiyon hacmi 2 μL ile sınırlıdır. Ek olarak, genç hayvanların yetişkin farelerden daha küçük gözleri olacaktır. Tipik olarak 6-8 haftalık fareler (20-25 g) düzgün bir göz boyutu sağlar ve Mtb enjeksiyonunu takiben iltihaplanmada daha fazla tutarlılık sağlar. Daha küçük farelerde mikobakteriyel süspansiyonun enjeksiyon sonrası reflüsünün daha yüksek bir sıklığı gözlenmiştir. Bu da, beklenenden daha az akut inflamasyona yol açar. Acemi enjektöre enjeksiyon tekniklerinin başarısı hakkında görsel geri bildirim sağlamak için seyreltik bir floresein çözeltisi kullanılır. Enjeksiyon sırasındaki genişleme, enjekte edilen materyalin vitreus boşluğuna doğrudan görselleştirilmesine ve lens travmasına dair herhangi bir kanıtı not etme fırsatına izin verecektir. Lens travması durumunda, OCT'de görselleştirilebilen bir katarakta neden olacak lens netliğinde bir değişikliğe neden olabilir. Oküler travma durumunda, lense bağlı üveit46 olasılığı nedeniyle gözlerin çalışmadan çıkarılması gerekir. Mtb süspansiyonunun göz içinde dağılmasını sağlamak ve reflüyü azaltmak için şırıngayı gözden çıkarmadan önce 10 s duraklamanızı öneririz.
PMU modeli, intravitreal enjeksiyondaki Mtb konsantrasyonunu değiştirerek akut inflamasyonun yoğunluğunu değiştirmek için değiştirilebilir. Laboratuvarımızda daha önce 2,5 μg/μL ila 15 μg/μL arasında değişen farklı dozajlar test edilmiştir. Bununla birlikte, 10 μg / μL'den yüksek dozların, spontan lens rüptürü, şiddetli kornea ödemi ve skarlaşması ve hifema dahil olmak üzere ciddi göz hasarına neden olduğu bulunmuştur. Bu şiddet derecesi, post-enfeksiyöz üveitli insan hastalarında tipik değildir ve bu nedenle bu konsantrasyonlar önerilmez. 5 μg / μL'lik bir dozun güvenilir bir şekilde hafif ila orta derecede akut inflamasyon ve hafif kronik üveit ürettiği bulunmuştur; 10 μg / μL dozu, güvenilir bir şekilde orta ila şiddetli akut hastalık ve daha belirgin kronik hastalık üretir. Bu nedenle, intravitreal konsantrasyonun değiştirilmesi, deneysel soruya dayanarak gerektiğinde kullanım için alternatif hastalık şiddetleri sağlayabilir. Sonuçların, subkutan veya intravitreal enjeksiyonlarla ilişkili travmadan değil, mTB'ye verilen yanıttan kaynaklandığından emin olmak için kontroller seçilmelidir. Sahte enjeksiyon kontrollerinde, mTB ekstraktının yerine PBS kullanılabilir. Maruz kalmamış hayvanlarla karşılaştırmalar için, gerçek naif örnekler göz önünde bulundurulmalıdır, çünkü diğer gözler her zaman eşdeğer değildir.
Fare gözünün küçük boyutu nedeniyle, OCT, ön odadaki iltihabı tespit etmek için doğrudan görselleştirme veya mikroskobik parlak alan fotoğrafçılığından daha hassas bir test olabilir. Sıçanlarda PMU ile yapılan önceki çalışmalar25, histoloji ile OCT'den daha fazla hücrenin tespit edilebileceğini, ancak iki yöntem arasında iyi bir korelasyon olduğunu belirlemiştir. OCT, aynı hayvanda iltihabı uzunlamasına izlemek için kullanılabileceği ek bir avantaja sahiptir. EAU ve EIU gibi diğer büyük fare üveit modelleri de nicel analiz için OCT kullanmıştır 12,47,48. Farelerin PMU modelinde, ön kamara hücreleri sadece OCT'de görülebilir ve büyük bir hipopyon bulunmadıkça klinik muayenelerde görülemez. Renkli fundus görüntülemesi ile vitreus inflamasyonu (vitrit) görülebilir, ancak kantitatif değişimin saptanması ancak OCT görüntüleme ile mümkündür. Modelin retinal vasküler inflamasyon ve retina hasarı gibi diğer yönleri, OCT ve mikroskobik parlak alan fundus fotoğrafçılığı ile kolayca tanımlanabilir.
OCT kullanırken, lokalize görüntülemenin inflamasyon derecesindeki bölgesel farklılıklardan nasıl etkilenebileceğini düşünmek önemlidir. Önceki raporlar, insanların ön odasındaki hücrelerin eşit olmayan bir dağılımını tanımladı ve daha fazla hücre49'un altında yer aldı. Farelerde benzer bir yatkınlık yaygındır. Bu nedenle, AC aracılığıyla dikey veya radyal taramalar, iltihaplanma aralığını yakalayan görüntülerin sağlanmasına yardımcı olacaktır. Ayrıca görüntülemenin aynı yerde yapılması da aynı gözde uzunlamasına toplanan görüntülere tutarlılık sağlayacaktır. Gözün aynı bölümünde görüntüler elde etmek için, sabit yer işaretleri ve sistematik bir yaklaşım kullanın. Ön kamara görüntüleri için, görüntü korneanın tepesine hemen bitişik olarak ortalanır ve dikey olarak yönlendirilir, böylece bir hipopyonun varlığı alt açıda tespit edilebilir. Arka segment görüntüleri için, görüntü optik sinir üzerinde ortalanır. Bölgesel değişkenliğin yakalandığından emin olmak için puanlama için en az 3 satırlık taramalar kullanmayı düşünmeniz önerilir. Enflamasyonun periferik konumlarla sınırlı olduğu durumlarda, hacim taramaları almak yardımcı olabilir. Birim taramalarının toplanması bölgesel varyasyonların yakalanmasına da yardımcı olabilir, ancak veri depolama gereksinimlerini artırır.
PMU fare modelinde inflamasyonu karakterize etmek için kullanılabilecek diğer in vivo testler arasında biyolüminesans görüntüleme13,35 bulunmaktadır. Gözün sulu ve arka odasındaki infiltrasyon yapan immün hücre tipi popülasyonları tanımlamak ve ölçmek için çok parametreli akış sitometrik analizi gibi ölüm sonrası testler yapılabilir12,26. PMU modelinde, akut inflamasyon, baskın bir nötrofil infiltrasyonu ile doğuştan gelen bir yanıt ile karakterizedir, bunu bir aydan fazla süren kronik ve kalıcı bir adaptif T hücresi baskın yanıtı izler35. Post-mortem dokular üzerinde yapılabilecek diğer immün fonksiyon tahlilleri arasında oküler sıvı sitokin analizi yer almaktadır. Ek olarak, üveit50,51'de retinal immün hücre popülasyonlarının gen ve protein ekspresyon paternlerini değerlendirmek için mRNA dizilimi ve immünofloresan görüntüleme gibi diğer aşağı akış testleri kullanılabilir.
PMU modeli, farklı türlere uygun uyarlamalar kullanılarak diğer kemirgen sistemlerinde çoğaltılabilir. PMU modeli daha önce sıçan ve tavşanlarda 38,39,40 olarak kullanılmıştır. Sıçanlarda, akut panüveit, histoloji24 tarafından kronik inflamasyon belirtileri gelişmeden 14 gün boyunca kendiliğinden düzelen intravitreal enjeksiyonu takiben gelişir. Tavşanlarda, üveit indüksiyonu, intravitreal enjeksiyondan önce iki tur deri altı enjeksiyonu kullanır, ancak aynı zamanda sağlam bir panüveit oluşturur. Fare modelini kullanmanın avantajlarından biri, üveit52'nin temel mekanizmasını anlamaya yardımcı olabilecek çok sayıda transgenik ve nakavt suşunun hazır bulunmasıdır. Tüm kemirgen modelleri, ajan sistemik olarak veya topikal bir damla olarak uygulanırsa, klinik öncesi tedavi testi için kullanılabilir. Bununla birlikte, daha büyük boyutlarından dolayı, sıçan ve tavşan gözleri, üveit için implante edilebilir veya lokal enjeksiyon tedavisi seçeneklerinin klinik öncesi çalışmalarında kullanılmak üzere daha iyi modellerdir.
Özetle, bu protokol, kronik oküler inflamasyonun mekanizmalarını incelemek isteyen araştırmacılara, oküler antijenlerle önceden bağışıklamaya bağlı olmayan yeni bir araç sağlar.
Açıklamalar
Yazarların açıklayacağı finansal çatışmaları yoktur.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri, Bethesda, Maryland, Amerika Birleşik Devletleri (KP) K08EY0123998, (KP) R01EY030431, (KP) R21 EY02939, UW vizyon araştırma çekirdek hibesi (NEI P30EY01730), Mark Daily, MD Araştırma Fonu ve Christopher ve Alida Latham Araştırma fonundan gelen hediyeler, Körlüğü Önlemek için Araştırma'dan sınırsız bir bölüm hibesi ve Körlüğü Önlemek için Araştırma'dan (KP) kariyer geliştirme ödülü ile desteklenmektedir. Bristol'de yürütülen çalışma, Sight Research UK ve The Underwood Trust'ın ek finansmanıyla desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AK-FLUOR | Akorn Pharmaceuticals, IL, USA | 10% Fluorescein sodium 100 mg/mL in 5 mL vial | |
| AnaSed | Akorn Animal Health, IL, USA | NDC 59399-110-20 | Xylazine 20 mg/mL |
| Betadine 5% Sterile Ophthalmic Prep Solution | Alcon, TX, USA | 8007-1 | |
| B-D Precision Glide Needles -25 G | Becton, Dickinson and Company, NJ, USA | 305122 | |
| B-D Precision Glide needle -30-G | Becton, Dickinson and Company, NJ, USA | 305106 | |
| Bond MAX, Bond Rx | Leica Biosystems, IL,USA | Automated IHC staining system | |
| Chloramphenicol ointment | Martindale Pharma, Romford, UK | 1% w/w Chloramphenicol | |
| EG1150H | Leica Biosystems, IL,USA | Tissue Embedding | |
| Envisu R2300 | Bioptigen/Leica | OCT Machine | |
| Freund's Incomplete Adjuvant | BD Difco, NJ, USA | 263910 | |
| GenTeal lubricant eye ointment | Alcon, TX, USA | --- | |
| GenTeal lubricant eye gel | Alcon, TX, USA | --- | |
| H37Ra lyophilized Mycobacteria extract | BD Difco, NJ, USA | 231141 | |
| Hamilton RN Needle (33/12/2)S | Hamilton, Reno, NV | 7803-05(33/12/2) | 33 G |
| Hamilton syringe | Hamilton, Reno, NV | CAL7633-01 | 5 µL |
| Insulin needle | Exel International, USA | 26029 | 1 mL |
| Isoflurane | |||
| Ketaset | Zoetis, USA | 377341 | Ketamine HCL 100 mg/mL |
| Microinjection Syringe Pump and Micro4Controller | World Precision Instruments, FL, USA | UMP3 | |
| Micron IV | Phoenix Research Laboratories, Pleasanton, CA | Alternative Imaging/OCT Machine | |
| Nanofil 10 µL syringe | World Precision Instruments, FL, USA | NANOFIL | |
| Nanofil Intraocular Injection Kit | World Precision Instruments, FL, USA | IO-KIT | |
| Olympus SZX10 | Olympus | Dissection scope | |
| PBS | Gibco | 14190 | |
| Phenylephrine Hydrochloride Ophthalmic Solution USP 2.5% Sterile 15 mL | Akorn Pharmaceuticals, IL, USA | 17478020115 | |
| RM2255 | Leica Biosystems, IL,USA | Tissue Sectioning | |
| TB Syringe | Becton, Dickinson and Company, NJ, USA | 309602 | 1 mL |
| Tetracaine 0.5% | Alcon, TX, USA | 1041544 | |
| Tissue Tek VIP series | Sakura Finetek USA, Inc.,CA. | Histology Tissue Processing | |
| Tropicamide 1% | Chauvin Pharmaceuticals, Romford, UK | Minims | |
| Tylenol | Johnson & Johnson Consumer Inc, PA, USA | NDC 50580-614-01 | Acetaminophen |
| Viscotears | Novartis Pharmaceuticals, Camberley, UK | Carbomer eye gel 0.2% w/w |
Referanslar
- American Academy of Ophthalmology. Aao 2019-2020 Basic and Clinical Science Course, Section 09: Uveitis and Ocular Inflammation. American Academy of Ophthalmology. , (2019).
- Caspi, R. R. Animal models of autoimmune and immune-mediated uveitis. Drug Discovery today. Disease Models. 3 (1), 3-9 (2006).
- DeVoss, J., et al. Spontaneous autoimmunity prevented by thymic expression of a single self-antigen. The Journal of Experimental Medicine. 203 (12), 2727-2735 (2006).
- Caspi, R. R., et al. A new model of autoimmune disease. Experimental autoimmune uveoretinitis induced in mice with two different retinal antigens. Journal of Immunology. 140 (5), 1490-1495 (1988).
- Tang, J., Zhu, W., Silver, P. B., Su, S. -B., Chan, C. -C., Caspi, R. R. Autoimmune uveitis elicited with antigen-pulsed dendritic cells has a distinct clinical signature and is driven by unique effector mechanisms: Initial encounter with autoantigen defines disease phenotype. The Journal of Immunology. 178 (9), 5578-5587 (2007).
- Broekhuyse, R. M., Kuhlmann, E. D., Winkens, H. J. Experimental melanin-protein induced uveitis (EMIU) is the sole type of uveitis evoked by a diversity of ocular melanin preparations and melanin-derived soluble polypeptides. Japanese Journal of Ophthalmology. 40 (4), 459-468 (1996).
- Pennesi, G., et al. A humanized model of experimental autoimmune uveitis in HLA class II transgenic mice. The Journal of Clinical Investigation. 111 (8), 1171-1180 (2003).
- Caspi, R. R. Understanding autoimmune uveitis through animal models. The Friedenwald lecture. Investigative Ophthalmology & Visual Science. 52 (3), 1872-1879 (2011).
- Bansal, S., Barathi, V. A., Iwata, D., Agrawal, R. Experimental autoimmune uveitis and other animal models of uveitis: An update. Indian Journal of Ophthalmology. 63 (3), 211-218 (2015).
- Smith, J. R., Hart, P. H., Williams, K. A. Basic pathogenic mechanisms operating in experimental models of acute anterior uveitis. Immunology and Cell Biology. 76 (6), 497-512 (1998).
- Rosenbaum, J. T., McDevitt, H. O., Guss, R. B., Egbert, P. R. Endotoxin-induced uveitis in rats as a model for human disease. Nature. 286 (5773), 611-613 (1980).
- Chu, C. J., et al. Multimodal analysis of ocular inflammation using the endotoxin-induced uveitis mouse model. Disease Models & Mechanisms. 9 (4), 473-481 (2016).
- Gutowski, M. B., Wilson, L., Van Gelder, R. N., Pepple, K. L. In vivo bioluminescence imaging for longitudinal monitoring of inflammation in animal models of uveitis. Investigative Ophthalmology & Visual Science. 58 (3), 1521-1528 (2017).
- World Health Organization. Global tuberculosis report 2019. World Health Organization. , (2019).
- Biswas, J., Badrinath, S. S. Ocular morbidity in patients with active systemic tuberculosis. International Ophthalmology. 19 (5), 293-298 (1995).
- Donahue, H. C. Ophthalmologic experience in a tuberculosis sanatorium. American Journal of Ophthalmology. 64 (4), 742-748 (1967).
- El-Asrar, M. A., Abouammoh, M., Al-Mezaine, H. S. Tuberculous uveitis. Middle East African Journal of Ophthalmology. 16 (4), 188-201 (2009).
- Bodaghi, B., et al. Chronic severe uveitis: etiology and visual outcome in 927 patients from a single center. Medicine. 80 (4), 263-270 (2001).
- Cunningham, E. T., Forrester, J. V., Rao, N. A., Zierhut, M. Post-infectious uveitis. Ocular Immunology and Inflammation. 24 (6), 603-606 (2016).
- Wroblewski, K. J., Hidayat, A. A., Neafie, R. C., Rao, N. A., Zapor, M. Ocular tuberculosis: a clinicopathologic and molecular study. Ophthalmology. 118 (4), 772-777 (2011).
- Yeh, S., Sen, H. N., Colyer, M., Zapor, M., Wroblewski, K. Update on ocular tuberculosis. Current Opinion in Ophthalmology. 23 (6), 551-556 (2012).
- Tagirasa, R., Parmar, S., Barik, M. R., Devadas, S., Basu, S. Autoreactive T cells in immunopathogenesis of TB-associated uveitis. Investigative Ophthalmology & Visual Science. 58 (13), 5682-5691 (2017).
- Agrawal, R., et al. Insights into the molecular pathogenesis of ocular tuberculosis. Tuberculosis. 126, 102018(2021).
- Pepple, K. L., et al. Primed mycobacterial uveitis (PMU): Histologic and cytokine characterization of a model of uveitis in rats. Investigative Ophthalmology & Visual Science. 56 (13), 8438-8448 (2015).
- Pepple, K. L., Choi, W. J., Wilson, L., Van Gelder, R. N., Wang, R. K. Quantitative assessment of anterior segment inflammation in a rat model of uveitis using spectral-domain optical coherence tomography. Investigative Ophthalmology & Visual Science. 57 (8), 3567-3575 (2016).
- Pepple, K. L., Wilson, L., Van Gelder, R. N. Comparison of aqueous and vitreous Lymphocyte populations from two rat models of experimental uveitis. Investigative Ophthalmology & Visual Science. 59 (6), 2504-2511 (2018).
- Basu, S., Elkington, P., Rao, N. A. Pathogenesis of ocular tuberculosis: New observations and future directions. Tuberculosis. 124, 101961(2020).
- Basu, S., Rao, N., Elkington, P. Animal models of ocular tuberculosis: Implications for diagnosis and treatment. Ocular Immunology and Inflammation. , 1-7 (2020).
- Mattapallil, M. J., et al. The Rd8 mutation of the Crb1 gene is present in vendor lines of C57BL/6N mice and embryonic stem cells, and confounds ocular induced mutant phenotypes. Investigative Ophthalmology & Visual Science. 53 (6), 2921-2927 (2012).
- Underwood, W., Anthony, R. AVMA guidelines for the euthanasia of animals: 2020 edition. 2013 (30), 2020-2021 (2020).
- Donovan, J., Brown, P., et al. Handling and restraint. Current protocols in immunology. Coligan, J. E., et al. , John Wiley & Sons, Inc. Chapter 1, Unit 1.3 (2006).
- Tremoleda, J. L., Kerton, A., Gsell, W. Anaesthesia and physiological monitoring during in vivo imaging of laboratory rodents: considerations on experimental outcomes and animal welfare. EJNMMI Research. 2 (1), 44(2012).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor protocols. 2014 (6), 655-658 (2014).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- John, S., Rolnick, K., Wilson, L., Wong, S., Van Gelder, R. N., Pepple, K. L. Bioluminescence for in vivo detection of cell-type-specific inflammation in a mouse model of uveitis. Scientific Reports. 10 (1), 11377(2020).
- Fortmann, S. D., Lorenc, V. E., Hackett, S., Campochiaro, P. A. Murine Vitreous Tap (MurViTap): a novel technique to extract uncontaminated mouse vitreous humor, quantify retinal vascular permeability, and compare proteins secreted by diseased and normal retina. Investigative ophthalmology & visual science. 58 (8), 5978(2017).
- Caspi, R. R. Understanding autoimmunity in the eye: from animal models to novel therapies. Discovery Medicine. 17 (93), 155-162 (2014).
- Mruthyunjaya, P., et al. Efficacy of low-release-rate fluocinolone acetonide intravitreal implants to treat experimental uveitis. Archives of Ophthalmology. 124 (7), 1012-1018 (2006).
- Jaffe, G. J., Yang, C. S., Wang, X. C., Cousins, S. W., Gallemore, R. P., Ashton, P. Intravitreal sustained-release cyclosporine in the treatment of experimental uveitis. Ophthalmology. 105 (1), 46-56 (1998).
- Pepple, K. L., et al. Uveitis therapy with shark variable novel antigen receptor domains targeting tumor necrosis factor alpha or inducible t-cell costimulatory ligand. Translational Vision Science & Technology. 8 (5), 11(2019).
- Mattapallil, M. J., et al. Characterization of a New epitope of IRBP that induces moderate to severe uveoretinitis in mice with H-2b haplotype. Investigative Ophthalmology & Visual Science. 56 (9), 5439-5449 (2015).
- Silver, P. B., Chan, C. C., Wiggert, B., Caspi, R. R. The requirement for pertussis to induce EAU is strain-dependent: B10.RIII, but not B10.A mice, develop EAU and Th1 responses to IRBP without pertussis treatment. Investigative Ophthalmology & Visual Science. 40 (12), 2898-2905 (1999).
- Li, Q., Peng, B., Whitcup, S. M., Jang, S. U., Chan, C. C. Endotoxin induced uveitis in the mouse: susceptibility and genetic control. Experimental Eye Research. 61 (5), 629-632 (1995).
- Astley, R. A., Coburn, P. S., Parkunan, S. M., Callegan, M. C. Modeling intraocular bacterial infections. Progress in Retinal and Eye Research. 54, 30-48 (2016).
- Lau, P. E., Jenkins, K. S., Layton, C. J. Current evidence for the prevention of endophthalmitis in anti-VEGF intravitreal injections. Journal of Ophthalmology. 2018, 8567912(2018).
- Nche, E. N., Amer, R. Lens-induced uveitis: an update. Graefe's Archive for Clinical and Experimental Ophthalmology. 258 (7), 1359-1365 (2020).
- Chu, C. J., et al. Assessment and in vivo scoring of murine experimental autoimmune uveoretinitis using optical coherence tomography. PLoS ONE. 8 (5), 63002(2013).
- Harimoto, K., Ito, M., Karasawa, Y., Sakurai, Y., Takeuchi, M. Evaluation of mouse experimental autoimmune uveoretinitis by spectral domain optical coherence tomography. The British Journal of Ophthalmology. 98 (6), 808-812 (2014).
- Li, Y., Lowder, C., Zhang, X., Huang, D. Anterior chamber cell grading by optical coherence tomography. Investigative Ophthalmology & Visual Science. 54 (1), 258-265 (2013).
- Bell, O. H., et al. Single eye mRNA-seq reveals normalisation of the retinal microglial transcriptome following acute inflammation. Frontiers in Immunology. 10, 3033(2019).
- Lipski, D. A., et al. Retinal endothelial cell phenotypic modifications during experimental autoimmune uveitis: a transcriptomic approach. BMC Ophthalmology. 20 (1), 106(2020).
- Agarwal, R. K., Silver, P. B., Caspi, R. R. Rodent Models of Experimental Autoimmune Uveitis. Autoimmunity. Methods in Molecular Biology (Methods and Protocols). Perl, A. , Humana Press. Totowa, NJ. 443-469 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır