Method Article
啮齿动物心脏和脑组织准备缺血后数码微距摄影
摘要
这里介绍的是缺血再灌注实验后啮齿动物组织制备标准化方法的方案,以及用于建立用于高分辨率图像采集的照明和相机设置的指南。该方法适用于所有实验性小动物器官摄影。
摘要
微距摄影适用于以高放大倍率对各种组织样品进行成像,以进行定性和定量分析。组织制备和随后的图像捕获是在缺血再灌注(IR)实验后立即执行的步骤,必须及时并适当小心地进行。为了评估IR诱导的心脏和大脑损伤,本文描述了基于2,3,5-三苯基-2H-氯化四氮唑(TTC)的染色,然后进行微距摄影。科学微距摄影需要受控照明和适当的成像设置。标准化方法可确保高质量、详细的数字图像,即使使用廉价的最新数码相机和微距镜头的组合也是如此。讨论了样品制备和图像采集中的正确技术和潜在错误,并提供了正确和不正确的设置对图像质量的影响示例。本文提供了有关如何避免常见错误的具体提示,例如过度染色、样品储存不当和照明条件欠佳。本文展示了大鼠心脏和脑组织切片和染色的适当方法,并为建立用于高分辨率图像采集的照明和相机设置以及摄影技术提供了指南。
引言
几十年来,心脏和脑组织标本的摄影和分析一直是生命科学实验的重要组成部分。科学和创新的进步推动了能够超分辨率的昂贵显微镜的发展。显微照片是在控制良好的光照环境中按照详细说明获得的。相比之下,微距摄影(放大倍率为1:2或更大)经常在不受控制的光线环境中使用不适当的成像设置进行。通常,样品制备和相机设置技术需要大幅优化。因此,质量有限的微距照片已广泛发表在科学期刊上。图像分辨率和对比度不足限制了红外研究中精确图像量化的可能性。
已经详细描述了心肌1,2 和脑3,4 梗死的实验过程。本研究的目的是提供有关如何在梗死后建立啮齿动物心脏和脑组织标本的摄影和标准化分析系统的分步指南。这包括组织切片,染色以及心脏和大脑样本的微距摄影。组织标本的制备是实验的重要组成部分,平面图像分析结果在很大程度上取决于所获得图像的质量5。
这些方法对于在啮齿动物组织中进行测量和图像平面分析特别有用,并且可能对一般的科学微距摄影有价值。此外,图像的高质量和一致性允许对数码照片进行自动分析,这有助于节省时间,避免用户输入,并最大限度地降低图像分析过程中的错误或偏差风险。这将导致生成强大而可靠的数据,并增加临床前发现在诊所中转化为新型抗缺血治疗的转化。
研究方案
实验程序是根据欧洲共同体的指导方针和当地法律和政策(指令2010/63 / EU)进行的,所有程序均由拉脱维亚里加食品和兽医局批准。
1. 心脏染色和切片
注意:本方案中描述的技术可以在朗根多夫灌注分离的大鼠或小鼠心脏6,7 和 体内 大鼠心脏IR损伤测定后使用8,9,10,11。对于 体内 IR损伤测定后的染色,假设心脏被切除,安装在套管上,并在Langendorff灌注模式下短暂灌注。
- 将心脏插管从装有克雷布斯-亨塞莱特溶液的注射器中分离出来,并将其连接到装有克雷布斯-亨塞莱特溶液中0.1%亚甲蓝的温(37°C)溶液的注射器。使用5 mL注射器用于大鼠心脏,使用1-2 mL注射器用于小鼠心脏。
注意:另一种方法是用含蓝色染料的溶液填充压力或流量控制(例如Langendorff)设备。在分离和安装过程中,至关重要的是不要在套管中留下任何气泡,并且不要松开用于冠状动脉再闭塞的缝合线。 - 进一步以~4mL/min的速率用4mL亚甲蓝溶液灌注大鼠心脏,并以~0.5-1mL/min的速率用1mL亚甲蓝溶液灌注小鼠心脏。
注意:根据经验,这两种技术都是安全的,并提供足够的染色;然而,对于新手科学家来说,使用压力控制泵/静液压系统是一种更耗时但更安全的选择,以防止过度染色。 - 断开插管与注射器的连接,并将心脏从套管中取出。
- 通过在薄纸上轻轻滚动心脏来去除多余的亚甲蓝。通过打开止血钳并仅在去除多余的亚甲蓝后才从手术缝合线中取出塑料管来松开冠状动脉周围的结扎。
注意:在此阶段,可以将鼠标心脏放在冰箱(-20°C)中的小塑料袋或5mL离心机微管中长达5-10分钟。最大冷冻时间应在每个实验室中通过实验确定。短期冷冻小鼠心脏可以帮助新手实验者将其切成1毫米厚的切片。不建议冻结老鼠心脏。必须避免在-20°C下过度冷冻超过10分钟。 - 将染色的大鼠心脏置于不锈钢基质(见 材料表)中进行心脏切片(图1A)。然后,将心脏的心室切成2毫米厚的切片(目标是成年大鼠心脏的6-7片)。对于小鼠心脏,将心脏的心室切成1.5毫米厚的切片(目标是至少4片成年小鼠心脏)。
注:必须使用与切割矩阵兼容的剃须刀片。通常,兼容的单刃剃须刀片(例如,厚度高达0.01英寸(0.254毫米))可用于切割老鼠心脏。双刃剃须刀片通常用于鼠标心脏,厚度通常可达0.004英寸(0.1毫米)。

图1:用于大鼠心脏和脑切片的矩阵 (A)大鼠心脏,(B)大鼠脑。 请点击此处查看此图的放大版本。
- 切割后,将切片转移到15 mL塑料管中。将5mL溶解在磷酸盐缓冲盐水(PBS)中的1%三苯基氯化四唑(TTC)加入带有心脏切片的管中,并在37°C的水浴中孵育10分钟。
- 在TTC溶液中孵育后,用PBS洗涤心脏切片至少2-3次,并准备进行图像捕获。
2. 脑部染色和切片
- 脑中动脉闭塞实验3,12后,从颅骨中取出包括脑干在内的脑干,并在冰冷的PBS中清洗。
- 根据动物的重量选择正确大小的大脑不锈钢基质(见 材料表)(图1B)。将大脑腹侧朝上放置在大脑基质中。
注意:当坐在基质中时,大脑的腹面必须平行于模具的顶部表面。 - 使用刀片,限制大脑的额部和尾部(两侧2个刀片)。
注:必须使用与切割矩阵兼容的剃须刀片。通常,兼容的单刃剃须刀片(厚度高达0.01英寸(0.254毫米))可用于大鼠脑切片。 - 将刀片部分(未完全切开大脑)放入第一个刀片和最后一个刀片之间的通道中。当所有刀片插入并平行排列时,同时用手掌向下按压所有刀片,将大脑切成2毫米的冠状切片。
- 用两根手指沿着两侧牢牢抓住刀片,然后将它们与切成碎片的大脑一起从基质中取出。
- 将脑切片逐个排列在托盘(70 mL,72 x 72 mm)中。排列切片时,请确保每个切片的前表面始终朝上。
- 将PBS中的温热(+ 37°C)1%TTC溶液倒入脑切片上,并在黑暗中在37°C下孵育8分钟。
注意:在孵育期间,脑切片必须完全浸入TTC溶液中。 - 在1%TTC溶液中孵育后,将脑切片转移到蓝色塑料托盘中以捕获图像。按顺序排列从额叶到尾部的脑切片,并使用手术刀将矢状面中的半球分开。
注意:托盘的表面应可清洗,哑光,并且颜色与脑切片形成对比(即,不是红色,白色或淡粉红色)。
3. 微距摄影
- 染色后立即拍摄组织切片。
注意:心脏切片可以储存在冷PBS(+4°C)或福尔马林溶液中长达30分钟。脑切片可以长时间储存在福尔马林中(1-2周)。 - 在支架上设置带电电池、存储卡和连接的镜头,设置所选相机(图2)
注:在采集图像前至少5-10分钟打开灯以预热设备。LED 灯在微秒内达到全亮度。

图2:为微距摄影设置的相机和灯光。 相机垂直于成像表面,以确保相机的焦平面与样品平行。缩写:LED =发光二极管。 请点击此处查看此图的放大版本。
- 根据可用的光源,选择适当的白平衡设置或根据相机手册中的说明执行色温校准。
注:白光LED灯(色温6,500K)是避免荧光灯泡闪烁的首选光源。 - 将相机切换到完全手动模式,将ISO 100和光圈设置为f / 10,然后调整快门速度以获得最佳图像曝光。确保相机焦平面平行于放置样品的表面。
注:直方图功能可用于确保组织切片不会过度曝光。 - 连接或启用有线或无线遥控触发器,以防止在释放快门时相机抖动。
注:另一种方法是启用延迟快门功能,按下触发按钮后,该功能会延迟触发器2或10秒。 - 将心脏切片完全浸入装有PBS的容器中。
注意:浸入式载玻片往往会漂浮在远离其位置的位置。为了最大限度地减少切片的漂浮,请使用所有切片都可以放入的最小托盘和最少量的浸入溶液,确保样品完全浸入。替代方法包括将切片放置在载玻片之间或在镜头上使用偏振滤光片。圆形偏振滤光片连接到镜头上并旋转,直到相机实时视图显示中的反射消失。 - 将脑切片放在没有PBS或其他液体的干燥托盘中。
注意:偏振滤光片非常方便捕获大脑切片的图像。 - 将装有切片的容器放在带有微距镜头的相机下方,并确保所有切片完全适合视野。确保切片位于同一平面上,即不弯曲或轧制。
- 检查曝光并根据需要调整相机设置。
注意:设置完成后,请勿在整个实验过程中更改曝光和其他设置。 - 捕获样品的数量(或其他标识),并使用远程触发器对组织切片进行成像。
注意:当需要对试样尺寸进行绝对定量时,应在视野中包括尺寸标记,例如毫米尺。 - 旋转切片并从另一侧捕获其图像。
结果
图3A 是心肌梗死后亚甲蓝色和TTC染色的心脏切片的照片,其中包含足够的细节和颜色信息,可用于进一步对梗死大小进行平面分析(图3B)。我们测试了心脏冻结24小时如何影响心脏组织的完整性(图3C)。长时间冷冻(>1小时, 图3C)会降低线粒体功能;因此,心脏的TTC染色不是红色而是淡粉红色,坏死组织和活组织之间的边界模糊(图3C)。
此外,比较了两种方法以减少样品中的反射。浸入是最有效的方法,可以产生具有良好对比度的详细图像(图4A)。第二种方法是使用附着在镜头上的偏振滤光片。偏振滤光片也很有效;但是,滤波器会略微降低图像的分辨率和微对比度(图4B)。没有浸入或滤光片的心脏切片的示例图像(图4C)包含许多反射,不适合进一步分析。
由于切片管理(浮动)问题,大脑切片没有浸入水中。在平面分析中,重要的是要比较大脑的未受影响(健康)侧(图5A)与中风受影响的一侧(图5B)。在干燥的盘子或托盘上更容易管理脑切片,并且使用偏振滤光片来去除反射。带有蓝色背景的托盘用于脑切片摄影(前面描述的背景选择5)。
手动相机设置用于确保完全控制曝光和白平衡。相机设置应在实验前或实验开始时根据可用的光源进行调整。这确保了所有图像的最佳曝光和白平衡,以实现统一的分析(图6A)。相机的自动设置并不完美,可能导致相机参数变化,导致不适当的结果并引入图像到图像的可变性。
图6 显示了心脏切片的过度曝光(图6B)和曝光不足的图像(图6C)的示例。应充分注意相机的正确白平衡设置,以匹配相机光设置中使用的特定光源。不正确的白平衡设置可能会导致图像中出现蓝色或黄色(图6D)以及洋红色或绿色(图6E)色偏。
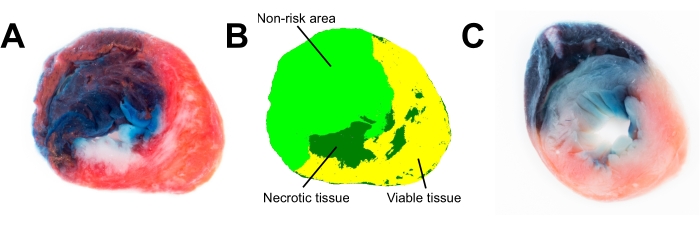
图3:大鼠心脏切片的图像。 (A)使用颜色分割(B)在ImageProPlus 6.3软件中分析新鲜心脏切片。(C)TTC染色对冷冻心脏切片(冷冻24小时)中的活组织和坏死组织区分不力。简称:TTC = 2,3,5-三苯基-2H-氯化四氮唑。 请点击此处查看此图的放大版本。
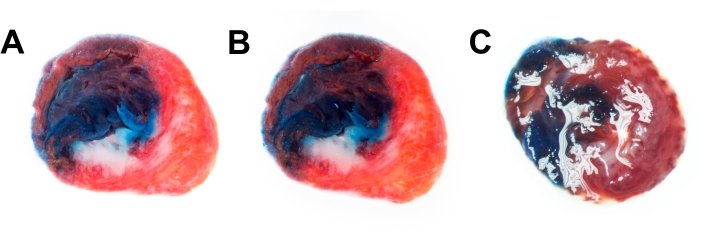
图 4:减少反射的技术。 在PBS(A)中使用偏振滤光片(B)中捕获的大鼠心脏切片图像。(C)既不使用浸泡也不过滤时带有反射的心切片。缩写 = PBS = 磷酸盐缓冲盐水。 请点击此处查看此图的放大版本。
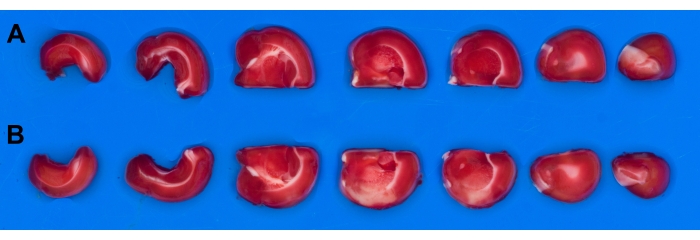
图5:大鼠脑切片的图像。 将大鼠脑切成七片,并在缺血再灌注后用TTC染色。使用偏振滤光片可采集无反射图像。(A)未受损半球的切片;(B) 从受卒中影响的半球切片。简称:TTC = 2,3,5-三苯基-2H-氯化四氮唑。 请点击此处查看此图的放大版本。
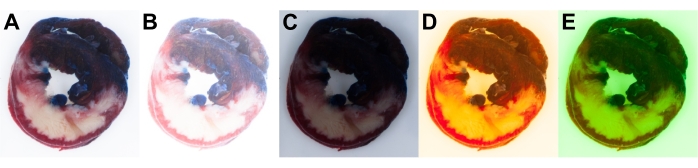
图 6:大鼠心脏切片图像。正确(A)和错误(B-E)捕获的心脏切片图像。不正确的曝光设置会导致过度曝光(B)和曝光不足的图像(C)。不正确的白平衡设置会导致图像出现黄色 (D) 或绿色色偏 (E)。请点击此处查看此图的放大版本。
讨论
IR后心脏的准备工作从血液心脏动脉的重新闭塞和蓝色染料的灌注开始,以区分高危区域和非危险区域。亚甲蓝或埃文斯蓝染料最常用于此目的2。由于过高的压力可能会损坏心脏瓣膜,从而部分或完全染色有风险的区域,因此最好使用压力控制系统(例如Langendorff设备或配备静液压系统的注射器或泵的简化版本)填充心脏。受控灌注将保证生理压力,染料通常不会进入心脏的闭塞区域。流速和压力控制技术都可以防止过度染色。
活组织处理中最严重的错误之一是在染色之前将组织长时间保存在冰箱中。冷冻主要是因为研究人员希望在IR实验后的第二天或之后进行心脏染色。此外,冷冻用于使心脏的切割更容易。我们发现,心脏的短期冷冻长达5-10分钟可以忽略不计地影响心脏组织的完整性,并有助于将组织(特别是对于小鼠心脏)切割成薄片。然而,长时间冷冻会损害膜,降低细胞活力和线粒体功能13。结果,功能线粒体的TTC染色受到影响,坏死和活组织之间的边界划定不清(模糊)。总体而言,应避免冻死鼠窝,只有短期冻鼠心才能便于切割。
下一步是在37°C14的1%TTC溶液中组织染色。染色液应预先加热, 这对于脑切片的染色尤其重要。当使用预热溶液时,心脏切片的最佳染色时间为10分钟。较长的孵育或高于37°C的温度导致心脏组织呈棕色。标本的正确染色和一致的红色强度对于进一步的图像分析非常重要。在摄影前的最后步骤中,用冷PBS或类似的缓冲液冲洗组织切片2-3次,以除去溶液中的TTC和多余的亚甲蓝,以避免照片中的蓝色铸件。心脏切片应在染色后不久拍摄,以获得最佳图像质量。如果在冷(+4°C)PBS中储存长达60分钟,心脏染色仍然具有良好的质量。染色的脑切片和主动脉组织通常储存在4%中性甲醛溶液中,并保持良好的质量一周。在福尔马林(+4°C)中过夜储存脑组织不会损害正常组织的颜色强度,并且对于图像采集是可以接受的。然而,福尔马林会引起心脏切片的肿胀和脱色。因此,不建议将心脏组织储存在福尔马林中。
下一步是图像采集。许多实验室使用平板扫描仪作为图像采集工具,有望取代数码相机和照明装置。我们确定切片的扫描不能提供足够的图像分辨率和色分离,因此不适合对心脏切片进行成像。特别是,扫描仪的分辨率对于鼠标心脏来说是不够的,我们注意到亚甲蓝的渲染效果很差。相比之下,扫描仪可能是照相相机的替代品,用于对仅用TTC或其他单一染料染色的脑切片进行成像。对于组织切片的扫描,确保恒定曝光设置的扫描软件至关重要。总体而言,平板扫描仪的功能较差,对于大多数成像应用而言,它无法取代数码相机。
标本背后的背景也很重要。理想情况下,托盘的底部应为染色试样中不存在的颜色。例如,为了以自动或半自动方式量化亚甲蓝和TTC(红色)染色的面积,应避免使用白色,红色,蓝色,黄色和棕色背景。因此,绿色背景更可取。然而,颜色选择取决于操作员的偏好,操作员对图像进行后处理。许多科学家更喜欢白色背景,因为在图像后处理中可以删除白色背景并将其转换为完全白色(RGB白色代码255,255,255)。然后,应该从用于半自动分析的选定颜色列表中排除完全白色,并仅计算苍白的坏死区域,如果不是过度曝光,则不是完全白色的。蓝色和绿色背景适用于脑切片和主动脉的摄影。
组织摄影的最佳成像工具是单镜头反光镜或无反光镜可互换镜头数码相机,具有兼容的微距镜头。捕获非常小的物体可能需要相机和显微镜的组合;然而,微距镜头通常具有足够的(至少1:2)放大倍率来获得小鼠心脏的详细图像。许多制造商提供价格合理的数码相机和微距镜头,以获得高分辨率和高倍率的照片。所有最新的数码相机都具有微距摄影所需的特性和功能,包括可以安装在支架上,大量像素(通常>20 Mpx),实时取景,镜像锁定,延时功能,远程快门以及手动设置相机参数的能力,从而确保恒定的快门速度,光圈,白平衡和ISO设置。具有上述功能且镜头放大倍率至少为1:2的紧凑型相机也可用于微距摄影。由于镜头特性,一些紧凑型相机应放置在靠近物体的地方,实验者必须确保相机机身不会影响标本的照明。
对于使用任何类型的可互换镜头相机进行微距摄影,需要高放大倍率(1:1-1:2)微距镜头。我们建议在全画幅(24 mm x 36 mm)传感器上使用焦距范围为50 mm至100(120)mm或等效焦距的微距镜头。较小的传感器相机具有不同的传感器尺寸,应相应地重新计算放大倍率。对于心形切片的摄影,100 mm微距镜头前部元件到拍摄对象的人体工程学距离约为150 mm。此设置允许操作员将所有设备放在桌子上,并轻松访问摄像机控件。50毫米微距镜头可以考虑用于拍摄较大的物体,例如脑切片,因为需要更宽的视野才能在一张照片中获得所有切片。
为了获得高分辨率的清晰图像,应将相机安装在坚固的支架上,该支架与灯光设置一起称为摄影复制支架。将摄像机安装在支架和远程(有线或无线)触发器上可消除摄像机抖动,并确保与目标保持恒定的距离。相机照明设置从两侧使用两个恒定光源,相对于被摄体平面的角度约为30-60°,可确保标本的充足照明,并有助于避免同时反射。相机应精确安装,使传感器平行于被摄体平面。为了均匀地照亮图像场,两盏灯的方向应相等,并与拍摄对象保持相同的距离。放置在与被摄体不同距离的光源会导致照明不均匀。此外,闪烁的光源是图像曝光变化的原因。总体而言,准确放置相机和光源以精确获取照明良好的标本的图像非常重要。
组织样本反射光(闪闪发光),在图像中显示为白点。这些光反射点不包含有用的颜色信息,因此,图像的这些部分不能用于图像的准确定量分析。组织切片的光反射可以通过各种方法去除。最有效的方法是将组织样品完全浸入含有盐水或PBS溶液的容器中。类似的方法是在玻璃板下方(或之间)插入组织切片。这种方法对反射是有效的;但是,图像分辨率可能低于浸入组织的照片。
还可以使用安装在镜头上的偏振滤光片来消除光反射。圆偏振滤光片随处可见,但质量因价格而异,而廉价滤光片会显著降低图像分辨率。反射光可以通过以一定角度转动偏振滤光片的移动部分来过滤掉。偏振滤光片的功效可能受到某些光源(例如,强LED光)的影响。总体而言,去除多余的液体后,偏振滤光片可以消除脑切片的所有反射;然而,样品浸入缓冲液中是心脏切片最简单,最具成本效益的方法。
手动设置快门速度、光圈、ISO和白平衡对于保持对成像过程的完全控制非常重要。光源的样本、背景和特性在自动设置中影响相机曝光测光系统;因此,在实验过程中,手动设置对于在多张照片之间保持恒定的曝光和白平衡是必要的。对于微距摄影,建议的光圈设置在f /8和f/16之间。通过减小光圈,景深会增加,如果对象不在单个平面中,这将很有帮助。但是,在光圈较小的情况下,衍射限制了摄影的总分辨率。大多数镜头的最佳光圈通常是f / 10,因为在此设置下,分辨率下降可以忽略不计,景深也足够。ISO值范围为50至400(越低越好),通常都是最佳选择,可以最大限度地减少图像伪像(噪点)。然后,快门速度仍有待更改,以便在现有光线条件下使用上述光圈和ISO设置获得正确的曝光。手动设置对于一致的图像分析非常重要。标准化成像可确保在任何研究中使用相同的颜色阈值设置,这需要分割分析。例如,如果标本图像具有一致的颜色、白平衡和曝光,则可以使用 ImagePro 软件基于具有预定义颜色(蓝色、红色和白色(+淡粉红色)的分割文件的半自动分析。
白平衡设置应根据用于照亮样品的光源的色温进行调整。白平衡可以从相机内置预设中选择,也可以使用灰度目标的手动校准进行选择。以RAW格式捕获图像的好处是,可以在图像的软件后处理期间调整白平衡。由于RAW文件包含的信息比JPEG文件多得多,因此RAW文件后处理为校正色彩平衡和曝光以及获得更好的图像分辨率提供了绝佳的机会。由于大多数相机可以同时捕获JPEG和RAW文件,因此我们建议捕获RAW文件并将其另存为备份。
总体而言,该协议描述了大鼠心脏和脑组织切片和染色的方法,并为建立照明和相机设置以及用于高分辨率图像采集的摄影技术提供了指南,以便进一步分析。该方法适用于所有实验性小动物器官摄影。
披露声明
作者声明他们没有利益冲突。
致谢
作者得到了欧盟Horizon 2020研究和创新计划的支持,该计划根据赠款协议No 857394,Project FAT4BRAIN。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Sagimed | N/A | |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | 298-96-4 | |
| 5 mL syringe | Sagimed | N/A | |
| 50 mL syringe | Terumo | N/A | |
| Adult Rat Brain Slicer Matrix | Zivic Instruments | BSRAS001-1 | |
| Aortic cannula for mouse heart | ADInstruments | SP3787 | |
| Aortic cannula for rat heart | ADInstruments | SP3786 | |
| Calcium chloride dihydrate, ≥99% | Acros Organics | 207780010 | |
| Cover Glass Forceps, Angled | Fine Science Tools | 11073-10 | |
| Hemostatic forceps | Agnthos | 13008-12 | |
| Hoya 62 mm alpha Circular Polarizer Filter | Hoya | HOCPA62 | |
| Magnesium chloride hexahydrate | Penta | 16330-31000 | |
| Methylene Blue | SigmaAldrich | M9140 | |
| Mouse Heart Slicer Matrix | Zivic Instruments | HSMS005-1 | |
| Polyethylene plastic tubing | BD Intramedic | N/A | |
| Potassium chloride for biochemistry | Acros Organics | 418205000 | |
| Potassium phosphate, monobasic, ≥99% | Acros Organics | 205920025 | |
| Rat Heart Slicer Matrix | Zivic Instruments | HSRS001-1 | |
| Scissors curved with blunt ends | Agnthos | 14013-15 | |
| Scissors for cleaning heart | Agnthos | 14058-11 | |
| Single Edge Razor Blades | Zivic Instruments | BLADE012.1 | |
| Sodium bicarbonate for biochemistry, 99.5% | Acros Organics | 447100010 | |
| Sodium chloride | Fisher bioreagents | BP358-10 | |
| Sony Alpha a6000 Mirrorless Digital Camera | Sony | ILCE6000 | Can be repalaced by any up-to-date digiatal camera |
| Sony FE 90 mm F/ 2.8 Macro G OSS | Sony | SEL90M28G | Important, lens should be compatible with camera |
| Sony SF32UZ SDHC 32 GB Class 10 UHS | Sony | 2190246141 | |
| Surgical blade | Heinz Herenz Hamburg Germany | BS2982 | |
| Thermo-Shaker | BioSan | PST-60HL-4 | |
| Toothed tissue forceps | Agnthos | 11021-12 | |
| Toothed tissue forceps for cleaning heart | Agnthos | 11023-10 | |
| Weigh tray, 70 mL | Sarsted | 71,99,23,212 |
参考文献
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Botker, H. E., et al. Practical guidelines for rigor and reproducibility in preclinical and clinical studies on cardioprotection. Basic Research in Cardiology. 113 (5), 39 (2018).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments: JoVE. (48), e1978 (2011).
- Zvejniece, L., Svalbe, B., Liepinsh, E., Pulks, E., Dambrova, M. The sensorimotor and cognitive deficits in rats following 90- and 120-min transient occlusion of the middle cerebral artery. Journal of Neuroscience Methods. 208 (2), 197-204 (2012).
- Liepinsh, E., Kuka, J., Dambrova, M. Troubleshooting digital macro photography for image acquisition and the analysis of biological samples. Journal of Pharmacological and Toxicological Methods. 67 (2), 98-106 (2013).
- Kolwicz, S. C., Tian, R. Assessment of cardiac function and energetics in isolated mouse hearts using 31P NMR spectroscopy. Journal of Visualized Experiments: JoVE. (42), e2069 (2010).
- Herr, D. J., Aune, S. E., Menick, D. R. Induction and assessment of ischemia-reperfusion injury in Langendorff-perfused rat hearts. Journal of Visualized Experiments: JoVE. (101), e52908 (2015).
- Liepinsh, E., et al. Inhibition of L-carnitine biosynthesis and transport by methyl-gamma-butyrobetaine decreases fatty acid oxidation and protects against myocardial infarction. British Journal of Pharmacology. 172 (5), 1319-1332 (2015).
- Nakamura, K., Al-Ruzzeh, S., Ilsley, C., Yacoub, M. H., Amrani, M. Acute effect of cerivastatin on cardiac regional ischemia in a rat model mimicking off-pump coronary surgery. Journal of Cardiac Surgery. 20 (6), 507-511 (2005).
- Li, Q., Morrison, M. S., Lim, H. W. Using a cardiac anchor to refine myocardial infarction surgery in the rat. Lab Animal. 39 (10), 313-317 (2010).
- Wu, Y., Yin, X., Wijaya, C., Huang, M. H., McConnell, B. K. Acute myocardial infarction in rats. Journal of Visualized Experiments: JoVE. (48), e2464 (2011).
- Vavers, E., et al. The neuroprotective effects of R-phenibut after focal cerebral ischemia. Pharmacological Research. 113, 796-801 (2016).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. EMBO Journal. 39 (13), 104073 (2020).
- Kloner, R. A., Darsee, J. R., DeBoer, L. W., Carlson, N. Early pathologic detection of acute myocardial infarction. Archives of Pathology & Laboratory Medicine. 105 (8), 403-406 (1981).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。