Method Article
使用PCR板深孔微孔设备生成更大的细菌生物膜生物质
摘要
该协议提供了使用自组装的深孔PCR板设备进行生物膜生长和生物质测量的方法,用于高通量96孔钉住盖子静态生物膜筛选。
摘要
使用常规抗菌干预措施很难从表面根除细菌生物膜。高通量96孔微孔板方法经常用于培养细菌生物膜,以进行快速抗菌敏感性测试,以计算最小生物膜根除浓度(MBEC)值。标准生物膜设备由装有96孔微孔板的聚苯乙烯钉住盖子组成,是测量生物膜生物量和MBEC值的理想选择,但这些设备受到可用于生物质积累和成本的可用钉表面积的限制。在这里,我们概述了使用自组装聚丙烯96孔深孔PCR板钉盖装置来生长大肠杆菌BW25113和铜绿假单胞菌PAO1生物膜的方案。描述了使用结晶紫生物质染色和MBEC测定测定法对每种物种在标准和深井设备上形成的24小时生物膜的比较。预计深井装置的较大表面积使两个物种的整体生物膜形成增加2-4倍。与标准装置相比,铜绿假单胞菌在深井钉上形成的生物量/mm2明显更大。与深井装置相比,标准聚苯乙烯装置上的大肠杆菌具有更大的生物量/mm2。使用次氯酸钠(漂白剂)或苯扎氯铵(BZK)等消毒剂进行的生物膜根除测定表明,这两种化合物都可以从两种设备中消除大肠杆菌和铜绿假单胞菌生物膜,但MBEC值不同。BZK生物膜根除导致设备之间的大肠杆菌MBEC值可变,然而,漂白剂显示出物种和设备的MBEC值可重复。本研究提供了一种高通量深井方法,用于在聚丙烯设备上生长大量生物膜,用于需要更高数量静态生物膜的下游研究。
引言
铜绿假单胞菌和大肠杆菌是革兰氏阴性变形杆菌,通常因其形成无柄表面附着的细胞群落(称为生物膜)的能力而受到研究1。当作为生物膜生长时,这两种物种都可以分泌主要由不同多糖和蛋白质组成的细胞外聚合物质(EPS)基质,其中还可以包括细胞外DNA和/或脂质,在恶劣的营养受限环境中提供额外的细胞保护并增强存活2,3。两个物种的生物膜生理学和形成具有临床相关性,因为它们代表了加拿大医院患者血液,尿路和肺部感染中最常见的五种最分离的抗菌素耐药病原体4,5。同样重要的是要注意,生物膜估计占这些细菌物种引起的所有慢性和复发性感染的近80%6。由于分泌的EPS物质和较慢的代谢活性7,8,当已建立的生物膜在植入式医疗设备,瘢痕组织和囊性纤维化患者的肺部等表面上形成时,它们变得更加难以根除,增加了其抗菌素耐药性。
细菌生物膜的顽固生长特性通常使它们对抗菌抑制和/或根除更具抵抗力2,9。因此,建立 体外 方法来研究细菌生物膜抗菌根除对于选择有效的化合物以根除在医用塑料(例如,固定导管)和医疗植入物上形成的感染至关重要。最快速 的体外 生物膜抗菌根除培养方法将生物膜生长检测为"静态"生物膜培养物,而不是"连续"培养物,其中在同一生长培养基中,在生物膜形成的早期至晚期阶段监测静态细菌生长。连续生物膜方法对于快速分析来说很麻烦,因为它们需要在更长的时间范围内评估生物膜的生长,这些生长室允许连续流动并用更少的重复替换生长培养基11。由于维护和建立连续生物膜需要时间和精力,静态 体外 生物膜是最受欢迎的,因为它们很容易适应塑料96孔微量滴定板中的高通量抗菌药敏试验测定,而不是复杂的流动室系统,限制同时测试的培养物数量 12,13.最简单的静态"井内"生物膜微孔板测定使用标准聚苯乙烯或乙烯基(300 μL容量)微量滴定板来测量每个孔的侧面和底部的生物膜形成,并且通常作为空气到液体表面界面处的环。通过对生长培养基液体除去并洗涤生物膜后粘附在孔中的沉积生物质进行染色来测量细菌井中生物膜的形成12,13。这些检测方法在经济上很受欢迎,但由于其固有的设计,通常存在可重复性问题,因为沉积的生物膜在细胞回收和生物质染色程序的漂洗过程中容易损坏或丢失11,14。
为了减少生物膜损失,标准商用生物膜设备改进了井内生物膜微孔板设计,在标准96孔孔板设计中添加了可插入的96孔粘合聚苯乙烯盖,在本文中称为"标准生物膜装置"。添加钉住盖子扩大了每个微孔板孔中的可用表面积,从而增强了表面附着力和生物膜生物质形成15,16。标准生物膜固定盖装置允许更高的生物膜回收,去除和冲洗,以便将固定盖插入含有药物或生长条件挑战的新微量滴定板中,以进行后续抗菌生物膜敏感性和根除测试。与井内生物膜微孔板技术类似,从去除和洗涤的钉住盖子装置中回收的材料允许进行细胞存活测试和生物膜生物质染色,通常涉及结晶紫(CV)染料配方 17,18,19。标准生物膜设备也是筛选生物膜抗菌敏感性的最佳选择。这些测定以两种方式监测生物膜生长抑制:1)当在生长开始时将抗菌剂添加到细胞中时,它可以确定最小生物膜抑制浓度(MBIC)值。2)当24小时后在钉子上形成建立的生物膜,然后暴露于抗菌剂中时,它可以确定最小生物膜根除浓度(MBEC)值 17,20。与井内生物膜微孔板设备类似,标准生物膜设备具有一些明显的局限性,例如其每个设备的成本高,不可高温高压灭菌,并且由于使用的聚苯乙烯板材料而对化学溶剂的耐久性较差。标准生物膜设备还具有低表面积与销钉比率,这限制了每个孔中的最大工作体积为200μL。这些因素可能使标准生物膜设备在需要大量高通量形式的生物膜的研究中使用更具挑战性。
在这里,我们描述了我们实验室开发的静态生物膜钉住盖96孔方法,该方法使用市售的聚丙烯半裙边0.5 mL 96孔PCR板安装到具有比标准板深的96孔微量滴定板(材料表)。当用于生长生物膜时,这些组装的装置的最大工作体积为750μL(本文称为"深井生物膜装置")。与标准生物膜设备相比,使用这些深井生物膜设备的优点是成本较低,可以通过高压灭菌进行灭菌,并且它们增加了在较大的外部PCR板"管/钉"上形成生物膜的表面积。通过这种方法,我们展示了这些设备在生长和表征由 大肠 杆菌BW25113和 铜绿假单 胞菌PAO1形成的生物膜生物质中的应用。使用季铵化合物消毒剂苯扎氯铵(BZK)和次氯酸钠(漂白剂)抗菌剂描述了使用生物膜根除测定确定MBEC值的方法。之所以选择抗菌剂/消毒剂 BZK,是因为这种化合物经常用于抑制受污染表面的生物膜,但据报道,它在根除成熟生物膜方面效果较差21。漂白剂是一种用于根除已建立的生物膜的高效化学品,是化学消毒的中流砥柱 22。两种消毒剂都提供了每个生物膜装置的MBEC值的有用比较21。本文总结了使用CV染色和生物膜根除测定进行MBEC测定的生物膜设备评估方案。包含了一个协议流程图,以简化这些方法的工作流程概述(图 1)。
研究方案
1. 用于生物膜生长的无菌培养制剂(第0-1天)
- 在第0天,将用于测试的冷冻保存的储备(甘油或二甲基亚砜(DMSO))中的所需细菌菌株直接划到营养琼脂平板上,并根据需要选择抗菌剂。在最佳温度(37°C)和时间(18-22小时)下孵育琼脂平板以进行菌株生长。
- 第二天(第1天),在最佳生长条件下将琼脂平板中的菌落接种在5mL生长培养基中。这些培养物将用作生物膜装置的第2天开始接种物(见步骤2.2; 图 1)。
注意:在本研究中, 大肠杆菌 K-12 BW21153和 铜绿假单胞菌 PAO1在37°C的Luria-Bertani(LB)培养基中生长18小时,以每分钟160转(rpm)振荡。- 由于钉住盖子设备上生物质形成的统计变异性,准备至少3个独立培养的菌株以产生用于生物膜测量的生物重复。
2. 板的制备和接种(第2天)
- 用750μL/孔无菌水填充高压灭菌的96孔,1.1mL /孔聚丙烯板的外孔(图2A)。用750μL生长培养基填充阴性对照孔(未接种的培养基孔;B柱),用675μL生长培养基填充其余孔。
注:上述步骤2.1和以下步骤列出了深井生物膜装置的适当体积。如果使用标准生物膜装置,体积应按如下方式改变:接种培养物75μL至20μL;675 μL生长培养基至180 μL;750μL无菌水/生长培养基至200μL;800 μL CV染色剂/醋酸/冲洗液至210 μL。此外,对于下面的步骤3.6,当使用标准生物膜设备微孔板时,混合后可以直接在聚苯乙烯微孔板中读取500nm(A550nm)处的吸光度。 - 使用第1天过夜培养物,将培养物标准化为600nm(OD 600nm)= 1.0的光密度或0.5-1单位的McFarland标准。
- 在试管或96孔深孔微量滴定板中对每种标准化培养物进行10倍连续稀释,直到达到10-3 稀释度。
- 用75μL的1×10-3稀释培养物接种含有如图2B所示的孔的培养基,以获得10-4的最终孔内细菌稀释。
- 小心地将高压灭菌的PCR板(钉住盖子)插入接种的深孔板中。在最佳应变条件(37°C)下将板在湿度为50-60%的培养箱中振荡(最大160rpm)孵育24小时。
3. 使用CV染色从设备中测定生物膜生物质(第3天)
- 无菌地从每个设备中取出生物膜固定盖,并通过插入用800μL无菌磷酸盐缓冲盐水(PBS)/孔制备的高压灭菌深孔板中冲洗30s以除去浮游细胞。
- 对于生物质CV染色,将固定的PCR板盖转移到用800μL /孔0.1%(w / v)CV在dH 2 O中制备的新板中并染色5分钟。
- 通过用800μL/孔无菌PBS制备的深孔板冲洗固定的盖子来去除多余的污渍。让板在生物安全柜中干燥10分钟,钉子朝上。
- 将干燥的PCR板盖转移到含有800μL/孔30%(v / v)乙酸的板中,并让盖子去污5分钟。
- 取出脱色的PCR钉盖,通过移液彻底混合溶液。将200μL从深孔板转移到标准的96孔微孔板中,并在紫外(UV)/可见(Vis)范围酶标仪中以550nm(A550nm)的波长测量去染色溶液的吸光度。
- 使用测量的A550nm 值,从每个生物膜样品值中减去平均空白(阴对照)A550nm 值。平均每个空白减去的A550nm 生物膜样品值表示样品的生物重复。
4. 用抗菌剂挑战生物膜,以计算其24小时抗菌MBEC值(第3天)
- 在水中制备抗菌储备溶液,该溶液是要测试的所需最高抗菌剂浓度的两倍(2x)。
- 在2倍浓缩的生长培养基中创建抗菌储备溶液的两倍稀释系列,以便有8种抗菌浓度。
- 如图 2B所示,用750μL/孔无菌水填充高压灭菌深孔板的外孔。用750μL/孔生长培养基填充板的柱B(阴性对照;无细菌)和C柱(阳性对照;无抗菌暴露)。用750μL/孔的抗菌稀释系列填充剩余的孔,如图 2B所示。
- 按照步骤3.1中所述取出并冲洗固定的盖子,并将其转移到抗菌激发板中。
- 在适当的应变条件下和所需的曝光时间范围内振荡(最大160 rpm)孵育板。
5. 从钉住的盖子中回收生物膜生物质(第4天)
- 取出抗菌剂暴露的钉住盖子,并按照步骤3.1中所述冲洗。将固定的盖子转移到深孔板中,内孔中含有750μL/孔恢复培养基,外孔中具有750μL/孔无菌dH 2 O。
- 要制备 70 mL 恢复培养基,请将 35 mL 2x 浓缩 LB、0.7 mL 100% 补间-20、3.5 mL 20x 通用中和溶液和 30.8 mL 无菌 dH2O 混合在无菌瓶中。
- 为了制备20x浓缩的通用中和溶液,加入1.0gL-组氨酸,1.0gL半胱氨酸和2.0g还原谷胱甘肽至最终体积为20mL的dH 2 O。
- 将步骤5.1中的设备放入安装在超声处理水浴内的辅助箱中。对设备进行超声处理30分钟,以将生物膜从销子中移出到恢复培养基中。
- 超声处理后,取下钉住的盖子,并将无菌平板盖盖在深井回收培养基板上。钉住的盖子可以丢弃。
- 将具有步骤5.3的回收培养基的板在最佳菌株生长条件下孵育过夜(16-18小时)。
6. 确定设备 MBEC 值(第 5 天)
- 第二天,将200μL从步骤5.4中孵育的深孔板转移到新的96孔微量滴定板中。使用紫外可见分光度范围酶标仪读取每个孔的OD 600nm 。
- 从每个含有孔的样品的生物膜中减去负对照(未接种空白)OD 600nm 值。
- 使用 OD600nm 值计算每个样品的 MBEC 值,其中 MBEC 值是导致特定抗菌处理物种/菌株样品的最低抗菌浓度 (与未接种的对照难以区分)的最低抗菌浓度。
结果
本研究的目的是提供一种使用深井生物膜设备进行更大体积,高通量(96孔)静态生物膜设备测量的方法。在这里,我们将插入深孔微孔板(称为深孔装置)的自组装半裙边PCR板与常用的标准生物膜固定盖装置进行了比较,以检查它们形成静态生物膜的能力。CV染色的生物质和生物膜根除测定(MBEC)用于评估两种装置的生物膜形成。
为了比较每种设备上不同物种的生物膜形成,我们使用生物膜CV染色方案评估了大肠杆菌BW25113和铜绿假单胞菌PAO1形成的生物膜生物量17。虽然CV染色通常报告为A550nm值,但由于每个器件的生长体积及其可用表面积的差异,我们将CV染色剂A550nm值转换为溶液中的摩尔CV浓度。摩尔CV浓度占每个装置的体积差异,并允许比较代表从每个装置回收的生物质的CV浓度。结果表明,与标准生物膜装置相比,这两种物种在深井生物膜装置(2.1倍大肠杆菌;4.1倍铜绿假单胞菌)上产生的生物量明显更多(图3A-B)。考虑到与标准设备钉表面积(108.9 mm2)相比,深孔PCR钉的表面积(320.4 mm2)更大,因此预期会出现这一结果。这一发现也与与标准设备孔(200μL)相比,深孔生物膜设备中使用的体积增加(750μL)增加也一致。因此,与使用标准生物膜装置的较小钉相比,深井装置增加了PCR管钉上的生物膜生物量积累。
当我们比较由大肠杆菌和铜绿假单胞菌形成的生物复制生物膜时,两种生物膜装置都形成了可重复的生物膜(图3A-B)。尽管在深井设备上生长的菌株的技术复制CV染色M A550nm值中观察到更大的变异性,但当我们使用成对双向方差分析(ANOVA)或学生T检验(均p)比较深井或标准设备上每个物种生物重复的中位数CV M值时,没有统计学上的显着差异 > 0.05)。这一发现表明,深井和标准装置形成生物膜形成可重复的生物膜。然而,CV染色结果还表明,当我们考虑每个装置上的peg表面积差异时,大肠杆菌和铜绿假单胞菌形成的生物膜生物量在生物量积累方面显示出统计学上的显着差异(表1)。计算大肠杆菌每钉表面积的平均CV染色生物量(M)(以mm2(CV M / mm2)为单位)表明,与标准生物膜装置相比,聚丙烯深井装置上的生物膜形成量比标准生物膜装置低1.5倍(表1)。然而,铜绿假单胞菌获得了相反的结果,与标准生物膜装置相比,聚丙烯深井装置上的CV M / mm2高出1.4倍(表1)。尽管观察到每个装置在生物膜生物量积累方面存在物种特异性差异,但深井装置仍然显示出每个物种生物膜生物量形成的总体(2-4倍增加)更大(图3)。
为了确定深井生物膜装置的抗菌药敏试验应用,我们比较了两种常用的消毒剂BZK和漂白剂的生物膜根除潜力。这两种化学品通常用于预防(BZK)和/或根除(漂白剂)临床和工业应用中的细菌生物膜21,22,23。将每种化合物以增加2倍的浓度添加到标准和深孔生物膜设备上由大肠杆菌和铜绿假单胞菌形成的生物膜中22,23(图1,2B)。导致OD600nm值与阴性对照井难以区分的BZK或漂白剂的最低浓度定义为MBEC值。用漂白剂处理在标准生物膜设备上形成的生物膜导致大肠杆菌和铜绿假单胞菌的漂白剂MBEC值为0.625%(表1,图4A-B)。在深井设备上形成的大肠杆菌和铜绿假单胞菌生物膜的漂白剂MBEC值显示两个物种的MBEC值降低了2-4倍(大肠杆菌; 0.156%;铜绿假单胞菌0.313%)与标准设备相比(表1)。深井装置的物种间漂白剂MBEC值差异为2倍,其中铜绿假单胞菌需要比大肠杆菌高2倍的漂白剂浓度来根除生物膜(图4A-B,表1)。深井装置中铜绿假单胞菌和大肠杆菌之间的漂白剂MBEC差异为2倍,与大肠杆菌相比,铜绿假单胞菌CV染色生物量形成增加1.5倍呈负相关(图3A-B)。铜绿假单胞菌在深井设备钉上形成的较大生物量也可以解释为什么与深井上的大肠杆菌相比,需要更高的漂白剂浓度来根除铜绿假单胞菌生物膜(图3A-B,表1)。因此,深井设备生物膜根除测定表明,这两种物种都容易受到漂白剂的影响,但与标准设备相比,漂白剂浓度较低(2-4倍)。这与深井设备PCR板钉的钉子表面积和体积大3倍成反比。这表明,对于漂白剂暴露,更大的生物质表面积可能会降低生物膜根除所需的漂白剂浓度。
与漂白剂结果相比,BZK生物膜根除测试显示每个物种的恢复生长(OD600nm值)和MBEC值的变异性更大(图4C-D)。基于先前的研究表明,BZK在防止生物膜形成方面比根除成熟的生物膜更有效,这种变异性并不出乎意料24,25,26。使用标准生物膜装置,只有用BZK处理的铜绿假单胞菌生物膜显示出一致的MBEC值(2560μg/ mL),比在深孔装置中获得的该菌株获得的MBEC值(20480μg/ mL)低8倍(表1,图4C)。这些结果可能反映了与标准设备钉相比,在深井固定表面和塑料组合物上形成的铜绿假单胞菌生物量的差异。BZK根除深井和标准设备上由大肠杆菌形成的生物膜同样较差,导致深井设备上的BZK MBEC值范围很广,从2560-40960μg/mL到标准设备上的320-10240 μg/mL(图4D)。对于大肠杆菌,这种变异性可以通过偶尔的例子来解释,其中1-2个重复孔在回收介质中显示出低但具有统计学意义的增长,这增加了误差并降低了任何一种设备的BZK MBEC测定准确性(图4D,表1)。这种变异性凸显了使用BZK根除大肠杆菌生物膜的无效性,如前所述,研究24,25,26。相比之下,铜绿假单胞菌生物膜可以通过BZK在两种装置中以规定的浓度可靠地根除,但BZK浓度差异为8倍(图4C)。总之,铜绿假单胞菌形成的生物膜的BZK根除MBEC值在每种装置上显示出不同的MBEC值,然而,两种装置在区分大肠杆菌精确BZK根除表型方面同样较差。
因此,与标准生物膜装置相比,本文所述的深井生物膜装置方法对于形成可重现的生物膜同样有效。

图 1.实验示意图概述。 第0天从冷冻保存的库存中分离单个菌落;第1天接种具有单个菌落的生长培养基;第2天接种生物膜板;第3天CV染色或抗菌挑战;第4天生物膜超声处理到恢复培养基中;第5天读取回收板的OD 600nm以确定MBEC值。图中的一些图像由施维雅医学艺术(smart.servier.com)提供。 请点击此处查看此图的放大版本。

图 2.为协议的各个步骤显示的示例板布局。A) 使用来自两种细菌菌株(大肠杆菌 和 铜绿假单胞菌)的第1天细菌培养物进行初始24小时生物膜生长的最终平板设置,每种菌株具有三个生物重复。阴性对照孔(灰色)用作无菌对照(不添加细菌)。 B) 用于生物膜抗菌挑战的板设置。变暗的颜色表明抗菌剂浓度增加。阴性对照是没有添加细菌的孔(灰色),阳性对照是没有抗菌剂暴露的生物膜(橙色)。从面板A取出的生物膜钉盖被转移到这个深孔板中以进行抗菌暴露。 请点击此处查看此图的放大版本。
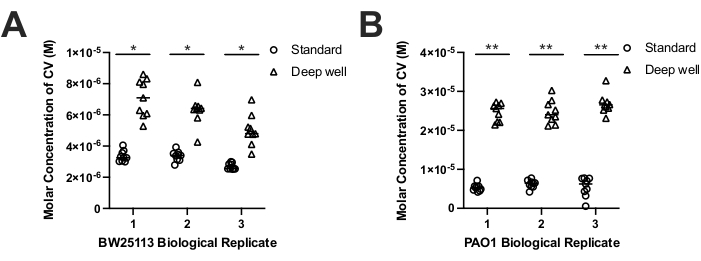
图 3.CV染色的大肠杆菌BW25113的摩尔浓度(M)。(A)和铜绿假单胞菌PAO1(B)生物膜生物质从标准(圆)和深井(三角形)装置中回收。通过读取CV在550nm(A550nm)处的吸光度来测量CV染色,并将深孔A550nm读数调整为3.809(800μL / 210μL)的因子,以解释设备之间的体积差异。CV摩尔浓度(M)由比尔-朗伯定律确定(CV浓度=A550nm/εl);其中,在96孔平底微量滴定板中210μL的光程(l)为0.56 cm,在A550nm处CV的消光系数(ε)为251500cm-1M-139。结果代表了作为生物膜生长的每个菌株的三个生物重复的9个技术重复,每个生物复制的中位数在每个图中显示为水平条。使用双尾配对t检验确定装置之间生物重复中位数之间的生物量差异具有统计学意义(大肠杆菌p= 0.008-0.018(*);铜绿假单胞菌 p= 0.002-0.009 (**)) 显示为带星号的柱。请点击此处查看此图的放大版本。
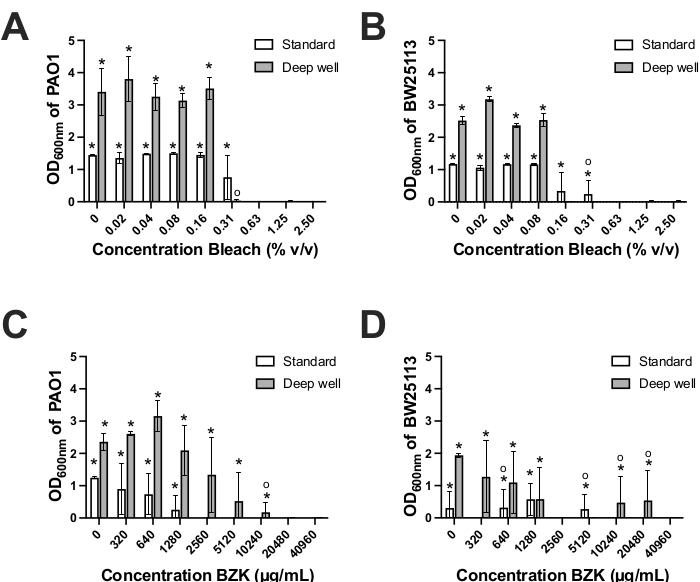
图 4.抗菌MBEC浓度的测定。 在标准(白条)和深井(灰条)生物膜固定装置上生长时,测定白剂(A,B)和铜绿假单 胞菌 PAO1(A,C)和 大肠杆菌 BW25113(B,D)的抗菌MBEC浓度。通过读取超声处理后回收的生物膜OD 600nm并进入回收培养基并过夜孵育来确定结果。深孔OD 600nm通过3.75(750μL / 210μL)的因子进行调整,以考虑器件之间的体积差异。结果代表了三个生物重复,误差条显示了每个抗菌浓度下重复之间的标准偏差39。每个条形图上方的星号 (*) 表示使用双尾学生 T 检验计算,与 p 值< 0.05 的空白对照相比,OD600nm 值在统计意义上显著差异。每个条形图上方的圆圈符号 (o) 表示只有 1 个或 2 个重复具有来自空白控件的具有统计显著性 OD600nm 值的测量值。 请点击此处查看此图的放大版本。
| BZK MBEC (μg/mL) | 漂白剂 MBEC (% v/v) | |||
| 经应变测试 | 深井装置 | 标准设备 | 深井装置 | 标准设备 |
| 大肠杆菌 BW25113 | 2560-40960 | 320-10240 | 0.156 | 0.625 |
| 铜绿假单胞菌 PAO1 | 20480 | 2560 | 0.313 | 0.625 |
| 深井装置 | 标准设备 | p 值** | 折叠更换(深井/标准) | |
| 经应变测试 | 平均 CV M*/ mm2 ±标清 | 平均 CV M*/ mm2 ±标清 | ||
| 大肠杆菌 BW25113 | 1.99 x 10-8 ± 3.25 x10-9 | 3.03 x 10-8 ± 3.31 x 10-9 | 0.0176 | -1.52 |
| 铜绿假单胞菌 PAO1 | 8.01 x 10-8 ± 9.42 x 10-9 | 5.72 x 10-8 ± 9.42 x 10-9 | 0.034 | 1.4 |
表 1. 大肠杆菌 BW25113 和铜绿假单 胞菌 PAO1 在各种设备上对 BZK 和漂白剂的平均 CV 染色生物量 M/mm2 值和生物膜根除 MBEC 值的摘要。
*使用生物复制CV M值的中位数计算的平均CV M / mm2值(图3)。
**使用双尾学生 T 检验确定的 p 值。
讨论
本研究描述了使用更大体积的96孔高通量静态生物膜生长装置的方法,该装置涉及装有半裙边PCR板盖的聚丙烯深孔微孔板,用于生物膜形成(深孔生物膜装置;材料表)。我们将该设备产生的生物膜与市售的聚苯乙烯标准生物膜设备进行了比较(材料表)。深井装置方法使用与标准装置17相同的方法学步骤和溶液,调整后体积适用于深井装置,使该装置成为大规模生物膜形成和实验分析的理想选择。大肠杆菌BW25113和铜绿假单胞菌PAO1的生长,这两种已知形成生物膜的革兰氏阴性物种,在两种设备上都检查了它们的生物量形成和消毒剂(BZK / bleach)MBEC值。对来自每个装置的钉子上形成的CV染色生物量的比较表明,与标准装置相比,大肠杆菌和铜绿假单胞菌在深井生物膜装置上形成具有更高生物量的生物膜(图3A-B)。与标准设备钉表面积相比,生物膜生物量的增加反映了深井钉的更大表面积。当我们考虑两种装置的钉子表面积(mm2)的差异时,注意到生物质形成的差异,其中大肠杆菌在聚苯乙烯标准装置钉上每mm2形成的CV生物量明显大于深井装置的PCR管钉(表1)。与标准设备相比,铜绿假单胞菌形成了更大的CV染色生物量/ peg mm 2(表1)。这些发现可能突出了不同设备上生物膜生物质形成的物种特异性差异。
应该注意的是,深井设备上大肠杆菌和铜绿假单胞菌生物膜的漂白根除的浓度比标准设备低2-4倍(图4A-B,表1)。从每个设备确定的漂白剂MBEC值的差异可能受到设备销形状(深孔"钉"是锥形管,标准销是圆柱形),塑料成分差异(聚丙烯与聚苯乙烯)和体积差异(750μL与200μL)的影响。例如,与标准设备相比,铜绿假单胞菌在深井装置钉上具有更大的CV M生物量/ mm2,但大肠杆菌在深井钉上的生物量较少(图3)。这表明,根除生物膜所需的消毒剂浓度可能会受到每个物种形成的生物量以及可用表面积的影响。此外,设备钉形状的差异可能会影响特定物种的各种生长条件。在我们的研究中,铜绿假单胞菌可能由于其更大的表面积和通气而在深井钉上形成更大的生物量,因为该物种是一种专性需氧菌,与大肠杆菌相反,大肠杆菌是一种兼性厌氧菌。迄今为止,我们尚未发现任何已发表的研究直接比较了聚丙烯27,28,29和聚苯乙烯30,31材料上的大肠杆菌和铜绿假单胞菌生物膜的形成。然而,在检查聚丙烯或聚苯乙烯材料的独立研究中已经注意到强健的大肠杆菌和铜绿假单胞菌生物膜形成的报告。关于假单胞菌,许多假单胞菌属可以使用聚丙烯等塑料作为潜在的碳源32。因此,这种聚丙烯深井生物膜装置的可用性是静态生物膜研究的有用进展。聚丙烯在化学上比聚苯乙烯更耐用,并且是一种临床相关的材料,因为它经常用于疝气或盆腔手术的医疗植入物,缝合线和网眼33,34。
虽然两种装置均形成生物膜生物质,但基于CV染色法和OD600nm 生物膜根除漂白剂和BZK值,深井装置的生物量变异性略高。这可以通过3个主要因素来解释:1)与标准设备挂钩相比,深井设备比标准设备具有更大的钉子表面积。2)测试的两种物质可能具有不同的能力来粘附每种设备的聚丙烯和聚苯乙烯材料。3)每个设备中使用的生长培养基的体积(750μL深孔,200μL标准)和插入的销到孔侧壁之间的间距不同。如果所有生物膜实验中只使用一种类型的设备,则这些问题不是问题,但是,如果同时选择了这两种设备,则应执行本文进行的比较以识别差异36,37。由于每个设备中使用的塑料材料不同,CV染色的生物膜生物量和MBEC值不应在不同设备之间直接比较。但是,如果在同一设备(深井或标准)上进行方法和实验,则所测试的物种和抗菌剂获得的结果具有可比性。
该协议表明,自组装式深孔PCR板装置是用于测量生物膜形成和根除的较大体积生物膜装置,也具有成本效益。从成本角度来看,具有96个良好固定盖子的标准生物膜设备的零售价为每台设备29-36美元(材料表)。聚苯乙烯标准生物膜设备不可高温高压灭菌,并且由于其塑料化学性质而对溶剂/酸的耐受性较差。本文所述的自组装聚丙烯深孔板,装有单独的半裙边96孔PCR板(材料表),每个组装设备的总成本为14美元,这是标准生物膜设备成本的一半。应该注意的是,价格可能因地区,分销商和可用性而异,我们在机构折扣后的成本达到9美元/深井设备。这些自组装式深井聚丙烯PCR板设备具有可高温高压灭菌的额外优势,并且提供比标准设备多2-4倍的生物膜生物质。
总之,该协议以及深井和标准生物膜装置的生物膜生长比较的代表性结果表明,这两种装置都能够培养细菌生物膜,但深井装置形成的生物膜多2-4倍。深井生物膜设备为大容量高通量生物膜形成实验(如药物敏感性筛选研究)提供了可行且经济实惠的替代方案。该技术可能产生可用于下游"组学"提取(蛋白质组学,代谢组学,转录组学)或实验测定(酶,荧光)的生物膜,这些实验测定可能需要大量生物膜材料进行分析。深井生物膜设备推荐用于希望使用具有临床相关性的低成本,更大体积,化学耐久的塑料材料在高通量96孔测定中研究生物膜的实验室。
披露声明
作者无需披露。
致谢
这项工作的资金来自加拿大自然科学与工程研究委员会发现补助金(RGPIN-2016-05891)向DCB提供的运营赠款,以及加拿大政府基因组学研究与开发计划(GRDI7 2254557)向MRM和GRG提供的运营赠款。
材料
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipets, individ wrap paper/plastic (200/CS) | Fisher Scientific | 13-678-11F | disposable serological pipettes for aseptic media/ culture transfer |
| 2 mL serological pipets, individ wrap paper/plastic, 500/CS | Fisher Scientific | 13-678-11C | disposable serological pipettes for aseptic media/ culture transfer |
| Axygen Aerosol Filter Tips, Sterile, 5 racks/ PK, 1000 tips/rack | Fisher Scientific | 14-222-766 | sterile pipettor tips for media aliquoting |
| Axygen deep well storage microplates, round wells, 1.1 mL cap, 5/PK, P-DW-11-C | Fisher Scientific | P-DW-11-C | microplate for 96 well deepwell device biofilm cultivation |
| Axygen Filter tips, 350 µL tips racked, 96/rack, 10 racks, low retention barrier tips | Fisher Scientific | TF-350-L-R-S | sterile pipettor tips for media aliquoting |
| Basin/reservoir natural PS 50 mL, Sterile, 5/bag, 40 bags, CS200 | Avantor/ VWR | 89094-676 | sterile basins/ reservoirs for microplate preparation |
| BD Difco Dehydrated Culture Media: Granulated Agar, 500 g | Fisher Scientific | DF0145-17-0 | materials for LB agar preparation |
| Biotek Synergy Neo2 multimode plate reader | Biotek | NEO2MB | microplate UV/Vis region plate reader |
| Branson M3800 Ultrasonic Bath, 117 V | Avantor/ VWR | CPX-952-316R | sonicating water bath |
| crystal violet (CV), ACS grade, 100 g | Fisher Scientific | C581-100 | biofilm biomass stain |
| Dimethyl sulfoxide (DMSO), 1 L, ACS grade 99.9%, poly bottle, BDH | Avantor/ VWR | CABDH1115-1LP | media components for cryopreservation |
| Easypet 3, pipet controller | Avantor/ VWR | CA11027-980 | serological pipettor for aseptic media/ culture transfer |
| Eppendorf Research Plus 8 multi-channel pipettor , 10-100 µL | Avantor/ VWR | CA89125-338 | multichannel pipettes for aseptic media/ culture transfer |
| Eppendorf Research Plus 8 multi-channel pipettor , 30-300 µL | Avantor/ VWR | CA89125-340 | multichannel pipettes for aseptic media/ culture transfer |
| Glacial acetic acid, CAS 64-19-7, 2.5L, ACS grade | Fisher Scientific | A38-212 | CV destain |
| Glass test tubes, 150 mm x 18 mm, 72/Pack, PYREX | Fisher Scientific | 14957H/ 9820-18 | materials for cell culturing |
| Glycerol, 4 L glass bottle ACS | Fisher Scientific | BP229-4 | media components for cryopreservation |
| L-Cysteine, 98%, 250 g | Avantor/ VWR | 97061-204 | universal neutralizing solution |
| L-glutathione reduced, 98%, 25 g | Fisher Scientific | AAJ6216614 | universal neutralizing solution |
| L-Hisitidine, 98%, 100 g | Avantor/ VWR | CA97062-598 | universal neutralizing solution |
| MBEC Assay Inoculator with 96 well tray, 100/CS | Innovotech | 19112 | material for 96 well MBEC device biofilm cultivation |
| McFarland Standard, 0.5 EA | Fisher Scientific | R20410 | cell culture standardization |
| McFarland Standard, 1.0 EA | Fisher Scientific | R20411 | cell culture standardization |
| NUNC 96-well microtiter plates, w/lid, 50/CS | Fisher Scientific | 167008 | microplate for 96 well MBEC device biofilm cultivation and OD measurements |
| PCR plate, semi-skirted 96 well, fast PCR, polypropylene, 25ea/PK | Sarstedt | 72.1981.202 | pegged lid for 96 well deepwell device biofilm cultivation |
| Petri dish, 100 mm x 15 mm, semi-TK CS/500 | Fisher Scientific | FB0875712 | materials for LB agar preparation |
| Potassium phosphate dibasic, ACS 500 g | Fisher Scientific | P288-500 | PBS component/ buffer |
| Sodium chloride, ACS grade, 3 kg | Fisher Scientific | S2713 | media components for LB broth and PBS |
| sodium phosphate monobasic, 1 kg | Fisher Scientific | S369-1 | PBS component/ buffer |
| Syringe filters, Sterile, PES 0.45 um, 25 mm, PK50 | Avantor/ VWR | 28145-505 | non-autoclavable solution sterilization |
| Tin foil, heavy duty, 50 feet | Grocery store | --- | materials for deepwell device sterilization |
| Tryptone (peptone from casein), 2.2 kg/EA | Fisher Scientific | B11922 | media components for LB broth |
| Tween-20, 100 mL | Fisher Scientific | BP337-100 | recovery media solution |
| Ultra-deepwell, 2.5 mL deep well plates (square well), with lid, polypropylene, 10/CS | Avantor/ VWR | 37001-520 | materials for biofilm dilution preparation |
| Yeast Extract, Fisher Bioreagents, 500 g | Fisher Scientific | BP1422-500 | media components for LB broth |
参考文献
- Verderosa, A. D., Totsika, M., Fairfull-Smith, K. E. Bacterial Biofilm Eradication Agents: A Current Review. Frontiers in Chemistry. 7, 1-17 (2019).
- Sharma, D., Misba, L., Khan, A. U. Antibiotics versus biofilm: An emerging battleground in microbial communities. Antimicrobial Resistance and Infection Control. 8 (1), 1-10 (2019).
- Fux, C. A., Costerton, J. W., Stewart, P. S., Stoodley, P. Survival strategies of infectious biofilms. Trends in Microbiology. 13 (1), 34-40 (2005).
- Lagacé-Wiens, P. R. S., et al. Trends in antimicrobial resistance over 10 years among key bacterial pathogens from Canadian hospitals: results of the CANWARD study 2007-16. The Journal of Antimicrobial Chemotherapy. 74, 22-31 (2019).
- Karlowsky, J. A., et al. In vitro susceptibility of urinary Escherichia coli isolates to first- and second-line empirically prescribed oral antimicrobials: CANWARD surveillance study results for Canadian outpatients, 2007-2016. International Journal of Antimicrobial Agents. 54 (1), 62-68 (2019).
- Mah, T. F. Biofilm-specific antibiotic resistance. Future Microbiology. 7 (9), 1061-1072 (2012).
- Amato, S. M., et al. The role of metabolism in bacterial persistence. Frontiers in Microbiology. 5, 1-9 (2014).
- Flemming, H. -. C., Neu, T. R., Wozniak, D. J. The EPS matrix: The "house of biofilm cells.". Journal of Bacteriology. 189 (22), 7945-7947 (2007).
- Dela Fuente-Núñez, C., Reffuveille, F., Fernández, L., Hancock, R. E. W. Bacterial biofilm development as a multicellular adaptation: Antibiotic resistance and new therapeutic strategies. Current Opinion in Microbiology. 16 (5), 580-589 (2013).
- Høiby, N., et al. The clinical impact of bacterial biofilms. International Journal of Oral Science. 3 (2), 55-65 (2011).
- Merritt, J. H., Kadouri, D. E., O'Toole, G. A. Growing and analyzing static biofilms. Current Protocols in Microbiology. 01, (2005).
- Coffey, B. M., Anderson, G. G. Biofilm formation in the 96-well microtiter plate. Methods in Molecular Biology. 1149, 631-641 (2014).
- O'Toole, G. A. Microtiter dish Biofilm formation assay. Journal of Visualized Experiments. (47), e2437 (2010).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Harrison, J. J., Turner, R. J., Ceri, H. High-throughput metal susceptibility testing of microbial biofilms. BMC Microbiology. 5 (53), (2005).
- Ceri, H., et al. The MBEC Assay System: Multiple Equivalent Bioffims for Antibiotic and Biocide Susceptibility Testing. Methods in Enzymology. 337, 377-385 (2001).
- Harrison, J. J., et al. Microtiter susceptibility testing of microbes growing on peg lids: a miniaturized biofilm model for high-throughput screening. Nature Protocols. 5 (7), 1236-1254 (2010).
- vanden Driessche, F., Rigole, P., Brackman, G., Coenye, T. Optimization of resazurin-based viability staining for quantification of microbial biofilms. Journal of Microbiological Methods. 98, (2014).
- Sabaeifard, P., Abdi-Ali, A., Gamazo, C., Irache, J. M., Soudi, M. R. Improved effect of amikacin-loaded poly(D,L-lactide-co-glycolide) nanoparticles against planktonic and biofilm cells of Pseudomonas aeruginosa. Journal of Medical Microbiology. 66 (2), 137-148 (2017).
- Thieme, L., et al. MBEC Versus MBIC: the Lack of Differentiation between Biofilm Reducing and Inhibitory Effects as a Current Problem in Biofilm Methodology. Biological Procedures Online. 21 (1), 18 (2019).
- Jennings, M. C., Ator, L. E., Paniak, T. J., Minbiole, K. P. C., Wuest, W. M. Biofilm-eradicating properties of quaternary ammonium amphiphiles: Simple mimics of antimicrobial peptides. Chembiochem. 15 (15), 2211-2215 (2014).
- Lineback, C. B., et al. Hydrogen peroxide and sodium hypochlorite disinfectants are more effective against Staphylococcus aureus and Pseudomonas aeruginosa biofilms than quaternary ammonium compounds. Antimicrobial Resistance & Infection Control. 7 (1), 154 (2018).
- Minbiole, K. P. C., et al. From antimicrobial activity to mechanism of resistance: The multifaceted role of simple quaternary ammonium compounds in bacterial eradication. Tetrahedron. 72 (25), 3559-3566 (2016).
- Mangalappalli-Illathu, A. K., Korber, D. R. Adaptive resistance and differential protein expression of Salmonella enterica serovar enteritidis biofilms exposed to benzalkonium chloride. Antimicrobial Agents and Chemotherapy. 50 (11), 3588-3596 (2006).
- El-Banna, T., Abd El-Aziz, A., Sonbol, F., El-Ekhnawy, E. Adaptation of Pseudomonas aeruginosa clinical isolates to benzalkonium chloride retards its growth and enhances biofilm production. Molecular Biology Reports. 46, 3437-3443 (2019).
- Ebrahimi, A., et al. Effects of benzalkonium Chloride on planktonic growth and biofilm formation by animal bacterial pathogens. Jundishapur Journal of Microbiology. 8 (2), 59764 (2015).
- Reśliński, A., et al. Evaluation of Staphylococcus aureus and Escherichia coli biofilm formation on the surface of polypropylene mesh. Medycyna doświadczalna i mikrobiologia. 63 (1), 21-27 (2011).
- Verhorstert, K. W. J., et al. In vitro bacterial adhesion and biofilm formation on fully absorbable poly-4-hydroxybutyrate and nonabsorbable polypropylene pelvic floor implants. Cite This: ACS Applied Materials & Interfaces. 12, 53646-53653 (2020).
- Arkatkar, A., Juwarkar, A. A., Bhaduri, S., Uppara, P. V., Doble, M. Growth of Pseudomonas and Bacillus biofilms on pretreated polypropylene surface. International Biodeterioration & Biodegradation. 64 (6), (2010).
- Jones, J. F., et al. Oriented adhesion of Escherichia coli to polystyrene particles. Applied and Environmental Microbiology. 69 (11), 6515-6519 (2003).
- Zameer, F., et al. Evaluation of adhesive and anti-adhesive properties of Pseudomonas aeruginosa biofilms and their inhibition by herbal plants. Iranian Journal of Microbiology. 8 (2), 108-119 (2016).
- Arkatkar, A., Juwarkar, A. A., Bhaduri, S., Uppara, P. V., Doble, M. Growth of Pseudomonas and Bacillus biofilms on pretreated polypropylene surface. International Biodeterioration and Biodegradation. 64 (6), 530-536 (2010).
- Dieterich, M., et al. Implant-Based Breast Reconstruction Using a Titanium-Coated Polypropylene Mesh (TiLOOP Bra). Plastic and Reconstructive Surgery. 132 (1), 8-19 (2013).
- Clavé, A., et al. Polypropylene as a reinforcement in pelvic surgery is not inert: comparative analysis of 100 explants. International Urogynecology Journal. 21 (3), 261-270 (2010).
- Zameer, F., et al. Evaluation of adhesive and anti-adhesive properties of Pseudomonas aeruginosa biofilms and their inhibition by herbal plants. Iranian Journal of Microbiology. 8 (2), 108-119 (2016).
- Chen, R., Liu, X., Han, L., Zhang, Z., Li, Y. Morphology, thermal behavior, rheological, and mechanical properties of polypropylene/polystyrene blends based on elongation flow. Polymers for Advanced Technologies. 31 (11), 2722-2732 (2020).
- Vial Loading Trays Polystyrene vs. polypropylene: Which tubes are best for your research. ChemTech International Available from: https://chemtech-us.com/polystyrene-vs-polypropylene-which-tubes-are-best-for-your-research/ (2020)
- Bock, L. J., Hind, C. K., Sutton, J. M., Wand, M. E. Growth media and assay plate material can impact on the effectiveness of cationic biocides and antibiotics against different bacterial species. Letters in Applied Microbiology. 66 (5), 368-377 (2018).
- . Crystal violet Available from: https://omic.org/spectra/PhotochemCAD/html/048.html (2017)
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。