需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
原代人鼻上皮细胞模型的收集、扩增和分化,用于定量纤毛搏动频率
摘要
该协议描述了鼻上皮细胞的收集,扩增和分化为器官型气道上皮细胞模型,并通过活细胞成像和定制脚本量化纤毛搏动频率。
摘要
纤毛功能(搏动频率、模式)的测量已被确定为原发性睫状肌运动障碍等呼吸系统疾病的诊断工具。然而,这些技术的广泛应用受到睫状功能对环境因素(例如温度、湿度和 pH 值)变化的极端敏感性的限制。 在囊性纤维化(CF)患者的气道中,粘液积聚阻碍纤毛跳动。纤毛功能已在原发性气道细胞模型中作为CF跨膜电导调节因子(CFTR)通道活性的指标进行了研究。然而,已经发现对CFTR调节药物的反应存在相当大的患者间纤毛跳动频率差异,即使对于具有相同 CFTR 突变的患者也是如此。此外,CFTR调节的氯化物分泌功能失调对睫状功能的影响知之甚少。目前尚无全面的方案证明 体外 气道模型的样品制备、图像采集和纤毛搏动频率(CBF)的分析。在环境受控条件下进行的标准化培养条件和图像采集将能够对个体之间和CFTR调节药物做出一致、可重现的CBF定量。该协议描述了三种不同气道上皮细胞模型系统中CBF的定量:1)天然上皮片,2)在可渗透支持插入物上成像的气液界面模型,以及3)细胞外基质嵌入的三维类器官。后两者在 体内 复制肺生理学,伴有纤毛跳动和粘液产生。睫状功能是在环境控制的腔室中使用高速摄像机捕获的。定制脚本用于CBF的分析。将CBF测量结果转化为临床被认为是预测每个患者对CFTR调节药物反应的重要临床工具。
引言
纤毛搏动频率 (CBF) 和模式的测量已被确立为原发性睫状肌运动障碍 (PCD)等呼吸系统疾病的诊断工具1。在囊性纤维化 (CF) 中,CF 跨膜传导调节器 (CFTR) 氯化物通道功能障碍导致气道表面液体脱水和粘液纤毛清除受损2。已在原发性气道细胞模型中体 外 研究了睫状功能作为CFTR通道活性的指标3。然而,CBF对CFTR调节药物的反应存在相当大的患者间差异,即使对于具有相同 CFTR 突变的患者也是如此3。此外,CFTR调节的氯化物分泌功能失调对睫状功能的影响知之甚少。目前尚无全面的方案证明 体外 气道模型的样本制备、图像采集和CBF分析。
从鼻粘膜刷牙中分离的鼻上皮片直接用于PCD诊断的睫状功能测量4。然而,虽然无法控制所获得的鼻上皮片的大小或质量,但CBF取决于它是在单细胞还是细胞片上测量的,以及在被破坏或未被破坏的上皮片纤毛边缘上测量5。因此,在收集鼻粘膜刷牙期间由细胞损伤引起的继发性运动障碍可能会影响CBF。鼻上皮细胞的原代细胞培养及其在气液界面 (ALI) 或三维基底膜基质中分化为纤毛状气道上皮类器官可产生无继发性运动障碍的纤毛4,6,7,8。在ALI分化的气道上皮细胞(以下简称ALI模型)被认为是一种重要的二级诊断辅助工具,可复制睫状搏动模式和离体鼻粘膜刷洗的频率6,并能够分析睫状超微结构,搏动模式和搏动频率,同时保留患者特异性缺陷9.然而,用于创建这些伪分层粘液纤毛分化细胞模型的方法存在差异。不同的培养物扩增或分化方案可诱导不同的上皮表型(纤毛或分泌)10,并导致CBF11的显着差异。CBF已在鼻上皮刷牙4,6,12,13,14,15,16,气道上皮类器官14,17,18和ALI模型3,4,6,13,19,20中定量,21.然而,在这些协议中,存在很大的可变性,并且通常许多参数不受控制。例如,在一些研究中,CBF被原位成像,而ALI模型的细胞保留在可渗透支持插入3,19,20,21上,而另一些则从可渗透支持插入物中刮下细胞并成像它们悬浮在培养基4,6,13中。
此外,纤毛功能测量技术的更广泛应用受到睫状功能对环境因素变化的极端敏感性的限制。温度 22、湿度23、24 和 pH 25,26 等环境因素会影响睫状功能,必须加以调节以准确量化 CBF。之前已经回顾了不同实验室使用的各种生理参数以及它们如何影响CBF27。
文献中报道了各种成像技术和CBF测量方法。对于PCD诊断,视频显微镜用于测量睫状功能28,29。最近,基于差分动态显微镜的视频分析算法用于量化气道上皮细胞ALI模型3,30中的CBF和纤毛协调。该方法能够以快速和全自动的方式表征气道上皮细胞中的睫状跳动,而无需分割或选择区域。CBF的各种成像和定量方法可能会增加文献中CBF中报道的差异(补充文件1)。
从培养到定量的协议,以简化现有方法、培养条件的标准化和图像采集,在严格的环境控制条件下进行,将实现个体内部和个体之间的CBF的一致、可重复的定量。
该协议提供了上皮细胞收集,扩增和分化培养条件以及鼻源性三种不同气道上皮细胞模型系统中CBF定量的完整描述:1)天然上皮片,2)在可渗透支撑插入物上成像的ALI模型和3)细胞外基质(ECM)嵌入的三维类器官(图1).从鼻下鼻甲刷牙获得的鼻上皮细胞被用作气道上皮的代表,因为它们是支气管上皮细胞31 的有效替代物,同时克服了与收集支气管刷牙相关的侵入性程序。条件重编程细胞(CRC)方法用于扩增原代气道上皮细胞,以创建ALI模型和三维类器官。通过与生长停滞的成纤维细胞饲养细胞系统和 Rho 相关激酶 (ROCK) 抑制剂32 共培养,诱导气道上皮细胞有条件地重编程为干细胞样状态。重要的是,CRC方法增加了气道上皮细胞中的群体倍增,同时保留了其组织特异性分化潜力33,34。在所有气道上皮细胞模型中,睫状功能都是使用具有标准化图像采集设置的高速摄像机在温控室中捕获的。定制脚本用于CBF的量化。

图 1:工作流程示意图。 刷完参与者的鼻下鼻甲后,气道上皮细胞以两种方式之一被利用。要么分离气道上皮片,立即对纤毛搏动频率进行成像,要么通过条件重编程细胞法扩增气道上皮细胞。对CRC扩增的气道上皮细胞进行分化,以在气液界面或气道上皮类器官培养物上建立气道上皮细胞。睫状搏动频率的成像是使用带有加热和湿度环境室的活细胞成像显微镜和快速帧率(>100Hz)科学相机获取的。数据分析是使用自定义脚本执行的。 请点击此处查看此图的大图。
研究方案
研究已获得悉尼儿童医院网络伦理审查委员会(HREC/16/SCHN/120)的批准。在收集生物标本之前,已获得所有参与者(或参与者的监护人)的书面同意。
1. 建立气道上皮细胞模型的准备
- 通过混合 80% Dulbecco 的改良鹰培养基和 20% 胎牛血清来制备鼻细胞收集培养基。补充 1 μL/mL 青霉素/链霉素。在4°C下储存长达3个月。
- 按照步骤1.2.1-1.2.4根据需要在烧瓶或渗透性支撑物插入物上涂上胶原蛋白溶液。不要长期储存胶原蛋白涂层的血管。
- 用磷酸盐缓冲盐水 (PBS) 以 1:100 的比例稀释 I 型胶原蛋白溶液(3 mg/mL 储备液),终止浓度为 0.03 mg/mL。混合均匀。
- 用 160 μL/cm 2(即每个 T25 烧瓶 4 mL)涂覆细胞培养瓶(第 4 部分)和用 455 μL/cm2(即每 6.5 mm 插入物 150 μL)制备的胶原蛋白溶液涂覆渗透性支持插入物(第 5 部分)。
- 在37°C孵育2-24小时。
- 在接种细胞之前,通过移液器或真空吸引器去除胶原蛋白溶液。接种细胞前不要清洗容器。
- 通过组合表1中列出的组分32来制备条件重编程细胞(CRC)培养基。使用瓶顶真空过滤系统进行过滤灭菌。在4°C下储存长达2个月。
- 使用当天,加入人表皮生长因子、ROCK抑制剂和抗生素,如 表1所示。
| 元件 | 卷 |
| DMEM,高血糖 | 156.7毫升 |
| DMEM/F-12, HEPES | 313.3毫升 |
| 氢化可的松 | 55.6 微升 |
| 胰岛素 | 1.25毫升 |
| 霍乱毒素 | 21 微升 |
| 腺嘌呤 | 1.2毫升 |
| HI-FBS | 25毫升 |
| 青霉素-链霉素 | 5毫升 |
| 人表皮生长因子 | 1 微升/毫升 |
| 岩石抑制剂 | 1 微升/毫升 |
| 真菌宗 | 2 μl/ml |
| 妥布霉素 | 2 微升/毫升 |
| 头孢他啶水合物 | 4 微升/毫升 |
| 庆大霉素溶液 | 1 微升/毫升 |
表 1:500 mL 条件重编程细胞培养基的组分
2.鼻下鼻甲刷牙的收集
注意:协议的这一部分需要一个带有鼻细胞收集培养基、细胞学刷、组织和适当个人防护设备的收集管 (50 mL)。上呼吸道感染期间避免刷牙。出血的风险很小,如果存在炎症,出血风险会增加。如果刷牙的目的是获得用于 离体 CBF测量的气道上皮薄片,则应在任何上呼吸道感染后至少6周刷牙;理想情况下,感染后 10 周以上35.
- 准备鼻细胞收集培养基(第1节)并将管子放在冰上。
- 向参与者描述不舒服的过程。解释刷牙时鼻孔有饱满的感觉,类似于跳入大海/游泳池,水冲入鼻腔。告知参与者,该程序将诱导眼泪的产生作为反射。
- 评估哪种姿势适合参与者。如果有检查床,请将参与者置于仰卧位,因为仰卧位可防止参与者的头部在手术过程中远离刷子。或者,让参与者坐在墙边,他们可以把头向后压。
- 检查鼻腔通道。注意鼻中隔偏曲、息肉和任何其他可能影响刷子在鼻腔通道中的通过并增加出血风险的解剖异常。
- 通过要求参与者将鼻子吹入纸巾来清洁鼻子中多余的粘液。
- 要求参与者用嘴呼吸。惯用手拿一把细胞学刷。将第五个数字放在参与者的下巴上以固定手的同时,将细胞学刷插入参与者的鼻腔通道(图2)。将刷子以~45°插入参与者的脸部以穿过鼻道。
- 将画笔直立旋转,使其垂直于参与者的脸部。将刷子轻轻但坚定地靠在下鼻甲下方的鼻侧壁上,直到它位于下鼻甲的中后部。
注意:避免过度插入;如果感觉到阻力突然下降,则鼻咽已进入,刷子应缩回,直到程序医生再次感受到阻力。 - 将画笔旋转 360°,最多旋转三次。与插入操作相反,轻轻地取出画笔,这样细胞就不会从画笔上脱落。
- 将刷子放入带有鼻细胞收集培养基的准备好的收集管中。将收集管放在冰上。
- 如果参与者同意/需要大量细胞(例如,开始细胞培养),则在第二个鼻孔重复刷牙。
注意:如果刷子上没有可见的血细胞,可以再次刷同一个鼻孔,但请注意,在同一鼻孔中进行第二次刷牙会略微增加出血的风险。
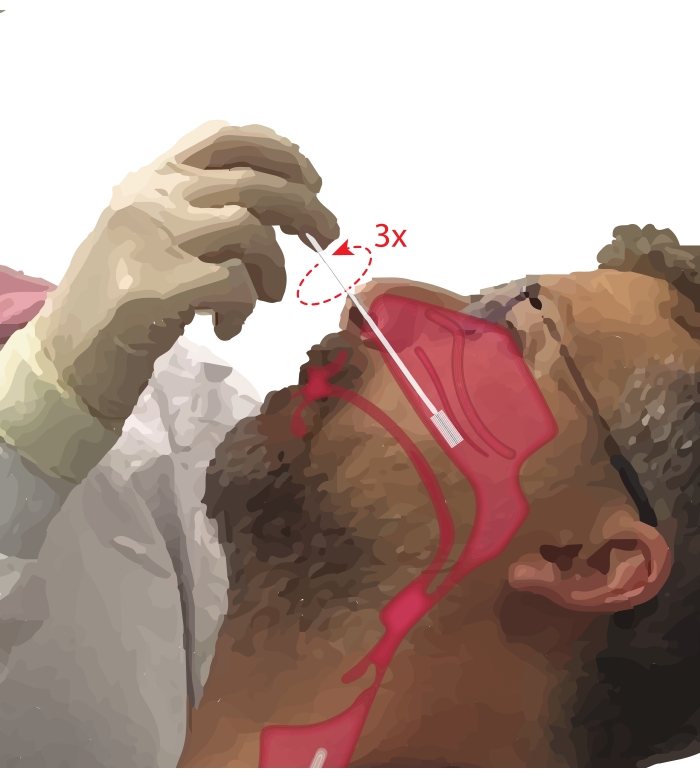
图2:鼻上皮细胞的收集。 细胞学刷在下鼻甲中至后部的位置图示。通过将刷子插入鼻孔,将刷子旋转到与面部成90°角并沿着下鼻甲下方的鼻腔引导刷子来达到该位置。 请点击此处查看此图的大图。
3.气道上皮片的制备
注意:协议的这一部分需要收集管(细胞学刷+ 1 mL鼻细胞收集培养基)(第2部分)和96孔平底板。如果收集鼻甲刷牙以对气道上皮片进行成像,则仅使用 1 mL 不含抗生素的鼻细胞收集培养基;否则,上皮片将过于分散而无法成像。
- 轻轻旋转装有细胞学刷的收集管,以将气道上皮片从刷子上移开。
- 用P1000移液器收集所有培养基和细胞。将5-6滴分配到96孔平底板的孔中。重复大约七个孔。
- 按照步骤7.1.4将板转移到显微镜上,并按照第7节的其余部分成像纤毛搏动频率。
- 成像上皮片(图1)而不是单个未附着细胞,因为已经证明上皮片和单个未附着细胞之间的睫状功能不同5。
4.气道上皮细胞扩增与维持
- 气道上皮条件重编程细胞扩增培养
注意:胶原蛋白溶液包被的容器(第1节),辐照小鼠胚胎饲养细胞(NIH-3T3),条件重编程细胞(CRC)培养基(第1节),鼻细胞收集培养基中的细胞学刷(第2节)。- 在与气道上皮细胞共培养之前,以8,000个细胞/ cm 2的接种密度将辐照的饲养层细胞板到制备的胶原溶液包被的培养容器中至少2 小时且不超过72小时(参见36 饲养层细胞培养和照射)。
- 将收集管中的刷状细胞(细胞学刷+鼻细胞收集培养基)转移到冰上的涡旋中。在低速下,涡旋管打开10秒,关闭10秒(中间保持在冰上)以将细胞从刷子中移开。剧烈涡旋可能会降低细胞活力。检查刷子以检查粘液是否仍然粘附。如果是这样,请重复涡旋。
- 将冰上的试管转移回生物安全柜。使用血清移液管将培养基从收集管转移到新管(管B),留下细胞学刷。在4°C下以300× g 离心管B7分钟。
- 从离心机中取出试管B,弃去上清液。如果粘液可见,用另外5 mL鼻细胞收集培养基洗涤沉淀并再次离心。
- 加入 1 mL CRC 培养基,将细胞沉淀重悬于管 B 中,使用 5 mL 血清移液器,以圆周运动将细胞穿过放置在 50 mL 管(管 C)顶部的细胞筛。
- 重复多次以形成单细胞悬液。从筛子底部收集残留的介质并将其与培养基合并。丢弃细胞筛。
- 使用 5 mL 血清移液器,从管 C 中取出 1 mL 培养基并将其转移到微量离心管中。
- 取 10 μL 该细胞悬液,加入用 10 μL 台盼蓝预先等分的微量离心管中。充分混合,并立即使用自动细胞计数器记录细胞计数和活力。
- 将气道上皮细胞接种到预先接种有辐照饲养层细胞的T25烧瓶中。
- 气道上皮细胞维持和解离
注意:在将CRC培养基添加到细胞中之前,必须将其放入温控实验室水浴或珠浴装置中,将其加热至37°C。- 定期在细胞培养显微镜(4×物镜)下检查细胞的附着、污染、形态和汇合。
- 每隔一天更换一次CRC介质。当观察到重编程的细胞(图1)并且不存在污染时,减少或停用抗生素。
- 当细胞达到90%汇合时,使用双胰蛋白酶方法32 解离细胞并按照步骤4.1.8中所述进行细胞计数(参见 补充文件2 进行细胞解离和冷冻)。
5. 气道上皮细胞的播种和分化以及分化的ALI模型的维持
- 将气道上皮细胞接种到可渗透的支撑插入物上
- 将涂有的胶原蛋白溶液渗透性支撑插件(第1部分)从CO2 培养箱转移到生物安全柜中。吸出胶原蛋白溶液并丢弃。将 750 μL 扩增培养基(不含抗生素)添加到渗透性支撑插入物的基底隔室中。
- 将解离的细胞或冰上的解离细胞转移到生物安全柜中。将接种 200,000-250,000 个细胞所需的膨胀培养基体积添加到每个可渗透支撑插入物的顶端隔室中。
- 注意不要产生气泡;充分混合以确保细胞均匀且悬浮。将 150 μL 细胞悬液添加到每个渗透性支撑插入物的顶端侧。
- 每三个渗透性支持插入物接种后重悬细胞,以保持均匀的细胞悬液。
- 每隔一天直到形成汇合的细胞单层(通常在接种后第4天),丢弃培养基并加入加热至室温(RT,15-25°C)的新鲜膨胀培养基。
- 气液界面处气道上皮细胞的分化
- 将ALI培养基(无抗生素)加热至室温(15-25°C)。
- 取出扩增培养基,并在顶端和基底隔室上更换为分化培养基(ALI)。
- 在浸没的ALI培养基中培养2天后,吸出并丢弃培养基。
- 将 750 μL ALI 培养基添加到基底隔室中,仅以创建气液界面。
注意:如果在培养1周后,单层不融合并且仍然观察到孔洞,细胞可能不再具有扩增到空隙区域的能力,请考虑丢弃气道上皮细胞。
- 维持分化的ALI模型和粘液去除
- 每隔一天更换一次顶端和基底培养基,直到完全分化(气液界面建立后第21-25天)。
- 每周一次,按照步骤5.3.3-5.3.4从顶端洗涤粘液。
- 将 PBS 加热至室温 (15-25 °C)。
- 向顶端隔室中加入 200 μL PBS。在CO2 培养箱中孵育10分钟。使用抽吸装置或移液器取出 PBS。
6. 三维气道上皮类器官
- 气道上皮类器官培养的制备
- 将 24 孔板放入 CO2 培养箱中加热至 37 °C 过夜。
- 按照制造商的说明在冰上解冻 10 mL 小瓶 ECM(材料表)。准备 500 μL 等分试样(一次性使用),以尽量减少冻融循环次数。
注意:建议使用蛋白质浓度为>10.5 mg / mL的ECM以获得最佳培养结果。较低的浓度将加速ECM圆顶的分解,并增加面向顶端的向外类器官的发生。 - 使用气道类器官试剂盒(材料表)按照制造商的说明制备气道类器官播种培养基 (AOSM) 和分化培养基 (AODM)。
- 按照 表2制备气道类器官基础培养基。
| 元件 | 卷 |
| 先进的 DMEM/F-12 | 500毫升 |
| 赫佩斯 | 5毫升 |
| 丙氨酰谷氨酰胺 | 5毫升 |
| 青霉素-链霉素 | 5毫升 |
表2:气道类器官基础培养基的成分
- 使用第4.2节中解离的活气道上皮细胞的数量来计算在10,000个细胞的接种密度下可以接种多少孔(见 表3)。
- 计算每孔创建 1 x 50 μL 90% ECM 圆顶(45 μL ECM 和 5 μL AOSM)所需的 ECM 和 AOSM 总体积。
注意:每孔10,000个细胞的推荐接种密度适用于第1代的CRC扩增的鼻上皮细胞。后来传代的细胞可能需要更高的接种密度才能形成相同数量的类器官。
| 井数 | 单元格数 | 圆顶数量 | 材料 ECM 卷 | AOSM卷 |
| 1 | 10,000 个细胞 | 1 | 45 μL x 1.1 | 5 μL x 1.1 |
| 2 | 20,000 个细胞 | 2 | 90 μL x 1.1 | 10 μL x 1.1 |
| 5 | 50,000 个细胞 | 5 | 225 μL x 1.1 | 25 μL x 1.1 |
| ......... | .........细胞 | ......... | .........μL x 1.1 | .........μL x 1.1 |
表3:在ECM圆顶中接种气道上皮细胞的计算
- 在ECM圆顶中接种气道上皮细胞
注意:始终将 ECM 放在冰上,并在冰上执行涉及 ECM 的所有步骤,因为 ECM 将在 >10°C 的温度下开始凝固。- 重悬在第4.2节中解离的气道上皮细胞,计算体积为90%ECM,如 表3所示。
- 将移液器保持在尽可能靠近孔底部的 90° 角(垂直),将 50 μL(到第一站以避免产生气泡)的 ECM 细胞悬液分配到孔的中心。避免触摸井壁。
- 将板在37°C孵育20分钟,直到ECM凝固。当ECM凝固时,将AOSM加热至室温(15-25°C),以防止其在添加时引起ECM圆顶的重新液化和崩解。
- 通过分配孔壁,向每个孔中加入 500 μL 加热的 AOSM。请勿将培养基直接移液到 ECM 圆顶上。
- 每 2 天更换一次介质,持续 4-7 天。要吸出培养基,请将板倾斜 45° 角,并从孔的底部边缘远离 ECM 圆顶吸出。
- 4-7 天后,通过向每个孔中加入 500 μL AODM (15-25 °C) 来启动类器官分化,并每 2 天更换一次培养基,持续 7 天。
- 分化第 7 天重镀气道上皮类器官
注意:重新铺板气道上皮类器官是必要的,因为ECM圆顶的边缘在2周的培养期内逐渐分解。当未完全嵌入 ECM 中时,圆顶边缘的气道上皮类器官可能会丢失(移位到介质中)或具有顶端朝外的方向。重镀步骤还通过去除不能成功形成类器官的细胞/碎片来"清理"ECM圆顶。- 从每个孔中吸出培养基。向每个孔中加入 500 μL 冷气道类器官基础培养基(以下简称基础培养基)。
- 请使用 P1000 移液器,因为该移液器吸头具有最大的孔口,可降低移液过程中类器官爆裂的可能性。将移液器调整至 350 μL 以避免产生气泡,然后轻轻上下移液以破坏每个孔中的 ECM 圆顶。将所有 ECM/基础培养基收集到 15 mL 离心管中。
- 用 500 μL 冷基础培养基冲洗每个孔。将含有任何剩余ECM和类器官的基础培养基收集到与上述相同的15 mL离心管中。
- 在4°C下以300× g 离心5分钟。 在离心后可见的三层中 - (1)上清液,(2)含有细胞碎片(蓬松)的ECM和(3)含有类器官的沉淀 - 丢弃上清液和ECM层并保留类器官沉淀。
- 将 1 mL 冷基础培养基加入类器官沉淀中,轻轻上下移液以分离任何剩余的 ECM。向试管中加入 6 mL 冷基础培养基并轻轻混合。
- 在4°C下以300× g 离心5分钟。 弃去上清液。
- 如果多余的ECM仍然可见,请重复步骤6.3.5- 6.3.6进行另一次洗涤。
- 用适当体积的 90% ECM(使用 AODM 代替 AOSM)重悬类器官沉淀,每 50 μL 圆顶板 ~30 个类器官。
- 在电镀第一个圆顶后,在细胞培养显微镜(4倍物镜)下检查类器官的密度。如果密度太高,则额外添加90%ECM,以达到~30类器官的所需密度。
- 按照步骤6.2.3- 6.2.4固化ECM,并每隔一天用500μL加热的AODM将细胞再进料14天,直到它们达到成熟(分化21天后),形成管腔被含有基底细胞,纤毛细胞和杯状细胞的向内伪分层上皮包围。
注意:此处描述的气道上皮类器官是终末分化的,不能传代或冷冻保存。
7.成像纤毛搏动频率
注意:协议的这一部分需要带有加热和湿度环境室的活细胞成像显微镜,快速帧速率(>100 Hz)科学相机,20倍长工作距离物镜和成像软件(请参阅 材料表 了解本协议中使用的推荐设备)。
- 显微镜设置
- 确保显微镜加热系统打开并平衡至37°C。 打开显微镜。通过 CO2/空气气体混配器将气体调节至 5% CO2。
- 用纯净水加满 CO2 通过的湿度模块瓶。通过载物台顶部控制器将相对湿度设置为85%,以便加热水并为电池提供加湿空气。平衡腔室30分钟。
- 将显微镜板插入显微镜支架。
- 将气道上皮细胞模型从培养箱转移到加热块或平衡至37°C的热珠上的显微镜中,以将样品保持在生理温度。
- 将含有气道上皮细胞模型的培养板放入显微镜板插入物中。关闭显微镜环境室。
- 让样品在预热的37°C,5%CO2填充的显微镜室中平衡30分钟。
注意:较短的平衡时间可能就足够了。这可以通过执行实验来确定CBF稳定所需的时间来确定(参见 图3)。
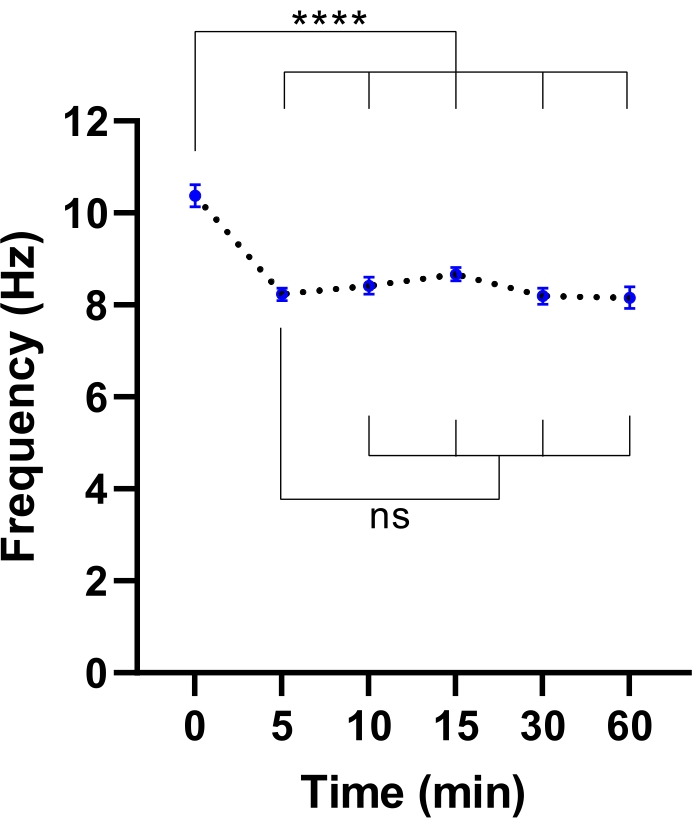
图3:活细胞成像显微镜中睫状搏动频率的稳定。 转移到带有环境室的活细胞成像显微镜后,气液界面处气道上皮细胞(ALI模型)的平均纤毛搏动频率(CBF)的点图。在打开腔室门并将培养板放入显微镜板插入之前,将腔室平衡并保持在37°C,5%CO2 和相对湿度85%下30分钟。以指定的间隔对细胞模型成像60分钟。ALI模型来自两名CF参与者,每个ALI模型采集了六张视场(FOV)图像。每个点(蓝色)代表 12-36 个 FOV 图像中的平均 CBF。数据表示为平均值± SEM,平均值由虚线连接。单因素方差分析(ANOVA)用于确定统计差异。P < 0.0001,ns:无显著性。 请点击此处查看此图的大图。
- 在平衡期间,在计算机上打开采集软件。选择20倍长工作距离物镜。
- 在显微镜目镜上,聚焦于细胞模型(~Z = 8000μm)。
- 确保显微镜设置为科勒照明,使透射光源灯泡灯丝不会聚焦在样品平面上,避免成像中的伪影。为此,请按照以下步骤 7.1.10-7.1.13
- 完全关闭聚光镜上方的视场光圈。慢慢打开视场虹膜,向上/向下移动聚光镜,直到出现八角形。
- 如果视场光圈未对齐(即八边形不在视场 (FOV) 的中心),请使用内六角扳键将其对齐到中心。
- 视场光圈对齐后,调整聚光镜焦点以使八边形清晰聚焦。
- 打开视场虹膜,直到在视场内再也看不到它。
- 使用采集软件,单击 L100 将光路切换到安装摄像机的端口。单击绿色播放(运行)按钮,通过软件可视化显微镜视场。检查纤毛是否清晰,并根据需要进行调整。
- 使用采集软件,使用以下设置设置显微镜:滤光片:空;冷凝器:空;格式:无分箱;曝光时间:0.003秒;读出模式:卷帘快门;ROI:512 × 512 像素。
注意:曝光时间基于需要测量的最高频率,因为1/曝光时间必须至少是该频率的两倍。例如,如果纤毛跳动的最大生理范围= 30 Hz,则1/曝光时间= 60,曝光时间必须≤0.016秒。选择捕获帧速率 >100 Hz 的 ROI。
- 图像采集
- 要从菜单中获取延时图像,请单击 "获取 ",然后单击 "快速延时摄影"。在弹出窗口中,选择保存位置和文件名。获取 1000 帧。
- 点击 应用。单击绿色播放(运行)按钮以预览显微镜FOV中的纤毛,并根据需要调整Z焦点。单击" 立即运行" 以捕获快速延时摄影。
- 捕获快速延时后,单击绿色播放(运行)按钮以可视化显微镜FOV。使用显微镜操纵杆,沿 X/Y 轴移动到另一个 FOV。
- 调整 Z 焦点以使纤毛聚焦。单击" 立即运行" 以捕获另一个快速延时摄影。
- 重复步骤 7.2.3-7.2.4。对于 ALI 模型和气道类器官,在 3 个重复样本中的每一个中成像 6x FOV。对于气道上皮片,每个参与者至少复制 4 倍图像。
8. CBF的数据分析和量化
- 数据分析的准备工作
注意:协议的这一部分需要自定义分析脚本(补充文件 3)、原始图像文件(在第 7.2 节中获取)、计算软件和分析软件。- 在分析计算机上安装计算软件,最好是最新版本。确保安装了标准计算软件工具箱(elmat,ops,datafun,uitools,datatypes,iofun,iotools,audiovideo)以及图像和信号处理工具箱。
- 将自定义分析脚本"BeatingCiliaBatchOMEfiles_JOVE.m"和"LoadRawDataExportFilteredMovies_JOVE.m"以及"支持脚本"文件夹复制到计算机的本地驱动器。
- 在计算软件上,单击"主页"选项卡。然后单击设置路径(图 4A-B)。
- 在弹出窗口中,单击"使用子文件夹添加"(图 4C)。在"MATLAB 搜索路径"下,选择图 4D 中所示的文件夹,然后单击保存并关闭(图 4E-F)。
- 通过检查分析脚本是否出现在左侧面板中,确认它们已链接到计算软件(图 4G)。
- 将第 7.2 节中获取的原始图像文件(开放显微镜环境 (OME) 格式)传输到计算机的本地驱动器。
注意:可以在以下位置访问示例原始图像文件:https://doi.org/10.6084/m9.figshare.16649878.v1。
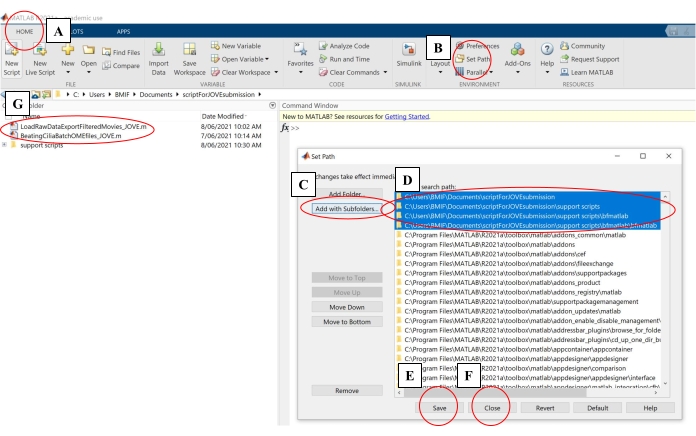
图 4:设置用于数据分析的计算软件。 (a) 打开" 主页 "选项卡。 (b) 选择 "设置路径"。(C) 选择" 使用子文件夹添加"。(D) 选择包含分析脚本的文件夹。(e) 选择 "保存"。(f) 选择 "关闭"。(G) 分析脚本将显示在左侧面板中。 请点击此处查看此图的大图。
- 通过单个像素强度光谱的峰值检测来量化CBF
- 打开计算软件。单击"BeatingCiliaBatchOMEfiles_JOVE.m"分析脚本文件(图 5A)。
- 单击"编辑器"选项卡,然后单击绿色的播放(运行)按钮以运行脚本(图 5B-C)。在提示窗口中,选择要分析的原始图像文件(图5D)。
- 将步骤7.1.15中的曝光时间输入每帧采集时间的提示窗口中,然后单击 确定 (图5E)。
- 每个文件等待 ~15 分钟,脚本在"AveSpectrum"文件(补充文件 4)中计算并输出 CBF,该文件会自动保存到与原始图像文件相同的文件夹中。通过进度条可视化进度(图 5F)。
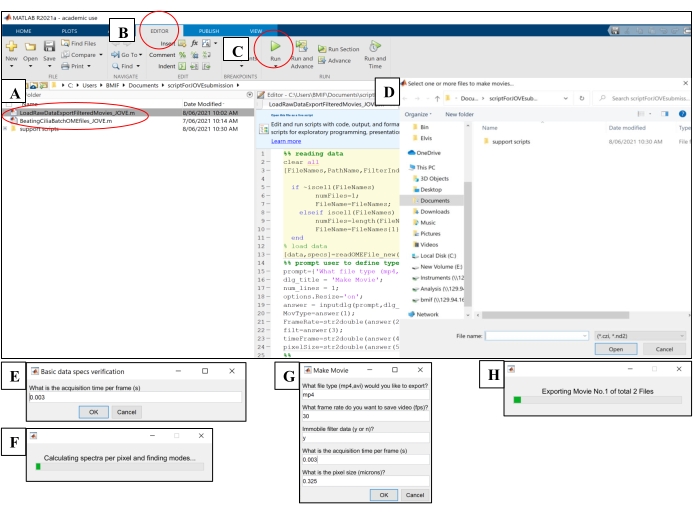
图 5:使用计算软件运行 分析脚本。 (A)打开脚本以分析CBF("BeatingCiliaBatchOMEfiles_JOVE.m")或创建纤毛跳动电影("LoadRawDataExportFilteredMovies_JOVE.m")。(B) 打开 "编辑器 "选项卡。 (C) 选择绿色的"播放"(运行)按钮以运行分析脚本。(D) 提示窗口将要求选择用于分析或视频创建的文件。(E) 运行"BeatingCiliaBatchOMEfiles_JOVE.m"脚本时,如果文件读取脚本未正确读取元数据,将出现手动输入每帧采集时间的提示。(F) 指示正在计算纤毛搏动频率的进度条。(G) 运行"LoadRawDataExportFilteredMovies_JOVE.m"脚本时,将出现一个提示,手动输入要输出的影片类型(mp4 或 avi)、影片帧速率 (fps)、是否从影片数据中删除固定组件("y"或"n")、帧时间 (s) 以及导出到影片中的数据的像素大小(微米)。建议使用"y"进行固定过滤,因为它将去除数据中的粘液或任何其他阻碍固定层。(H) 用于指示正在导出的影片的进度条。 请点击此处查看此图的大图。
- 使用步骤 8.2.1-8.2.2 中的过程在包含"AveSpectrum"文件的文件夹上运行"GetFirstAmplitude.m"脚本。等待脚本输出"FirstAmplitudeStacked.xlsx"文件,该文件包含具有最高振幅的频率,并且在气道上皮纤毛跳动的生理范围内,≥3 和 <30 Hz。
- 从"第一振幅堆叠.xlsx"文件中复制频率值,并使用科学分析软件绘制。
注意: 补充文件 5 中提供了自定义分析脚本如何量化 CBF 的说明。示例分析数据集可在以下位置访问:https://doi.org/10.6084/m9.figshare.16649815。
- 导出纤毛跳动的视频
- 打开计算软件。单击"LoadRawDataExportFilteredMovies_JOVE.m"脚本文件(图 5A)以加载脚本。
- 单击 "编辑器 "选项卡,然后单击绿色的播放(运行)按钮以运行脚本(图 5C)。在提示窗口中,选择要导出到动画文件的原始图像文件(图5D)。
- 将 表4 中详述的设置输入到"制作电影"弹出窗口中(图5G)。
- 每个文件等待 ~8 分钟,脚本将创建影片文件并将其输出到原始图像文件的位置。通过进度条可视化进度(图 5H)。
| 短片输入 | 描述 |
| 文件类型 | 输入您要导出的文件类型(mp4 或 avi)。 |
| 帧速率 | 输入应导出影片的帧速率。如果每个时间序列获取了 ~1000 帧,建议将帧速率设置为 ~30 fps。 |
| 固定过滤 | 选项为"y"或"n"。默认值为"y",时间过滤脚本使用傅里叶空间从电影数据中删除任何不移动的分量。通常,纤毛或不动粘液下的任何细胞层都会在信号中贡献零频偏移分量或时间不变分量,从而可以滤除。 |
| 每帧采集时间 | 每帧采集数据的采集时间。它用于在电影中以秒为单位显示时间戳。 |
| 像素大小 | 以微米为单位的像素大小用于在电影中以微米为单位显示比例尺。 |
表 4:影片创建的输入设置
结果
为了证明该方案在量化CBF方面的效率,介绍了从三名CF参与者和三名健康对照参与者获得的气道上皮细胞ALI模型中CBF测量的结果。在培养分化的第14天,出现跳动纤毛(图6)。从培养分化的第14天到第21天,两个队列中CBF均观察到统计学上的显着增加(P < 0.0345)。在培养分化的第21天,健康对照受试者的平均CBF(7.61±0.11赫兹)明显高于CF受试者(6.75±0.17赫兹)。为了了解粘液...
讨论
有多种因素可能掩盖鼻上皮片中CBF的定量。上皮片应在样本采集后 3-9 小时内成像,因为睫状功能在此期间最稳定37.较少的红细胞和碎片最适合成像,因为它们会干扰数据采集。在选择用于成像的ROI时,重要的是选择在样品收集过程中边缘未损坏或破坏的上皮片,而不是单个未连接的上皮细胞,因为这些变量已被证明会影响CBF5。上皮片也必须是静止的,因为运?...
披露声明
作者声明他们没有什么可透露的。
致谢
我们感谢研究参与者及其家人的贡献。我们感谢悉尼儿童医院(SCH)兰德威克呼吸科在组织和收集患者生物标本方面的帮助 - 特别感谢John Widger博士,Yvonne Belessis博士,Leanne Plush,Amanda Thompson和Rhonda Bell。我们感谢悉尼新南威尔士大学马克·温赖特分析中心Katharina Gaus光学显微镜设施的Iveta Slaptova和Renee Whan的帮助。这项工作得到了澳大利亚国家健康与医学研究委员会(NHMRC)(GNT1188987),澳大利亚CF基金会和悉尼儿童医院基金会的支持。作者要感谢Luminesce联盟 - 儿童健康创新的贡献和支持。Luminesce Alliance - Innovation for Children's Health是悉尼儿童医院网络,儿童医学研究所和儿童癌症研究所之间的非营利性合资企业。它是在新南威尔士州政府的支持下成立的,旨在协调和整合儿科研究。Luminesce Alliance还隶属于悉尼大学和新南威尔士大学悉尼分校。KMA 由澳大利亚政府研究培训计划奖学金支持。兰桂坊由悉尼湾扶轮社/悉尼儿童医院基金会和新南威尔士大学研究生奖学金支持。
材料
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
参考文献
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O'Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O'Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。