Method Article
使用未纯化的重组腺相关病毒载体在培养细胞中进行转基因表达
摘要
重组腺相关病毒(rAAV)广泛用于临床和临床前基因递送。rAAV的一个被低估的用途是培养细胞的稳健转导,无需纯化。对于刚接触rAAV的研究人员,我们提供了转基因盒克隆、粗载体生产和细胞培养转导的方案。
摘要
重组腺相关病毒载体 (rAAV) 无需整合到多种组织类型中即可实现有效且持久的转基因表达,使其成为动物模型和临床环境中基因递送的热门选择。除了治疗应用外,rAAV还是一种有用的实验室工具,用于提供根据研究人员在培养细胞中的实验需求和科学目标量身定制的转基因。一些例子包括外源报告基因、过表达盒、RNA 干扰和基于 CRISPR 的工具,包括用于全基因组筛选的工具。与电穿孔或化学转染相比,rAAV转导对细胞的危害更小,并且不需要任何特殊设备或昂贵的试剂即可生产。含有 rAAV 的粗裂解物或条件培养基可以直接添加到培养的细胞中,而无需进一步纯化以转导多种细胞类型——这是 rAAV 的一个被低估的特征。在这里,我们提供了基本转基因盒克隆的方案,并演示了如何生产粗制rAAV制剂并将其应用于培养的细胞。作为原理证明,我们证明了三种细胞类型的转导,这些细胞类型尚未在rAAV应用中报道:胎盘细胞、成肌细胞和小肠类器官。我们讨论了粗制rAAV制剂的适当用途、rAAV在基因递送中的局限性以及衣壳选择的注意事项。该协议概述了一种简单、低成本和有效的方法,供研究人员使用 rAAV 在细胞培养中实现高效的 DNA 递送,而无需费力的滴定和纯化步骤。
引言
阐明细胞功能的分子基础通常需要在细胞培养物中表达转基因DNA。要表达,转基因必须穿透细胞的选择性膜并到达细胞核 1,2。因此,有效绕过细胞的物理屏障并操纵其中心过程的能力是应用转基因发现新生物现象的必要条件。一种方法利用病毒递送和表达外源DNA的内在能力3,4。
腺相关病毒 (AAV) 是最小的哺乳动物病毒之一:其 4.7 千碱基 (kb) 的单链 DNA 基因组包含两个基因,rep(用于复制酶)和 cap(用于衣壳),包装在 25 nm 的 60 聚体二十面体衣壳内。rep/cap 基因具有多个启动子、阅读框和剪接产物,它们编码病毒复制、生产和包装所需的至少 9 种独特蛋白质 5,6。此外,基因组的两端都包含称为倒置末端重复序列 (ITR) 的二级结构,这些二级结构是转导过程中 DNA 复制、基因组包装和下游加工所必需的 7,8,9,10。ITR 是将基因组包装到衣壳中所需的唯一 DNA 元件,因此可以通过用研究人员选择的调控元件和/或感兴趣的基因替换病毒 rep/cap 基因来克隆 AAV 用于转基因递送目的6。由此产生的重组 AAV (rAAV) 具有工程载体基因组 (VG),在临床上广泛用于人类基因治疗,并取得了成功11.载体在实验室中被低估了;rAAV可以有效地在培养细胞中实现转基因表达,以满足研究人员的实验需求12。
产生rAAV的最常见方法是将三重质粒转染到HEK293或293T细胞中(图1)。第一个质粒,通常称为顺式质粒,包含所需的转基因,两侧是ITR(pAAV)。根据应用的不同,可以购买具有常见元素的顺式质粒,例如强启动子或基于CRISPR的工具。第二种是pRep/Cap质粒,它含有反式提供的野生型AAV rep和cap基因,即在一个单独的、不含ITR的质粒上,该质粒表达调控和结构元件,然后与顺式质粒相互作用,因此被称为反式质粒。除了物理上包围VG外,衣壳还影响细胞趋向性12,13。通过提供血清型特异性帽基因,研究人员可以通过为给定的靶细胞选择优化的衣壳血清型,从而轻松实现转导效率的最大化。最后,作为一种依赖细小病毒,AAV 需要辅助病毒来激活其病毒启动子的 rep/cap 表达,这是由第三个质粒(如 pAdΔF614,15)上提供的腺病毒辅助基因实现的。三重质粒转染72小时后,载体可以通过反复冻融循环从生产细胞释放到培养基中。然后收集整个板内容物,并通过离心除去大的细胞碎片;所得培养基上清液是一种粗制剂,可用于下游转导。
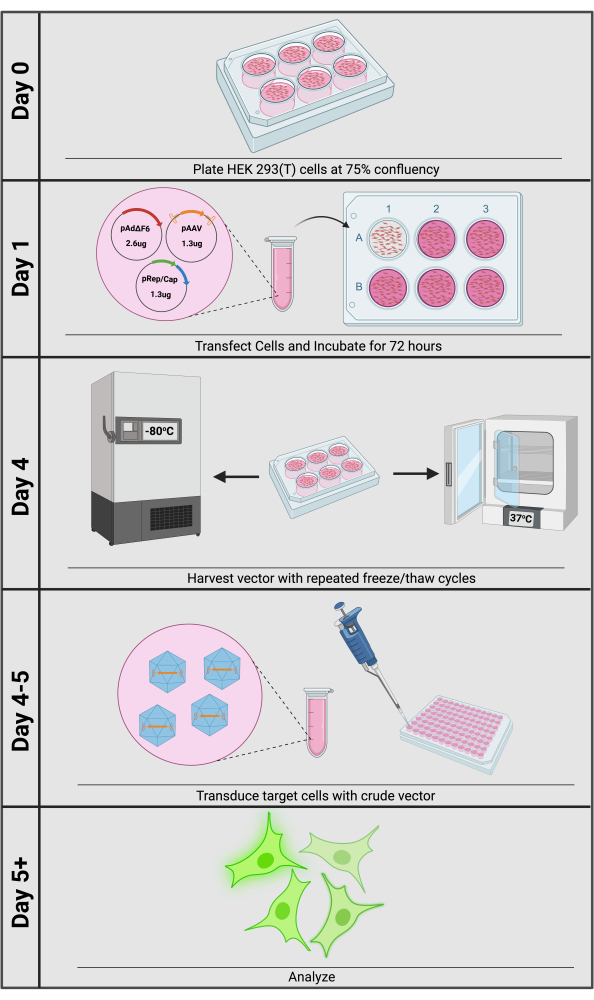
图1:粗rAAV载体生产概述。 粗 rAAV 的产生和转导可在 5 天内完成。 请点击这里查看此图的较大版本.
与其他转染方法相比,rAAV 可能更有利于转基因递送,这些方法通常与细胞毒性、低效率以及昂贵的试剂和设备有关,例如用于电穿孔或化学/脂质转染16,17。rAAV绕过了这些障碍,通常以最小的毒性和最短的手动操作时间提供有效的转基因表达。重要的是,生产rAAV并将其应用于细胞培养非常简单,很少需要从培养基中纯化载体(图1)。此外,与慢病毒转基因递送不同,rAAV 不会将其 VG 整合到宿主基因组中,从而降低插入诱变的风险18。尽管使用rAAV进行转基因递送具有潜在益处,但必须考虑局限性。重要的是,由于衣壳的物理限制,转基因(包括 ITR)的大小不应超过 4.9 kb,从而限制了研究人员有效递送大型调控元件和转基因的能力。此外,由于rAAV是一种非整合病毒,转导会导致分裂细胞中的瞬时转基因表达,并且可能不适用于稳定表达。然而,如果研究人员愿意,可以使用使用双 rAAV 递送的 Cas9 和同源定向修复 (HDR) 模板的方法在特定基因组位点稳定插入序列19.
研究方案
1. 质粒采集
注意:该方案将目的基因(GOI)克隆到具有巨细胞病毒(CMV)启动子和SV40聚腺苷酸化序列(pAAV.CMV.Luc.IRES.EGFP.SV40)的含ITR质粒中。然而,该质粒无需进一步克隆即可用于生产 rAAV,从而包装方便的 EGFP 和荧光素酶双报告基因。具有不同调控元件或不同应用(例如基于CRISPR的实验)的质粒可在线获得,并将遵循与以下类似的克隆步骤(有关其他克隆步骤,请参阅讨论)。此外,可以使用不同血清型的 rep/cap 或 反式 质粒——该方案将使用 AAV 血清型 2 的 rep/cap。
- 购买含有含ITR的 顺式 质粒、腺病毒辅助质粒、rep/cap质粒和含有GOI的质粒的细菌刺。在含有对每个质粒的耐药性具有特异性抗生素的单个琼脂平板上划线细菌。将细菌在30°C下孵育过夜以生长。
注:如果不容易购买具有GOI的质粒,则可以在线购买合成DNA片段(参见 材料表)。此外,如果需要,可以使用合成DNA片段跳过整个PCR过程。 - 从每个平板中挑选一个菌落,并在30°C下在补充有相应抗生素的3mL Luria Bertani(LB)缓冲液中生长过夜,以180rpm振荡。将 1 mL 细菌转移到含有 50 mL 补充有相应抗生素的 LB 缓冲液的无菌 250 mL 锥形瓶中。在30°C,180rpm下振荡过夜。
- 将细菌转移到 50 mL 锥形管中,并在室温下以 3,000 x g离心 20 分钟。弃去上清液。按照制造商的说明,使用低内毒素或无内毒素的midiprep试剂盒分离质粒。
注:ITR是不稳定的结构。为了防止ITR缺失或突变,细菌细胞应在30°C下生长,以减缓细胞分裂并减轻复制错误。为了提高质粒产量和纯度,midiprep或maxiprep试剂盒是理想的选择。建议使用低内毒素或无内毒素试剂盒,以减少细胞的下游内毒素污染。没有必要在层流罩内进行质粒分离,因为如果在标准工作台上进行,质粒制备不太可能受到污染。
2. 将目的基因克隆到含AAV ITR的质粒中
- 在DNA查看软件中打开含有GOI的质粒图谱。
注意:由于衣壳的物理包装限制,包括 ITR 在内的完整盒不应超过 4.9 kb。此外,由于二级结构的原因,PCR扩增无法通过ITR实现。因此,不建议将Gibson组装用于rAAV转基因克隆。- 单击"序列"选项卡以显示质粒的完整 序列 。滚动到 GOI 序列的最 5' 区域,然后单击 第一个核苷酸 ,同时向内拖向基因体以创建正向引物。一旦达到~55°C的熔化温度(Tm)就释放。
- 单击 "转发引物"。在引物序列的最末端 5' 手动包括 EcoRI 限制性位点 (5' GAATTC 3') 的序列。此外,在该限制性位点的 5' 端添加六个额外的随机碱基,以使酶有效地与 DNA 相互作用。单击 添加引物。有关代表性示例,请参阅 图 2 。
- 检查引物,确保它不会形成发夹或引物二聚体(回文的限制性部位除外)。如果形成发夹,则更改六个额外碱基的随机顺序。此外,确保引物不会与质粒上的其他任何地方结合。
- 重复这些步骤,在GOI向内到基因体的3'最区域创建反向引物。单击 Reverse Primer 并包括一个 NotI 限制位点 (5' GCGGCCGC 3')。
注意:GOI 不能包含 EcoRI 或 NotI 限制性位点 - 如果是这样,则需要使用不同的限制性内切酶。
- 在 50 μL PCR 反应中扩增 GOI。使用 表 1 中所需的单个组件。
- 将反应物置于热循环仪中,并按照表2中的循环参数进行编程。如果引物具有不同的 T m,则使用较低的 Tm 作为程序。
- 通过将 1 μL 凝胶上样染料 (6x) 加入 5 μL PCR 反应中来验证正确 PCR 片段的扩增。在含有溴化乙锭的0.8%琼脂糖凝胶上运行DNA分子量标准和PCR混合物,并用紫外光观察。
注意:溴化乙锭是一种已知的诱变剂。 - 如果凝胶上出现单个特定条带,则按照制造商的说明使用基于柱的PCR纯化试剂盒纯化PCR联排管中剩余的PCR产物。如果出现多个条带(由于非特异性扩增),切除所需的条带,并按照制造商的说明使用凝胶提取试剂盒纯化 DNA。
- 在37°C下,用 表3 中所需的单个组分在50μL反应中消化纯化的PCR产物和pAAV.CMV.Luc.IRES.EGFP.SV40骨架质粒1小时。 由于凝胶提取后预期的回收率低下,因此需要更多的 pAAV 质粒 DNA。
注:使用的限制性内切酶是高保真 (HF) 版本。常规 NotI 不能与 CutSmart 缓冲区一起使用。如果使用不同的酶,则可能需要不同的孵育温度和缓冲液。- 按照制造商的说明,使用基于柱的PCR纯化试剂盒纯化消化的PCR产物。
- 通过向 50 μL 消化反应中加入 10 μL 凝胶上样染料 (6x) 来制备用于凝胶电泳的消化 pAAV.CMV.Luc.IRES.EGFP.SV40 骨架质粒。将DNA分子量标准,消化反应和250ng未消化的质粒(阴性对照)加载到含有溴化乙锭的0.8%琼脂糖凝胶上,具有宽齿孔。用紫外光观察,切除所需的片段 (~4.5 kb),并按照制造商的说明使用凝胶提取试剂盒纯化 DNA。
- 在20μL连接反应中将消化的PCR产物和消化的pAAV骨架质粒与 表4中所需的单个组分连接。要计算所需的PCR产物量,请使用公式1。通常,使用摩尔比为 3:1 的 PCR 产物(插入片段)与骨架 (pAAV),骨架质量数为 50 ng。
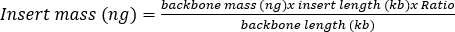 一级方程式赛车
一级方程式赛车 - 通过用水代替PCR产物进行阴性对照。将连接反应在16°C孵育过夜,或在室温下孵育2小时。
- 在冰上解冻一小瓶感受态重组缺陷细菌细胞(如 Stbl3 细胞),并将 50 μL 放入 1.5 mL 试管中。将 3 μL 连接反应直接加入细胞上,并在冰上孵育 30 分钟。
注:ITR是不稳定的结构,因此需要重组缺陷的细菌菌株来限制ITR缺失和重组事件。DH5α 细胞可间歇性地用于增殖(一次或两次),但不建议长期使用。midiprep纯化后应定期检查ITR完整性。- 将细菌在42°C水浴中热休克30秒,然后立即转移到冰上2分钟。加入200μLLB缓冲液,在30°C,180rpm下振荡1小时。
- 将125μL混合物铺在含有相应抗生素的琼脂平板上,并在30°C下孵育过夜(~18小时)。 挑选多个克隆,并将每个克隆放入含有相应抗生素的 3 mL LB 的无菌塑料培养管中。在30°C,180rpm下振荡孵育过夜。
注意:为了防止ITR缺失或突变,细菌细胞应在30°C下生长,以减缓细胞分裂并减少复制错误。此外,应选择较小的菌落,因为那些没有 ITR 的菌落可能比其他菌落具有生长优势。 - 将每种培养物 1.8 mL 移液到 2 mL 管中,并在室温下以 6,000 x g 离心 3 分钟。使用小量制备试剂盒分离DNA。将剩余的1.2mL培养物储存在4°C。 通过 DNA 测序或诊断限制性内切酶消化来验证正确的克隆。
注:建议对插入片段进行Sanger测序,但通过ITR无法通过标准方法实现持续合成能力。ITR 应通过限制性摘要进行验证,如下所述。 - 将含有相应抗生素的 50 mL LB 缓冲液加入无菌 250 mL 锥形瓶中。向烧瓶中加入500μL剩余的培养物,并在30°C,180rpm下摇动,直到OD600 达到0.2-0.5(~18小时)。将细菌转移到50mL锥形管中,并在3,000× g,4°C下离心20分钟。 使用低内毒素或无内毒素的midiprep试剂盒分离DNA。
- 使用 XmaI(或 SmaI)用 20 μL 诊断限制性内切酶消化物检查 ITR 完整性。制备含有 500 ng 质粒、0.5 μL 酶和 1x 缓冲液的反应物;在37°C孵育1小时。 在0.8%琼脂糖凝胶上进行反应。如果 ITR 完好无损,则酶切将得到一个 ~2.9 kb 的条带和另一个盒大小的条带。如果没有观察到这个不同的条带,ITR可能不完整,需要重做克隆。
注意:含有XmaI(或SmaI)限制性位点的质粒(除了ITR中的位点)将在凝胶上出现额外的条带。
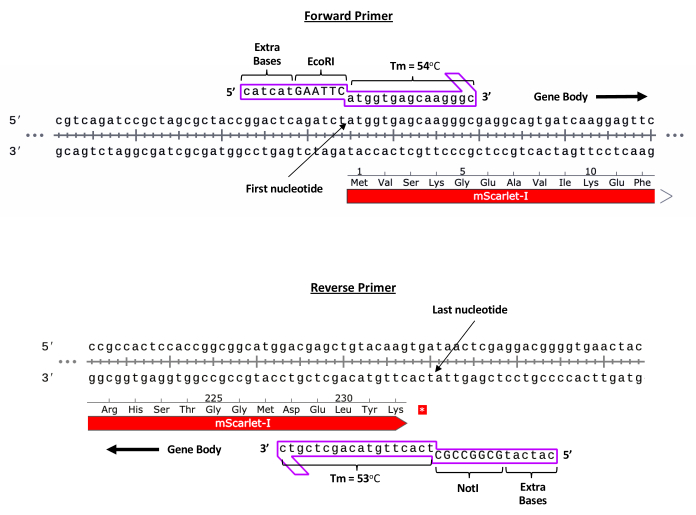
图 2:引物设计的代表性示例。 mScarlet转基因的正向和反向引物设计(代表性示例)。 请点击这里查看此图的较大版本.
| 量 | 元件 |
| X 微升 | DNA 模板 (25 ng) |
| 1微升 | F引物(10μM) |
| 1微升 | R引物(10μM) |
| 1微升 | dNTP(10毫米) |
| 10微升 | Phusion 缓冲液 (5x) |
| 1微升 | Phusion聚合酶 |
| X 微升 | 水 |
| 50微升 | 最终卷 |
表1:PCR扩增试剂。 成功PCR反应所需的组分。
| 步 | 温度 | 时间 |
| 初始变性 | 98 摄氏度 | 1 分钟 |
| 30 周期 | 98 摄氏度 | 10 秒 |
| 底漆的Tm | 30 秒 | |
| 72 摄氏度 | 每 kb 30 秒 | |
| 最终延期 | 72 摄氏度 | 10 分钟 |
| 拿 | 4 摄氏度 | 无限期 |
表2:PCR扩增编程。 成功PCR反应所需的循环参数。
| 量 | 元件 |
| X 微升 | PCR产物(1μg)或pAAV质粒(3μg) |
| 5微升 | 缓冲液 (10x) |
| 1微升 | EcoRI-HF系列 |
| 1微升 | NotI-HF型 |
| X 微升 | 水 |
| 50微升 | 最终卷 |
表3:消解试剂。 成功消化反应所需的组分。
| 量 | 元件 |
| X 微升 | 插入 (X ng) |
| X 微升 | 骨架 (50 ng) |
| 2微升 | T4 DNA 连接酶缓冲液 (10x) |
| 1微升 | T4 DNA连接酶 |
| X 微升 | 水 |
| 20微升 | 最终卷 |
表4:连接试剂。 成功连接反应所需的组分。
3. 使用三质粒转染进行载体生产
注:以下值针对 6 孔板的单孔进行了优化,该孔板的最终粗制剂体积为 2 mL。对于最终体积为 20 mL 的 15 cm 板,所有值都可以放大 10 倍,对于最终体积为 500 μL 的 24 孔板,所有值都可以放大 4 倍。
- 通过将 100 mg PEI MAX 溶解在 100 mL 蒸馏水中,制备 1 μg/μL 聚盐酸亚胺 (PEI) MAX 原液。用NaOH调节pH至7.1。过滤:用0.22μm过滤器对混合物进行灭菌,并在-20°C下冷冻1mL等分试样以长期储存。解冻后,将试剂在4°C下储存1个月。
- 将 3 x 10 5 个 HEK293 或 HEK293T 细胞接种到 6 孔板中,该板含有补充有 10% 胎牛血清 (FBS) 的预热 Dulbecco 改良的 eagle 培养基(DMEM,4.5 g/L 葡萄糖、110 mg/L 丙酮酸钠)。在设置在37°C和5%CO2的培养箱中生长至~75%-90%汇合度(图3)。
注:已观察到用青霉素/链霉素 (P/S) 培养的细胞会降低载体产量。使用适当的无菌技术可绕过使用 P/S 的需要,因此建议不要用抗生素20 培养 HEK293 细胞。如果下游转导需要P/S,建议在收获后将P/S添加到粗制剂中。 - 在 2 mL 管中,制备含有 1.3 μg pAAV2/2(Rep/Cap,血清型 2)、1.3 μg pAAV.GOI、2.6 μg pAdΔF6 和无血清 (SF) DMEM(4.5 g/L 葡萄糖、110 mg/L 丙酮酸钠)的混合物,总体积为 100 μL(方便计算,参见 补充表 1 )。
- 通过用任何不相关的质粒替换pRep / Cap,在单独的试管中制备阴性对照。阴性对照解释了粗制剂中存在的未包装的pAAV.GOI质粒,这些质粒可能在转导过程中转染细胞,尽管很少见。
注:低内毒素或无内毒素的maxiprep或midiprep质粒是三重转染的理想选择,与小量制备DNA相比,通常产生更高的滴度载体,尽管小量制备DNA可用于快速和肮脏的初步测试。 - 向质粒混合物中加入 5.2 μL PEI MAX;这是一种质粒:PEI混合物,比例为1:1。在设置为 10 的涡旋混合器上脉冲 15-7 次,充分混合。如果产生多个载体制剂,则以1分钟的交错时间间隔(即,在t = 0 min时制备PEI,在t = 1 min时制备制备2,以在以下步骤中留出足够的时间吸出孔并稀释反应。
注:已观察到质粒:PEI 的 1:1 比例是最佳的。但是,单个用户可以优化此比率以获得最大效率。有关如何执行PEI优化的讨论(另请参阅 补充表2)。 - 将每个试管孵育 15 分钟,然后用 1.9 mL SF DMEM(4.5 g/L 葡萄糖,110 mg/L 丙酮酸钠)稀释反应物,最终体积为 2 mL。轻轻移液 2 次混合。过混合会破坏质粒/PEI复合物,导致转染效率降低。
- 从孔中吸出培养基,并在孔侧轻轻添加质粒:PEI混合物,以防止细胞脱离。将细胞在37°C和5%CO2下孵育72小时。孵育过程中的细胞裂解和分离是rAAV产生的正常过程(图4)。
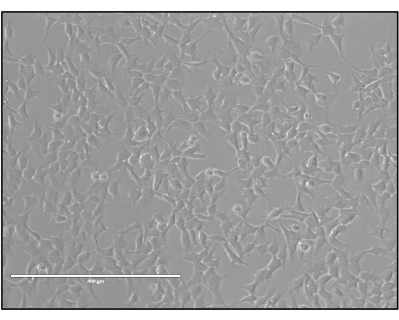
图 3:准备转染的 HEK293 细胞。 三质粒转染所需的HEK293细胞的理想汇合度(75%-90%)。 请点击这里查看此图的较大版本.

图 4:转染后的 HEK293 细胞。 转染 pAAV.CMV.Luc.IRES.EGFP.SV40、pAAV2/2、pAdΔF6 和 1:1 比例的质粒:PEI 后 1、2 或 3 天前后 HEK293 细胞的外观。比例尺:400 μm。 请点击这里查看此图的较大版本.
4. 收获粗制载体制剂
- 将转染细胞的整个板在-80°C下冷冻30分钟,然后在37°C下解冻30分钟。 重复总共三个冻融循环。不要取下盖子——板内部必须保持无菌。板可以保持在-80°C,直到准备进行下一步。
注意:非加湿培养箱最适合解冻,可最大限度地减少板外部可能导致意外污染的冷凝。 - 使用无菌技术在层流罩中执行以下两个步骤。通过移液混合每个孔,以确保最大限度地破坏细胞。将裂解物转移到 2 mL 试管中,并在室温下以 15,000 x g离心 15 分钟以除去细胞碎片。
- 小心地将上清液转移到新的 2 mL 试管中。这种粗制剂可立即使用,无需滴定或纯化。载体可在4°C下储存数月或-20°C储存数年。
注:如果需要,可以通过定量PCR(qPCR)通过量化DNase抗性颗粒内的载体基因组(VG)数量来计算滴度。因此,滴度以 VG/mL 为单位给出。在4°C下储存数月的载体在使用前应重新滴定,因为载体可以聚集和/或结合管壁,降低制剂的滴度。
5. 转导
- 根据转导的持续时间,将所需的细胞类型(例如,Huh7)铺在96孔板中以50%-75%的目标汇合度接种。更大的汇合度可能导致AAV转导效率降低。
- 在不知道粗制剂滴度的情况下向细胞中添加载体(例如,CMV.mScarlet),用于剂量无关的应用,例如测试一组衣壳在新细胞类型中的转导。在无血清 (SF) 培养基中对粗制剂进行 1:3 稀释系列,以获得应用所需的最佳载体量。从 96 孔板中吸出培养基,并向孔中加入 50-100 μL 稀释的粗制剂。在37°C和5%CO2下孵育细胞。
注意:血清可能含有可以中和AAV载体并降低转导效率的抗体。然而,血清可用于敏感细胞类型的转导。 - 转导后 (hpt) 48 小时后除去载体,并用预热的磷酸盐缓冲盐水 (PBS) 洗涤细胞一次。对于敏感细胞类型,也可以在 2 hpt 时去除载体并用含血清的培养基替换。对于许多应用,进行过夜孵育以转导细胞,并在早上用含血清的新鲜培养基替换孔。Huh7 和 U2-OS 等稳健细胞类型无需更换培养基。
- 通过将细胞固定在 4% 多聚甲醛 (PFA) 中 10 分钟来终止转导。根据应用,还可以使用各种终止方法(例如裂解)。对于大多数细胞类型,峰值表达发生在 48 hpt 时,因此是一个常见的实验终点。
6. 不同细胞类型转导方法的变化
注意:不同的细胞类型需要不同的培养条件。因此,应根据细胞类型的需要优化转导载体的添加。以下是代表性结果中包含的细胞类型的非常具体的转导方案,说明了研究人员可能希望根据自己的需要尝试的转导方案的一些变化。
- 小鼠小肠类器官
- 从 C57BL/6J 小鼠的小肠隐窝制备中获得小鼠小肠类器官 (mSIO)。将类器官包埋在90%基底膜基质中,并在含有类器官生长培养基(不含抗生素)或预转导培养基(50%Wnt3a条件培养基[在类器官生长培养基中使用L Wnt-3A细胞内部生产],10mM烟酰胺,10μROCK抑制剂和2.5μM CHIR99021)的24孔板中培养一次(5-7天),然后在37°C和5%CO2下转导。
- 在转导之前,用D-PBS冲洗类器官,通过移液破坏基底膜基质圆顶,并通过在37°C下在解离培养基中孵育10分钟并进一步移液将类器官解离成小细胞簇。
- 通过在含有15mM HEPES的DMEM / F-12中加入5%FBS来终止细胞解离过程,将细胞簇转移到离心管中,并通过在室温下以1000× g离心5分钟来收集细胞簇。
- 将细胞簇重悬于转导培养基(含有 10 μg/mL 聚凝胺的预转导培养基或含有 10 μg/mL 聚凝胺的类器官生长培养基)中并转移到 48 孔板中,然后加入 AAV 粗制剂包装 CMV.mScarlet 用于转导。
- 通过将板在600× g 和37°C下离心1小时,然后在37°C下再孵育6小时来进行类器官的转导。将转导的类器官收集在 1.5 mL 微量离心管中,在室温下以 1000 x g离心 5 分钟,然后置于冰上。
- 除去上清液后,将转导的类器官重悬于预转导培养基或类器官生长培养基中的90%基底膜基质中,并将20μL的种子液滴重悬于预热腔盖玻璃的一个孔中。
- 在培养箱中孵育10分钟后,将液滴嵌入350μL预转导培养基或类器官生长培养基中,并在培养箱中在37°C下孵育。通过在共聚焦显微镜上对转导的类器官进行成像来确定转导后 2-5 天的转导效率,并估计每个类器官的红色荧光细胞百分比。
- BeWo 电池
- 在转导前 24 小时,以 96 孔板每孔 10,000 个细胞铺平人胎盘绒毛膜癌 BeWo 细胞。在无血清 F12-K BeWo 培养基中将粗 AAV 制剂包装 CMV.mScarlet 稀释至 1:1,每孔总体积高达 50 μL。从孔中吸出培养基,并用每孔 50 μL 稀释的 AAV 替换。
- 将细胞在37°C下孵育过夜(~18小时),然后加入100μL含有10%FBS的F12-K BeWo培养基,使总体积增加至150μL。 将细胞再孵育 6 小时,转导后总共 24 小时 (hpt)。
- 对于成像,用 Hoechst 染料在 F12-K 培养基中染色活细胞 30 分钟,然后将培养基换成含有 10% FBS、1x glutamax 补充剂和 1x 丙酮酸钠补充剂的无酚 DMEM 进行成像。使用DAPI(用于Hoechst成像)和mCherry(用于mScarlet成像)滤光片组在37°C和5%CO2的共聚焦显微镜上进行活细胞成像。
- Hepa1-6 和 Huh7 细胞
- 在转导前 24 小时,将小鼠 Hepa1-6 肝细胞和人 Huh7 肝细胞铺在 DMEM(4.5 g/L 葡萄糖、110 mg/L 丙酮酸钠、10% FBS)中,每孔 5,000 个细胞。
- 将50μL未稀释的粗AAV制剂包装CMV.mScarlet直接添加到细胞中,并在37°C下孵育48小时。在PBS中洗涤细胞一次,固定在4%PFA中,并用Hoechst染料染色10分钟。使用DAPI(用于Hoechst成像)和mCherry(用于mScarlet成像)滤光片组在共聚焦显微镜上进行成像。
- C2C12 和 HSkMC 细胞
- 在转导前 72 小时,以 96 孔板每孔 5,000 个细胞铺平未分化的小鼠 C2C12 成肌细胞和未分化的人原代骨骼肌细胞 (HSkMC) 成肌细胞。
- 将粗AAV制剂包装CMV.mScarlet稀释至1:1,用于C2C12成肌细胞的DMEM(4.5g / L葡萄糖,Penn / Strep,20%FBS)或用于HSkMC成肌细胞的骨骼肌生长培养基。通过将培养基更改为分化培养基来区分HSkMC成肌细胞到肌管。
- 将成肌细胞和肌管在稀释的AAV制剂中在37°C孵育24小时。 用Hoechst染料染色活细胞10分钟,并使用DAPI(用于Hoechst成像)和mCherry(用于mScarlet成像)滤光片组在共聚焦显微镜上成像。
结果
寻找用于转导目标培养细胞的最佳衣壳
转导多种细胞类型以确定各种衣壳血清型的趋向性(图5)。天然血清型 AAV214、AAV4 21、AAV5 22、AAV8 23、AAV9 24 和工程衣壳变体 Anc80 25、DJ 26、LK0327 和KP1 28 与在 CMV 启动子下表达 mScarlet 的载体基因组一起包装,使用本协议中提供的方法克隆。将未滴定的粗载体制剂在适当的培养基中稀释,并将细胞转导24 +小时并成像(图5B)。转导效率通过mScarlet+总细胞的比例或单个z平面中mScarlet+的细胞比例来计算(对于小鼠小肠类器官;图5C)。转导效率(mScarlet +细胞)不提供给分化的C2C12和HSkMC肌管,而是提供未分化的C2C12和HSkMC成肌细胞(图5A)。
AAV2 和 KP1 是测试细胞系中最有效的血清型(图 5A)。还观察到,来自不同物种的相似细胞类型以不同的效率转导。例如,当使用AAV2时,与Huh7(人源性肝细胞系)相比,Hepa1-6(鼠源性肝细胞系)的转导明显降低(图5B)。此外,不同的培养基条件在转导过程中起着重要作用。与在类器官生长培养基中培养的小鼠小肠类器官(mSIO)相比,在预转导培养基中培养的小鼠小肠类器官(mSIO)的转导效率较低(图5C)。此外,AAV2 可有效转导未分化的 HSkMC 成肌细胞和分化的 HSkMC 肌管(图 5B),但肌管的定量分析很困难,因此未提供。
图 5 中观察到的各种细胞类型的高转导效率表明,粗载体制备可以有效地用于转导各种细胞类型,而无需进一步的纯化和滴定等步骤。然而,在选择衣壳以最大限度地提高转基因递送时应仔细考虑。许多其他细胞系和衣壳之前已经过测试并发表过,尽管使用纯化的载体制剂12。
与介质条件无关的载体粒子效应会影响转导效率。然而,人们普遍认为,趋向性(即细胞类型特异性摄取和载体表达)是衣壳特异性的特性29。剂量匹配的粗制剂和纯化制剂之间的比较尚未观察到影响细胞趋向性。因此,粗载体制剂可以以与细胞培养中的纯化载体类似的方式使用。
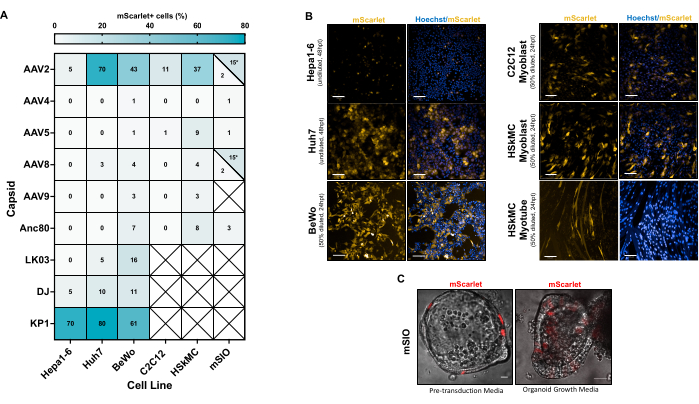
图5:各种细胞类型的粗载体转导 。 (A) 添加含有 mScarlet 转基因的各种 AAV 载体后 mScarlet + 的百分比。(B) 表达从 AAV 血清型 2 递送的 mScarlet 的细胞。比例尺:100 μm(Hepa1-6、Huh7、C2C12 和 HSkMC)、200 μm (BeWo)、20 μm (mSIO)。缩写:hpt = 转导后小时数。(C) 小鼠小肠类器官 (mSIO) 在预转导培养基或类器官生长培养基中处理 rAAV。请点击这里查看此图的较大版本.
补充表1:三重质粒转染工作表。请点击这里下载此文件。
补充表2:PEI优化工作表。请点击这里下载此文件。
讨论
克隆
克隆方案不限于上述使用的pAAV.CMV.Luc.IRES.EGFP.SV40质粒,可以根据研究人员的实验需求轻松改变。许多含ITR的质粒很容易在网上购买。例如,含有Cas9和sgRNA克隆位点的质粒是可用的,但需要一些额外的步骤,如寡核苷酸退火和PNK处理30。此外,还可以发现含有多克隆位点 (MCS) 的质粒,只有 ITR 而没有内部调节元件31。如果要使用不同的质粒,则用于消化的限制性内切酶(RE)通常是该方案中唯一可能需要更改的元素。然而,rAAV的一个局限性是其有限的载货能力。由于衣壳的物理限制,载体基因组不应超过4.9 kb,包括ITR。
从细菌中分离质粒时,使用内毒素低或无内毒素的midiprep或maxiprep试剂盒以减轻三重质粒转染或转导过程中对细胞的伤害至关重要。小量制备试剂盒中的质粒通常含有较高的杂质、较低的浓度和较少的超螺旋DNA,所有这些都会影响rAAV的下游生产,因此不推荐使用。
在克隆过程中了解 ITR 的结构和特性至关重要。首先,通过ITR使用PCR是极其困难的。应避免需要通过ITR进行PCR扩增的克隆设计,并进一步限制Gibson组装克隆技术的使用。因此,限制性内切酶克隆是克隆到含ITR的质粒中的首选方法。此外,如果测序区域包含 ITR,则某些用于 Sanger 测序的引物可能不兼容。相反,建议使用从ITR测序到载体基因组体的引物,以获得更精确的测序结果。其次,ITR在转化为细菌进行质粒扩增时容易发生缺失、重排和突变32,33。为了减轻这些事件,建议使用重组缺陷的感受态细菌菌株,如Stbl3,并在30°C下孵育以减缓细胞分裂。最后,已经观察到较小的菌落可能与没有重排或缺失的克隆相对应,因为没有ITR的克隆可能具有生长优势并且更大。因此,建议选择较小的菌落。
载体生产
rAAV载体的成功生产可能受到多种元素的影响。一个关键因素是用于转染的 HEK293 或 293T 细胞的健康状况。通常,低传代数是理想的,因为高传代细胞可能表现出基因型和表型变异,从而降低 rAAV 滴度。此外,接种细胞的密度应为75%-90%的汇合度,以实现有效生产。稀疏细胞产生的载体产量较低,因为可用于产生载体的细胞较少,而过度生长的细胞将无法有效转染。
试剂批次、细胞储备液之间的差异以及实验室间的一般差异会导致转染效率和生产滴度的差异。可提高滴度的一个可优化因素是转染反应中的质粒:PEI 比率。使用新鲜(<1 个月大)PEI MAX 至关重要。建议使用1:1的质粒:PEI比例作为起点,如果转染或转导效率较差,则测试几种不同的比例。如果使用具有视觉读数的转基因,例如本文使用的CMV.Luc.IRES.EGFP报告基因转基因作为克隆的起始材料,则滴度优化是最简单的。要进行优化,请使用12孔板遵循方案步骤3,并将质粒质量和试剂体积缩小两个(最终质粒质量为2.6μg)。相应地调整PEI体积,使其对应于1:0.75至1:3的比率,增量为0.25(图6)。15 分钟后用 950 μL SF 培养基稀释每个反应。为方便起见,在添加 PEI 之前,可以制备含有三重质粒的预混液并单独移液到 1.5 mL 管中——参见 补充文件 2。收获载体,转导目标细胞并成像。转导效率最高的孔(GFP+细胞比例)对应于PEI:DNA的最高滴度和最优化比例。
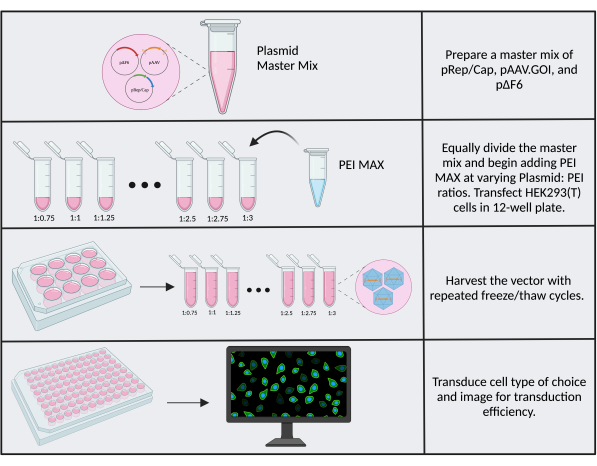
图 6:PEI 优化工作流程。 PEI优化所需步骤示意图。质粒的多种比例:PEI经过测试以确定最佳比例。 请点击这里查看此图的较大版本.
收获和滴度注意事项
用于收获 rAAV 载体的冻融技术可有效裂解 HEK293 细胞,其方式与直接使用澄清裂解物转导培养细胞的方式兼容。某些 rAAV 血清型,如 AAV1、AAV8 和 AAV9,在载体生产过程中从细胞中释放,并且可以从培养的细胞培养基中收获,无需冻融循环34。当使用 AAV2 衣壳时,此处描述的方法通常产生 1 x10 10 VG/mL 的滴度,而使用 AAV8 时的滴度为 1 x 1011 VG/mL。虽然可以通过洗涤剂或其他基于化学的裂解获得更高的滴度,但这些裂解在下游使用中对细胞有害,需要从裂解物中进一步纯化rAAV。较低的滴度是研究人员在确定粗制剂是否适合其研究需求时应考虑的一个权衡因素,但是,此处描述的方法产生的略低滴度可以很好地转导许多细胞类型(参见代表性结果)。除了转染效率和细胞健康外,载体滴度还取决于 rAAV 生产过程中使用的衣壳以及 VG35 中转基因的大小和序列。
当收获粗载体制剂时,可能存在三重质粒转染过程中使用的质粒DNA,尽管很少见,但在转导过程中会导致下游转染。此外,未包装的VG可能与衣壳外部结合,并引发对裸露和外来单链DNA的先天免疫反应36,37。因此,敏感细胞类型可能需要对载体制备物进行 DNase 酶解和纯化,以去除未包装的 VG 和质粒。
如果希望计算粗制剂的滴度,可以进行qPCR来量化DNase抗性颗粒(DRP)内包装VG的数量。简言之,少量粗制剂被DNase酶解,以去除质粒DNA、污染的核酸或部分包装的VG。然后对样品进行qPCR,并定量DRP内部受保护的VG,从而得到每mL粗制剂载体基因组单位的滴度38。不建议使用基于ELISA的定量衣壳滴度的测定法进行载体滴定。与野生型AAV病毒相比,rAAV存在一定比例的空衣壳和部分包装衣壳39。ELISA 将量化所有衣壳,无论其基因组含量如何,并且会高估制剂中存在的可转导单位,这需要包装的 VG。
转导注意事项
许多因素会影响rAAV转导,任何新的实验都应适当考虑。根据驱动转基因表达的启动子,最早可在转导后 4 小时 (hpt) 开始表达,通常在 48 hpt 时达到峰值表达。重要的是要记住从细胞初始接种到实验终点的持续时间。这是为了估计细胞的起始汇合度,并确保它们在实验结束时不会过度生长。如果细胞过度融合,细胞行为可能会因应激反应而改变,并可能混淆实验结果。某些细胞类型,如U2-OS,可以很好地耐受过度生长/接触抑制。此外,它们可以在无血清条件培养基中长时间(48 小时+)耐受,这是该生产方案的产物。然而,敏感细胞类型可能需要用特殊的生长培养基添加或稀释粗制剂的血清,以在转导过程中保持健康。使用含血清培养基导致的转导效率略有降低是细胞健康的潜在权衡,研究人员应考虑这一点。
通常,对于快速分裂的细胞,对于将终止 48 hpt 的应用,大约 50% 的起始汇合度是最佳的。但是,可以根据实验的需要相应地调整汇合度。由于转导效率降低,不建议转导超过 75% 汇合度的单层型永生化细胞系。大多数培养的细胞类型在与粗 rAAV 制剂孵育过夜后成功转导且健康,然后在早上更换为新鲜的含血清培养基。
衣壳血清型是产生 rAAV 转导靶细胞时要考虑的重要因素,因为衣壳是细胞趋向性和随后转基因表达的主要决定因素13。AAV2 是一种广泛使用的血清型,因为它能够有效转导多种类型的培养细胞12。AAV2 的这种特性可归因于硫酸肝素蛋白聚糖 (HSPG) 作为 AAV2 的主要附着因子,以及培养细胞从适应到培养皿中生长过程中高水平的 HSPG40。其他衣壳,如AAV9,在转导广泛的细胞类型方面效果较差,并且可以通过其依赖附着因子来解释,这些因子在此环境中未表达41。因此,如果文献中之前未使用rAAV测试过所需的靶细胞,我们建议将AAV2作为培养细胞的首选衣壳。
请注意,粗制载体制剂的一个主要局限性是它们不适合转导动物模型。 体内 研究需要对制剂进行纯化和质量评估。
转基因表达和潜在整合注意事项
rAAV不能可靠地导致转基因的永久表达。随着时间的流逝,VG 可能会变得沉默,转基因表达可能会在几次传代后被关闭42。此外,大多数 VG 仍是发作性的,并且 rAAV 不包含病毒 Rep 蛋白,这些蛋白会像野生型病毒溶原感染那样介导频繁整合到宿主基因组中或促进 VGs的复制 43。因此,转导细胞中的游离体最终将通过分裂在子细胞中稀释出来。
基础水平整合是所有递送的转基因DNA材料的可能性。然而,含有 ITR 的 VG 容易在更高的频率下进行积分44。因此,可以在一小部分细胞中观察到转基因的永久表达。用户应考虑这种可能性,尤其是在使用 rAAV 递送 DNA 切割酶(如 Cas9)时,因为双链断裂可能导致更高的整合频率和永久表达45。虽然这使得 rAAV 成为为内源性标记或基因添加提供同源定向修复模板的良好候选者,但应考虑 Cas9 插入的可能性19,46。
披露声明
A.C.M. 是 Janssen Pharmaceuticals 的顾问,并在 NewBiologix 的 SAB 任职。所有其他作者均无利益冲突需声明。
致谢
我们感谢Robert Tjian和Xavier Darzacq对实验室设备的支持和使用。我们感谢 Mark Kay 赠送的 KP1 和 LK03 代表/帽质粒,以及 Luk Vandenberghe 赠送的 AAV4 代表/帽质粒。资金由霍华德休斯医学研究所(34430,R.T.)和加州再生医学研究所培训计划EDUC4-12790提供。NW感谢伯克利干细胞中心通过Siebel博士后奖学金和德国研究基金会(DFG)通过Walter Benjamin奖学金提供的资助。
材料
| Name | Company | Catalog Number | Comments |
| Snapgene DNA viewing sofrware | Snapgene | ||
| pAAV.CMV.Luc.IRES.EGFP.SV40 | AddGene | 105533 | |
| pAAV2/2 (Rep/Cap) | AddGene | 104963 | |
| pAdΔF6 | AddGene | 112867 | |
| LB Agar Carbenicillin | Sigma-Aldrich | L0418 | |
| Boekel Scientific Economy Digital Incubator | Boekel Scientific | 133000 | |
| LB medium, powder | MP Biomedicals | 113002042 | |
| Carbencillin (Disodium) | GoldBio | C-103-5 | |
| New Brunswick I26 Shaker | Eppendorf | M1324-0000 | |
| 50 mL Centrifuge Tubes | Corning | 430828 | |
| Centrifuge 5810 R | Eppendorf | 22627040 | |
| QIAGEN Plasmid Plus Midi Kit | Qiagen | 12945 | |
| PCR PULL-APART 8-TUBE STRIPS | USA Scientific | 1402-3900 | |
| Mastercycler nexus | Eppendorf | 6333000022 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| 5x Phusion Buffer | NEB | B0518S | Provided with purchase of Phusion Polymerase |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530S | |
| Gel Loading Dye, Orange (6X) | NEB | B7022S | |
| DNA Clean & Concentrator-100 | Zymo | D4029 | |
| Zymoclean Gel DNA Recovery Kit | Zymo | D4001 | |
| NotI-HF | NEB | R3189S | |
| EcoRI-HF | NEB | R3101S | |
| CutSmart Buffer (10x) | NEB | B6004S | Provided with purchase of restriction enzyme |
| UltraPure Agarose | Thermo Fisher Scientific | 16500100 | |
| Ethidium Bromide | Sigma-Aldrich | E1510 | |
| T4 DNA Ligase | NEB | M0202S | |
| T4 DNA Ligase Reaction Buffer | NEB | B0202S | Provided with purchase of T4 Ligase |
| Eppendorf Safe-Lock Tubes (1.5mL) | Eppendorf | 22363204 | |
| Precision Microprocessor Water Bath | Thermo Scientific | 51221046 | |
| Sterile Plastic Culture Tubes | Fisher Scientific | 149566B | |
| 2.0 mL Microcentrifuge Tube | Thomas Scientific | 1149Y01 | |
| ZR Plasmid Miniprep - Classic | Zymo | D4015 | |
| Xma1 | NEB | R0180S | |
| Sma1 | NEB | R0141S | |
| HEK 293T cells | ATCC | CRL-3216 | |
| Falcon 6-well | Corning | 353046 | |
| Gibco DMEM, high glucose, pyruvate | Thermo-Fisher | 11995065 | |
| Sanyo MCO-18AIC(UV) CO2 Incubator | Marshall Scientific | MCO-18AIC | |
| PEI MAX (Polyethylenimine Hydrochloride) | Polysciences | 24765-100 | |
| Mixer Vortex Genie 2 | Electron Microscopy Sciences | 102091-234 | |
| Sanyo Ultra Low Freezer | Sanyo | 14656-15267-16219 | |
| INCU-Line IL 10 with transparent window | VWR | 390-0384 | |
| Eppendorf Microcentrifuges | Eppendorf | 05-400-005 | |
| Falcon 96-well | Corning | 353072 | |
| C57BL/6J mice | JAX | strain #000664 | |
| organoid growth medium | STEMCELL Technologies | 6005 | |
| L Wnt-3A cells | ATCC | CRL-2647 | |
| nicotinamide | Sigma | N0636-100G | |
| ROCK inhibitor | STEMCELL Technologies | 72302 | |
| CHIR99021 | STEMCELL Technologies | 72052 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane | Fisher | 356231 | |
| 24-well plate | Fisher | 08-772-1 | |
| D-PBS | Thermo Fisher Scientific | 14-190-250 | |
| TrypLE Express | Fisher | 12604013 | |
| DMEM/F-12 with 15 mM HEPES | STEMCELL Technologies | 36254 | |
| polybrene | Millipore Sigma | TR-1003-G | |
| 48-well plates | Fisher | 08-772-3D | |
| Thermo Scientific Nunc Lab-Tek Chambered Coverglass | Fisher | 12-565-470 | |
| BeWo cells | ATCC | CCL-98 | |
| F-12K Medium | ATCC | 30-2004 | |
| Hepa1-6 | ATCC | CRL-1830 | |
| Huh7 | UC Berkeley BSD Cell Culture Facility | HUH-7 | |
| C2C12 | ATCC | CRL-1772 | |
| HSkMC | ATCC | PCS-950-010 | |
| Skeletal Muscle Cell Growth Medium | Sigma | C-23060 | |
| Skeletal Muscle Differentiation Medium | Sigma | C-23061 | |
| Invitrogen EVOS Digital Color Fluorescence Microscope | Fisher Scientific | 12-563-340 | |
| Perkin Elmer Opera Phenix | Perkin Elmer | HH14001000 | |
| PhenoPlate 96-well | Perkin Elmer | 6055302 | |
| DMEM, high glucose, no glutamine, no phenol red | Thermo-Fisher | 31053028 | |
| GlutaMAX Supplement | Thermo-Fisher | 35050079 | |
| Sodium Pyruvate | Thermo-Fisher | 11360070 | |
| pAAV2/5 (Rep/Cap) | Addgene | 104964 | |
| pAAV2/8 (Rep/Cap) | Addgene | 112864 | |
| pAAV-DJ-N589X (Rep/Cap) | Addgene | 130878 | |
| pAAV2/9n (Rep/Cap) | Addgene | 112865 | |
| pAnc80L65AAP | Addgene | 92307 | |
| KP1 (rep/cap) | gifted by Professor Mark Kay (Stanford University) | ||
| LK03 (rep/cap) | gifted by Professor Mark Kay (Stanford University) | ||
| pAAV4 (rep/cap) | gifted by Professor Luk Vandenberghe (Harvard Medical School) | ||
| pAAV.Cas9.sgRNA | Addgene | 61591 | |
| pAAV.MCS | Addgene | 46954 | |
| gBlock (synthetic DNA fragement) | IDT |
参考文献
- Pillay, S., et al. Corrigendum: An essential receptor for adeno-associated virus infection. Nature. 539 (7629), 456(2016).
- Nicolson, S. C., Samulski, R. J. Recombinant adeno-associated virus utilizes host cell nuclear import machinery to enter the nucleus. Journal of Virology. 88 (8), 4132-4144 (2014).
- Lundstrom, K. Viral Vectors in Gene Therapy. Diseases. 6 (2), 42(2018).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clinical Microbiology Reviews. 21 (4), 583-593 (2008).
- Ling, C., et al. The Adeno-Associated Virus Genome Packaging Puzzle. Journal of Molecular and Genetic Medicine. 9 (3), 175(2015).
- Maurer, A. C., Weitzman, M. D. Adeno-Associated Virus Genome Interactions Important for Vector Production and Transduction. Human Gene Therapy. 31 (9-10), 499-511 (2020).
- Srivastava, A. Replication of the adeno-associated virus DNA termini in vitro. Intervirology. 27 (3), 138-147 (1987).
- Wang, X. S., Ponnazhagan, S., Srivastava, A. Rescue and replication of adeno-associated virus type 2 as well as vector DNA sequences from recombinant plasmids containing deletions in the viral inverted terminal repeats: selective encapsidation of viral genomes in progeny virions. Journal of Virology. 70 (3), 1668-1677 (1996).
- Earley, L. F., et al. Adeno-Associated Virus Serotype-Specific Inverted Terminal Repeat Sequence Role in Vector Transgene Expression. Human Gene Therapy. 31 (3-4), 151-162 (2020).
- Yang, J., et al. Concatamerization of adeno-associated virus circular genomes occurs through intermolecular recombination. Journal of Virology. 73 (11), 9468-9477 (1999).
- Au, H. K. E., Isalan, M., Mielcarek, M. Gene Therapy Advances: A Meta-Analysis of AAV Usage in Clinical Settings. Frontiers in Medicine. 8, 809118(2021).
- Ellis, B. L., et al. A survey of ex vivo/in vitro transduction efficiency of mammalian primary cells and cell lines with Nine natural adeno-associated virus (AAV1-9) and one engineered adeno-associated virus serotype. Virology Journal. 10, 74(2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-Associated Defective Virus Particles. Science. 149 (3685), 754-756 (1965).
- Meier, A. F., Fraefel, C., Seyffert, M. The Interplay between Adeno-Associated Virus and its Helper Viruses. Viruses. 12 (6), 662(2020).
- Djurovic, S., Iversen, N., Jeansson, S., Hoover, F., Christensen, G. Comparison of nonviral transfection and adeno-associated viral transduction on cardiomyocytes. Molecular Biotechnology. 28 (1), 21-32 (2004).
- Batista Napotnik, T., Polajzer, T., Miklavcic, D. Cell death due to electroporation - A review. Bioelectrochemistry. 141, 107871(2021).
- McCarty, D. M., Young, S. M. Jr, Samulski, R. J. Integration of adeno-associated virus (AAV) and recombinant AAV vectors. Annual Review of Genetics. 38, 819-845 (2004).
- Yang, Y., et al. A dual AAV system enables the Cas9-mediated correction of a metabolic liver disease in newborn mice. Nature Biotechnology. 34 (3), 334-338 (2016).
- Stacey, G. N. Cell culture contamination. Methods in Molecular Biology. 731, 79-91 (2011).
- Parks, W. P., Melnick, J. L., Rongey, R., Mayor, H. D. Physical assay and growth cycle studies of a defective adeno-satellite virus. Journal of Virology. 1 (1), 171-180 (1967).
- Bantel-Schaal, U., zur Hausen, H. Characterization of the DNA of a defective human parvovirus isolated from a genital site. Virology. 134 (1), 52-63 (1984).
- Gao, G. P., et al. Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy. Proceedings of the National Academy of Science United States of America. 99 (18), 11854-11859 (2002).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. Journal of Virology. 78 (12), 6381-6388 (2004).
- Zinn, E., et al. In Silico Reconstruction of the Viral Evolutionary Lineage Yields a Potent Gene Therapy Vector. Cell Reports. 12 (6), 1056-1068 (2015).
- Grimm, D., et al. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses. Journal of Virology. 82 (12), 5887-5911 (2008).
- Lisowski, L., et al. Selection and evaluation of clinically relevant AAV variants in a xenograft liver model. Nature. 506 (7488), 382-386 (2014).
- Pekrun, K., et al. Using a barcoded AAV capsid library to select for clinically relevant gene therapy vectors. JCI Insight. 4 (22), e131610(2019).
- Colon-Thillet, R., Jerome, K. R., Stone, D. Optimization of AAV vectors to target persistent viral reservoirs. Virology Journal. 18 (1), 85(2021).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Britton, S., Coates, J., Jackson, S. P. A new method for high-resolution imaging of Ku foci to decipher mechanisms of DNA double-strand break repair. The Journal of Cell Biology. 202 (3), 579-595 (2013).
- Bi, X., Liu, L. F. DNA rearrangement mediated by inverted repeats. Proceedings of the National Academy of Science United States of America. 93 (2), 819-823 (1996).
- Samulski, R. J., Berns, K. I., Tan, M., Muzyczka, N. Cloning of adeno-associated virus into pBR322: rescue of intact virus from the recombinant plasmid in human cells. Proceedings of the National Academy of Science United States of America. 79 (6), 2077-2081 (1982).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Molecular Therapy. 7 (1), 122-128 (2003).
- Zhu, J., Huang, X., Yang, Y. The TLR9-MyD88 pathway is critical for adaptive immune responses to adeno-associated virus gene therapy vectors in mice. The Journal of Clinical Investigation. 119 (8), 2388-2398 (2009).
- Wagner, H., Bauer, S. All is not Toll: new pathways in DNA recognition. The Journal of Experimental Medicine. 203 (2), 265-268 (2006).
- Sanmiguel, J., Gao, G., Vandenberghe, L. H. Quantitative and Digital Droplet-Based AAV Genome Titration. Methods in Molecular Biology. 1950, 51-83 (2019).
- Grimm, D., et al. Titration of AAV-2 particles via a novel capsid ELISA: packaging of genomes can limit production of recombinant AAV-2. Gene Therapy. 6 (7), 1322-1330 (1999).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. Journal of Virology. 72 (2), 1438-1445 (1998).
- Bell, C. L., et al. The AAV9 receptor and its modification to improve in vivo lung gene transfer in mice. The Journal of Clinical Investigation. 121 (6), 2427-2435 (2011).
- McCown, T. J., Xiao, X., Li, J., Breese, G. R., Samulski, R. J. Differential and persistent expression patterns of CNS gene transfer by an adeno-associated virus (AAV) vector. Brain Research. 713 (1-2), 99-107 (1996).
- Weitzman, M. D., Kyostio, S. R., Kotin, R. M., Owens, R. A. Adeno-associated virus (AAV) Rep proteins mediate complex formation between AAV DNA and its integration site in human DNA. Proceedings of the National Academy of Science United States of America. 91 (13), 5808-5812 (1994).
- Miller, D. G., Petek, L. M., Russell, D. W. Adeno-associated virus vectors integrate at chromosome breakage sites. Nature Genetics. 36 (7), 767-773 (2004).
- Hanlon, K. S., et al. High levels of AAV vector integration into CRISPR-induced DNA breaks. Nature Communications. 10 (1), 4439(2019).
- Porteus, M. H., Cathomen, T., Weitzman, M. D., Baltimore, D. Efficient gene targeting mediated by adeno-associated virus and DNA double-strand breaks. Molecular and Cellular Biology. 23 (10), 3558-3565 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。