Method Article
通过一种新颖的注射部位修复技术促进小鼠模型中的重复颈内注射
摘要
注射后小鼠模型中的颈内动脉修复使血流返回动脉,而不会对注射材料的分布产生负面影响。注射部位修复有助于通过同一动脉进行后续注射,并防止缺乏完整 Willis 环的小鼠品系发生脑缺血。
摘要
鉴于神经肿瘤学中使用血管内选择性动脉内递送方法递送新型抗肿瘤疗法的最新进展,迫切需要开发小鼠模型中颈动脉内注射的方法,包括注射后修复小鼠颈动脉以允许后续注射的方法。我们开发了一种在小鼠模型中进行颈内注射的方法,通过两种替代程序将治疗药物输送到颈内动脉 (ICA)。
在注射过程中,在颈外动脉 (ECA) 周围缝合后,将针头插入颈总动脉 (CCA),并将注射的治疗药物输送到 ICA 中。注射后,可以结扎颈总动脉 (CCA),这将颈动脉内注射的次数限制为一次。本文中描述的替代程序包括一种修改,其中颈内动脉注射后进行 CCA 注射部位修复,这恢复了 CCA 内的血流并避免了某些小鼠模型中出现的脑缺血并发症。
我们还比较了骨髓来源的人间充质干细胞 (BM-hMSCs) 与颅内肿瘤在注射后有和没有注射部位修复时的递送。BM-hMSCs 的递送在方法之间没有显着差异。我们的结果表明,CCA 的注射部位修复允许通过同一动脉重复注射,并且不会损害注射材料的输送和分布,从而提供了一个具有更大灵活性的模型,更接近于人类颈动脉内注射。
引言
由于血脑屏障 (BBB) 和血肿瘤屏障 (BTB) 的不可渗透性,向脑肿瘤提供治疗药物具有挑战性。通过使用 Ommaya 储液管、用于对流增强输送的低流量微输注或局部注射到切除腔或邻近组织1 ,可以直接瘤内注射治疗药物以规避 BBB。然而,这些方法达到的肿瘤组织总体积是有限的 2,3,4。动脉内注射以前曾用于将治疗剂输送到脑肿瘤,目的是到达更多的肿瘤 5,6,7,8,最近,动脉内输送技术和新型治疗剂的进步已经证明了使用这种方法治疗脑肿瘤的好处7,9.这些进步包括微导管的开发、具有先进成像的血管内选择性动脉内 (ESIA) 输送、使用渗透剂破坏 BBB 和 BTB,以及靶向生物疗法的开发。因此,要对通过动脉内注射给药的新型治疗药物进行临床前测试,需要适当的转化研究模型 9,10。
在脑肿瘤小鼠模型中,经腹膜内或静脉内(通过尾静脉)输送的治疗剂分别穿过肝脏或心脏和肺,然后分布到包括大脑在内的全身。这些首过效应可能会捕获和去除药物,或在到达大脑之前稀释药物,并且可能在大脑中达到治疗剂量之前出现剂量限制性毒性。相比之下,颈内动脉注射通过绕过首过代谢和限制脱靶输送,在循环之前集中输送到大脑。虽然小鼠颈内注射更费力,但该技术的特异性和可重复性导致完成研究的动物数量减少11,12。
一般来说,在先前描述的小鼠颈内动脉注射方法中,注射后结扎颈总动脉,对侧颈动脉和大脑后循环通过 Willis 环提供大脑循环11,12。这种方法具有固有的局限性,即最多只允许向颈内动脉或颈外动脉注射一次。同样重要的是,在结扎颈动脉的实验中使用的小鼠品系具有完整的 Willis 环,以防止由于结扎的动脉而引起的脑缺血13。颈动脉闭塞也被证明可以减少脑血流量并限制注射颗粒的分布14。此外,注射后小鼠颈动脉的闭塞与人类患者的颈内动脉注射不同。
我们小组以前曾使用颈内动脉注射成功地将间充质干细胞输送到大脑 10,15,16,17,18,19。在本文中,我们详细描述了这种颈内动脉注射方法,并包括对我们开发的方法的修改,其中注射部位在不阻塞动脉的情况下得到修复,避免了注射后颈动脉结扎带来的限制。在这种方法中,通过放置两根缝合线(一根在预期注射部位的两端)来准备注射颈总动脉 (CCA),并收紧下缝线(注射部位下方)。颈外动脉 (ECA) 使用另一根缝合线进行密封。将针头插入 CCA,并将治疗药物输送到颈内动脉 (ICA)。在此之后,收紧 CCA 上的上缝线以防止 ICA 回流。在此步骤中,注射的 CCA 可以结扎或修复。如果要结扎 CCA,应收紧缝合线并留在原位。如果注射部位得到修复,修复后拆线,恢复血流。这些替代程序的详细信息如下。
研究方案
以下概述的所有步骤均符合我们的方案,该方案遵循德克萨斯大学 MD 安德森癌症中心机构动物护理和使用委员会制定并经其批准的指南。
1. 准备手术台和小鼠进行外科手术
- 准备用于外科手术的手术台和小鼠(参见图 1A、B)
- 将解剖显微镜和光源布置在带有主动清除系统的异氟醚蒸发器前面,或放置在下吸式工作台上。将电加热垫放在解剖显微镜底座上(如果底座是实心的并且可以传递热量,则最好放在显微镜下)并用无菌手术单覆盖。
注意:所有手术工具和窗帘在使用前都应通过高压灭菌进行消毒,所有一次性用品都应无菌并单独包装。在整个设置和程序过程中应使用无菌手套,并在必要时更换以保持无菌。 - 使用乙烯基实验室胶带在手术单上准备床(4-5 英寸长 x 2 英寸宽)。剪下 1.5 英寸 x 1.5 英寸见方的纱布,将其卷紧,然后将卷起的纱布放在床"头"处的 3 英寸乙烯基胶带下,形成一个枕头(使用枕头时头部倾斜可以更大程度地伸展腹侧颈部区域)。
- 沿床两侧铺设 4 英寸的手术胶带(在乙烯基胶带的顶部)。[如果使用异氟醚,请在床头附近放置一个带有重物(或胶带)的麻醉鼻锥。一旦鼠标被麻醉和约束,就将其调整为特定位置。参见 图 1A、B。
- 使用针头驱动器或重型镊子,从棉签上撕下小块棉花,然后卷成直径从 0.5 到 1 毫米不等的各种尺寸的球(每只小鼠 8-10 个棉花)。将棉花放在靠近床头的手术单上。
- 使用无菌器械,将 6-0 缝合线切成 1 厘米的小块(每只小鼠 3-4 条)。将准备好的缝合线长度放在无菌窗帘上。准备一个 1 mL 注射器,用于施用丁丙诺啡或其他合适的镇痛药(经机构动物护理和使用委员会 [IACUC] 协议批准)。在将工具放入无菌区域之前,根据 IACUC 标准对所有手术工具进行消毒。
- 将解剖显微镜和光源布置在带有主动清除系统的异氟醚蒸发器前面,或放置在下吸式工作台上。将电加热垫放在解剖显微镜底座上(如果底座是实心的并且可以传递热量,则最好放在显微镜下)并用无菌手术单覆盖。
- 为外科手术准备小鼠(参见 图 1C-F)
- 按照 IACUC 批准用于主要生存手术的方法麻醉一只小鼠(根据个体小鼠的敏感性使用 1%-4% 的异氟醚,或 100 mg/mL 氯胺酮、1 mg/mL 甲苯噻嗪的混合物,体重为 100-200 mg/kg(氯胺酮))。如有必要,夹住毛皮或毛皮。在外科手术开始前 30 分钟通过皮下注射施用 0.5-1.0 mg/kg 丁丙诺啡缓释剂(缓释剂)。
- 放置麻醉的鼠标,使枕头放在脖子下方(图 1C)。与麻醉鼻锥一起使用时,枕头有助于伸展和支撑颈部。如果使用氯胺酮/甲苯噻嗪混合物,请在门牙后面的口腔中放置加重的牙棒或类似工具,以倾斜头部并伸展颈部。
- 使用先前放置在手术床两侧的手术胶带约束前肢(图 1D)。调整鼠标在显微镜下的位置,使颈部腹面可见,并调整放大倍率以舒适地观察手术部位(图 1E)。
注意:外科医生应根据每个步骤的舒适程度调整解剖显微镜的放大倍率。 - 使用无菌棉签涂抹人工泪液。每种消毒剂交替使用优碘或洗必泰和酒精的循环拭子 3 次对手术部位进行消毒(图 1F)。
- 通过确保鼠标不会因脚趾挤压而缩回腿来确认麻醉深度。监测呼吸频率并确保小鼠没有喘息,因为这是使用异氟醚时过度麻醉的迹象。如有必要,调整氧气和异氟醚流速以达到适当的麻醉深度和均匀呼吸。
2. 手术过程(图 2、图 3、图 4、图 5、图 6 和图 7)
- 初次切开和解剖
- 首先做一个 1 厘米的纵向中线切口,从颅骨开始到柄(胸骨颅端突出的肿块),然后按照用户批准的 IACUC 指南使用无菌手术刀刀片或类似仪器继续穿过气管(图 2A)。
- 将闭合剪刀的尖端插入切口并轻轻打开,对皮下结缔组织进行钝性解剖,将两个唾液腺分开。用细镊子轻轻地将右侧唾液腺拉过切口,使其放在无菌制备的皮肤表面,或使用钝钩牵开器横向缩回唾液腺(图 2B、C)。如果外化的腺体看起来干燥或发粘,请用无菌盐水润湿。
- 继续钝性解剖结缔组织,直到可以看到胸锁乳突肌和二腹肌(图 2D)。
注意:由气管/胸骨舌骨 (sh) 肌、胸锁乳突肌 (sm) 和二腹肌 (dg) 肌肉(尾腹)形成的肌肉三角形将用于定位方案中的右侧 CCA 和颈动脉分叉。一般来说,也可以看到较小的舌骨 (oh) 肌肉横向横卧在 CCA 上(图 2D);然而,这块肌肉的大小各不相同,在年轻或小型小鼠中完全不存在舌骨肌的情况并不少见。
- CCA 隔离
- 使用倾斜的尖端镊子,继续小心解剖肌肉三角尾端附近的结缔组织(通过打开镊子的尖端),以暴露颈总动脉、颈静脉和迷走神经。
注意:颈总动脉是靠近气管的最大血管,通常可以很容易地在肌肉三角的底部识别(图 2E,箭头)。使用血管周围的细镊子时要格外小心,因为尖端很容易划伤血管,导致出血过多,甚至可能致命。 - 继续仔细解剖颈总动脉部分周围的结缔组织,从肌肉三角基部一直到舌骨肌。使用无菌小棉球控制任何轻微出血,并根据需要从唾液腺吸收分泌的液体。
- 小心解剖掉结缔组织,将 CCA 与迷走神经分开。特别小心,尽量减少对迷走神经的处理和损伤,迷走神经很容易被识别为与 CCA 相邻的粗白色神经束(图 2F)。
- 使用倾斜的尖端镊子,继续小心解剖肌肉三角尾端附近的结缔组织(通过打开镊子的尖端),以暴露颈总动脉、颈静脉和迷走神经。
- CCA 准备
- 一旦 CCA 从胸锁乳突肌完全动员,并且在可见的地方,直到舌骨肌,将 1 厘米的 6-0 缝合线放在小鼠胸骨无菌准备的皮肤上(以便于取出)并将倾斜的尖端镊子穿过 CCA 下方(注意将 CCA 与迷走神经和颈静脉隔离)(图 3A).如果不存在舌骨肌,请充分清理 CCA 周围的区域,以便能够在 CCA、颅骨和尾部缝合到建议的注射部位,并插入针头。
- 用左手的细镊子,将缝合线传到倾斜的尖端镊子上,抓住缝合线末端附近。用倾斜的尖端镊子轻轻拉动 CCA 下方缝合线长度的一半(图 3B)。
- 用平行于第一条缝合线的第二条缝合线重复此过程(图 3C)。
- 将每根缝合线松散地系在 CCA 周围,但不要收紧结或限制血液流动(图 3D)。
- 颈外动脉分离和准备
- 使用倾斜的尖端镊子,小心地去除肌肉三角颅端的结缔组织,从颅骨到舌骨肌,以定位 CCA 和分叉处为 ECA 和 ICA(图 4A)。
注意:ECA 向中线倾斜,略浅,而 ICA 横向倾斜并深入颈部。特别注意防止在分叉上方穿过 ICA 的舌下神经 (HN) 受损。 - 小心地清除分叉附近 ECA 各个侧面的结缔组织。一旦从 ECA 中清除了足够的结缔组织,将一块缝合线放在小鼠胸骨上无菌制备的皮肤上,然后将斜尖镊子穿过 ECA 下方。用左手的细镊子,将缝合线穿过 ICA 和 ECA 之间空间中的倾斜尖端镊子,然后轻轻地将缝合线长度的一半拉过(图 4B)。将缝合线松散地系在 ECA 周围,但不要拧紧结。
注意:从 ECA 中清除足够的结缔组织非常重要,这样您就可以用斜尖镊子抓住缝合线,而不会无意中抓住动脉周围的结缔组织,从而在取回缝合线时对动脉造成损害。
- 使用倾斜的尖端镊子,小心地去除肌肉三角颅端的结缔组织,从颅骨到舌骨肌,以定位 CCA 和分叉处为 ECA 和 ICA(图 4A)。
- 针头和注射器准备
注意:对于此步骤,可以使用直针进行注射,这允许注射器靠在小鼠的身体上并由鼠标身体稳定(图 5A)。或者,可以使用在尖端附近弯曲的针头进行注射,让注射器像铅笔一样握住,手放在手术台上(图 5B)。这两种技术都很好用,技术的选择是个人喜好。- 要准备弯曲的针头,请握住一根 33 G、1/2 英寸的针头,斜面朝上,然后用无菌针头驱动器抓住尖端(图 5C)。将针头直接向斜面弯曲约 30-40°(图 5D)。
- 用适当体积的待注射溶液填充注射器(如果注射溶液没有通过针头吸入以加载注射器,请务必考虑针头的空腔空间)。连接针头并去除所有气泡。确保溶液的弯月面在针头的斜面处可见。
- 颈动脉内注射
- 收紧 ECA 周围的缝合线结。接下来,将 CCA 上的下缝合线尽可能向下滑向胸锁乳突肌并收紧结。确保 CCA 上的上缝合线在注射前保持松动。将无菌棉球放入腔体边缘,以吸收注射过程中分泌的液体和血液。
- 右手握住注射器,左手握住细镊子,将针头带到 CCA 下缝合线正上方的动脉。用细镊子,沿尾部方向轻轻拉动下缝合线的松散端,以在 CCA 上施加低水平的张力(图 6A)。
- 将针头插入刚过斜面的 CCA 中,然后慢慢释放缝合线的张力(图 6B)。
注意:动脉有大量的血流,当针头插入时可能会流入手术腔。但是,一旦针头插入斜面,动脉就会在针头周围形成密封,出血就会停止。针头就位持续出血表明针头没有深入动脉足够远(斜面的间隙允许血液流动)或针头已被推过动脉后部。现在重要的是保持针头非常静止,以防止撕裂动脉或让针头滑出。持续监测有出血事件的动物,如果出血严重(例如当动物失去颜色、出现发绀、摸起来很凉或动物使用方案中描述的任何其他人道终点时),有必要应用人道终点。 - 用左手推动注射器柱塞,非常缓慢地注入溶液(图 5B,注入 100 μL 溶液不少于 15 秒)。注射完溶液后不要取下针头。为防止回流,用左手的细镊子,用结抓住 CCA(仍然松散地系住)上的上缝合线,然后抬起以扭结动脉(图 6C)。
- 取下针头,将注射器放在一边,然后用右手拿起斜头镊子。将扭结保持在动脉中,收紧 CCA 上缝合线中的结(图 6D)。
注意:此时,手术腔不应有额外的出血。在此步骤之后,有两个替代过程,如下面的步骤 2.7 和 2.8 中所述。如果要连接 CCA,请遵循步骤 2.7。如果要在注射部位修复 CCA,请按照步骤 2.8 中列出的修改进行操作。
- CCA 结扎
- 在不需要恢复 CCA 循环的情况下,保持动脉结扎,使 CCA 上的两条缝合线都收紧。修剪缝合末端并确认缝合结已完全拧紧。
- 继续执行步骤 2.9 中描述的关闭和镇痛程序。
- 替代 CCA 注射部位结扎的部位修复和恢复循环
- 使用无菌棉球吸收手术腔内残留的血液。在 CCA 上找到注射部位(图 7A)并确定需要闭合的缝合线数量。彻底冲洗 CCA 孤立区域的注射部位和管腔,以去除凝固的血液。
- 使用斜尖镊子,通过靠近模锻的针体抓住 9-0 缝合针。在使用细镊子从另一侧支撑动脉的同时,通过穿透垂直于动脉的注射部位外侧约 1-1.5 毫米的动脉壁,在 CCA 中放置一根缝合线。用细镊子握住动脉,打开注射部位,然后将针头和缝合线分别穿过左右两侧。或者,握住动脉,用细镊子轻轻地将两侧压在一起,穿过针头,然后一口缝合动脉的两侧。
注意:无论使用哪种技术,都要小心针头和缝合线不要穿透动脉内的后壁,因为这会在收紧时关闭管腔。 - 用外科医生的结关闭注射部位,用细镊子和斜尖镊子进行器械系带,至少使用四次抛掷(图 7B)。通常,使用单个简单的间断缝合来闭合 33 G 针头的注射部位。
- 要使用细镊子恢复血液循环,请解开并取下 ECA 周围的缝合线,然后是 CCA 上的上缝合线(图 7C,D)。接下来,慢慢松开 CCA 上的下缝合线,但不要立即解开。确认注射部位已充分闭合,以防止大出血并恢复血压和流量(图 7D)。
注意:如果注射部位发生大出血,可以迅速重新拧紧 CCA 上的下缝合线,并在必要时调整或重新缝合注射部位。 - 拆下上下 CCA 缝合线(图 7E)。请转至步骤 2.9。
- 闭合和镇痛
- 将唾液腺重新定位在腔中,并使用无菌缝合包用三条简单的间断缝合线闭合切口。取下手术胶带束缚,让鼠标在加热垫上从麻醉中恢复。
注意:应根据用户批准的 IACUC 方案中规定的频率和剂量给予镇痛药的后续剂量。建议两次注射之间的愈合持续时间为一周。如果需要重复注射,可以在第一次注射后修复注射部位,并且可以在后续注射中遵循相同的外科手术。随后的注射可以注射到修复的注射部位的 CCA 颅骨中,因为重复缝合以修复同一注射部位可能会导致疤痕和血栓。
- 将唾液腺重新定位在腔中,并使用无菌缝合包用三条简单的间断缝合线闭合切口。取下手术胶带束缚,让鼠标在加热垫上从麻醉中恢复。
结果
先前的报道表明,通过颈动脉内注射递送的骨髓来源的人间充质干细胞 (BM-hMSCs) 成功地归巢到小鼠的颅内神经胶质瘤中 19.我们采用该模型来比较 CCA 结扎与 CCA 修复在载胶质瘤小鼠颈内注射 BM-hMSCs 后恢复循环的效果。无胸腺裸鼠植入 U87 神经胶质瘤细胞,然后注射 GFP 标记的 BM-hMSCs,随后进行 CCA 结扎或 CCA 修复并恢复循环。3 天后,处死小鼠并收获大脑,固定,进行免疫组织化学检测 GFP,并计数 GFP 阳性细胞(图 8A-D)。
通过来自同一标本的两张不同载玻片 (切片相距 >75 μm) 上肿瘤边界内的 GFP 阳性细胞总数来评估 GFP-BM-hMSCs 与颅内神经胶质瘤的总体归巢。通过未配对 t 检验对平均值的比较表明,在两种程序之间观察到的平均归巢之间没有显着差异 (P = 0.6858)(图 8E)。通过在肿瘤内 10 个高倍视野中计数 GFP 阳性细胞来评估 GFP-BM-hMSCs 在整个肿瘤中的扩散。高倍视野内细胞数量的增加可能表明由于手术变化而导致的细胞在整个肿瘤中的分散变化。使用 Wilcoxon Signed Rank 检验比较中位数表明,CCA 连接组和 CCA 修复组之间高倍视野中 GFP 阳性细胞的中位数没有显着差异(图 8F)。

图 1:手术台和小鼠的手术准备。 (A,B) 手术床(标签 A. 形成床的乙烯基胶带,B. 手术胶带前肢约束装置,C. 枕头,D. 重量,E. 麻醉鼻锥,F. 钝钩牵开器,G. 1 cm 70% 乙醇缝合线,H. 细镊子,I. 斜尖镊子,J. 窄剪刀,K. 无菌棉球)。(C,D)定位鼠标。(东、女)手术部位和手术部位消毒。 请单击此处查看此图的较大版本。
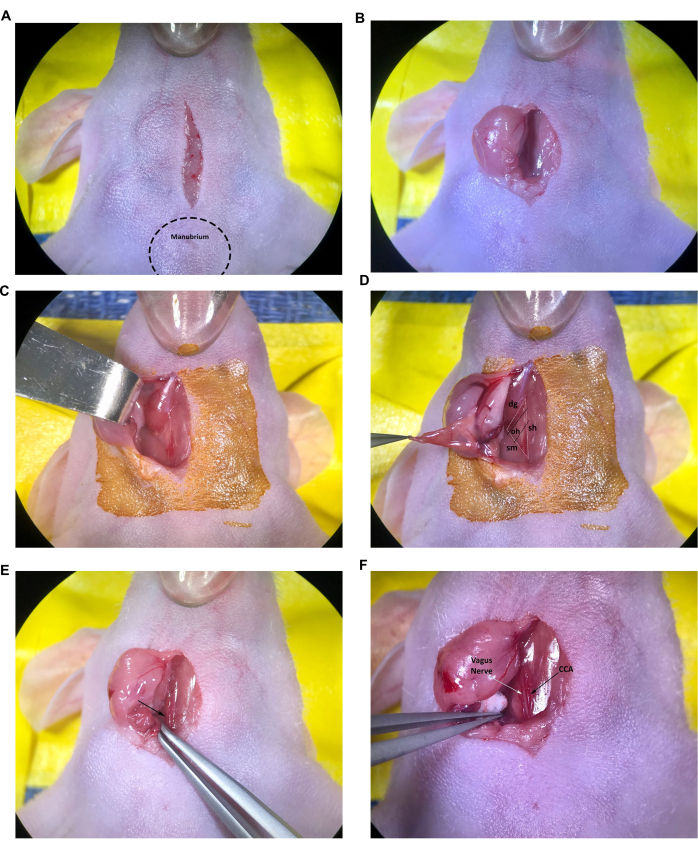
图 2:注射部位结构的切口和暴露。 (A) 中线切口。(B,C)右侧唾液腺回缩。(D) 由气管/胸骨舌骨肌、胸锁乳突肌和二腹肌形成的肌肉三角,舌骨肌也可见。(E) 颈总动脉,箭头所示。(F) 迷走神经和颈总动脉,如箭头所示。缩写: sh = 气管/胸骨舌骨肌;sm = 胸锁乳突肌;dg = 二腹肌;oh = 舌骨肌;CCA = 颈总动脉。 请单击此处查看此图的较大版本。
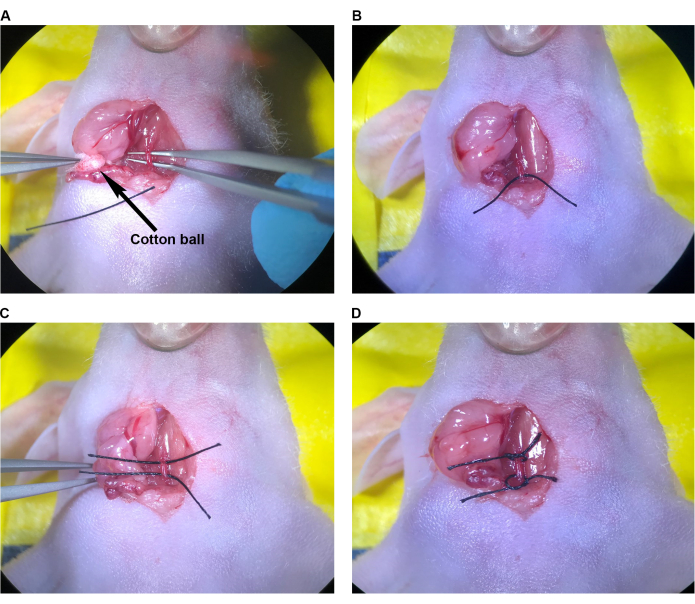
图 3:准备注射 CCA。 (A) 在 CCA 下通过的斜头镊子。(B) 使用斜尖镊子将缝合线拉到 CCA 下方的一半。(C) 第二根缝合线被拉到 CCA 下方的一半。(D) 缝合在 CCA 周围的松散知道。缩写:CCA = 颈总动脉。 请单击此处查看此图的较大版本。
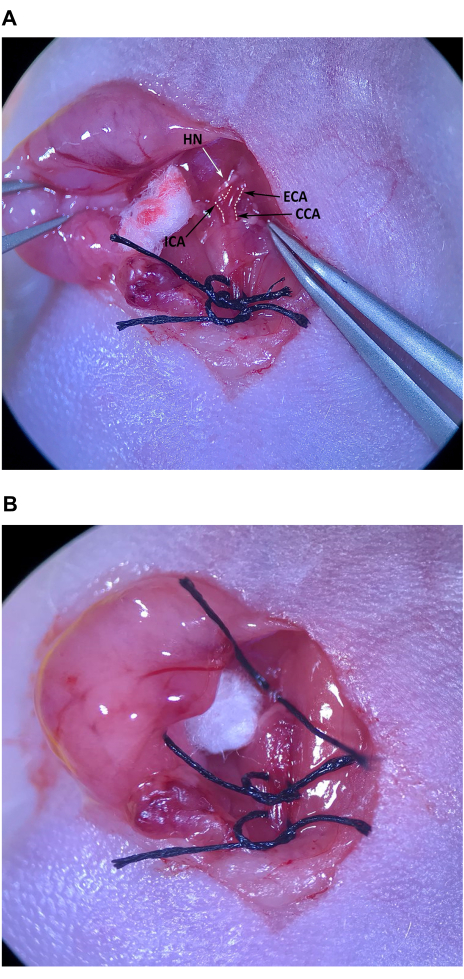
图 4:颈外动脉分离和准备。 (A) CCA、颈外动脉和颈内动脉。(B) 在 ECA 下拉合线的一半。缩写:CCA 颈总动脉;ECA = 颈外动脉;ICA = 颈内动脉。 请单击此处查看此图的较大版本。
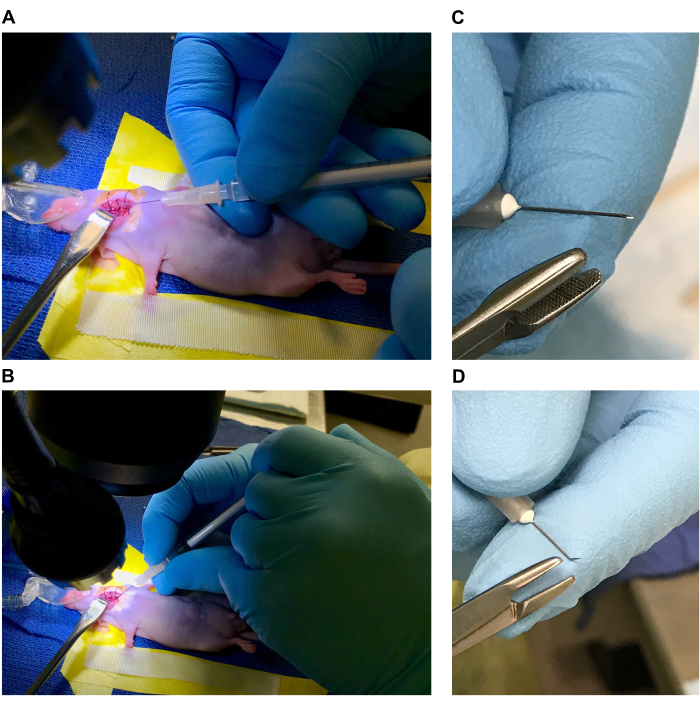
图 5:针头和注射器准备。 (A) 用直针头注射,注射器靠在小鼠身体上。(B) 用弯曲的针头注射,一只手放在手术台上。(C,D)准备一根弯曲的针头。 请单击此处查看此图的较大版本。
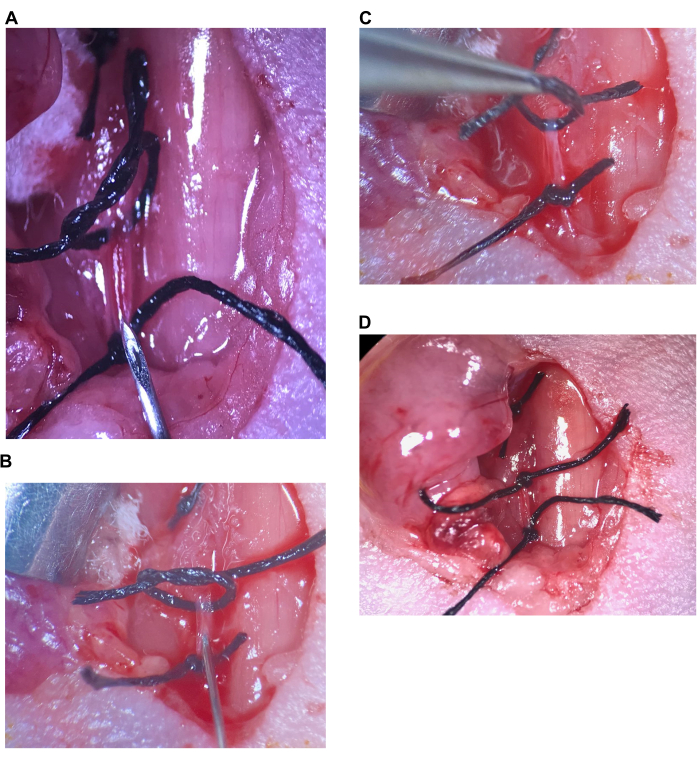
图 6:颈内注射。 (A) 上缝线松动,下缝线在 CCA 上收紧,针头放在下缝合线上方。(B) 针头刚好穿过斜面插入,动脉密封在针头周围。(C) 抬起上缝合线以使动脉向上扭结并防止回流。(D) CCA 上的上缝合线收紧。缩写:CCA = 颈总动脉。 请单击此处查看此图的较大版本。
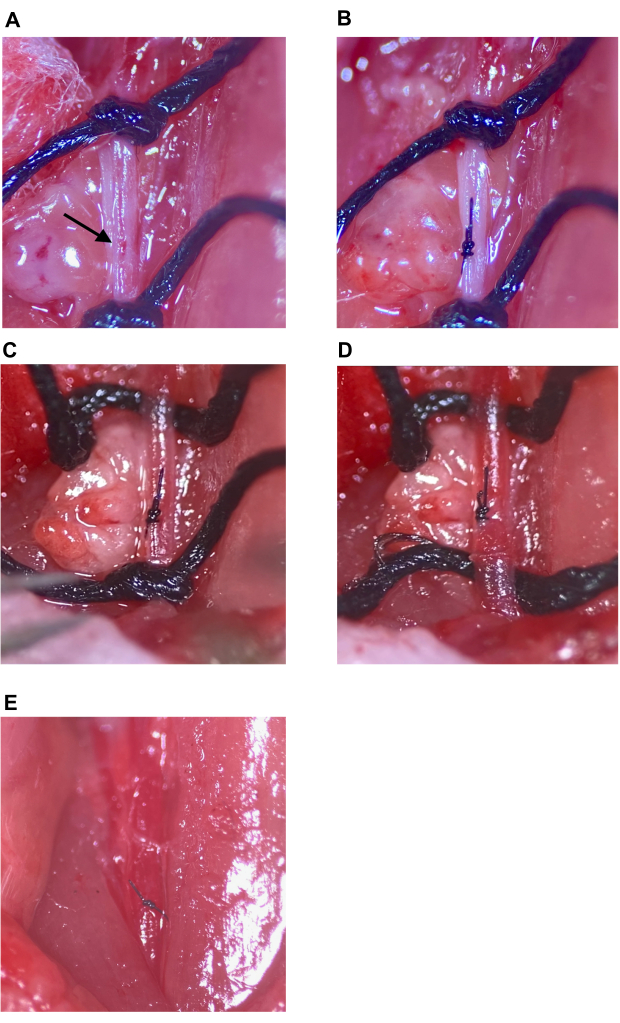
图 7:注射部位修复和恢复循环。 (A) 用箭头表示的注射部位。(B) 注射部位用外科医生的结闭合,至少四次投掷。(C,D)注射部位修复后 CCA 上下缝合线松动;缝合线松动后未见出血。(E) 在确定注射部位得到充分修复后,拆除缝合线。缩写:CCA = 颈总动脉。 请单击此处查看此图的较大版本。
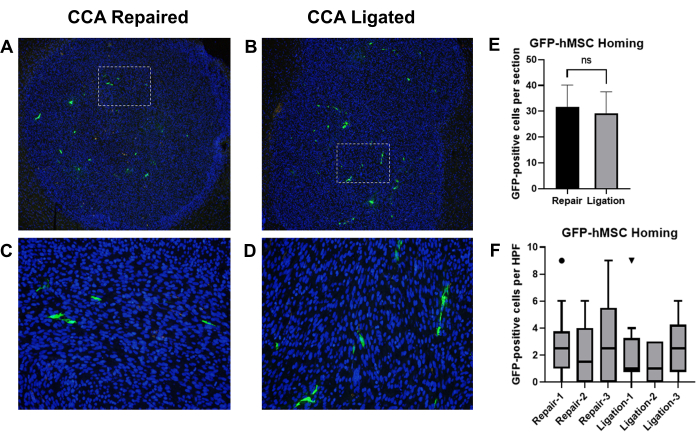
图 8:GFP-BM-hMSC 的颈内注射以及 CCA 结扎或 CCA 修复后循环恢复后归巢与颅内神经胶质瘤肿瘤的比较。 用抗 GFP 一抗和 Alexa Fluor 488 二抗对荷瘤小鼠的脑组织切片进行染色,以标记 GFP-BM-hMSC (绿色)。细胞核用 Hoechst 33342(蓝色)染色。标记切片的代表性低倍视野显示整体归巢到肿瘤,高倍视野显示 (A,C) CCA 修复或 (B,D) CCA 连接后 GFP 阳性细胞分布。(E) 通过两张不同载玻片上肿瘤边界内 GFP 阳性细胞的总数来评估 GFP-BM-hMSCs 与肿瘤的总体归巢,并通过 t 检验比较平均值。在替代程序之间未观察到总体归巢的显着差异 (P = 0.6858)。(F) 通过在肿瘤内的 10 个高倍视野中计数 GFP 阳性细胞来评估 GFP-BM-hMSC 在整个肿瘤中的扩散。通过 Wilcoxon 符号秩检验对中位数的比较表明,无论程序如何,个体之间都没有显着差异 (P = 0.1914、0.5000、0.1641、0.9512、0.8828、0.2207)。缩写:GFP = 绿色荧光蛋白;GFP-BM-hMSCs = GFP 标记的骨髓来源的人间充质干细胞;CCA = 颈总动脉。 请单击此处查看此图的较大版本。
讨论
近年来,颈动脉内注射越来越多地用于为脑肿瘤提供治疗。因此,建立反映人类颈内动脉注射的小鼠模型用于研究目的非常重要。以前,在小鼠中进行颈内动脉注射,随后结扎动脉,这限制了动脉注射次数11,12。此外,小鼠颈动脉闭塞可导致某些没有完整 Willis13 环的小鼠品系出现脑缺血。我们开发了一种修复注射的颈动脉的方法,以克服先前方法的局限性。注射部位的修复导致重新建立流向注射动脉的血流,减少脑缺血的机会,并促进随后注射到同一颈内动脉。
几个步骤对成功至关重要,需要小心处理手术器械或组织,其中包括:将针头正确插入动脉腔,以避免颈动脉内注射时出血;在针头插入前仔细解剖注射部位的结缔组织;注射前去除注射器和针头中的所有团块和气泡;以及正确关闭注射部位以防止在修复过程中动脉腔关闭。为防止针头插入后出血,请确保将针头插入穿过斜面的动脉中,以在针杆周围形成密封。为避免动脉后壁撕裂,请以浅角度插入针头,然后巧妙地向后摇晃注射器和针头,以保持针尖远离动脉后壁。如果注射的溶液在注射过程中泄漏,则表明针头仅插入动脉周围的结缔组织中;注射前仔细解剖注射部位多余的结缔组织可以防止此问题。
关于缝合和闭合技术的选择,如果初始注射使用 33 G 针头并干净地插入动脉,则一次 9-0 缝合的简单缝合就足以修复动脉。如果使用较大的针头进行注射(30 G 等)或在插入针头时发生任何撕裂(例如,当针头偏离中心或由于鼠标呼吸而动脉移动时),这会导致孔稍大,需要修复。两根简单的缝合线或一个 8 字形通常足以修复这种类型的大孔。在这种情况下,这两种技术之间的选择取决于外科医生的偏好。需要注意的是,尚未在注射部位孔明显大于上述情况的情况下评估修复技术。如果注射部位的撕裂向外侧延伸(打一个更宽的洞,大于动脉周长的三分之一),用这种方法修复可能会导致动脉收缩和血栓形成的风险增加。
如果在拆线时修复的注射部位有出血,这可能是由于修复部位在恢复正常循环时被拉伸;这可以通过用无菌棉轻轻覆盖修复的注射部位并轻轻按压 30 秒来纠正。或者,如果修复后的注射部位有出血,没有可见的血流并且动脉近端扩张,则表明缝合针在修复过程中穿过了动脉的后壁。在这种情况下,在修复过程中轻轻打开注射部位边缘,将缝合针以浅角度穿过动脉,并在打结缝合前目视确认缝合线未穿过后壁。
采取这些措施后,注射部位修复方法在动物队列中是精确且可重复的,无论遗传背景或年龄如何。根据我们的经验,由三位不同的外科医生进行手术的成功率为 100%。凭借足够的经验并仔细遵循提供的方案,我们预计其他外科医生执行此手术不会有任何困难。通过练习,熟练的外科医生可以在 15-20 分钟内完成手术。如果实验允许,也可以通过保持上下 CCA 缝合线完好无损,放弃修复注射部位来减少每只动物的时间。然而,如上所述,已经记录了脑血管解剖结构的菌株特异性差异,并且在开始实验之前验证手术中使用的小鼠菌株是否可以耐受这一点非常重要。
由于这是一项外科手术,因此必须考虑小鼠的恢复。抗压性和伤口恢复是重要的考虑因素,会因不同的小鼠品系而异。此外,手术部位的炎症和疤痕组织的形成可能会增加重复手术后的恢复时间。我们已经成功地进行了间隔 7 天的多次注射,但如果需要更频繁的注射,则应在要使用的特定小鼠品系中仔细评估它们。对 CCA 的强行处理和压力(在隔离、打结和拆除缝合线以及注射期间)会损伤和削弱动脉壁,导致在重复注射过程中撕裂。重要的是要尽量减少 CCA 和分叉周围支撑结缔组织的解剖,并避免对动脉施加过大的张力。
我们的结果表明,在这个特定的模型中,注射后恢复循环的 CCA 结扎或 CCA 修复在总体归巢频率或注射的 BM-hMSCs 在颅内肿瘤中的分布没有差异。虽然这在不同的小鼠品系中可能有所不同,但使用注射部位修复提供了将血流返回注射动脉的优势,允许随后注射到同一动脉中,重要的是,类似于人类患者的颈内动脉注射。结扎与修复注射动脉的选择取决于实验类型和所使用的小鼠模型。如果需要第二次注射,或者如果小鼠模型没有完整的 Willis 环,则应使用注射部位修复。在小鼠模型中重新注入 CCA 的能力可以促进额外的实验操作。例如,为了测试随着时间的推移给予的多种潜在治疗药物的剂量,修复注射的动脉对于进行后续注射至关重要。这种方法在涉及注射需要在不同时间注射的治疗剂组合的实验中也很有用。通过修复注射动脉提供的颈内注射灵活性增加,提高了小鼠脑肿瘤模型的转化效用。
披露声明
作者没有相关的披露/利益冲突。
致谢
这项研究得到了美国国家癌症研究所(R01CA115729、R01CA214749 和 1P50 CA127001)的资助以及对德克萨斯大学 MD 安德森癌症中心登月计划™、Broach 脑癌研究基金会、Elias Family 脑肿瘤研究基金、Priscilla Hiley 癌症研究基金、Bauman Family Curefest 脑癌研究基金的慷慨慈善捐款的支持, Chuanwei Lu基金,甜蜜家族脑癌研究基金,Ira Schneider纪念癌症研究基金会,Jim & Pam Harris基金,Gene Pennebaker脑癌研究基金,Sorenson脑瘤研究基金,Brian McCulloch纪念基金,TLC发自内心的基金会和Mary Harris Pappas胶质母细胞瘤研究基金。 全部归 F.F.L.
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
参考文献
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。