Method Article
새로운 주입 부위 복구 기법을 통한 마우스 모델의 반복 경동맥 내 주입 촉진
요약
주입 후 마우스 모델에서 경동맥 내 동맥을 복구하면 주입된 물질의 분포에 부정적인 영향을 미치지 않고 동맥으로의 혈류가 되돌아갑니다. 주사 부위 복구는 동일한 동맥을 통한 후속 주입을 용이하게 하고 완전한 Circle of Willis가 없는 마우스 균주에서 뇌 허혈을 예방합니다.
초록
최근 신경종양학에서 혈관내 선택적 동맥내 전달 방법을 사용한 새로운 항종양 치료제의 전달이 발전함에 따라, 주입 후 마우스의 경동맥을 복구하여 후속 주입을 허용하는 방법을 포함하여 마우스 모델에서 경동맥 내 주입을 위한 방법을 시급히 개발해야 할 필요성이 있습니다. 우리는 두 가지 대체 절차를 통해 내부 경동맥(ICA)에 치료제를 전달하기 위해 마우스 모델에서 경동맥 내 주사 방법을 개발했습니다.
주사 중에는 외부 경동맥(ECA) 주위에 봉합사를 묶은 후 총경동맥(CCA)에 바늘을 삽입하고 주입된 치료제를 ICA로 전달합니다. 주사 후 총경동맥(CCA)을 결찰할 수 있으며, 이는 경동맥 내 주사 횟수를 1회로 제한합니다. 이 기사에서 설명하는 대체 절차에는 경동맥 내 주사 후 CCA의 주사 부위 복구가 이루어지는 수정이 포함되어 있으며, 이는 CCA 내의 혈류를 복원하고 일부 마우스 모델에서 볼 수 있는 뇌 허혈의 합병증을 피합니다.
또한 골수 유래 인간 중간엽 줄기세포(BM-hMSCs)의 투여를 통해 주사 부위 복구를 동반한 경동맥 내 주사를 통해 투여된 경우와 투여 후 주사 부위 재건 없이 투여된 경우의 투여를 비교했다. BM-hMSC의 전달은 방법 간에 크게 다르지 않습니다. 우리의 결과는 CCA의 주사 부위 복구가 동일한 동맥을 통한 반복 주입을 허용하고 주입된 물질의 전달 및 분포를 손상시키지 않으므로 인간의 경동맥 내 주입을 보다 밀접하게 모방하는 더 큰 유연성을 가진 모델을 제공한다는 것을 보여줍니다.
서문
뇌종양에 치료제를 투여하는 것은 혈액뇌장벽(BBB)과 혈액종양장벽(BTB)의 불투과성으로 인해 어렵습니다. BBB를 우회하기 위한 치료제의 직접 종양내 주입은 Ommaya 저장소-카테터, 대류 강화 전달을 위한 저유량 미세주입 또는 절제강 또는 인접 조직으로의 국소 주입을 통해 이루어질 수 있다1. 그러나, 이러한 방법으로 도달하는 종양 조직의 총 부피는제한되어 있습니다 2,3,4. 동맥 내 주사는 종양의 더 많은 부분에 도달하는 것을 목표로 뇌종양에 치료제를 전달하기 위해 이전에 사용되어 왔으며, 최근에는 동맥 내 전달 기술과 새로운 치료제의 발전으로 뇌종양 치료에서 이 접근법을 사용하는 이점이 입증되었습니다7, 9. 이러한 발전에는 미세 카테터의 개발, 고급 이미징을 통한 혈관 내 선택적 동맥 내(ESIA) 전달, BBB 및 BTB를 파괴하기 위한 삼투압제의 사용, 표적 생물학적 치료법의 개발이 포함됩니다. 따라서 동맥 내 주사를 통해 투여되는 새로운 치료제의 전임상 시험을 수행하기 위해서는 적절한 중개 연구 모델이 필요합니다 9,10.
뇌종양의 마우스 모델에서, 복강내 또는 정맥 투여(꼬리 정맥을 통해)로 전달되는 치료제는 각각 간 또는 심장 및 폐를 통과한 후 뇌를 포함한 전신에 분포됩니다. 이러한 1차 통과 효과는 제제를 포획 및 제거하거나, 뇌에 도달하기 전에 제제를 희석시킬 수 있으며, 뇌에서 치료 용량을 달성하기 전에 용량 제한 독성을 나타낼 수 있습니다. 대조적으로, 경동맥 내 주사는 1차 통과 대사를 우회하고 off-target 전달을 제한하여 순환 전에 뇌에 집중 전달을 가능하게 합니다. 마우스의 경동맥 내 주사는 더 노동 집약적이지만, 기술의 특이성과 재현성으로 인해 동물 수가 감소하여 조사를 완료할 수 있습니다11,12.
일반적으로, 앞서 기술된 마우스에서의 경동맥내 주입 방법에서, 주사 후 총경동맥을 결찰하고, 뇌로의 순환은 Willis11,12의 원을 통해 반대측 경동맥 및 후뇌 순환에 의해 제공된다. 이 방법은 내부 또는 외부 경동맥에 최대 한 번만 주입할 수 있다는 고유한 한계가 있습니다. 또한 경동맥이 결찰된 실험에 사용되는 마우스 균주가 결찰된 동맥으로 인한 뇌 허혈을 예방하기 위해 완전한 Circle of Willis를 갖는 것이 중요하다13. 경동맥의 폐색은 또한 뇌혈류를 감소시키고 주입된 입자의 분포를 제한하는 것으로 입증되었다14. 또한, 주입 후 마우스에서 경동맥의 폐색은 인간 환자에서 경동맥 내 주입을 모방하지 않습니다.
우리 그룹은 이전에 경동맥 내 주사를 사용하여 중간엽 줄기 세포를 뇌에 성공적으로 전달했습니다 10,15,16,17,18,19. 이 기사에서는 이러한 경동맥 내 주입 방법에 대해 자세히 설명하고 주사 부위가 동맥을 막지 않고 수리되어 주사 후 경동맥 결찰로 인한 제한을 피하는 우리가 개발한 방법의 수정을 포함합니다. 이 방법에서는 총경동맥(CCA)을 의도한 주사 부위의 양쪽 끝에 하나씩 두 개의 봉합사를 배치하여 주입을 준비하고 아래쪽 봉합사(주사 부위 아래)를 조입니다. 외부 경동맥(ECA)은 다른 봉합사를 사용하여 봉합됩니다. 바늘을 CCA에 삽입하고 치료제를 내부 경동맥(ICA)으로 전달합니다. 그런 다음 CCA의 상부 봉합사를 조여 ICA의 역류를 방지합니다. 이 단계에서, 주입된 CCA는 결찰되거나 수리될 수 있다. CCA를 결찰해야 하는 경우 봉합사를 조이고 제자리에 둡니다. 주사 부위를 수선하면 수합 후 봉합사를 제거하고 혈류가 회복됩니다. 이러한 대체 절차에 대한 자세한 내용은 아래에 나와 있습니다.
프로토콜
아래에 설명된 모든 단계는 텍사스 대학교 MD 앤더슨 암 센터의 기관 동물 관리 및 사용 위원회에서 수립하고 승인한 지침을 따르는 당사의 프로토콜을 준수합니다.
1. 수술을 위한 수술대와 마우스 준비
- 수술을 위한 수술 테이블과 마우스 준비(그림 1A, B 참조)
- 활성 청소 시스템이 있는 이소플루란 기화기 앞에 해부 현미경과 광원을 배치하거나 다운드래프트 테이블에 놓습니다. 전기 가열 패드를 해부 현미경 베이스에 놓고(또는 베이스가 단단하고 열을 전달할 수 있는 경우 현미경 아래에 바람직하게) 멸균 수술용 드레이프로 덮습니다.
알림: 모든 수술 도구와 드레이프는 사용하기 전에 고압멸균으로 멸균해야 하며 모든 일회용품은 멸균하고 개별 포장해야 합니다. 멸균 장갑은 설정 및 절차 전반에 걸쳐 사용해야 하며 멸균 상태를 유지하기 위해 필요한 경우 교체해야 합니다. - 비닐 랩 테이프를 사용하여 수술용 드레이프에 침대(길이 4-5인치 x 너비 2인치)를 준비합니다. 1.5 인치 x 1.5 인치 정사각형의 거즈를 자르고 단단히 굴린 다음 롤링 거즈를 침대의 "머리"에서 3 인치 비닐 테이프 조각 아래에 놓아 베개를 만듭니다 (베개를 사용하여 머리를 기울이면 복부 목 영역이 더 많이 확장 될 수 있음).
- 침대 측면을 따라 4인치 크기의 수술용 테이프를 깔습니다(비닐 테이프 위). [이소플루란을 사용하는 경우, 추(또는 테이프)가 부착된 마취 노즈콘을 침대 머리 근처에 놓습니다. 마우스가 마취되고 구속되면 특정 위치에 맞게 조정하십시오.] 그림 1A,B를 참조하십시오.
- 바늘 드라이버나 무거운 집게를 사용하여 면봉에서 작은 면 조각을 떼어내고 직경 0.5-1mm(마우스당 8-10개의 면봉)의 다양한 크기의 공으로 굴립니다. 침대 머리 근처의 수술용 드레이프에 면화를 보관하십시오.
- 멸균 기구를 사용하여 6-0 봉합사 실을 1cm 조각(마우스당 3-4개)으로 자릅니다. 준비된 봉합사 길이를 멸균 드레이프에 놓습니다. 부프레노르핀 투여 또는 기타 적절한 진통제를 투여하기 위해 1mL 주사기를 준비합니다(IACUC[Institutional Animal Care and Use Committee] 프로토콜에서 승인). 도구를 멸균 필드에 배치하기 전에 IACUC 표준에 따라 모든 수술 도구를 멸균하십시오.
- 활성 청소 시스템이 있는 이소플루란 기화기 앞에 해부 현미경과 광원을 배치하거나 다운드래프트 테이블에 놓습니다. 전기 가열 패드를 해부 현미경 베이스에 놓고(또는 베이스가 단단하고 열을 전달할 수 있는 경우 현미경 아래에 바람직하게) 멸균 수술용 드레이프로 덮습니다.
- 수술을 위한 마우스 준비(그림 1C-F 참조)
- 주요 생존 수술을 위해 IACUC에서 승인한 방법에 따라 한 마리의 마우스를 마취합니다(개별 마우스의 민감도에 따라 이소플루란 1%-4% 사용 또는 체중 100-200mg/kg(케타민)에서 10mg/mL 케타민, 1mg/mL 자일라진 칵테일 사용). 필요한 경우 모피를 자르거나 제모하십시오. 수술 시작 30분 전에 0.5-1.0mg/kg 부프레노르핀 ER(서방형)을 피하 주사로 투여합니다.
- 베개가 목 아래에 놓이도록 마취된 쥐를 배치합니다(그림 1C). 베개는 마취 노즈 콘과 함께 사용할 때 목을 펴고 지지하는 데 도움이 됩니다. 케타민/자일라진 칵테일을 사용하는 경우 무게가 있는 치아 바 또는 이와 유사한 도구를 앞니 뒤의 입에 넣어 머리를 기울이고 목을 펴십시오.
- 수술 침대의 측면을 따라 이전에 배치된 수술용 테이프를 사용하여 앞다리를 고정합니다(그림 1D). 목의 복부 표면이 보이도록 현미경 아래에서 마우스의 위치를 조정하고 수술 부위를 편안하게 관찰할 수 있도록 배율을 조정합니다(그림 1E).
알림: 해부 현미경의 배율은 외과의가 각 단계에 대한 편안함 수준에 맞게 조정해야 합니다. - 멸균 면봉을 사용하여 인공 눈물을 바릅니다. 소독제당 베타딘 또는 클로르헥시딘과 알코올을 번갈아 가며 원형 면봉으로 수술 부위를 소독합니다(그림 1F).
- 마우스가 발가락 꼬집음에 반응하여 다리를 수축하지 않도록 하여 마취 깊이를 확인합니다. 호흡수를 모니터링하고 마우스가 숨을 헐떡이지 않는지 확인하십시오., 이는 이소플루란을 사용할 때 과도한 마취의 표시입니다. 필요한 경우 산소와 이소플루란 유속을 조정하여 적절한 마취 깊이와 균일한 호흡에 도달합니다.
2. 수술 절차(그림 2, 그림 3, 그림 4, 그림 5, 그림 6 및 그림 7)
- 1차 절개 및 절개
- 사용자가 승인한 IACUC 지침에 따라 멸균 메스 블레이드 또는 유사한 기구를 사용하여 기관을 통해 두개골(흉골 끝에서 돌출된 덩어리)까지 두개골까지 1cm의 세로로 정중선을 절개하는 것으로 시작합니다.
- 닫힌 가위의 끝을 절개 부위에 삽입하고 부드럽게 열어 피하 결합 조직을 둔하게 절개하고 두 개의 타액선을 분리합니다. 미세한 집게를 사용하여 절개 부위를 통해 오른쪽 타액선을 부드럽게 당겨 무균 처리된 피부 표면에 놓거나 뭉툭한 후크 견인기를 사용하여 타액선을 측면으로 수축시킵니다(그림 2B, C). 외부 분비샘이 건조하거나 끈적끈적해 보이면 멸균 식염수로 적십니다.
- 흉쇄유돌근과 이위근이 보일 때까지 결합 조직을 둔하게 절개합니다(그림 2D).
참고: 기관/흉골 설골(sh) 근육, 흉쇄유돌기(sm) 근육 및 이위(dg) 근육(꼬리 배)에 의해 형성된 근육 삼각형은 프로토콜에서 오른쪽 CCA와 경동맥 분기를 찾는 데 사용됩니다. 일반적으로 더 작은 오모히오이드(oh) 근육도 CCA를 가로질러 가로로 누워 있는 것을 볼 수 있습니다(그림 2D). 그러나 이 근육은 크기가 다양하며 젊거나 작은 쥐에서 오모히오이드 근육이 완전히 없는 것은 드문 일이 아닙니다.
- CCA 절연
- 각진 팁 겸자를 사용하여 근육 삼각형의 꼬리 끝 부분 근처에서 결합 조직을 조심스럽게 절개(겸자 끝을 열어)하여 총경동맥, 경정맥 및 미주 신경을 노출시킵니다.
참고: 총경동맥은 기관에 인접한 가장 큰 혈관이며 일반적으로 근육 삼각형의 기저부에서 쉽게 식별할 수 있습니다(그림 2E, 화살표). 혈관 주변의 미세한 집게는 팁이 혈관을 쉽게 흠집 내어 과도하고 잠재적으로 치명적인 출혈을 유발할 수 있으므로 매우 주의하십시오. - 근육 삼각형의 기저부에서 근육 설근까지 총경동맥 부분 주변의 결합 조직을 계속 조심스럽게 절개합니다. 작고 멸균된 면봉을 사용하여 경미한 출혈을 조절하고 필요에 따라 침샘에서 분비되는 액체를 흡수합니다.
- CCA를 미주 신경에서 분리하기 위해 결합 조직을 조심스럽게 절개합니다. CCA에 인접한 두껍고 하얀 신경 다발로 쉽게 식별되는 미주 신경의 취급 및 손상을 최소화하기 위해 특별한 주의를 기울이십시오(그림 2F).
- 각진 팁 겸자를 사용하여 근육 삼각형의 꼬리 끝 부분 근처에서 결합 조직을 조심스럽게 절개(겸자 끝을 열어)하여 총경동맥, 경정맥 및 미주 신경을 노출시킵니다.
- CCA 준비
- CCA가 흉쇄유돌근에서 완전히 동원되고 보이는 경우 오모히오이드 근육까지 무균 상태로 준비된 마우스 흉골의 피부에 1cm 크기의 6-0 봉합사 조각을 놓고(쉽게 회수할 수 있도록) 각진 끝 겸자를 CCA 아래로 통과시킵니다(미주 신경과 경정맥에서 CCA를 분리하도록 주의) (그림 3A). 오모설근이 없는 경우 CCA 주변 영역을 충분히 비우고 CCA, 제안된 주사 부위의 두개골 및 꼬리에 봉합사를 배치하고 바늘을 삽입할 수 있습니다.
- 왼손에 가는 집게를 대고 봉합사를 각진 끝 집게에 전달하여 봉합사 끝 부분을 잡습니다. 각진 팁 겸자를 사용하여 CCA 아래의 봉합사 길이의 절반을 부드럽게 당깁니다(그림 3B).
- 첫 번째 봉합사와 평행한 두 번째 봉합사로 이 과정을 반복합니다(그림 3C).
- CCA 주위의 각 봉합사를 느슨하게 묶되 매듭을 조이거나 혈류를 제한하지 마십시오(그림 3D).
- 외부 경동맥 격리 및 준비
- 각진 팁 겸자를 사용하여 근육 삼각형의 두개골 끝, 즉 두개골에서 오모히오이드 근육까지의 결합 조직을 조심스럽게 제거하여 CCA와 ECA 및 ICA로 분기되는 분기점을 찾습니다(그림 4A).
알림: ECA는 정중선을 향해 각도를 이루고 약간 더 피상적인 반면 ICA는 측면으로 각도를 이루고 목 깊숙이 이동합니다. 분기점 바로 위의 ICA를 가로지르는 설하신경(HN)의 손상을 방지하기 위해 특별한 주의를 기울이십시오. - 분기 근처의 ECA의 모든 면에서 결합 조직을 조심스럽게 제거합니다. ECA에서 결합 조직이 충분히 제거되면 쥐의 흉골에 무균 처리된 피부에 봉합사 조각을 놓고 ECA 아래에 각진 끝 겸자를 통과시킵니다. 왼손에 가는 집게를 대고 봉합사를 ICA와 ECA 사이의 공간에 있는 각진 끝 집게에 통과시키고 봉합사 길이의 절반을 부드럽게 잡아당깁니다(그림 4B). ECA 주위에 봉합사를 느슨하게 묶되 매듭을 조이지 마십시오.
참고: 봉합사를 회수할 때 동맥에 손상을 입히지 않고 각진 팁 겸자로 봉합사를 잡을 수 있을 만큼 ECA에서 충분한 결합 조직을 제거하는 것이 중요합니다.
- 각진 팁 겸자를 사용하여 근육 삼각형의 두개골 끝, 즉 두개골에서 오모히오이드 근육까지의 결합 조직을 조심스럽게 제거하여 CCA와 ECA 및 ICA로 분기되는 분기점을 찾습니다(그림 4A).
- 바늘 및 주사기 준비
참고: 이 단계에서는 주사기가 마우스 몸체에 닿아 안정화될 수 있도록 직선 바늘로 주입을 수행할 수 있습니다(그림 5A). 또는 팁 근처에서 구부러진 바늘을 사용하여 주사기를 수술 테이블에 올려 놓고 연필처럼 잡을 수 있도록 주사를 수행할 수 있습니다(그림 5B). 두 기술 모두 잘 작동하며 기술 선택은 개인 취향입니다.- 구부러진 바늘을 준비하려면 베벨이 위를 향하도록 33G, 1/2인치 바늘을 잡고 멸균 바늘 드라이버로 팁을 잡습니다(그림 5C). 바늘을 베벨 쪽으로 직접 약 30-40° 구부립니다(그림 5D).
- 주사기에 주입할 용액의 적절한 부피를 채웁니다(주사기를 로드하기 위해 주사기를 주입하기 위해 주사액이 바늘을 통해 위로 올라오지 않는 경우 바늘의 공동 공간을 고려해야 함). 바늘을 부착하고 기포를 제거하십시오. 용액의 반월상 연골이 바늘의 경사에서 보이는지 확인하십시오.
- 경동맥 내 주사
- ECA 주변의 봉합사 매듭을 조입니다. 다음으로, CCA의 하부 봉합사를 흉쇄유돌근 쪽으로 가능한 한 멀리 밀어 넣고 매듭을 조입니다. CCA의 상부 봉합사가 주사 후까지 느슨하게 유지되는지 확인하십시오. 멸균 면봉을 캐비티 가장자리에 넣어 주입 중 분비된 액체와 혈액을 흡수합니다.
- 오른손에는 주사기를, 왼손에는 미세한 집게를 잡고 바늘을 CCA의 하부 봉합사 바로 위의 동맥으로 가져옵니다. 미세한 집게를 사용하여 아래쪽 봉합사의 느슨한 끝을 꼬리 방향으로 부드럽게 당겨 CCA에 낮은 수준의 장력을 가합니다(그림 6A).
- 베벨 바로 뒤에 바늘을 CCA에 삽입하고 봉합사에서 장력을 천천히 풉니다(그림 6B).
알림: 동맥에는 상당한 혈류가 있으며 바늘을 삽입할 때 수술강으로 출혈이 발생할 수 있습니다. 그러나 바늘이 베벨을 지나 삽입되면 동맥이 바늘 주위를 밀봉하고 출혈이 멎습니다. 바늘을 제자리에 놓은 상태에서 지속적인 출혈은 바늘이 동맥에 충분히 깊지 않거나(베벨과의 틈으로 혈액이 흐를 수 있음) 바늘이 동맥 뒤쪽을 통해 밀려났음을 나타냅니다. 이제 동맥이 찢어지거나 바늘이 빠지지 않도록 바늘을 매우 가만히 유지하는 것이 중요합니다. 출혈 사례가 있는 동물을 지속적으로 모니터링하고, 출혈이 심한 경우(예: 동물이 색이 변하거나, 청색증으로 보이거나, 만지면 차가워지거나, 동물 사용 프로토콜에 설명된 기타 인도적 평가변수) 인도적 평가변수를 적용해야 합니다. - 왼손을 사용하여 주사기 플런저를 밀어 용액을 매우 천천히 주입합니다(그림 5B, 100μL의 용액을 주입하는 데 15초 이상). 용액 주입이 끝나면 바늘을 제거하지 마십시오. 역류를 방지하려면 왼손에 가는 집게를 들고 CCA의 상부 봉합사(여전히 느슨하게 묶여 있음)를 매듭으로 잡고 들어 올려 동맥을 꼬습니다(그림 6C).
- 바늘을 제거하고 주사기를 한쪽에 보관한 다음 오른손으로 각진 끝 겸자를 집어 듭니다. 동맥의 꼬임을 유지하면서 CCA의 상부 봉합사에 있는 매듭을 조입니다(그림 6D).
참고: 이 시점에서 수술강으로의 추가 출혈이 없어야 합니다. 이 단계를 수행하면 아래 2.7 단계 및 2.8 단계에 설명된 두 가지 대체 절차가 있습니다. CCA를 결찰해야 하는 경우 2.7단계를 따르십시오. 주입 부위에서 CCA를 수리해야 하는 경우 2.8단계에 나열된 수정 사항을 따르십시오.
- CCA의 결찰
- CCA의 순환을 복원할 필요가 없는 경우, 동맥을 결찰된 상태로 두고 CCA에서 양쪽 봉합사를 조입니다. 봉합사 끝을 자르고 봉합사 매듭이 완전히 조여졌는지 확인합니다.
- 2.9단계에 설명된 폐쇄 및 진통 절차를 진행합니다.
- CCA 주입 부위 복구 및 순환 복원의 결찰에 대한 대안
- 멸균 면봉을 사용하여 수술강 내에 남아 있는 혈액을 흡수합니다. CCA에서 주입 부위를 찾고(그림 7A) 봉합에 필요한 봉합사 수를 결정합니다. CCA의 격리된 영역의 주사 부위와 내강을 철저히 세척하여 응고된 혈액을 제거합니다.
- 각진 팁 집게를 사용하여 바늘 몸체가 스웨이지에 가까운 9-0 봉합 바늘을 잡습니다. 미세한 겸자를 사용하여 반대쪽에서 동맥을 지지하면서 동맥에 수직으로 주사 부위 측면으로 약 1-1.5mm 떨어진 동맥벽을 관통하여 CCA에 단일 봉합사를 배치합니다. 미세한 집게로 동맥을 잡고 주사 부위를 열고 바늘과 봉합사를 각각 좌우에 통과시킵니다. 또는 동맥을 잡고 미세한 집게로 양쪽을 부드럽게 누르고 바늘을 통과시킨 다음 한 번의 물기로 동맥의 양쪽을 봉합합니다.
알림: 두 기술 중 하나를 사용하면 바늘과 봉합사가 동맥 내부의 뒷벽을 관통하지 않도록 주의하십시오. 이렇게 하면 조일 때 내강이 닫힙니다. - 외과 의사의 매듭으로 주사 부위를 닫고 최소 4번의 던지기를 사용하여 미세한 집게와 각진 끝 집게로 기구를 묶습니다(그림 7B). 일반적으로 33G 바늘의 주입 부위를 봉합하기 위해 단일 단순 단속 봉합사를 사용하십시오.
- 미세한 집게를 사용하여 혈액 순환을 복원하려면 ECA 주변의 봉합사를 풀어서 제거한 다음 CCA의 상부 봉합사를 제거합니다(그림 7C,D). 다음으로, CCA의 하부 봉합사를 천천히 풀되 즉시 풀지 마십시오. 혈압과 혈류가 회복된 상태에서 주요 출혈을 예방할 수 있도록 주사 부위가 충분히 닫혀 있는지 확인합니다(그림 7D).
알림: 주사 부위에 심한 출혈이 발생하면 CCA의 하단 봉합사를 빠르게 다시 조일 수 있으며 필요한 경우 주사 부위를 조정하거나 다시 봉합할 수 있습니다. - 상부 및 하부 CCA 봉합사를 제거합니다(그림 7E). 2.9단계로 이동합니다.
- 폐쇄 및 진통
- 구멍에서 타액선의 위치를 조정하고 멸균 봉합사 팩을 사용하여 3개의 간단한 단속 봉합사로 절개 부위를 봉합합니다. 수술용 테이프 고정 장치를 제거하고 마우스가 가열 패드의 마취에서 회복될 수 있도록 합니다.
알림: 진통제의 후속 용량은 사용자가 승인한 IACUC 프로토콜에 명시된 빈도와 용량에 따라 투여해야 합니다. 주사 사이에 1 주일의 치유 기간을 권장합니다. 반복 주입이 필요한 경우 첫 번째 주사 후 주사 부위의 복원을 사용할 수 있으며 후속 주사에 대해서도 동일한 수술 절차를 따를 수 있습니다. 후속 주사는 동일한 주사 부위를 복구하기 위해 반복적으로 봉합하면 흉터와 혈전이 발생할 수 있으므로 수리된 주사 부위의 CCA 두개골에 투여할 수 있습니다.
- 구멍에서 타액선의 위치를 조정하고 멸균 봉합사 팩을 사용하여 3개의 간단한 단속 봉합사로 절개 부위를 봉합합니다. 수술용 테이프 고정 장치를 제거하고 마우스가 가열 패드의 마취에서 회복될 수 있도록 합니다.
결과
이전 보고에 따르면 경동맥 내 주사로 전달된 골수 유래 인간 중간엽 줄기세포(BM-hMSCs)가 마우스에서 두개내 신경교종에 성공적으로 정착한 것으로 나타났습니다19. 우리는 신경교종이 있는 마우스에서 BM-hMSC의 경동맥 내 주사 후 혈액 순환 회복과 함께 CCA 결찰과 CCA 복구의 효과를 비교하기 위해 이 모델을 사용했습니다. 흉선성 누드 마우스에 U87 신경교종 세포를 이식한 후 GFP 표지된 BM-hMSC를 주입하고 후속 CCA 결찰 또는 순환이 복원된 CCA 복구를 수행했습니다. 3일 후, 마우스를 희생시키고 뇌를 수확하여 고정하고 면역조직화학을 수행하여 GFP를 검출하고 GFP 양성 세포를 계산했습니다(그림 8A-D).
두개내 신경교종에 대한 GFP-BM-hMSC의 전반적인 귀환은 동일한 표본에서 두 개의 다른 슬라이드(섹션 >75 μm 간격)에서 종양 경계 내의 GFP 양성 세포의 총 수에 의해 평가되었습니다. 쌍을 이루지 않은 t-검정에 의한 평균 비교는 두 절차 간에 관찰된 평균 원점 복귀 간에 유의한 차이가 없음을 시사했습니다(P = 0.6858)(그림 8E). 종양 전체에 걸친 GFP-BM-hMSC의 분산은 종양 내 10개의 고출력 필드에 걸쳐 GFP 양성 세포를 계산하여 평가되었습니다. 고출력 필드 내에서 세포 수가 증가하면 절차의 변화로 인해 종양 전체에 걸쳐 세포 분산의 변화를 나타낼 수 있습니다. Wilcoxon Signed Rank 검정을 사용하여 중앙값을 비교한 결과, CCA 결찰군과 CCA 복구군 간에 고출력 필드에 걸친 GFP 양성 세포의 중앙값 수에는 유의한 차이가 없는 것으로 나타났습니다(그림 8F).

그림 1: 수술을 위한 수술 테이블과 마우스의 준비. (A,B) 수술용 침대(라벨 A. 침대를 형성하는 비닐 테이프, B. 수술용 테이프 앞다리 구속대, C. 베개, D. 무게, E. 마취 코뿔, F. 뭉툭한 후크 견인기, G. 70% 에탄올의 1cm 봉합사, H. 미세 집게, I. 각진 끝 집게, J. 좁은 가위, K. 멸균 면봉). (씨,디) 마우스 위치 지정. (E,F) 수술 부위 및 수술 부위의 소독. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
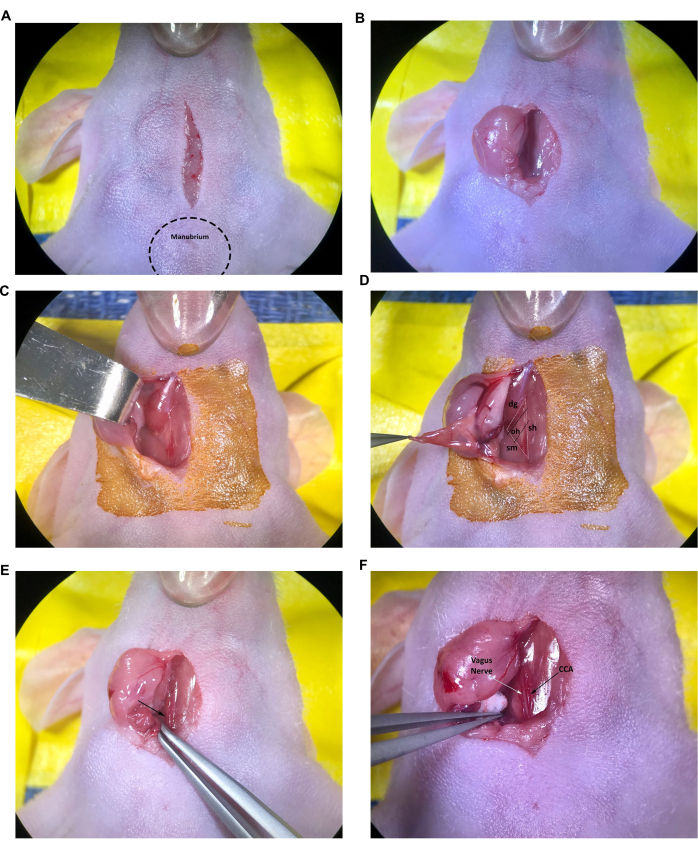
그림 2: 주입 부위의 구조물 절개 및 노출. (A) 정중선 절개. (나,씨) 우측 타액선의 수축. (D) 기관/흉골설근, 흉쇄유돌근, 이위근, 이복근에 의해 형성된 근육 삼각형도 볼 수 있습니다. (E) 화살표로 표시된 총경동맥. (F) 화살표로 표시된 미주 신경 및 총경동맥. 약어: sh = 기관/흉골설근; SM = 흉쇄유돌근; DG = 이위근; OH = 오모히오이드 근육; CCA = 총경동맥(General carotid artery). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
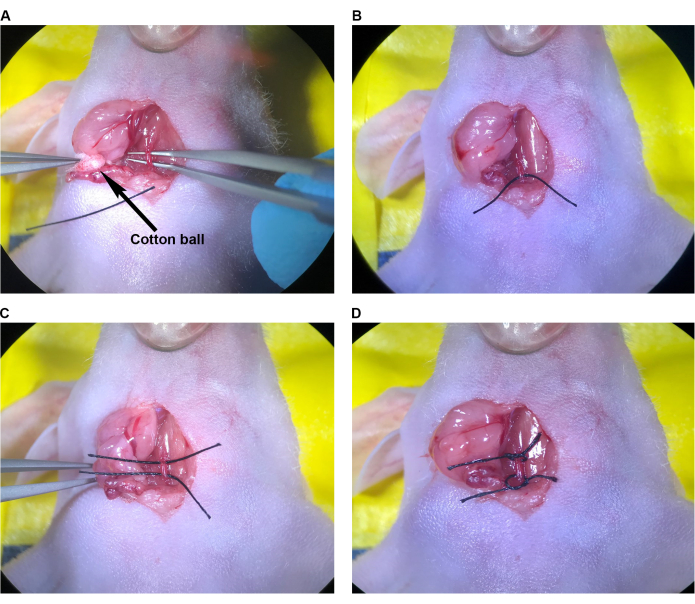
그림 3: 주입을 위한 CCA 준비. (A) CCA 아래를 통과한 각진 끝 겸자. (B) 봉합사는 각진 팁 겸자를 사용하여 CCA 아래의 절반을 당겼습니다. (C) 두 번째 봉합사는 CCA 아래 절반으로 당겨졌습니다. (D) CCA 주위를 느슨하게 묶은 봉합. 약어: CCA = 총경동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
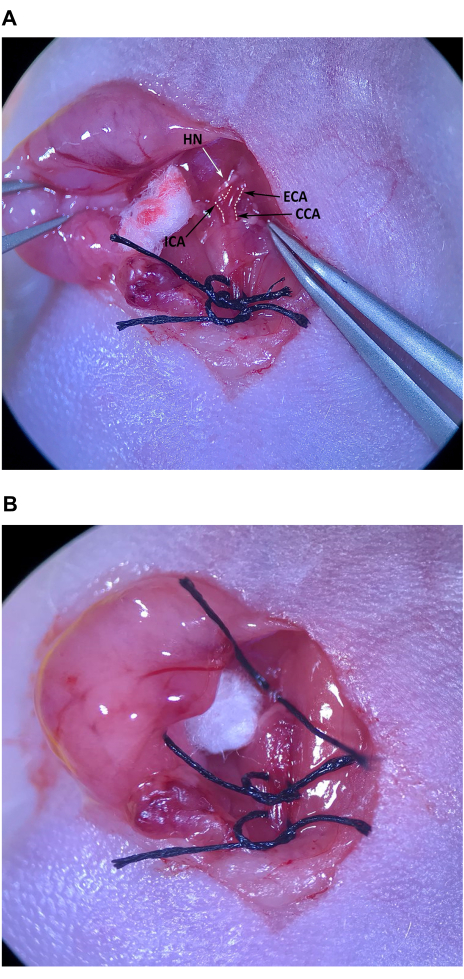
그림 4: 외부 경동맥 격리 및 준비. (A) CCA, 외부 경동맥 및 내부 경동맥. (B) 봉합사가 ECA 아래에서 반쯤 당겨졌습니다. 약어: CCA 일반 경동맥; ECA = 외부 경동맥; ICA = 내경동맥(internal carotid artery). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
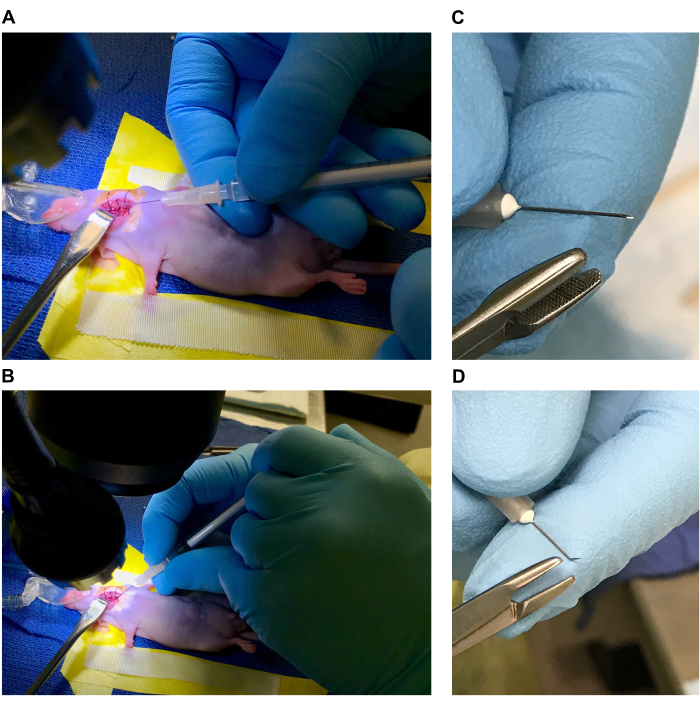
그림 5: 바늘 및 주사기 준비. (A) 주사기가 쥐의 몸에 닿도록 직선 바늘로 주사합니다. (B) 구부러진 바늘로 주사하고 손을 수술 테이블에 올려 놓습니다. (씨,디) 구부러진 바늘을 준비합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
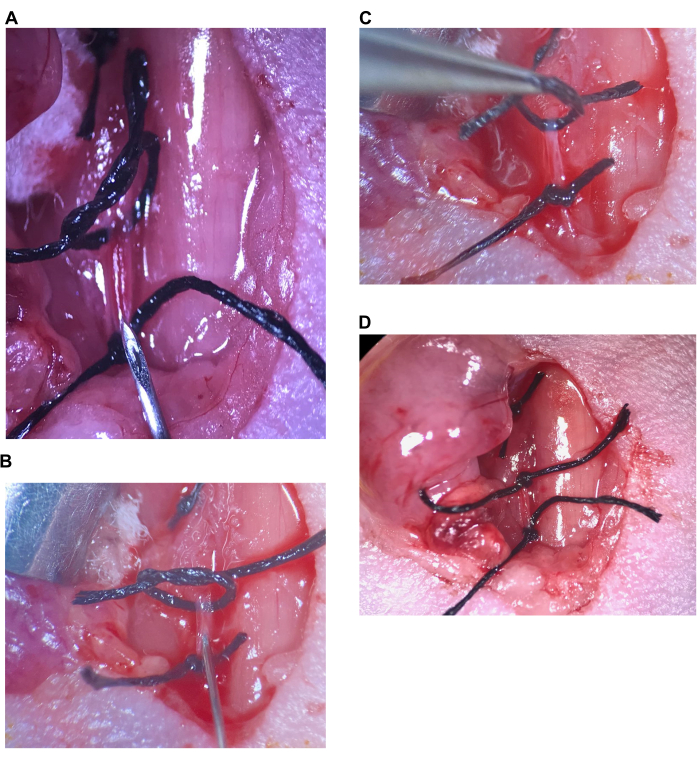
그림 6: 경동맥 내 주입. (A) 상부 봉합사가 느슨하고 하부 봉합사가 CCA에 조여지고 바늘이 하부 봉합사 위에 놓입니다. (B) 바늘은 베벨 바로 너머로 삽입되고 동맥은 바늘 주위로 밀봉됩니다. (C) 상부 봉합사를 들어 올려 동맥을 위쪽으로 꼬고 역류를 방지합니다. (D) CCA의 상부 봉합사가 조여집니다. 약어: CCA = 총경동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
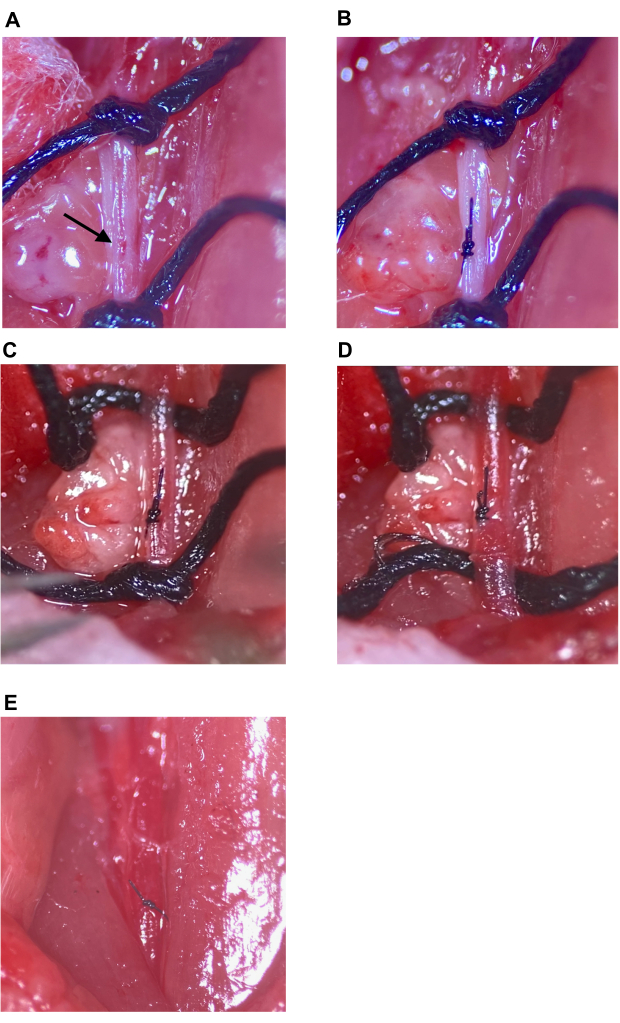
그림 7: 주입 부위 복구 및 순환 복원. (A) 화살표로 표시된 주입 부위. (B) 주사 부위는 외과 의사의 매듭으로 최소 4회 던지기로 봉합되었습니다. (씨,디) 주입 부위 수리 후 CCA의 상부 및 하부 봉합사의 풀림; 봉합사 풀림 후 출혈이 보이지 않습니다. (E) 주입 부위가 충분히 수리되었다고 판단된 후 봉합사를 제거합니다. 약어: CCA = 총경동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
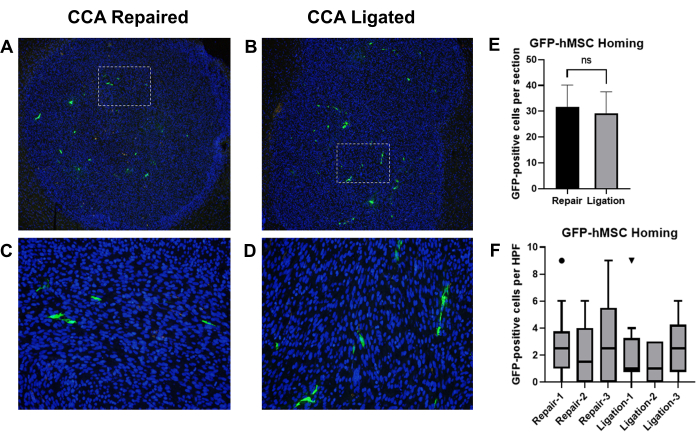
그림 8: GFP-BM-hMSC의 경동맥 내 주입 및 순환 복원을 통한 CCA 결찰 또는 CCA 복구 후 두개내 신경교종 종양에 대한 귀환 비교. 종양이 있는 마우스의 뇌 조직 절편을 항-GFP 1차 항체 및 Alexa Fluor 488 2차 항체로 염색하여 GFP-BM-hMSC(녹색)를 라벨링했습니다. 핵은 Hoechst 33342(청색)로 염색하였다. 종양에 대한 전반적인 귀환을 보여주는 라벨링된 섹션의 대표적인 저전력 필드 및 (A,C) CCA 복구 또는 (B,D) CCA 결찰 후 GFP 양성 세포 분포를 보여주는 고출력 필드. (E) 종양에 대한 GFP-BM-hMSC의 전반적인 귀환은 두 개의 서로 다른 슬라이드에서 종양 경계 내의 GFP-양성 세포의 총 수에 의해 평가되었으며 평균은 t-test에 의해 비교되었습니다. 대안 절차 간에 전체 원점 복귀에서 유의한 차이는 관찰되지 않았다(P=0.6858). (F) 종양 전체에 걸친 GFP-BM-hMSC의 분산은 종양 내 10개의 고출력 필드에 걸쳐 GFP 양성 세포를 계수하여 평가되었습니다. Wilcoxon Signed Rank 검정에 의한 중앙값 비교는 절차에 관계없이 개인 간에 유의한 차이가 없음을 나타냅니다(P = 0.1914, 0.5000, 0.1641, 0.9512, 0.8828, 0.2207). 약어 : GFP = 녹색 형광 단백질; GFP-BM-hMSCs = GFP 표지 골수 유래 인간 중간엽 줄기 세포; CCA = 총경동맥(General carotid artery). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
경동맥 내 주사는 최근 몇 년 동안 뇌종양에 치료제를 전달하기 위해 점점 더 많이 사용되고 있습니다. 따라서 연구 목적으로 인간의 경동맥 내 주사를 모방하는 마우스 모델을 확립하는 것이 중요합니다. 이전에는 마우스의 경동맥 내 주사는 동맥의 후속 결찰과 함께 수행되었으며, 이는 동맥으로의 주입 횟수를 제한했습니다11,12. 또한, 마우스에서 경동맥의 폐색은 완전한 Circle of Willis13을 갖지 않는 특정 마우스 균주에서 뇌 허혈을 유발할 수 있습니다. 주입된 경동맥을 복구하는 방법을 개발하여 기존 방법의 한계를 극복하였습니다. 주사 부위를 복구하면 주입된 동맥으로의 혈류가 다시 형성되고 뇌 허혈의 가능성이 줄어들며 동일한 내부 경동맥에 후속 주사를 용이하게 할 수 있습니다.
성공에 중요한 몇 가지 단계는 다음을 포함하여 수술 기구 또는 조직을 신중하게 다루어야 합니다: 경동맥 내 주입 중 출혈을 피하기 위해 동맥 내강에 바늘을 올바르게 삽입; 바늘을 삽입하기 전에 주사 부위에서 결합 조직을 조심스럽게 절개합니다. 주입 전에 주사기와 바늘의 모든 덩어리와 기포 제거; 그리고 수리 중 동맥의 내강이 닫히는 것을 방지하기 위해 주사 부위를 올바르게 닫으십시오. 바늘을 삽입한 후 출혈을 방지하려면 바늘이 베벨을 지나 동맥에 삽입되어 바늘 축 주위를 밀봉하도록 합니다. 동맥 뒤쪽 벽이 찢어지는 것을 방지하려면 바늘을 얕은 각도로 삽입하고 주사기와 바늘을 조심스럽게 흔들어 바늘 끝이 동맥 뒤쪽 벽에 닿지 않도록 합니다. 주입된 용액이 주입 중에 누출되면 바늘이 동맥을 둘러싼 결합 조직에만 삽입되었음을 나타냅니다. 주사 전에 주사 부위의 과도한 결합 조직을 조심스럽게 절개하면 이 문제를 예방할 수 있습니다.
봉합사 및 봉합 기술의 선택과 관련하여, 초기 주입 시 33G 바늘을 사용하여 동맥에 깨끗하게 삽입한 경우 9-0 봉합사를 사용한 간단한 봉합사 1회로 동맥을 복구하기에 충분합니다. 주사에 더 큰 바늘을 사용하거나(30G 등) 바늘을 삽입할 때 찢어짐이 발생하는 경우(예: 바늘이 중심에서 벗어나거나 마우스가 숨을 쉬기 때문에 동맥이 움직이는 경우) 수리해야 하는 약간 더 큰 구멍이 생깁니다. 두 개의 간단한 봉합사 또는 8 개의 숫자는 일반적으로 이러한 유형의 더 큰 구멍을 수리하기에 충분합니다. 이 두 가지 기술 중 선택은 이 상황에서 외과 의사의 선호도에 따라 결정됩니다. 사출 부위 구멍이 위에서 언급한 상황보다 훨씬 큰 상황에서는 수리 기술이 평가되지 않았다는 점에 유의하는 것이 중요합니다. 주입 부위의 찢어짐이 옆으로 뻗어있는 경우 (동맥 둘레의 1/3 이상으로 넓은 구멍을 만드는 경우)이 방법으로 수합하면 동맥의 수축이 발생하고 혈전증의 위험이 높아질 수 있습니다.
봉합사를 제거할 때 수복된 주사 부위에서 출혈이 있는 경우 정상적인 순환이 재개됨에 따라 수복된 주사 부위가 늘어나기 때문일 수 있습니다. 이것은 수리된 주사 부위를 멸균면으로 부드럽게 덮고 30초 동안 가벼운 압력을 가하면 해결할 수 있습니다. 또는 수복된 주사 부위에서 혈류가 보이지 않고 근위 팽창된 동맥이 있는 경우 봉합 바늘이 수복 중 동맥의 뒷벽을 통과했음을 나타냅니다. 이 경우 수복시 주입 부위 가장자리를 부드럽게 열고 봉합 바늘을 얕은 각도로 동맥에 통과시키고 봉합사가 뒷벽을 통과하지 않았는지 육안으로 확인한 후 봉합사 매듭을 묶습니다.
이러한 조치를 취하면 주입 부위 복구 방법은 유전적 배경이나 연령에 관계없이 동물 코호트에서 정확하고 반복 가능합니다. 우리의 경험에 따르면 3명의 다른 외과의가 시술을 수행했을 때 성공률은 100%였습니다. 충분한 경험과 제공된 프로토콜을 주의 깊게 따른다면 다른 외과의가 이 절차를 수행하는 데 어려움이 없을 것으로 예상됩니다. 연습을 통해 숙련 된 외과 의사는 15-20 분 안에 절차를 완료 할 수 있습니다. 실험이 허용하는 경우, 주사 부위의 수리를 포기하고 상부 및 하부 CCA 봉합사를 그대로 두어 동물당 시간을 줄일 수도 있습니다. 그러나 위에서 언급했듯이 대뇌 혈관 해부학의 균주에 따른 차이가 문서화되었으며 실험을 시작하기 전에 절차에 사용된 마우스의 변형이 이를 견딜 수 있는지 확인하는 것이 중요합니다.
이것은 외과 수술이기 때문에 쥐의 회복을 고려해야 합니다. 스트레스 내성과 상처 회복은 마우스 균주에 따라 달라지는 중요한 고려 사항입니다. 또한 수술 부위의 염증 및 흉터 조직 형성으로 인해 반복 수술 후 회복 시간이 늘어날 수 있습니다. 우리는 7일 간격으로 여러 번 성공적으로 주사를 수행했지만 더 빈번한 주사가 필요한 경우 사용할 특정 마우스 균주에서 신중하게 평가해야 합니다. CCA에 대한 무리한 취급과 스트레스(봉합사 격리, 봉합사 묶기 및 제거, 주입 중)는 동맥벽을 손상시키고 약화시켜 반복적인 주입 시 찢어짐을 유발할 수 있습니다. CCA 주위의 지지 결합 조직의 박리와 분기를 최소화하고 동맥에 과도한 압력을 가하지 않는 것이 중요합니다.
본 연구의 결과는 이 특정 모델에서 주사 후 혈액 순환이 회복된 CCA 결찰 또는 CCA 복구가 두개내 종양에 걸쳐 주입된 BM-hMSC의 전체 귀환 빈도 또는 분포에서 다르지 않다는 것을 시사합니다. 이는 마우스 균주에 따라 다를 수 있지만, 주사 부위 복구를 사용하면 주입된 동맥으로의 혈류를 되돌려 동일한 동맥에 후속 주입할 수 있으며, 중요하게는 인간 환자의 경동맥 내 주사와 유사하다는 이점을 제공합니다. 주입된 동맥을 결찰하는 것과 복구하는 것의 선택은 실험 유형과 사용되는 마우스 모델에 따라 결정됩니다. 두 번째 주입이 필요하거나 마우스 모델에 완전한 Circle of Willis가 없는 경우 주입 부위 수리를 사용해야 합니다. 마우스 모델에 CCA를 다시 주입하는 기능은 추가적인 실험 조작을 용이하게 할 수 있습니다. 예를 들어, 시간이 지남에 따라 투여된 잠재적 치료제의 여러 용량을 테스트하려면 주입된 동맥의 복구가 후속 주사를 수행하는 데 필수적입니다. 이 방법은 또한 서로 다른 시간에 주입할 필요가 있는 치료제의 조합의 주입과 관련된 실험에서 유용할 것이다. 주입된 동맥의 복구로 제공되는 경동맥 내 주사의 유연성 증가는 마우스 뇌종양 모델의 번역 유용성을 향상시킵니다.
공개
저자는 관련 공개/이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립암연구소(National Cancer Institute, R01CA115729, R01CA214749, 1P50 CA127001)의 보조금과 텍사스 대학교 MD 앤더슨 암 센터 Moon Shots Program™, 뇌암 연구를 위한 브로치 재단, 뇌종양 연구를 위한 일라이어스 가족 기금, 프리실라 힐리 암 연구 기금, 바우만 가족 큐어페스트 뇌암 연구 기금, Chuanwei Lu Fund, The Sweet Family Brain Cancer Research Fund, The Ira Schneider Memorial Cancer Research Foundation, The Jim & Pam Harris Fund, The Gene Pennebaker Fund for Brain Cancer Research, the Sorenson Fund for Brain Tumor Research, the Brian McCulloch Memorial Fund, the TLC Foundation from the Heart and the Mary Harris Pappas Endowed Fund for Glioblastoma Research, 모두 F.F.L.에게
자료
| Name | Company | Catalog Number | Comments |
| 1 mL syringes (low dead space) | Air-tite Products Co. | A1 | |
| 26 G; 1/2" needle | Air-tite Products Co. | N2612 | |
| 33 G; 1/2" needle | JBP, Air-tite Products Co. | JBP3313B | |
| 3 cm Petri dish | Falcon, Fisher Scientific | 08-772A | |
| 3M durapore surgical tape | Fisher Scientific | 19-071-152 | |
| 6-0 suture thread | Fine Science Tools | 18020-60 | |
| 70% Ethanol | Fisher Scientific | 04-355-122 | |
| 9-0 microsurgical suture with needle | Fine Science Tools | 12052-09 | |
| Analgesic for major surgery | |||
| Artificial tears/ophthalmic ointment | Covetrus | 8897 | |
| Bead Sterilizer | Fisher Scientific | 14-955-341 | |
| Betadine/Chlorhexidine | McKesson, Fisher Scientific | NC1696484 | |
| Blunt hook retractor | Fine Science Tools | 17022-13 | |
| Dissecting microscope | Zeiss Microscopy, LLC | 491903-0010-000 | |
| Electric heating pad | Insource, Fisher Scientific | NC0667724 | |
| Extra narrow scissors | Fine Science Tools | 14088-10 | |
| Fine forceps - Dumont #5 forceps with micro-blunted tips | Fine Science Tools | 11253-20 | |
| Fine forceps - Dumont #5/45 angled tip forceps with micro-blunted tips | Fine Science Tools | 11253-25 | |
| Isoflurane vaporizer (or Ketamine/Xylazine cocktail) | Kent Scientific | VetFlo-1231 | |
| Light source | Laxco, Fisher Scientific | AMPSILED21 | |
| Mouse anesthesia nose cone | Braintree Scientific, Inc | XENO- M | |
| Needle driver | Fine Science Tools | 12002-12 | |
| Sterile cotton swabs | Texwipe, Fisher Scientific | 18-366-472 | |
| Sterile gauze pads | Covidien, Fisher Scientific | 22-037-907 | |
| Sterile saline (0.9%) | KD Medical, Fisher Scientific | 50-103-1363 | |
| Sterile surgical drapes | Fisher Scientific | 50-129-6666 | |
| Sterile surgical/downdraft table | |||
| Sterile suture pack (any suitable diameter for mouse wound closure) | Ethicon, Fisher Scientific | 50-209-2811 | |
| Surgical tools | |||
| Vinyl lab tape | Fisher Scientific | 15-901 |
참고문헌
- Loya, J., Zhang, C., Cox, E., Achrol, A. S., Kesari, S. Biological intratumoral therapy for the high-grade glioma part i: Intratumoral delivery and immunotoxins. CNS Oncol. 8 (3), (2019).
- Garfield, J., Dayan, A. D. Postoperative intracavitary chemotherapy of malignant gliomas. A preliminary study using methotrexate. J Neurosurg. 39 (3), 315-322 (1973).
- Kroin, J. S., Penn, R. D. Intracerebral chemotherapy: Chronic microinfusion of cisplatin. Neurosurgery. 10 (3), 349-354 (1982).
- Sendelbeck, S. L., Urquhart, J. Spatial distribution of dopamine, methotrexate and antipyrine during continuous intracerebral microperfusion. Brain Res. 328 (2), 251-258 (1985).
- Alter, R. A., et al. Long-term benefit of intra-arterial bevacizumab for recurrent glioblastoma. J Exp Ther Oncol. 12 (1), 67-71 (2017).
- Angelov, L., et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary cns lymphoma: A multi-institutional experience. J Clin Oncol. 27 (21), 3503-3509 (2009).
- Chen, S. R., Chen, M. M., Ene, C., Lang, F. F., Kan, P. Perfusion-guided endovascular super-selective intra-arterial infusion for treatment of malignant brain tumors. J Neurointerv Surg. 14 (6), 533-538 (2022).
- Faltings, L., et al. Rechallenging recurrent glioblastoma with intra-arterial bevacizumab with blood brain-barrier disruption results in radiographic response. World Neurosurg. 131, 234-241 (2019).
- Srinivasan, V. M., et al. Advances in endovascular neuro-oncology: Endovascular selective intra-arterial (esia) infusion of targeted biologic therapy for brain tumors. J Neurointerv Surg. 12 (2), 197-203 (2020).
- Shinojima, N., et al. Tgf-β mediates homing of bone marrow-derived human mesenchymal stem cells to glioma stem cells. Cancer Res. 73 (7), 2333-2344 (2013).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of visualized experiments : JoVE. (120), e55085 (2017).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Benbenishty, A., et al. Maintaining unperturbed cerebral blood flow is key in the study of brain metastasis and its interactions with stress and inflammatory responses. Brain, behavior, and immunity. 62, 265-276 (2017).
- Doucette, T., et al. Mesenchymal stem cells display tumor-specific tropism in an rcas/ntv-a glioma model. Neoplasia. 13 (8), 716-725 (2011).
- Hata, N., et al. Platelet-derived growth factor bb mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 66 (1), 144-156 (2010).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 65 (8), 3307-3318 (2005).
- Qiao, Y., et al. Magnetic resonance and photoacoustic imaging of brain tumor mediated by mesenchymal stem cell labeled with multifunctional nanoparticle introduced via carotid artery injection. Nanotechnology. 29 (16), 165101 (2018).
- Yong, R. L., et al. Human bone marrow-derived mesenchymal stem cells for intravascular delivery of oncolytic adenovirus delta24-rgd to human gliomas. Cancer Res. 69 (23), 8932-8940 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유