需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
机械通气小鼠的超极化 129Xe 肺 MRI 和光谱学
摘要
超极化氙 MRI 可以量化转化研究和临床护理中的区域肺微观结构(气腔尺寸)和生理学(通气和气体交换)。尽管具有挑战性,但它可以在临床前研究中提供类似的肺部见解。该协议描述了在小鼠中执行常规氙肺 MRI 所需的基础设施和程序。
摘要
超极化 (HP) 氙 129 (129Xe) 是一种吸入式磁共振成像 (MRI) 造影剂,具有独特的光谱和物理特性,可用于量化肺生理学,包括通气、限制扩散(肺泡空腔大小)和气体交换。在人类中,它已被用于评估各种肺部疾病的疾病严重程度和进展,并在美国和英国被批准用于临床。除了临床应用之外, 129Xe MRI 无创评估肺部病理生理学并提供空间分辨信息的能力对于临床前研究也很有价值。在动物模型中,由于转基因疾病模型的可及性,小鼠使用最广泛。在这里, 129Xe MRI 作为一种微创、无辐射且敏感的技术很有前途,可用于纵向监测肺部疾病进展和治疗反应(例如,在药物发现中)。该技术可以通过结合 MRI 触发的自由呼吸装置或机械呼吸机来输送气体,从而扩展到临床前应用。在这里,我们描述了步骤并提供清单,以确保可靠的数据收集和分析,包括创建用于质量控制的热极化氙气模型、优化极化、动物处理(镇静、插管、通气和小鼠护理)以及通气、限制扩散和气体交换数据的方案。虽然临床前 129Xe MRI 可以应用于各种动物模型(例如,大鼠、猪、羊),但由于小鼠的小解剖结构带来的挑战,该协议侧重于小鼠,这与它们的可负担性和许多疾病模型的可用性相平衡。
引言
虽然肺部疾病仍然是全球发病率和死亡率的主要原因1,但在过去十年中,患者的预后有了显著改善。这些改进部分是由两个因素推动的。首先,III 期临床试验现在将肺功能的变化作为终点而不是死亡率,从而加速了药物试验 2,3,4,5。其次,改进的动物模型的进步为疾病机制提供了见解,并有助于治疗的发展 6,7。小鼠模型通常受到转化研究的青睐,因为它们具有与人类的生理相似性、可负担性和疾病发展速度快。基因工程扩大了可用模型的范围和质量,国际小鼠品系资源现在拥有超过 32,000 种小鼠品系8,而只有 4,218 种大鼠品系(大鼠基因组数据库9)。这些模型为研究一系列肺部疾病的机制驱动因素和治疗反应开辟了新途径,包括慢性阻塞性肺病 (COPD) 10、囊性纤维化 (CF)11、肺纤维化12,13、肺动脉高压14,15 和哮喘16。
不幸的是,涉及小鼠的肺部研究受到可用于量化疾病负担的技术的限制。研究通常依赖于 1) 提供全肺信息(生化分析)或局部信息(组织学)和 2) 需要横断面设计和大样本量的终端程序。因此,它们既不捕捉疾病动态的空间也不捕捉时间动态。相比之下,无创三维成像可以评估肺部的结构、分子过程和功能随时间的变化。
肺结构(例如气道异常和间质纤维化)可以通过超短回声时间 (UTE) MRI 和显微计算机断层扫描 (μCT) 以高分辨率可视化。功能和机制信息(例如,通气、灌注、肿瘤代谢和炎症过程)可以通过外源性造影剂(例如,氙气增强 CT 和氧增强 UTE)和电离核医学方法(即正电子发射计算机断层扫描 [PET] 和单光子发射计算机断层扫描 [SPECT])获得。然而,由于在不采用辐射水平高于正常辐射水平的电离方式的情况下,可以使用适度的对比噪声(特别是对于临床前 MRI 用于高磁场强度的氧增强 UTE,其中 T1 被延长),因此功能成像具有挑战性。虽然在使用常规剂量的动物模型中使用这些方式进行成像具有良好的耐受性,但累积辐射可能会混淆免疫学、炎症和肺癌研究的结果17。然而,超极化 (HP) 氙 129 (129Xe) 磁共振成像 (MRI) 可提供微创、非辐照且高度敏感的结构和功能信息。虽然该技术已用于临床前研究,以表征单个或多个时间点的肺气肿18,19、纤维化20、肺癌21、慢性阻塞性肺病22 和辐射诱导的肺损伤23 等病症,但它在临床前环境中仍未得到充分利用。
为了实现常规的临床前 129Xe MRI,需要几个先决条件,包括机构监管支持、超极化装置、129Xe 调谐射频 (RF) 线圈和多核扫描仪。尽管高级应用程序24、25、26、27、28、29、30、31、32、33 需要供应商特定的脉冲编程,这超出了本协议的范围,但基本应用程序可以通过适度的软件修改来实现。因此,我们专注于临床前 129Xe MRI 独有的质量控制、磁化处理、数据收集和动物处理程序(包括机械通气)(图 1)。
迄今为止,小动物 129Xe 成像已经采用了三种 MR 安全的气体输送方法,每种方法都有优点和缺点:自由呼吸、活塞驱动和压降。自由呼吸允许自发吸入,没有因插管或气管切开术而受伤的风险,但消耗更多的 HP 气体,并可能引入运动伪影34,35。商用活塞驱动设备是自校准的,开箱即用,但可能非常昂贵36。此处使用的基于压降的方法在文献中有很好的描述,模块化、可定制,并通过开源代码 37,38,39,40 运行。此外,它具有成本效益,通常总额不到 10 美元和几周的专用构建时间。压降呼吸机从加压罐内的剂量袋中提供 129Xe,同时监测插管小鼠的气道压力。
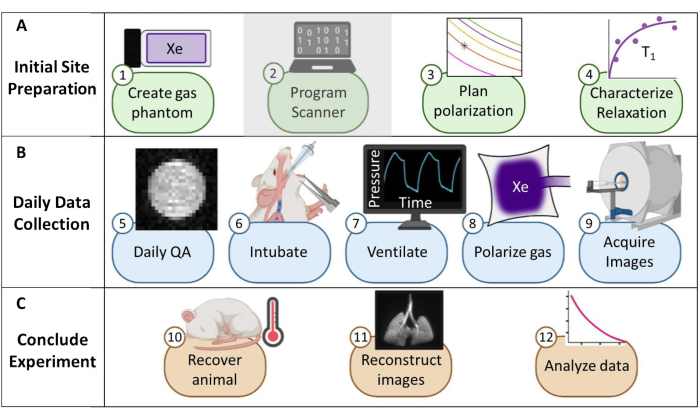
图 1:在小鼠中收集常规氙 129 (129Xe) 磁共振成像 (MRI) 的方案概述。 (A) 初始设置的步骤。(注意:扫描仪编程对于每个供应商都是唯一的,本协议中未对此进行描述)。(B) 收集每日质量保证 (QA) 和动物数据的步骤。(C) 成功实验结论和数据分析的步骤。 请单击此处查看此图的较大版本。
在这里,我们收集并分析了 129Xe MRI 数据的三类常见类别:通气、弥散加权成像(肺泡空腔大小)和气体交换。通气图像描绘了吸入的 129Xe 气体的分布。气流减少的肺部区域在 HP 气体图像中显得较暗,病理学通过通气不良的体积进行量化。在人类中,通气缺陷百分比 (VDP) 显示出很强的可重复性41,42 和对 COPD 43,44,45 和哮喘46,47 等疾病的肺梗阻高度敏感。
129个 Xe 原子在空域中的受限扩散可以通过表观扩散系数 (ADC) 来测量,并作为空域大小的替代物。通过获取没有扩散加权的基线图像 (b0) 和在双极梯度诱导扩散加权 (bN) 存在下获取的一个或多个图像来计算 ADC。ADC 升高反映了由于衰老或气肿重塑而导致的空腔大小的增加18,48。此外,使用多个 b 值图像 (≥4) 可以计算更详细的形态测量信息(例如,平均线性截距)49,50。
气体交换的表征取决于 1) 129Xe 在毛细血管膜组织、血浆和 RBC(红细胞)中的溶解度,以及 2) 129Xe 溶解在这些区室中时 >200 ppm 的下场化学变化。光谱和成像数据都提供了对心肺疾病(例如肺动脉高压和左心衰竭 51,52,53)的见解。虽然许多物种(人类、犬和大鼠)显示出源自每个隔室的独特光谱峰,但由于血红蛋白-氙结合位点相互作用的差异,小鼠缺乏独特的 RBC 信号。相反,在小鼠54 中将所有溶解的成分组合成单个信号。然而,在表达人血红蛋白的转基因小鼠中可以观察到明显的 RBC 共振,例如镰状细胞病模型中使用的小鼠54。总体而言,溶解 129Xe 光谱和成像为小鼠的心肺病理生理学提供了独特的见解55,56。
在尝试此协议之前,有必要了解有关 MRI 扫描仪、机械通气和小鼠研究所需的小鼠处理技术的背景信息。在开始动物研究之前,所有程序必须得到当地机构动物护理和使用委员会 (IACUC) 的批准57。由于小鼠肺中可用的总磁矩本质上很低(即潮气量 ~250 μL),因此体素大小必须比人类小 1000 倍才能达到解剖学上等效的分辨率。小鼠的呼吸频率也非常快(>100 次呼吸/分钟)。因此,通常用于人体成像的单次屏气程序是不可行的。相反,每次呼吸中只能施加少量射频激励,因此必须在数十到数百次呼吸中编码 129个 Xe 图像。可能需要脉冲编程,以允许外部触发采集,并正确循环切片、相位编码和/或扩散加权图像,同时平衡信噪比 (SNR)、分辨率和扫描持续时间。在这里,呼吸机每次呼吸输出一次晶体管-晶体管逻辑 (TTL) 脉冲以触发数据采集(图 2)。
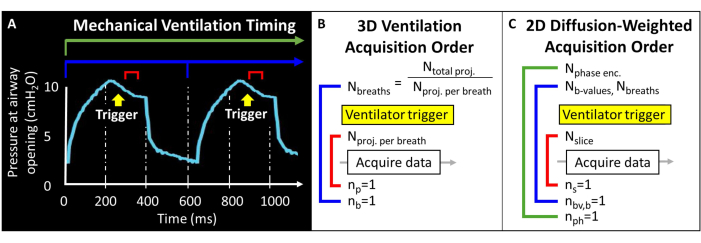
图 2:代表性机械通气和数据采集时间。(A) 用户控制的通气可以在吸气末、屏气期间或呼气末触发数据采集。(B) 对于此 3D 桡�动脉通气序列,用户定义获得的投影总数和每次呼吸的投影次数。(C) 对于切片选择性的 2D 扩散加权图像,用户定义切片、b 值图像和相位编码的顺序。 请单击此处查看此图的较大版本。
为了实现可靠的通气和 129Xe 输送,需要强大的镇静和插管程序。对于每项研究,必须考虑每种麻醉剂的下游影响 - 包括每分钟通气量、心率 (HR) 和血压 58,59,60,61,62,63,64,65,66 的变化。虽然临床前 HP 气体 MRI 已使用多种镇静剂,但由于其可用性、成本效益、可靠性和持续时间,我们采用氯胺酮、甲苯噻嗪和乙酰丙嗪的混合物67,68。镇静后,必须对动物进行插管以进行有效的机械通气。由于小鼠的解剖结构较小,因此很难插管,因此,对这项技术进行彻底训练很重要。我们鼓励研究人员审查已发布的视频协议69,70。由于大多数市售插管插管都含有不锈钢,因此我们引入了一种技术来制作无金属(即 MRI 和 HP-gas 兼容)的楔形插管,这些插管可以定制以匹配气道直径,从而与小鼠气管壁形成气密密封。
由于在多次呼吸中收集了 129个 Xe 图像,因此呼吸机设置至关重要。必须仔细考虑保护性通气策略以防止肺损伤 71,72,73,74。特别是,使用低潮气量 (TV)、适度呼气末正压 (PEEP) 和肺泡肺复张作 (RM) 可降低人类患者和动物模型呼吸机诱导肺损伤的风险 75,76,77,78,79,80,81。在这里,我们推荐一种与压降 129Xe 机械通气兼容的简单技术,该技术具有保护性并提供足够的 129Xe 图像 SNR。具体来说,我们通过在呼吸机的呼气管路上添加商用 PEEP 阀来应用 PEEP。要进行 RM,必须关闭呼气管,以便动物接受多次吸入而不呼气,直到达到目标压力和持续时间。
在整个过程中,我们提供一般的通气设置,但建议回顾文献以解决具体的研究目标82,83。除了监测机械通气期间的吸气峰值压力外,监测动物的体温也很重要,这可以使用标准的小鼠体温监测方法来完成。虽然不需要成像,但通过心电图 (ECG) 监测心率可能是有利的;心电图可以表明动物是否从镇静中醒来、服药过量或痛苦,从而允许研究人员进行干预。
我们描述的协议旨在收集 129Xe 3D 径向通气数据61、2D GRE 扩散加权数据76 和动态脉冲采集光谱气体交换数据。该协议旨在弥合小动物模型的临床前研究与 129Xe MRI 促进我们对肺部疾病的理解的潜力之间的差距。
Access restricted. Please log in or start a trial to view this content.
研究方案
此处描述的所有方法均已获得辛辛那提儿童医院医疗中心的机构动物护理和使用委员会 (IACUC) 的批准。
1. 初步场地准备
- 创建并测试热极化 129Xe 气体模型(图 3)。
- 获得一个硼硅酸盐玻璃容器 (~60 mL)、一个带前密封 O 形圈的柱塞阀和一个研磨的硼硅酸盐玻璃杆,所有容器的额定压力均高达 150 psig。确保没有磁性部件。将压缩接头连接到玻璃杆上。拧紧以产生气密密封。
- 根据 图 3A 将容器连接到真空泵和储氧罐。将容器真空至绝对压力小于 100 mTorr。
- 将氧气填充到容器中至 1.5 个大气压的压力,以将 129Xe T1 从 > 30 分钟降低到 ~2 s(在 7 T 磁场强度下;对于 9.4 T 扫描仪,请使用 1.6 atm 氧气)。海豹船。
注意:对于更高的场强,需要稍高的氧分压才能达到 T1≤ 2 s84。 - 用 400 mL 富含同位素的氙 (85% 129Xe) 填充不透气的储液器。
注:也可以使用自然丰度氙 (26% 129Xe),但需要增加信号平均以减轻 SNR 的 ~3 倍降低。 - 将容器连接到 129Xe 的储液罐。将软管真空至绝对压力小于 100 mTorr。
- 将张口台式液体 N2 杜瓦瓶填充至 ~90%。将容器底部 (~5 cm) 浸入液氮中以冷凝 O2 并产生真空(图 3B)。浸入水中时,打开阀门,让来自储液罐的 129Xe 流入容器(图 3C)。
- 通过缓慢拉动阀杆直到柱塞上的流入孔被拉过 O 形圈来密封柱塞阀。孔通过 O 形圈后,立即用手拧紧以密封容器。从液氮中取出容器并使其解冻。
注意:解冻后,容器将加压至 ~4.5 atm(2 atm O2 + 2.5 atm 129Xe)。 - 保护玻璃器皿(例如,将容器插入带衬垫的聚氯乙烯 (PVC) 管容器中, 图 3D)。
注意:如果维护得当,模型可以保持压力十年或更长时间。 - 测量体模的 T1 (例如,使用光谱反演恢复序列)。确认 7 T 扫描仪的 T1 < 2 秒。随时间跟踪信号和 T1 以进行质量保证 (QA)。
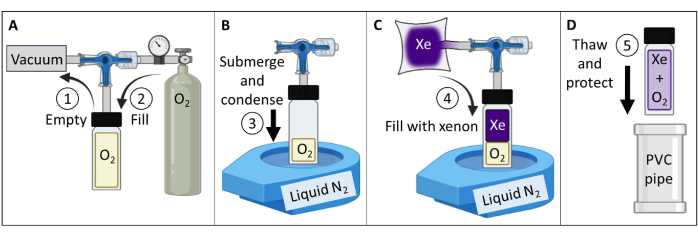
图 3:根据步骤 1.1 中详述的方案引导创建热极化 129Xe 气体模型。 可以改变 O2 和 129Xe 分压以定制 T1 ,以产生适当的 129Xe T1 倍和给定场强84 的信号强度。 请单击此处查看此图的较大版本。
- 使用热极化气体模型进行质量保证(表 1 和图 4)。
- 将 129Xe 线圈置于磁体的等中心,并将 129Xe 气体模型置于线圈内的中心。在单个脉冲和采集序列(“单脉冲”)中,设置工作频率以匹配模型中大约 129Xe 气体频率(7T 时为 ~83.07 MHz)。
- 将采集和激发频率居中到 129Xe Larmor 频率,并将此频率用于所有体模校准和质量控制 129Xe 扫描。有关所有 QA 扫描的实验参数,请参见 表 1 。确认虚拟定位器以虚拟定位器为中心(图 4A)。
- 执行章动实验以校准翻转角度:假设 SNR 足够,使用重复时间 (TR) 间距> 5 x T1 的单个射频脉冲。对于每次采集,逐渐增加 RF 功率,直到信号归零并开始反转。这里使用的标准是: 脉冲数 = 65;TR = 10 秒;脉冲持续时间 = 125 μs;射频功率 = 1-13.8 W,以 0.2 W 为增量
- 傅里叶变换和相位第一个频谱(即以最低 RF 功率获得的频谱)。对所有光谱应用相同的相位。将真实频谱绘制为 RF 脉冲功率的函数(图 4B)。
- 产生零峰的功率(即最小峰高)对应于 180° 翻转角。通过使用相同的功率,以产生 180° 翻转角所需的脉冲长度的一半实现 90° 翻转角。假设扫描仪软件允许,请设置此 90° 参考功率和脉冲长度,以便进行后续的翻转角度缩放。
- 通过最小化 129Xe 光谱 (TR ~ 1 s) 的一半最大值处的全宽,使用单个脉冲进行垫片。如有必要,请在填充后重新调整频率。记录全宽 half max。
- 运行 129Xe QA 扫描(表 1 和 图 4C)。记录 QA 数据:SNR、平均幻象信号和噪声的标准偏差。
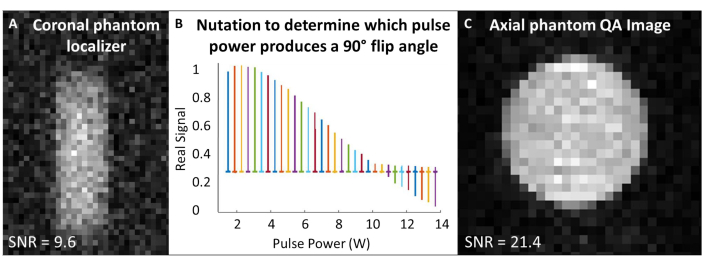
图 4:扫描前质量保证。 (A) 低分辨率 2D GRE 冠状体模定位器可确保体模位于磁体的中心。(B) 设置 90° 脉冲的章动实验显示 180° 脉冲处的零峰。(C) 定位和校准翻转角度后,获取更高分辨率的 2D GRE QA 图像。 请单击此处查看此图的较大版本。
| 协议短手名称 | 序列描述 | TR (毫秒) | TE (毫秒) | 平均值/重复次数 | 翻转角度 (°) | 矩阵大小或 N点 | 视场角 (mm2) | 射频带宽 (kHz) | 切片/板坯厚度 (mm) | 扫描持续时间 |
| 单脉冲 | 脉冲采集 | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 秒 | |||
| Phantom 定位器 | 2D GRE | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 分钟 |
| 翻转角度校准 | 脉冲采集 | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7.5 分钟 | |||
| 129 元谢 QA | 2D GRE | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 分钟 |
表 1:幻象校准质量保证序列参数。 TR = 重复时间,TE = 回波时间,Npts = 点数,FOV = 视场,BW = 带宽。 请点击此处下载此表格。
- 平面极化(图 5A、B)。
- 选择极化 129Xe 体积和积累时间:15 分钟内 400 mL 是该方案的最佳选择(图 5),但也可以很容易地针对其他应用和设备进行调整。
- 假设超极化器内的已知死体积(例如,V死体积 = 80 mL),计算所需分配体积 V 的流速(SLM 中的 FXe)、129Xe 气体分数 f 和累积时间 tacc:
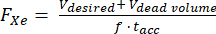 (1)
(1)
注意:虽然较长的生产时间通常会产生更高的偏振,但它们可能不适用于体内成像。为超极化器 85,86,87,88 使用适当的模型来确定平衡生产时间和极化的流速。这里使用了 JW Plummer 等人 89 的模型(图 5A)。这适用于连续流偏振器,但不适用于停流超极化器90。 - 根据这些参数对气体进行极化,使用商用或自制设备测量极化,并将其与 QA 预测的极化进行比较。
- 测量运输过程中的极化损耗。如果极化减少足够大(例如,>10%),请制作一个磁性手提箱以保护运输过程中的极化。参见 补充文件 1:管理运输过程中的极化和 补充图 1。
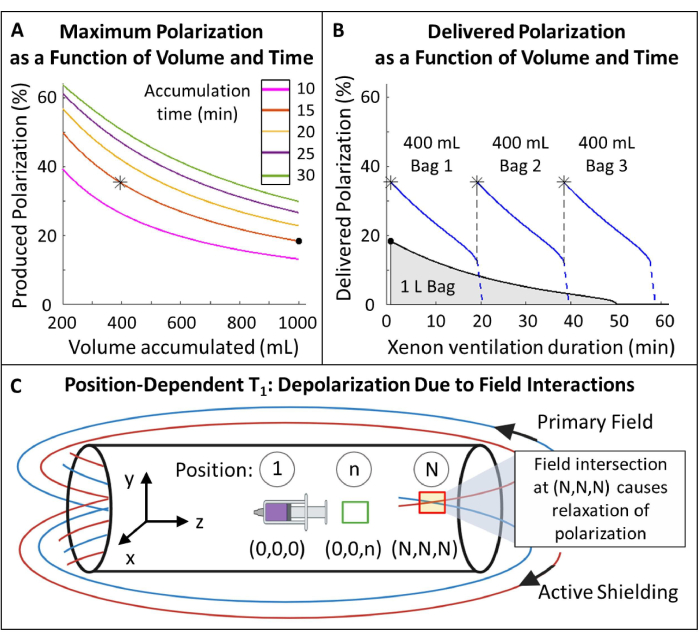
图 5:极化管理。 (A) 极化和产生体积是累积时间和流速的函数。一袋 400 mL 的气体可在 20 分钟内提供高初始极化 (~35%)。虽然使用 1 L 气体可能看起来很有吸引力,但它的初始极化较低 (~20%)。(B) 通风 ~15 分钟后,一批 1 升的 HP 129Xe 将耗尽至 <10% 的极化,而 600 mL 的气体仍为116。因此,使用多个 400 mL 的 129Xe 袋可保持较高的平均输送极化。 C) 主磁场和有源屏蔽场相交的位置(位置 (N,N,N)处的红框)会导致 HP 129Xe 的快速松弛。表征磁体的边缘场有助于确定可以放置 HP 129Xe 储液槽而无需快速松弛的安全区域(位置 (0,0,n) 处的绿色框)。 请单击此处查看此图的较大版本。
补充文件 1:管理运输过程中的极化。请点击此处下载此文件。
- 测量条纹场内 HP 129Xe 的位置依赖性 T1(图 5C)。
- 沿 X、Y 和 Z 尺寸创建相对于磁体等心的已知距离和位置的参考点。标记等中心并标记其他位置 n 到 N。要调查的职位数量将取决于可用空间。
- 超极化 129Xe (~250 mL) 的小体积并将其输送到 MRI 控制室。用 129Xe 填充一个大注射器 (50-100 mL),并将其放置在磁铁内的等中心( 图 1C 中的位置 5)。播放 ~1° 翻转角度脉冲以测量信号。
- 将注射器留在原位 ~10 分钟,然后获取另一个光谱。每 10 分钟重新测量一次信号,直到信号衰减至少 1 T1 (即信号已衰减到其初始值的 ~1/3)。
- 通过重复步骤 1.4.2,使用 129Xe 的新注射器开始新的 T1 实验。
- 将注射器移动到新位置(例如, 图 5C 中的位置 n)并在那里放置 10 分钟。将注射器返回到等中心以获得额外的 ~1° 翻转角光谱。
- 重复此过程:将注射器移至位置 n,等待 10 分钟,将其放回等中心,然后重新测量信号,直到它衰减至少 1 T1。
- 对覆盖 X、Y 和 Z 方向的其余参考位置重复步骤 1.4.4 - 1.4.6。
- 初始信号 (S0) 将在 n 个 RF 脉冲上以 θ 翻转角单指数衰减。将信号 (S) 拟合为条纹场中时间 (t) 的函数,以计算每个位置的 T1 :
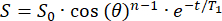 (2)
(2) - 确定具有足够 T1 (>20 分钟)的位置,用于放置 129Xe 储液槽。
- 创建无金属插管插管(图 6)。
- 获得两根带鲁尔接头的静脉留置聚四氟乙烯 (PTFE) 导管。将针头丢弃到锐器处理容器中。
注:对于 >25 g 的小鼠,请使用 18 G 和 20 G 导管。对于较小的动物,请使用 20 G 和 22 G 导管。 - 从导管上剪断 Luer 连接器。将较小的导管送入较大导管的上端,以形成更尖锐的锥形和更长的套管。将复合套管切成 ~4.6 厘米,末端呈斜面,不包括鲁尔底座(图 6A、B)。
- 将 200 μL 移液器吸头较宽的一端剪成 ~2.6 cm 的长度(图 6C)。
- 在移液器吸头内侧涂上通用脱模润滑剂。使用插入内部的另一个移液器吸头将润滑剂稀薄分布。用乙酰氧基硅硫化膏环氧树脂填充移液器吸头(图 6D,E)。
- 用从两端伸出的 22 G 线塞住套管。将套管穿过移液器吸头中的硅胶。将试管伸出移液器吸头末端 ~7 mm(图 6F,G)。
- 将移液器吸头较宽一侧的套管滑过塑料公滑鲁尔接头,将插管与环氧树脂粘合在一起。修剪超出 Luer 连接器的管子(图 6H)。
- 等待环氧树脂干燥(>24 小时),然后小心地从移液器吸头模具中取出硅胶插管套管。从套管上取下电线,确保管子没有被堵塞(图 6I)。
- 为了制作便于插管的手柄,请将管路(1/16 英寸或 1/8 英寸)连接到母鲁尔接头。准备插管时,将此母 Luer 连接器连接到公 Luer 插管。这块可以在插管后轻松分离(图 6J)。
- 每次对动物使用前进行消毒:用 70% 的酒精擦拭套管的外部。用消毒剂擦拭 20 G 电线,然后将电线穿过套管以消毒内部并确保没有堵塞。
- 获得两根带鲁尔接头的静脉留置聚四氟乙烯 (PTFE) 导管。将针头丢弃到锐器处理容器中。
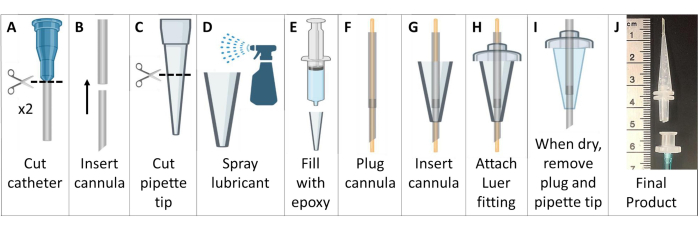
图 6:创建 MRI 和 HP 129Xe 兼容的小鼠插管插管。 这些套管由静脉导管、移液器吸头和硅密封剂构成,如步骤 1.5 所述。 请单击此处查看此图的较大版本。
2. 日常数据收集
注意:请参阅 补充文件 2:临床前扫描 QA 清单。
补充文件 2:临床前扫描 QA 清单。请点击此处下载此文件。
- 完成日常扫描仪质量控制并设置呼吸机(图 4)。
- 使用模型,在扫描仪上运行 QA 协议(有关 QA 扫描参数,请参见 表 1 ,有关日常质量控制步骤,请参见步骤 1.2)。
- 根据 J. Nouls 等人的方法校准呼吸机38。参见 补充文件 3:呼吸机校准、 补充图 2 和 补充图 3。
- 设置呼吸机设置,以便在吸气结束时成像(表 2)。将动物床放在扫描仪架上,将生命支持模块(即机械呼吸机部件)放在扫描仪旁边的桌子上。
- 激活特定于地点的动物加热系统。将加热器设置为 35.5 - 40 °C,打开循环空气,并将空气软管放置在距离动物头部休息位置的 ~5 英寸范围内,以预热扫描仪的孔。
| 通风设置 | 推荐给 HP 129Xe MRI | 笔记 |
| 潮气量 (TV) | 理想体重 8–10 mL/kg | 适度电视;低 TV 需要更高的 BR,这可能会导致图像中出现运动伪影 |
| 呼气末正压 (PEEP) | 2–6 厘米高2O | |
| 呼吸频率 (BR) | 80–120 BR/分钟 | |
| 招募机动 (RM) | ~35 cmH2O,每 5 分钟 6 秒 | |
| 通风持续时间;位置 | < 6 小时;仰卧 | 仰卧位以更好地观察胸部运动 |
| 吸入氧分数 (FIO2) | 0.3–0.5 | 防止麻醉小鼠缺氧 |
| 吸气呼气比 (I:E) | 1:2–1:4 | |
| 吸气至总周期持续时间 | 0.2–0.4 | |
| 分钟通风 | ≥0.57 mL·g-1·min-1 | |
| 我们的标准: | ||
| BR = 80 br/min,吸气持续时间 = 200 ms,FIO2 = 0.3 | ||
| 吸气结束时的成像: 屏气 = 200 毫秒,吸气开始后触发延迟 = 200 毫秒 | ||
| 屏气期间的影像学检查: 屏气 = 250 毫秒,吸气开始后触发延迟 = 250 毫秒 | ||
| 呼气末影像学检查: 屏气 = 200 毫秒,吸气开始后触发延迟 = 650 毫秒 | ||
表 2:129Xe 成像的推荐呼吸机设置。参数可以根据特定的研究目标和实验条件进行微调 117,118,119,120,121,122,123,124。请点击此处下载此表格。
补充文件 3:呼吸机校准。请点击此处下载此文件。
- 镇静和插管动物。
- 将培养箱打开至 27.7 °C 和/或将电加热垫打开至 37.7 °C。 测量并记录动物的体重。根据质量计算镇静剂剂量。典型的给药方案见 表 3 。
- 腹膜内注射镇静剂。记下注射时间并设置下一次镇静剂剂量的计时器。
注意:尽快完成第 2 节(每日数据收集)中的其余步骤,以尽量减少镇静时间和过量风险。 - 将眼睛润滑剂涂抹在动物的眼睛上,并将动物放在笼子里的加热垫上或培养箱内,以防止体温过低。
- 通过在注射镇静剂后 10-15 分钟进行脚趾捏试验来确认动物已完全镇静68。按照 Das 等人 69 中概述的程序插管。
注意:Das 等人 69 的文章附有该技术的全面视频演示。步骤如下: - 用牙齿将动物仰卧挂在倾斜的木板上。使用啮齿动物压舌板拉出舌头。
- 为确保声带可见,通过插管内的光纤电缆或放置在喉咙外侧的强光提供白光。将套管插入声带后不到 5 毫米的位置。
- 确保套管在气管中,而不是在食道中,方法是将其连接到一根里面有一小滴水的管子上。如果水滴随着动物的呼吸及时移动,则位置可能是正确的。
| 代理 | 剂量 | 路线 | 期间 | 评论 | |||
| 吸入剂 | |||||||
| 异氟醚 | 感应:4%–5% 养护: 1%– 3% 或生效 | 吸入 | 在连续流动期间 | • 需要使用校准的蒸发器 | |||
| 注射剂 | |||||||
| 推荐:氯胺酮 + 甲苯噻嗪 + 乙酰丙嗪 | 90 + 9 + 3 毫克/公斤 | 腹腔 | 20 - 60 分钟 | • 易感体温过低 | |||
| • 对于重复给药,建议改用氯胺酮 + 甲苯噻嗪混合物以防止过量 | |||||||
| • 磨损时引起震动。对于成像,请严格遵守给药方案 | |||||||
| • 可能导致心动过缓 | |||||||
| 氯胺酮 + 甲苯噻嗪 | 90 + 9 毫克/公斤 | 腹腔 | 20 - 40 分钟 | • 见上文(氯胺酮 + 甲苯噻嗪 + 乙酰丙嗪) | |||
| 戊巴比妥 | 50 - 70 毫克/公斤 | 腹腔 | 20 - 60 分钟 | • 抑制呼吸频率和运动 | |||
| • 费用可能高昂 | |||||||
| • 可能没有医药级产品 | |||||||
| 免责声明:这些是一般准则。在实施之前,请咨询兽医以获取更多信息。 | |||||||
表 3:小鼠的常见麻醉处方集。请点击此处下载此表格。
- 通风动物(表 2)。
- 通过插管插管上的 Luer 连接器将动物连接到呼吸机上。监测横膈肌运动和吸气峰压(~10-12 cm H2O,潮气量为 10 mL/kg 体重)。如果压力或呼吸动作异常,请根据需要小心调整套管的颈部角度和深度。
- 通过执行肺复张作确保插管气密:防止呼气(例如,用手指堵住呼气口),使动物多次吸气而不呼气。
注意:如果气道压力在 ~6 s 内达到 35 cmH2O 峰值吸气压力,则气道密封足够紧密。如果没有,请参阅故障排除讨论。 - 让恢复正常呼气。在两次扫描之间和不扫描时每 ~5 分钟进行一次肺复张作,以保持肺顺应性并防止肺不张。将 PEEP 阀连接到呼气管路。将 PEEP 设置为 4 cmH2O。观察吸气峰值压力增加该量。
- 成功插管后,围绕镇静剂重新给药计划并初始化 HP 129Xe 的生产,以防止动物在扫描期间醒来。在整个实验过程中监测体温。
- 数据采集:收集通风图像。
注意:数据采集步骤 2.4、2.5 和 2.6 可以按任何顺序完成- 根据 表 2 设置呼吸机,以便在吸气结束时成像。
- 加载以下设置方案:质子动物定位器、以小鼠肺中气体频率为中心的单脉冲和 129Xe 动物定位器。扫描参数见 表 4 。
- 将动物定位在等中心,并确认胸腔位于质子定位视野的中心。如果使用单频线圈,请将质子线圈替换为 129Xe 调谐的射频线圈。
- 记录 129Xe 极化并将其传输到 MRI 扫描仪。参见 补充文件 4:氙气偏振 QA 清单。
- 将一袋 129Xe 放入呼吸机罐中并密封。将罐与呼吸机对齐连接,并让罐加压 (3 - 6 psig)。
- 启动 129Xe 机械通气。每次激活 129Xe 通气时,让动物在开始扫描之前完成 ~5 次呼吸,以翻转肺的功能性残余活量。
注:在 129次 Xe 扫描之间切换到 N2/O2 混合物以节省超极化气体。 - 使用单个脉冲调整工作频率以匹配气态 129Xe 的体内共振频率(7 T 时为 ~83.07 MHz)。将频率复制到所有后续气相 129Xe 扫描。进行 129Xe 定位以确认肺处于等中心。
- 加载并运行 129Xe 径向通气序列。监测吸气峰压。
注意:如果 129Xe 气体在方案完成之前耗尽,则吸气峰值压力将迅速下降。一袋 400 mL 的 129Xe 可以为 30 g 的小鼠通气 ~24 分钟,当以 70% 129Xe 通气时,每分钟 80 次呼吸,潮气量为 10 mL/kg 的理想体重。 - 扫描完成后,切换到使用 N2/O2 混合物通气并取出 129Xe 的空袋。
- 对于呼气结束时的成像,根据 表 2 更改屏气持续时间和触发延迟,然后重复步骤 2.4.2 - 2.4.9。
- 从扫描仪导出原始数据。
| 协议短手名称 | 序列描述 | 触发 | TR (毫秒) | TE (毫秒) | 重复 | 翻转角度 (°) | 矩阵大小或 N点 | 视场角 (mm2) | 射频带宽 (kHz) | 切片/板厚 (mm) | 扫描持续时间 |
| 单脉冲 | 脉冲采集(气相) | 自选 | 1000 | 1 | 60 | 2048 | 10 | 1 秒 | |||
| 动物定位器 | 2D GRE | 是的 | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60 秒 |
| 径向通风 | 3D 多回波径向 | 是的 | 20 | 见标题 | 1 | 30 | 613 | 223 | 32.05 | 30 | 16 分钟 |
| 溶解相单脉冲 | 脉冲采集(溶解相) | 不 | 80 | 1 | 90 | 512 | 10.35 | 80 毫秒 | |||
| 溶解相动态规格 | 脉冲采集(溶解相) | 不 | 50 | 1000 | 90 | 512 | 10.5 | 50 秒 | |||
| 扩散加权 | 2D GRE | 是的 | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18 分钟 |
表 4: 体内 序列参数。 前面39 描述的 3D 多回波桡�通气序列在 6 个回波时间采集图像。显示了第一个回波图像的结果(TE = 1.12 ms, 图 7)。 请点击此处下载此表格。
补充文件 4:氙气偏振 QA 清单。请点击此处下载此文件。
- 数据采集:运行动态溶解相光谱。
- 根据 表 2 设置呼吸机,以便在屏气期间进行成像。将 BR 设置为 100 次呼吸/分钟。按照步骤 2.4.2 - 2.4.5 中准备一个新的 129Xe 袋。
- 启动 129Xe 机械通气。加载并运行单个脉冲以调整工作频率以匹配溶解频率(7 T 时为 ~83.084 MHz)。将工作频率复制到溶解相动态光谱中。
注:这将是具有野生型血红蛋白54 的小鼠的单个峰。 - 加载并运行以动物肺中溶解频率为中心的动态光谱序列。扫描完成后,切换到使用 N2/O2 混合物通气并取出 129Xe 的空袋。从扫描仪导出原始数据。
- 数据采集:收集扩散加权图像。
- 根据 表 2 设置呼吸机,以便在屏气期间进行成像。按照步骤 2.4.2 - 2.4.7 中准备一个新的 129Xe 袋。
- 加载并运行扩散加权序列。扫描完成后,切换到使用 N2/O2 混合物通气并取出 129Xe 的空袋。从扫描仪导出原始数据。
3. 实验结束
- 恢复动物。
- 将插管插管直接从动物的嘴中拉出。如果动物没有立即开始自主呼吸,则进行轻度胸外按压。如果可用,在动物面部附近施用少量医用级氧气,以支持镇静恢复。
- 一旦动物自行稳定呼吸,如果动物被镇静 >2 小时,皮下注射 0.5 - 1 mL 生理盐水以防止脱水。
- 将动物自行放回笼子中。将笼子放在培养箱或加热垫上。
注意:镇静动物容易受到同类相食的影响,在完全恢复(即独立行走)之前不能与笼子伴侣一起放入笼子中。镇静的动物无法调节体温。每隔几分钟用手背感受一次动物的温度。 - 密切监测动物,直到它们的扶正反射恢复(即,它可以独立地从仰卧位翻转到俯卧位)。
- 一旦动物可以独立行走,就将动物从热支持中移开。将动物与其笼子伙伴一起放回笼子里。
注意:如果动物没有笼子伴侣,它更容易受到镇静诱导的体温过低的影响。为动物提供额外的床上用品,如果有的话,将动物放在保温箱中过夜。 - 每周记录一次动物的体重,持续 2 周,以监测其健康状况。
注意:如果动物因插管而对口腔或食道造成伤害,它可能会停止进食。如果动物减轻了初始体重的 >20%,请咨询兽医有关安乐死的知识。
- 分析通风图像(图 7)。
- 将原始数据加载到编程平台中。下载用于非笛卡尔图像91 的开源重建框架。
- 根据开源框架说明重建镜像。规格化每个径向投影上的第一个点39。
- 分割图像中的肺实质,包括具有低 129 Xe 信号或无 129Xe 信号的体素。不包括大型气道。分割图像中的背景噪声,不包括肺、气道和成像伪影。
注意:质子定位器图像可以帮助确定实质边界。 - 使用以下公式计算 SNR :
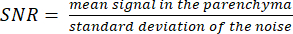 (3)
(3) - 量化通气缺陷。
注意:已经提出了各种方法来量化小动物模型中的通气障碍。分析方法仍然是一个开放的研究领域,但易于实施的方法包括:(i) 半定量手动分割92,(ii) 使用来自气管的信号使实质信号正常化的直方图方法47,以及 (iii) 分割总肺容积 (TLV) 并定义信号阈值(例如,<整个肺平均值的 60%)将肺分为缺陷体积和通气肺容积 (VV)。根据以下标准定量 VDP 93,94:
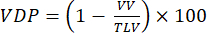 (4)
(4)
- 分析溶解相动态光谱(图 8)。
- 将原始数据加载到编程平台中。执行快速傅里叶变换并对光谱进行相位(对于此应用程序,同时手动、零阶光谱相位就足够了。
- 计算标准核磁共振 (NMR) 数据95,96:SNR、全宽半峰、积分面积、化学位移和两个峰的相位。
- 根据幅度数据,将每次重复的溶解光谱的信号幅度除以气体光谱的信号幅度,以求出随时间变化的溶解与气体比率。
- 分析扩散加权图像(图 9)。
- 将原始数据加载到编程平台中。如步骤 3.2.3 所示,分割 b0 图像的肺实质。计算每个 b 值图像的 SNR。
- 通过将 b0 图像的每个体素中的信号除以图像噪声的标准差来计算信噪比 SVNR0。排除 SVNR为 0 <图像杂色97 的 2.5 倍的体素。
注意:SVNR0 是单个体素指标,而实质 SNR 是全肺指标。 - 根据公式 598,99 拟合 b 值 (bi) 上的信号衰减,从而计算 ADC:
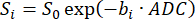 (5)
(5)
Access restricted. Please log in or start a trial to view this content.
结果
通风图片
如果正确实施动物准备和通气程序,3D 径向成像可以在吸气或呼气时进行数据采集时成功捕获通气模式(图 7)。虽然这些图像是通过多次呼吸收集的,但此处描述的方法类似于人类使用的单次呼吸成像方法。这是因为 k 空间的所有线都是在呼吸周期的特定时间收集的(例如,都在吸气结束时),累积创建...
Access restricted. Please log in or start a trial to view this content.
讨论
超极化 129Xe MRI 正在成为一种复杂而强大的技术,用于研究小动物模型中的肺微观结构和功能。该协议旨在指导初始站点准备,并描述使用 HP 129Xe 量化小鼠肺部通气、扩散和气体交换所需的实验程序。实验的关键先决条件包括建立 129Xe 气体模型并确保将高气体极化输送到动物。后者需要仔细规划极化参数,减轻气体运输过程中的极化损耗(例如?...
Access restricted. Please log in or start a trial to view this content.
披露声明
Peter Niedbalski 是 Polarean Imaging, Plc 的顾问。
致谢
作者对 Jerry Dalke 成为呼吸机制造的指路明灯表示衷心的感谢。我们要感谢 Carter McMaster 酿造 HP 129Xe 气体。我们还要感谢 Matthew Willmering 博士和 Juan Parra-Robles 博士进行的发人深省的科学讨论。使用 BioRender.com 创建的图窗。这项工作由美国国立卫生研究院资助(资助号:NHLBI R01HL143011,R01HL151588)
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
参考文献
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , Geneva. (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042(2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25(2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475(2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091(2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702(2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159(2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302(2020).
- Akinyi, T. G. An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , University of Cincinnati. Master's thesis (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441(2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713(2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035(2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029(2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831(2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23(2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251(2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , Churchill Livingstone. 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318(2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269(2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30(2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201(2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11(2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845(2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. Magnetic Resonance Imaging: Physical Principles and Sequence Design. , Wiley. (2014).
- Levitt, M. H. Spin Dynamics: Basics of Nuclear Magnetic Resonance. , Wiley. (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639(2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147(2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527(2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419(2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559(2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , Treasure Island, FL. (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。