A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
MRI ריאות היפרפולריזציה 129Xe וספקטרוסקופיה בעכברים מאווררים מכנית
In This Article
Summary
MRI קסנון היפר-פולרי יכול לכמת מיקרו-מבנה ריאה אזורי (ממדי אוויר-חלל) ופיזיולוגיה (אוורור וחילופי גזים) במחקר תרגומי וטיפול קליני. למרות שהוא מאתגר, הוא יכול לספק תובנות ריאתיות דומות במחקרים פרה-קליניים. פרוטוקול זה מתאר את התשתית והנהלים הדרושים לביצוע MRI ריאות קסנון שגרתי בעכברים.
Abstract
קסנון-129 (129Xe) היפרפולריזציה (HP) הוא חומר ניגוד הדמיית תהודה מגנטית בשאיפה (MRI) בעל תכונות ספקטרליות ופיזיקליות ייחודיות שניתן לנצל כדי לכמת פיזיולוגיה ריאתית, כולל אוורור, דיפוזיה מוגבלת (גודל מרחב אווירי) וחילופי גזים. בבני אדם, הוא שימש להערכת חומרת המחלה והתקדמותה במגוון הפרעות ריאה ומאושר לשימוש קליני בארצות הברית ובבריטניה. מעבר ליישומים הקליניים שלו, היכולת של 129Xe MRI להעריך באופן לא פולשני פתופיזיולוגיה ריאתית ולספק מידע שנפתר מרחבית היא בעלת ערך למחקר פרה-קליני. מבין מודלים של בעלי חיים, עכברים הם הנפוצים ביותר בשל הנגישות של מודלים של מחלות מהונדסות גנטית. כאן, 129Xe MRI מבטיח כטכניקה זעיר פולשנית, נטולת קרינה ורגישה לניטור אורך של התקדמות מחלת ריאות ותגובה לטיפול (למשל, בגילוי תרופות). טכניקה זו יכולה להרחיב ליישומים פרה-קליניים על ידי שילוב מכשיר נשימה חופשית המופעל על ידי MRI או מכונת הנשמה מכנית להעברת גז. כאן, אנו מתארים את השלבים ומספקים רשימות בדיקה כדי להבטיח איסוף וניתוח נתונים חזקים, כולל יצירת פנטום גז קסנון מקוטב תרמית לבקרת איכות, אופטימיזציה של קיטוב, טיפול בבעלי חיים (טשטוש, אינטובציה, אוורור וטיפול בעכברים), ופרוטוקולים לאוורור, דיפוזיה מוגבלת ונתוני חילופי גזים. בעוד שניתן ליישם MRI פרה-קליני 129Xe במודלים שונים של בעלי חיים (למשל, חולדות, חזירים, כבשים), פרוטוקול זה מתמקד בעכברים בשל האתגרים שמציבה האנטומיה הקטנה שלהם, המאוזנים על ידי סבירותם וזמינותם של מודלים רבים של מחלות.
Introduction
בעוד שהפרעות ריאה נותרו הגורמים המובילים לתחלואה ותמותה עולמית, בעשור האחרון נרשמו שיפורים דרמטיים בתוצאות המטופלים. שיפורים אלה מונעים בחלקם על ידי שני גורמים. ראשית, ניסויים קליניים שלב III מתעדפים כעת שינויים בתפקוד הריאות כנקודות קצה ולא תמותה, ומאיצים את ניסויי התרופות 2,3,4,5. שנית, התקדמות במודלים משופרים של בעלי חיים סיפקה תובנות לגבי מנגנוני מחלה וסייעה בפיתוח טיפול 6,7. מודלים של עכברים מועדפים לעתים קרובות למחקר תרגומי מכיוון שהם מציעים הקבלות פיזיולוגיות לבני אדם, סבירות והתפתחות מהירה של מחלות. ההנדסה הגנטית הרחיבה את מגוון ואיכות המודלים הזמינים, כאשר משאב זני העכברים הבינלאומי מתהדר כעת ביותר מ-32,000 זני עכברים8, בהשוואה ל-4,218 זני חולדות בלבד (מאגר גנום העכברים9). מודלים אלה פתחו אפיקים חדשים לחקירת מניעים מכניסטיים ותגובות טיפוליות למגוון מחלות ריאה, כולל מחלת ריאות חסימתית כרונית (COPD)10, סיסטיק פיברוזיס (CF)11, פיברוזיס ריאתי12,13, יתר לחץ דם ריאתי14,15 ואסטמה16.
למרבה הצער, מחקר ריאות הכולל עכברים מוגבל על ידי הטכניקות הזמינות לכימות נטל המחלה. מחקרים מסתמכים לעתים קרובות על נהלים סופיים אשר 1) מספקים מידע על כל הריאה (מבחנים ביוכימיים) או מידע מקומי (היסטולוגיה) ו-2) דורשים עיצובי חתך וגדלי מדגם גדולים. לפיכך, הם אינם לוכדים דינמיקה מרחבית או זמנית של מחלה. לעומת זאת, הדמיה תלת מימדית לא פולשנית יכולה להעריך מבנה, תהליכים מולקולריים ותפקוד בריאות לאורך זמן.
ניתן לדמיין את מבנה הריאות (למשל, הפרעות בדרכי הנשימה ופיברוזיס אינטרסטיציאלי) באמצעות MRI קצר במיוחד (UTE) וטומוגרפיה מיקרו-ממוחשבת (μCT) ברזולוציה גבוהה. ניתן להשיג מידע פונקציונלי ומכניסטי (למשל, אוורור, זלוף, מטבוליזם של גידול ותהליכים דלקתיים) באמצעות חומרי ניגוד אקסוגניים (למשל, CT משופר קסנון ו-UTE משופר חמצן) וגישות רפואה גרעינית מייננות (כלומר, טומוגרפיה של פליטת פוזיטרונים [PET], וטומוגרפיה ממוחשבת של פליטת פוטון יחיד [SPECT]). עם זאת, הדמיה פונקציונלית מאתגרת בשל הניגודיות הצנועה לרעש (במיוחד עבור UTE משופר חמצן בעוצמות השדה המגנטי הגבוהות המשמשות ל-MRI פרה-קליני, כאשר T1 מתארך) הזמין ללא שימוש בשיטות מייננות עם רמות קרינה גבוהות מהרגיל. בעוד שהדמיה בשיטות אלה נסבלת היטב במודלים של בעלי חיים המשתמשים במינונים קונבנציונליים, קרינה מצטברת עלולה לבלבל את התוצאות במחקרים על אימונולוגיה, דלקת וסרטן ריאות17. עם זאת, הדמיית תהודה מגנטית (MRI) קסנון-129 (129Xe) היפרפולרית (HP) מספקת מידע מבני ותפקודי זעיר פולשני, לא מקרין ורגיש ביותר. בעוד שטכניקה זו שימשה במחקר פרה-קליני כדי לאפיין מצבים הכוללים אמפיזמה18,19, פיברוזיס20, סרטן ריאות21, COPD22 ופגיעה ריאתית הנגרמת על ידי קרינה23 בנקודות זמן בודדות או מרובות, היא נותרה לא מנוצלת בסביבה הפרה-קלינית.
כדי לאפשר MRI 129Xe שגרתי ופרה-קליני, נדרשים מספר תנאים מוקדמים, כולל תמיכה רגולטורית מוסדית, מכשיר היפרפולריזציה, סליל תדר רדיו (RF) מכוון Xe 129וסורק בעל יכולת גרעינית רב-גרעינית. למרות שיישומים מתקדמים 24,25,26,27,28,29,30,31,32,33 דורשים תכנות פולסים ספציפי לספק שנמצא מחוץ לתחום של פרוטוקול זה, ניתן להשיג יישומים בסיסיים עם שינויי תוכנה צנועים. לכן, אנו מתמקדים בבקרת איכות, טיפול במגנטיזציה, איסוף נתונים והליכי טיפול בבעלי חיים - כולל הנשמה מכנית - שהם ייחודיים ל-MRI פרה-קליני 129Xe (איור 1).
עד כה, הדמיית Xe של בעלי חיים קטנים השתמשהבשלוש גישות להעברת גז בטוחות MR, כל אחת עם יתרונות וחסרונות: נשימה חופשית, מונעת בוכנה וירידת לחץ. נשימה חופשית מאפשרת שאיפה ספונטנית ללא סיכון לפציעה מאינטובציה או טרכאוסטומיה, אך צורכת הרבה יותר גז HP ויכולה להכניס חפצי תנועה 34,35. מכשירים מונעי בוכנה מסחריים הם כיול עצמי וקלים לשימוש מחוץ לקופסה, אך עשויים להיות יקרים להחריד36. הגישה המבוססת על ירידת לחץ המשמשת כאן מתוארת היטב בספרות, מודולרית, ניתנת להתאמה אישית ומופעלת על ידי קוד פתוח 37,38,39,40. יתר על כן, הוא חסכוני, בדרך כלל מסתכם בפחות מ-10,000 דולר וכמה שבועות של זמן בנייה ייעודי. מאוורר ירידת הלחץ מספק 129Xe משקית מינון בתוך מיכל בלחץ תוך ניטור לחץ דרכי הנשימה של עכבר עם אינטובציה.
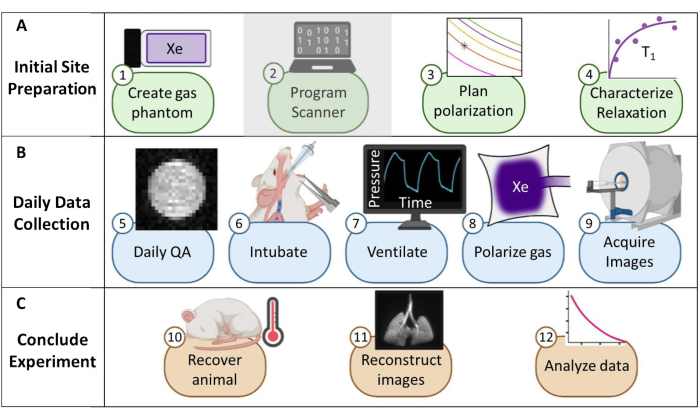
איור 1: סקירה כללית של הפרוטוקול לאיסוף הדמיית תהודה מגנטית (MRI) שגרתית של קסנון-129 (129Xe) בעכברים. (A) שלבים להגדרה ראשונית. (הערה: תכנות הסורק הוא ייחודי לכל ספק ואינו מתואר בפרוטוקול זה). (ב) שלבים לאיסוף אבטחת איכות יומית (QA) ונתונים על בעלי חיים. (ג) שלבים לסיום מוצלח של ניסוי וניתוח נתונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
כאן, אנו אוספים ומנתחים את שלושת הסוגים הנפוצים של נתוני 129Xe MRI: אוורור, הדמיה משוקללת דיפוזיה (גודל מרחב אווירי מכתשית) וחילופי גזים. תמונות אוורור מתארות את התפלגות גז 129Xe שנשאף. אזורים בריאות עם זרימת אוויר מופחתת נראים כהים בתמונות גז HP, והפתולוגיה מכומתת על ידי נפח האוורור הפגום. בבני אדם, אחוז פגם האוורור (VDP) הראה יכולת חזרה חזקה41,42 ורגישות גבוהה לחסימת ריאות במחלות כמו COPD 43,44,45 ואסטמה 46,47.
ניתן למדוד את הדיפוזיה המוגבלת של 129אטומי Xe במרחב האווירי באמצעות מקדם הדיפוזיה לכאורה (ADC) ומשמש כתחליף לגודל חלל האוויר. ה-ADC מחושב על ידי רכישת תמונת בסיס (b0) ללא שקלול דיפוזיה ותמונה אחת או יותר שנרכשו בנוכחות שקלול דיפוזיה המושרה על ידי שיפוע דו קוטבי (bN). ADC מוגבה משקף עלייה בגודל המרחב האווירי עקב הזדקנות או שיפוץ אמפיזמטי18,48. יתר על כן, שימוש בתמונות מרובות של ערך b (≥4) מאפשר לחשב מידע מורפומטרי מפורט יותר (למשל, יירוט ליניארי ממוצע)49,50.
ניתן לאפיין את חילופי הגזים עקב 1) המסיסות של 129Xe ברקמת הממברנה הנימים, הפלזמה וה-RBCs (כדוריות דם אדומות) ו-2) השינוי הכימי של >200 ppm במורד השדה של 129Xe כאשר הוא מומס בתאים אלה. הן נתונים ספקטרוסקופיים והן נתוני הדמיה מספקים תובנה לגבי מחלות לב ריאה (למשל, יתר לחץ דם ריאתי ואי ספיקת לב שמאלית 51,52,53). בעוד שמינים רבים (בני אדם, כלבים וחולדות) מציגים פסגות ספקטרליות ייחודיות שמקורן בכל תא, לעכברים חסר אות RBC ייחודי עקב הבדלים באינטראקציות אתר קשירה של המוגלובין-קסנון. במקום זאת, כל הרכיבים המומסים משולבים לאות יחיד בעכברים54. עם זאת, ניתן להבחין בתהודה מובהקת של RBC בעכברים טרנסגניים המבטאים המוגלובין אנושי, כמו אלה המשמשים במודלים של מחלת תאי חרמש54. בסך הכל, ספקטרוסקופיה והדמיה מומסת 129Xe מספקות תובנות ייחודיות לגבי פתופיזיולוגיה של לב ריאה בעכברים55,56.
לפני שתנסה פרוטוקול זה, יש צורך להבין מידע רקע על סורק ה-MRI, אוורור מכני וטכניקות טיפול בעכבר הנדרשות למחקרי עכברים. לפני תחילת ניסויים בבעלי חיים, כל ההליכים חייבים להיות מאושרים על ידי הוועדה המוסדית המקומית לטיפול ושימוש בבעלי חיים (IACUC)57. מכיוון שהמומנט המגנטי הכולל הזמין בריאה של העכבר נמוך באופן מהותי (כלומר, נפח גאות ~ 250 מיקרוליטר), גודל הווקסל חייב להיות קטן פי 1000 מאשר בבני אדם כדי להשיג רזולוציה שווה ערך מבחינה אנטומית. קצב הנשימה של העכברים גם הוא מהיר במיוחד (>100 נשימות לדקה). ככזה, הליכי עצירת נשימה בודדת המשמשים בדרך כלל להדמיה אנושית אינם ניתנים לביצוע. במקום זאת, ניתן ליישם רק כמה עירורי RF בתוך כל נשימה, כך ש-129תמונות Xe חייבות להיות מקודדות על פני עשרות עד מאות נשימות. ייתכן שיידרש תכנות פולסים כדי לאפשר הפעלה חיצונית של רכישות ולולאה נכונה של פרוסות, קידודי פאזה ו/או תמונות משוקללות דיפוזיה תוך איזון יחס אות לרעש (SNR), רזולוציה ומשך הסריקה. כאן, המאוורר מוציא פולס לוגי טרנזיסטור-טרנזיסטור (TTL) פעם אחת בכל נשימה כדי להפעיל קליטת נתונים (איור 2).
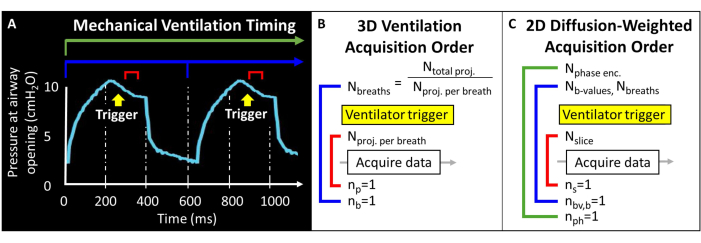
איור 2: אוורור מכני מייצג ותזמון קליטת נתונים. (א) אוורור מבוקר על ידי המשתמש יכול לעורר רכישת נתונים בהשראה סופית, במהלך עצירת הנשימה או בסוף התפוגה. (ב) עבור רצף אוורור רדיאלי תלת-ממדי זה, המשתמש מגדיר את המספר הכולל של הקרנות שנרכשו ואת מספר ההקרנות לנשימה. (C) לתמונה סלקטיבית של פרוסות ומשקללת דיפוזיה דו-ממדית, המשתמש מגדיר את סדר הפרוסות, תמונות עם ערך b וקידוד פאזה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
כדי לאפשר אוורור אמין ואספקת 129Xe, נדרשים הליכי טשטוש ואינטובציה חזקים. עבור כל מחקר, יש לקחת בחשבון את ההשפעות במורד הזרם של כל חומר הרדמה - כולל שינויים באוורור זעיר, קצב לב (HR) ולחץ דם 58,59,60,61,62,63,64,65,66. בעוד שמגוון תרופות הרגעה שימשו ל-MRI גז פרה-קליני של HP, אנו משתמשים בתערובת של קטמין, קסילזין ואצפרומזין, בשל זמינותו, עלות-תועלת, אמינותו ומשך הזמן שלו67,68. לאחר ההרדמה, יש להחדיר את בעלי החיים לאוורור מכני יעיל. אינטובציה של עכברים קשה בגלל הגודל הקטן של האנטומיה שלהם, ולכן חשוב להתאמן היטב בטכניקה זו. אנו מעודדים את החוקרים לעיין בפרוטוקולי וידאו שפורסמו69,70. מכיוון שרוב צינוריות האינטובציה המסחריות מכילות נירוסטה, אנו מציגים טכניקה ליצירת צינוריות נטולות מתכת (כלומר, תואמות MRI וגז HP), בצורת טריז שניתן להתאים אישית כך שיתאימו לקוטר דרכי הנשימה כדי ליצור אטימה אטומה עם דופן קנה הנשימה של העכבר.
מכיוון ש-129תמונות Xe נאספות על פני נשימות רבות, הגדרות מכונת ההנשמה הן קריטיות. יש לשקול בזהירות אסטרטגיות אוורור מגן כדי למנוע פגיעה ריאתית 71,72,73,74. בפרט, השימוש בנפח גאות נמוך (TV), לחץ נשיפה חיובי מתון (PEEP) ותמרוני גיוס מכתשית (RMs) מפחיתים את הסיכון לפגיעה ריאתית הנגרמת על ידי מכונת הנשמה בחולים אנושיים ובמודלים של בעלי חיים 75,76,77,78,79,80,81. כאן, אנו ממליצים על טכניקה פשוטה התואמת לאוורור מכני של 129Xe עם ירידת לחץ המגן ומספק מספיק 129Xe תמונה SNR. באופן ספציפי, אנו מיישמים PEEP על ידי הוספת שסתום PEEP מסחרי לקו הנשיפה של מכונת ההנשמה. כדי לבצע RMs, יש לסגור את קו הנשיפה כך שהחיה תקבל שאיפות מרובות ללא נשיפה עד להגעה ללחץ ומשך המטרה.
לאורך כל הדרך, אנו מספקים הגדרות אוורור כלליות, אך מומלץ לסקור את הספרות כדי להתייחס ליעדי המחקר הספציפיים82,83. בנוסף לניטור שיא לחץ השאיבה במהלך אוורור מכני, חשוב לנטר את טמפרטורת החיה, שניתן לעשות זאת בשיטות ניטור טמפרטורת עכבר סטנדרטיות. למרות שאינו נדרש להדמיה, ניטור דופק באמצעות אלקטרוקרדיוגרמה (ECG) יכול להיות יתרון; א.ק.ג יכול להצביע אם בעל חיים מתעורר מהרגעה, ממנת יתר או ממצוקה, מה שמאפשר לחוקר להתערב.
הפרוטוקול שאנו מתארים נועד לאסוף 129נתוני אוורור רדיאלי תלת-ממדישל Xe 61, נתונים משוקללים של דיפוזיה GRE דו-ממדית76 ונתוני חילופי גזים ספקטרוסקופיה דינמית של רכישת דופק. פרוטוקול זה נועד לגשר על הפער בין מחקר פרה-קליני במודלים של בעלי חיים קטנים לבין הפוטנציאל של 129Xe MRI לקדם את ההבנה שלנו של הפרעות ריאה.
Protocol
כל השיטות המתוארות כאן אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של המרכז הרפואי לילדים בסינסינטי.
1. הכנת האתר הראשונית
- צור ובדוק פנטום גז 129Xe מקוטב תרמית (איור 3).
- השג כלי זכוכית בורוסיליקט (~60 מ"ל), שסתום בוכנה עם טבעת O איטום קדמית וגזע זכוכית בורוסיליקט טחון, כולם מדורגים עד 150 psig. ודא שאין חלקים מגנטיים. חבר אביזר דחיסה לגבעול הזכוכית. הדק כדי לייצר אטימה אטומה לגז.
- חבר את הכלי למשאבת ואקום ומאגר חמצן לפי איור 3A. כלי ואקום ללחץ מוחלט של פחות מ-100 mTorr.
- מלאו את הכלי בחמצן בלחץ של 1.5 אטמוספירה כדי להפחית את ה-129Xe T1 מ-> 30 דקות ל-~2 שניות (בעוצמת שדה מגנטי של 7 T; עבור סורק 9.4 T, השתמש בחמצן 1.6 אטמוספירה). כלי חותם.
הערה: עבור עוצמות שדה גבוהות יותר, יידרש לחץ חלקי חמצן גבוה במקצת כדי להשיג T1≤ 2 שניות84. - מלאו מאגר אטום לגז ב-400 מ"ל קסנון מועשר איזוטופי (85% 129Xe).
הערה: ניתן להשתמש גם בקסנון בשפע טבעי (26% 129Xe), אך יהיה צורך להגדיל את הפחתה של האותות כדי להפחית את ההפחתה של ~פי 3 ב-SNR. - חבר את הכלי למאגר של 129Xe. צינורות ואקום ללחץ מוחלט של פחות מ-100 mTorr.
- מלאו נוזל ספסל בפה פתוח N2 Dewar עד ~90%. טבלו את תחתית הכלי (~5 ס"מ) בחנקן נוזלי כדי לעבות את O2 וליצור ואקום (איור 3B). בעודו שקוע, פתח את השסתום כדי לאפשר ל-129Xe מהמאגר לזרום לתוך הכלי (איור 3C).
- אטום את שסתום הבוכנה על ידי משיכה איטית של הגבעול עד שחור הזרימה בבוכנה נמשך מעבר לטבעת ה-O. מיד לאחר שהחור עבר את טבעת ה-O, הדק את היד כדי לאטום את הכלי. הסר את הכלי מחנקן נוזלי ואפשר לו להפשיר.
הערה: לאחר ההפשרה, הכלי ילחץ ל~4.5 אטמוספירה (2 כספומטים O2 + 2.5 כספומט 129Xe). - הגן על כלי זכוכית (למשל, הכנס כלי במיכל צינור פוליוויניל כלוריד מרופד (PVC), איור 3D).
הערה: אם הוא מתוחזק כראוי, הפנטום יכול לשמור על לחץ במשך עשור או יותר. - מדוד את ה-T1 של הפנטום (למשל, באמצעות רצף התאוששות היפוך ספקטרוסקופי). אשר את T1 < 2 שניות עבור סורקי 7 T. עקוב אחר אות ו-T1 לאורך זמן לאבטחת איכות (QA).
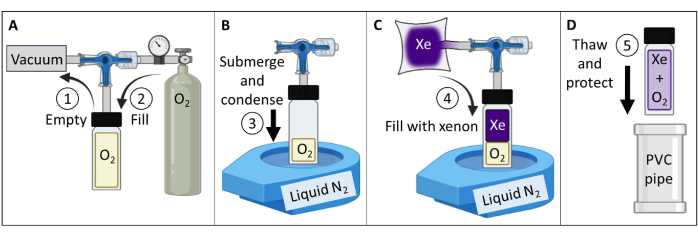
איור 3: יצירת פנטום גז 129Xe מקוטב תרמית המונחה על ידי הפרוטוקול המפורט בשלב 1.1. ניתן לשנות את הלחצים החלקיים של O2 ו-129Xe כדי להתאים אישית את ה-T1 כך שיניב 129Xe T1 פעמים ועוצמת אות בעוצמת שדה נתונה84. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- בצע אבטחת איכות עם פנטום הגז המקוטב תרמית (טבלה 1 ואיור 4).
- הנח את סליל 129Xe במרכז המגנט ומרכז את פנטום הגז 129Xe בתוך הסליל. ברצף דופק ורכישה יחיד ("דופק יחיד"), הגדר את תדר העבודה כך שיתאים לתדר הגז המשוער של 129Xe בפנטום (~83.07 מגה-הרץ ב-7T).
- מרכז את תדרי הקליטה והעירור לתדר 129Xe Larmor, והשתמש בתדר זה עבור כל סריקות כיול הפנטום ובקרת האיכות 129Xe. ראה טבלה 1 לפרמטרים ניסיוניים עבור כל סריקות ה-QA. ודא שהפנטום ממורכז עם לוקלייזר פנטום (איור 4A).
- בצע ניסוי נוטציה כדי לכייל את זווית ההיפוך: בהנחה ש-SNR מספיק, השתמש בפולסים בודדים של RF עם מרווח זמן חזרה (TR) >-5 x T1. עבור כל רכישה, הגדל בהדרגה את עוצמת ה-RF עד שהאות מתבטל ומתחיל להתהפך. התקן המשמש כאן הוא: מספר פולסים = 65; TR = 10 שניות; משך הדופק = 125 מיקרון; הספק RF = 1-13.8 וואט, גדל ב-0.2 וואט
- פורייה מתמיר ופאזה את הספקטרום הראשון (כלומר, הספקטרום הנרכש עם הספק ה-RF הנמוך ביותר). החל את אותו שלב עבור כל הספקטרום. שרטטו את הספקטרום האמיתי כפונקציה של עוצמת פולס ה-RF (איור 4B).
- ההספק שמייצר שיא אפס (כלומר, גובה שיא מינימלי) מתאים לזווית ההיפוך של 180°. השג זווית היפוך של 90° על ידי שימוש באותו כוח במחצית אורך הדופק הדרוש להפקת זווית היפוך של 180°. בהנחה שתוכנת הסורק מאפשרת, הגדר את עוצמת הייחוס ואורך הדופק של 90° עבור קנה המידה של זווית ההיפוך שלאחר מכן.
- השתמש בפולס בודד כדי להחליק על ידי מזעור הרוחב המלא במחצית המקסימום של ספקטרום 129Xe (TR ~ 1 שניות). במידת הצורך, מרכז מחדש את התדר לאחר החלקה. הקלט את חצי הרוחב המרבי במלואו.
- הפעל את סריקת 129Xe QA (טבלה 1 ואיור 4C). רשום נתוני QA: SNR, אות פנטום ממוצע וסטיית תקן של הרעש.
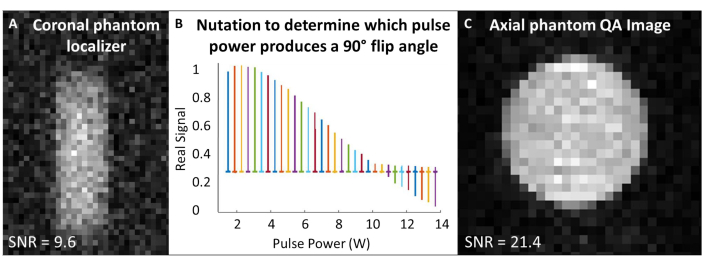
איור 4: אבטחת איכות טרום-סריקה. (A) לוקלייזר פנטום קורונלי 2D GRE ברזולוציה נמוכה מבטיח שהפנטום מרוכז במגנט. (B) ניסוי נוטציה להגדרת פולס של 90 מעלות מראה שיא אפס בפולס של 180 מעלות. (C) לאחר לוקליזציה וכיול של זווית ההיפוך, רכוש תמונת 2D GRE QA ברזולוציה גבוהה יותר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| שם מקוצר של פרוטוקול | תיאור רצף | ת"ר (אלפיות השנייה) | TE (ms) | ממוצעים / חזרות | זווית היפוך (°) | גודל מטריקס או Nנקודות | FOV (מ"מ2) | RF שחור-לבן (kHz) | עובי פרוסה / לוח (מ"מ) | משך הסריקה |
| דופק יחיד | רכישת דופק | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 שניות | |||
| לוקלייזר פנטום | GRE דו-ממדי | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 דק' |
| כיול זווית היפוך | רכישת דופק | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7.5 דק' | |||
| 129Xe QA | GRE דו-ממדי | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 דק' |
טבלה 1: פרמטרים של רצף אבטחת איכות של כיול פנטום. TR = זמן חזרה, TE = זמן הד, Nנקודות = מספר נקודות, FOV = שדה ראייה, BW = רוחב פס. אנא לחץ כאן להורדת טבלה זו.
- תכנן קיטוב (איור 5A, B).
- בחר נפח וזמן צבירה של 129Xe מקוטב: 400 מ"ל ב-15 דקות הוא אופטימלי עבור פרוטוקול זה (איור 5) אך ניתן לכוונן אותו בקלות עבור יישומים וציוד אחרים.
- בהנחה שנפח מת ידוע בתוך ההיפרפולרייזר (למשל, Vנפח מת = 80 מ"ל), חשב את קצב הזרימה (FXe ב-SLM) עבור נפח V מחולק רצוי, 129Xe שבר גז f וזמן הצטברות tacc:
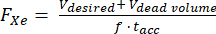 (1)
(1)
הערה: בעוד שזמני ייצור ארוכים יותר יניבו בדרך כלל קיטוב גבוה יותר, ייתכן שהם לא יהיו מעשיים עבור הדמיה in vivo. השתמש במודל מתאים עבור ההיפרפולרייזר 85,86,87,88 כדי לקבוע קצב זרימה שיאזן את זמן הייצור והקיטוב. כאן נעשה שימוש במודל של J. W. Plummer et al.89 (איור 5A). זה חל על מקטבים בזרימה רציפה ואינו חל על היפרפולרייזרים בזרימה עצורה90. - לקטב גז לפי פרמטרים אלה, למדוד את הקיטוב באמצעות מכשיר מסחרי או ביתי ולהשוות אותו לקיטוב החזוי עבור QA.
- מדוד את אובדן הקיטוב במהלך ההובלה. אם הקיטוב יורד בכמות גדולה מספיק (למשל, >10%), בנה תיק נשיאה מגנטי כדי להגן על הקיטוב במהלך ההובלה. ראה קובץ משלים 1: ניהול קיטוב במהלך תחבורה ואיור משלים 1.
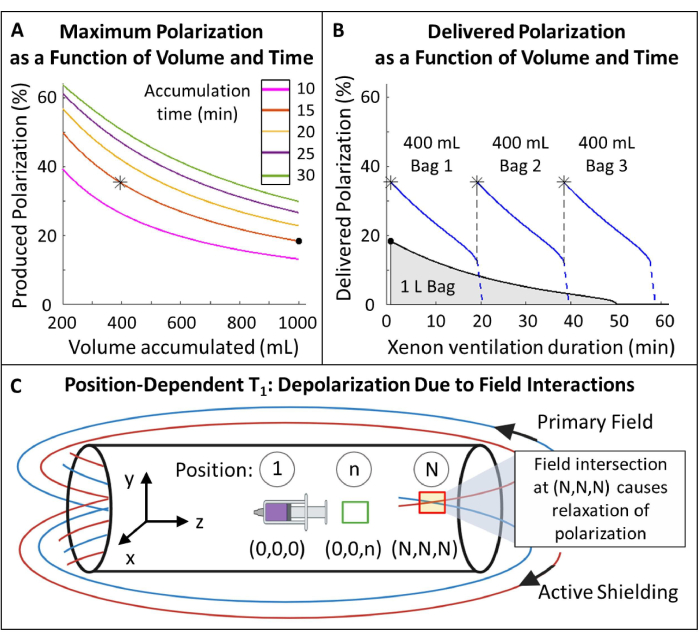
איור 5: ניהול קיטוב. (A) קיטוב ונפח מיוצר הם פונקציה של זמן הצטברות וקצב זרימה. שקית גז של 400 מ"ל מספקת קיטוב ראשוני גבוה (~35%) במשך 20 דקות. בעוד ששימוש ב-1 ליטר גז עשוי להיראות אטרקטיבי, יהיה לו קיטוב ראשוני נמוך יותר (~20%). (B) לאחר ~15 דקות של אוורור, אצווה של 1 ליטר של HP 129Xe תתרוקן ל-<10% קיטוב בעוד ש-600 מ"ל גז יישארו116. לפיכך, שימוש בשקיות מרובות של 400 מ"ל של 129Xe שומר על קיטוב ממוצע גבוה יותר. ג) מיקומים שבהם השדה הראשי ושדה המיגון הפעיל מצטלבים (תיבה אדומה במיקום (N,N,N)) עלולים לגרום להרפיה מהירה של HP 129Xe. אפיון שדה השוליים של המגנט מסייע בזיהוי אזורים בטוחים שבהם ניתן למקם מאגרים של HP 129Xe ללא הרפיה מהירה (תיבה ירוקה במיקום (0,0,n)). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
קובץ משלים 1: ניהול קיטוב במהלך הובלה. אנא לחץ כאן להורדת קובץ זה.
- מדוד את T1 תלוי המיקום של HP 129Xe בתוך שדה השוליים (איור 5C).
- צור נקודות ייחוס עם מרחקים ומיקומים ידועים ביחס לאיזוסנטר המגנט לאורך מידות X, Y ו-Z. סמן איזוסנטר ותייג את המיקומים האחרים n עד N. מספר התפקידים לחקירה יהיה תלוי בשטח הזמין.
- היפרפולריזציה של נפח קטן של 129Xe (~250 מ"ל) והעברתו לחדר הבקרה של ה-MRI. מלאו מזרק גדול (50-100 מ"ל) ב-129Xe והניחו אותו באיזוסנטר בתוך המגנט (מיקום 1 באיור 5C). הפעל דופק זווית היפוך ~1° כדי למדוד את האות.
- השאירו את המזרק במקומו למשך ~10 דקות, ואז רכשו ספקטרום נוסף. מדוד מחדש את האות כל 10 דקות עד שהאות דעך לפחות 1 T1 (כלומר, האות דעך ל-~1/3 מערכו ההתחלתי).
- התחל ניסוי T1 חדש עם מזרק חדש של 129Xe על ידי חזרה על שלב 1.4.2.
- העבר את המזרק למצב חדש (למשל, מיקום n באיור 5C) והשאיר אותו שם למשך 10 דקות. החזר את המזרק לאיזוסנטר כדי לרכוש ספקטרום זווית היפוך נוסף של ~1°.
- חזור על תהליך זה: העבר את המזרק למצב n, המתן 10 דקות, החזר אותו לאיזוסנטר ומדוד מחדש את האות עד שהוא דועך לפחות 1 T1.
- חזור על שלבים 1.4.4 - 1.4.6 עבור מיקומי הייחוס הנותרים המכסים את כיווני X, Y ו-Z.
- האות הראשוני (S0) ידעך באופן חד-אקספוננציאלי על פני n פולסי RF עם זווית היפוך θ . התאם את האות (S) כפונקציה של זמן (t) בשדה השוליים כדי לחשב את ה-T1 בכל מיקום:
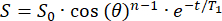 (2)
(2) - זהה מיקום עם מספיק T1 (>20 דקות) למיקום מאגר 129Xe.
- צור צינוריות אינטובציה נטולות מתכת (איור 6).
- השג שני צנתרים שוכנים בוורידים פוליטטרפלואורואתילן (PTFE) עם מחברי Luer. השליכו מחטים למיכל סילוק חדים.
הערה: עבור עכברים >25 גרם, השתמש בצנתרים של 18 גרם ו-20 גרם. עבור בעלי חיים קטנים יותר, השתמש בצנתרים של 20 גרם ו-22 גרם. - נתק את מחבר Luer מהצנתרים. הזינו את הצנתר הקטן יותר לקצה העליון של הצנתר הגדול יותר כדי ליצור צינורית מחודדת וארוכה יותר. חותכים את הצינורית המרוכבת ל-~4.6 ס"מ עם קצה משופע, לא כולל בסיס Luer (איור 6A, B).
- חותכים את הקצה הרחב יותר של קצה פיפטה של 200 מיקרוליטר לאורך של ~2.6 ס"מ (איור 6C).
- מצפים את החלק הפנימי של קצה הפיפטה בחומר סיכה כללי לשחרור עובש. השתמש בקצה פיפטה נוסף המוחדר פנימה כדי לפזר דק את חומר הסיכה. מלאו את קצה הפיפטה באפוקסי משחת גיפור סיליקון אצטוקסי (איור 6D, E).
- חבר את הצינורית עם חוט 22 G המשתרע משני הקצוות. הזינו את צינור הצינורית דרך סיליקון בקצה הפיפטה. הארך את הצינור ~ 7 מ"מ מעבר לקצה קצה הפיפטה (איור 6F, G).
- החלק את צינור הצינורית בצד הרחב יותר של קצה הפיפטה דרך מחבר לואר זכר מפלסטיק, והדבק את החלקים יחד עם האפוקסי. חיתוך צינורות המשתרעים מעבר למחבר Luer (איור 6H).
- המתן לייבוש האפוקסי (>24 שעות), ולאחר מכן הסר בזהירות את צינורית אינטובציית הסיליקון מתבנית קצה הפיפטה. הסר את החוט מהצינורית, וודא שהצינור לא נסתם (איור 6I).
- כדי ליצור ידית לאינטובציה קלה, חבר צינורות (1/16 אינץ' או 1/8 אינץ') למחבר Luer נקבה. כאשר הוא מוכן לאינטובציה, חבר את מחבר ה-Luer הנקבי הזה לצינורית האינטובציה הזכרית של Luer. ניתן לנתק את החלק הזה בקלות לאחר אינטובציה (איור 6J).
- חיטוי לפני כל שימוש בבעלי חיים: נגב את החלק החיצוני של הצינורית ב-70% אלכוהול. נגב חוט 20 גרם עם חומר חיטוי ולאחר מכן הזין את החוט דרך הצינורית כדי לחטא את החלק הפנימי ולהבטיח שאין סתימות.
- השג שני צנתרים שוכנים בוורידים פוליטטרפלואורואתילן (PTFE) עם מחברי Luer. השליכו מחטים למיכל סילוק חדים.
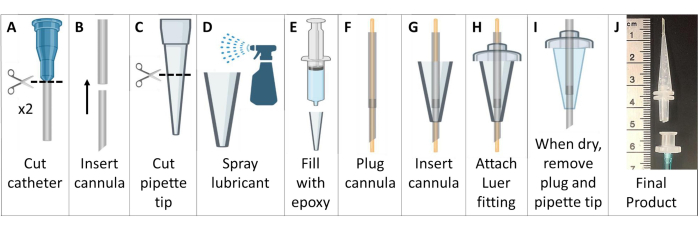
איור 6: יצירת צינוריות אינטובציה של עכבר תואמות MRI ו-HP 129Xe. צינוריות אלו בנויות מצנתרים ורידיים, קצות פיפטות ואיטום סיליקון, כמתואר בשלב 1.5. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. איסוף נתונים יומי
הערה: ראה קובץ משלים 2: רשימת תיוג ל-QA של סריקה פרה-קלינית.
קובץ משלים 2: רשימת בדיקה לבדיקת QA של סריקה פרה-קלינית. אנא לחץ כאן להורדת קובץ זה.
- בקרת איכות יומית מלאה של הסורק והתקנת מאוורר (איור 4).
- עם פנטומים, הפעל פרוטוקולי QA על הסורק (ראה טבלה 1 לפרמטרים של סריקת QA ושלב 1.2 לשלבי בקרת איכות יומיים).
- כיול מאוורר לפי השיטה של J. Nouls et al.38. ראה קובץ משלים 3: כיול מכונת הנשמה, איור משלים 2 ואיור משלים 3.
- הגדר את הגדרות מכונת ההנשמה להדמיה בהשראה סופית (טבלה 2). הנח את מיטת בעלי החיים על מתלה הסורק ואת מודול תומכי החיים (כלומר, חלקי מאוורר מכניים) על השולחן שליד הסורק.
- הפעל את מערכת חימום בעלי החיים הספציפית לאתר. הגדר תנור חימום ל-35.5 - 40 מעלות צלזיוס, הפעל אוויר במחזור והנח את צינור האוויר בטווח של ~5 אינץ' מהמקום שבו ראש החיה ינוח כדי לחמם מראש את קדח הסורק.
| הגדרת אוורור | המלצה על HP 129Xe MRI | הערות |
| עוצמת גאות ושפל (טלוויזיה) | 8-10 מ"ל/ק"ג של משקל גוף אידיאלי | טלוויזיה מתונה; טלוויזיה נמוכה דורשת BR גבוה יותר שעלול לגרום לחפצי תנועה בתמונות |
| לחץ נשיפה חיובי (PEEP) | 2–6 סמ"ק2O | |
| קצב נשימה (BR) | 80-120 br/min | |
| תמרוני גיוס (RMs) | ~ 35 ס"מ H2O ל-6 שניות כל 5 דקות | |
| משך אוורור; מיקום | < 6 שעות; שכיבה | שכב כדי לראות טוב יותר את תנועת החזה |
| חלק של חמצן בהשראה (FIO2) | 0.3–0.5 | למנוע היפוקסיה בעכברים מורדמים |
| יחס שאיפה לנשיפה (I:E) | 1:2–1:4 | |
| מעורר השראה עד משך המחזור הכולל | 0.2–0.4 | |
| אוורור דק | ≥0.57 מ"ל גרם-1 דקה-1 | |
| הסטנדרטים שלנו: | ||
| BR = 80 br/min, משך ההשראה = 200 ms, FIO2 = 0.3 | ||
| הדמיה בסוף ההשראה: עצירת נשימה = 200 אלפיות השנייה, עיכוב טריגר = 200 אלפיות השנייה לאחר תחילת ההשראה | ||
| הדמיה בזמן עצירת נשימה: עצירת נשימה = 250 אלפיות השנייה, עיכוב טריגר = 250 אלפיות השנייה לאחר תחילת ההשראה | ||
| הדמיה בסוף התפוגה: עצירת נשימה = 200 אלפיות השנייה, עיכוב טריגר = 650 אלפיות השנייה לאחר תחילת ההשראה | ||
טבלה 2: הגדרות הנשמה מומלצות להדמיית 129Xe. ניתן לכוונן את הפרמטרים למטרות מחקר ספציפיות ולתנאי ניסוי 117,118,119,120,121,122,123,124. אנא לחץ כאן להורדת טבלה זו.
קובץ משלים 3: כיול מכונת הנשמה. אנא לחץ כאן להורדת קובץ זה.
- בעל חיים רגוע ואינטובציה.
- הפעל את החממה ל-27.7 מעלות צלזיוס ו/או את כרית החימום החשמלית ל-37.7 מעלות צלזיוס. מדוד ורשום את מסת הגוף של החיה. חשב מינון הרגעה על סמך מסה. ראה טבלה 3 למשטר מינון טיפוסי.
- הזריק את תרופת ההרגעה תוך צפקית. שימו לב לזמן ההזרקה והגדירו את הטיימר למינון הבא של תרופת ההרגעה.
הערה: השלם את השלבים הנותרים בסעיף 2 (איסוף נתונים יומי) במהירות האפשרית כדי למזער את זמן ההרגעה ואת הסיכון למנת יתר. - מרחו חומר סיכה לעיניים על עיני החיה והניחו את החיה בכלוב על כרית החימום או בתוך אינקובטור כדי למנוע היפותרמיה.
- ודא שהחיה מורדמת לחלוטין על ידי ביצוע בדיקת צביטה בבוהן 10-15 דקות לאחר הזרקת הרגעה68. אינטובציה בהתאם להליכים המתוארים ב- Das et al.69.
הערה: המאמר של Das et al.69 מלווה בהדגמת וידאו מקיפה של הטכניקה. השלבים הם כדלקמן: - תלו את החיה בשכיבה בשיניים על לוח מלוכסן. השתמש במדכא לשון מכרסמים כדי לשלוף את הלשון.
- כדי להבטיח שמיתרי הקול נראים לעין, ספק אור לבן באמצעות כבל סיב אופטי בתוך צינורית האינטובציה או אור בהיר הממוקם בחלק החיצוני של הגרון. הכנס את הצינורית פחות מ-5 מ"מ מעבר למיתרי הקול.
- ודא שהצינורית נמצאת בקנה הנשימה, לא בוושט, על ידי חיבורה לחתיכת צינור עם טיפת מים קטנה בפנים. אם טיפת המים נעה בזמן עם נשימות החיה, סביר להניח שהמיקום נכון.
| סוכן | מנה | מסלול | משך | הערות | |||
| חומרים באינהלציה | |||||||
| איזופלורן | אינדוקציה: 4%-5% תחזוקה: 1%- 3% או לאפקט | שאיפה | במהלך זרימה רציפה | • דורש שימוש בוופורייזר מכויל | |||
| חומרים הניתנים להזרקה | |||||||
| מומלץ: קטמין + קסילזין + אצפרומזין | 90 + 9 + 3 מ"ג/ק"ג | תוך-צפקי | 20–60 דקות | • יוצר רגישות להיפותרמיה | |||
| • למינון חוזר מומלץ לעבור לתערובת קטמין + קסילזין למניעת מנת יתר | |||||||
| • גורם לרעידות כשהוא מתפוגג. לצורך הדמיה, הקפידו על לוח הזמנים של המינון | |||||||
| • עלול לגרום לברדיקרדיה | |||||||
| קטמין + קסילזין | 90 + 9 מ"ג/ק"ג | תוך-צפקי | 20–40 דקות | • ראה לעיל (קטמין + קסילזין + אצפרומזין) | |||
| פנטוברביטל | 50 - 70 מ"ג/ק"ג | תוך-צפקי | 20–60 דקות | • מדכא את קצב הנשימה והתנועה | |||
| • ההוצאה עלולה להיות יקרה | |||||||
| • ייתכן שאיכות פרמצבטית לא תהיה זמינה | |||||||
| כתב ויתור: אלה הנחיות כלליות. התייעץ עם וטרינר למידע נוסף לפני היישום. | |||||||
טבלה 3: נוסחאות הרדמה נפוצות לעכברים. אנא לחץ כאן להורדת טבלה זו.
- בעל חיים מאוורר (טבלה 2).
- חבר את החיה למכונת הנשמה באמצעות מחבר Luer בצינורית האינטובציה. עקוב אחר תנועת הסרעפת ולחץ השאיבה השיא (~10-12 ס"מ H2O לנפח גאות של 10 מ"ל/ק"ג משקל גוף). אם הלחץ או תנועת הנשימה אינם תקינים, התאם בזהירות את זווית הצוואר ועומק הצינורית לפי הצורך.
- ודא שצינורית האינטובציה אטומה על ידי ביצוע תמרון גיוס: מנע נשיפה (למשל, עם אצבע, חסום את פתח הנשיפה) כך שהחיה תשאף מספר פעמים מבלי לנשוף.
הערה: אם לחץ דרכי הנשימה מגיע ל-35 סמ"ש2O לחץ נשימה שיא מעל ~6 שניות, אטם דרכי הנשימה הדוק מספיק. אם לא, עיין בדיון לפתרון בעיות. - אפשר לנשיפה רגילה להתחדש. בצע תמרוני גיוס בין סריקות וכל ~5 דקות כאשר לא סורקים כדי לשמור על תאימות ריאות ולמנוע אטלקטזיס. חבר את שסתום ה-PEEP לקו הנשיפה. הגדר את PEEP ל-4 סמ"ש2O. צפה בשיא לחץ השאיבה עולה בכמות זו.
- לאחר אינטובציה מוצלחת, תכנן ואתחל את הייצור של HP 129Xe סביב לוח הזמנים של מינון חוזר של תרופות הרגעה כדי למנוע מהחיה להתעורר במהלך סריקה. עקוב אחר טמפרטורת הגוף לאורך כל הניסוי.
- רכישת נתונים: אסוף תמונות אוורור.
הערה: ניתן לבצע את שלבים 2.4, 2.5 ו-2.6 של רכישת נתונים בכל סדר- הגדר את מכונת ההנשמה לפי טבלה 2 להדמיה בהשראת הקצה.
- טען את פרוטוקולי ההתקנה הבאים: לוקלייזר בעלי חיים של פרוטון, דופק יחיד להתמקדות בתדר הגז בריאות העכבר, ולוקלייזר בעלי חיים 129Xe. ראה טבלה 4 לפרמטרים של סריקה.
- מקם את החיה באיזוסנטר ואשר שחלל בית החזה נמצא במרכז שדה הראייה עם לוקליזציה של פרוטונים. אם אתה משתמש בסלילים בתדר יחיד, החלף את סליל הפרוטון בסליל RF מכוון Xe 129.
- רשום קיטוב של 129Xe והעבר אותו לסורק ה-MRI. ראה קובץ משלים 4: רשימת בדיקה לקיטוב קסנון QA.
- הנח שקית של 129Xe בתוך מיכל ההנשמה ואטום. חבר את המיכל בקו אחד עם המאוורר ואפשר למיכל ללחוץ (3 - 6 psig).
- הפעל אוורור מכני 129Xe. בכל פעם שמופעל אוורור 129Xe, אפשר לבעל החיים להשלים ~5 נשימות לפני תחילת הסריקה כדי להפוך את הקיבולת השיורית התפקודית של הריאות.
הערה: עבור לתערובת N2/O2 בין 129סריקות Xe כדי לחסוך בגז היפר-פולריזציה. - באמצעות דופק יחיד, כוונן את תדר העבודה כך שיתאים לתדר התהודה in vivo של 129Xe גזי (~83.07 מגה-הרץ ב-7 T). העתק את התדר לכל סריקות שלב הגז 129Xe הבאות. בצע לוקליזציה של 129Xe כדי לאשר שהריאות נמצאות באיזוסנטר.
- טען והפעל את רצף האוורור הרדיאלי 129Xe. עקוב אחר לחץ השאיבה המרבי.
הערה: אם הגז 129Xe נגמר לפני סיום הפרוטוקול, לחץ השאיבה השיא יירד במהירות. שקית של 400 מ"ל של 129Xe יכולה לאוורר עכבר של 30 גרם למשך ~24 דקות כאשר הוא מאוורר עם 70% 129Xe ב-80 נשימות לדקה עם נפח גאות של 10 מ"ל/ק"ג של משקל גוף אידיאלי. - בסיום הסריקה, עבור לאוורור עם תערובת N2/O2 והסר את השקית הריקה של 129Xe.
- להדמיה בסוף התפוגה, שנה את משך עצירת הנשימה ועיכוב ההדק בהתאם לטבלה 2 וחזור על שלבים 2.4.2 - 2.4.9.
- ייצא את הנתונים הגולמיים מהסורק.
| שם מקוצר של פרוטוקול | תיאור רצף | ההדק | ת"ר (אלפיות השנייה) | TE (ms) | חזרות | זווית היפוך (°) | גודל מטריקס או Nנקודות | FOV (מ"מ2) | RF שחור-לבן (kHz) | עובי פרוסה/לוח (מ"מ) | משך הסריקה |
| דופק יחיד | רכישת דופק (פאזה גזית) | אופציונלי | 1000 | 1 | 60 | 2048 | 10 | 1 שניות | |||
| לוקלייזר בעלי חיים | GRE דו-ממדי | כן | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60 שניות |
| אוורור רדיאלי | רדיאלי תלת-ממדי רב-הד | כן | 20 | ראה כיתוב | 1 | 30 | 613 | 223 | 32.05 | 30 | 16 דק' |
| שלב מומס דופק יחיד | רכישת דופק (שלב מומס) | לא | 80 | 1 | 90 | 512 | 10.35 | 80 אלפיות השנייה | |||
| מפרט דינמי של שלב מומס. | רכישת דופק (שלב מומס) | לא | 50 | 1000 | 90 | 512 | 10.5 | 50 שניות | |||
| דיפוזיה משוקללת | GRE דו-ממדי | כן | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18 דק' |
טבלה 4: פרמטרים של רצף in vivo . רצף האוורור הרדיאלי התלת-ממדי מרובה הד שתואר קודם לכן39 רוכש תמונות ב-6 פעמים הד. התוצאות מוצגות עבור תמונת ההד הראשונה (TE = 1.12 ms, איור 7). אנא לחץ כאן להורדת טבלה זו.
קובץ משלים 4: רשימת בדיקה לקיטוב קסנון QA. אנא לחץ כאן להורדת קובץ זה.
- רכישת נתונים: הפעל ספקטרוסקופיה פאזה מומסת דינמית.
- הגדר את מכונת ההנשמה לפי טבלה 2 להדמיה בזמן עצירת נשימה. הגדר את ה-BR ל-100 נשימות לדקה. התכוננו לתיק חדש של 129Xe כמו בשלבים 2.4.2 - 2.4.5.
- הפעל אוורור מכני 129Xe. טען והפעל דופק בודד כדי להתאים את תדר העבודה כך שיתאים לתדר המומס (~83.084 מגה-הרץ ב-7 T). העתק את תדר העבודה לספקטרוסקופיה הדינמית של הפאזה המומסת.
הערה: זו תהיה שיא בודד בעכברים עם המוגלוביןמסוג בר 54. - טען והפעל את רצף הספקטרוסקופיה הדינמי שבמרכזו התדר המומס בריאות של בעלי חיים. בסיום הסריקה, עבור לאוורור עם תערובת N2/O2 והסר את השקית הריקה של 129Xe. ייצא את הנתונים הגולמיים מהסורק.
- רכישת נתונים: אסוף תמונות משוקללות דיפוזיה.
- הגדר את מכונת ההנשמה לפי טבלה 2 להדמיה בזמן עצירת נשימה. התכוננו לתיק חדש של 129Xe כמו בשלבים 2.4.2 - 2.4.7.
- טען והפעל את הרצף המשוקלל לדיפוזיה. בסיום הסריקה, עבור לאוורור עם תערובת N2/O2 והסר את השקית הריקה של 129Xe. ייצא את הנתונים הגולמיים מהסורק.
3. סיום הניסוי
- לשחזר בעל חיים.
- משוך את צינורית האינטובציה היישר מהפה של החיה. אם החיה לא מתחילה לנשום מיד באופן ספונטני, יש לבצע לחיצות חזה קלות. אם זמין, יש לתת זרימה קלה של חמצן ברמה רפואית ליד פני החיה כדי לתמוך בהתאוששות מהרגעה.
- ברגע שהחיה נושמת בהתמדה בכוחות עצמה ואם החיה הייתה מורדמת במשך >2 שעות, יש לתת 0.5 - 1 מ"ל של מי מלח רגילים תת עורית כדי למנוע התייבשות.
- החזירו את החיה לכלוב בעצמה. הניחו את הכלוב בחממה או על כרית חימום.
הערה: בעלי חיים מרדימים פגיעים לקניבליזם ולא ניתן לשים אותם בכלוב עם חברים לכלוב עד להתאוששות מלאה (כלומר, להסתובב באופן עצמאי). בעלי חיים מרדימים אינם יכולים לווסת את טמפרטורת גופם. השתמש בגב היד כדי להרגיש את הטמפרטורה של החיה כל כמה דקות. - עקוב אחר בעל החיים מקרוב עד שרפלקס היישור שלו חוזר (כלומר, הוא יכול להתהפך באופן עצמאי משכיבה למצב שכיבה).
- הסר את החיה מתמיכת החום ברגע שהיא יכולה לנוע באופן עצמאי. החזירו את החיה לכלוב עם חבריה לכלוב.
הערה: אם לבעל החיים אין חברים לכלוב, הוא רגיש יותר להיפותרמיה הנגרמת על ידי הרגעה. ספקו לבעל החיים מצעים נוספים, ואם זמין, השאירו את החיה באינקובטור למשך הלילה. - רשום את משקל החיה פעם בשבוע למשך שבועיים כדי לעקוב אחר בריאותה.
הערה: אם החיה סבלה מפגיעה בפה או בוושט כתוצאה מאינטובציה, היא עלולה להפסיק לאכול. אם בעל החיים מאבד >20% ממשקל גופו הראשוני, התייעץ עם וטרינר לגבי המתת חסד.
- נתח תמונות אוורור (איור 7).
- טען נתונים גולמיים לפלטפורמת תכנות. הורד את מסגרת השחזור בקוד פתוח עבור תמונות לא קרטזיות91.
- שחזר תמונות בהתאם להוראות מסגרת קוד פתוח. נרמל את הנקודה הראשונה בכל הטלה רדיאלית39.
- פלח את פרנכימת הריאות בתמונות, כולל ווקסלים עם אות 129Xe נמוך או ללא אות. אל תכלול דרכי נשימה גדולות. פלח את רעשי הרקע בתמונה, למעט ריאות, דרכי נשימה וחפצי הדמיה.
הערה: תמונת לוקלייזר הפרוטונים יכולה לסייע בקביעת גבולות פרנכימליים. - חשב את ה- SNR באמצעות הנוסחה:
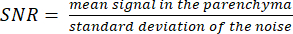 (3)
(3) - כמת אוורור פגום.
הערה: הוצעו שיטות שונות לכימות אוורור לקוי במודלים של בעלי חיים קטנים. שיטות ניתוח נותרו תחום מחקר פתוח, אך גישות המיושמות בקלות כוללות: (i) סגמנטציה ידנית חצי כמותית92, (ii) גישת היסטוגרמה המשתמשת באות מקנה הנשימה כדי לנרמל אות פרנכימלי47, ו-(iii) פילוח נפח הריאות הכולל (TLV) והגדרת סף אות (למשל, <60% מממוצע הריאות השלם) כדי לחלק את הריאות לנפח פגום ונפח ריאות מאוורר (VV). כמת VDP 93,94 לפי:
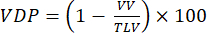 (4)
(4)
- נתח ספקטרוסקופיה דינמית של פאזה מומסת (איור 8).
- טען נתונים גולמיים לפלטפורמת תכנות. בצע התמרת פורייה מהירה ושלב את הספקטרום (ידני סימולטני, שלב מסדר אפס של ספקטרום מספיק ליישום זה.)
- חשב נתוני תהודה מגנטית גרעינית סטנדרטית (NMR)95,96: SNR, רוחב מלא חצי מקסימום, שטח משולב, הסטה כימית ופאזה של שתי הפסגות.
- מנתוני הגודל, חלקו את משרעת האות של הספקטרום המומס בזו של ספקטרום הגז עבור כל חזרה כדי למצוא את היחס המומס לגז לאורך זמן.
- נתח תמונות משוקללות דיפוזיה (איור 9).
- טען נתונים גולמיים לפלטפורמת תכנות. פלח את פרנכימת הריאות של תמונת b0 כמו בשלב 3.2.3. חשב את ה-SNR עבור כל תמונה בעלת ערך b.
- חשב את יחס האות לרעש, SVNR0, על ידי חלוקת האות בכל ווקסל של התמונה b0 בסטיית התקן של רעש התמונה. אל תכלול ווקסלים עם SVNR0 < פי 2.5 מרעש התמונה97.
הערה: ה-SVNR0 הוא מדד ווקסל בודד, בעוד שה-SNR הפרנכימלי הוא מדד ריאה שלמה. - חשב את ה-ADC על ידי התאמת דעיכת האות על פני ערכי b (bi) לפי משוואה 598,99:
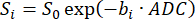 (5)
(5)
תוצאות
תמונות אוורור
אם הליכי הכנה ואוורור של בעלי חיים מיושמים כהלכה, הדמיה רדיאלית תלת-ממדית יכולה ללכוד בהצלחה דפוסי אוורור כאשר רכישת הנתונים מתבצעת בהשראה או בתאריך התפוגה (איור 7). בעוד שהתמונות האלה נאספות על פני נשימות רבות, השיט?...
Discussion
MRI היפרפולריזציה 129Xe מתגלה כטכניקה מתוחכמת ועוצמתית לחקר מיקרו-מבנה ותפקוד ריאות במודלים של בעלי חיים קטנים. פרוטוקול זה נועד להנחות את הכנת האתר הראשונית ולתאר הליכים ניסיוניים הדרושים לכימות אוורור, דיפוזיה וחילופי גזים בריאות עכברים עם HP 129Xe. התנאים המוקד...
Disclosures
פיטר נידבלסקי הוא יועץ ל-Polarean Imaging, Plc.
Acknowledgements
המחברים מביעים את תודתם העמוקה לג'רי דאלקה על היותו אור מנחה בבניית מכונות הנשמה. ברצוננו להודות לקרטר מקמאסטר על בישול גז HP 129Xe. ברצוננו גם להודות לד"ר מתיו וילמרינג ולד"ר חואן פארה-רובלס על הדיונים המדעיים מעוררי המחשבה שלהם. דמויות שנוצרו באמצעות BioRender.com. עבודה זו מומנה על ידי המכונים הלאומיים לבריאות (מענק מס': NHLBI R01HL143011, R01HL151588)
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
References
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved