Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Fluoreszenzmarkierung Drosophila Herz Structures
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine grundlegende Protokoll für die Fluoreszenzmarkierung der verschiedenen Elemente des Herzens Rohre von Larven und erwachsenen Drosophila melanogaster. Diese Proben sind für die Bildgebung mittels Fluoreszenz-oder konfokalen Mikroskopie geeignet. Diese Technik ermöglicht detaillierte Strukturanalyse der Funktionen des Herzens von einem leistungsstarken Modell-Organismus.
Zusammenfassung
Die
Protokoll
Bevor Sie beginnen
- Bereiten Sie die folgenden Lösungen:
- Entspannung Puffer (künstliche Drosophila Hämolymphe (ADH) (siehe "Visualisierung des schlagenden Herzens in Drosophila"), die 10 mM EGTA enthält)
- Fixativ (4% Formaldehyd in 1x PBS)
- PBSTx (PBS mit 0,1% Triton-X-100)
- Entsprechend verdünnten Primär-und Spezies-spezifische fluoreszenzmarkierte Sekundärantikörper in PBSTx
- Dissect Drosophila, die Herz-Röhren (von erwachsenen Fliegen und / oder Larven) folgende aussetzen
- die semi-intakten Drosophila Herzen Vorbereitung Protokoll in "Visualisierung des schlagenden Herzens in Drosophila", oder
- Drosophila Larven NMJ Dissection-Protokoll 1 mit folgenden Änderungen: Mit Sauerstoff ADH während Larven Dissektion und verdrängen den hinteren Stift leicht von der ventralen Mittellinie. Die Larven sind entlang der ventralen Mittellinie geschnitten. Entfernen Sie nicht jedes Gewebe vor der Fixierung.
Fluoreszenzfärbung
- Prüfen Sie, ob alle Herzen sind rhythmisch schlagen in Sauerstoff ADH. Schnell zu ersetzen ADH mit entspannenden Puffer. Untersuchen Sie jeden Herzschlauchs, um sicherzustellen, Kontraktionen gehemmt werden.
- Fix die Herzen durch den Austausch des entspannten Puffer mit Fixativ. Inkubieren bei Raumtemperatur für 20 Minuten unter leichtem Schütteln. (Für Larven Vorbereitung Schütteln ist nicht notwendig, bei jedem Schritt, und darf als schädlich für Herzgewebe Integrität).
- Wash Proben dreimal für 10 Minuten mit PBSTx bei Raumtemperatur unter ständigem Schütteln.
- Für Erwachsene, sorgfältig trimmen zurück ventralen Kanten der abdominalen Häutchen, wie das, was bleibt, ist mehr elliptisch und weniger abgerundet. Zusätzlich mit einem einzigen Schnitt zwischen den Bauch und Brustkorb, sorgfältig und sauber zu trennen beide Körper ab und sorgen für minimale Schäden an den vorderen Bereich des Herzens. Für Larven Herzen, entfernen Sie vorsichtig die fetten Körper mit feinen Pinzetten. Die Fettabsaugung muss mit äußerster Vorsicht ausgeführt werden, da die Larven Herz ist besonders empfindlich und hat sehr wenig Unterstützung von anderen Muskeln oder Bindegewebe. Entfernen Sie nicht die trachealen Äste, da dies das Herz schädigen können.
- Übertragen Sie die getrimmt dorsalen Bereich der Bauch-Nagelhaut an den Rändern, Vermeidung von Kontakt mit dem zentral gelegenen Herz-Rohr, in eine 96-Well-Platte mit Brunnen dass 50-100 ul des primären Antikörpers in PBSTx verdünnt enthalten. Legen Sie nicht mehr als 12 Proben pro Vertiefung. Inkubieren bei Raumtemperatur für 2 Stunden unter ständigem Rühren. Incubation kann auch über Nacht bei 4 ° C.
- Entfernen primärer Antikörper-Lösung. Waschen Sie die Herzen dreimal für 10 Minuten mit 100 ul PBSTx bei Raumtemperatur unter ständigem Schütteln.
- Nach dem Entfernen des letzten Waschpuffer, 100 ul des sekundären Antikörpers in PBSTx mit Alexa594-Phalloidin (1:1000) ergänzt. Inkubieren für eine Stunde unter ständigem Schütteln bei Raumtemperatur. Keep Proben abgedeckt, um zu verhindern Fluorophor Bleichen.
- Nach sekundären Inkubation, waschen Sie die Herzen dreimal für 10 Minuten mit 100 ul PBSTx bei Raumtemperatur unter ständigem Schütteln. Halten Sie die Proben während der Waschschritte abgedeckt.
- Zur Entfernung von Triton-X-100, spülen Sie die Herzen ein letztes Mal in 100 ul PBS für 10 Minuten. Die Proben können im Dunkeln bei 4 ° C für mehrere Tage gelagert, bevor Montage.
Halterung für Adult Herzen
- Beachten zwei 18 x 18 mm Deckgläser auf einen Objektträger mit 10 ul Vectashield Eindeckmedium. Die Deckgläser sollten ~ 10-15 mm auseinander liegen. Legen Sie eine kleine Terz Tropfen Eindeckmedium in-zwischen den beiden Deckgläsern.
- Platz 20 ul der Vectashield in der Mitte ein Drittel Deckglas.
- Entfernen Sie vorsichtig jede der Herzen aus dem PBS-Waschlösung durch den äußersten Rändern der Kutikula, und sanft lege sie Herz-Seite nach unten auf den Tropfen Eindeckmedium auf der dritten Deckglas. Legen Sie nicht mehr als fünf Herzen pro Tropfen auf dem Deckglas.
- Überprüfen Sie unter einem Mikroskop, um sicherzustellen, alle Herzen nach unten zeigen.
- Vorsichtig umdrehen das Deckglas mit dem Herzen und schnell platzieren Sie es auf die Folie mit den zwei Deckgläser, so dass die Tropfen mit kardiologischen Rohre verschmilzt mit dem Vectashield Tropfen zwischen Deckglas Paar. Eine "Brücke" sollte durch die Deckgläschen gebildet werden. Die Herzen werden zwischen einem Deckglas und dem Objektträger suspendiert werden.
- Überprüfen Sie unter einem Mikroskop, um sicherzustellen, dass die Herzen sind jetzt nach oben.
- Fix Deckgläschen an ihren Rändern mit Nagellack.
- Die Herzen sind nun bereit, über fluoreszierende oder konfokalen Mikroskopie abgebildet werden.
Montage für Larven Herzen
- Geben Sie einen Tropfen (~ 20 ul) Vectashield auf einen Objektträger.
- Sorgfältig Transfer bis zu zwei Larven Exemplaren in die Vectashield und orientieren sie dorsalen Seite nach unten mit Wolfram Nadeln.
- Individuell ziehen Sie die Proben aus dem Eindeckmedium und richten jeweils parallel.
- Legen Sie ein Deckglas auf gegenüberliegenden Seiten der Probe. Mit einer Pinzette, statt ein Drittel Deckglas auf, zunächst durch Verlegung einer Seite auf die hintere Deckglas und Senken es auf den vorderen Deckglas bildet somit eine Brücke. Kapillarkräfte verursacht einen Strom von Vectashield von posterior nach anterior, die korrekte Ausrichtung der Larven Herzen hilft.
- Fix alle Deckgläser in Ort, an ihren Rändern, mit Nagellack und sorgfältig füllen den Raum zwischen den Deckgläschen mit 20-30 ul Vectashield.
- Seal mit Nagellack und lagern bei 4 ° C, oder für die langfristige Lagerung bei -20 ° C.
Repräsentative Ergebnisse
Wenn richtig ausgeführt, sollten alle Komponenten und der dazugehörigen Gewebe des dorsalen Gefäß intakt bleiben und leicht sichtbar gemacht werden. Die Hintergrund-Fluoreszenz sollte minimal sein. Für Erwachsene, die ventralen Längs-Muskelschicht Flecken sehr gut und erzeugt eine erhebliche Signal (Abbildung 1 und Abbildung 2). Die zugrunde liegenden kreisförmigen Kardiomyozyten jedoch eher nicht so intensiv ein Signal, dass der darüberliegenden ventralen Schicht zu erzeugen. Die Myozyten des vorderen "konischen Kammer" des erwachsenen Herzens enthalten eine beträchtliche Menge von kontraktilen Materials und damit erscheint diese Region als die robustesten gegenüber dem Rest des Herzschlauches. Die Larven Herz zeigt eine Spirale myofibrillären Anordnung ähnlich der des Erwachsenen kontraktilen Kardiomyozyten (Abbildung 3).
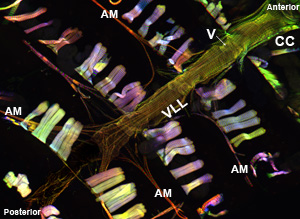
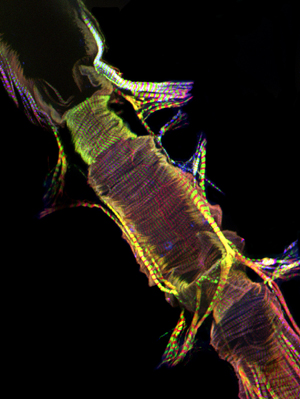
Abbildung 1: Top. Ein fluoreszierendes Aufnahme zeigt das gesamte Herz-Rohr eines erwachsenen Drosophila melanogaster, dass Myosin-GFP zum Ausdruck bringt. Das Bild wurde mit einem Zeiss-Imager Z1 Fluoreszenzmikroskop mit einer Apotome Schiebe-Modul ausgestattet übernommen. Myosin-GFP in grün angezeigt wird, Aktin ist mit AlexaFluor ® 594 Phalloidin (rot) und α-Actinin gefärbt mit anti-α-Antikörper actinin (blau) markiert. Beachten Sie die präparativen Verfahren ermöglicht Wiederherstellung von Herz-Proben mit gut erhaltenen Strukturen. CC = konische Kammer; AM = Alary Muskel; V = internes Ventil; VLL = ventralen Längs-Muskelschicht. Bottom. Eine Region der erwachsenen Herzschlauchs von der CC durch das 3. Abdominalsegment des Herzens nur unter der ventralen Längs-Schicht zeigt die Spirale Myofibrille Anordnung der kontraktilen Kardiomyozyten. Bitte klicken Sie hier für eine größere Version der Abbildung 1a und hier für eine größere Version der Abbildung 1b
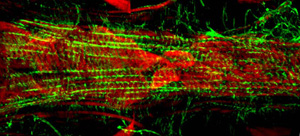
Abbildung 2: Repräsentative konfokalen Stapel von einer vorderen Teil des erwachsenen Herzens mit AlexaFluor ® 594 Phalloidin (rot) und ein Anti-Pericardin (Kollagen Typ IV) (grün)-Antikörper gefärbt. Pericardin ist mit dem Herzen an der ventralen Fläche verbunden sind, wahrscheinlich aus dem längsorientierten Myofibrillen der ventralen Muskelschicht. Bitte klicken Sie hier für eine größere Version der Abbildung 2 dargestellt.

Abbildung 3: Ein fluoreszierendes Aufnahme Segment A7 des Herzens ordnungsgemäße einer dritten Stufe Drosophila Larve. Das Bild wurde mit einem Zeiss-Imager Z1 Fluoreszenzmikroskop mit einer Apotome Schiebe-Modul ausgestattet übernommen. Aktin ist mit AlexaFluor ® 594 Phalloidin (grün) und α-Actinin beschriftet ist mit Anti-α-Antikörper actinin (rot) gefärbt. Bitte klicken Sie hier für eine größere Version der Abbildung 3 dargestellt.
Diskussion
Hier präsentieren wir ein Protokoll, die zur Herstellung und Färbung der Drosophila melanogaster dorsalen Gefäß und der dazugehörigen Gewebe für die Bildgebung mittels Fluoreszenz-oder konfokalen Mikroskopie. Wir bieten eine übersichtliche Darstellung der Schritte verfeinert und am häufigsten in unserem Labor für eine effektive Färbung, die gut aufgelösten erlaubt in situ Darstellung von Larven und erwachsenen Drosophila Herzen Rohre eingesetzt. Andere haben ähnliche Methoden in ab...
Danksagungen
Die Autoren danken SI Bernstein (San Diego State University) für die kritische Durchsicht und Anregungen in Bezug auf die Erstellung des Manuskripts. Diese Arbeit wurde vom NIH gewährt SI Bernstein, SDSU, und R. Bodmer, BIMR unterstützt, und durch ein Postdoc-Stipendium von der Western States Partner der American Heart Association zu G. Vogler und A. Cammarato.
Materialien
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
Referenzen
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. . The internal anatomy and histology of the imago of Drosophila melanogaster. , (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten